Method Article
Sintesi radiochimica automatizzata di [
In questo articolo
Riepilogo
Abbiamo dimostrato la sintesi radiochimica semiautomatica di procedure [ 18 F] 3F4AP e di controllo della qualità.
Abstract
3- [ 18 F] fluoro-4-aminopiridina, [18F] 3F4AP, è un analogo radiofluorinato del farmaco approvato dalla FDA per la sclerosi multipla 4-aminopiridina (4AP). Questo composto è attualmente sotto inchiesta come tracciante di PET per la demielinizzazione. Recentemente abbiamo descritto una nuova reazione chimica per produrre piridinici metafluorurate costituite dalla fluorurazione diretta di un piridina N-ossido e dall'uso di questa reazione per la sintesi radiochimica di [18F] 3F4AP. In questo articolo dimostriamo come produrre questo tracciatore utilizzando un sintetizzatore automatizzato e un reattore di idrogenazione del flusso fatto in casa. Mostriamo anche le procedure standard di controllo della qualità eseguite prima di rilasciare il radiotracer per gli studi clinici preclinici di imaging. Questa procedura semi-automatizzata può servire da base per la futura produzione di [ 18 F] 3F4AP per studi clinici.
Introduzione
La capacità di tracciare un farmaco di piccola molecola non invasiva all'interno del corpo umano ha un grande potenziale verso la medicina di precisione. Tra le tecniche di imaging molecolare, la tomografia a emissione positronica (PET) ha molte caratteristiche favorevoli: l'alta sensibilità dei rilevatori di PET consente la rilevazione e la quantificazione di piccole quantità di materiale radioattivo e le caratteristiche degli scanner consentono una mappatura spaziale precisa della localizzazione dei farmaci 1 , 2 , 3 . Ad esempio, PET consente di individuare e localizzare tumori e metastasi basati sul livello di assunzione di un analogo di glucosio radioattivo, [ 18 F] FDG 4 . Il PET può anche fornire la localizzazione e la quantificazione di recettori specifici del cervello e la loro occupazione che possono essere utili per la diagnosi e la comprensione dei disturbi neurologici e psichiatrici 5 . Al fine di sviluppareUn tracciante di PET di piccola molecola, il composto di interesse deve essere etichettato con un isotopo emittente positrone, tipicamente 11 o 18 F. Tra questi due radioisotopi, 18 F ha un'emivita più lunga (109 min vs 20.3 per 11 C) , Che consente la produzione multi-dose e offsite. Tuttavia, l'aggiunta di 18 F a una molecola può essere impegnativa. L'etichettatura a 18 F richiede reazioni veloci compatibili con l'automazione che allevia il farmacista della gestione diretta dell'attività e riceve dosi di radiazioni ad alta assorbimento.
Recentemente abbiamo descritto l'uso di N-ossidi di piridina come precursori per la fluorurazione delle piridine e l'uso di questa chimica nella sintesi radiochimica di [ 18 F] 3F4AP 6 , un analogo radiofluorato del farmaco approvato dalla FDA per la sclerosi multipla, Aminopiridina (4AP) 7 , 8 , 9 . thÈ un nuovo radiotracer attualmente sotto inchiesta come tracciante di PET per la demielinizzazione 10 , 11 , 12 . In questo articolo video, dimostriamo la sintesi semiautomatica di questo composto usando una unità di sintesi IBA Synthera (di seguito definita "sintetizzatore") e un dispositivo di idrogenazione del flusso fatto in-house. La sintesi è basata sulla reazione mostrata in Figura 1 . La preparazione per la procedura richiede circa 1 h, la radiodifica e la purificazione 1.5 ore e le procedure di controllo di qualità 0.5 h.
Protocollo
ATTENZIONE: Tutte le procedure che prevedono l'utilizzo di materiali radioattivi devono essere approvati dall'Ufficio locale per la radioprotezione. Quando si lavora con materiali radioattivi indossare un cappotto di laboratorio e distintivi di radiazioni personali. Usare sempre due strati di guanti e controllare le mani con un contatore Geiger dopo ogni passaggio che comporta la manipolazione della radioattività. Se i guanti sono contaminati con scorie radioattive e sostituire i guanti esterni. Utilizzare opportune schermature, ridurre al minimo il tempo a contatto con la sorgente di radiazione e massimizzare la distanza.
1. Una settimana prima dell'esperimento: preparazione dei materiali
- Scaricare la sequenza [ 18 F] 3F4AP: gli utenti di Synthera possono accedere al database degli utenti (http://www.iba-radiopharmasolutions.com/products/chemistry) e scaricare il file di sequenza per 3F4AP. Gli utenti di altri sintetizzatori potrebbero aver bisogno di scrivere il proprio script in base alla sequenza di passi. Sfoglia la sequenza annotata per familiarizzare con i sTappi coinvolti nella sintesi.
- Assicurarsi che ci sia abbastanza gas per la sintesi. Il sintetizzatore richiede gas compresso, sia elio che azoto. Richiede inoltre aria compressa> 75 psi. Assicurarsi che le pressioni siano all'interno del prodotto raccomandato dal costruttore.
- Preparare la fase mobile HPLC: preparare 1 L di 50 mM sodio fosfato e 10 mM trietilammina. Utilizzando un misuratore di pH regolare il pH a 8.0 ± 0.1 aggiungendo l'idrossido di sodio saturo in goccia mescolando. Filtrare la soluzione attraverso un filtro da bottiglia da 0,22 μm e aggiungere 5% di etanolo.
- Vetrerie secchi nel forno durante la notte.
2. Giorno di sperimentazione: prima dell'arrivo di Fluorine-18
- Utilizzando 1 ml di siringhe, riempire i flaconi del reagente con i reagenti appropriati. Per i flaconi 2 e 3 utilizzare flaconcini secchi e solventi anidro tenuti sotto argon. Sigillare i flaconi con le guarnizioni di crimpatura usando un crimpino.
- Riempire Vial 1 (diametro 11 mm / 2 ml volume viAl) con 400 μl di TBA-HCO 3 + 800 μL di acetonitrile (MeCN).
- Riempire il flaconcino 2 (flaconcino da 13 mm / 4 mL) con 50 μL di soluzione precursore 1,0 mg / ml + 450 μl di MeCN.
- Riempire il flaconcino 3 (flaconcino da 11 mm / 2 ml) con 500 μL di MeCN.
- Riempire il flaconcino 4 (flaconcino da 13 mm / 4 mL) con 4 mL di acido oxalico 0,2% in metanolo (MeOH).
- Condizione della cartuccia QMA (forte scambio di anioni) e Alumina-N. Usando una siringa da 10 ml, passare 5 mL di 8,4% di NaHCO 3 a goccia attraverso il QMA seguita da 5 mL di acqua ultrapure deionizzata tipo I (18,2 ΜΩ • cm a 25 ºC). Passare 5 ml di acqua ultrapure in goccia attraverso la cartuccia Alumina-N seguita da 5 ml di MeOH + 0,2% di acido ossalico.
- Accendere l'HPLC e condurre la colonna C-18 con 4 mL per min di fase mobile per 30 minuti.
- Caricare una nuova cartuccia del catalizzatore sul supporto della cartuccia idrogenatore e avviare un flusso di 0,5 mL / min di 100% MeOH. SE il regolatore di idrogeno a 50 psi e condizionare la cartuccia per 15 minuti ( figura 2 ).
- Montare il Processore Fluido Integrato (IFP) introducendo flaconi da 1 a 4 nelle loro posizioni, fissando le cartucce e il flaconcino di raccolta come mostrato in Figura 3 . Fissare una fiala di raccolta con un ago di sfiato alla linea di uscita dell'idrogeno.
- Avviare il software del sintetizzatore. Inserisci il login e la password. Eseguire i controlli di pre-esecuzione sul sintetizzatore in base alle istruzioni del produttore.
- Fare clic su "Sequences" e poi su "Open" per caricare la sequenza 3F4AP.
- Caricare l'IFP facendo clic sul pulsante "Carica" sullo schermo. Digitare un nome di file per l'esecuzione e avviare la sequenza cliccando su "Start". (Il sintetizzatore automatico sospenderà automaticamente prima della fase di caricamento di 18 F.)
- Guarda come il sintetizzatore va attraverso i passaggi di autodiagnostica di routine (parte uno della sequenza). Guarda lo screeN per garantire che non ci siano allarmi o allarmi. Prestare attenzione ai suoni mentre il sintetizzatore scompare le linee e pre-riscalda il vaso di reazione in preparazione alla corsa. L'indicatore di temperatura dovrebbe salire e rimanere a 65 ºC. Attendere il segnale (segnale acustico) che indica che il sintetizzatore è pronto per il trasferimento da 18 F.
3. Giornata dell'esperimento: 18 F Etichettatura
- Trasferire in remoto la quantità desiderata di 18 ciclotrone prodotta dal target ciclotrone a una fiala da 18 F. Verificare la quantità di radioattività e registrarla con l'orario di consegna.
NOTA: Se non si utilizza una linea diretta per 18 F trasferimento utilizzare una siringa pre-riempita con un ago attaccato per trasferire l'attività alla fiala attraverso il setto. La quantità di radioattività di partenza dipende dai limiti stabiliti dall'Ufficio di sicurezza delle radiazioni e dalla quantità di tracciante finale desiderata. La quantità tipica varia da 50 a 500 mCi. - Riprendere la sequenza sul sintetizzatore premendo "Riprendi". Questo avvierà il trasferimento dei 18 F nel QMA.
- Monitorare la progressione della sintesi durante la sequenza automatica sullo schermo del computer.
- Guarda il trasferimento del 18 F dalla fiala sul QMA per 90 s. Dopo aver intrappolato 18 F - su QMA eluve con soluzione TBA-HCO 3 (flaconcino 1). (Parte seconda della sequenza)
- Monitorare le tracce di pressione e temperatura sul sintetizzatore mentre il TBA 18 F viene essiccato a pressione ridotta (5 kPa) e riscaldamento (100 ºC), seguita da ulteriori asciugatura e raffreddamento. (Parte 3 della sequenza)
- Osservare il trasferimento di MeCN anidride (flaconcino 3) e soluzione precursore (flaconcino 2) al reattore e come reagisce per 1 min a temperatura ambiente. La soluzione deve essere incolore o molto giallo debole. (Parte 4 della sequenza)
- Osservare il trasferimento dell'acido ossalicoSoluzione (flaconcino 4) al reattore. Guarda come la soluzione è la pressione trasferita dal reattore attraverso la cartuccia di allumina-N alla fiala del prodotto finale. (Parte 5 della sequenza)
- Alla fine della sequenza, stampare il rapporto, espellere l'IFP, arrestare i serbatoi di gas e chiudere il software.
- Prima di stabilire la procedura, misurare la radioattività nella cartuccia di allumina-N e nella fiala di raccolta introducendo separatamente la cartuccia e la fiala nel calibratore della dose. Registrare l'attività e il tempo di misurazione. Posizionare la cartuccia usata in un contenitore di residui di piombo. Posizionare il flaconcino di raccolta in un contenitore schermato per il trasporto al passo successivo.
- Utilizzando una siringa da 1 ml con un ago da 2 ", trasferire manualmente circa 100 μl di campione della soluzione di prodotto intermedio in un flacone HPLC standard per il controllo della qualità in processo. Iniettare 10 μL di questo campione nella HPLC per valutare la purezza e Identità dell'intermeComposto diattivo.
NOTA: condizioni HPLC: colonna XDB 5 μm, 9,4 x 250 mm C18. Flusso 4 mL / min. Fase mobile (50 mM Na 2 HPO 4 , 10 mM TEA, 5% EtOH). Isocratico 15 min.
4. Giornata dell'esperimento: idrogenazione
ATTENZIONE: L'iniezione del prodotto nell'idrogeno deve essere effettuata utilizzando adeguate precauzioni di schermatura. Il gas idrogeno deve essere adeguatamente manipolato e sfiato.
NOTA: il reattore di idrogenazione può essere collegato al posto della colonna HPLC sul sintetizzatore e controllato utilizzando il software del sintetizzatore.
- Impostare il flusso dell'idrogenoatore a 0,5 mL / min iniziando la sequenza HPLC del sintetizzatore. Impostare manualmente la pressione dell'idrogeno a 50 psi.
- Dopo aver terminato i passaggi di etichettatura e di spegnimento, il sintetizzatore trasferirà la soluzione di prodotto intermedio in idrogeno / ciclo HPLC.
- Quando il picco radioattivo viene visualizzato sul HPLC software sposta la valvola di raccolta per raccogliere il prodotto. Misurare la radioattività del prodotto grezzo utilizzando un calibratore di dosaggio.
NOTA: il prodotto grezzo dovrebbe essere iniettato in un sistema HPLC automatizzato all'interno di una cella calda. Dopo la purificazione, il prodotto finale viene quindi raccolto e dispensato in una cella ausiliaria fluida del flusso laminare classico classe 5 conformemente alle normative USP e FDA.
5. Giorno di sperimentazione: purificazione e preparazione del dosaggio
- Iniettare il prodotto grezzo nel HPLC e utilizzare il collettore di frazioni automatizzato per raccogliere le frazioni corrispondenti al picco del prodotto finale. Ogni tubo contiene 0,66 ml di soluzione.
NOTA: condizioni HPLC: colonna XDB 5 μm, 9,4 x 250 mm C18. Flusso 4 mL / min. Fase mobile (50 mM Na 2 HPO 4 , 10 mM TEA, 5% EtOH). Isocratico 15 min. Raccogli 4-15 min. - Misurare la radioattività di ciascuna frazione utilizzando un calibratore di dose e registrarla. Combinare le frazioni con la massima quantitàS di radioattività (tipicamente i tubi 14-18).
- Disegnare la soluzione del prodotto con una siringa da 10 ml e passare il campione attraverso un filtro da 0,22 μm in una fiala sterile. Registrare la quantità di radioattività, la fine del tempo di sintesi e il volume della soluzione sull'etichetta del flaconcino. Questa è la dose finale per l'iniezione. Mettere da parte ~ 0,8 ml della soluzione per i test di controllo di qualità.
6. Giorno di sperimentazione: Controlli di qualità (QC)
- Prima di rilasciare la dose:
Ispezionare la dose attraverso un vetro schermato di piombo. La soluzione deve essere chiara, incolore e priva di particolato. - Identità radiochimica:
- Per RadioTLC: posizionare una goccia del campione su una piastra TLC affiancata dalla norma di riferimento. Eseguire la lastra di TLC su una camera di TLC usando il 95% di MeOH: 5% di acido acetico. Visualizzare lo standard di riferimento sotto l'illuminazione UV e segnare la sua posizione con la matita.
- Nastri la lastra TLC allo stadio della scansione radioTLCEr e il tempo record del picco. I valori Rf dello standard di riferimento e il picco radioattivo devono corrispondere al 5%.
- Per RadioHPLC: eseguire 10 μL della dose con e senza lo standard di riferimento sul HPLC. Il tempo di ritenzione dello standard di riferimento e il picco radioattivo devono corrispondere. Sul campione tamponato deve essere visto un solo picco di coefficiente.
- Per la purezza radiochimica: misurare l'area sotto curva per i picchi di target radioHPLC e radioTLC. L'area del picco obiettivo deve essere> 95% della superficie per tutti i picchi radioattivi combinati.
- Per la radioattività specifica: calcolare la radioattività specifica come la quantità di radioattività nel picco (misurata alla fase 5.2) sulla quantità di massa determinata dall'area sotto la curva della traccia UV HPLC utilizzando una curva di calibrazione prestabilita. La radioattività specifica deve essere superiore a 50 mCi / μmol.
- Per l'analisi residua del solvente: misurare la quantità di solventi residuiTs (MeCN, MeOH) nella dose usando la cromatografia a gas. I livelli di solventi devono essere <0,04% per acetonitrile e <3,000 ppm per metanolo. La quantità di EtOH deve essere inferiore al 10% w / v.
- Per il test di integrità del filtro sterile (punto bolle): collegare il filtro utilizzato nella fase 5.3 ad una fornitura di azoto dotata di un regolatore di pressione e immergere l'ago in acqua. Aprire gradualmente la valvola del gas mentre si guarda il manometro. Il filtro deve resistere a pressioni fino a 50 psi senza scoppio, come dimostra la mancanza di un flusso di bolle dall'ago. Aumenta la pressione oltre i 50 psi finché un flusso di bolle esce dall'ago. Registrare questa pressione, è la pressione di scoppio e deve essere> 50 psi.
- Per l'emivita del radionuclide: misurare la radioattività del prodotto in due punti di tempo ≥10 min in un calibratore di dosaggio. Calcolare l'emivita utilizzando l'equazione seguente. L'emivita deve corrispondere a quella di 18 F entro 5 minuti (109 ± 5 min):
T ½ calcolato = 0,693 t ÷ ln (A 1 / A 2 )
Dove t è l'intervallo tra le misurazioni e A 1 , A 2 l'attività misurata in ogni punto temporale. - Per l'identità radionuclidica e la purezza: ottenere lo spettro di raggi gamma di un campione del prodotto utilizzando un contatore gamma. Lo spettro dovrebbe presentare una singola foto-picco ad un'energia di 511 keV. Non ci dovrebbero essere altre foto-picchi nello spettro.
- Per l'analisi dell'endotossina: misurare i livelli di endotossina usando un test quantitativo cromogenico di endotossina LAL. I livelli di endotossina devono essere <1.75 EU / mL per un prodotto diluito 1:10 con un volume finale del prodotto di 10 mL.
- Documentare i risultati di ciascun test QC. Rilasciare la dose per gli studi sugli animali solo se tutti i test sono passati.
- Sblocco post-dose:
Per il test di sterilità: aggiungere un campione della dose sia al tioglicolato fluido che alla tripicinaBrodo di soia. Nessuna crescita deve essere visto sui media dopo 14 giorni.
7. Giorno dell'esperimento: calcoli (tabella 1)
- Per la resa radiochimica (ndc RCY) corretto di non decadimento: calcolare il ndc RCY come quantità di radioattività nel prodotto finale sulla radioattività di partenza.
- Per l'efficienza del radiolabel: calcolare la resa di etichettatura come rapporto di radioattività nel flaconcino di raccolta sulla radioattività nella cartuccia di allumina-N (non incorporata [ 18 F] F) e nella fiala di raccolta.
- Per la resa di idrogenazione: calcolare la resa di idrogenazione come la quantità di radioattività nel picco desiderato rispetto alla radioattività iniettata nella HPLC.
- Per le perdite di filtraggio: calcolare il filtraggio perde come la radioattività residua nel filtro e siringa sulla radioattività prima del filtraggio.
Risultati
La sintesi radiochimica di [18F] 3F4AP comprende due fasi ( Figura 1 ). Il primo passo viene effettuato in modo completamente automatico utilizzando l'unità di sintesi ( Figura 3 ). Questo sistema a base di cassette utilizza quattro flaconi di reagente e un flacone per reattori e dispone di valvole controllate da computer che consentono il trasferimento e la miscelazione di reagenti, nonché il riscaldamento, il pressurizzazione e l'evacuazione del reattore. Inoltre, supporta le cartucce di estrazione standard a fase solida per la separazione dei reagenti. L'interfaccia computer consente agli utenti di scrivere e modificare gli script per eseguire le loro proprie sintesi. Nel caso di [18F] 3F4AP, la procedura di sintesi è composta da cinque parti di base. Nella prima parte, il sintetizzatore esegue i passi di autocontrollo, preleva il reattore e attende il segnale dell'operatore che il 18 F è pronto. Durante la seconda parte, il fluoro [ 18 F] viene trasferito al di sopraM il flacone da 18 F nella cartuccia di sostituzione dell'anione e eluito dalla cartuccia nel reattore utilizzando un bicarbonato di tetrabutil ammonio di soluzione. La terza parte, il sintetizzatore azeotropicamente asciuga il fluoro [ 18 F] sotto vuoto per renderlo reattivo verso lo spostamento nucleofilico. Nella quarta parte, il precursore viene automaticamente aggiunto al reattore dove reagisce con il 18 F - per generare il composto etichettato. Infine, la reazione viene interrotta con l'aggiunta di 0,2% di acido ossalico in metanolo, che impedisce la decomposizione del prodotto promossa dalla base e la soluzione finale viene trasferita a pressione alla fiala di raccolta dopo aver attraversato una cartuccia di allumina-N che trapassa qualsiasi Fluoruro non reagito.
Una volta completata la fase di etichettatura, è possibile prendere un piccolo campione per il controllo della qualità. L'esecuzione di un campione sul HPLC fornisce la conferma che la fase di etichettatura ha funzionato e una stimaSulla purezza radiochimica ( Figura 4 ). Inoltre, dalla traccia UV sulla HPLC, la massa di prodotto può essere calcolata utilizzando una curva di calibrazione prestabilita.
Mentre è in esecuzione il controllo qualità HPLC in processo, viene eseguita la seconda fase di reazione, la riduzione dei gruppi N-ossido e nitro. Per fare questo, il prodotto etichettato viene iniettato automaticamente in un dispositivo di idrogenazione in-house basato sul metodo pubblicato da Yoswathananont et al. 13 ( Figura 2 ). Questo dispositivo è costituito da una pompa HPLC e da un serbatoio di idrogeno compresso collegato al dispositivo di idrogenazione del flusso attraverso linee dotate di valvole di bloccaggio per impedire il back-streaming. Il prodotto viene spinto dalla pompa HPLC e mescolato con idrogeno in un miscelatore a forma di T. Questa miscela viene poi passata attraverso una piccola cartuccia contenente catalizzatore Pd / C del 10% su un supporto solido. Dopo aver superato la cataIl prodotto ridotto viene poi raccolto in piccole frazioni.
Dopo l'idrogenazione, il prodotto grezzo viene trasportato e iniettato manualmente nel HPLC per la purificazione del prodotto finale ( Figura 5 ). La fase mobile della HPLC è stata selezionata per essere compatibile con l'iniezione animale. I picchi corrispondenti al prodotto vengono poi raccolti e sterilizzati a filtrazione per ottenere la dose finale.
Prima di rilasciare la dose per gli studi di imaging PET, vengono eseguiti test di qualità. Questi test vengono eseguiti per assicurare che il tracciante sia l'entità chimica che si suppone e che sia sicura per l'iniezione. Alcune di queste prove potrebbero non essere necessarie per l'iniezione negli animali, ma generalmente è consigliabile seguire le linee guida per l'uso umano. In tal modo assicura la qualità del prodotto, che aumenta la fiducia nei risultati e si affaccia notevolmentePrevede la transizione futura alla produzione del prodotto per l'iniezione umana.
La tabella 1 contiene i parametri tipici di sintesi che includono la radioattività di quantità iniziale, la quantità iniziale del precursore, la resa per ogni fase, l'attività specifica, i filtri perdenti ecc. Questi parametri sono utili per risolvere i guasti occasionali e per ottimizzare ulteriormente la procedura.
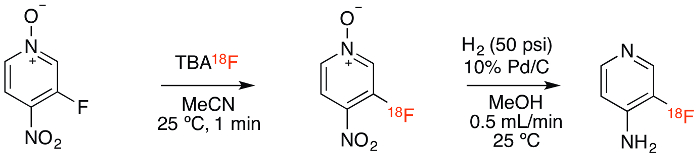
Figura 1. Schema di reazione. La sintesi radiochimica consiste nell'etichettatura con 19 F / 18 F scambio seguito da idrogenazione catalizzata da palladio. Clicca qui per visualizzare una versione più grande di questa figura.
Src = "/ files / ftp_upload / 55537 / 55537fig2.jpg" />
Figura 2. Sistema di idrogenazione. Schema del dispositivo. Questo dispositivo è basato sulla pubblicazione di Yoswathananont et al. (Rif. 13).

Figura 3. Schema del processore fluido integrato sintetizzatore (IFP) e dei reagenti. L'IFP contiene quattro flaconcini di reagente, una cartuccia QMA e una fiala del reattore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4. Traccianti UV e radioHPLC per il prodotto intermedio. 3-fluoro-4-nitropyridine N-ossido ha un assorbimento caratteristico a 313 nm.E.jove.com/files/ftp_upload/55537/55537fig4large.jpg "target =" _ blank "> Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5. Indicatori UV e radioHPLC per il prodotto finale. 3-fluoro-4-ammino-piridina assorbe a 254 nm. Clicca qui per visualizzare una versione più grande di questa figura.
| Concetto | Medio (n = 4) | SD | Commenti |
| Attività iniziale 18 F (mCi) | 148,0 | 44.9 | Inizio della sintesi |
| Quantità precursore (μg) | 50 | Utilizzare 50 μL di azione da 1,0 mg / ml | |
| Attività rimasta in QMA (mCi) | 3.0 | 1.7 | Misurato alla fine della fase di etichettatura |
| Rendimento del radiolabel | 29,7% | 6,3% | Act_collection_vial ÷ (Act_collection_vial + Act_AluN) |
| Purezza radiochimica (HPLC-1) | > 98% | Da HPLC-1 QC | |
| Spec. atto. Intermedio (mCi / μmol) | 122,9 | 29.7 | Da HPLC-1 utilizzando la curva di calibrazione |
| Recupero idrogenazione (dc) | 74% | 9,0% | Corretto per decadimento |
| Purezza radiochimica HPLC (HPLC-2) | 90.7% | 2,9% | Calcolato da HPLC-2 |
| Efficienza di essiccazione | > 98% | Corretto per decadimento | |
| Filtraggio di recupero | 93,5% | 1,7% | Corretto per decadimento |
| Volume di dosaggio (ml) | 3.3 | Raccogli le frazioni con la massima radioattività | |
| Spec. atto. Prodotto finale (mCi / μmol) | 75.5 | 30,0 | Da HPLC-3 utilizzando la curva di calibrazione |
| Efficienza di sintesi | 8,5% | 3,6% | Corretto il non decadimento |
| Tempo di sintesi (min) | 104 | 11.2 |
Tabella 1. Parametri di sintesi radiochimica.
| Problemi comuni | Possibili ragioni e soluzioni |
| [ 18 F] fluoruro non è eluitamente eluso dal QMA | · TBA-HCO 3 non è stato preparato correttamente. Assicurarsi che la concentrazione sia adeguata. |
| · Ci sono perdite sulla fiala TBA-HCO 3 . Assicurarsi che la guarnizione di crimpatura sia fissa e che il setto non venga forato prima di installarlo sull'IFP. | |
| · TBA-HCO 3 non è in buone condizioni. Ordinare un lotto fresco. | |
| La resa di etichettatura è bassa | · C'è l'umidità nella soluzione precursore. Precursore secco e solventi. |
| · La temperatura è troppo bassa. | |
| La soluzione di reazione è gialla | · Il prodotto si decompone a causa della base. Usa meno TBA-HCO 3 . |
| · C'è tOo molto precursore. Usa meno precursore. | |
| · C'è troppo poco solvente per la quantità di 18 F - . Utilizzare più solventi. | |
| Ulteriori cime su radioHPLC | · Il gruppo nitro è sostituito: ridurre la temperatura di reazione o abbreviare il tempo di reazione. |
| La reazione di idrogenazione non funziona | · Il catalizzatore non è buono. Utilizzare una nuova cartuccia. |
| · Il flusso è troppo veloce e non consente un contatto sufficiente tra catalizzatore e substrato. Riduci il flusso. | |
| · La pressione dell'idrogeno è troppo bassa. Aumentare la pressione H 2 . | |
| La pressione dell'idrogeno aumenta drasticamente durante la procedura | · L'integrità della cartuccia è compromessa e il supporto solido è intasamento delle linee. Arrestare il flusso e spegnere il gas. Lasciare decadere la radioattività. Rimuovere la cartuccia del catalizzatore e irrigare il sistema. Mettere unCartuccia ew. |
| La resa di idrogenazione è bassa | · Troppe impurità che competono per il catalizzatore (MeCN, acido oxalico). Diminuire la quantità di impurità o aumentare la massa del precursore (avviso: aumentare la quantità precursore ridurrà l'attività specifica). |
| Il recupero di radioattività dalla fase di idrogenazione è basso | · Nel sistema è presente una perdita. Controllare le perdite e il ritorno nella linea di idrogeno. |
| · Il composto è defluorinato nel reattore. Valutare le diverse condizioni di reazione (pressione, temperatura, flusso, ecc. ). | |
| Troppa radioattività viene persa durante la filtrazione | · Bagnare il filtro prima dell'uso. |
| · Utilizzare un filtro con un volume inferiore morto. | |
| Il picco finale del prodotto sul HPLC sembra ampio | · Iniettato troppo volume. Iniettare più bassoount. Utilizzare colonna con diametro maggiore. |
| · La colonna non è ben condizionata. Condizione della colonna per almeno 30 volumi di colonna. | |
| · Il pH della fase mobile è basso. Assicurarsi che il pH ≥ 8. | |
| · La colonna non è in buone condizioni. Sostituisci colonna. Utilizzare la colonna compatibile con il pH di base. |
Tabella 2. Guida alla risoluzione dei problemi.
Discussione
La preparazione dei traccianti in PET richiede un'efficace etichettatura con un intervento minimo da parte dell'utente per ridurre al minimo l'esposizione alle radiazioni 14 . Qui abbiamo descritto la prima procedura semi-automatizzata per la sintesi radiochimica di [ 18 F] 3F4AP, un tracciante di PET attualmente in fase di indagine per la demielinizzazione dell'immagine. Questo metodo semi-automatizzato produce il radiotracer con purezza elevata e sufficiente attività specifica per gli studi sugli animali. I metodi precedenti per la sintesi di questo composto si sono basati sulla sintesi manuale 6 , che limita significativamente la quantità di traccianti radioattivi che possono essere prodotte. Avere un metodo automatizzato per la sintesi fornisce anche rendimenti più riproducibili e rende più facile trasferire la procedura ad altri laboratori con attrezzature simili. Gli sforzi futuri per automatizzare completamente la procedura saranno strumentali alla produzione del tracciante in quantità elevate per studi su grandi animali o umani.
Questa procedura utilizza scambio nucleofilico di 19 F per 18 F per incorporare il radioisotopo nella molecola di interesse. I vantaggi di questa reazione sono che è veloce e produce quasi esclusivamente il prodotto desiderato senza la necessità di eseguire una fase di purificazione potenzialmente lunga per rimuovere l'eccesso di precursore. Una limitazione dell'utilizzo di reazioni di etichettatura a scambio di fluoruri come quella utilizzata qui è che, a causa della massa iniziale di composto freddo, può essere limitata l'attività specifica finale definita come quantità di radioattività in mCi rispetto alla quantità di composto in μmol. Nelle nostre condizioni standard, a partire da 100-200 mCi di 18 F e 50 μg di precursore, la tipica attività specifica alla fine della sintesi è fino a 100-200 mCi / μmol, che sembra sufficiente per gli studi preclinici di imaging PET . Tuttavia, l'attività specifica può migliorare aumentando l'importo di partenza per 18 F - mantenendo la quantità di massa bassa. Ci sono stati diversi rapporti di produzione di radioligande mediante scambio di fluoruri ad alta attività specifica (1-3 Ci / μmol), iniziando con attività elevata e bassi precursori 15 , 16 .
Come per tutte le sintesi radiochimiche dei traccianti in PET, è fondamentale lavorare rapidamente al fine di ridurre al minimo il decadimento radioattivo. È inoltre importante ridurre al minimo il tempo di manipolazione dei materiali radioattivi, utilizzare una corretta schermatura e massimizzare la distanza tra il materiale radioattivo e l'utente per ridurre al minimo l'esposizione alle radiazioni. Questi aspetti sono particolarmente importanti durante la seconda metà del protocollo (purificazione e controllo della qualità) in cui l'utente deve iniettare manualmente la soluzione nella HPLC, raccogliere le frazioni e filtrare il prodotto finale.
Come per tutte le sintesi radiochimiche dei traccianti in PET, è fondamentale lavorare rapidamente per mInimizzare il decadimento radioattivo. È inoltre importante ridurre al minimo il tempo di manipolazione dei materiali radioattivi, utilizzare una corretta schermatura e massimizzare la distanza tra il materiale radioattivo e l'utente per ridurre al minimo l'esposizione alle radiazioni. Questi aspetti sono particolarmente importanti durante la seconda metà del protocollo (idrogenazione e purificazione) in cui l'utente deve iniettare manualmente la soluzione nel idrogeno, raccogliere le frazioni, impostare la procedura di essiccazione, risolvere il prodotto in tampone e filtrarlo. Durante la fase di filtraggio è facile perdere una grande quantità di materiale radioattivo nelle pareti delle fiale. Quindi, è importante cercare di raccogliere tutto il liquido prima del filtraggio. L'utilizzo di una quantità maggiore di tampone da sciogliere può migliorare la resa del recupero, ma il suo utilizzo è scoraggiato perché richiederà l'iniezione di un volume maggiore sulla HPLC, causando che il picco si espande e aumenta il volume della dose finale.
Per risolvere un problemaNd ottimizzare la procedura è importante per tenere traccia delle rese di ogni passo. Per la maggior parte dei passaggi questo è fatto semplicemente misurando la quantità di radioattività prima e dopo qualsiasi passo. Nel caso della reazione le rese possono essere calcolate attraverso la quantificazione dei picchi HPLC. La Tabella 1 nella sezione Risultati mostra i rendimenti tipici per ogni passaggio. La tabella 2 riportata di seguito elenca molti dei guasti comunemente rilevati con potenziali motivi per il fallimento e come correggerli.
Infine, anche se la procedura qui dimostrata è specifica per la sintesi di [ 18 F] 3F4AP, il flusso di lavoro generale e molti dei singoli passaggi sono comuni alla sintesi di altri composti 17 . In questo articolo abbiamo anche dimostrato i tipici test QC eseguiti su qualsiasi tracciante di PET.
Divulgazioni
Gli autori non hanno niente da divulgare.
Riconoscimenti
Questo progetto è stato sostenuto da sovvenzioni NIH / NIBIB 1K99EB020075 a Pedro Brugarolas e un premio Innovation Fund da Chicago Innovation Exchange a Brian Popko e Pedro Brugarolas. Il professor Brian Popko è riconosciuto con gratitudine per la sua tutorazione e il sostegno finanziario al progetto. Prof Chin-Tu Chen e la Risorsa di Ricerca Integrata per l'Imaging Piccolo Animale presso l'Università di Chicago sono riconosciuti per aver generosamente condiviso lo spazio e le attrezzature del laboratorio. L'IBA è riconosciuta per sponsorizzare l'accesso aperto di questo articolo.
Materiali
| Name | Company | Catalog Number | Comments |
| Cyclotron produced [18F]fluoride | House supplied/Zevacor | IBA Cyclone 18 | 100-200 mCi |
| Integrated fluid processor for production FLT/FDG | ABX | K-2715SYN | Cassette used for nucleophilic substitution |
| Anhydrous acetonitrile | Janssen | 36431-0010 | Transfer under nitrogen |
| Methanol | Janssen | 67-56-1 | |
| ultrapure water | house supplied | Millipore MilliQ system | |
| TBA-HCO3 | ABX | 808.0000.6 | abx.de |
| QMA | Waters | WAT023525 | Quaternary methyl ammonium: Anion exchange solid phase extraction cartridge for trap and release of 18F- from the target water |
| Sodium bicarbonate | ABX | K-28XX.03 | Prefilled 5 mL syringes |
| Alumina-N | Waters | WAT020510 | Alumina-N solid phase extraction cartridge (for trapping unreacted 18F-) |
| 3-fluoro-4-nitropyridine N-oxide | Synthonix | 76954-0 | Store in desicator. Precursor |
| 3-fluoro-4-aminopyridine | Sigma Aldrich | 704490-1G | Reference standard |
| Oxalic acid | Sigma Aldrich | 75688-50G | |
| Sodium phosphate monobasic | Fisher Scientific | S80191-1 | |
| Triethyl amine | Fisher Scientific | 04885-1 | |
| Ethanol | Decon Labs | DSP-MD.43 | USP |
| Final product vial | ABX | K28XX.04 | |
| Millex Filter Syringe | Millex | SLGVR04NL | |
| 10% Pd/C cartridge | Sigma Aldrich | THS-01111-12EA | |
| 11 mm vials + crimp seals | Fisher Scientific | 03-250-618, 06-451-117, or equivalent | |
| 13 mm vials + crimp seals | Fisher Scientific | 06-718-992, 06-718-643, or equivalent | |
| HPLC vials | Fisher Scientific | 03-391-16, 03-391-17, or equivalent | |
| SEMIPREP C18 column | Agilent | 990967-202 | |
| V-vials | Alltech | ||
| Syringes: 1, 3, 10 mL | Fisher Scientific | 14-829-10D, 14-829-13Q, 14-829-18G, or equivalent | |
| Compressed gases: N2, He, H2 | Airgas | UHP N300, UHP HE300, UHP H300, or equivalent | |
| TLC plates | Sigma Aldrich | Z193275, or equivalent | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Synthera automated synthesizer | IBA SA, Belgium, iba-worldwide.com | Synthera, 250.001 | Automatic synthesis unit |
| In-house hydrogenator | See picture | See text description | |
| Hot cells | Comecer | For manipulating radioactive materials | |
| RadioTLC scanner | Eckert and Ziegler | For handling sterile materials | |
| HPLC | Dionex | Ultimate 3000 | |
| Dose calibrator | Capintec | CRC15 | Or equivalent |
| Gamma counter | Capintec, 7 Vreeland Road, Florham Park, NJ 07932 | CRC 15, PET-CRC25, or equivalent | For measuring radioactivity |
| Personal dosimeters | Packard | Cobra II | For measuring gamma spectrum |
| Personal radiation badges and rings | Atlantic Nuclear | Rados Rad-60 Electronic Dosimeter, or equivalent | |
| Rotavap + vacuum pump | Landauer | ||
| Lead pigs + syringe shields | Heidolph | Or equivalent | |
| Geiger counter | Pinestar | ||
| Geiger counter | Ludlum | Model 3 + Pancake GM detector, 4801605, 47-1539, or equivalent |
Riferimenti
- Valk, P. E. Positron emission tomography : basic science and clinical practice. , Springer. (2003).
- Phelps, M. E. PET: molecular imaging and its biological applications. , Springer. (2004).
- Ametamey, S. M., Honer, M., Schubiger, P. A. Molecular imaging with PET. Chem Rev. 108 (5), 1501-1516 (2008).
- Oriuchi, N., et al. Present role and future prospects of positron emission tomography in clinical oncology. Cancer Sci. 97 (12), 1291-1297 (2006).
- Heiss, W. D., Herholz, K. Brain receptor imaging. J Nucl Med. 47 (2), 302-312 (2006).
- Brugarolas, P., Freifelder, R., Cheng, S. -H., DeJesus, O. Synthesis of meta-substituted [18F]3-fluoro-4-aminopyridine via direct radiofluorination of pyridine N-oxides. Chemical Communications. , (2016).
- Jones, R. E., Heron, J. R., Foster, D. H., Snelgar, R. S., Mason, R. J. Effects of 4-aminopyridine in patients with multiple sclerosis. J Neurol Sci. 60 (3), 353-362 (1983).
- Davis, F. A., Stefoski, D., Rush, J. Orally administered 4-aminopyridine improves clinical signs in multiple sclerosis. Ann Neurol. 27 (2), 186-192 (1990).
- Goodman, A. D., et al. Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. Lancet. 373 (9665), 732-738 (2009).
- Brugarolas, P., et al. Abstracts Of Papers Of The American Chemical Society. , Amer Chemical Soc. (2016).
- Brugarolas, P., et al. Development of a PET tracer for MS. J Nucl Med Meeting Abstracts. 55 (1), 1124(2014).
- Brugarolas, P., et al. Fluorinated 4-aminopyrdines as PET tracers for MS. Journal of Nuclear Medicine. 56, Suppl 3. 493(2015).
- Yoswathananont, N., Nitta, K., Nishiuchi, Y., Sato, M. Continuous hydrogenation reactions in a tube reactor packed with Pd/C. Chem Comm. (1), 40-42 (2005).
- Stöcklin, G., Pike, V. W. Radiopharmaceuticals for Positron Emission Tomography-Methodological Aspects. 24, Springer Science & Business Media. (1993).
- Liu, Z., et al. Preclinical evaluation of a high-affinity 18F-trifluoroborate octreotate derivative for somatostatin receptor imaging. J Nucl Med. 55 (9), 1499-1505 (2014).
- Liu, Z., et al. 18F-trifluoroborate derivatives of [des-arg(10)]kallidin for imaging bradykinin b1 receptor expression with positron emission tomography. Mol Pharm. 12 (3), 974-982 (2015).
- Scott, P. J. H., Hockley, B. G., Kilbourn, M. R. Radiochemical Syntheses, Volume 1: Radiopharmaceuticals for Positron Emission Tomography. , Wiley. (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon