Method Article
Quantificazione dei metalli pesanti e altri contaminanti inorganici sulla produttività delle microalghe
In questo articolo
Riepilogo
Integration of microalgal cultivation with industrial flue gas will ultimately introduce heavy metals and other inorganic compounds into the growth media. This study presents a procedure used to determine the end fate and impact of heavy metals and inorganic contaminants on the growth of Nannochloropsis salina grown in photobioreactors.
Abstract
La crescente domanda di carburanti rinnovabili ha ricercatori che studiano la fattibilità di materie prime alternative, come microalghe. Vantaggi intrinseci includono ad alto rendimento potenziale, l'uso di terreni non coltivabili e l'integrazione con i flussi di rifiuti. Le esigenze nutrizionali di un sistema di produzione di microalghe su larga scala richiederà l'accoppiamento dei sistemi di coltivazione con le risorse dei rifiuti industriali, come l'anidride carbonica dai gas di scarico e le sostanze nutrienti dalle acque reflue. Contaminanti inorganici presenti in tali rifiuti possono potenzialmente portare a bioaccumulo in biomassa microalgale impatto negativo dell'uso finale produttività e limitante. Questo studio si concentra sulla valutazione sperimentale dell'impatto e il destino di 14 contaminanti inorganici (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V e Zn) sulla crescita salina Nannochloropsis . Le microalghe sono state coltivate in fotobioreattori illuminato di 984 mmol m-2 sec -1 e mantenuta a pH 7 in una crescita del media inquinata con contaminanti inorganici a livelli previsti basato sulla composizione si trovano in sistemi di gas di scarico del carbone commerciali. Contaminanti presenti nella biomassa e mezzo alla fine di un periodo di crescita del 7 giorno erano analiticamente quantificate mediante vapore freddo spettrometria ad assorbimento atomico per Hg e mediante spettrometria di massa ad accoppiamento induttivo plasma per As, Cd, Co, Cr, Cu, Mn, Ni, Pb, Sb, Se, Sn, V e Zn. I risultati mostrano N. salina è un ceppo sensibile all'ambiente multi-metallo con una diminuzione statistica della biomassa yieldwith l'introduzione di questi contaminanti. Le tecniche qui presentate sono adeguate per quantificare la crescita delle alghe e determinare il destino di contaminanti inorganici.
Introduzione
Rispetto alle colture tradizionali terrestri microalghe hanno dimostrato di ottenere biomassa e lipidi rendimenti più elevati a causa intrinseche elevate efficienze di conversione solare 1,2. La coltivazione di microalghe ad alti tassi di produttività richiede la fornitura di vari nutrienti, tra cui una fonte di carbonio esterna. Si prevede che le strutture di crescita grandi saranno integrati con flussi di rifiuti industriali quali fumi industriali per minimizzare i costi di produzione e allo stesso tempo fornire bonifica ambientale. Carbonio Rifiuti industriali è in genere sotto forma di anidride carbonica gassosa e può contenere contaminanti che hanno il potenziale per avere un impatto negativo la produzione di microalghe. Specificamente, fumi derivati dal carbon avrà una varietà di contaminanti inclusi ma non limitati a prodotti di combustione di acqua e biossido di carbonio, nonché ossidi di zolfo e azoto, polveri sottili, contaminanti organici come diossine e furani, e con inorganicocontaminanti quali i metalli pesanti. L'impatto della maggior parte di questi contaminanti inorganici compresi con alcuni di essi noto come metalli pesanti sulla produttività microalghe non sono stati esplorati. Alcuni di questi elementi possono essere nutrienti a concentrazioni appropriate, ma a concentrazioni più elevate si possono produrre disfunzione delle cellule e persino la morte 3.
L'integrazione di microalghe con fumi industriali ha il potenziale per introdurre direttamente contaminanti inorganici in terreni di coltura. Fumi base di carbone ha una varietà di elementi inorganici (ad esempio, As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V e Zn) a varie concentrazioni alcune delle quali, in basso concentrazione, rappresentano elementi nutritivi per la crescita di microalghe. Contaminanti inorganici hanno una alta affinità per legare di microalghe e in seguito essere sorbita internamente attraverso trasportatori di nutrienti. Alcuni contaminanti inorganici (cioè, Co, Cu, Zn e Mn) sono nutrienti che fanno parte di enzimi coinvolgonod nella fotosintesi, la respirazione e altre funzioni 3,4. Tuttavia, in eccesso metalli e metalloidi possono essere tossici. Altri elementi, come il Pb, Cd, Sn, Sb, Se, As e Hg, non sono noti per sostenere la funzione delle cellule in qualsiasi concentrazione e rappresentano metalli non-nutrienti che possono influire negativamente sulla crescita della cultura 3,5,6. La presenza di uno qualsiasi di questi contaminanti ha il potenziale per produrre effetti negativi sulla funzione cellulare microalghe. Inoltre, l'interazione di metalli multipli con microalghe complica dinamiche di crescita e ha il potenziale di impatto di crescita.
Economia su larga scala sono stati direttamente collegati alla produttività del sistema di coltivazione 7-19. Inoltre, ricicla medie del sistema di crescita di microalghe sia per vasche all'aperto raceway (ORP) o fotobioreattori (PBR) è fondamentale in quanto rappresenta il 99,9 e il 99,4% della massa, rispettivamente, 20. La presenza di contaminanti inorganici in media potrebbe infine limitare mproduttività icroalgae e il riciclo dei media a causa di accumulo di contaminanti. Questo studio ha determinato sperimentalmente l'impatto di 14 contaminanti inorganici (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V e Zn), a concentrazioni attese dall'integrazione dei sistemi di coltivazione di microalghe con carbone derivato fumi, sulla produttività di N. salina coltivate in PBRs trasporto aereo. I contaminanti utilizzati in questo studio hanno dimostrato di non essere presente solo in fumi a carbone ma basato rifiuti urbani fumi, biosolids basata fumi, acque reflue urbane, acqua prodotta, sotterranee compromessa e l'acqua di mare 21-23. Le concentrazioni utilizzate in questo studio si basano su ciò che ci si aspetterebbe se sistemi di crescita delle microalghe sono stati integrati con una base di CO 2 di origine carbone con un'efficienza assorbimento dimostrata in sistemi PBR commerciali 20. Calcoli dettagliati che supportano le concentrazioni dei metalli pesanti e contaminanti inorganici sono presentati in napanet al. sono stati usati 24 tecniche analitiche per comprendere la distribuzione della maggior parte dei metalli nelle biomasse, media e ambiente. I metodi presentati hanno consentito la valutazione del potenziale di produttività delle microalghe sotto inorganico sforzo contaminanti e la quantificazione del loro destino finale.
Protocollo
Sistema 1. Crescita

Figura 1. Microalghe sistema di crescita. (A) rotometer aria, (B) di CO 2 rotometer, (C) Regolatore pH con solenoide, (D) data logger, (E) filtri in linea d'aria, (F) un colpo di testa di distribuzione dell'aria, (G) banca luce fluorescente, (H) misuratori di pH, sistema di (I) di raffreddamento, (J) bagno d'acqua, (K) filo termocoppia, (L) ponte aereo fotobioreattore, (M) di riscaldamento, (N) cabina fumi cappa, (O) sfiato, (P) di mandata aria capillare, (Q) filtri aria, (R) tubo di campionamento, (S) coperchio di silicone PBR, e (T)pH bene nel coperchio di silicone. Cliccate qui per vedere una versione più grande di questa figura.
- Creare il seguente microalghe sistema di crescita sperimentale (Figura 1).
- Acquisire dodici PBRs trasporto aereo, comprensivi di reattori di tubo di vetro 4,5 centimetri di diametro e 80 cm di altezza, con una capacità di coltivazione di 1,1 L con coperchio di silicone. Acquisire tubi pretagliati capillari di vetro (da 5 mm di diametro esterno e di 1 mm di diametro interno) di 10 cm (3 per PBR) e 85 centimetri (1 per PBR) di lunghezza.
- Congelare coperchi di silicone in una -80 ° C freezer. Lubrificare una punta con glicerolo e mentre coperchi sono congelati fare 3 buchi per ospitare i tubi capillari di sfiato, di campionamento e di erogazione del gas e 1 foro di diametro 17 mm a ospitare una sonda pH.
- Inserire i tubi capillari 3 in luogo con il tubo più lungo che si estende a 2 cm dalla parte inferiore del PBR. Nell'altra capillare aggiungere un tubo di silicone with un tubo capillare attaccato all'altra estremità che si estende ad un punto di campionamento desiderata. Coprire il foro per il pHmetro con un tappo in silicone 21D.
- Umidificare aria ambiente facendolo gorgogliare attraverso l'acqua e fornire l'aria umidificata al collettore di distribuzione dell'aria. Far passare il gas attraverso un filtro da 0,2 micron e consegnarlo alla sospensione algale attraverso il capillare di vetro consegna più lunga.
- Invia CO 2 compressa nel flusso d'aria umidificata per mantenere un pH neutro di 7,0 ± 0,1 nella sospensione cultura. Controllare il tasso di CO 2 di consegna con un (pH controller) automatizzato di CO 2 Sistema dispensario che apre un solenoide magnetico quando la coltura di alghe raggiunge pH 7.1 e chiude a pH 6.9.
- Fornire luce utilizzando 24 T5 lampade fluorescenti che si traducono in una illuminazione media di 984 mmol m-2 sec -1 simile a picco condizioni esterne.
- Immergere le PBRs in un bagno d'acqua, al fine di mAINTAIN una temperatura costante di circa 25 ° C. Controllare la temperatura del sistema utilizzando un refrigeratore ricircolo e di un riscaldamento ricircolo bagnomaria controllo automatizzato unità.
- Monitorare la temperatura e pH in tempo reale e registrare con un registratore di dati.
- Assicurarsi che tutti i componenti del sistema di crescita microalghe siano correttamente lavorando, in particolare prima della raccolta microalghe inoculo o preparazione contaminanti inorganici in quanto non possono essere conservati.
2. Lab Ware Preparazione
- Lavare palloni volumetrici, PBR, damigiane e contenitori, con acqua di rubinetto e sapone. Risciacquare con acqua deionizzata (DW).
- Acid sciacquare la ware laboratorio per eliminare eventuali tracce di contaminanti inorganici. Questo può essere fatto da uno dei due modi:
- Mettere a bagno / N a 10% di acido nitrico grado metalli in tracce laboratorio ware O (ATTENZIONE: non respirare i fumi, acido nitrico concentrato in grado di produrre gravi ustioni e fumi tossici, il lavoro in una hoo fumid utilizzando guanti di nitrile, occhiali e camice da laboratorio).
- Mettere a bagno laboratorio ware per 15 minuti nel 50% dei metalli in tracce di acido nitrico grado.
- Sciacquare la merce laboratorio con DW accuratamente almeno 3 volte facendo attenzione tutto l'acido viene rimosso. E 'fondamentale che PBRs siano risciacquati a fondo, in particolare i tubi di campionamento e tubi capillari. In caso contrario questo produrrà acidificazione dell'inibizione media e possibile di crescita. Verificare il pH dell'acqua di risciacquo per verificare tutte acido è stato rimosso.
- Sterilizzare PBRs, contenitori e flaconi da loro autoclave a 120 ° C e pressione atmosferica standard per almeno 30 min.
3. N. salina Media Preparazione
- Preparazione della soluzione A: Riempire parzialmente un pallone tarato da 1 l con DW. Inserire una ancoretta magnetica e aggiungere i prodotti chimici riportati nella Tabella 1, uno dopo l'altro. Assicurarsi che ogni ingrediente dissolve prima dell'aggiunta del componente successivo. Rimuovere il magnete e riempire °e a segno volume di 1 l.
| Componente | Importo da aggiungere (g) | Concentrazione finale (g / L) |
| H 3 BO 3 | 0.900 | 0.900 |
| Na 2 MoO 4 · 2H 2 O | 0.012 | 0.012 |
| MnCl 2 · 4H 2 O | 0.300 | 0.300 |
| ZnSO4 · 7H 2 O | 0.060 | 0.060 |
| CuSO 4 · 5H 2 O | 0,020 | 0,020 |
Tabella 1:. Soluzione A ricetta quantità sono importi necessari per la preparazione di 1 L di soluzione concentrata.
- Preparazione della soluzione di vitamina: In tre vol separataboccette umetric aggiungono le vitamine come mostrato nella Tabella 2. Filtro ciascuna soluzione vitamina attraverso un filtro a siringa da 0,2 micron sterile in un contenitore sterile. Conserva vitamine a -4 ° C al buio.
| Vitamine | Importo (mg) | Volume finale (mL) | Concentrazione di vitamina finale (mg / L) |
| Biotina | 12.22 | 500 | 24.43 |
| La vitamina B12 | 13.50 | 100 | 135.00 |
| Cloridrato di tiamina | 977,63 | 500 | 1,955.27 |
Tabella 2:. Vitamina soluzione ricetta quantità sono importi necessari per la preparazione di solu concentratozione.
- Parzialmente riempire un contenitore autoclavabile 20 L con DW e inserire un bastoncino magnetico. Posizionare il contenitore sulla sommità di una piastra di agitatore magnetico e aggiungere sostanze chimiche mostrati nella Tabella 3 (ad eccezione delle vitamine), aggiungendo una dopo l'altra e dopo ogni dissolve completamente. Riempire il contenitore per raggiungere 20 L.
| Componente | Importo da aggiungere al mezzo | Unità |
| NaCl | 350.00 | g |
| CaCl 2 · 2H 2 O | 3.00 | g |
| KCl | 9.60 | g |
| Na 2 SiO 3 · 9H 2 O | 1.14 | g |
| MgSO4 · 7H 2 O | 29.60 | g |
| KNO 3 | 20.40 | g |
| KH 2 PO 4 | 1.36 | g |
| Ammonio citrato ferrico | 0.10 | g |
| Soluzione A | 20.00 | ml |
| Soluzione biotina * | 818.00 | pl |
| Soluzione di vitamina B12 * | 296,20 | pl |
| Soluzione di cloridrato di tiamina * | 521,60 | pl |
| * Aggiungere ai media autoclavato raffreddato |
Tabella 3: N. salina medio ricetta. Le quantità sono gli importi necessari per la preparazione di 20 L di media ricchi di nutrienti.
- Sterilizzare il mezzo in autoclave per 30 minuti a 120 ° C e pressione atmosferica. Lasciate che il mezzo di cool fino a RT.
- Posizionare il contenitore su una piastra agitatore magnetico. Aggiungere le vitamine previste al punto 3.2 e lasciare a fondo il medio impasto.
4. contaminanti inorganici magazzino di preparazione
- Riempire parzialmente le matracci indicati nella tabella 4 con DW e aggiungere il sale individuo elencato. Riempire con DW al volume finale richiesto e mescolare accuratamente. Non conservare queste popolazioni a partire alcuni elementi aderire a pallone pareti
ATTENZIONE: Molti contaminanti inorganici utilizzati nel presente protocollo sono cancerogeni, teratogeni e mutageni, indossare una maschera di protezione, guanti e camice da laboratorio quando si maneggiano i sali.
| Analita | Fonte Salt | Volume di azione per preparare (L) | Sale da aggiungere al pallone60; (Sale mg) | Concentrazione dell'analita aggiunto alla coltura (analita mg / L) |
| Come | NAASO 2 | 0.1 | 14.8 | 7.74E-02 |
| CD | CdCl 2 | 0.5 | 13.5 | 1.50E-02 |
| Co | CoCl 2 .6H 2 O | 0.5 | 34.7 | 1.56E-02 |
| Cr | Na 2 Cr 2 O 7 · 2H 2 O | 0.1 | 40.6 | 1.29E-01 |
| Cu | CuCl 2 .2H 2 O | 0.1 | 38.3 | 1.30E-01 |
| Hg | HgCl2 | 1.0 | 14.6 | 9.80E-03 |
| Mn | MnCl 2 .4H 2 O | 0.1 | 58,8 | 1.49E-01 |
| Ni | NiCl 2 .6H 2 O | 0.1 | 112.0 | 2.51E-01 |
| Pb | PbCl 2 | 0.5 | 39.9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| Se | Na 2 SEO 3 | 0.5 | 11.8 | 9.80E-03 |
| Sn | SnCl 2 .2H 2 O | 0.5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| Zn | ZnCl 2 | 0.1 | 99,9 | 4.36E-01 |
Tabella 4:. Concentrato inorganico contaminanti preparazione dell'impasto L'aggiunta di 1 ml di questo stock concentrazione al mezzo PBR 1.1 L produce la concentrazione finale indicato nell'ultima colonna.
- Sterilizzare le scorte di contaminanti inorganici facendo passare la soluzione attraverso un filtro a siringa da 0,2 micron sterile e raccogliere il filtrato in una provetta sterile.
5. N. salina Inoculum Produzione
- In una beuta da 500 ml aggiungere 200 ml di terreno previste al punto 3 e quindi aggiungere 3 g di agar. Coprire il pallone in foglio di alluminio e in autoclave per 20 minuti a 120 ° C. Versare la soluzione in sterili-piatti e lasciate raffreddare fino a quando si solidifica. Questo dovrebbe essere completata be una cappa sterile o comunque in prossimità di una fiamma in un ambiente pulito per ridurre il rischio di contaminazione.
- Streak N. cellule Salina sterili-dishes preparato in fase 5.1 utilizzando un ciclo semina sterile. Posizionare le culture petri-piatto su un tavolo illuminato con luci T12 mantenuti a temperatura ambiente. Lasciate microalghe crescono fino colonie sono visibili.
- Colonie di trasferimento di sterile sconcertati beute contenenti 200 ml di terreno ricco di sostanze nutritive previste al punto 3 e tenerli su un tavolo shaker illuminata (1000 RPM). Lasciate che la cultura cresca fino a mezzo diventa verde.
- Trasferire il microalghe ad un 1.1 L PBR sterile. Posizionare il PBR in un bagno d'acqua inoculo illuminato di 200 mmol m -2 s -1 con luci fluorescenti T8 e mantenuta a 23 ° C da un refrigeratore di ricircolo e di un riscaldamento ricircolo controllo automatizzato bagnomaria. Regolare l'aria e CO 2 rotometers a 2.5 L min -1 e 25 cc min -1, rispettivamente.
- Dopo una settimana di crescita diviso biomassa in nuovi 1 .1 L PBRs contenenti nuovo mezzo e lasciarlo crescere fino a un totale di almeno 28 g di secco biomassa peso sonoottenuto tra i due reattori che possono essere determinate con densità ottica.
- Raccogliere la biomassa inoculo per centrifugazione a 2.054 xg per 15 min a 10 ° C utilizzando bottiglie da centrifuga sterili e tecniche sterili per evitare la contaminazione. Smaltire il surnatante e continua concentrazione cellulare, se necessario.
- Una volta che tutti biomassa viene centrifugata, risospendere le cellule in 300 ml di mezzo fresco sterile.
- Diluire 0,1 ml di coltura delle microalghe in 3 ml di DW e diluire 0,1 ml di questa nuova soluzione in 3 ml di DW. Assicurarsi che il campione è accuratamente miscelati. Misurare la densità ottica (OD) del concentrato microalghe a 750 nm () immediatamente utilizzando uno spettrofotometro.
- Utilizzare l'equazione (1) per determinare la quantità di biomassa nel concentrato.
Nota: L'equazione (1) è stato ottenuto dalla regressione lineare tra rispetto totale dei solidi sospesi (in g / L -1) per N. Salina (R 2 = 0.9995). Equazione 1 è stato sviluppato per la spectrophotometer modello nella tabella dei materiali, generare una nuova calibrazione se si utilizza un altro modello spettrofotometro.- Usando l'equazione (2) calcolare il volume di microalghe concentrato (in L) necessaria per ottenere una densità di 4 g / L -1 cultura in un PBR di 1,1 L di volume (a L).
- Usando tecniche sterili, aggiungere il volume di microalghe concentrato trovato nel passo 5.9 a un PBR autoclavato per raggiungere una densità coltura iniziale di 4 g / L -1. Riempire PBR con medio 1.1 L. Ripetere questa operazione fino a 6 PBRs vengono inoculate. Posizionare le PBRs nel bagnomaria inoculo.
- Lasciate che il microalghe nelle PBRs crescere per 8 giorni e poi raccogliere la biomassa (da ripetere le fasi 5,6-5,7). Ripetere il punto 5.8 per il calcolo inizialevolume di inoculo per una densità coltura iniziale di 1 g / L -1.
6. Reattori sperimentali
- Utilizzando tecniche sterili aggiungere circa 1 L di terreno preparato nel passaggio 3 per ciascuna delle 12 PBR sterili acido-risciacquato. Posizionare le PBRs nel bagnomaria del sistema di crescita sperimentale. Accendere l'aria sparge su a 1.5 L min -1.
- Sterilizzare un pH metro calibrato pulendo con etanolo al 70%. Misurare il pH del mezzo in PBR e garantire pH è circa 7,0; in caso contrario, ripetere il punto 2 per rimuovere l'acido lisciviati dalla fase di risciacquo acido.
- Calibrare ogni controller pH con tampone pH 7, disinfettare le sonde utilizzando etanolo (70%) e poi inserirli nei coperchi PBR.
- Per ogni PBR (tranne i PBRs controllo) aggiungere 1 ml di ciascuna delle sterili contaminanti inorganici scorte preparate al punto 4. Lasciate che i contaminanti mescolare accuratamente nel PBR. La concentrazione finale dei contaminanti inorganici nei PBR sono spettacolon nell'ultima colonna della tabella 4, e sono le concentrazioni massime stimate ci si aspetta da una integrazione centrale elettrica a carbone.
- Aggiungere 14 ml di DW sterile per i PBRs controllo.
- Aggiungere l'inoculo microalghe concentrato ottenuto nel passaggio 5.11 alle PBRs sperimentali, per ottenere una densità di coltura iniziale di 1 g / L -1. Lasciate accuratamente mix di biomassa.
- Girare alte luci di intensità della luce (di 984 mmol m -2 s -1) e controllori di pH e regolare di CO 2 a 30 cc min 1. Aumentare il flusso di CO 2 a 50 cc min -1 dal giorno 3 dopo. Tasso iniziale basso flusso di CO 2 è fondamentale al fine di evitare grandi variazioni di pH a causa di ritardi nel gas / trasferimento di liquidi e la misurazione del pH.
- Misurare e prendere campioni, se necessario. Assicurati di segnare il livello dell'acqua dopo il campionamento. (ATTENZIONE: alcuni contaminanti inorganici del PBR sono cancerogene, teratogene e mutagene, utilizzare guanti e cappcontenitori ndr durante la manipolazione dei campioni).
- Aggiungere sterile DW giornaliera alle PBRs per compensare le perdite per evaporazione.
- Dopo 7 giorni di crescita, raccogliere la biomassa mediante centrifugazione a 9.936 xg e preservare sia, biomassa e supernatante media, a -80 ° C.
- Congelare asciugare la biomassa al 0,1 mbar e -50 ° CO / N. Powder la biomassa (utilizzare una spatola di biomassa polvere all'interno del tubo da centrifuga). Preservare congelare biomassa secca a -80 ° C.
7. Microwave Assisted digestione dei campioni
La digestione dei campioni di biomassa è richiesto come una fase di pre-elaborazione per analisi ICP-MS.
Nota: Queste procedure utilizzano un sistema chiuso di digestione nave microonde con sollievo pressione controllata. (ATTENZIONE: Alte pressioni si sviluppano durante la digestione l'acido, controllare l'integrità fisica dei vasi di digestione e scudi, e rimodellare i coperchi dei vasi digestione a microonde prima di ogni utilizzo).
- Lavare Teflon vasi microonde digestione con acqua e sapone, risciacquare con DW e lasciare i vasi aria secca. Per rimuovere la contaminazione da metalli traccia nei vasi digerire acido come descritto nella procedura seguente.
- Rimodellare i coperchi dei vasi microonde digestione e chiudere i flaconi ben.
- Aggiungere 10 ml di acido nitrico per ciascuno.
- Introdurre la nave nello scudo di sicurezza. Evitare la biomassa, acqua o reagenti vengono lasciati sulle pareti dello scudo sicurezza o nelle pareti esterne dei vasi di digestione per evitare di danneggiare il schermo di sicurezza. Tappare la schermo di protezione con la valvola di sicurezza accertandosi che la primavera nel flacone è a filo. Trova lo scudo sul rotore con le prese d'aria della protezione punta verso l'esterno nel lato esterno e verso l'interno nella fila interna.
- Sul bordo di un numero, inserire il pozzetto ceramica e il sensore di temperatura. Questo termometro controlla la temperatura interna effettiva nel flaconcino e serve come parametro di controllo per eseguire il progr digestioneam. Assicurarsi che il numero uno fiala contiene le stesse campione e di reattivo importi degli altri flaconi.
- Ingresso i parametri digestione mostrati in Tabella 5 e iniziare la digestione. Quando il programma è terminato, l'aria fresca le fiale fino a raggiungere RT.
| Passo | Fiale di risciacquo | Digestione del campione | ||||
| Temperatura (° C) | Tempo (min) | Max. Potenza (W) | Temperatura (° C) | Tempo (min) | Max. Potenza (W) | |
| 1 | RT a 190 | 25 | 1.000 | RT a 180 | 15 | 1.000 |
| 2 | 190 | 10 | 1.000 | 180 | 15 | 1.000 |
| Scarico | - | 20 | - | - | 20 | - |
Tabella 5: Parametri utilizzati nel programma di digestione a microonde.
- All'interno di una cappa aspirante, inserire lo strumento di massima pressione sul tappo scudo con le prese d'aria della protezione punto lontano da voi. Una volta che la pressione viene rilasciata aperto il tappo (ATTENZIONE: Sempre aperto fiale digerito all'interno cappa da biomassa digestione con acido produce fumi tossici).
- Smaltire l'acido. Sciacquare i contenitori in Teflon con DW 3 volte. Lasciare fiale aria secca.
- Per digerire biomasse, aggiungere 50 mg di liofilizzato biomassa alle navi di digestione a microonde. Per il controllo di qualità (QC) preparare le seguenti flaconcini: in due fiale diverse aggiungere o 5 ml di Livello 7 ICPMS o 5 ml di livello standard di 7 Hg CVAAS preparato in passi 9.1 e 10.1 (la soluzione digerita da questa fiala è chiamato il laboratorio fortificato vuoto (LFB)), lascia un altro (la soluzione fiala vuota digeritada questa fiala è chiamato il reagente di laboratorio vuoto (LRB)).
- Per digerire media, aggiungere 10 ml di mezzo surnatante asciugare acido sciacquati vasi microonde digestione. Per il controllo di qualità (QC) preparare le seguenti flaconcini: In due fiale diverse aggiungere 5 ml di Livello 7 ICPMS o standard di metallo CVAAS previste al punto 9.1 e 10.1 (la soluzione digerita da questa fiala si chiama LFB), in un altro flacone aggiungere 10 ml di DW (la soluzione digerita da questa fiala è chiamato il LRB).
- Rimodellare i coperchi dei vasi microonde digestione e chiudere i flaconi ben.
- Aggiungere 7 ml di acido nitrico concentrato traccia grado di metallo e 3 ml di perossido di idrogeno per ogni flacone. Omogeneizzare il contenuto agitando delicatamente la soluzione. Digerire il contenuto dei flaconi ripetendo i passaggi 7,4-7,7 (utilizzare i parametri microonde digestione per il campione digestione nella Tabella 5).
- Aggiungi campione digerito in un pallone tarato da 25 ml, risciacquando i vasi con DW per aumentare il recupero. Riempire il matraccio con DWal marchio.
- Trasferimento digerito campioni ad un contenitore dotato di tappo. Conserva campioni a 4 ° C fino al momento dell'analisi può essere completata. Per questa analisi studio è fatto lo stesso giorno per Hg ed entro tre giorni per gli altri elementi.
8. Controllo qualità (QC) Campioni
Nota: Analizzare campioni QC per garantire affidabilità dei risultati dei campioni sperimentali.
- Riempire parzialmente un acido sciacquati 1 L matraccio con DW. Aggiungere 280 ml di tracce di acido nitrico grado metallo concentrato e mescolare bene (questa soluzione si chiama anche la soluzione del bianco) (ATTENZIONE: aggiungere sempre l'acido all'acqua, mai aggiungere acqua all'acido come la reazione esotermica può essere violenta). Lasciate soluzione raffreddare a temperatura ambiente.
- Oltre ai campioni QC preparati in passi 7.9 e 7.10, preparare i seguenti campioni QC.
- Per la verifica della calibrazione continua (CCV): Riempite un tubo di polistirene con standard di calibrazione (per la preparazione cfrpasso 9.2 e 10.1). Mettere la soluzione standard Hg sulla cremagliera CVAAS ei ICPMS soluzione standard nel ICPMS campionatore automatico.
- Per la taratura continua vuoto (CCB): Riempire due tubi di polistirolo (16 ml) con il vuoto (soluzione preparata al punto 8.1). Mettere un campione nel rack CVAAS e l'altro campione nella ICPMS campionatore automatico.
- Per la matrice di laboratorio fortificato (LFM): Casualmente scegliere 1 campione di ogni 12 campioni per ogni tipo di campione (ad esempio, la biomassa o medio) e usarlo per preparare un LFM. Per ICPMS, aggiungere 0,5 ml di ICPMS livello standard 7 e 3 ml di campione sperimentale digerito (sia da biomasse o medio) di un tubo di polistirene.
- Mescolare contenuti e posizionare le fiale sull'autocampionatore ICPMS. Per CVAAS, aggiungere 2 mL Hg Level 7 e 6 ml di campione sperimentale digerito (da biomassa o media) in una provetta di polistirene. Mescolare contenuti e posto fiale sul rack CVAAS.
- Per i campioni in doppio: Casualmente scegliere 1 campione di semprey 12 campioni per ciascun tipo di matrice (ad esempio, biomasse, media, LFM o qualsiasi matrice diluita) e duplicare la fiala. Posizionare le fiale ripetuti nel campionatore automatico ICPMS o il rack CVAAS.
- Per i campioni in doppio: Casualmente scegliere 1 campione di ogni 12 campioni per ogni tipo di matrice (ad esempio, la biomassa, medio, LFM o qualsiasi matrice diluita) e duplicare la fiala. Posizionare le fiale ripetuti nel campionatore automatico ICPMS o il rack CVAAS.
- Definire i criteri di qualità dei dati per lo studio. Per il presente studio duplicare i criteri di qualità stabiliti da Eaton, Clesceri, Riso e Greenberg 25. I parametri stabiliti per il controllo di qualità sono: differenza percentuale (% D) per CCV entro ± 10% 25 (con l'eccezione di Pb e Sb, vedi la discussione), percentuale di recupero LFB (% R) entro ± 70-130% 25, LFM per cento recupero (% R) entro 75-125% 25, e la differenza relativa per cento (RPD) ± 20% 25, e un ca continualibrazione vuoto (CCB) sotto il limite metodo di rendiconto (LMR) 25. Vedere equazioni di calcolo in fase 9.7.
9. Quantificazione da plasma accoppiato induttivamente spettrometria di massa (ICPMS)
- Il giorno di analisi, trasferire circa 5 ml di campione digerito per provette di polistirene e metterli nella ICPMS autocampionatore. Aggiungere circa 15 ml di campioni digeriti per tubi in polistirolo e metterli nel rack CVAAS.
- Lo stesso giorno dell'analisi preparare gli standard di calibrazione. Aggiungere ICPMS acquistati soluzione standard e riempire con vuoto (soluzione preparata al punto 8.1), come descritto nella tabella 6 (vedi descrizione soluzione standard in Materiale tabella) per palloni tarati acido-risciacquato.
| Parametro | Livello 1 | Livello 2 | Livello 3 | Livello 4 | Livello 5 | Livello 6 | Livello 7 |
| Norma Acquistato da aggiungere (ml) | - | - | - | - | - | - | 10.0 |
| Livello 7 da aggiungere (ml) | 0.0 | 1.0 | 2.5 | 5.0 | 20.0 | 25,0 | - |
| Volume * finale (ml) | - | 50.0 | 50.0 | 50.0 | 100.0 | 50.0 | 100.0 |
| Concentrazione finale (mg / L) | |||||||
| 75 Come | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 111 Cd | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25,0 | 50.0 |
| 59 Co | 0.0 | 10.0 | 25,0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 52 Cr | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 63 Cu | 0.0 | 5.0 | 12.5 | 25,0 | 50.0 | 125.0 | 250.0 |
| 55 Mn | 0.0 | 3.0 | 7.5 | 15.0 | 30.0 | 75.0 | 150.0 |
| 60 Ni | 0.0 | 8.0 | 20.0 | 40.0 | 80.0 | 200.0 | 400.0 |
| 208 Pb | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25,0 | 50.0 |
| 121 Sb | 0.0 | 12.0 | 30.0 | 60.0 | 120.0 | 300.0 | 600.0 |
| 51 V | 0.0 | 10.0 | 25,0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 66 Zn | 0,0 | 4.0 | 10.0 | 20.0 | 40.0 | 100.0 | 200.0 |
| * Raggiungere questo volume aggiungendo la soluzione preparata al punto 8.1 | |||||||
Tabella 6: Concentrazione di standard di calibrazione Livelli 1-7..
- Rimuovere i coni dalle ICPMS e sonicare per 1 min a DW. Asciugare i coni e rimetterli nello strumento.
- Accendere il refrigeratore d'acqua, gas (Ar, H 2, He), il ICPMS, linee spina a standard interno, e il riempimento di contenitori auto-campionatore risciacquo (DW, il 10% di acido nitrico, 1% di acido nitrico + acido cloridrico al 0,5%) .
- Aprire il software Workstation MassHunter e accendere il plasma, sintonizzare la ICPMS e caricare il metodo impostato su parametri nella tabella 7.
| Parametri | Valori |
| Norme interne | 72 Ge, 115 |
| Potenza Rf | 1.500 W |
| Portata del gas plasma | 14.98 |
| Portata del gas nebulizzatore | 1.1 L / min (carrier e la diluizione dei gas combinato - 0,6 + 0,5 l / min) |
| Cono di campionamento | Nickel per x lente |
| Cono Skimmer | Nichel |
| Velocità di assorbimento del campione | 0,3 rps |
| Pompa nebulizzatore | 0,1 rps |
| S / C di temperatura | 2 ° C |
| Condizioni di scansione | Tempo di sosta 1 sec, il numero di replicare 3 |
| H flusso di 2 gas | N / A |
| Egli flusso di gas | 4,3 ml / min |
Tabella 7: condizioni di funzionamento ICPMS.
- Mettere standard di calibrazione, campioni QC e campioni sperimentali nel campionatore automatico. Nel software ICPMS aggiungere la sequenza di analisi e analizzare campioni. Aspirare il campione all'interno dello strumento al plasma dove vengono ionizzati elementi. Poi un vuoto ritira gli ioni di un contatore. Gli ioni si separano a seconda del loro peso atomico dai più leggeri ai più pesanti.
ATTENZIONE: Raccogliere i rifiuti in ICPMS contenimento pericolosi e gestire in modo appropriato per lo smaltimento. - Assicurarsi che il valore del coefficiente di correlazione (R) per la curva di calibrazione per ogni metallo o metalloide è superiore a 0.995 24.
- Durante l'analisi del campione, calcolare% R,% D e RPD come descritto nelle equazioni 3-6 26 e confrontare i risultati con i criteri di qualità dei dati di progetto in 8.3.
- Calcola recupero percentuale (% R) per determinare le perdite / guadagnando dal laboratorio fortificata blank (LFB) e la matrice interferenze da matrice laboratorio fortificato (LFM).
- Calcola differenza percentuale (% D) per determinare le variazioni delle prestazioni dello strumento con il tempo durante l'esecuzione dei campioni CCV.
- Calcolare la differenza percentuale relativa (RPD) per determinare le variazioni di metodo di precisione con il tempo durante l'esecuzione di campioni sperimentali.
- Per ridurre l'interferenza di matrice (% R fuori l'intervallo accettabile), diluire i campioni per poveri% R a un rapporto di 1: 3 (campione: DW).
- Preparare gli standard di calibrazione lo stesso giorno di analisi. Diluire norma Hg acquistati con l'aggiunta di 1 ml di soluzione standard acquistati Hg per un matraccio da 100 ml e riempire con la soluzione preparata al punto 8.1.
- Aggiungere 2,5 ml di questa soluzione in un pallone tarato da 100 ml e riempire con la soluzione preparata al punto 8.1 (questa nuova soluzione è il Livello 7 Standard Hg). Aggiungere diluito Livello 7 Standard Hg di palloni tarati e riempire con vuoto (soluzione preparata al punto 8.1.), Come descritto nella Tabella 8 (vedi acquistato descrizione soluzione standard Hg in Materiale tabella).
| Parametro | Livello 1 | Livello 2 | Livello 3 | Livello 4 | Livello 5 | Livello 6 |
| Serie L7 Hg da aggiungere (ml) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| Volume * finale (ml) | - | 50 | 50 | 50 | 100 | 50 |
| Concentrazione finale (mg / L) | 0 | 0.5 | 1.25 | 2.5 | 5 | 12.5 |
| * Raggiungere questo volume aggiungendo la soluzione preparata al punto 8.1 | ||||||
Tabella 8: Concentrazione di standard di calibrazione Hg Livelli 1-6..
- Aprire il gas Ar e valvola di sfiato, accendere il 'assorbimento atomicozione spettrofotometro e il Flow Injection Spettroscopia atomica (FIAS). Aprire il software CVAAS WINLAB, accendere la lampada Hg e lasciarlo scaldare fino a quando il parametro di energia del software raggiunge 79. Caricare il programma per l'analisi Hg con i parametri nella tabella 9. Regolare il percorso della luce nello strumento per dare il massimo di trasmittanza.
| Parametri | Valori |
| Gas di trasporto | Argon, 100 ml / min |
| Lampada | Hg lampada a scarica senza elettrodi, la configurazione a 185 mA |
| Lunghezza d'onda | 253,7 nm |
| Fessura | 0,7 nm |
| Temperatura della cella | 100 ° C |
| Volume del campione | 500 microlitri |
| Vettore | 3% HCl, 9.23 ml / min |
| Riducente | 10% SnCl 2, 5.31 ml / min |
| Misurazione | Altezza Peak |
| Leggi repliche | 3 |
Tabella 9: condizioni operative CVAAS.
- Inserire la linea per la soluzione carrier fatta di acido cloridrico grado metalli in tracce 3%.
- Inserire la linea alla soluzione riducente costituito da 10% di cloruro stannoso (adatto per l'analisi Hg) in acido cloridrico al 3% di grado metalli in tracce. Preparare questa soluzione lo stesso giorno di analisi in quanto è soggetto all'ossidazione atmosferica (ATTENZIONE: il cloruro stannoso è molto pericolosa, utilizzare abbigliamento protettivo quando si lavora con esso Raccogliere i rifiuti in CVAAS contenimento pericolosi e smaltire correttamente.).
- Posizionare le norme Hg, campioni QC e campioni sperimentali nel rack CVAAS e inserire la sequenza nel software CVAAS WINLAB. Eseguire gli standard e generare l'equazione di taratura.
- Run QC samples e campioni sperimentali. Il CVAAS trae circa 5 ml di campione nello strumento, riduce la presente Hg nel campione per elementale Hg (Hg 0) gas e ripulisce il gas dalla soluzione con un gas carrier (Ar) in un sistema chiuso. Il vapore Hg passa attraverso una cella nel percorso ottico della lampada Hg. Un rilevatore determina la luce assorbita a 253,7 nm e correla alla concentrazione. (ATTENZIONE: il vapore di mercurio è tossico, garantire cappa aspirante strumento è a posto).
- Calcola% R,% D e RPD nella fase 9.7 durante l'analisi e confrontare i risultati con i criteri di qualità dei dati di progetto.
Risultati
I rendimenti biomassa
Produzione di N. salina nel sistema PBR usato in questo studio è passato da 1 g / L -1 a 8,5 ± 0,19 g / L -1 (N = 12) per i reattori di controllo e 4,0 ± 0,3 g / L -1 (N = 12) per la multi-metal contaminato in 7 giorni. Gli esperimenti hanno prodotto dati ripetibili attraverso reattori in triplo e più batch. Figura 2A mostra la densità media cultura con molto piccolo errore standard sulla base di campionamento da tre PBRs indipendenti. Per conseguire questo risultato non era un risultato isolato, altri tre lotti sono state coltivate con risultati simili. I risultati combinati per tutti i quattro lotti sono mostrati nella Figura 2B. Nonostante la variabilità biologica esiste, questo studio dimostra che vi è un impatto negativo coerente dei contaminanti inorganici a N. produzione salina. Le rese di biomassa dei contaminanti esposti PBRs erano statisticamente differenti alle PBRs controllo dagiorno 2 in avanti (ANOVA, p <0,05).
Valutazione qualitativa di inorganico quantificazione contaminante
Dodici dei quattordici elementi analizzati sono stati interamente recuperabile dopo la digestione, come dimostra la LFB% R con% R vicino al 100%, che indica nessuna perdita, nessun guadagni e nessuna contaminazione incrociata di analiti durante la digestione (Tabella 10). Durante l'analisi quantitativa dei campioni% D e RPD sono state monitorate attraverso tutte le analisi e la media dei risultati sono riportati in Tabella 10. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V e Zn passati la% D e RPD, comunque% D per Pb e Sb gradualmente sceso durante l'analisi. La% D per questi elementi sono migliorate dopo la pulizia del cono, tuttavia, la pulizia cono costante è impraticabile, e di conseguenza gli obiettivi di qualità dei dati per Pb e Sb sono stati ridotti. CCB per tutti gli analiti sono stati anche sotto il LMR. Gli effetti di matrice sono stati valutati analizzando campioni LFM e ottenere il% R. While Co, Hg, V e Sb superato i criteri dati QC, non è stato superato da As, Cd, Cr, Cu, Mn, Ni, Pb e Zn quando sono stati analizzati campioni di biomassa digeriti, con conseguente% R sotto degli obiettivi QC. Diluizione Matrix DW in un rapporto di 1: 3 (soluto: solvente) provocato% R che passava criteri di qualità dei dati. Gli effetti di matrice sono stati osservati anche durante l'analisi del surnatante digerito e sono state affrontate con lo stesso rapporto di diluizione (Tabella 10) facendo attenzione che la diluizione non ha compromesso il limite di rilevabilità dello strumento. Problemi con il rilevamento di Se e Sn sono stati osservati basate sulle letture instabili e un problema di contaminazione, rispettivamente. Le letture instabili per Se sono attribuiti ai sali nella matrice 27. La contaminazione Sn è stato ricondotto a un acido utilizzato nella fase di digestione.
| Analita | R | CCV | LFB | LFM per i campioni di biomassa | LFM per i campioni supernatante | ||||
| % D | % R | Rapporto di diluizione | % R | RPD | Rapporto di diluizione | % R | RPD | ||
| QC limita 25 | 0,9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| Come | 0,9998 | 1.8 | 101.0 | 1: 3 | 100.4 | 5.2 | 1: 3 | 92.5 | -0.5 |
| CD | 1.0000 | 1.4 | 102.6 | 1: 3 | 103.5 | 4.6 | Nessuno | 92,3 | 0.6 |
| Co | 0,9997 | 1.7 | 98,8 | Nessuno | 95.2 | -1.4 | Nessuno | 96,5 | -1.5 |
| Cr | 0,9999 | 1.5 | 99,8 | 1: 3 | 96,5 | 1.8 | 1: 3 | 90.1 | -0.8 |
| Cu | 0,9999 | 2.9 | 98,2 | 1: 3 | 101.4 | 4.8 | 1: 3 | 94,4 | -0.5 |
| Hg | 0,9983 | -1.7 | 103.0 | Nessuno | 98,7 | 1.5 | Nessuno | 98.0 | 0.3 |
| Mn | 0,9998 | 2.9 | 97.6 | 1: 3 | 83.2 | 1.8 | 1: 3 | 95.4 | -1.7 |
| Ni | 0,9999 | 0,5 | 103.5 | 1: 3 | 98,5 | 2.1 | Nessuno | 93.3 | -0.9 |
| V | 0,9998 | 2.5 | 97,2 | Nessuno | 95.5 | -1.5 | Nessuno | 101.2 | -1.9 |
| Pb | 0,9998 | 12.6 | 105.2 | 1: 3 | 88.9 | 0.0 | Nessuno | 93.5 | -0.5 |
| Sb | 0,9998 | 1.1 | 105,7 | Nessuno | 101.8 | -9.6 | Nessuno | 90.8 | -1.2 |
| Zn | 0,9997 | 5.2 | 120,8 | 1: 3 | 90.7 | 1.4 | Nessuno | 89.2 | -1.9 |
Tabella 10: Sintesi dei risultati di campioni di controllo di qualità. R = coCoefficiente rrelation,% D: differenza percentuale,% R: la percentuale di recupero, RPD = differenza relativa per cento, rapporto di diluizione si riferisce a soluto: il rapporto solvente.
Concentrazioni di agenti contaminanti inorganici
Heavy metal e contaminanti inorganici sono stati trovati in entrambi medio biomassa e surnatante. Le concentrazioni riscontrate nella biomassa per i 12 elementi analizzati sono mostrati in Figura 3. Concentrazioni nella biomassa raccolta da PBRs in triplicato (n = 3) in lotto # 1 mostra un piccolo errore standard (Figura 3A). Combinando i dati da PBRs triplicato da 4 lotti mostra costantemente che i contaminanti inorganici sono presenti nella biomassa (N = 12). Le concentrazioni riscontrate nel medio supernatante sono mostrati in Figura 4. I risultati mostrano PBRs in triplicato (n = 3) per il lotto # 1 hanno anche piccolo errore standard (Figura 4A) e mostrano che la maggior parte dei contaminanti preferenzialmente si trovavano nella biomassa leading a concentrazioni molto basse nel surnatante con diverse concentrazioni del campione vicino alla MRL dello strumento. I risultati di tutti e quattro i lotti sono presentati nella Figura 4B.
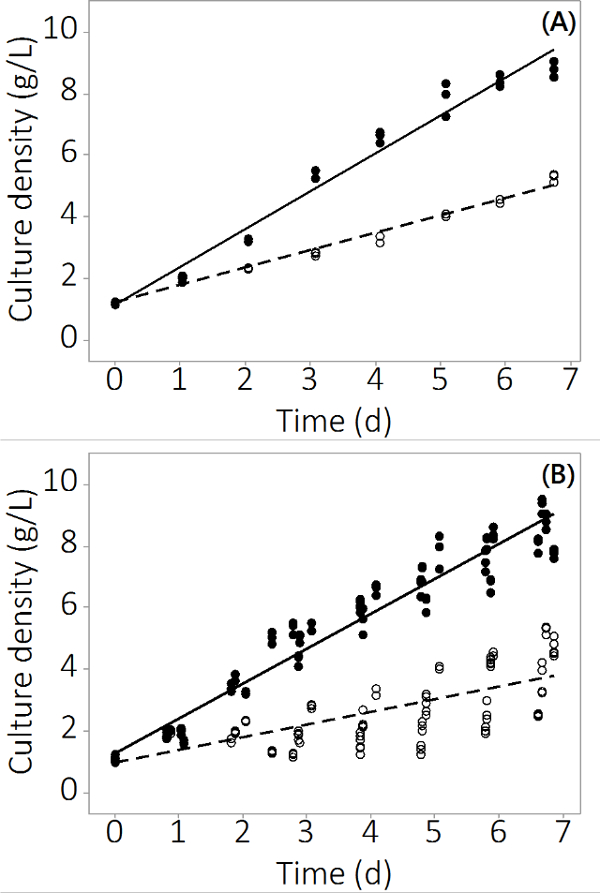
Figura 2. C ultura concentrazione nel periodo di coltivazione per PBRs contaminati e di controllo. (A) Densità cultura nel gruppo # 1, i risultati di N = 3 PBRs. (B) Densità Cultura in 4 lotti, i risultati di N = 12 PBRs. Cerchi vuoti rappresentano contaminati biomassa, cerchi pieni rappresentano il controllo.

Figura 3. La concentrazione di contaminanti inorganici a biomassa. (A) Concentrazione nel lotto #1, i risultati da N = 1 PBR per Zn e N = 3 PBRs per tutti gli altri analiti, (B) Concentrazione da 4 lotti, i risultati di N = 4 PBRs per Zn e N = 12 PBRs per tutti gli altri analiti. Le concentrazioni medie sono rappresentati da neri pieni circoli, i singoli punti dati sono rappresentati da cerchi pieni grigi. Barre di errore rappresentano ± un errore standard dalla media.
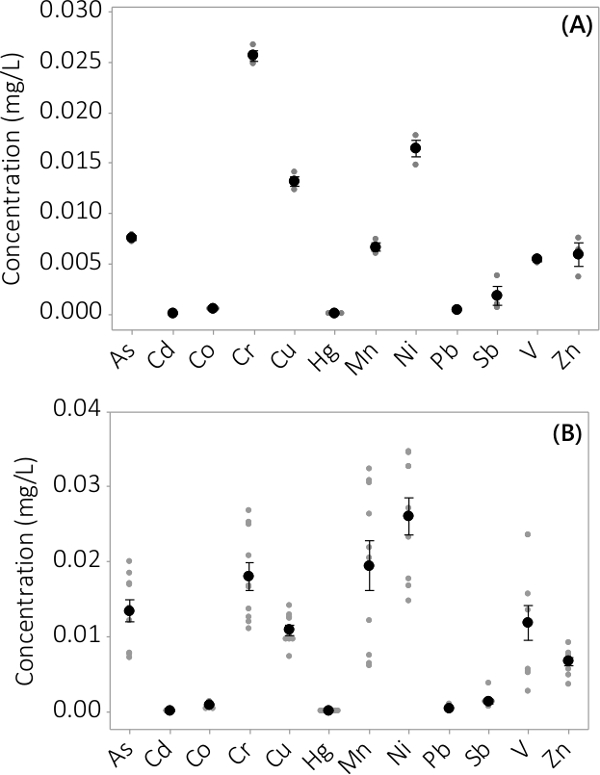
Figura 4. Concentrazione di contaminanti inorganici in supernatante. (A) Concentrazione nel lotto # 1, i risultati di N = 3 PBRs, (B) Concentrazione da 4 lotti, i risultati di N = 12 PBRs. Le concentrazioni medie sono rappresentati da neri pieni circoli, i singoli punti dati sono rappresentati da cerchi pieni grigi. Barre di errore rappresentano ± un errore standard dalla media.
Discussione
Saline microalghe N. salina può essere coltivata con successo nel sistema di crescita progettato con risultati ripetibili e alti rendimenti biomassa. Airlift miscelazione permesso per una cultura sospesa ben miscelato con assestamento minimo o incrostazioni nei periodi di crescita di 7 giorni. La variabilità minima luce attraverso la banca luce fluorescente è anche mostrato di non produrre differenze notevoli in termini di crescita.
Lo studio mostra metalli pesanti mezzi contaminata con concentrazioni rappresentante di integrazione con fumi di carbone negativamente l'impatto della crescita della biomassa. Ripetibilità nello studio evidenzia l'impatto che il sistema multi-metallo ha sulla produttività. Varie fasi del processo hanno il potenziale di influire negativamente sulla crescita e contaminare il sistema richiede una preparazione sperimentale diligente. Determinazione del pH del mezzo prima dell'inizio dell'esperimento è un passo QC che permette di verificare che il mezzo non viene acidificata (ad esempio, resulting da improprio PBR risciacquo dopo ammollo acida). Medio acidificato influenzerà la crescita delle alghe e modificare la biodisponibilità dei nutrienti (ad esempio, i cambiamenti nella inorganico speciazione carbonio e metalli speciazione) che incidono così le interazioni tra alghe vincolanti siti, nutrienti e metalli. La preparazione meticolosa delle attrezzature di laboratorio per questi studi era necessaria tale che un accurato bilancio di massa dei metalli immessi può essere eseguita. Altri passaggi del processo hanno il potenziale per introdurre dispersi metalli evidenziando la necessità per l'impiego di solventi e prodotti chimici di grado adeguate. QC corretta attraverso il processo può efficacemente identificare l'introduzione di contaminanti metallici pesanti.
I risultati mostrano contaminanti introdotti sono distribuiti tra la biomassa (Figura 3), media (Figura 4) e l'ambiente. Contaminanti inorganici presenti in N. raccolto salina suggerisce che questa microalga si incorporatevie molti dei contaminanti inorganici presenti nei fumi. Questa assimilazione può essere il risultato di adsorbimento su pareti cellulari causa siti carichi di legame, assorbimento all'interno della cellula dovuta all'attività metabolica e precipitazione dei complessi formati con elementi presenti nel mezzo 28. Visivamente i reattori con contaminanti inorganici, dopo un paio di giorni è apparso colore giallo rispetto al verde scuro dei reattori di controllo. Contaminati biomassa raccolta non era visivamente diverso da biomassa senza contaminanti dopo la formazione pallina dopo la raccolta mediante centrifugazione. La differenza di colore visiva prima del raccolto è attribuito ad una biomassa minore densità e sottolineato microalghe. Contaminanti non rimossi nella biomassa hanno il potenziale di accumulare nei media come illustrato nella figura 4. Accumulation nei media rappresenta un potenziale di limitare scala come riciclaggio media rappresentano una necessità per redditività. La limitazione sarebbe dettatadalla tolleranza ai contaminanti metalli pesanti che saranno specie-specifico. I risultati di questo studio evidenziano la necessità di comprendere meglio i potenziali impatti negativi sulla integrazione di sistemi di crescita di microalghe con fonti di carbonio dei rifiuti, in particolare dei gas di scarico a base di carbone. I risultati di questo studio evidenziano le necessità di comprendere le implicazioni di produttività di altri agenti inquinanti che dovrebbero essere presenti nel gas di scarico come gli ossidi di zolfo e di azoto, polveri sottili e contaminanti organici come le diossine dibenzo policlorurati e dibenzo furani. TEA e LCA precedenti valutazioni hanno assunto una perfetta integrazione senza considerare gli effetti di contaminanti, quali metalli pesanti e agenti inquinanti inorganici sulla produttività. In generale, i risultati di questo lavoro evidenziano l'impatto di un sistema multi-metallo sulla produttività e possono essere utilizzati per comprendere le potenzialità di microalghe ad bioremediate contaminanti.
La metodologia presentata consentito per the lo studio dei contaminanti inorganici con risultati ripetibili per microalghe. Alcuni contaminanti inorganici utilizzati in questo esperimento sono tradizionalmente presenti nei sistemi di crescita a basse concentrazioni, ma gli altri non hanno una funzione nota nella cella. Di conseguenza la miscela multi-elemento di As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V e Zn alla concentrazione indicata in Tabella 4 inibito la crescita. Quantificare la quantità di contaminanti nella biomassa può rivelarsi difficile in sistemi multi-metallo. Spesso, i campioni con elevato contenuto di sostanze organiche e sali possono produrre interferenze della matrice, interferenze poliatomiche, interferenze fisiche e sale accumularsi nei coni che alla fine porta a letture inaccurate e perdita di accuratezza analitica 29,30. Campioni di controllo di qualità corrono insieme con i campioni sperimentali contribuito a determinare l'accuratezza e la precisione delle letture. Misurazione degli analiti utilizzando i protocolli sviluppati per questo studio ha dimostrato di essere unccurate e preciso produrre recuperi accettabili che rientrano prestazioni accettabili per questo tipo di studio 25,29. Digestione dei campioni di forno a microonde è stato dimostrato di essere efficace per N. salina come campioni digeriti erano chiare, senza la presenza di detriti cellulari o parti immiscibili. La matrice utilizzata in questo esperimenti (alghe biomassa e acqua di mare artificiale) ha prodotto le interferenze della matrice che sono state superate mediante diluizione matrice. Tuttavia, le dimensioni del campione maggiore di biomassa rispetto a quelle utilizzate in questo esperimento potrebbe portare a interferenze della matrice, e quindi QC dovrebbero essere analizzati per ogni scenario specifico.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The authors would like to acknowledge funding from the National Science Foundation (award # 1335550), Utah Water Research Laboratory, Professor Joan McLean and Tessa Guy for their help during the metal/metalloids analysis. The authors also thank Laura Birkhold for her support with the data collection and Danna Olbright.
Materiali
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
Riferimenti
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. . Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3. 1. 2. 5. B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Smith, M., Compton, J. S. . Matrix effects in the ICP-MS analysis of selenium in saline water samples. , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3. 1. 2. 0. B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon