Method Article
In Vitro Ricostituzione di Complessi Light-raccolta di piante e alghe verdi
In questo articolo
Riepilogo
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
Abstract
Nelle piante e alghe verdi, la luce viene catturato dai complessi luce-raccolta (LHCs), una famiglia di proteine integrali di membrana che coordinano clorofille e carotenoidi. In vivo, queste proteine sono piegati con pigmenti per formare complessi che vengono inseriti nella membrana tilacoidale del cloroplasto. L'elevata somiglianza nelle proprietà chimiche e fisiche dei membri della famiglia, unitamente al fatto che essi possono facilmente perdere pigmenti durante l'isolamento, rende la loro purificazione in uno stato nativo impegnativo. Un approccio alternativo per ottenere preparazioni omogenee di LHCs è stato sviluppato da Plumley e Schmidt nel 1987 1, che ha mostrato che era possibile ricostituire questi complessi in vitro a partire da pigmenti purificati e apoproteine spiegate, con conseguente complessi con proprietà molto simili a quelle del nativo complessi. Questo apre la strada all'uso delle proteine ricombinanti espresse batteriche in vitro (ad esempio, siti di legame pigmento) o dominio proteine (ad esempio, l'interazione proteina-proteina, pieghevole). Questo metodo è stato ottimizzato in vari laboratori e applicato alla maggior parte dei complessi di luce raccolta. Il protocollo qui descritto in dettaglio il metodo di ricostituzione complessi luce-raccolta in vitro attualmente in uso nel nostro laboratorio, e sono forniti esempi che descrivono applicazioni del metodo.
Introduzione
L'apparato fotosintetico delle piante e alghe comprendono proteine integrali di membrana che legano clorofilla a (chl a), b (chl b) e carotenoidi (auto). Questi complessi pigmento-proteina sono attive in energia luminosa raccolta e il trasferimento di energia di eccitazione che ai centri di reazione, dove viene utilizzato per promuovere la separazione di carica 2. Essi sono anche coinvolti in meccanismi di feedback regolatori che proteggono l'apparato fotosintetico dai danni luce alta 3,4. I complessi di raccolta della luce (LHCs) sono costituiti da una grande famiglia di proteine correlate nelle piante e alghe 5.
La purificazione omogenea di ciascun membro della famiglia è stata complicata dalle proprietà chimiche e fisiche molto simili complessi. Inoltre, le procedure di purificazione causano spesso la perdita di pigmenti o altri potenziali cofattori, come i lipidi. In vitro rappre ricostituzionets un potente metodo per superare questi problemi. L'LHC associato Fotosistema II (LHC-II) è stato ricostituito in vitro da Plumley e Schmidt nel 1987 1. I ricercatori hanno estratto proteico delipidato e pigmenti separatamente dai cloroplasti vegetali, e poi combinati proteina calore denaturato con pigmenti in presenza di Litio Dodecyl Sulfate (LDS), seguito da tre cicli di congelamento e scongelamento 1. Essi hanno dimostrato che le proprietà spettrali dei complessi LHC ricostituiti erano molto simili a complessi purificati dalle piante. La facilità di ricostituire LHC complessi pigmento-proteina, probabilmente a causa di qualche funzione di auto-assemblaggio inerente, insieme con la difficoltà di isolare complessi purificati da organismi, ha portato alla rapida adozione del metodo da altri ricercatori. La ricostituzione delle proteine fotosintetiche sovraespresse in Escherichia coli (E. coli) è stato raggiunto da Paulsen e colleghi nel 1990 6. In E.coli, proteine di membrana sovraespresse sono in genere contenute in corpi di inclusione, che loro servizi di depurazione. Ricostituzione è ottenuta attraverso denaturazione termica dei corpi di inclusione contenenti la proteina ricombinante in presenza di LDS, seguita dall'aggiunta di pigmenti che avvia il ripiegamento delle proteine. Pieghevole del complesso LHCII è un processo in due fasi: in primo luogo, la clorofilla a è legato in meno di 1 minuto; secondo, clorofilla b è legato e stabilizzato nell'arco di diversi minuti 7.
Oltre a fornire comprensione delle dinamiche pieghevoli, in ricostituzione vitro in combinazione con mutagenesi sito-diretta ha permesso l'individuazione di specifici aminoacidi importanti per la stabilità (ad esempio, 8,9) o coordinamento pigmento (ad esempio, 10). Manipolazione delle condizioni regolando parametri quali la composizione del pigmento o detergenti ripiegamento hanno inoltre individuato elementi critical per la corretta piegatura, come l'obbligo di xantofille per il complesso LHCII (es, 1,11). Inoltre, studio delle proprietà dei singoli pigmenti legati ai complessi 'stato possibile utilizzando complessi ricostituiti in vivo (ad esempio, 10).
Il metodo qui descritto inizia con isolamento di pigmenti (clorofille e carotenoidi) dal spinaci e il verde alga Chlamydomonas reinhardtii. L'espressione e la purificazione di una proteina LHC da E. coli in forma di corpi di inclusione viene poi dettagliato, seguita dalla ricostituzione di LHC e successiva purificazione mediante colonna di affinità Ni. Nella fase finale, i complessi ricostituite sono ulteriormente purificati mediante centrifugazione su gradiente di saccarosio per rimuovere i pigmenti liberi e apoproteina spiegato. Questo protocollo rappresenta un procedimento ottimizzato incorpora varie modifiche che sono state introdotte da diversi laboratori oltretempo 1,6,10,12 -14.
Protocollo
1 Totale Pigmento Estrazione da foglie di spinaci
- Omogeneizzare una manciata di foglie di spinaci (~ 20 g) in 100 ml di freddo Grinding Buffer (vedi Tabella 1) con un frullatore per 20 sec.
- Filtrare la soluzione attraverso due strati di tessuto di nylon con un diametro dei pori di 20 micron e centrifugare il filtrato a 1.500 xg per 10 min a 4 ° C.
- Risospendere il pellet contenente i cloroplasti con un morbido artisti pennello di vernice in 1 ml di tampone di lavaggio a freddo (vedi Tabella 1). Una volta che il pellet viene risospeso, aggiungere 50 ml di tampone di lavaggio e centrifugare la soluzione a 10.000 xg per 10 min a 4 ° C.
- Rimuovere il surnatante e delicatamente risospendere il pellet (tilacoidi) in 50 ml di tampone di lavaggio (vedi Tabella 1).
- Centrifugare la soluzione a 10.000 xg per 10 min a 4 ° C e rimuovere completamente il surnatante. A questo punto, eseguire le seguenti operazioni al buio, per evitare l'ossidazione del pigmento.
- Aggiungi ~ 20 ml di acetone 80% tamponata con Na 2 CO 3 (vedi tabella 1) per estrarre i pigmenti. Lasciare la soluzione in ghiaccio per 10 minuti, vortex di tanto in tanto.
- Agglomerare le componenti cellulari mediante centrifugazione a 12.000 xg per 15 min a 4 ° C.
NOTA: Se i pigmenti non sono completamente estratti, il pellet avrà un colore verde e punto 1.6 deve essere ripetuto. - Raccogliere il supernatante in un imbuto separatore. Aggiungere 0,4 volumi di dietiletere, agitare vigorosamente e aprire la valvola di sfogo del gas.
- Aggiungere 0,8 volumi di 0,33 M NaCl e mescolare energicamente. Consenti ~ 10 min per separare gli strati. La fase eterea sopra contiene i pigmenti estratti. Rimuovere la fase inferiore chiara.
NOTA: Se la separazione non è chiara, congelare e scongelare la soluzione per migliorare la separazione di fase. - Rimuovere l'etere versandolo dall'alto della imbuto separatore in un contenitore di vetro adatto. Secco con l'aggiunta di un cucchiaio di granlare solfato di sodio anidro. Agitare la soluzione e lasciare ~ 5 min per l'essiccante per assorbire l'acqua dall'etere.
NOTA: Ripetere questo passaggio se il solfato di sodio appare completamente raggruppata insieme; ci dovrebbero essere alcuni cristalli liberi di fluttuare quando l'etere è sufficientemente asciugato. Se si forma un velo d'acqua, rimuovere questo con una pipetta Pasteur prima di aggiungere ulteriore solfato di sodio anidro. - Decantare l'etere di un nuovo contenitore di vetro, lasciando il solfato di sodio solido dietro.
- Si evapora l'etere in un speedvac rotativo o sotto flusso di N 2.
- Sciogliere i pigmenti completamente in 10 ml di acetone 100%.
- Diluire una piccola quantità (~ 3 ml) in 1 ml di 80% acetone e misurare gli spettri di assorbimento e determinare l'a / b rapporto Chl e la concentrazione di Chl con il metodo descritto da Porra et al. (1989) 15.
- Aliquota e asciugare i pigmenti in una speedvac rotativo o sotto N 2 fino a quando il flusso di acetone ècompletamente evaporato. Conservare i pigmenti secchi a -80 ° C.
2 Estrazione di carotenoidi da spinaci
- Seguire i passaggi da 1.1 a 1.5. A questo punto, eseguire le seguenti operazioni al buio, per evitare l'ossidazione del pigmento.
- Risospendere il pellet tilacoidi in ~ 50 ml di etanolo al 96% tamponata con Na 2 CO 3 (vedi Tabella 1) per estrarre i pigmenti. La soluzione viene lasciata in ghiaccio per 5 min.
- Agglomerare le componenti cellulari mediante centrifugazione a 12.000 xg per 15 min a 4 ° C.
NOTA: Se i pigmenti non sono completamente estratti, il pellet avrà un colore verde e punto 2.2 deve essere ripetuto. - Raccogliere il surnatante e aggiungere 0,1 volume del 80% KOH (w / v) per avviare saponificazione.
- Lasciare la soluzione a 4 ° CO / N, ben chiuso e al riparo dalla luce.
- Raccogliere la soluzione in un imbuto separatore. Aggiungere 1 volume di etere etilico e mescolare delicatamente.
- Aggiungere 0,8 volUmes di 0,33 M NaCl e mescolare delicatamente. Consenti ~ 10 min per separare gli strati. La fase eterea arancione sulla parte superiore contiene i carotenoidi saponificati. Rimuovere la fase inferiore verde drenando attraverso il rubinetto dell'imbuto.
- Aggiungere 3 volumi di acqua e mescolare delicatamente per rimuovere l'idrossido di potassio. Lasciare che gli strati si separino. NOTA: Se la fase superiore appare torbido, aggiungere una piccola quantità di NaCl (ad esempio, 3 g di NaCl in 200 ml di soluzione) e miscelare delicatamente per sciogliere.
- Rimuovere la fase inferiore di drenaggio attraverso il rubinetto dell'imbuto.
- Seguire i passaggi da 1,10-1,13.
- Diluire una piccola quantità (~ 3 ml) in 1 ml di 80% acetone e misurare gli spettri di assorbimento a 440 nm nel 80% acetone. Per determinare la concentrazione, utilizzare l'estinzione media coefficiente per i carotenoidi (ε 440 = 255) 16 nel seguente formula: Auto [mg / ml] = (Abs 440 nm / 225) x 11 (cammino ottico) = 1 cm.
- Aliquota e asciugare il carotenoids in un speedvac o sotto N 2 torrente fino a quando tutti etere etilico è stato evaporato. Conservare i pigmenti secchi a -80 ° C.
3 Totale pigmento e carotenoide Estrazione da Chlamydomonas reinhardtii
- Grow C. reinhardtii su terreno solido TAP 17 in una capsula di Petri diffondendo una piccola quantità di coltura liquido sulla superficie. Crescere sotto illuminazione flusso continuo di 20 micromol foto PSA m -2 s -1 fino a uno strato verde di cellule è visibile.
- Utilizzando un'ansa da inoculo sterile, raccogliere una piccola quantità di C. reinhardtii dal mezzo TAP solida e mettere le cellule in 500 ml di TAP media 17 in un pallone da 1 L. Far crescere la coltura a 25 ° C con 170 giri al minuto, agitando sotto un'illuminazione flusso continuo di 20 micromol foto PSA m -2 s -1.
- Dopo 5-6 giorni, la cultura dovrebbe raggiungere la fine della fase logaritmica (6 x 10 6 cellule / mlo 2-2,5 densità ottica a 750 nm). Centrifugare la cultura a 4.000 xg per 15 min a 4 ° C.
- Per l'estrazione totale del pigmento, seguire i passaggi 1,6-1,15.
- La resa di estratto totale pigmento a partire da 500 ml di coltura piena crescita di C. reinhardtii è di circa 5 ml di soluzione con una concentrazione di 0,5 mg Chl a + b / ml.
- Per l'estrazione carotenoidi, seguire i passaggi 2,2-2,12.
4 Purificazione di corpi di inclusione
- Clonare la sequenza codificante della proteina LHC di interesse in un vettore di espressione che si traduce in un C-terminale sua tag fuso utilizzando le procedure di biologia molecolare standard. Trasforma questo costrutto in E. ceppo ospite coli come BL21 (DE3).
- Preparare il tampone di lisi, tampone detergente, buffer di Triton, TE (Tabella 1), 1 M isopropilici β-D-1-thiogalactopyranoside (IPTG) e terreno LB 18 con gli antibiotici appropriati.
- Scegli una single E. coli colonia contenente il clone di espressione da un piatto appena striato in ~ 5 ml di terreno LB con gli antibiotici appropriati utilizzando le procedure standard 6. Crescere a 37 ° C con 220 rpm agitazione per almeno 16 ore.
- Aggiungere 2,5 ml di O / N cultura in un pallone da 1 L Erlenmeyer con 250 ml di LB integrate con l'antibiotico appropriato.
- Crescere le cellule per 2-3 ore (o fino a quando l'OD 600 è ~ 0.6) a 37 ° C a 220 giri al minuto.
- Aggiungi IPTG ad una concentrazione finale di 1 mM. Continua a crescere le cellule a 37 ° C con 220 giri 3-4 ore.
- Centrifugare la coltura per 10 min a 5000 xga 4 ° C in una provetta da centrifuga pre-pesato. Eliminare il supernatante a fondo e determinare il peso del pellet pesando di nuovo e sottraendo il peso provetta da centrifuga.
- Risospendere il E. pellet di cellule coli in 0,8 ml / g di tampone di lisi nel vortex vigorosa.
NOTA: In alternativa, il pellet cellulare può essere congelato a -80C per un uso successivo. Se a partire da un pellet congelato, lasciar scongelare completamente prima di aggiungere il tampone di lisi. - Aggiungere 2 mg di lisozima per grammo di cellule, e incubare in ghiaccio con vortex occasionale per 30 min.
- Aggiungere 20 mg / ml DNAse, 10 mM MgCl 2, 1 mM NaCl, 20 mg / ml RNAsi. Vortex e mettere in ghiaccio per 30 min.
- Aggiungere 2 ml di tampone detergente a freddo per grammo di cellule. Mescolare bene e tenere RT per 5 min.
- Trasferimento a 2 ml provette da centrifuga (diviso in due tubi, se necessario). Centrifugare per 10 minuti a 12.000 xg a 4 ° C per far sedimentare i corpi di inclusione.
- Aggiungere 1 ml di tampone freddo Triton e risospendere completamente il pellet da sonicazione (3 impulsi x 5 sec x 50% di potenza con intervalli di 20 sec). NOTA: Avere il tubo in un piccolo bicchiere circondato da acqua ghiacciata per mantenerlo freddo durante la sonificazione. Nel caso di più tubi, combinare i corpi di inclusione risospeso in una provetta dopo risospensione.
- Centrifugare per 10 minuti a 12.000xga 4 ° C per far sedimentare i corpi di inclusione.
- Ripetere il punto 4.13 e 4.14 due volte.
- Risospendere i corpi di inclusione in 1 ml di freddo TE con sonification per un lavaggio finale per rimuovere il buffer di Triton. Centrifugare per 10 minuti a 12.000 xg a 4 ° C per far sedimentare i corpi di inclusione.
- Risospendere il pellet in 1 ml di freddo TE di sonificazione.
- Valutare la concentrazione di proteine con metodi standard come il saggio Bradford 19. Conservare aliquote dei corpi di inclusione a -20 ° C.
5. Ricostituzione
Questo protocollo produce tipicamente 1-2 ml di proteine ricostituito con un diametro esterno di 4 quando assorbanza viene misurata nella regione Qy (600-750 nm). Quantità può essere regolata a piacere, anche se occorre prestare attenzione per mantenere i rapporti corretti durante la procedura.
- Preparare le seguenti soluzioni, come descritto nella Tabella 1: 2x Tampone di ricostituzione, il 20% OG, 2 M KCl, TE. Eseguire il seguente sPTO in penombra.
- Risospendere 800 mg di corpi di inclusione LHC in un totale di 400 microlitri TE in una provetta per microcentrifuga da 2 ml. Aggiungere 400 ml di tampone di ricostituzione 2x e vortex brevemente.
- Aggiungere 0,6 ml di β-mercaptoetanolo (archivio 14.8 M) per avere una concentrazione finale di 10 mM. Riscaldare la proteina per 1 min a 98 ° C. Vortex brevemente e posto a temperatura ambiente per 3 min.
- Risospendere 500 mg del totale dei pigmenti di clorofilla secchi più 80 mg pigmenti carotenoidi in 30 microlitri 100% EtOH vigorosamente vortex per 1 minuto o posto in un bagno sonicatore per 1-2 min.
- Gira la miscela pigmento ~ 30 sec a 15.800 xg a 4 ° C e verificare che non vi è alcun pellet. Se c'è un pellet, ripetere vortex e / o sonicazione. IMPORTANTE: Dopo la risospensione e centrifuga, aggiungere subito pigmento alla proteina, oppure può aggregare e dovrà essere risospeso di nuovo.
- Aggiungere lentamente la miscela pigmento alla proteina raffreddato mentre vortex. Continuare a vortice 5-10 sec provetta e collocarla sul ghiaccio bagnato. Fare attenzione a non vortice troppo energicamente come la proteina può traboccare la parte superiore del tubo.
- Aggiungere 94 ml di 20% Octyl β-D-glucopiranoside (OG) (concentrazione finale 2%), vortice brevemente e tenere su ghiaccio 10 min.
- Aggiungere 90 ml di KCl 2 M (concentrazione finale 150-200 mM), vortice brevemente e tenere su ghiaccio 20 min. NOTA: Preparazione della colonna (sezione 6) possono essere avviati in questo momento.
- Spin per 10 min a 15.800 xg a 4 ° C. Rimuovere il surnatante senza disturbare il pellet (precipitato LDS) in una provetta da 10 ml. Mantenere freddo e al riparo dalla luce.
6 Nickel colonna di purificazione
- Preparare le seguenti soluzioni, come descritto nella Tabella 1: tampone OG, buffer di risciacquo OG, tampone di eluizione.
- Collegare una colonna Ni-Sepharose (1 ml) o equivalente ad una pompa peristaltica assicurare che l'aria penetri all'interno della colonna durante questa fase e le seguenti operazioni.
- Impostare la velocità di tsi pompa a 1 ml / min e risciacquare la colonna con 5-10 ml di acqua per rimuovere la soluzione di archiviazione.
- Equilibrare la colonna con 3-4 ml di tampone OG.
- Aggiungere 3-4 ml di tampone OG al campione proteico e carico alla colonna. NOTA: se la proteina è stato seduto sul ghiaccio per più di 10 minuti dopo la rimozione di LDS, girare di nuovo a 15.800 xg a 4 ° C per 1 min per rimuovere qualsiasi precipitazione LDS aggiuntivo.
- Lavare la colonna con 5 ml di tampone OG.
- Lavare la colonna con 2 ml di tampone OG risciacquo.
- Eluire le proteine con 3 ml di tampone di eluizione. Raccogliere il eluire verde che contiene la proteina ricostituita. NOTA: Questo è di solito di circa 1 ml in totale.
7 centrifugazione in gradiente di saccarosio
- Preparare le seguenti soluzioni, come descritto nella Tabella 1: soluzione di saccarosio, 0,06% β-DM, HEPES 0,01 M, pH 7,6.
- Riempire i tubi ultracentrifuga con la soluzione di saccarosio e congelare a -20 ° CO / N or -80 ° C per almeno 1 ora.
- Togliere la provetta dal freezer e lasciare scongelare indisturbati a 4 ° C. NOTA: Il processo di congelamento / scongelamento crea un gradiente 0,1-1 M saccarosio. Un tubo da 15 ml si scioglie di solito in circa 3 ore.
- Rimuovere con cautela dalla parte superiore lo stesso volume la frazione verde eluito dalla colonna Sepharose nichel al punto 6.8. Poi caricare il campione ricostituito in cima lentamente per evitare di disturbare il gradiente.
- Saldo tubi e centrifugare a 200.000 xg a 4 ° C in un'ultracentrifuga utilizzando un rotore secchio SW-41 o SW-60 oscillante per 18 ore, impostare a rallentare l'accelerazione e arresto senza freni.
- Togliere la sfumatura dal supporto tubo con una pinza. Utilizzare una siringa con un ago lungo che ha una apertura smussato per raccogliere la frazione dall'alto. NOTA: In alternativa, raccogliere frazioni dal fondo forando il tubo con un ago e di raccolta gocce.
Risultati
Dettagli Questo protocollo un metodo per ricostituire chorophyll a / b proteine di legame in vitro. Questa tecnica consente di ripiegare questi complessi pigmento-proteina in vitro a partire dalla apoproteina, che può essere ottenuta con sovraespressione in un sistema eterologo, e pigmenti estratti da piante o alghe. Dopo ricostituzione, il complesso pigmento-proteina ripiegata è purificata dall'eccesso di pigmenti e l'apoproteina spiegato in due fasi. Il primo passo (Figura 1 AB) si basa sulla presenza di His-tag al C-terminale della proteina, che consente la rimozione di gran parte dei pigmenti sciolti. La seconda fase di purificazione utilizza densità di saccarosio gradiente di centrifugazione, (figura 2) in cui la proteina spiegato solito migra più lentamente rispetto alla banda verde che contiene la proteina ricostituito. L'obiettivo della ricostituzione in vitro è di ottenere complessi con la stessa correttalegami come quelli nativi. Per illustrare questo risultato, le proprietà spettroscopiche di un complesso di luce-raccolta in vivo viene confrontato con lo stesso complesso LHC ricostituita in vitro 13,20,21. Lo spettro di assorbimento della LHCs nel visibile (350 nm e 750 nm) dipende dalla composizione del pigmento del complesso, nonché l'ambiente del pigmento (che comprende la proteina) ed è quindi uno strumento sensibile per controllare la qualità della ricostituzione. In figura 3, lo spettro di assorbimento di CP24, un clorofilla a / b proteina da Arabidopsis thaliana, ricostituito legame in vitro, viene confrontato con lo spettro dello stesso complesso purificato da Arabidopsis tilacoidi 21. Nel spettri, è possibile riconoscere il Qy e la transizione Soret di Chl a (picchi a 671/439 nm) e Chl b (picchi a 649/466 nm). I complessi nativi e ricostituiti mostrano abso identicirption spettri, che indica una composizione pigmento praticamente identico e l'organizzazione. Spettroscopia di fluorescenza può essere utilizzata per valutare la qualità del complesso ricostituito. Gli spettri di emissione di fluorescenza è misurata su di eccitazione a diverse lunghezze d'onda, che eccitano preferenzialmente diversi pigmenti: Chl a a 440 nm, Chl b a 475 nm, e xantofille a 500 nm. In un complesso proteina-pigmento correttamente ripiegata, Chl b e xantofille trasferiscono la loro energia di eccitazione principalmente Chl a pochi picosecondi, e la fluorescenza proviene da un sistema equilibrato termicamente risultante in un singolo picco con la stessa forma e massimi in tutti e tre eccitazione lunghezze d'onda (Figura 4A-B). La presenza di Chl b non coordinato alla proteina può essere riconosciuto da un picco o spalla supplementare di circa 650 nm su 475 nm di eccitazione (Figura 4C). La presenza di libera Chl conduce un postodi emissione supplementare circa 675 nm, che è presente principalmente su 440 nm di eccitazione. Gli spettri di emissione di fluorescenza su 475 nm di eccitazione sia ricostituito e complessi CP24 nativi (Figura 4D) mostrano un unico picco a 681 nm, per indicare quel complesso ricostituita è piegato correttamente. Una conferma ulteriore che il complesso pigmento-proteina è ricostituito correttamente viene da dicroismo circolare (CD) misurazioni. Il segnale CD nella regione del visibile dipende dalle interazioni tra eccitonici pigmenti ed è quindi molto sensibile a piccoli cambiamenti anche nell'organizzazione dei cromofori 22. Figura 5 mostra gli spettri CD di ricostituito e nativo CP24, con i tipici picchi di impronte digitali 681 nm, 650 nm e 481 nm. In conclusione, l'elevata somiglianza tra le proprietà spettroscopiche dei nativi e del CP24 ricostituito conferma che i complessi i rendimenti procedura di ricostituzione nativo-come suita BLE per lo studio in vitro delle proteine luce-raccolta.

Figura 1 Rappresentazione della purificazione di proteine ricombinanti LHC con la sua etichetta utilizzando una colonna di nichel. (A) Durante la purificazione, His-tagged proteine, composto da due complessi ricostituiti (esagono verde) e di proteine non-ricostituito / aggregato (arancione esagono) sono legati alla superficie del Ni-Sepharose (punto blu), mentre i pigmenti sciolti (piccole macchie colorate) scorrono attraverso. (B) Quando la colonna viene lavata con il tampone di eluizione contenente imidazolo, le proteine ricostituite e non-ricostituito sono raccolti nel flusso attraverso.
hres.jpg "width =" 500 "/>
Figura 2 Saccarosio gradiente di LHCII ricostituito dopo purificazione mediante colonna di nichel. I complessi ricostituiti sono separati dal pigmento libero dal gradiente di densità. La fascia verde scuro rappresenta LHCII ricostituito e lo sfondo verde pallido è composto da pigmenti liberi.

Figura 3: Spettro di assorbimento di proteine ricostituito CP24 (rCP24, linea rossa) e quella nativa (nCP24, linea nera) isolato da Arabidopsis thaliana. In entrambi gli spettri, è possibile riconoscere il Qy e la transizione Soret di Chl a (picchi a 671/439 nm) e Chl b (picchi a 649/466 nm). Questo dato è stato modificato da Passarini et al. 2014 21.

Figura 4 spettri di emissione di fluorescenza. Gli spettri di emissione di fluorescenza del complesso ricostituito CP24 tipo selvatico (A) e normalizzati al massimo (B) mostra un efficiente trasferimento di energia da Chl b e Xanthophyls di Chl a. (C) spettri di emissione di fluorescenza del ricostituito CP24 (rCP24) e il complesso nativo (nCP24) isolato da Arabidopsis thaliana. Gli spettri sono normalizzati al massimo del picco (D). Cliccate qui per vedere una versione più grande di questa figura.

Figura 5 dicroismo circolare Spectra. Ricostituito CP24 (rCP24, linea rossa) e il nativo complesso (nCP24, linea nera) isolato da Arabidopsis thaliana mostra spettri molto simili.
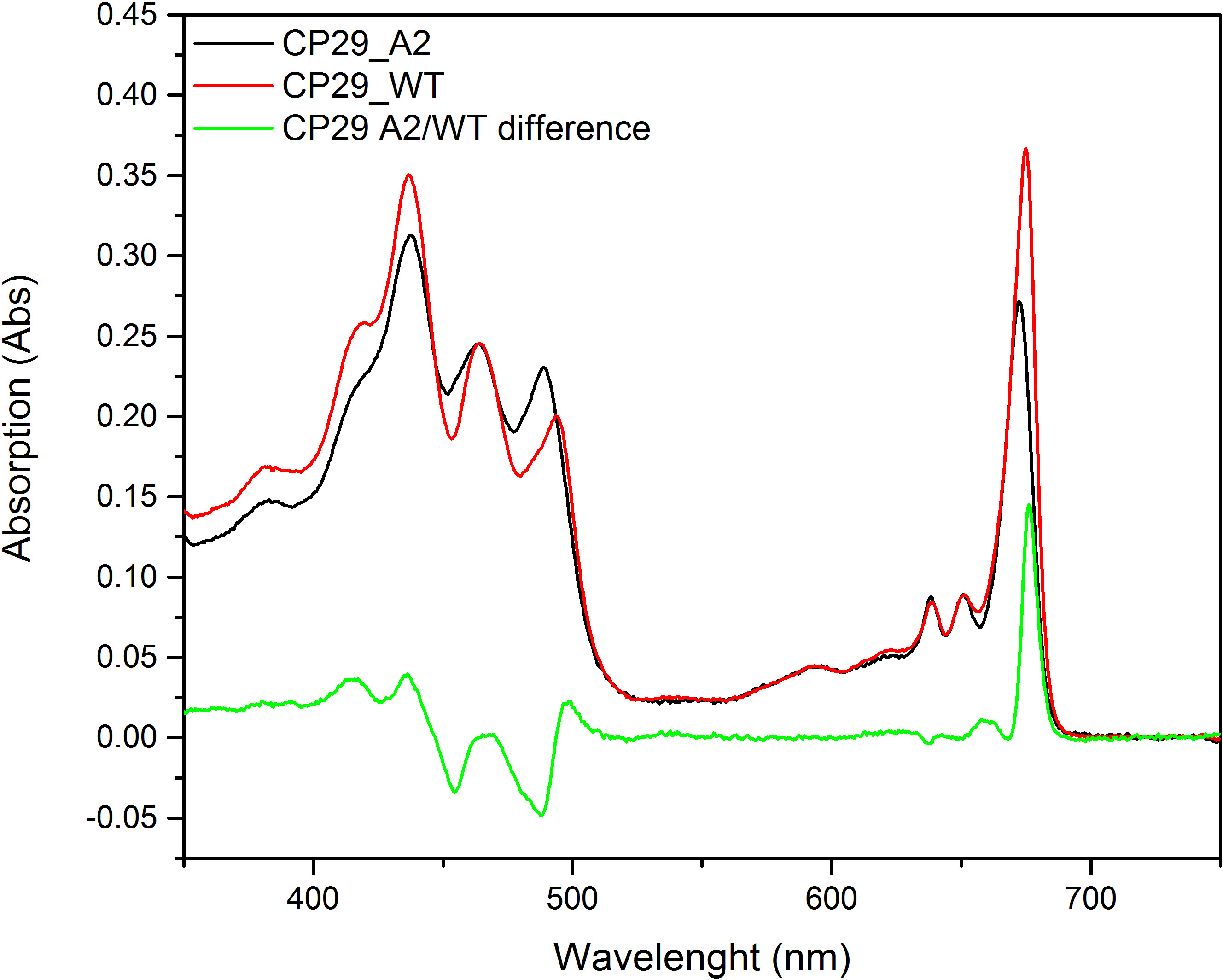
Figura 6 spettri di assorbimento di CP29 wild type (CP29_WT) e mutato CP29 (CP29_A2). La linea verde mostra le differenze tra i due grafici.
| Tutti i tamponi possono essere conservati a 4 ° C. | |||
| Componenti | Concentrazione finale | Note aggiuntive | |
| Rettifica Buffer | Sorbitolo | 0,4 M | |
| Tricine | 0.1 M | pH 7.8 | |
| NaCl | 10 mM | ||
| MgCl 2 | 5 mM | ||
| Latte in polvere | 0,5% w / v | ||
| Tampone di lavaggio | Sorbitolo | 50 mM | |
| Tricine | 5 mM | pH 7.8 | |
| EDTA | 10 mM | pH 8 | |
| Lysis Buffer | Tris | 50 mM | pH 8 |
| Saccarosio | 2,5% w / v | ||
| EDTA | 1 mM | pH 8 | |
| Tampone detergente | NaCl | NaCl 200 mM | |
| Acido desossicolico | 1% w / v | ||
| Nonidet P-40 | 1% w / v | ||
| Tris | 20 mM | pH 7.5 | |
| EDTA | 2 mM | pH 8 | |
| beta-mercaptoetanolo | 10 mM | ||
| Triton Buffer | Triton X-100 | 0,5% w / v | |
| Tris | 20 mM | pH 7.5 | |
| beta-mercaptoetanolo | 1 mM | ||
| Buffer TE | Tris | 50 mM | pH 8 |
| EDTA | 1 mM | pH 8 | |
| Tampone di ricostituzione | HEPES | 200 mm | |
| Saccarosio | 5% w / v | ||
| Lithiumdodecylsulfate (LDS) | 4% w / v | ||
| Benzamidine | 2 mM | ||
| EACA | 10 mM | ||
| OG Buffer | Octylglucoside | 1% w / v | |
| 12,5% w / v | |||
| NaCl | 0.2 M | ||
| HEPES | 20 mM | ||
| Imidazolo | 10 mM | ||
| OG Rinse Buffer | n-Dodecyl-beta-D-Maltoside (β-DM) | 0.06% w / v | |
| HEPES | 40 mM | pH 7,5-9 | |
| NaCl | 0.2 M | ||
| Elution Buffer | Imidazolo | 0.5 M | |
| n-Dodecyl-beta-D-Maltoside (β-DM) | 0.06% w / v | ||
| HEPES | 40 mM | pH 8 | |
| NaCl | 0.2 M | ||
| Soluzione di saccarosio | Saccarosio | 20% w / v | |
| n-Dodecyl-beta-D-Maltoside (β-DM) | 0.06% w / v | ||
| HEPES | 0,01 M | pH 7,6 | |
| Acetone 80% tamponata con carbonato di sodio | Acetone | 80% v / v | |
| Carbonato di sodio | 1 M | ||
| Etanolo 96% tamponata con carbonato di sodio | Etanolo | 96% v / v | |
| Carbonato di sodio | 1 M | ||
Tabella 1 Elenco dei tamponi e le soluzioni utilizzate in questo protocollo.
rCP26| CHLA a / b mix | CHLA a / b | Chl a | Chl b | Neo | Viola | Liuto | Chl tot | Chl / Car | |
| nCP26 | - | 2.2 ± 0.05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4,5 ± 0,1 |
| rCP26 | 8 | 2.71 ± 0.05 | 6.57 | 2.43 | 0.72 | 0.32 | 0.97 | 3.9 ± 0.04 | |
| rCP26 | 5.5 | 2.25 ± 0.05 | 6.23 | 2.77 | 0,77 | 0.3 | 0.96 | 9 | 4.0 ± 0.1 |
| rCP26 | 3 | 2.08 ± 0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1 ± 0.1 |
| rCP26 | 1 | 1,7 ± 0,05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4.3 ± 0.05 |
| rCP26 | 0.3 | 1.11 ± 0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2 ± 0.2 |
| 0.05 | 0.23 ± 0.01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3.1 ± 0.06 | |
| rCP26 | <0,01 | 0.11 ± 0.01 | 0.7 | 6.3 | 0.64 | 0.3 | 1.08 | 7 | 3.06 ± 0.06 |
Tabella 2 contenuto di pigmento CP26 nativo complesso rispetto al ricostituiti complessi proteina-pigmento con diverse Chl a / b Rapporti 39.
Discussione
Le proteine di membrana non sono così facili da studiare. Isolamento delle proteine di membrana native è complicata dalla necessità di solubilizzare il doppio strato lipidico con detergenti, che possono danneggiare le proteine e rimuovere cofattori essenziali. Queste proteine possono essere presenti anche a bassi livelli nelle membrane biologiche, o essere mescolato con proteine strettamente correlate, come nel caso dei complessi di raccolta della luce, che rende la purificazione dei singoli complessi difficili. Espressione della proteina eterologa in E. coli e ricostituzione in vitro offre la possibilità di evitare questi problemi. ricostituzione in vitro e purificazione di proteine ripiegate risultati in complessi che possiedono caratteristiche molto simili a quelle dei complessi nativi 20,21,23 e quindi può essere usato per studiare complessi che non possono essere purificate all'omogeneità 24 - 27.
Questo metodo utilizza spinaci, che è facilmente attainabtutto l'anno le, come fonte per il totale dei pigmenti carotenoidi e preparati. Per alcune ricostruzioni di proteine native per le alghe, l'uso di pigmenti purificati dalle alghe è preferito a causa di diverse composizioni pigmento. L'a / b rapporto Chl e rapporto / auto Chl rimane lo stesso indipendentemente dalla fonte pigmento.
È importante rendersi conto che l'efficienza della ricostituzione è di solito intorno al 35% 28. Quindi è necessario rimuovere i pigmenti non vincolato e l'apoproteina spiegato dalla soluzione dopo la ricostituzione. Un protocollo di purificazione a due fasi è presentato in questo protocollo (vedi anche i risultati). Tuttavia, va notato che la fase gradiente di saccarosio non permette la completa separazione di apo e olo-proteina. Per la maggior parte delle analisi questo non è un problema, in quanto la apoproteina non contiene pigmenti e quindi non interferisce con le misurazioni funzionali. Tuttavia, nel caso sia necessario rimuovere completamente l'apoproteina dal frazione contenente il complesso ricostituito (per esempio, per calcolare il pigmento di proteina stechiometria), una colonna di scambio anionico può essere usato (vedere Passarini et al 2009 29 per i dettagli.).
La capacità di ripiegare le proteine ricombinanti di raccolta luce con pigmenti isolate in vitro offre la possibilità di "manipolare" i complessi modificando la ricostituzione "ambiente" in vari modi, cambiando così le caratteristiche del complesso risultante. Ad esempio, modificando la composizione del pigmento durante la ricostituzione può risultare in un complesso con la composizione del pigmento alterato. Questa caratteristica può essere utilizzata per studiare l'influenza vari pigmenti hanno sulla struttura e la stabilità del complesso. Solitamente la preparazione pigmento ottenuto da spinaci ha un rapporto Chl a / b di 3: 1 e un rapporto / auto Chl di 2,9: 1. Questo rapporto produce tipicamente una proteina ricostituita con le stesse proprietà del native uno. Tuttavia, la regolazione del rapporto Chl a / b con l'aggiunta di una o purificato Chl b può influenzare il legame di differenti pigmenti dovuti al variare selettività dei siti di legame 30-33. Ciò è possibile perché la maggior parte dei siti di legame di pigmento non sono completamente selettivo per Chl una o Chl b, ma può alloggiare, sebbene con differente affinità 10,30,34. In modo simile, i siti di legame di carotenoidi sono stati anche dimostrato di essere in grado di ospitare più di una specie xantofilla 8,35 - 38. Diverse ricostruzioni di CP26, un altro complesso pigmento-proteina di piante superiori, utilizzando varie composizioni di pigmento sono riportati nella tabella 2 39. Queste ricostruzioni sono stati utilizzati per valutare l'affinità di siti per particolari pigmenti 39 vincolante. È interessante notare che, al fine di ottenere un complesso con lo stesso pigmento composizione come quella nativa, il rapporto Chl a / b della miscela pigmento deve essere di 3: 1. Questo sembra essere il caso per tutti i complessi LHC di piante superiori 20,40.
La combinazione di biologia molecolare con la tecnica ricostituzione permette le proprietà di un complesso Chl vincolante da studiare più dettagliatamente. L'importanza dei diversi domini proteici sulla stabilità e la piegatura dei complessi, o il loro coinvolgimento nelle interazioni proteina-proteina, sono stati determinati troncando il apoproteina o l'esecuzione di mutagenesi casuale 8,41 - 44. Residui amminoacidici singolo importanti per il coordinamento dei diversi pigmenti possono essere modificati mediante mutagenesi sito-diretta per analizzare le proprietà dei singoli pigmenti o valutare il loro contributo alla funzione e la stabilità del complesso 10,28,29,45 - 52. La figura 6 mostra ricostituiti Lhcb4 (CP29) conuna mutazione della istidina in posizione 216 53. Un confronto della composizione pigmento di tipo selvatico e complessi mutanti mostra che la mutazione induce la perdita di una Chl una molecola, che indica che il sito mirato ospita un un Chl nel complesso WT. Le differenze degli spettri di assorbimento di WT e mutanti, sulla normalizzazione al contenuto di pigmento, mostra anche le proprietà di assorbimento del pigmento perduta. In questo caso, la differenza può essere visto nel picco principale a 680 nm, che indica che la Chl a coordinato da His216 assorbe a questa lunghezza d'onda (per maggiori dettagli su questo mutante e le proprietà spettroscopiche vedono Mozzo et al. 2008 53). L'analisi di mutazione può anche essere usato per determinare l'effetto dell'ambiente sulle proprietà spettroscopiche dei pigmenti 54.
In conclusione, le proteine di raccolta della luce possono facilmente essere ricostituito in vitro con conseguente pigmento-Protein complessi con proprietà molto simili a complessi nativi. In questo modo, le difficoltà di isolare proteine native sono eliminati, offrendo anche la preparazione di proteine con elevata resa e purezza per ulteriori studi. L'importanza di un 3: 1 Chl rapporto a / b nella produzione di un complesso autentica è sottolineato, ed esempi di tipo selvatico ricostituito e LHCs mutanti sono forniti per illustrare le applicazioni della tecnica.
Divulgazioni
The authors declare no conflict of interest
Riconoscimenti
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
Materiali
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
Riferimenti
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon