Method Article
L'uso di Spettroscopia di Risonanza Magnetica come uno strumento per la misura della Bi-emisferici transcraniali elettrici effetti di stimolazione sul motore principale Cortex Metabolismo
In questo articolo
Riepilogo
This article aims to describe a basic protocol for combining transcranial direct current stimulation (tDCS) with proton magnetic resonance spectroscopy (1H-MRS) measurements to investigate the effects of bilateral stimulation on primary motor cortex metabolism.
Abstract
Transcranica stimolazione in corrente continua (tDCS) è una tecnica di neuromodulazione che è stato sempre più utilizzato negli ultimi dieci anni nel trattamento dei disturbi neurologici e psichiatrici come l'ictus e la depressione. Tuttavia, i meccanismi alla base la sua capacità di modulare l'eccitabilità del cervello per migliorare i sintomi clinici rimane poco compresa 33. Per migliorare questa comprensione, la spettroscopia di risonanza magnetica protonica (1H-MRS) può essere utilizzato in quanto consente la quantificazione in vivo dei metaboliti cerebrali come l'acido γ-amminobutirrico (GABA) e glutammato di una determinata regione maniera 41. In realtà, un recente studio ha dimostrato che 1 H-MRS è infatti un potente mezzo per capire meglio gli effetti della tDCS sulla concentrazione del neurotrasmettitore 34. Questo articolo si propone di descrivere il protocollo completo per combinare tDCS (NeuroConn MR stimolatore compatibile) con 1 H-MRS a 3 T con un seguenti MEGA-PRESSinfluenza. Descriveremo l'impatto di un protocollo che ha mostrato una grande promessa per il trattamento di disfunzioni del motore dopo l'ictus, che consiste in una stimolazione bilaterale delle cortecce motorie primarie 27,30,31. Fattori metodologici da considerare e eventuali modifiche al protocollo sono anche discussi.
Introduzione
L'idea di applicare energia elettrica al cervello umano di modulare la sua attività è stato studiato fin dai tempi antichi. Infatti, scritti da fin dal 11 ° secolo sono stati trovati che descrivono l'uso del pesce siluro elettrico nel trattamento delle crisi epilettiche 1. Eppure, non è fino a poco tempo che la stimolazione cerebrale non invasiva ha ricevuto l'interesse diffuso nella comunità scientifica, come è stato dimostrato di produrre effetti modulatori sulla funzione cognitiva e la risposta del motore 2. Mentre Stimolazione Magnetica Transcranica (TMS) è stato ampiamente studiato fin dai primi anni del 1980 del 3, recente interesse transcranica stimolazione corrente continua (tDCS) è aumentata in quanto è ormai considerato una valida opzione di trattamento per una vasta gamma di neuropatologie, come l'ictus 4, dipendenza da alcol 5, 6 e il dolore cronico. tDCS ha molti vantaggi rispetto alle tecniche di neurostimolazione come TMS, per esempio,poiché è relativamente poco costoso, indolore, ben tollerata dai pazienti, e portatile, rendendo così possibile somministrare al letto 7. In realtà, solo una piccola percentuale dei pazienti avvertono una sensazione di formicolio lieve durante la stimolazione 8. Tuttavia, questa sensazione generalmente scompare dopo pochi secondi 9. Di conseguenza, tDCS permette, studi sham-controllato in doppio cieco robusti in quanto la maggioranza dei partecipanti non permette di distinguere la stimolazione sham da vera stimolazione 9,10.
tDCS comporta l'induzione di una costante di corrente elettrica a basso amperaggio (1-2 mA) applicata alla corteccia tramite elettrodi di superficie posizionati sulla cute del soggetto. Gli elettrodi sono generalmente inseriti in spugna imbevuti di soluzione fisiologica o direttamente sul cuoio capelluto con una pasta EEG tipo. Per condurre uno studio tDCS, devono essere controllati dallo sperimentatore quattro parametri principali: 1) la durata della stimolazione; 2) l'intensità della stimolazione; 3) la dimensione dell'elettrodo; e 4) il montaggio dell'elettrodo. In protocolli standard, l'elettrodo "attiva" è posizionato sopra la regione di interesse mentre l'elettrodo di riferimento è solitamente posizionato sulla regione sopraorbitali. La corrente fluisce dall'anodo carica positiva verso il catodo caricato negativamente. L'effetto della tDCS sulla corteccia motoria primaria (M1) è determinato dalla polarità della stimolazione dove stimolazione anodica aumenta l'eccitabilità di una popolazione di neuroni e la stimolazione catodica riduce 11. Diversamente TMS, la corrente indotta è insufficiente a produrre potenziali d'azione nei neuroni corticali. Le variazioni dell'eccitabilità corticale si ritiene essere dovuto alla modulazione della membrana neuronale soglia che conduce sia alla iperpolarizzazione del potenziale di membrana o di una facilitazione di depolarizzazione dei neuroni a seconda della direzione del flusso di corrente 8,11. La durata dei cambiamenti di eccitabilità può durare fino a 90 minuti dopo l'offsetdella stimolazione, a seconda della durata di stimolazione 11,12.
tDCS e Riabilitazione Motoria
La M1 è stato ampiamente utilizzato come un obiettivo di stimolazione in quanto i cambiamenti di eccitabilità indotte da tDCS possono essere quantificati attraverso potenziali evocati motori (MEP) indotti da singolo impulso TMS 3. I primi studi che mostrano la possibilità di misurare specifici di polarità di eccitabilità cambiamenti indotti dalla tDCS hanno usato M1 come bersaglio di stimolazione 11,12. Da allora, M1 è rimasto uno degli obiettivi primari della tDCS in studi che coinvolgono entrambe le popolazioni cliniche e soggetti sani a causa della sua importanza nella funzione motoria, la formazione della memoria, e il consolidamento delle capacità motorie 12.
Il cervello si basa su una complessa interazione tra le regioni a motore di entrambi gli emisferi per l'esecuzione di un movimento 14. Quando un settore è danneggiato, dopo aver subito un ictus ad esempio, inter-interazioni emisferiche sono alterati. Studi sulla plasticità del cervello hanno dimostrato che le aree motorie del cervello adattarsi a questa modifica in diversi modi 15. In primo luogo, le intatte, regioni circostanti della zona danneggiata può diventare overactived, che porta alla inibizione della zona danneggiata - un processo chiamato inibizione intra-emisferica. In secondo luogo, la regione omologa della zona danneggiata può diventare overactivated ed esercitare inibizione dell'emisfero ferito - un processo chiamato inibizione inter-emisferica. L'interessato M1 può quindi essere penalizzato due volte: prima dalla lesione e in secondo luogo l'inibizione proveniente sia dal inalterato M1 e la regione circostante della M1 colpito 16. Un recente studio ha dimostrato che una maggiore eccitabilità nell'emisfero inalterato è legata alla riabilitazione più lenta 17, che è stato descritto come disadattivi concorrenza tra emisferica 18.
Comprendere la plasticità che si verifica dopoun ictus può portare allo sviluppo di protocolli di neuromodulazione in grado di ripristinare le interazioni interemisferiche 19. Tre principali trattamenti tDCS sono stati proposti in pazienti con deficit motori seguenti ictus 20,21. Il primo trattamento ha lo scopo di riattivare la corteccia motoria lesa dalla stimolazione anodica unilaterale (a-tDCS). In questo caso, la stimolazione mira ad aumentare direttamente l'attività in aree perilesionali, che si ritiene essere essenziale per il recupero. Infatti, gli studi hanno mostrato un miglioramento del paretico arto superiore o inferiore dopo questo trattamento 22-26. Il secondo trattamento è stata sviluppata con l'obiettivo di ridurre l'eccessiva attivazione dell'emisfero controlesionale applicando tDCS catodica unilaterali (c-tDCS) sulla M1 intatta. Qui, la stimolazione mira ad indirettamente, aumentando l'attività nelle aree perilesionali attraverso interazioni interhemispehric. I risultati di questi studi hanno dimostrato un miglioramento della functi motoredopo c-tDCS 4,27-29. Infine, il terzo trattamento mira a combinare gli effetti eccitatori di un tDCS sulla ferita M1 con gli effetti inibitori di c-tDCS sul inalterato M1 utilizzando tDCS bilaterali. I risultati hanno mostrato miglioramenti nella funzione motoria dopo tDCS bilaterali 27,30,31. Inoltre, uno studio ha dimostrato grandi miglioramenti seguenti tDCS bilaterali rispetto a entrambi i metodi unilaterali 32.
Fisiologici meccanismi di tDCS
Nonostante il crescente utilizzo di tDCS nel trattamento di ictus, il meccanismo fisiologico sottostante suoi effetti rimane sconosciuta 33. Una migliore comprensione degli effetti fisiologici potrebbe contribuire allo sviluppo di migliori opzioni di trattamento e potrebbe portare a protocolli standardizzati. Come accennato in precedenza, gli effetti della tDCS può durare fino a 90 minuti dopo l'offset della stimolazione 11,12. Pertanto, iperpolarizzazione / depolarizzazioneI processi non possono spiegare completamente gli effetti di lunga durata 33,34. Diverse ipotesi sono state proposte per quanto riguarda il meccanismo fisiologico alla base tDCS postumi sulla M1 compresi i cambiamenti di rilascio dei neurotrasmettitori, la sintesi proteica, la funzione dei canali ionici, o attività del recettore 34,35. Approfondimenti sulla materia sono stati acquisiti attraverso studi farmacologici che mostrano una soppressione della postumi di anodica e la stimolazione catodica sulla M1 eccitabilità da parte del glutammato N-metil-D-aspartato (NMDA) destrometorfano 36,37, mentre l'effetto contrario è stato dimostrato con un agonista del recettore NMDA 38. Recettori NMDA sono pensati per essere coinvolti nella funzione di apprendimento e memoria attraverso potenziamento a lungo termine (LTP) e depressione a lungo termine (LTD), sia mediato da neuroni GABAergici del glutammato e 39,40. Gli studi su animali sono in linea con questa ipotesi in quanto hanno dimostrato che una-tDCS induce LTP 13.
Nonostante i notevoli progressi compiuti nella comprensione dei meccanismi di azione alla base tDCS effetti, i protocolli farmacologici attuali limitazioni importanti. Infatti, l'azione farmaco non può essere spazialmente specifico tDCS, specialmente nel contesto della sperimentazione umana, e il meccanismo di azione dei loro effetti è dovuto principalmente ai recettori postsinaptici 34. Pertanto, vi è la necessità di indagare più direttamente gli effetti della tDCS sul cervello umano. Spettroscopia di risonanza magnetica protonica (1H-MRS) è un buon candidato in quanto consente non invasivo in vivo di rilevamento delle concentrazioni di neurotrasmettitori in una regione specifica di interesse. Questo metodo si basa sul principio che ogni neurochimico-protone contenente nel cervello ha una struttura molecolare specifica e, di conseguenza, produce risonanze chimicamente specifici che possono essere rilevati da 1 H-MRS 41. Il segnale acquisito dal volume del cervello inTERESSE è generato da tutti i protoni che risuonano tra 1 e 5 ppm. Le sostanze neurochimiche acquisite sono rappresentate su uno spettro e riportati in funzione del loro spostamento chimico con alcuni picchi chiaramente distinguibili, ma dove molte risonanze dei diversi neurochimiche sovrappongono. L'intensità di ogni segnale di picco è proporzionale alla concentrazione del neurometabolite 41. La quantità di sostanze neurochimiche che possono essere quantificati dipende dalla forza del campo magnetico 42,43. Tuttavia, i metaboliti a bassa concentrazione, che sono oscurati dalle risonanze molto forti, sono difficili da quantificare a intensità di campo inferiori come 3 T. Un modo per ottenere informazioni su tali segnali si sovrappongono è quello di rimuovere le forti risonanze tramite editing spettrale. Una di queste tecniche è una sequenza MEGA-PRESS, che consente il rilevamento di acido γ-amminobutirrico (GABA) segnali 44,45.
Solo pochi studi hanno indagato l'effetto della tDCS sulmetabolismo cerebrale con 1 H-MRS a motore 34,46 e non motori regioni 47. Stagg e collaboratori 34 ha valutato gli effetti di un-tDCS, c-tDCS, e la stimolazione sham sul metabolismo M1. Hanno trovato una significativa riduzione della concentrazione di GABA in seguito a-tDCS, e una significativa riduzione del glutammato + glutammina (Glx) e GABA seguente c-tDCS. In un altro studio, è stato riferito che la quantità di cambiamenti nella concentrazione di GABA indotto da un-tDCS su M1 era legata all'apprendimento del motore 46.
Questi studi mettono in luce le potenzialità di combinare 1 H-MRS con tDCS per aumentare la nostra comprensione dei meccanismi fisiologici alla base l'effetto della tDCS sulla funzione motoria. Inoltre, l'uso di protocolli clinici come un tDCS e c-tDCS sopra M1 è utile perché i loro effetti comportamentali sono ben studiata e possono essere direttamente connessi ai risultati fisiologici. Pertanto, un protocollo standard per la combinazione tDC bilateraleS e 1 H-MRS è dimostrata in soggetti sani con un sistema a 3 T MRI. Bihemispheric tDCS è presentato in contrasto con i dati di uno studio precedente in cui MRS catodica unilaterale o tDCS anodica unilaterali sono stati applicati su corteccia motoria 34. Il protocollo è descritto specificamente per la stimolazione con uno stimolatore NeuroConn in una T scanner Siemens 3 esegue MEGA-PRESS 1 H-MRS.
Protocollo
Lo studio è stato approvato dalla ricerca e comunitarie Etica Consigli di Unité de Neuroimagerie fonctionnelle e Università di Montréal ed è stato fatto nel rispetto del codice etico come affermato nella Dichiarazione di Helsinki. Tutti i soggetti hanno firmato un consenso informato dopo un attento screening per la compatibilità con la risonanza magnetica e sono stati compensati finanziariamente per la loro partecipazione.
1. tDCS Materiale
- Assicurarsi che tutti i materiali necessari sono disponibili prima di iniziare l'esperimento (si veda la Figura 1 per la lista).
Nota: I formati differenti elettrodi sono disponibili per la tDCS. Per questo studio, verranno utilizzati elettrodi in gomma due 5 x 7 cm. Altre misure possono essere scelti a seconda della zona della stimolazione e focalità desiderata della stimolazione 48. - Assicuratevi di controllare che le batterie del DC-stimolatore sono addebitate a loro pagare periodicamente, in quanto il dispositivo non può essere caricato o inserito, in dustimolazione ring per motivi di sicurezza.
2. Pianificazione delle Condizioni di stimolazione
- Accendere il dispositivo tDCS in base alle istruzioni fornite con il dispositivo. Pre-impostare il dispositivo tDCS per due diverse modalità di stimolazione (attivi e sham).
- Poiché alcuni dispositivi non dispongono di una modalità preimpostata, selezionare i parametri sham appropriati prima di iniziare la stimolazione.
- Pre-definire una serie di parametri caricando un'impostazione. Premere il tasto 2 o 4 per selezionare dal menu principale l'opzione "sistema" (vedi figura 2).
- Spostare il cursore alla linea 2 del display premendo il tasto 3.
- Premere il tasto 2 o 4 fino a quando la "regolazione del carico" appare sul display. Premere il tasto 3.
- Selezionare la lettera della regolazione (A, B, C o D) premendo il tasto 2 o 4.
- Spostare il cursore verso l'alto con il tasto 1. Il display visualizza automaticamente l'opzione "Parametri".
- impostare il dispositivo tDCS a una corrente di 1 mA. Per fare ciò, premere il tasto 1 per selezionare la linea 3 del menu "parametri" del display. Selezionare l'opzione "corrente" premendo il tasto 2 o 4. Premere il tasto 3 per raggiungere la linea 4 e modificare l'intensità a 1000 μA premendo il tasto 2 o 4.
- Premere il tasto 1 per tornare alla linea 3. Selezionare il "Fade In" dal menu a video del dispositivo premendo il pulsante 2 o 4. Premere il tasto 3 per passare alla linea 4 e premere i pulsanti 2 e 4 per regolare la durata di 15 s.
Nota: Fade in durata può essere modificata. - Premere il tasto 1 per tornare alla linea 3. Selezionare l'opzione "fade out" dal menu a schermo del dispositivo premendo i tasti 2 o 4. Premere il tasto 3 per passare alla riga 4 e premere i pulsanti 2 e 4 per regolare la durata di 15 s.
Nota: Fade in durata può essere modificata. - Premere il tasto 1 per tornare alla linea 3. Press il tasto 2 o 4 fino a quando l'opzione "durata" appare sul menu del display. Premere il tasto 3 per passare alla riga 4 e premere il tasto 2 e 4 per regolare la durata della durata minima disponibile sul dispositivo (15 s per il presente dispositivo; vedi figura 3 b).
Nota: In questo modo si induce una sensazione di formicolio simile alla stimolazione attiva.
- Premere i tasti 1 e 3 simultaneamente per salvare le modifiche del setting.
- Pre-programma i parametri di stimolazione attiva. Per fare ciò, seguire le stesse istruzioni per l'impostazione della stimolazione sham, ma programmare la durata di 1.200 secondi (20 min; vedere la Figura 3a).
- Pre-programma i parametri di stimolazione di prova. Per fare ciò, seguire le stesse istruzioni per l'impostazione della stimolazione sham, ma programmare la durata di 45 sec.
Nota: La stimolazione prova sarà utilizzato per la misura dell'impedenza prima della sperimentazione. - Pseudo-ransequenza casuale assegnare le condizioni di stimolazione ai partecipanti.
- Assegnare un numero a ciascuna delle tre condizioni per una sperimentazione cieco: 1) bilaterale: anodica destra, sinistra catodica; 2) bilaterale: anodica sinistra, destra catodica; 3) sham: anodica destra, di sinistra catodica.
3. Consenting i partecipanti
- Informare il partecipante della procedura e firmare modulo di consenso.
- Verificare che i partecipanti non hanno alcuna controindicazione alla tDCS: una storia psichiatrica o neurologica, la presenza di un pacemaker, metallico impiantato nel cranio, una storia di svenimento, una storia di convulsioni, una storia di abuso di sostanze, una storia familiare di convulsioni, una storia di convulsioni febbrili, una mancanza di sonno nella notte precedente, una storia di sensibilità della pelle, e ogni consumo di alcol il giorno precedente.
- Informare il partecipante dei più segnalati effetti collaterali di tDCS: formicolio lieve; moderata fatica; leggera sensazione di prurito sotto gli elettrodi; lievesensazione di bruciore.
- Informare il partecipante delle solite controindicazioni MR e gli effetti collaterali.
4. Misure per posizionamento elettrodi
- Utilizzare il sistema internazionale 10/20 per trovare i seguenti punti di riferimento sulla testa partecipante: nasion e inion (Figura 4a), punti preauricolari, e le due aree interessate: C3 e C4 (figura 4b).
- Individuare il nasion come area depressa distinta situato sul ponte del naso al livello tra entrambi gli occhi. Individuare la inion come proiezione più prominente dell'osso occipitale situato nella parte inferiore del cranio. Individuare il punto di preauricolare vicino a ciascun orecchio; è la rientranza sopra la tacca zigomatica. Individuare C3 e C4 sulla base di misurazioni come descritto di seguito.
- Utilizzare un metro per misurare la distanza tra la nasion e inion lungo la linea mediana della testa e fare un segno al 50% della distanza di ingegnoha marcatore idro non permanente.
- Utilizzare un metro per misurare la distanza tra i due punti preauricolari e fare un segno con un pennarello non permanente idro al 50% della distanza in linea con il marchio precedente. Questo punto corrisponde Cz (vertice).
- Dal Cz, lungo la linea creata tra i punti preauricolari, segnare due punti, uno su ciascun lato, con un pennarello non permanente idro che corrispondono al 20% della distanza totale. Questi segni corrispondono alle aree bersaglio (C3 e C4, Figura 4b).
Nota: Altri metodi come TMS o neuronavigazione possono anche essere usate per localizzare M1.
5. Posizionamento degli elettrodi
- Spostare il più capelli il più possibile lontano dalle zone in questione che saranno stimolati. Applicare un gel esfoliante EEG-tipo con un tampone di cotone per pulire le aree mirate.
- Pulire le zone interessate con alcool isopropilico al 70% e pomice Prepping pad per migliorare il contatto degli elettrodi.
- Coprire generosamente l'intero elettrodo con una pasta conduttiva EEG-tipo. Assicurarsi che la pasta è di circa 5 mm di spessore su tutta la superficie. Assicurarsi che l'intera area è ricoperta in gomma con pasta. Leggermente bagnare le aree di destinazione e la pasta conduttiva sugli elettrodi con una soluzione salina.
- Posizionare gli elettrodi come mostrato in Figura 4b e premere saldamente gli elettrodi sulle zone mirate. Inserire un elastico intorno alla testa del partecipante per garantire la stabilità ottimale degli elettrodi. Regolare in modo tale che il partecipante sperimenterà nessun dolore o disagio durante la sessione di scansione.
- Assicurarsi che i cavi non vengano a contatto con la pelle, per evitare il rischio di ustioni.
6. tDCS prova ai lati della camera Scanner
- Utilizzare un tester per verificare il corretto funzionamento del cavo dell'elettrodo e la resistenza.
- Accendere il dispositivo tDCS e caricare le impostazioni di stimolazione di prova.
- Premere il tasto 2 o 4 per selezionare dal menu principale l'opzione "sistema". Spostare il cursore alla linea 2 del display premendo il tasto 3. Premere il pulsante 2 o 4 fino a quando la "regolazione del carico" appare sul display. Premere il pulsante 3. Selezionare la lettera dell'impostazione test pre-programmata (A, B, C o D) premendo il tasto 2 o 4.
- Spostare il cursore verso l'alto con il tasto 1. Il display mostrerà automaticamente "parametri" opzione. Nella prima riga, premere il tasto 2. Il display visualizzerà "stimolazione?" con i diversi parametri preimpostati.
- Premere il tasto 1 per iniziare la stimolazione. Il display visualizza il livello di impedenza e arresta automaticamente se raggiunge più di 20 kΩ. Se il livello di impedenza è superiore a 20 kΩ, scollegare i cavi dell'elettrodo dalla scatola interna ed uscire dalla camera scansione per verificare il posizionamento degli elettrodi.
- Ripeti la stimolazione di prova. Quando un buon livello di impedance viene raggiunto e quando la stimolazione test, scollegare gli elettrodi dalla scatola interna.
7. tDCS Setup
- Come mostrato in Figura 5, collocare il dispositivo tDCS e la scatola esterna nella sala di controllo dello scanner.
Nota: Il dispositivo tDCS e la scatola esterna non sono MR compatibili e non devono essere presi nell'ambiente magnete. - Collegare i fili scatola esterna nel dispositivo tDCS e quindi collegare il cavo lunga scatola nella scatola esterna.
- Far passare il cavo di dialogo tDCS dalla sala di controllo dello scanner nella stanza MRI. Accertarsi di far passare questo cavo il più diritta possibile, evitando pieghe o loop, lungo la parete della stanza risonanza magnetica verso il retro dello scanner MRI. Mettere diversi sacchetti di sabbia compatibili MR sul cavo per assicurarne la stabilità, come mostrato in Figura 5.
- Portare la scatola interna nella stanza MRI e collegare il cavo di dialogo lungo in esso (Figura 5).
8. RMN Preparation
- Chiedere al partecipante di entrare nella stanza risonanza magnetica, se non già in là dalla prova tDCS, e di mettere in tappi per le orecchie.
- Mettere un cuscino sottile sotto l'area della bobina del tavolo risonanza magnetica. Chiedere al partecipante di sdraiarsi sul tavolo. Mettere un cuscino sotto le gambe del partecipante per comodità e una coperta, se necessario. Dare il pulsante di allarme per motivi di sicurezza il partecipante.
- Mettete le cuffie separati su entrambe le orecchie per consentire la trasmissione delle informazioni dalla sala di controllo dello scanner al partecipante nella stanza MRI.
- Posizionare la testa del partecipante in alto possibile sotto la zona in cui la bobina testa sarà posizionata (parte superiore della testa più vicino possibile alla parte superiore della tabella in cui verrà inserito bobina). Mettere i fili elettrodi lungo il lato destro della testa del partecipante, come raccomandato dalla ditta dispositivo tDCS.
- Posizionare il 32 canali di sola ricezione bobina intorno alla testa del partecipante. Far passare i cavi degli elettrodi attraversoil lato destro della bobina. Posizionare la testa del partecipante più diritta possibile utilizzando un laser di posizionamento rosso (built-in funzione dello scanner).
- Chiedere al partecipante di muovere braccia e gambe in una posizione comoda, facendo in modo che le mani non si toccano. Assicurati di ricordare ai partecipanti di rimanere il più fermo possibile durante l'intera sessione. Quando il partecipante è pronto, spostare la tabella oltre la linea di mezzo per raggiungere i fili degli elettrodi sul retro dello scanner.
- Utilizzare nastro medico per stabilizzare il cavo dell'elettrodo sul lato destro della parte posteriore della bobina. Collegare i fili degli elettrodi situati all'interno dello scanner nella scatola interna tDCS. Posizionare la scatola interna sul lato destro dello scanner con un sacchetto di sabbia su di esso per la massima stabilità.
- Spostare il tavolo nella sua posizione finale. Tenere i tDCS acceso e gli elettrodi collegato a scatola esterna per l'intera sessione di risonanza magnetica.
9. Pre-tDCS 1 H-MRS sessione
- Eseguire una sequenza localizzatore di acquisire immagini necessarie per verificare il corretto posizionamento della testa e di confrontare una seconda localizzatore che verrà acquisita alla fine della sessione per controllare il movimento complessivo.
- Acquisire anatomiche T 1 immagini MPRAGE pesate per il posizionamento del voxel M1 e rilevazione di eventuali anomalie strutturali (T R = 2,300 msec; T E = 2,91 msec, FA: 9 °; FOV = 256 x 256 mm, 256 x 256 matrice ; T I: 900 msec, 176 fette; orientamento: sagittale; tempo di acquisizione: 4 min 12 sec).
- Eseguire una ricostruzione multi-progettista delle immagini in piani che sono più appropriati per la visualizzazione della spettroscopia volume-di-interesse (VOI).
- Nella scheda 3D, sfogliare le foto prime MPRAGE (orientamento sagittale). Dalla finestra "Creazione di campi paralleli" selezionare "2X2 assiale". Regolare la posizione delle linee parallele e fare clic su Salva per creare la vista ortogonale assiale.
- Dalla finestra "Creazione di campi paralleli" selezionare "2X2 coronale". Regolare la posizione delle linee parallele e fare clic su "Salva" per creare la vista ortogonale coronale.
- Individuare la M1 a sinistra sulla base di Yousry e 49 punti di repere anatomici dei collaboratori sui tre fette di orientamento. Quindi, posizionare la VOI (30 x 30 x 30 mm 3) sull'area senza angolazione rispetto all'asse dello scanner (figura 6).
- Acquisire una scansione linea di larghezza (21 s).
- Selezionare la scheda spettroscopia per misurare acqua linea larghezza sulla parte reale del segnale da questa linea di scansione larghezza. Caricare i dati grezzi line-larghezza dal browser. Caricare il protocollo di misura linea di larghezza (menu protocolli: selezionare il protocollo).
- Regolare la fase utilizzando gli strumenti di post-processing interattive software dello scanner. Selezionare la sezione di correzione di fase e regolare la fase per la linea di base con il cursore.
- Per ridurre la linea di larghezza,eseguire il FAST (EST) MAP 50 sequenza per tre volte. Ripetere la scansione linea di larghezza e la misurazione linea di larghezza (punto 9.5). Si noti la linea di acqua-larghezza finale.
- Avviare 4 blocchi di scansioni 64 metaboliti (32 "EDIT OFF" e 32 "EDIT ON", Interleaved) con una sequenza MEGA-PRESS 44,45, dove VAPOR 51, OVS 51 e lo stoccaggio individuale di FID sono abilitati (T R = 3 S, T E = 68 msec, tempo di acquisizione totale: 12 min)
- Acquisire un riferimento di acqua utilizzando la sequenza MEGA-PRESS senza soppressione acqua MEGA, con soppressione VAPORE ("solo RF off") e con una misura delta a 0 ppm. Acquisire un unico blocco di 4 scansioni metaboliti invece di 64 (tempo di acquisizione: 42 sec).
10. Procedura tDCS
- Informare il partecipante che la stimolazione tDCS verrà avviato e che lo scanner sia in silenzio per tutta la stimolazione.
- Selezionare una delle due in precedenza progsbattuta parametri secondo la condizione e iniziare la stimolazione. Tenere traccia dell'impedenza e della tensione durante i 20 min di stimolazione. Quando la stimolazione è finita, informa il partecipante che il posto tDCS-MRS sessione avrà inizio. Non spegnere il dispositivo tDCS.
11. Post-tDCS 1 H-MRS sessione
- Eseguire le stesse scansioni metaboliti con sequenza MEGA-PRESS come il pre-tDCS eseguire la scansione, ma il doppio dei blocchi di acquisizione (8 blocchi di 64 scansioni (32 "EDIT OFF" e 32 "EDIT ON", Interleaved)) per acquisire i metaboliti a due tempo diversi punti di post-tDCS.
- Come per la sessione di pre-tDCS, acquisire una scansione di riferimento dell'acqua utilizzando gli stessi parametri. Terminare la sessione con una sequenza localizzatore.
- Confrontare visivamente le immagini acquisite localizzatore all'inizio e alla fine della sessione di scansione come indice di movimento della testa.
- Accedere alla scheda di visualizzazione e passare al menu del browser. Selezionare la prima e la seconda localiimmagini RAW dell'equalizzatore. Caricare le immagini nella scheda di visualizzazione e confrontare le due immagini. Esportazione dei dati in formato DICOM tramite il server.
12. Analisi della 1 H-MRS dati
- Importazione di dati utilizzando un software di programmazione e di elaborazione, e regolare la frequenza e la fase di FID memorizzati singolarmente con segnale TCR e TCHO tra 2,85 e 3,40 ppm. Per fare ciò, utilizzare la funzione lsqnonlin del software per adattarsi frequenza e la fase di ogni singolo FID Fourier-trasformati (spettri) per gli spettri media della sessione.
Nota: questo è un approccio site-specific e altri metodi per l'importazione e l'analisi dei dati non necessariamente influire sulla qualità dei dati. - Per ottenere gli spettri finale, sottrarre i segnali provenienti da scansioni si alternano con gli impulsi a doppio fasciato selettive che sono state applicate a 4,7 ppm e 7,5 ppm ("EDIT OFF") e di 1,9 ppm e 4,7 ppm ("EDIT ON") (Figura 7 ).
- Utilizzare il LCModel 52per l'analisi sia differenza e spettri "EDIT OFF". Disattivare simulazioni di default e la modellazione di base.
- Eseguire un controllo visivo degli spettri di escludere le sessioni con la contaminazione da segnale lipidico sottoscapolare (vedi F IGURA 9).
- Nell'ambito del controllo di qualità, escludere spettri con larghezza di riga di TCR-CH 3 superiore a 10 Hz. Includere solo nei metaboliti di analisi (GABA, GLX, TCR, tNAA) che sono stati quantificati con Cramer-Rao limiti inferiori (CRLB) inferiore al 35%.
Nota: CRLB forniscono errore previsto per la quantificazione metabolita. CRLB> 50% non è affidabile ed è un cut-off raccomandato dal manuale LCModel. Molti nel settore hanno utilizzato un CRLB inferiore al 35% come standard. 53-55 Inoltre, il CRLB dovrebbe essere tenuto in considerazione quando si interpretano i risultati. - Ottenere GABA e GLX quantificazioni dagli spettri "DIFF", TCR dal "EDIT OFF" spettri, e tNAA sia "EDIT OFF" e "; DIFF "Express Le concentrazioni dei diversi metaboliti di interesse, rapporti di oltre TCR per GABA e GLX, moltiplicare il rapporto dal seguente fattore di correzione gruppo-media per tenere conto del diverso set di base utilizzato per il numeratore e il denominatore (tNAA da.". EDIT OFF "spettri / tNAA da" spettri DIFF ").
Nota: Nota: le concentrazioni di GABA e GLX possono essere quantificati con segnale d'acqua o NAA.
Risultati
La Figura 6 mostra la posizione del VOI situato sulla rappresentazione della mano in M1 cui sono state effettuate le misure MRS. Nella figura 6D, una visualizzazione 3D mostra una chiara rappresentazione degli elettrodi tDCS posizionati sul cuoio capelluto sopra il presunto corteccia motoria primaria. La figura 7 mostra rappresentante "EDIT OFF" e la differenza ("DIFF") spettri acquisiti in M1. Picchi corrispondenti a Glx, GABA + MM e NAA può essere visto chiaramente.
La Figura 8 mostra la percentuale di variazione tra l'acquisizione MRS pre-tDCS e post-tDCS per le tre diverse condizioni in un singolo partecipante. I risultati della sessione di post-tDCS sono separati in due punti di tempo per illustrare l'evoluzione del cambiamento nel tempo. Figura 8a mostra la percentuale di cambiamento per Glx. Per la stimolazione sham, display concentrazione GLX senza modulazione notevole. Per stimu bilateralezione 1 (sinistra anodica, catodica a destra), ancora una volta si osserva alcuna modulazione notevole di Glx; Tuttavia, la modulazione della concentrazione nel tempo è opposto a quanto si osserva nella stimolazione sham. Infine, per quanto riguarda la stimolazione bilaterale 2 (catodica sinistra, destra anodica), un modello simile si osserva alla stimolazione sham ma con un notevole aumento della concentrazione Glx nel secondo time-point dopo stimolazione.
La figura 8b mostra la percentuale di variazione della concentrazione di GABA in relazione alla condizione di stimolazione. Per la stimolazione sham, visualizza concentrazione di GABA senza modulazione notevole. Tuttavia, una leggera riduzione si osserva in entrambi i punti temporali. La modulazione del GABA dopo la stimolazione sham è più importante per la Glx ,. Al contrario, un notevole aumento della concentrazione di GABA è visto nel punto seconda volta dopo stimolazione bilaterale 1 (anodo sinistra, destra catodo). Infine, un modello simile di cambiamentoalla stimolazione sham si osserva per la stimolazione bilaterale 2 (catodo sinistra, anodo a destra).
La Figura 9 mostra gli spettri ottenuti da due diversi partecipanti. Figura 9a mostra uno spettro di buona qualità con un segnale lipidi accettabili. Figura 9b mostra uno spettro con grandi segnali lipidi, che è stato escluso dopo l'ispezione visiva. Infine, la figura 10 mostra lo spostamento della posizione del voxel di interesse successivo al 5 mm movimento partecipante.

Figura 1: Materiali. 1) Soluzione salina; 2) pasta conduttiva; 3) gel per elettrodi; 4) L'alcol durante la preparazione pad; 5) Nastro di misurazione; 6) matita EEG; 7) Elastici; 8) Scatola interna; 9) Dispositivo tDCS; 10) Scatola esterna; 11) Cavo di dialogo interno; 12) Cavo scatola esterna; 13) Elettrodi; 14) Cavo di dialogo a lungo

Figura 2: tDCS dispositivo Immagine del posizionamento dei pulsanti sul dispositivo tDCS specifici utilizzati nella presente protocollo. Questi pulsanti sono usati per pre-impostare le diverse impostazioni.
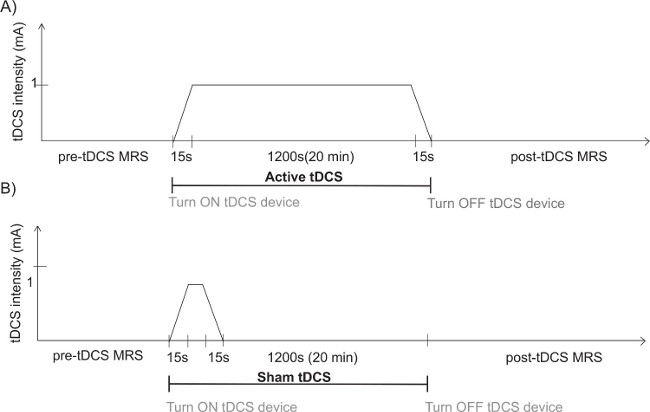
Figura 3: Naturalmente il tempo delle condizioni di tDCS. A) Naturalmente il tempo della condizione tDCS attiva. Dopo l'acquisizione metabolita pre-tDCS, accendere il dispositivo tDCS e ramp-up la corrente per 15 secondi fino a un'intensità di 1 mA. Stimolare per raggiungimento 20 min e rampa di discesa della corrente per 15 secondi fino a una intensità di 0 mA. Non spegnere il dispositivo tDCS e procedere al post-stimolazione acquisizione metabolita. B) Naturalmente il tempo della condizione sham tDCS. Dopo il pre-tDCS acquisizione metabolita, turn sul dispositivo tDCS e accelerazione della corrente per 15 secondi fino un'intensità di 1 mA si ottiene. Stimolare per 15 secondi (il tempo minimo disponibile sul dispositivo corrente) e decelerazione la corrente per 15 secondi fino a un'intensità di 0 mA. Attendere 20 min. Non spegnere il dispositivo tDCS e procedere al post-stimolazione acquisizione metabolita.
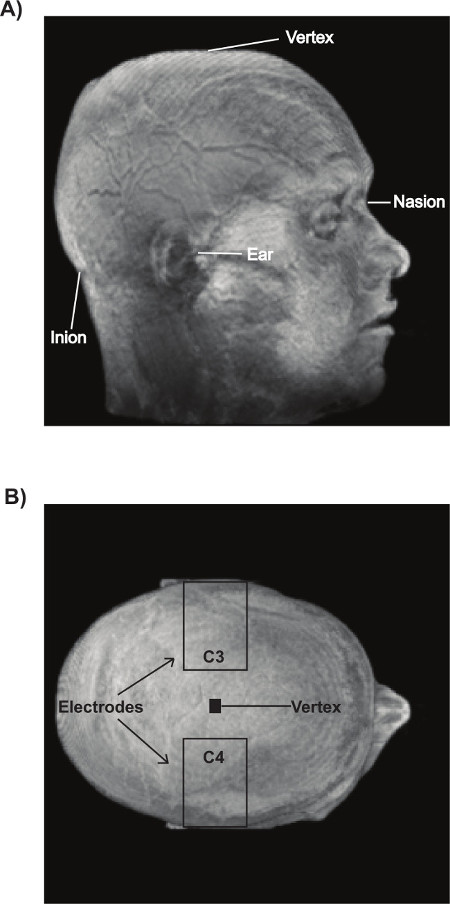
Figura 4: posizionamento elettrodi A) 10/20 punti di riferimento del sistema internazionali utilizzati per l'identificazione di C3 e C4. Il vertice (Cz) corrisponde al 50% della distanza tra la nasion e inion, e il 50% della distanza tra i due punti preauricolari. B) C3 e C4 corrispondono al 20% della distanza totale tra i punti preauricolari, misurata dal punto di vertice. Assicurarsi di lasciare almeno 8 cm di distanza tra i due elettrodi.
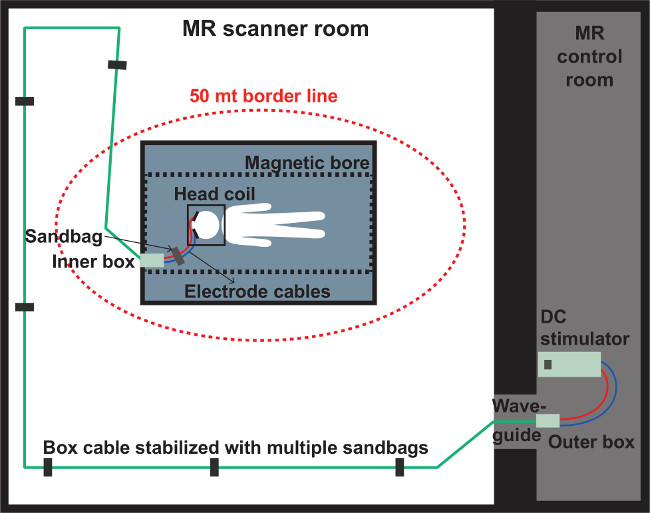
Figura 5: Rappresentazione schematica della stanza MR. Posizionamento dei materiali nelle camere di scansione MR e console. È essenziale seguire il protocollo per il posizionamento delle varie parti del dispositivo in modo da ottenere un segnale RM di buona qualità e per motivi di sicurezza.
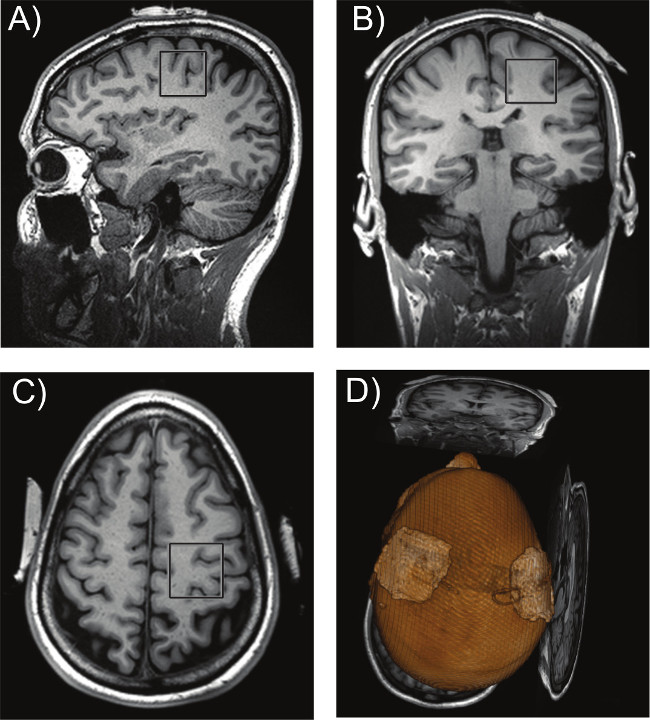
Figura 6: posizionamento VOI. Posizione del VOI (30 x 30 x 30 mm 3) sopra la zona sinistra M1 in (A) sagittale, (B) coronale, e (C) sezioni assiali. Visualizzazione 3D del posizionamento degli elettrodi è mostrato in (D).

Figura 7: 1 H-MRS metabolita spectrum. Rappresentante (A) "EDIT OFF" e (B) la differenza ("DIFF") spettri acquisiti con la sequenza MEGA-PRESS 44,45 compresi i dati grezzi, la misura da LCModel e residui. Cr: creatina totale (creatina + fosfocreatina (Cr-CH 3 + PCr-CH 3)); NAA: N acetil-aspartato + NAAG (sNAA + NAAG); Glx: glutammato + glutammina (Glu + Gln); GABA + MM: acido + macromolecole γ-aminobutirrico
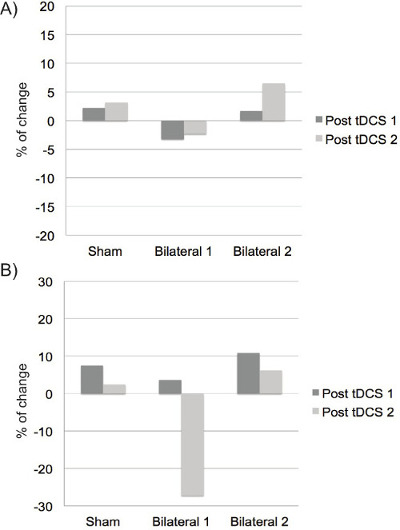
Figura 8: Effetti della tDCS bilaterali in materia di Glx e GABA per un unico soggetto. A) effetti tDCS sulla concentrazione Glx sono indicati per le tre condizioni. I risultati sono espressi come percentuale di variazione tra l'acquisizione pre-tDCS e le due acquisizioni di stimolazione posta. B) effetti tDCS sulla concentrazione di GABA sono indicati per le tre condizioni. I risultati sono espressi come percentuale del chaESN tra l'acquisizione pre-tDCS e le due acquisizioni di stimolazione posta. Sham: Bilaterale Bilaterale 1,: anodo sinistro, catodo a destra; Bilaterale 2: catodo di sinistra, anodo destra
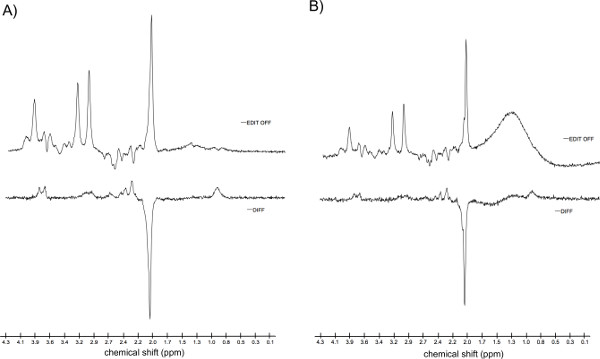
Figura 9: ispezione visiva degli spettri A) Esempio di dati di buona qualità. La figura mostra il "EDIT OFF" e spettri "DIFF" con una quantità accettabile di lipidi. SNR dall'analisi degli spettri "DIFF": 56 CRLB del segnale GABA: 14% Lw di TCR-CH 3 a 3 ppm: 5.6 Hz. B) Esempio di dati di scarsa qualità causati da un eccessivo movimento del partecipante. La figura mostra il "EDIT OFF" e spettri "DIFF". SNR dall'analisi degli spettri "DIFF": 39 CRLB del segnale GABA: 47% Lw di TCR-CH 3 a 3 ppm: 4.4 Hz

Figura 10: VOI posizione dopo il movimento Posizione del VOI (30 x 30 x 30 mm 3) sopra la zona sinistra M1 in (A) e sagittale (B) fette coronali dopo un movimento di 5 mm. Inclusione delle ossa craniche e le meningi nella casella porterebbe all'inclusione dei lipidi e l'eliminazione della scansione. Il quadrato grigio chiaro mostra la posizione iniziale del VOI.
Discussione
Il presente lavoro mira a descrivere un protocollo standard per tDCS conciliano e 1 H-MRS utilizzando uno scanner 3 T. Nella sezione successiva, saranno discussi i fattori metodologici.
Fasi critiche
Controindicazioni Screening
Precedente all'esperimento, è fondamentale ai partecipanti dello schermo per qualsiasi controindicazione per quanto riguarda l'uso di tDCS e 1 H-MRS. L'uso dei seguenti criteri di esclusione è raccomandato per tDCS: anamnesi psichiatrica o neurologica, la presenza di un pacemaker, un pezzo di metallo impiantato nel cranio, una storia di svenimento, una storia di convulsioni o una storia di abuso di sostanze. Dato che saranno acquisiti solo i metaboliti dal M1 sinistra, si raccomanda l'esclusione di sinistra partecipanti mani dello studio. Infatti, un recente studio ha dimostrato un'inibizione interemisferico differenziale tra gli emisferi dominante e non dominante a seconda della preferenza mano, Che può modulare l'effetto della stimolazione 15. Inoltre, prima di iniziare l'esperimento, verificare la presenza di eventuali lesioni sul cuoio capelluto e chiedere qualsiasi malattia della pelle 56. Se c'è una lesione presente, cercare di evitare di stimolare direttamente l'area interessata. Si raccomanda inoltre di ispezionare la pelle dopo la stimolazione 57. Inoltre, lo screening per la presenza di allergie a qualsiasi dei prodotti utilizzati per l'elettrodo montaggio. Per 1 H-MRS, i criteri di esclusione dovrebbe essere la stessa per ogni studio di risonanza magnetica comprendente una accurata selezione di eventuali interventi chirurgici precedenti per la presenza di metallo nel corpo.
E 'anche importante determinare se il partecipante sentiva fastidio durante la stimolazione tDCS. Anche in questo caso, dopo l'esperimento, partecipante dovrebbe essere chiesto di eventuali effetti collaterali. E 'possibile utilizzare un record-forma, compresi gli effetti collaterali più segnalati per quantificare la loro presenza in relazione al protocollo (vedi 58 perun esempio). Gli effetti collaterali più riportati sono formicolio lieve (70,6%), affaticamento moderata (35,3%), una leggera sensazione di prurito in corrispondenza degli elettrodi (30,4%), e una leggera sensazione di bruciore (21,6%) 58.
Movimento Riduzione Artefatti
Movimento del partecipante nello scanner è una questione importante durante 1 H-MRS come questo è uno dei principali fattori che influenzano la qualità dei dati 59. Come mostrato in figura 10, un movimento del soggetto (da 1 mm a 5 mm) può portare a grande segnale di lipidi nello spettro alterando così la qualità dei dati e, di conseguenza, l'esclusione di tale acquisizione dei dati. Pertanto, è fondamentale per spiegare attenzione al partecipante l'importanza della stabilità testa durante tutta la scansione. Durante il posizionamento del partecipante nello scanner, è importante chiedere al soggetto di trovare la posizione più comoda per evitare qualsiasi ulteriore movimento. Durzione posizionamento del VOI, è anche importante informare il partecipante che anche se la scansione è silenziosa, è indispensabile rimanere fermi.
Inoltre, la durata dell'esperimento è un fattore importante per ridurre al minimo ammontare di movimento. In primo luogo, è importante utilizzare una lunghezza ottimale per la sequenza anatomica, il più breve possibile, ma abbastanza lungo per ottenere immagini di buona qualità per il posizionamento del VOI. In secondo luogo, l'uso di una breve sequenza di acquisizione metabolita è raccomandato prima tDCS. In terzo luogo, al fine di catturare il corso temporale degli effetti di stimolazione, si consiglia l'uso di una sequenza più lunga di acquisizione dopo la stimolazione. In quarto luogo, confrontare le immagini pre e post-esperimento localizzatore per stimare il movimento partecipante.
Analisi
La sequenza MEGA-PRESS 44,45 viene utilizzato per acquisire localizzata, acqua soppressa, e modificato spettri. Una localizzazione spaziale in PRESS viene eseguita utilizzando un 906; Hamming-filtrato impulso di sincronismo (prodotto banda passante in tempo = 8,75, durata = 2.12 msec, la larghezza di banda (FWHM) = 4.2 kHz) e due a 180 impulsi ° MAO (durata = 5.25 msec, larghezza di banda = 1.2 kHz). Tutti gli impulsi di localizzazione sono eseguiti a 3 ppm. Un selettiva doppio fasciato 180 ° Shinnar-Le Roux impulso viene applicato a 1.9, la frequenza di risonanza del β-CH 2 del GABA, e 4,7 ppm alternati a 7.5 e 4.7 ppm. Soppressione acqua supplementare con potenza variabile con ritardi ottimizzati rilassamento (vapore) e la soppressione del volume esterno, OVS 50 sono stati adattati per il sistema umano 3 T e incorporate prima MEGA-PRESS e sono utilizzati per sopprimere l'acqua e per migliorare la localizzazione del VOI. Quando l'impulso selettiva viene applicata a 1.9 ppm, la risonanza a 1.9 ppm e le risonanze all'interno della banda dell'impulso sono invertiti causando rifocalizzazione della γ-CH 2 risonanza del GABA ("EDIT ON"). Quando l'impulso selettiva viene applicata a 7,5 ppm, il solito spectrum a T E di 68 msec si ottiene ("EDIT OFF") con la γ-CH 2 risonanza della fase GABA modulato. La sottrazione dei segnali provenienti alternative scansioni risultati in osservazione selettiva di linee esterne di GABA tripletta e l'annullamento della creatina totale (creatina + fosfocreatina) di risonanza ("DIFF"). A causa della larghezza di banda dell'impulso di inversione, si osservano anche risonanze supplementari di NAA, Glu + Gln e macromolecole. L'intero protocollo è diviso in quattro acquisizioni interleaved e la frequenza viene aggiornato prima di ogni singola scansione per minimizzare le derive di frequenza a causa dell'hardware. L'acquisizione interleaved e singola stoccaggio FID permette la correzione di frequenza e di fase in post-elaborazione.
Il metodo di analisi descritto nel protocollo permette di calcolare il migliore adattamento dello spettro sperimentale come combinazione lineare di modello spettri. Modello spettri nel set baseSpettri "EDIT OFF" sono stati simulati sulla base di matrice densità formalismo 59 e conosciuti chemical shift e J accoppiamenti 60, e sono stati i seguenti: acetil frazione di N -acetylaspartate (sNAA), alanina (Ala), ascorbato (Asc), aspartato (Asp ), frazione aspartato di NAA (mNAA), CH 2 gruppo di Cr (Cr-CH 2), CH 3 gruppo di Cr (Cr-CH 2), CH 2 gruppo di PCR (PCR-CH 2), CH 3 gruppo di PCR (PCR-CH 2), GABA, il glucosio (Glc), Glu, Gln, glicerofosforilcolina (GPC), glicina (Gly), glutatione (GSH), lattato (Lac), Myo-inositolo (mI), N -acetylaspartylglutamate ( NAAG), fosforilcolina (PCHO), phosphorylethanolamine (PE), scillo inositolo (sl), e taurina.
La base di quanto stabilito per gli spettri "DIFF" è stata generata dagli spettri misurata sperimentalmente di quattro soluzioni 100 mM di NAA, GABA, Glu e Gln (600 ml in vetro sferica flasks) utilizzando gli stessi parametri e scanner come per esperimenti in vivo. Ogni soluzione inoltre conteneva K 2 HPO 4 (72 mM), KH 2 PO 4 (28 mM), sodio azide (0,1 mM), 3- (trimetilsilil) -1-propanosulfonico sale sodico (TSP; 2 mM), formiato ( 200 mM; opzionale), e acqua distillata. Gli spettri sono stati acquisiti set base alla temperatura fisiologica di 37 ° C e ogni sforzo è stato fatto per minimizzare raffreddamento (~ 1 ° C entro il 15 dell'acquisizione) preriscaldando fantasmi in un grande serbatoio di acqua prima di mettere ciascuno in acqua minori -filled isolato contenitore di plastica, che è stata posta nella bobina. Temperatura e pH sono particolarmente importanti nella spettroscopia quanto influenzano l'chemical shift dei metaboliti. Inoltre, per entrambi gli spettri "EDIT OFF" e "diff", set di base incluso uno spettro macromolecolare metabolita-annullato misurata sperimentalmente da 10 soggetti dalla corteccia occipitale utilizzando ilinversione di recupero (tempo di inversione, T I = 760 msec) tecnica che utilizza gli stessi parametri come la regolare acquisizione MEGA-PRESS (ad eccezione di T R = 2,7 s) 61.
Test Phantom
Verifica della procedura su un GABA mM phantom 100 con e senza lo stimolatore tDCS che verrà utilizzato sui partecipanti con i parametri dello scanner e esatta sequenza è vivamente consigliato prima del primo partecipante in fase di studio. La procedura dovrebbe includere una sequenza localizzatore, una sequenza anatomica (cioè MPRAGE), una scansione linea di larghezza e 16 "EDIT ON" e "OFF" EDIT scansioni. Questo dovrebbe essere ripetuto se stimolatore, parametri di stimolazione o scanner sono cambiati. Per investigare la presenza di artefatti del segnale, si dovrebbe esaminare spettri delle variazioni SNR con e senza il simulatore tDCS, presenza di picchi e disturbi a determinate frequenze, ei valori SNR e ogni manufatto importante sul anatomica imaGES.
Eventuali modifiche al protocollo
1 H-MRS Parametri
Per acquisire concentrazioni di metaboliti mediante 1 H-MRS, è necessario localizzare una regione specifica ed eccitare segnali in questo volume 35. Nel presente documento, la procedura per il posizionamento di un singolo VOI sul sinistro M1 è stato descritto. Tuttavia, molte modifiche diverse a questo protocollo possono essere applicate. Misura di successo delle concentrazioni dei metaboliti sono state dimostrate in diverse regioni corticali e subcorticali, come la corteccia prefrontale 62, 63 ippocampo, striato cervelletto e ponte 64, corteccia visiva 66, e la corteccia uditiva 67. Le dimensioni del VOI può anche differire in funzione della regione di interesse, ma il volume varia tipicamente tra 3 e 27 cm 3 68. Tuttavia, è difficile determinare la concentrazione dei metaboliti bassa concentrazione such come GABA dal voxel inferiori a 20 cm 3. Una questione importante è fare in modo di evitare qualsiasi contatto del VOI con le ossa del cranio, meningi e liquido cerebrospinale extra-cerebrale. Nel cervello più piccolo, VOI potrebbe includere parte del ventricolo laterale sinistro. In questo caso, l'inserimento del ventricolo è preferibile per l'inclusione delle ossa craniche.
Inoltre, a seconda della sequenza di acquisizione selezionata, diversi metaboliti possono essere quantificate 69. I metodi precedenti, come ad esempio la spettroscopia Point-RE-risolto (PRESS) Sequenza 70 e stimolato modalità di acquisizione eco (VAPORE) 71, non ha consentito la quantificazione del GABA a 1,5 T. Tuttavia, a causa dell'effetto specifico di polarità della tDCS sulla corticale eccitabilità, la quantificazione sia eccitatori (glutammato) ed inibitori (GABA) neurotrasmettitori è essenziale. Nel presente protocollo, è stato mostrato l'uso della sequenza MEGA-PRESS editing spettrale 44,45, Che consente la quantificazione dei principali neurochimiche, compresi GABA (vedi figura 6). Altre sequenze che permettono GABA quantificazione, come l'ultra-short TE MRS e J -resolved MRS, sono stati sviluppati nel corso degli ultimi anni (vedi 41 per una rassegna).
Infine, poiché le concentrazioni dei metaboliti sono di solito espresse come rapporto rispetto a un altro metabolita (concentrazione relativa), la scelta del metabolita riferimento è molto importante, e in modo particolare negli studi che impiegano popolazioni cliniche 69. I metaboliti di riferimento più comunemente usati sono TCR e NAA, in quanto le loro concentrazioni si trovano ad essere relativamente stabile nel cervello umano. Occorre notare che è anche possibile utilizzare una quantificazione assoluta dei metaboliti che richiede riferimento sia ad un esterno (ad esempio, fantoccio) o segnale interno (ad esempio, il segnale di acqua) 68. L'uso di un riferimento interno dell'acqua richiede un ulteriorefase di correzione del tessuto poiché le proprietà di concentrazione di acqua e di rilassamento differiscono tra materia grigia, materia bianca e liquido cerebrospinale (CSF). 72 La correzione tessuto può essere effettuata sia mediante la composizione del tessuto stimato nel VOI di tutti i partecipanti o tramite soggetti composizione tessuto specifico dalla segmentazione 73. Inoltre, va notato che tDCS comporta il rischio teorico di edema indurre, che potrebbe avere un impatto minimo sulle concentrazioni acqua. Tuttavia, Nitsche e collaboratori 74 direttamente valutato questa preoccupazione specifica e non hanno mostrato alcuna evidenza di edema dopo tDCS sulla corteccia frontale. Di conseguenza, l'uso di un riferimento acqua è considerata una valida opzione.
tDCS Parametri
Elettrodi diversi formati possono essere utilizzati 9 a seconda della regione della stimolazione e la focalità desiderata della stimolazione 75,76. Da Silva e collaboratori 56 Fornire una descrizione esauriente dei diversi tipi di elettrodi che sono attualmente disponibili per la tDCS. Inoltre, come descritto nel presente documento, 1 H-MRS è una tecnica utile che può essere utilizzato per verificare i meccanismi alla base dell'azione di specifici protocolli tDCS che hanno dimostrato di migliorare i sintomi in diverse popolazioni cliniche. Posizionamento degli elettrodi e la durata della stimolazione possono essere modificati per studiare gli effetti di questi protocolli specifici tDCS, come quelli quello utilizzato nel trattamento del dolore, depressione, tinnito, Parkinson, emicrania, e l'abuso di alcool (vedi 77 per una descrizione dei protocolli ). Va inoltre osservato che se il livello di impedenza è superiore a 20 kΩ, il dispositivo non stimolare e visualizzare un messaggio di errore impedenza sullo schermo. Diversi fattori che possono causare una elevata impedenza includono: 1) insufficiente quantità di pasta conduttiva sugli elettrodi; 2) insufficiente pressione sugli elettrodi; 3) male contact con il cuoio capelluto (causata da capelli); 4) ispessimento del cuoio capelluto a causa della calvizie; 5) problemi con le connessioni; 6) problemi con cablaggio; (7) problemi con stimolatore; e 8) problemi con elettrodi.
Va inoltre notato che la localizzazione di corteccia motoria primaria per tDCS potrebbe essere reso più preciso. Nel presente protocollo, il sistema EEG 10/20 viene utilizzato, che può introdurre leggero disallineamento tra proiezione campo elettrico massimo e la rappresentazione reale di M1 nel giro precentrale. Un modo per aggirare questo problema è quello di utilizzare la stimolazione magnetica transcranica per localizzare con precisione la rappresentazione di pari M1 attraverso la risposta muscolare TMS-indotta. Disponibilità di un'unità TMS in prossimità dello scanner MR può limitare questa possibilità.
Sicurezza di tDCS e 1 H-MRS
Sicurezza di tDCS
Diversi studi hanno dimostrato che la tDCS èuna tecnica di neuromodulazione sicuro produrre effetti negativi solo lievi in entrambe le popolazioni non-clinici e clinici 10. In realtà, nessun caso di crisi epilettica è mai stato riportato di seguito tDCS 10. Tuttavia, la sicurezza di tDCS deve ancora essere studiato nei bambini e donne in gravidanza 78.
MR materiali compatibili
Si deve usare cautela quando stimolante all'interno di uno scanner MR. Tutti i materiali introdotti nel locale di MR MR devono essere compatibili (vedi figura 1). A causa della possibile interazione tra la corrente elettrica prodotta dalla tDCS e lo scanner MR, tDCS dovrebbe essere sempre acceso e gli elettrodi deve rimanere collegato, durante le sequenze RM descritti nel presente protocollo. Avvolgimento dei fili sotto la bobina testa può produrre artefatti e distorsioni nel segnale. Inoltre, il collegamento non corretto dei cavi potrebbe potenzialmente produrre una corrente abbastanza forte da bruciare il partecipante 79. Infine, è importante scollegare mai gli elettrodi mentre la corrente scorre in quanto ciò potrebbe causare una stimolazione ad alta tensione indesiderata.
Tecnica di tDCS-MRS
Utilizzando tDCS in collaborazione con MRS offre la possibilità di comprendere meglio il meccanismo alla base di modulazione dell'attività cerebrale con questa tecnica relativamente nuova neuromodulazione. Tuttavia, alcune limitazioni della tecnica dovrebbero essere affrontati. In primo luogo, gli elettrodi utilizzati in tDCS sono solitamente piuttosto grandi e gli effetti della stimolazione sono creduti per coprire un'ampia estensione spaziale del tessuto cerebrale. Accoppiato con il fatto che l'acquisizione MRS è limitata ad un piccolo voxel di interesse, tDCS-MRS consente solo per la valutazione degli effetti spazialmente circoscritti, nonostante la modulazione diffusa presunta di eccitabilità del cervello. Un modo per aggirare questo problema è di utilizzare più voxel di interesse distribuiti in tutto il cervello. Tuttavia, questo sigsignificativamente aumentare la durata della sessione sperimentale, che è già un notevole limitazione della tecnica attuale. In effetti, se si considera la preparazione dei partecipanti, pre-tDCS MRS, intervento e post-tDCS tDCS MRS, una sessione completa può facilmente durare fino a due ore. Durata può anche aumentare se si vuole mappare l'andamento nel tempo degli effetti tDCS sulla concentrazione dei metaboliti.
Un problema importante legato alla durata dell'esperimento è la possibilità che l'impedenza dell'elettrodo aumenterà dopo il partecipante è nello scanner. Poiché tDCS può facilmente iniziare più che 45 minuti dopo il posizionamento degli elettrodi, vi è il rischio che gli elettrodi stimolanti gradualmente perdono aderenza al cuoio capelluto del partecipante, se l'applicazione della pasta non è ottimale e gli elettrodi non sono tenuti abbastanza saldamente. Se impedenza raggiunge più di 20 kΩ, la stimolazione non sarà possibile e il partecipante dovrà essere rimosso dallo scanner per risolvere il problema. Dal the procedimento descritto comporta l'acquisizione di più della stessa zona pre e post-tDCS, rimuovendo il partecipante dallo scanner può creare importante spostamento del voxel di interesse. E 'quindi molto importante per testare l'impedenza immediatamente prima della scansione e di fare molta attenzione durante l'installazione di elettrodi.
Teoricamente, la corrente di flusso della tDCS potrebbe produrre artefatti nel segnale MR. Antal e collaboratori 80 hanno studiato questo problema specifico misurando l'impatto delle diverse condizioni tDCS (con e senza elettrodi, con e senza stimolazione, ecc) sulla qualità delle immagini di risonanza magnetica funzionale. Tuttavia, a nostra conoscenza, non è ancora stata valutata la presenza di artefatti nel segnale spettroscopia a causa della presenza del dispositivo tDCS nello scanner.
Infine, occorre prestare attenzione per quanto riguarda le resistenze dei cavi degli elettrodi. Il campo MR può danneggiare le resistenze, quindi preventing stimolazione. Come misura precauzionale, la resistenza deve essere verificata al di fuori dell'ambiente dello scanner prima di ogni sessione di MRS. Inoltre, una impedenza superiore a 20 kΩ può causare reazioni cutanee e alta impedenza può riflettere un problema incipiente o effettivo con lo stimolatore. Pertanto, lo stimolatore deve essere controllato attentamente prima di ogni partecipante e di impedenza livelli controllato al di fuori della stanza dello scanner prima di ogni sessione di MRS.
TDCS combinate e 1 H-MRS è un potente strumento che fornisce una misura quantitativa dell'effetto dei trattamenti utilizzati clinicamente sul metabolismo cerebrale. Come il meccanismo fisiologico di effetti tDCS rimane poco compresa, vi è la necessità di approcci multimodali in grado di far luce su questi processi. Con il recente aumento di interesse tDCS come strumento clinico per patologie come ictus 27,30,31 e depressione 81, è chiaro che la combinazione di tDCS con MRS può essere un importantestrumento per comprendere meglio gli effetti terapeutici della tDCS. Inoltre, tDCS-MRS può servire come strumento presto per determinare quali pazienti hanno una migliore possibilità di rispondere in clinica per tDCS. Se viene trovata una tale indicatore, tDCS-MRS può essere utilizzato come test di screening prima di iscriversi pazienti in un intervento tDCS.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questi lavori è stato supportato da sovvenzioni dal Canadian Institutes of Health Research e le scienze naturali e ingegneria Research Council del Canada. ST è stato sostenuto da una borsa di studio Vanier Canada Graduate dal Canadian Institutes of Health Research. MM riconosce il sostegno da parte Biotechnology Research Center (BTRC) concessione P41 e P41 RR008079 EB015894 (NIBIB), e NCC P30 NS076408.
Vorremmo ringraziare Romain Valabrègue (Centre de Recherche de NeuroImagerie - CENIR, Parigi, Francia) e Brice Tiret (Centro Recherche de l'Institut de Universiatire Gériatrie (CRIUGM), Montréal, Canada; Commissariat à l'énergie atomique et aux énergies alternative (CEA), Parigi, Francia) per lo sviluppo di strumenti di elaborazione, e Edward J. Auerbach (Centro per la Risonanza Magnetica Ricerca e Dipartimento di Radiologia, Università del Minnesota, USA). Le sequenze MEGA-PRESS e FASTESTMAP sono stati sviluppatida Edward J. Auerbach e Małgorzata Marjańska e sono stati forniti dalla University of Minnesota nell'ambito di un accordo C2P.
Materiali
| Name | Company | Catalog Number | Comments |
| DC-stimulator plus | NeuroConn | 30DCS01E | MR compatible device |
| NuPrep preparation gel | Weaver and Co. | #10-61 | |
| Ten20 conductive paste | Weaver and Co. | #10-20-4 | |
| Electrode prepping pad | Grass technologies | MD0017 | 70% isopropyl alcohol and pumice |
| Saline solution | Local drugstore sample | 0.9% sodium chloride | |
| Non permanent hydro-marker | Sharpie | SHPE20WH | |
| SYNGO MR VB17 | Siemens AG | MRI software | |
| MAGNETOM Trio A Tim System | Siemens AG | MRI scanner version | |
| Matlab 2013a (Version 8.1) | MathWorks Inc | processing and analysis software | |
| LCModel 6.3 | LC MODEL inc | see: s-provencher.com | |
| FASTESTMAP | Developers: Edward J. Auerbach and Małgorzata Marjańska | shimming sequence | |
| MEGA-PRESS | Developers: Edward J. Auerbach and Małgorzata Marjańska | MRS sequence | |
Riferimenti
- Kellaway, P. The part played by electric fish in the early history of bioelectricity and electrotherapy. Bull. Hist. Med. 20 (2), 112-137 (1946).
- Brunoni, A. R., et al. Clinical research with transcranial direct current stimulation (tDCS): Challenges and future directions. Brain Stim. 5 (3), 175-195 (2011).
- Reis, J., Fritsch, B. Modulation of motor performance and motor learning by transcranial direct current stimulation. Curr. Opin. Neurol. 24 (6), 590-596 (2011).
- Boggio, P. S., et al. Repeated sessions of noninvasive brain DC stimulation is associated with motor function improvement in stroke patients. Restor. Neurol. Neuros. 25 (2), 123-129 (2007).
- Boggio, P. S., et al. Prefrontal cortex modulation using transcranial DC stimulation reduces alcohol craving: a double-blind, sham-controlled study. Drug Alcohol. Depend. 92 (1-3), 55-60 (2008).
- Fregni, F., et al. A sham-controlled, phase II trial of transcranial direct current stimulation for the treatment of central pain in traumatic spinal cord injury. Pain. 122 (1-2), 197-209 (2006).
- Fusco, A., et al. The ABC of tDCS: Effects of Anodal, Bilateral and Cathodal Montages of Transcranial Direct Current Stimulation in Patients with Stroke-A Pilot Study. Stroke Res. Treat. , 837595 (2013).
- Nitsche, M. A., et al. Modulation of cortical excitability by weak direct current stimulation--technical, safety and functional aspects. Suppl. Clin. Neurophysiol. 56, 255-276 (2003).
- Gandiga, P. C., Hummel, F. C., Cohen, L. G. Transcranial DC stimulation (tDCS): a tool for double-blind sham-controlled clinical studies in brain stimulation. Clin. Neurophysiol. 117 (4), 845-850 (2006).
- Poreisz, C., Boros, K., Antal, A., Paulus, W. Safety aspects of transcranial direct current stimulation concerning healthy subjects and patients. Brain Res. Bull. 72 (4-6), 208-214 (2007).
- Nitsche, M. A., Paulus, W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J. Physiol. 527 Pt 3, 633-639 (2000).
- Priori, A., Berardelli, A., Rona, S., Accornero, N., Manfredi, M. Polarization of the human motor cortex through the scalp. Neuroreport. 9 (10), 2257-2260 (1998).
- Fritsch, B., et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: potential implications for motor learning. Neuron. 66 (2), 198-204 (2010).
- Schulz, R., Gerloff, C., Hummel, F. C. Non-invasive brain stimulation in neurological diseases. Neuropharmacol. 64 (1), 579-587 (2013).
- Johansson, B. B. Current trends in stroke rehabilitation. A review with focus on brain plasticity. Acta Neurol. Scand. 123 (3), 147-159 (2011).
- Kandel, M., Beis, J. -. M., Le Chapelain, L., Guesdon, H., Paysant, J. Non-invasive cerebral stimulation for the upper limb rehabilitation after stroke: a review. Annals Phys. Rehab. Med. 55 (9-10), 657-680 (2012).
- Hummel, F. C., Cohen, L. G. Non-invasive brain stimulation: a new strategy to improve neurorehabilitation after stroke. Lancet Neurol. 5 (8), 708-712 (2006).
- Murase, N., Duque, J., Mazzocchio, R., Cohen, L. G. Influence of interhemispheric interactions on motor function in chronic stroke. Annals Neurol. 55 (3), 400-409 (2004).
- Adeyemo, B. O., Simis, M., Macea, D. D., Fregni, F. Systematic review of parameters of stimulation, clinical trial design characteristics, and motor outcomes in non-invasive brain stimulation in stroke. Front. Psychiatry. 3, 88 (2012).
- Butler, A. J., et al. A meta-analysis of the efficacy of anodal transcranial direct current stimulation for upper limb motor recovery in stroke survivors. J. Hand Ther. 26 (2), 162-170 (2013).
- Marquez, J., van Vliet, P., McElduff, P., Lagopoulos, J., Parsons, M. Transcranial direct current stimulation (tDCS): Does it have merit in stroke rehabilitation? A systematic review. Int. J. Stroke. , (2013).
- Hummel, F. C., et al. Facilitating skilled right hand motor function in older subjects by anodal polarization over the left primary motor cortex. Neurobiol. Aging. 31 (12), 2160-2168 (2010).
- Reis, J., et al. Noninvasive cortical stimulation enhances motor skill acquisition over multiple days through an effect on consolidation. PNAS. 106 (5), 1590-1595 (2009).
- Hesse, S., et al. Combined transcranial direct current stimulation and robot-assisted arm training in subacute stroke patients: a pilot study. Restor. Neurol. Neuros. 25 (1), 9-15 (2007).
- Madhavan, S., Weber, K. A., Stinear, J. W. Non-invasive brain stimulation enhances fine motor control of the hemiparetic ankle: implications for rehabilitation. Exp. Brain Res. 209 (1), 9-17 (2011).
- Tanaka, S., et al. Single session of transcranial direct current stimulation transiently increases knee extensor force in patients with hemiparetic stroke. Neurorehab. Neural Rep. 25 (6), 565-569 (2011).
- Mahmoudi, H., et al. Transcranial direct current stimulation: electrode montage in stroke. Disabil. Rehabil. 33 (15-16), 1383-1388 (2011).
- Mansur, C. G., et al. A sham stimulation-controlled trial of rTMS of the unaffected hemisphere in stroke patients. Neurology. 64 (10), 1802-1804 (2005).
- Fregni, F., et al. Transcranial direct current stimulation of the unaffected hemisphere in stroke patients. Neuroreport. 16 (14), 1551-1555 (2005).
- Lindenberg, R., Renga, V., Zhu, L. L., Nair, D., Schlaug, G. Bihemispheric brain stimulation facilitates motor recovery in chronic stroke patients. Neurology. 75 (24), 2176-2184 (2010).
- Bolognini, N., et al. Neurophysiological and behavioral effects of tDCS combined with constraint-induced movement therapy in poststroke patients. Neurorehab. Neural Rep. 25 (9), 819-829 (2011).
- Vines, B. W., Cerruti, C., Schlaug, G. Dual-hemisphere tDCS facilitates greater improvements for healthy subjects' non-dominant hand compared to uni-hemisphere stimulation. BMC Neurosci. 9, 103 (2008).
- Edwardson, M. A., Lucas, T. H., Carey, J. R., Fetz, E. E. New modalities of brain stimulation for stroke rehabilitation. Exp. Brain Res. 224 (3), 335-358 (2013).
- Stagg, C. J., et al. Polarity-sensitive modulation of cortical neurotransmitters by transcranial stimulation. J. Neurosci. 29 (16), 5202-5206 (2009).
- Clark, V. P., Coffman, B. A., Trumbo, M. C., Gasparovic, C. Transcranial direct current stimulation (tDCS) produces localized and specific alterations in neurochemistry: a H magnetic resonance spectroscopy study. Neurosci. Lett. 500 (1), 67-71 (2011).
- Liebetanz, D., Nitsche, M. A., Tergau, F., Paulus, W. Pharmacological approach to the mechanisms of transcranial DC-stimulation-induced after-effects of human motor cortex excitability. Brain. 125 (10), 2238-2247 (2002).
- Nitsche, M. A., et al. Pharmacological modulation of cortical excitability shifts induced by transcranial direct current stimulation in humans. J. Physiol. 553 (Pt 1), 293-301 (2003).
- Nitsche, M. A., et al. Consolidation of human motor cortical neuroplasticity by D-cycloserine). Neuropsychopharmacol. 29 (8), 1573-1578 (2004).
- Shors, T. J., Matzel, L. D. Long-term potentiation: what's learning got to do with it. Behav. Brain Sci. 20 (4), 597-614 (1997).
- Miyamoto, E. Molecular mechanism of neuronal plasticity: induction and maintenance of long-term potentiation in the hippocampus. J. Pharmacol. Sci. 100 (5), 433-442 (2006).
- Puts, N. A. J., Edden, R. A. E. In vivo magnetic resonance spectroscopy of GABA: a methodological review. Prog. Nucl. Magn. Reson. Spectrosc. 60, 29-41 (2012).
- Tkác, I., Oz, G., Adriany, G., Ugurbil, K., Gruetter, R. In vivo 1H NMR spectroscopy of the human brain at high magnetic fields: metabolite quantification at 4T vs. 7T. Magn. Res. Med. 62 (4), 868-879 (2009).
- Marjanska, M., et al. Localized 1H NMR spectroscopy in different regions of human brain in vivo at 7 T2 relaxation times and concentrations of cerebral metabolites. NMR Biomed. 25 (2), 332-339 (2012).
- Mescher, M., Merkle, H., Kirsch, J., Garwood, M., Gruetter, R. Simultaneous in vivo spectral editing and water suppression. NMR Biomed. 11 (6), 266-272 (1998).
- Mescher, M., Tannus, A., Johnson, M. O., Garwood, M. Solvent suppression using selective echo dephasing. J. Magn. Res. Series A. 123, 226-229 (1996).
- Stagg, C. J., Bachtiar, V., Johansen-Berg, H. The role of GABA in human motor learning. Curr. Biol. 21 (6), 480-484 (2011).
- Rango, M., et al. Myoinositol content in the human brain is modified by transcranial direct current stimulation in a matter of minutes: a 1H-MRS study. Magn. Reson. Med. 60 (4), 782-789 (2008).
- Bastani, A., Jaberzadeh, S. a-tDCS Differential Modulation of Corticospinal Excitability: The Effects of Electrode Size. Brain Stim. 6 (6), 932-937 (2013).
- Yousry, T. A., et al. Localization of the motor hand area to a knob on the precentral gyrus. A new landmark. Brain. 120 (Pt 1), 141-157 (1997).
- Gruetter, R., Tkác, I. Field mapping without reference scan using asymmetric echo-planar techniques). Magn. Res. Med. 43 (2), 319-323 (2000).
- Tkác, I., Starcuk, Z., Choi, I. Y., Gruetter, R. In vivo 1H NMR spectroscopy of rat brain at 1 ms echo time. Magn. Res. Med. 41 (4), 649-656 (1999).
- Provencher, S. W. Estimation of metabolite concentrations from localized in vivo proton NMR spectra. Magn. Res. Med. 30 (6), 672-679 (1993).
- Oz, G., et al. Assessment of adrenoleukodystrophy lesions by high field MRS in non-sedated pediatric patients. Neurology. 64 (3), 434-441 (2005).
- Henry, P. -. G., et al. Brain energy metabolism and neurotransmission at near-freezing temperatures: in vivo (1)H MRS study of a hibernating mammal. J. Neurochem. 101 (6), 1505-1515 (2007).
- Westman, E., et al. In vivo 1H-magnetic resonance spectroscopy can detect metabolic changes in APP/PS1 mice after donepezil treatment. BMC Neurosci. 10, 33 (2009).
- DaSilva, A. F., Volz, M. S., Bikson, M., Fregni, F. Electrode positioning and montage in transcranial direct current stimulation. J. Vis. Exp. (51), (2011).
- Nitsche, M. A., et al. Transcranial direct current stimulation: State of the art. Brain Stim. 1 (3), (2008).
- Brunoni, A. R., et al. A systematic review on reporting and assessment of adverse effects associated with transcranial direct current stimulation. Int. J. Neuropsychopharmacol. 14 (8), 1133-1145 (2011).
- Zaitsev, M., Speck, O., Hennig, J., Büchert, M. Single-voxel MRS with prospective motion correction and retrospective frequency correction. NMR Biomed. 23, 325-332 (2010).
- Henry, P. -. G., et al. Proton-observed carbon-edited NMR spectroscopy in strongly coupled second-order spin systems. Magn. Res. Med. 55 (2), 250-257 (2006).
- Govindaraju, V., Young, K., Maudsley, A. A. Proton NMR chemical shifts and coupling constants for brain metabolites. NMR Biomed. 13 (3), 129-153 (2000).
- Pfeuffer, J., Tkác, I., Provencher, S. W., Gruetter, R. Toward an in vivo neurochemical profile: quantification of 18 metabolites in short-echo-time (1)H NMR spectra of the rat brain. J. Magn. Res. 141 (1), 104-120 (1999).
- Adler, C. M., et al. Neurochemical effects of quetiapine in patients with bipolar mania: a proton magnetic resonance spectroscopy study. J. Clin. Psychopharmacol. 33 (4), 528-532 (2013).
- Aoki, Y., Inokuchi, R., Suwa, H. Reduced N-acetylaspartate in the hippocampus in patients with fibromyalgia: A meta-analysis. Psychiatry Res. 213 (3), 242-248 (2013).
- Zahr, N. M., et al. In glutamate measured with magnetic resonance spectroscopy: behavioral correlates in aging. Neurobiol. Aging. 34 (4), 1265-1276 (2013).
- Reyngoudt, H., et al. Does visual cortex lactate increase following photic stimulation in migraine without aura patients? A functional (1)H-MRS study. J. Headache Pain. 12 (3), 295-302 (2011).
- Nenadic, I., et al. Superior temporal metabolic changes related to auditory hallucinations: a (31)P-MR spectroscopy study in antipsychotic-free schizophrenia patients. Brain Struct. Funct. , (2013).
- Currie, S., et al. Magnetic resonance spectroscopy of the brain. Postgrad. Med. J. 89 (1048), 94-106 (2013).
- Stagg, C. J. Magnetic Resonance Spectroscopy as a tool to study the role of GABA in motor-cortical plasticity. NeuroImage. , (2013).
- Bottomley, P. A. Spatial localization in NMR spectroscopy in vivo. Ann. N. Y. Acad. Sci. , 333-348 (1987).
- Frahm, J., et al. Localized high-resolution proton NMR spectroscopy using stimulated echoes: initial applications to human brain in vivo. Magn. Res. Med. 9 (1), 79-93 (1989).
- Gussew, A., et al. Absolute quantitation of brain metabolites with respect to heterogeneous tissue compositions in (1)H-MR spectroscopic volumes. Mag. Res. Mat. Phys. 25 (5), 321-333 (2012).
- Gasparovic, C., et al. Use of tissue water as a concentration reference for proton spectroscopic imaging. Magn. Res. Med. 55 (6), 1219-1226 (2006).
- Nitsche, M. A., et al. MRI study of human brain exposed to weak direct current stimulation of the frontal cortex. Clin. Neurophysiol. 115 (10), 2419-2423 (2004).
- Miranda, P. C., Faria, P., Hallett, M. What does the ratio of injected current to electrode area tell us about current density in the brain during tDCS?. Clin. Neurophysiol. 120 (6), 1183-1187 (2009).
- Faria, P., Leal, A., Miranda, P. C. Comparing different electrode configurations using the 10-10 international system in tDCS: a finite element model analysis. IEEE Engineering Med. Biol. Soc. 2009, 1596-1599 (2009).
- Schestatsky, P., Morales-Quezada, L., Fregni, F. Simultaneous EEG monitoring during transcranial direct current stimulation. J. Vis. Exp. (76), 1-11 (2013).
- Reidler, J. S., Zaghi, S., Fregni, F., Coben, R., Evans, J. R. Chapter 12. Neurophysiological Effects of Transcranial Direct Current Stimulation. Neurofeedback and neuromodulation techniques and applications. , (2011).
- Zheng, X., Alsop, D. C., Schlaug, G. Effects of transcranial direct current stimulation (tDCS) on human regional cerebral blood flow. NeuroImage. 58 (1), 26-33 (2011).
- Antal, A., Polanía, R., Schmidt-Samoa, C., Dechent, P., Paulus, W. Transcranial direct current stimulation over the primary motor cortex during fMRI. NeuroImage. 55 (2), 590-596 (2011).
- Brunoni, A. R., et al. The sertraline vs. electrical current therapy for treating depression clinical study: results from a factorial, randomized, controlled trial. JAMA Psychiatry. 70, 383-391 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon