Method Article
FtsZ polimerizzazione saggi: protocolli semplici e considerazioni
In questo articolo
Riepilogo
Polimerizzazione di FtsZ è essenziale per la divisione cellulare batterica. In questo rapporto, dettaglio semplici protocolli per monitorare l'attività di polimerizzazione FtsZ e discutere l'influenza della composizione del tampone. I protocolli possono essere usati per studiare l'interazione di FtsZ con proteine regolatrici o farmaci antibatterici che influiscono FtsZ polimerizzazione.
Abstract
Durante la divisione cellulare batterica, la proteina FtsZ essenziale assembla nel mezzo della cellula per formare il cosiddetto Z-ring. FtsZ polimerizza in lunghi filamenti in presenza di GTP in vitro, e la polimerizzazione è regolata da numerose proteine accessorie. FtsZ polimerizzazione è stata ampiamente studiata in vitro utilizzando metodi di base, tra cui la dispersione della luce, sedimentazione, GTP saggi di idrolisi e la microscopia elettronica. Condizioni di buffer influenza sia le proprietà di polimerizzazione di FtsZ, e la capacità di FtsZ di interagire con proteine regolatrici. Qui, descriviamo i protocolli per gli studi di polimerizzazione FtsZ e validare le condizioni ei controlli utilizzando Escherichia coli e Bacillus subtilis FtsZ come proteine modello. Un test di sedimentazione a bassa velocità viene introdotta che consente lo studio dell'interazione di FtsZ con proteine che abbinata o tubulate polimeri FtsZ. Una migliore protocollo del saggio GTPase è descritto che permette il testidrolisi di GTP nel tempo utilizzando varie condizioni in una configurazione di piastra a 96 pozzetti, con tempi di incubazione standardizzati che aboliscono variazione di sviluppo del colore nella reazione di rilevamento fosfato. La preparazione dei campioni per gli studi di diffrazione della luce e la microscopia elettronica è descritto. Diversi buffer vengono utilizzati per stabilire adatto pH buffer e concentrazione di sale per gli studi di polimerizzazione FtsZ. Un'elevata concentrazione di KCl è la migliore per la maggior parte degli esperimenti. I nostri metodi forniscono un punto di partenza per la caratterizzazione in vitro di FtsZ, non solo da E. coli e B. subtilis ma da qualsiasi altro batterio. Come tali, i metodi possono essere utilizzati per gli studi di interazione di FtsZ con proteine regolatrici o alla sperimentazione di farmaci antibatterici che possono influire polimerizzazione FtsZ.
Introduzione
La proteina batterica FtsZ essenziale è la migliore proteina caratterizzata della macchina divisione cellulare batterica. FtsZ è l'omologo procariotica di tubulina e polimerizza in vitro in modo dipendente GTP. FtsZ è un obiettivo molto attraente per i nuovi antibiotici a causa della sua natura incontaminata e unicità ai batteri 1,2. All'inizio della divisione cellulare, FtsZ forma un anello cytokinetic a midcell, che serve come impalcatura per l'assemblaggio di altre proteine divisione cellulare. Formazione del Z-ring è fondamentale per la corretta localizzazione del piano di divisione. Le dinamiche di assemblaggio di FtsZ sono regolati da diverse proteine accessorie, quali (a seconda delle specie batteriche) Minc, SepF, Zapa, UgtP, ed Ezra 2. FtsZ polimerizzazione è stato intensamente studiato in vitro e molte strutture tra cui protofilamenti dritte, curve protofilamenti, fogli di filamenti, fasci di filamenti e tubi di filamenti sono stati described seconda buffer assemblaggio, nucleotide, e proteine addizionali incluse nel saggio 3. L'architettura di protofilamenti FtsZ in vivo non è ancora pienamente compreso, anche se gli esperimenti di elettroni cryotomography in Caulobacter crescentus suggeriscono che la Z-anello viene assemblato da relativamente brevi, non continui singoli protofilamenti senza una bundling 4.
In vitro, le proprietà di polimerizzazione FtsZ e l'interazione di FtsZ con proteine regolatrici sono sensibili alla composizione del tampone di reazione. Ad esempio, abbiamo recentemente descritto il luogo di interazione per SepF sul FtsZ C-terminale e ha mostrato che un troncamento Δ16 C-terminale FtsZ B non si lega a SepF 5. In un precedente studio sull'interazione SepF-FtsZ B, una simile FtsZ B Δ16 troncare ancora cosedimented con SepF, che ha suggerito che SepF lega ad un sito secondario in FtsZ 6. La differenza tra questi studi era la composizione di buffer-a pH 7,5 reazione non c'era cosedimentation di SepF con il troncamento FtsZ, mentre a pH 6.5 c'era cosedimentation. Gündoğdu et al. notato che SepF non è funzionale e precipita a pH 6,5 7, dimostrando che la cosedimentation osservata a pH 6,5 è probabile che sia causata da precipitazione di SepF anziché interazione con il troncamento Δ16 C-terminale FtsZ B. L'influenza del pH e concentrazione di KCl sulla polimerizzazione di FtsZ è stato esaminato in precedenza. Polimeri di E. coli FtsZ (FtsZ Ec) a pH 6.5 sono più lunghi e più abbondanti di quelle formate a 8,9 pH neutro. Tadros et al. hanno studiato la polimerizzazione di FtsZ Ec in presenza di cationi monovalenti rilevando che K + associazione è legata al FtsZ Ec polimerizzazione ed è cruciale per l'attività FtsZ 10. Il pH è più Critical quando l'interazione di FtsZ con altre proteine è studiato, come dimostra l'esempio precedente del SepF, e la dipendenza pH dell'effetto inibitorio di Minc su FtsZ 11. Poiché sia pH e concentrazione salina possono influenzare l'interazione di FtsZ con altre proteine, è importante scegliere le giuste condizioni ei controlli per gli studi di polimerizzazione FtsZ.
Qui descriviamo protocolli di studiare FtsZ polimerizzazione e attività GTPasica dalla dispersione della luce, microscopia elettronica, la sedimentazione, e saggi GTPasi. Destra light scattering angolo è un metodo standard per studiare FtsZ polimerizzazione in tempo reale 12. Noi introdotto alcuni miglioramenti per il test di sedimentazione e GTPase. Vi presentiamo in dettaglio come preparare i campioni per diffusione della luce e la microscopia elettronica. Diversi buffer utilizzati in letteratura per studiare FtsZ polimerizzazione sono stati testati e si descrivono le migliori condizioni per ogni esperimento. Mostriamo anche che i controlli devono essereintrodotto per ottenere i migliori dati.
Questi metodi consentono un breve studio di FtsZ polimerizzazione, l'attività e l'interazione con altre proteine con metodi e apparecchiature che è disponibile nella maggior parte dei laboratori semplici. Esistono metodi più sofisticati per studiare FtsZ polimerizzazione, ma spesso richiedono l'accesso ad attrezzature più specializzate, e / o la modifica di FtsZ con le etichette fluorescenti 8,13,14. Semplici metodi descritti nel presente documento sono illustrati utilizzando FtsZ da B. subtilis e E. coli, il più comune Gram + e Gram-modello. I protocolli sono adattati a qualsiasi altra proteina FtsZ. Sulla base delle analisi preliminari con questi nuovi FtsZs, lievi modifiche per quanto riguarda il tempo, tampone o temperatura di incubazione può essere necessario per un risultato ottimale. Gli esperimenti qui descritti dovrebbero aiutare a trovare queste condizioni ottimali.
Protocollo
Proteine FtsZ senza tag sono state purificate come descritto in precedenza 11,15, dializzato contro 20 mM Tris / HCl (pH 7,9), 50 mM KCl, 1 mM EGTA, 2.5 MgAc mM e 10% glicerolo e conservati a -80 ° C. In queste condizioni la proteina può essere conservato per oltre 2 anni senza una significativa perdita di attività. La proteina deve essere conservato in aliquote di 100 microlitri per evitare lo scongelamento e congelamento del campione. Dopo lo scongelamento, il campione può essere conservato a 4 ° C per massimo una settimana. FtsZ è solubile a concentrazioni elevate e può essere conservato a 7-10 mg / ml. È importante mantenere la concentrazione proteica alta per evitare effetti indesiderati di componenti del tampone di stoccaggio in esperimenti successivi. Così, la concentrazione di stoccaggio dovrebbe consentire una diluizione di FtsZ di almeno 10x per portare la concentrazione di glicerolo inferiore all'1% e ridurre al minimo la concentrazione degli altri componenti del tampone di dialisi nella miscela di reazione. FtsZ polimerizzazione può essere influenzato anche dalla presenza di sodio ad alta 9 o imidazolo quindi questi componenti devono essere rimossi dal buffer polimerizzazione. SepF stato purificato come descritto 7 e memorizzato in tampone di eluizione a -80 ° C. Procedure pubblicate alternative per la depurazione delle FtsZ da E. coli e B. subtilis nonché riferimenti alle procedure di purificazione di FtsZ da fonti diverse sono riassunti nella Tabella 1 (vedi risultati rappresentativi sezione).
1. Preparazione del campione
- Preparare buffer di polimerizzazione:
1 50 mM Hepes / NaOH, pH 7.5 2 TUBI 25 mm / NaOH, pH 6.8 3 MES 50 mM / NaOH, pH 6.5 4 50 mM Hepes / NaOH, pH 7,5; 50 mM KCl 5 TUBI 25 mm / NaOH, pH 6.8, 50 mM KCl 6 50 mm mES / NaOH, pH 6.5, 50 mM KCl 7 50 mM Hepes / NaOH, pH 7.5, KCl 300 mM 8 TUBI 25 mm / NaOH, pH 6.8, KCl 300 mM 9 MES 50 mm / NaOH, pH 6.5, KCl 300 mM - Filtrare sterilizzare tutti i buffer usando un filtro a membrana 22 micron.
- Preparare GTP 100 mm, due soluzioni madre PIL e MgCl in ogni buffer di polimerizzazione da (1).
- Preclear le proteine mediante filatura a 100.000 xg per 20 min a 4 ° C per tutti gli esperimenti.
2. FtsZ sedimentazione di analisi
- Preparare la miscela di reazione per aggiunta di MgCl 2 e FtsZ ad uno dei buffer di polimerizzazione (vedi punto campione preparazione 1) in provette compatibili con centrifugazione ad alta velocità. Il volume totale dovrebbe essere 49 microlitri, con MgCl 2 a 10 mm e FtsZ a 12 micron a 50 microlitri volume finale.
- Pallacciare il tubo in un incubatore con funzione di scuotimento, incubare per 2 minuti a 30 ° C a 300 rpm (in alternativa il campione può essere colpita delicatamente e brevemente microfuged seguito da preriscaldamento a 30 ° C).
- Inizia polimerizzazione aggiungendo 1 ml di GTP o GDP soluzione madre nello stesso tampone come usato nell'esperimento (concentrazione finale di 2 mM). Incubare per 10 min o 2 (per i buffer con 50 mM KCl e KCl 300 mM, rispettivamente) a 30 ° C a 300 rpm (o in un incubatore con agitazione della funzione).
- Trasferire i tubi di un rotore ultracentrifuga e spin down per 10 min a 350.000 xg (89.700 rpm per TLA 120.1 rotore) a 25 ° C.
- Dopo la filatura, rimuovere con cautela le provette dal rotore e immediatamente trasferire il surnatante in una provetta pulita. Preparare i campioni per SDS-PAGE con l'aggiunta di 20 ml di surnatante a 20 ml di tampone campione 2x. Bollire per 10 min a 98 ° C.
- Aggiungere 50 ml di tampone campione 2x per la frazione di pellet contenente Ftpolimeri Tg. Posizionare il tubo ultracentrifuga in un tubo da 2 ml. Risospendere il pellet facendo bollire per 10 min a 98 ° C, quindi si aggiungono 50 ml di H 2 O demineralizzata per rendere il campione stesso diluizione 2x come il campione supernatante.
- Girare il tubo ultracentrifuga a testa in giù nel tubo di 2 ml e centrifugare per 5 minuti in una centrifuga Eppendorf a 18.000 x g. Rimuovere il tubo ultracentrifuga dal tubo di 2 ml.
- Carico 10 microlitri di ciascun supernatante e laterale campione pellet a fianco su un gel SDS-PAGE 10%. Attivare il gel a 150 V.
- Colorare il gel con Coomassie Brilliant Blu G-250 e continuare per la quantificazione.
3. FtsZ sedimentazione di analisi a Slow Spin
- Preparare polimerizzazione in soluzione come al punto 2, aggiungere SepF e / o FtsZ (concentrazione finale 12 micron). Questi esperimenti possono essere eseguiti in Beckman monouso provette da 1,5 ml in combinazione con un rotore TLA-55.
- Porre il tubo in un incubatore con agitazione function e incubare per 2 minuti a 30 ° C a 300 rpm.
- Inizia polimerizzazione dai aggiungendo 1 ml di GTP o GDP da una soluzione madre (concentrazione finale 2 mm), incubare per 20 minuti a 30 ° C a 300 rpm.
- Spin down per 15 minuti a 24.600 xg (20.000 rpm per TLA 55 rotore) a 25 ° C.
- Rimuovere il surnatante e trasferire in una provetta pulita, prendere 20 ml e trasferire in 20 ml di tampone campione 2x. Bollire per 10 min a 98 ° C.
- Aggiungere 50 ml di tampone campione 2x a pellet frazione contenente polimeri e risospendere facendo bollire per 10 min a 98 ° C, aggiungere 50 ml di H 2 O. demineralizzata
- Carico 10 microlitri di ciascun supernatante e laterale campione pellet a fianco su un gel SDS-PAGE 10%. Attivare il gel a 150 V.
- Colorare il gel con Coomassie Brilliant Blu G-250 e continuare per la quantificazione.
4. Quantificazione dei FtsZ sedimentazione saggi
- Scatta una foto della stazione Coomassiegel ined utilizzando un sistema di documentazione gel (es LAS-4000, Fujifilm).
- Apri l'immagine gel in un programma per l'analisi densitometrica dei gel (es AIDA programma analizzatore di immagini (Raytest)) e descrivere analisi in questo programma di seguito.
- Fare clic sul pulsante "Valutazione" nella barra degli strumenti.
- Selezionare l'opzione "2D Densitometria" dall'elenco e fare clic su OK.
- Nel menu principale, fare clic su "Valutazione" e scegliere la voce "Determinazione Regione".
- Per creare una regione sul gel, fare clic sul simbolo di strumento di Auto-profilo nella determinazione degli strumenti Region.
- Fare clic nell'angolo superiore sinistro della band proteine sul gel, tenere premuto il pulsante del mouse e trascinare fino alla fine in basso a destra desiderato della band e rilasciare il pulsante del mouse.
- Mark ciascuna banda FtsZ / SepF nello stesso modo.
- Tutte le informazioni sulla valutazione delle regioni assegnate può essere trovata nel Rapporto Region. Per ottenere il Region rapporto, fare clic sul pulsante "Mostra regione Report" nella casella degli strumenti regione Determinazione.
- Per esportare il report, nel menu principale, fare clic su File e scegliere "Esporta à 2D Regione Report" voce.
- Nella relazione regione, l'intensità di ogni regione creata dovrebbe essere trovato. Calcolare la percentuale di proteine (FtsZ, proteina regolatrice) nel pellet utilizzando i valori di intensità dalla relazione.
5. 90 ° Light Scattering
- Accendere uno spettrometro a fluorescenza (ad es Aminco-Bowman Series 2), attendere che la lampada si riscaldi per alcuni minuti per evitare fluttuazioni termiche e accendere un bagno di acqua circolante per mantenere la temperatura della camera cuvetta a 30 ° C.
- Definire i parametri di funzionamento dello spettrometro: rivelatore di alta tensione a 300 V, emissione e di eccitazione lunghezza d'onda di 350 nm, larghezza della fenditura: 4 nm. Si noti che molti spettrometri regolare automaticamente il segnale all'inizio di un esperimento per un Certain percentuale (ad esempio 60%) del massimo. Questo provoca un segnale dispersione di andare fuori portata, non appena viene aggiunto GTP a polimerizzare FtsZ. E 'consigliabile stabilire prima il giusto segnale di amplificazione-detector ad alta tensione per la polimerizzazione massimo prima di iniziare una serie di esperimenti.
- Programmare un protocollo di acquisizione dati. Scegliere acquisizione basata sul tempo, con una durata di 3.600 sec.
- Pulire accuratamente una cuvetta fluorescenza con acqua ed etanolo, se necessario: ultrasuoni a bagnomaria a temperatura ambiente per 5 min. In questo protocollo, cuvette con un 1 cm di cammino e un volume di 200 microlitri sono stati utilizzati e conservati nella soluzione di conservazione (0,5-1% HELLMANEX). In alternativa, può essere utilizzato monouso cuvette di plastica compatibile-UV (UVette, Eppendorf).
- Preparare 294 ml di una master mix del buffer di polimerizzazione (vedi esempio punto di preparazione 1) con 10 mM MgCl 2 e 12 micron FtsZ come concentrazione finale calcolato per 300 ml, e vortex.
- Trasferire 196 microlitri di buffer polimerizzazione alla cuvetta e posizionarlo nella spettrometro. Incubare per 2 min a 30 ° C.
- Avviare l'acquisizione dei dati e attendere 90 sec per verificare che il segnale è stabile.
- Aggiungere 4 ml di GTP 100 mM o PIL (concentrazione finale: 2 mM) per ottenere un volume finale di reazione di 200 ml, pipetta su e giù con una pipetta di volume più grande per mescolare e riprendere acquisizione.
6. Transmission Electron Microscopy
- Preparare i campioni per il dosaggio sedimentazione FtsZ (il volume può essere ridotto a 10 microlitri volume finale di risparmiare materiale).
- Dopo il periodo di incubazione, applicare 2 ml di campione su un 400 griglia di rame carbonio rivestito di maglia glow-scarica, incubare per 15 sec.
- Tamponare la griglia secco sfiorando o trascinando la griglia parallelo o perpendicolare ad un pezzo di carta da filtro.
- Macchiare la griglia con 4 ml di una soluzione di acetato di uranile-2%. Blot griglia secco come descritto al punto 6.3.
- Visualizzare la griglia in un microscopio elettronico Philips CM120 operante a 120 kV a 39.200 X di ingrandimento.
7. GTP idrolisi Assay
Il setup dell'esperimento è progettato in modo tale che GTP idrolisi di FtsZ viene fermata dopo diversi tempi di reazione miscelando la reazione con verde malachite. In questo modo, il tempo di sviluppo di colore verde malachite è la stessa per ogni campione.
- Preparare ml 2 mM GTP 1.5 in uno dei buffer di polimerizzazione (vedi preparazione del campione, punto 1).
Preparare una 0-40 mM fosfato diluizione standard in un buffer di polimerizzazione, e preparare malachite reagente lavoro verde come descritto nel POMG-25H (test Bio) kit. In alternativa, reagenti di lavoro possono essere preparati in casa secondo i protocolli descritti da Lanzetta et al. 16 - Preparare master mix in un volume totale di 360 microlitri: Io 24 micron FtsZ B, 20 mM MgCl 2, buffer di polimerizzazione II 12 pM FtsZ Ec, 20 mM MgCl 2, tampone polimerizzazione III (controllo 1) 24 micron FtsZ B, 2 mM EDTA, tampone di polimerizzazione IV (controllo 2) 12 micron FtsZ Ec, 2 mM EDTA, tampone di polimerizzazione
- Pipettare 20 microlitri aliquote dei Master Mix, 100 standard microlitri di fosfato e 180 ml di 2 mM GTP in una piastra a 96 pozzetti qPCR nel seguente ordine:
La B C D E F Sol H 1 III III Io Io IV IV II II 2 III III Io Io IV IV II II 3 III III Io Io IV IV II II 4 III III Io Io IV IV II II 5 III III Io Io IV IV II II 6 III III Io Io IV IV II II 7 III III Io Io IV IV II II 8 III III Io Io IV IV II II 9 PS PS PS PS PS PS PS PS 10 PS PS PS PS PS PS PS PS 11 12 GTP GTP GTP GTP GTP GTP GTP GTP
PS - standard di fosfato - Posizionare la piastra qPCR in una macchina PCR con il programma impostato a 40 min ciclo a 30 ° C.
- Preparare 20 aliquote microlitri di malachite reagente di lavoro verde in una piastra a 96 pozzetti. Aggiungere 60 ml di tampone di polimerizzazione dall'esperimento a corsie 1'-8. Il campione sarà diluito 4 volte rispetto allo standard fosfato, perche questo fatto durante i calcoli finali.
La B C D E F Sol H 1 ' III III Io Io IV IV II II 2 ' III III Io Io IV IV II II 3 ' III III Io Io IV IV II II 4 ' III III Io Io IV IV II II 5 ' III III Io Io IV IV II II 6 ' III III Io Io IV IV II II 7 ' III III Io Io IV IV II II 8 ' III III Io Io IV IV II II 9 ' PS PS PS PS PS PS PS PS 10 ' PS PS PS PS PS PS PS PS - Aggiungere 20 ml di GTP a corsia 1, pipetta su e giù per mescolare, avviare il timer (questo è il punto ora di inizio per la reazione 30 min).
- Dopo 10 min, 30 sec aggiungi GTP alla corsia 2, pipetta su e giù per miscelare (20 min di reazione).
- Dopo 16 minuti aggiungere GTP alla corsia 3, pipetta su e giù per mescolare (15 min reazione).
- Dopo 21 min, 30 sec aggiungi GTP alla corsia 4, pipetta su e giù per mescolare (10 min reazione).
- Dopo 25 minuti aggiungere GTP alla corsia 5, pipetta su e giù per mescolare (reazione 7 min).
- Dopo 27 min, 30 sec aggiungi GTP alla corsia 6, pipetta su e giù per mescolare (reazione 5 min).
- Dopo 29 minuti aggiungere GTP alla corsia 7, pipetta su e giù per mescolare (reazione 4 min) ..
- Dopo 30 min di trasferimento 20 microlitri di corsia 1 in corsia 1 ', pipetta su e giù per mescolare (punto di malachite sviluppo di colore verde di inizio del 30 min reazione).
- Dopo 30 min, 30 sec transfer 20 microlitri da corsia 2 a 2 ', pipetta su e giù per mescolare (punto iniziale di sviluppo di colore verde malachite per la reazione 20 min).
- Ripetere l'operazione per le corsie 3-7 ogni 30 sec.
- Dopo 33 min, 30 sec aggiungere 20 ml di GTP Lane 8, pipetta su e giù per mescolare e trasferire 20 microlitri di corsia 8 ', pipetta su e giù per mescolare (0 min di reazione e punto di partenza di tempo per malachite sviluppo del colore verde per la reazione).
- Dopo 34 min aggiungere 80 microlitri da corsia 9 a 9 ', pipetta su e giù per miscelare (punto di tempo di partenza per lo sviluppo di colore verde malachite per lo standard fosfato 1).
- Dopo 34 min di trasferimento 30 sec 80 microlitri di corsia 10 a 10 ', pipetta su e giù per mescolare (il punto di tempo di inizio malachite sviluppo del colore verde per lo standard fosfato 2).
- Rimuovere tutte le bolle d'aria dai campioni e incubare la piastra a temperatura ambiente per altri 25 min30 sec.
- Porre la piastra in 96 pozzetti lettore di piastra.
- Dopo 60 min misurare la piastra 10x ogni 30 sec a lunghezza d'onda di 630 nm (malachite sviluppo del colore verde è ora 30 min per la prima reazione). Ogni misura corrisponde ad ogni punto di tempo da passaggi 7,6-7,12 e 7,16 e deve essere calcolato separatamente per un analisi dei dati.
- Calcolare il fosfato gratuito in ogni campione utilizzando la curva di calibrazione standard fosfato.
- Tracciare i dati come il rilascio di fosfati nel tempo, e calcolare l'attività di idrolisi FtsZ GTP della gamma lineare della curva.
Risultati
Purificazione di FtsZ da diverse fonti batteriche è stata descritta in letteratura ed è riassunto in Tabella 1.
| Fonte | Metodo | Modifica | Rendimento ottenuto [mg / L della cultura]> | Riferimenti |
| B. subtilis | 1) cromatografia a scambio ammonio solfato di precipitazione / ione | no | 40 | Questo lavoro, 11,15 |
| 2) Cromatografia di affinità | His-tag | ND | 17 | |
| E. coli | 1) cromatografia a scambio ammonio solfato di precipitazione / ione | no | 35 | Questo lavoro, 11,15 |
| 2) precipitazione di calcio, cromatografia a scambio ionico | no | 40 | 18 | |
| Methanococcus jannaschii | 1) cromatografia di affinità in condizioni denaturanti / ripiegamento / ammonio solfato precipitazione / gel filtrazione | His-tag | 1.3 | 19 |
| 2) filtrazione cromatografia di affinità / gel | His-tag | ND | 20 | |
| Thermotoga maritima | Filtrazione cromatografia a scambio ionico / gel | no | 6.7 | 19 |
| Pseudomonas aeruginosa | Filtrazione cromatografia / gel di affinità | Strep-tag, His-tag | ND | 21 |
| Mycobacterium tuberculosis | 1) cromatografia a scambio Affinity / ione | no | ND | 22 |
| 2) filtrazione cromatografia di affinità / gel | no | 30 | 23 | |
| Aquifex aeolicus | Filtrazione cromatografia / gel di affinità | His-tag, troncamento C-terminale (331-367) | ND | 24 |
| Caulobacter crescentus | Solfato di cromatografia a scambio ionico / ammonio precipitazione / gel filtrazione | no | ND | 25 |
Tabella 1. Protocolli di purificazione FtsZ descritti. ND: non determinato.
La sedimentazione di polimeri FtsZ
Inizialmente, abbiamo utilizzato due diverse velocità di spin down polimeri FtsZ. Abbiamo scoperto che solo a una velocità di 350.000 XG singoli polimeri di FtsZ Ec si girò verso il basso (Figura 1), mentre a 190.000 xg solo fasci di FtsZ B sono presenti nella frazione di pellet (dati non riportati). Pertanto 350.000 xg stato usato nella nostra pellicciaesperimenti ther. La percentuale di polimerizzato FtsZ Ec e FtsZ B è simile a 50 mM KCl anche se gli esperimenti di scattering di luce hanno rivelato un segnale di dispersione molto più elevato per FtsZ breakfast. Ciò è dovuto a pacchetti formati da FtsZ B che disperdono più luce di singoli polimeri di FtsZ Ec. Non era possibile avere elevata quantità di polimeri FtsZ nella frazione di pellet nell'esperimento con KCl 300 mM sia FtsZ Ec e FtsZ B (Figura 1). Noi attribuiamo ad una combinazione di rapido smontaggio delle strutture FtsZ e diminuita accorpamento dei filamenti.
Sedimentazione dei tubuli FtsZ-SepF
Per analizzare l'interazione di FtsZ con alcuni attivatori saggi sedimentazione possono essere eseguite a velocità di centrifugazione inferiori. A questa velocità solo le grandi strutture di FtsZ possono essere pellet, ad esempio, i grandi tubuli formati da anelli SepF und FtsZ B Filamenti 5, oppure i pacchetti formati da FtsZ e Zapa. Abbiamo usato centrifugazione inferiore (24.600 xg) per dimostrare la fattibilità di questo approccio per i tubuli formati da FtsZ e SepF. FtsZ stato recuperato nel precipitato di sopra dei livelli di fondo solo quando entrambi SepF e GTP erano presenti nel campione (Figura 2), e la presenza di SepF non influenza l'attività GTPasi FtsZ 7 mostra che FtsZ è pienamente attiva in presenza di SepF. Sedimentazione specifica di SepF e FtsZ è di circa il 45% del totale SepF e il 15% del totale FtsZ (rispetto alla sedimentazione del materiale quando il PIL è aggiunto). Questo dimostra che i tubuli SepF-FtsZ contengono più SepF di FtsZ. Questo può essere perché molti anelli SepF organizzano il FtsZ-SepF tubuli 5,7. La stechiometria esatta di SepF-FtsZ in questi tubuli non è nota, ma i nostri risultati suggeriscono che non vi è più SepF presenza di FtsZ.
FtsZ Ec e FtsZ B polymerizatione e le proprietà bundling
Per caratterizzare l'efficienza polimerizzazione di FtsZ B e FtsZ Ec in diversi tamponi abbiamo analizzato entrambe le proteine di 90 ° angolo di dispersione della luce. A 50 mM KCl, FtsZ B dà un segnale di 20-40 volte superiore light scattering di FtsZ Ec seconda tampone di pH (Figure 3A e B), confermando i risultati di Buske et al. 26 aumentando la concentrazione KCl nel buffer non ha fatto in maniera significativa influenza il segnale di diffusione della luce di FtsZ Ec (Figura 3D) ma il segnale di FtsZ B diminuiti ~ 80 volte a pH 7,5, ~ 30 volte a pH 6.8 e ~ 45 volte a pH 6,5 in 300 mM KCl (Figura 3C) rispetto ai buffer con 50 mM KCl (Figura 3A). Smontaggio dei polimeri FtsZ è più veloce a concentrazione KCl superiore per entrambe le proteine (Figure 3C e D ). Studi di Pacheco-Gómez et al. dimostrare che E. coli FtsZ polimerizzazione e l'abbinamento è pH dipendente. Questi autori hanno trovato che in un tampone con 50 mM KCl il segnale di diffusione della luce di FtsZ polimerizzazione era maggiore, e lo smontaggio di FtsZ voluti più a pH 6,0 rispetto a pH 7,0 8. Questi risultati non sono in accordo con i nostri dati da polimerizzazione di FtsZ Ec a 50 mM KCl (Figura 3B), ma deve essere notato che abbiamo usato tre diversi tamponi (HEPES, MES e tubi), dove Pacheco-Gómez et al. utilizzati solo MES. Così, non solo il pH, ma anche tampone composizione (forza ionica) influenza la cinetica di polimeri FtsZ a 50 mM KCl. Tuttavia, a KCl 300 mM né composizione del tampone né pH influenzati montaggio FtsZ Ec in maniera rilevabile.
Un esperimento di dispersione della luce di FtsZ B a buffer senza KCl non è stato possibile a causa di precipitazione del protein queste condizioni. Quando la concentrazione di FtsZ B è stata abbassata a 3 mM, precipitazione non si è verificato. Tuttavia, 3 mM non è la concentrazione fisiologica di FtsZ nella cella. In cuvette di plastica, FtsZ B non ha precipitato a 12 mM a pH 7.5, ma a pH 6.8 e 6.5 FtsZ ancora precipitato in assenza di KCl.
Morfologie delle strutture FtsZ da E. coli e B. subtilis
Le strutture formate da FtsZ stati controllati mediante TEM. FtsZ B assemblati in polimeri strettamente compattati che ricoprivano l'intera rete in tutti i buffer a basso contenuto di sale (Figure 4A-C). FtsZ Ec formata lunghi filamenti, cavi e fasci in tutti i buffer a basso contenuto di sale (figure 4D-F). Tuttavia, la quantità osservabile di polimeri formati da FtsZ Ec era inferiore a quello formato da FtsZ B. Nel buffer di sali FtsZ B formata piùprotofilamenti a singolo filamento che non si associano in fasci (dati 4G-I). Mentre protofilamenti FtsZ B cambiati struttura a più alta concentrazione di sale, FtsZ Ec formata strutture indistinguibili da quelli di tampone sale basso (figure 4J-L). Non c'era pH influenza osservabile sulla polimerizzazione di FtsZ Ec ma FtsZ breakfast forme più fasci a pH 6,5, che sono visibili come i polimeri strettamente compattati e lenzuola (Figura 4B). Questi risultati sono in accordo con i nostri esperimenti di scattering di luce e precedentemente pubblicato con il lavoro TEM 8,11,26.
L'attività della GTPasi FtsZ a concentrazioni di KCl alte e basse
L'attività di idrolisi GTP di FtsZ è stata misurata in condizioni differenti utilizzando un saggio colorimetrico per fosfati. Come riportato in precedenza 15 l'attività GTPase di FtsZ aumentata con l'aumentare KCl concentration: a seconda del buffer utilizzato FtsZ B. hanno mostrato un aumento di 3-7 volte, e FtsZ Ec ha mostrato un aumento 1,5-2,5 volte in attività GTPasica a KCl 300 mM rispetto al 50 mM KCl. L'attività GTPase ridotta a 50 mM KCl è dovuto al bundling di filamenti FtsZ B. A 50 mM KCl FtsZ Ec aveva una attività GTPasica 3-6 volte superiore rispetto FtsZ B a causa di rapido smontaggio dei polimeri FtsZ Ec. La differenza nell'attività di idrolisi GTP tra FtsZ B e FtsZ Ec è stata ridotta a 300 mM KCl, probabilmente a causa della ridotta raggruppamento di filamenti FtsZ B (Figura 5).
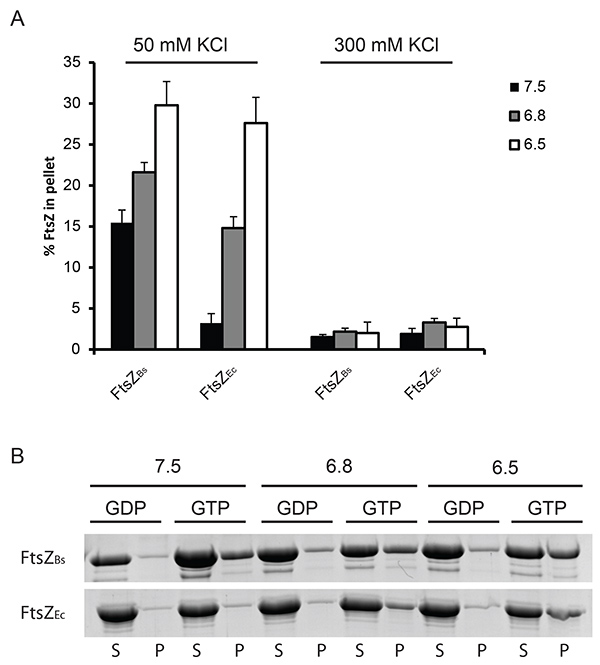
Figura 1. Quantificazione di FtsZ polimerizzazione per sedimentazione. (A) 12 pM FtsZ è stato polimerizzato in presenza di 2 mM GTP oPIL a pH 7.5 (barre nere), 6.8 (barre grigie) o 6.5 (barre bianche). La quantità di proteine pellettato stata determinata mediante analisi densitometrica dei gel colorato con Coomassie. PIL servito come controllo per una sedimentazione specifica e la percentuale di FtsZ sedimentato con PIL è stata sottratta dalla percentuale di FtsZ sedimentato con GTP avere valori tracciati nel grafico. A sinistra: FtsZ sedimentato a 50 mM KCl, a destra: FtsZ sedimentato in KCl 300 mM. (B) I risultati rappresentativi di Coomassie macchiati gel. Polimerizzazione di FtsZ B (gel superiore) e FtsZ Ec (gel inferiore) a 50 mM KCl. (S) surnatante, (P) pellet frazioni dell'esperimento. Clicca qui per vedere l'immagine ingrandita .
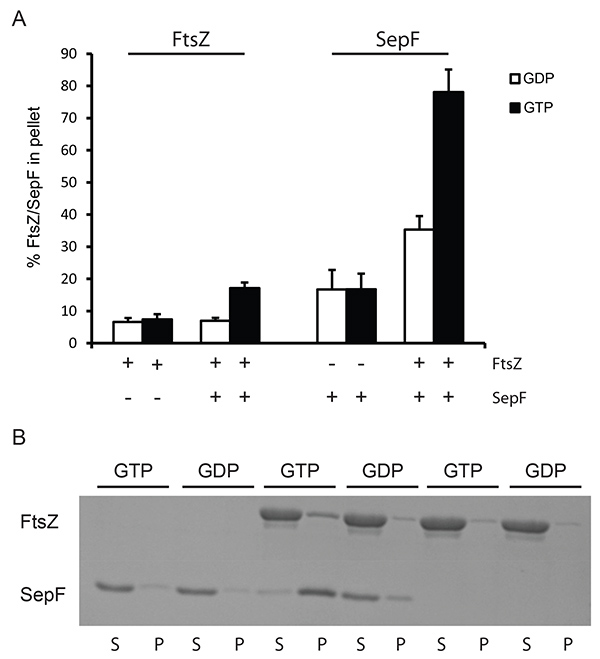
Figura 2. Sedimentazione di tubuli SepF / FtsZ a bassa velocità. (A) 12 micron FtsZ Breakfast è stato polimerizzato con un PIL 2 mm (barre bianche) o GTP (barre nere). La quantità di proteine pellettato stata determinata mediante analisi densitometrica dei gel colorato con Coomassie. I segni + e - sotto l'asse x indicano la presenza o l'assenza di FtsZ e SepF nella reazione. (B) I risultati rappresentativi da un gel Coomassie colorato. Polimerizzazione di FtsZ B in presenza e assenza di SepF. Come è stata utilizzata una SepF controllo senza FtsZ. La polimerizzazione è stata effettuata con GTP e PIL. (S) surnatante, (P) pellet frazioni dell'esperimento. Clicca qui per vedere l'immagine ingrandita .
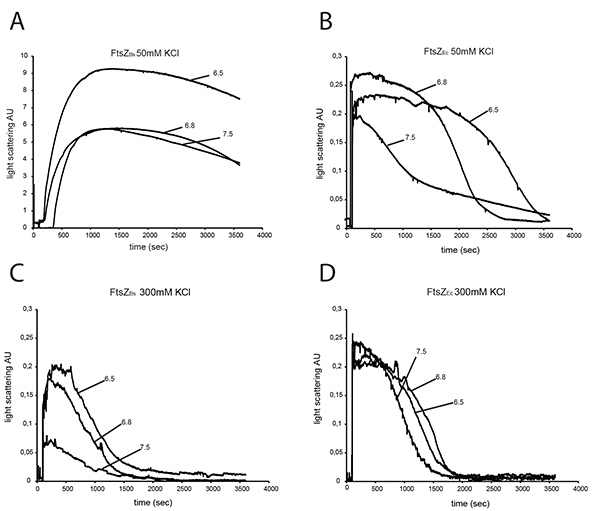
Figura 3. Light dispersione di 12 micron FtsZ Ec e 12 micron FtsZ breakfast. FtsZs sono stati assemblati in presenza di 2 mM GTP e la polimerizzazione è stata monitorata dal 90 ° dispersione della luce angolo. Polimerizzazione di FtsZ B (A) e FtsZ Ec (B) a 50 mM KCl a pH 7,5, pH 6,8, pH 6,5. Polimerizzazione di FtsZ B (C) e FtsZ Ec (D) al KCl 300 mM a pH 7.5, pH 6.8 e pH 6.5. Clicca qui per vedere l'immagine ingrandita .
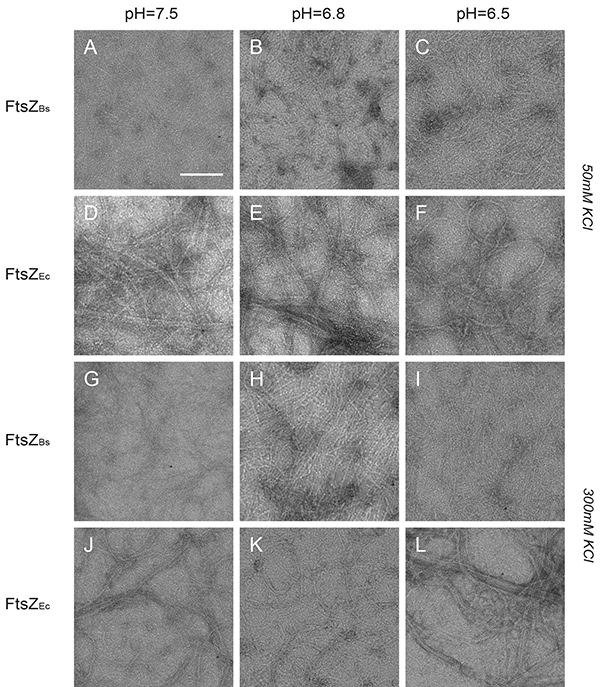
Figura 4. Strutture di FtsZ B e FtsZ Ec polimeri visualizzati mediante microscopia elettronica. (AL) Immagini di 12 micron FtsZ B (AC e GI) e FtsZ Ec (DF) e (JL) polimerizzati con 2 GTP mm. (AC) FtsZ B a tampone con 50 mM KCl e pH 7.5, 6.8, e 6.5, rispettivamente. (DF) FtsZ Ec in tampone con 50 mM KCl e pH 7.5, 6.8, e 6.5, rispettivamente. (GI) FtsZ B a tampone con 300 mM KCl e pH 7.5, 6.8, e 6.5, rispettivamente. (JL) FtsZ Ec in tampone con 300 mM KCl e pH 7.5, 6.8, e 6.5, rispettivamente. Barra della scala:. 100 nm Clicca qui per vedere l'immagine ingrandita .
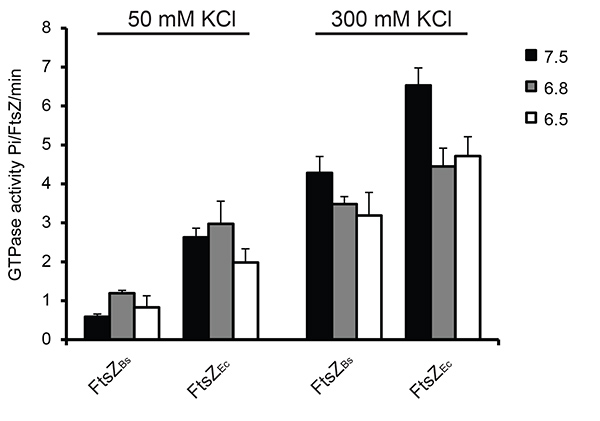
Figura 5. GTP idrolisi durante FtsZ polimerizzazione in 6 diversi tamponi. In tutti gli esperimenti 2 mM GTP wcome usato. Come è stato utilizzato un campione di controllo senza MgCl 2. Attività di FtsZ senza MgCl 2 è stato sottratto dalla attività del FtsZ in presenza di MgCl 2. A sinistra: attività GTPasica di FtsZ a 50 mM KCl, a destra:. GTPasi attività di FtsZ a KCl 300 mM Clicca qui per vedere l'immagine ingrandita .
Discussione
Descriviamo un insieme di metodi che permette una rapida analisi dell'attività FtsZ e la sua interazione con altre proteine. Light scattering, sedimentazione e GTPasi saggi e microscopia elettronica sono stati ampiamente utilizzati per studiare FtsZ polimerizzazione. Abbiamo fatto alcuni miglioramenti ai protocolli esistenti, abbiamo mostrato l'influenza delle diverse condizioni in assemblea FtsZ, e proponiamo i controlli che dovrebbero essere inclusi in studi FtsZ.
Introduciamo centrifugazione a bassa velocità per distinguere grandi strutture formate dall'associazione tra FtsZ e le sue proteine che interagiscono da polimeri FtsZ. Questo metodo presenta due vantaggi rispetto al dosaggio sedimentazione standard. Prima, senza sfondo è formato da i polimeri FtsZ nella frazione pellet in quanto non sono centrifugati a 24.600 xg. In secondo luogo, la quantità di FtsZ presente nella struttura formata con una proteina interagente può essere calcolato dal gel. Due passaggi critici di questo metodo sono la incubattempo ione e la concentrazione GTP. È importante centrifugare la grande struttura della proteina quando è completo ma prima che smonta quando tutto GTP viene idrolizzato. La migliore controllo di questo studio è la polimerizzazione di FtsZ con il PIL. C'è un potenziale limite di sensibilità del metodo. FtsZ forma un complesso stabile con SepF, che può essere facilmente centrifugata a 24.600 x g. Se viene eseguita la sedimentazione con un altro attivatore o un farmaco che raggruppa polimeri FtsZ, potrebbe essere necessario adattare il dosaggio. Essa può essere eseguita modificando il tempo di incubazione, o aumentando la velocità di centrifugazione.
La corretta preparazione del campione è la più importante per esperimenti di light scattering. Le proteine devono essere precleared da spinning e tutti i buffer devono essere filtrati prima dell'uso. Se eventuali aggregati sono presenti nel campione, si interrompono un segnale stabile ottenuto da polimeri FtsZ. Per l'analisi delle strutture FtsZ mediante microscopia elettronica, la preparazione di una griglia is la fase principale. Il tempo di incubazione del campione sulla griglia avrà l'effetto di produrre polimeri più o meno compatti. Per i fasci di FtsZ Bs, il tempo di incubazione deve essere inferiore per FtsZ Ec e FtsZ B ad alta concentrazione di KCl. Abbiamo usato una concentrazione di 12 mM per ogni campione da poter confrontare i risultati. Tuttavia, per FtsZ B a 50 mM KCl dovrebbe essere utilizzata una concentrazione FtsZ inferiore, 12 mM portato ad una saturazione completa della griglia. Questo rende i polimeri altamente compattato e difficile da rilevare. Polimeri meno compattati sono meglio per rilevare il EM.
Il saggio GTPasi è l'unico esperimento usato per studiare l'attività piuttosto che le strutture di FtsZ. Mg 2 + è necessaria per fatturato GTP nei polimeri FtsZ. Pertanto, in assenza di Mg 2 +, FtsZ non si idrolizza GTP. Pertanto, un campione senza Mg 2 + è il giusto controllo in questo saggio ma cationi di Mg sono presentinel tampone di conservazione FtsZ. Essi possono essere rimosse mediante aggiunta di 1 mM EDTA al campione di controllo. Il passaggio critico in questo saggio è il tempo di incubazione. È importante interrompere l'attività FtsZ dopo un determinato tempo. Ciò si ottiene mediante il trasferimento del campione FtsZ di una soluzione di verde malachite in una piastra a 96 pozzetti. Tuttavia, lo sviluppo del colore verde malachite è un processo continuo. Pertanto, le misure devono essere prese al tempo stesso per ogni campione. Utilizzando un protocollo GTP Inoltre ben programmata con misure effettuate ogni 30 sec a parte in un ordine prestabilito, è possibile avere la stessa incubazione e tempo di trattamento del campione per ogni punto temporale. Un altro punto critico è scegliere la concentrazione della proteina per l'esperimento. Nell'esperimento abbiamo utilizzato due diverse concentrazioni per FtsZ Ec e FtsZ breakfast. GTP idrolisi è molto più veloce per FtsZ Ec rispetto al FtsZ breakfast. L'attività GTPase di FtsZ Ec in condizioni scelte e al12 micron è lineare solo per massimo 5 minuti e dopo che il tempo altopiani tasso di idrolisi. Pertanto, è difficile interpretare i dati dall'esperimento quando eseguito in queste condizioni. In questo caso FtsZEc deve essere utilizzato a una concentrazione inferiore FtsZ B per essere in grado di confrontare le attività di entrambe le proteine. L'attività GTPase di FtsZs provenienti da fonti diverse può variare. Così, la giusta concentrazione deve essere scelto. La concentrazione di FtsZ polimerizzazione dovrebbe essere ben al di sopra della concentrazione critica (in generale 2,5-10 micron). La dinamica del montaggio e smontaggio FtsZ è importante. Alcune proteine mostrano un significativo ritardo nella polimerizzazione dopo l'aggiunta del GTP, come mostrato per FtsZBs a 50 mM KCl. È utile per eseguire il test di dispersione della luce prima del dosaggio GTPasi per approssimare il tempo di montaggio e smontaggio di polimeri FtsZ. Dopo di che, il tempo di incubazione e la concentrazione di proteina può essere scelto. Poiché le condizioni scelte per FtsZ polymerization sono fondamentali, è importante utilizzare il giusto pH e la concentrazione di KCl in ciascun metodo. In questo lavoro abbiamo studiato 9 diversi buffer con pH compreso 6,5-7,5 e concentrazioni di KCl da 0 M a 300 mm. Abbiamo notato che la condizione migliore per analizzare FtsZs da B. subtilis e E.coli e la loro attività biologica è a pH prossimo al livello fisiologico (7.5) insieme ad una elevata concentrazione di KCl. Ad una concentrazione elevata KCl, FtsZ ha una maggiore attività GTPasi e produce polimeri che sono meglio rilevabile mediante microscopia elettronica. Abbiamo anche confermato che il pH fisiologico e un'elevata concentrazione KCl sono migliori per lo studio dell'interazione tra FtsZ e proteine regolatrici di qualsiasi altro buffer soprattutto allo studio di montaggio FtsZ. FtsZBs mostra una attività simile a FtsZEc quando è stato studiato ad alta concentrazione di KCl. Inoltre, a bassa concentrazione di sale l'influenza del pH è più visibile nei buffer ad alta concentrazione salina. FtsZ cosìmetimes precipitati quando si utilizza buffer senza KCl, come risultato, i buffer senza sale dovrebbero essere evitati. La sedimentazione di polimeri FtsZ è basso quando si utilizza tamponi con alte concentrazioni di KCl. Questo può essere un vantaggio quando si studiano le interazioni tra FtsZ e le proteine che si assemblano filamenti FtsZ come SepF e Zapa come queste strutture di ordine superiore sono facili da rilevare con centrifugazione. In tutti i nostri esperimenti abbiamo usato MgCl 2 ad una concentrazione 10 mM. È stato dimostrato che una relativamente alta concentrazione di Mg 2 + stabilizza polimeri FtsZ e riduce l'attività GTPasi di FtsZ. Nella Tabella 2 risultati di diversi studi sono riassunti descrivere FtsZ polimerizzazione e attività GTPasica a diversi Mg 2 + concentrazioni utilizzando condizioni tampone altrimenti identiche 27. La concentrazione misurata del libero citoplasmatico Mg 2 + è di 0,9 mm 3. Si noti che GTP chela una quantità equivalente di Mg 2 +. Gios, la concentrazione ottimale Mg 2 + per esperimenti GTPasi è di circa 2-2,5 mM, che è vicino al livello fisiologico 3. Tuttavia, nei nostri esperimenti abbiamo usato MgCl 2 ad una concentrazione 10 mM per ottenere un segnale di diffusione della luce facilmente individuabili e per stabilizzare i polimeri FtsZ durante il dosaggio sedimentazione.
Anche se abbiamo applicato i nostri protocolli di FtsZ dal modello organismi E. coli e B. subtilis, possono essere adattati a FtsZ da qualsiasi altro organismo. Va notato che il pH fisiologico, e le concentrazioni di monovalenti, bivalenti e cationi differiscono tra gli organismi. Pertanto, le condizioni ottimali per FtsZ polimerizzazione possono variare. Differenze nella raddoppiando tempo e condizioni di crescita differenti batteri possono provocare diverse cinetiche di assemblaggio di FtsZ e condizioni ottimali degli esperimenti. Tuttavia, il nostro protocollo fornisce un buon punto di partenza per gli esperimenti con FtsZs da altri organismi. I protocollidovrebbe essere utile per lo studio di FtsZ con proteine regolatorie o lo studio degli effetti di piccoli composti e droghe sul FtsZ.
| Fonte | La polimerizzazione [% dei FtsZ sedimentato] | GTPase [Pi / FtsZ / min] | Mg 2 concentrazione + [mm] | Concentrazione FtsZ [micron] | Riferimenti |
| FtsZ Ec | ~ 28% | ~ 2.1 | 10 | 12 | Questo lavoro |
| ~ 50% | ~ 2.4 | 10 | 12.5 | 27 | |
| ~ 43% | ~ 3.5 | 5 | 12.5 | 27 | |
| ~ 27% | ~ 4.6 | 2.5 | 12.5 | 27 | |
| ND | ~ 5.4 | 2.5 | 5 | 26 | |
| FtsZ B | ~ 30% | ~ 0.8 | 12 | Questo lavoro | |
| ~ 52% (con DEAE destrano) | ~ 0.5 | 10 | 10 | 11 | |
| ND | ~ 2.25 | 2.5 | 5 | 26 |
Tabella 2. Effetto sulla Mg 2 + su FtsZ polimerizzazione e GTPase. Risultati di questo lavoro rispetto ai dati pubblicati. Tutti gli esperimenti sono stati condotti in 50 mM MES / NaOH, pH = 6,5, 50 mM KCl.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Il lavoro nel nostro laboratorio è finanziato da una sovvenzione VIDI dalla Organizzazione olandese per la ricerca scientifica (a DJS). Ringraziamo Marc Stuart e il Dipartimento di microscopia elettronica presso la nostra università, per l'assistenza e l'accesso al microscopio elettronico a trasmissione.
Materiali
| Name | Company | Catalog Number | Comments |
| GTP | Roche | 10106399001 | Part 1, 2, 3, 4, 5, 6, 7 |
| Thickwall Polycarbonate Tubes | Beckman Coulter | 343776 | Part 2 |
| Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | Part 2, 3 |
| Polyallomer Tube with Snap-on Cap | Beckman Coulter | 357448 | Part 3 |
| AIDA Bio-package, 1D, 2D, FL | Raytest Isotopenmessgeräte GmbH | 15000001 | Part 4 |
| Luminescence Image Analyzer LAS-4000 | Fujifilm | Part 4 | |
| Thermo Spectronic AMINCO-Bowman Luminescence Spectrometer | Spectronic Instruments | Part 5 | |
| Fluorescence Cell | Hellma Analytics | 105-250-15-40 | Part 5 |
| Square 400 Mesh, Copper, 100/vial | Electron Microscopy Sciences | G400-Cu | Part 6 |
| CM120 Electron Microscope Operating at 120 kV | Philips | Part 6 | |
| 96 ml x 0.2 ml Plate | BIOplastics | B70501 | Part 7 |
| Malachite Green Phosphate Assay Kit | BioAssay System | POMG-25H | Part 7 |
| PowerWave HT Microplate Spectrophotometer | BioTek | Part 7 |
Riferimenti
- Haydon, D. J., Stokes, N. R., et al. An inhibitor of FtsZ with potent and selective anti-staphylococcal activity. Science. 321 (5896), 1673-1675 (2008).
- Adams, D. W., Errington, J. Bacterial cell division: assembly, maintenance and disassembly of the Z ring. Nat. Rev. Microbiol. 7 (9), 642-653 (2009).
- Erickson, H. P., Anderson, D. E., Osawa, M. FtsZ in bacterial cytokinesis: cytoskeleton and force generator all in one. Microbiol. Mol. Biol. Rev. 74 (4), 504-528 (2010).
- Li, Z., Trimble, M. J., Brun, Y. V., Jensen, G. J. The structure of FtsZ filaments in vivo suggests a force-generating role in cell division. EMBO J. 26 (22), 4694-4708 (2007).
- Król, E., van Kessel, S. P., van Bezouwen, L. S., Kumar, N., Boekema, E. J., Scheffers, D. J. Bacillus subtilis SepF binds to the C-terminus of FtsZ. PLoS One. 7 (8), e43293 (2012).
- Singh, J. K., Makde, R. D., Kumar, V., Panda, D. SepF increases the assembly and bundling of FtsZ polymers and stabilizes FtsZ protofilaments by binding along its length. J. Biol. Chem. 283 (45), 31116-31124 (2008).
- Gündoğdu, M. E., Kawai, Y., et al. Large ring polymers align FtsZ polymers for normal septum formation. EMBO J. 30 (3), 617-626 (2011).
- Pacheco-Gomez, R., Roper, D. I., Dafforn, T. R., Rodger, A. The pH dependence of polymerization and bundling by the essential bacterial cytoskeletal protein FtsZ. PLoS One. 6 (6), e19369 (2011).
- Mendieta, J., Rico, A. I., Lopez-Vinas, E., Vicente, M., Mingorance, J., Gomez-Puertas, P. Structural and functional model for ionic (K(+)/Na(+)) and pH dependence of GTPase activity and polymerization of FtsZ, the prokaryotic ortholog of tubulin. J. Mol. Biol. 390 (1), 17-25 (2009).
- Tadros, M., Gonzalez, J. M., Rivas, G., Vicente, M., Mingorance, J. Activation of the Escherichia coli cell division protein FtsZ by a low-affinity interaction with monovalent cations. FEBS Lett. 580 (20), 4941-4946 (2006).
- Scheffers, D. J. The effect of MinC on FtsZ polymerization is pH dependent and can be counteracted by ZapA. FEBS Lett. 582 (17), 2601-2608 (2008).
- Mukherjee, A., Lutkenhaus, J. Analysis of FtsZ assembly by light scattering and determination of the role of divalent metal cations. J. Bacteriol. 181 (3), 823-832 (1999).
- Chen, Y., Erickson, H. P. Rapid in vitro assembly dynamics and subunit turnover of FtsZ demonstrated by fluorescence resonance energy transfer. J. Biol. Chem. 280 (23), 22549-22554 (2005).
- Hou, S., Wieczorek, S. A., et al. Characterization of Caulobacter crescentus FtsZ protein using dynamic light scattering. J. Biol. Chem. 287 (28), 23878-23886 (2012).
- Mukherjee, A., Lutkenhaus, J. Dynamic assembly of FtsZ regulated by GTP hydrolysis. EMBO J. 17 (2), 462-469 (1998).
- Lanzetta, P. A., Alvarez, L. J., Reinach, P. S., Candia, O. A. An improved assay for nanomole amounts of inorganic phosphate. Anal. Biochem. 100 (1), 95-97 (1979).
- Ray, S., Kumar, A., Panda, D. GTP regulates the interaction between MciZ and FtsZ: a possible role of MciZ in bacterial cell division. Biochemistry. 52 (2), 392-401 (2013).
- Rivas, G., Lopez, A., et al. Magnesium-induced linear self-association of the FtsZ bacterial cell division protein monomer. The primary steps for FtsZ assembly. J. Biol. Chem. 275 (16), 11740-11749 (2000).
- Oliva, M. A., Cordell, S. C., Lowe, J. Structural insights into FtsZ protofilament formation. Nat. Struct. Mol. Biol. 11 (12), 1243-1250 (2004).
- Lowe, J., Amos, L. A. Crystal structure of the bacterial cell-division protein FtsZ. Nature. 391 (6663), 203-206 (1998).
- Cordell, S. C., Robinson, E. J., Lowe, J. Crystal structure of the SOS cell division inhibitor SulA and in complex with FtsZ. Proc. Natl. Acad. Sci. U.S.A. 100 (13), 7889-7894 (2003).
- Chen, Y., Anderson, D. E., Rajagopalan, M., Erickson, H. P. Assembly dynamics of Mycobacterium tuberculosis FtsZ. J. Biol. Chem. 282 (38), 27736-27743 (2007).
- White, E. L., Ross, L. J., Reynolds, R. C., Seitz, L. E., Moore, G. D., Borhani, D. W. Slow polymerization of Mycobacterium tuberculosis FtsZ. J. Bacteriol. 182 (14), 4028-4034 (2000).
- Oliva, M. A., Trambaiolo, D., Lowe, J. Structural insights into the conformational variability of FtsZ. J. Mol. Biol. 373 (5), 1229-1242 (2007).
- Thanbichler, M., Shapiro, L. M. i. p. Z. a spatial regulator coordinating chromosome segregation with cell division in Caulobacter. Cell. 126 (1), 147-162 (2006).
- Buske, P. J., Levin, P. A. Extreme C terminus of bacterial cytoskeletal protein FtsZ plays fundamental role in assembly independent of modulatory proteins. J. Biol. Chem. 287 (14), 10945-10957 (2012).
- Mukherjee, A., Lutkenhaus, J. Analysis of FtsZ assembly by light scattering and determination of the role of divalent metal cations. J. Bacteriol. 181 (3), 823-832 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon