Method Article
Determinazione delle acidità in fase gassosa di oligopeptidi
In questo articolo
Riepilogo
La determinazione delle acidità fase gas di oligopeptidi contenenti cisteina è descritto. Gli esperimenti vengono eseguiti utilizzando uno spettrometro di massa a triplo quadrupolo. Le acidità relative dei peptidi sono valutate con esperimenti di dissociazione indotta da collisione, e le acidità quantitativi sono determinati utilizzando i Cuochi estesi metodo cinetico.
Abstract
Residui amminoacidici situati in posizioni differenti in proteine ripiegate spesso mostrano diversi gradi di acidità. Per esempio, un residuo di cisteina situato in prossimità o al N-terminale di un elica è spesso più acido che in prossimità o al C-terminale 1-6. Sebbene ampi studi sperimentali sulle proprietà acido-base di peptidi sono stati effettuati nella fase condensata, in particolare in soluzioni acquose 6-8, i risultati sono spesso complicati da effetti solvente 7. Infatti, la maggior parte dei siti attivi di proteine si trovano vicino alla regione interna in cui sono stati minimizzati effetti del solvente 9,10. Per comprendere intrinseche proprietà acido-base di peptidi e proteine, è importante effettuare gli studi in un ambiente privo di solventi.
Presentiamo un metodo per misurare le acidità degli oligopeptidi in fase gas. Usiamo una cisteina contenente oligopeptide, Ala 3 CysNH 3 CH), come composto modello. Le misurazioni sono basate sul metodo cinetico esteso Cuochi consolidata (Figura 1) 11-16. Gli esperimenti vengono eseguiti usando uno spettrometro di massa triplo quadrupolo interfacciato con ionizzazione elettrospray (ESI) sorgente di ioni (Figura 2). Per ogni campione peptide, sono selezionati diversi acidi riferimento. Gli acidi di riferimento sono composti organici strutturalmente simili con noti acidità in fase gas. Una soluzione della miscela del peptide e un acido riferimento viene introdotta nello spettrometro di massa, ed una fase gassosa protone-bound gruppo anionico di acido-peptide di riferimento è formato. Il cluster protone-bound è massa isolata e successivamente frammentata tramite dissociazione (CID) esperimenti di collisione-indotte. I risultanti abbondanze di ioni frammento vengono analizzati utilizzando un rapporto tra le acidità e il cluster di ioni dissociazione cinetica. L'acidità fase gas del peptide è poi ottenito da regressione lineare delle trame termo-cinetica 17,18.
Il metodo può essere applicato ad una varietà di sistemi molecolari, compresi i composti organici, amminoacidi e loro derivati, oligonucleotidi e degli oligopeptidi. Confrontando le acidità fase gas misurati sperimentalmente con quei valori calcolati per i diversi conformeri, effetti conformazionali sui acidità possono essere valutati.
Introduzione
Le acidità di residui di aminoacidi sono tra i più importanti proprietà termochimici che influenzano le strutture, la reattività, e dei processi di piegatura-unfolding di proteine 9,19. Residui di singoli aminoacidi mostrano spesso diverse acidità efficaci a seconda delle loro posizioni in proteine. In particolare, i residui presenti in altri siti attivi presentano spesso perturbato significativamente acidità. Un esempio è il residuo di cisteina che risiedono nei siti attivi della tioredossina super-famiglia di enzimi 20,21. Il sito attivo è insolitamente cisteina acido rispetto a quelle in dispiegato proteine 3-5. È stato suggerito che la conformazione elicoidale può avere un contributo significativo alla acidità insolito. Ci sono ampi studi sperimentali sulle proprietà acido-base di peptidi effettuati in soluzioni, specialmente in soluzioni acquose 2,6-8. I risultati sono stati spesso complicati da effetti solvente7. Infatti, la maggior parte dei siti attivi di proteine si trovano vicino alla regione interna dove effetti del solvente sono minimizzati 9,10.
Per comprendere intrinseche proprietà acido-base di peptidi e proteine, è importante realizzare gli studi in un ambiente privo di solventi. Qui si introduce un metodo di spettrometria di massa a base per la determinazione dell'acidità in fase gas. L'approccio è indicato come il metodo cinetico Cuochi esteso. Questo metodo è stato applicato con successo per una vasta gamma di sistemi chimici per la determinazione delle varie proprietà termochimici, come l'acidità in fase gassosa, l'affinità protonica, lo ione metallico affinità, l'affinità elettronica, e l'energia di ionizzazione 11-15, 22-26. Abbiamo applicato questo metodo per determinare le acidità in fase gas di una serie di oligo-cisteina-cisteina e polialanine polyglycine peptidi 17,18,27. Questi studi dimostrano che la cisteina N-terminale peptidees sono significativamente più acido di quello dei corrispondenti quelli C-terminale. Le alte acidità delle prime sono probabilmente dovuti agli effetti conformazionali elicoidali in cui l'anione tiolato è fortemente stabilizzato dalla interazione con l'elica macro-dipolo. A causa della natura non volatile e termicamente labile di peptidi, il metodo cinetico è l'approccio più pratico attualmente disponibili per produrre ragionevolmente accurate acido-base termochimici quantità di peptidi 28.
Nel regime generale e l'equazione associato al metodo cinetico sono mostrati in Figura 1. La determinazione dell'acidità in fase gassosa di un peptide (AH) inizia con la formazione di una serie di cluster di anioni protone-bound, [A • H • A i] ¯ (o [A + H ¯ • • A i ¯] ¯), nella regione di sorgente ionica dello spettrometro di massa, dove A e A i ¯ ¯ sono le forme deprotonate del peptide egli acidi di riferimento, rispettivamente. Gli acidi di riferimento sono composti organici con noti acidità in fase gas. Gli acidi riferimento dovrebbero avere strutture analoghe tra loro (ma non necessariamente simile a quella del peptide). La somiglianza delle strutture tra acidi riferimento assicura la somiglianza dei entropie di deprotonazione tra loro. Il cluster protone-bound anioni vengono selezionati e massa collisionally attivati e successivamente dissociato usando dissociazione (CID) esperimenti di collisione indotti a cedere gli anioni corrispondenti monomeriche, A e A i ¯ ¯, con rate costanti di K e K i, rispettivamente, mostrata in Figura 1a. Se frammentazioni secondarie sono trascurabili, il rapporto di abbondanza dei frammenti ionici CID, [A ¯] / [A i ¯], rappresenta una misura approssimativa del rapporto tra le costanti di velocità, k / k i. Partendo dal presupposto che non ci sono attivata inverso, [A °] / [A I °], verrà linearmente correlati all'acidità fase gas del peptide (Δ acido H) e quelli degli acidi riferimento ln barriere per entrambi i canali ionici dissociazione, il CID ione prodotto branching ratio (acido Δ H i), come mostrato in Figura 1b. In questa equazione, acido Δ H avg è la media acidità in fase gassosa degli acidi riferimento, Δ (Δ S) è il termine entropia (che può essere assunta costante se gli acidi riferimento sono strutturalmente simili tra loro), R è la costante universale dei gas, e T eff è la temperatura effettiva del sistema. La temperatura efficace è un parametro empirico che dipende da diverse variabili sperimentali, inclusi l'energia di collisione.
Il valore di acidità in fase gassosa è determinato disegnando due serie di trame termo-cinetici. La prima serie è obcontenute tracciando ln ([A ¯] / [A i ¯]) contro l'acido Δ H i - acido Δ H avg, come mostrato nella figura 4a. La regressione lineare produrrà una serie di linee rette con le piste di X = 1 / RT eff e intercetta di Y = - [Δ H acido - acido Δ H avg] / RT eff - Δ (Δ S) / R. La seconda serie di trame viene ottenuta riportando le intercettazioni risultanti (Y) con la prima serie contro le corrispondenti piste (X), come mostrato in Figura 4b. La regressione lineare produce una nuova linea con una pendenza di Δ H acido - acido Δ H avg e un'intercettazione di Δ (Δ S) / R. Il valore di Δ acido H si ottiene poi dal pendio e il termine entropia, Δ (Δ S), è ottenuto dal'intercetta.
Gli esperimenti vengono eseguiti utilizzando uno spettrometro di massa triplo quadrupolo interfacciato ad un ionizzazione elettrospray (ESI) sorgente di ioni. Un diagramma schematico dello spettrometro di massa è mostrato in Figura 2. Gli esperimenti vengono eseguiti CID in massa selezionando gli anioni del cluster protone-bound con la prima unità quadrupolo e permettendo loro di sottoporsi collisioni con atomi di argon fuoriusciti nella camera di collisione mantenuto ad una pressione di circa 0,5 mTorr. Gli ioni prodotti di dissociazione di massa sono analizzati con la terza unità quadrupolo. Gli spettri CID sono registrati in diverse energie di collisione con il range m / z sufficientemente ampia da coprire tutte le possibili frammenti secondari. I CID intensità di ioni prodotti vengono misurate impostando lo strumento nel monitoraggio reazione selezionato (SRM) modalità in cui la scansione è focalizzata sulla ioni prodotti selezionati. Gli esperimenti CID vengono eseguite in quattro diverse energie di collisione, che corrispondono aenergie centro-di-massa (E cm) di 1.0, 1.5, 2.0, e 2.5 eV, rispettivamente. L'energia centro-di-massa è calcolata usando l'equazione: E = E cm lab [m / (M + m)], dove E è l'energia laboratorio collisione nel sistema del laboratorio, m è la massa di argon, e M è la massa dello ione cluster di protone-bound.
In questo articolo, si usa il oligopeptide Ala 3 CysNH 2 (A 3 CH) come composto modello. Il C-terminale è amidate e il gruppo tiolo (SH) del residuo cisteina sarà il sito acida. La selezione degli acidi riferimento adeguati è fondamentale per la misurazione riuscita dell'acidità fase gas. Gli acidi riferimento ideali sono strutturalmente simili (tra loro) composti organici con valori di acidità in fase gas ben consolidati. Gli acidi di riferimento devono avere valori di acidità prossime a quella dei peptidi. Per il peptide A 3 CH, sei alogenati carboxyliacidi c sono scelti come gli acidi di riferimento. Gli acidi di riferimento sei sono cloroacetico (MCAH), acido bromoacetico (Mbah), acido difluoroacetic (DFAH), acido dicloroacetico (DCAH), acido dibromoacetic (dban), e trifluoroacetico (TFAH). Due di loro, DFAH e Mbah, saranno utilizzati per illustrare il protocollo.
Protocollo
1. Preparazione delle soluzioni campione
- Prima preparare le soluzioni madre del peptide e gli acidi riferimento sei usando un solvente misto di metanolo e acqua in un rapporto in volume di 1:1. Le soluzioni madre dovrebbero avere una concentrazione di circa 10 -3 M.
- Pesare 1 mg del campione peptide solido, A 3 CH, in una provetta Eppendorf 1,5 ml e aggiungere 1,0 ml di solvente misto di metanolo e acqua, e miscelare con un vortice.
- Pesare 1 mg di acido difluoroacetic (DFAH) e aggiungere 1,0 ml di solvente misto di metanolo e acqua, e mescolare con un vortice.
- Utilizzare la stessa procedura per rendere le soluzioni madre per gli altri cinque acidi acido riferimento cloroacetico (MCAH), acido bromoacetico (Mbah), acido dicloroacetico (DCAH), acido dibromoacetic (dban) e acido trifluoroacetico (TFAH).
- Disegnare circa 50 ml di soluzione madre peptide in una provetta Eppendorf 1.5, e disegnare circa 50 ml di soluzione madre di DFAH in SAMi provetta Eppendorf. Diluire la soluzione mista con 900 microlitri della solvente misto di metanolo e acqua per ottenere una concentrazione finale di circa 10 -4 M. Questa soluzione diluita sarà utilizzata come soluzione campione per le misurazioni di spettrometria di massa. Il rapporto effettivo del peptide all'acido riferimento e la concentrazione finale della soluzione campione viene regolata sulla base dei segnali di ioni abbondanze osservate nello spettrometro di massa.
- Utilizzare la stessa procedura per la preparazione delle soluzioni campione del peptide con gli altri acidi cinque riferimento.
2. Spettrometria di Massa di misura 1: Proton-bound Cluster Ion Formazione
- Il primo passo della misurazione spettrometria di massa è di generare ioni di cluster protone-bound stabili del peptide con un acido riferimento.
- Impostare lo strumento in modalità di ioni negativi MS con la tensione dell'ago ESI a -4,5 kV, la tensione capillare a circa -35 V, e la temperatura del gas di essiccazionemantenuta a 150 ° C. Impostare la larghezza del picco Q1 e l'ampiezza del picco Q3 sia alla scala calibrata (La larghezza del picco è un parametro strumento che può essere utilizzato per regolare la risoluzione dei picchi. L'impostazione "calibrata scala" consente di visualizzare picchi stretti per una migliore separazione dei picchi ). La tensione capillare e la temperatura del gas di essiccazione possono essere regolate per migliorare le abbondanze di ioni osservati.
- Infondere circa 0,5 ml della soluzione campione di peptide-DFAH in un 1 ml siringa Hamilton e collegare la siringa verso l'ingresso dell'ago ESI utilizzando tubi PEEK. Poi posto la siringa sulla pompa a siringa. Accendere la pompa a siringa per infondere la soluzione campione nell'ago ESI con la portata a 10 microlitri / min.
- Accendere la tensione dell'ago ESI per attivare il processo di ESI. Accendere il rivelatore. Un display spettro di massa deve essere osservato in modalità profilo. Se il display è in modalità di baricentro, passare alla modalità di profilo. Guarda il protone-bound grappolo ioni formazione di monitoring il picco am / z 428. L'abbondanza dello ione grappolo segnale può essere regolata la messa a punto dello strumento. Un parametro importante è la tensione capillare. Si può cambiare manualmente la tensione capillare (tipicamente nell'intervallo di -20 a -50 V) per massimizzare l'abbondanza del picco am / z 428.
3. Spettrometria di Massa di misura 2: gli esperimenti Bracketing CID
- Il passo successivo è quello di eseguire l'esperimento bracketing CID.
- Una volta che l'abbondanza dello ione grappolo raggiunge il valore desiderato (circa 100 mV), accendere lo strumento alla modalità MS / MS. In questa modalità, le funzioni Q1 come massa filtro per isolare lo ione cluster, Q2 funzioni come la cella di collisione, e Q3 funzioni come l'analizzatore di massa.
- Impostare la collisione gas (argon, in questo caso) di pressione a 0,5 mTorr e l'energia di collisione a 17 eV. Tre cime devono essere osservate nella finestra di visualizzazione dello spettro della massa. Il picco am / z 428 corrisponde allo ione cluster, [DFA • H • A 3 CS] ¯. I due picchi am / z 332 e m / z 95 corrispondono al peptide deprotonato (A 3 CS ¯) e l'acido difluoroacetic deprotonato (DFA ¯), rispettivamente. Il picco minore a m / z 298 è un frammento secondario dal peptide deprotonato. Acquisire uno spettro CID per 2 min, figura 3a.
- Effettuare esperimenti CID simili e di acquisire uno spettro CID per la soluzione campione del peptide con acido bromoacetico (Mbah), figura 3b.
- Esperimenti CID simili e acquisire gli spettri CID per le soluzioni campione del peptide con tutti gli altri acidi riferimento. La risultante spettri CID sarà qualitativamente simile alle figure 3a e 3b, ma i valori m / z e le altezze relative sarà diverso.
4. Spettrometria di Massa Misura 3: il metodo cinetico
- L'ultimo passo è quello di acquisire gli spettri SRM.
- Accendere il display dello spettro di baricentro e impostare lo strumento per il monitoraggio reazione selezionata (SRM) modalità. Tenere m / z 428, come lo ione isolato dal primo quadrupolo (Q1), e riempire in quattro masse (rapporto massa-carica) da monitorare con il terzo quadrupolo (Q3). I quattro masse sono m / z 428 (lo ione cluster), m / z 332 (lo ione peptide), m / z 298 (il frammento del peptide ione), e m / z 95 (DFA ¯ ione). Mantenere la pressione del gas di collisione a 0,5 mTorr.
- Impostare l'energia di collisione a 11,7 eV e acquisire gli spettri per 5 min.
- Modificare l'energia di collisione a 17,6 eV e acquisire gli spettri per 5 min.
- Cambia l'energia di collisione a 23,4 eV e 29.3 eV, e acquisire gli spettri di entrambe le energie di collisione per 5 min.
- Eseguire misure analoghe per il peptide con tutti gli altri acidi riferimento.
5. Analisi dei dati
- Copiare i valori delle intensità di ioni di all gli spettri SRM su un foglio di lavoro di Excel.
- Calcolare i rapporti di decadimento di ioni prodotto CID, ln ([A ¯] / [A i ¯]), misurata per tutti i sei cluster protone-bound a tutti i quattro energie di collisione. Valori di esempio sono mostrati nella Tabella 1.
- Riportare i valori di ln ([A ¯] / [A i ¯]) contro i valori di acido Δ H i - acido Δ H avg. Questo darà quattro lotti corrispondenti ai dati di quattro energie di collisione, Figura 4a.
- Estrarre i valori delle piste e le intercettazioni di regressione lineare dei quattro lotti. In questo caso, le pendenze sono valori positivi e le intercettazioni sono valori negativi. Dare il simbolo "X" per le piste e il simbolo "Y" per le intercettazioni. I risultati sono mostrati nella Tabella 2. Moltiplicare i valori di Y per -1 e utilizzare il simbolo Y 'per rappresentare i valori positivi (questo permette l'asse y per disgiocare valori positivi). Nota, questa conversione è opzionale finché i valori corrispondenti sono usati per rendere la trama per il passo successivo.
- Tracciare i valori di Y 'contro i valori di X, la Figura 4b. La regressione lineare della trama produce una pendenza di 1.706 e di un'intercettazione di -0,536. La pendenza corrisponde a Δ H acido - acido Δ H avg. Il valore di acido Δ H avg è noto per essere 330.5 kcal / mol, che viene determinata dal set di acidi riferimento selezionati. Il valore di acidità in fase gassosa del peptide viene poi ottenuto dalla pendenza: Δ acido H (A 3 CH) = 332,2 kcal / mol.
Risultati
- Gli esperimenti bracketing CID forniscono informazioni sui relativi acidità del peptide rispetto agli acidi riferimento selezionati. Due rappresentativo spettri CID del peptide (A 3 CH) con due acidi riferimento, DFAH e Mbah, sono mostrati in Figura 3. In Figura 3a all'abbondanza ione (altezza picco) del peptide ione è più debole di quella del DFA ¯, e in Figura 3b, l'abbondanza ione dello ione peptide è più forte di quello del MBA ¯. I due spettri suggeriscono che l'acidità in fase gas del peptide è nell'intervallo tra le acidità di questi due acidi riferimento.
- Il valore quantitativo dell'acidità fase gassosa del peptide è determinato dagli esperimenti CID quantitativi. Le trame termo-cinetici per la dissociazione dei cluster protone-bound del peptide con gli acidi riferimento sei sono mostrati in Figura 4. Regressione lineare delle piazzole secondo il termo-cinetica relationship tra l'acidità in fase gas e il CID branching ratio ioni prodotto (Figura 1b) fornisce il valore di acidità in fase gassosa del peptide A 3 CH, che è 332,2 kcal / mol. Valori campione delle piste e intercetta sono riportati nelle tabelle 1 e 2.

Figura 1. Lo schema generale della Cuochi estesa metodo cinetico. A) Lo schema del cluster protone-bound ioni dissociazione. B) Il rapporto termo-cinetica tra le acidità in fase gas e il CID di ioni prodotto ramificazione rapporto. In questa equazione, acido Δ H i è il valore di acidità in fase gassosa degli acidi riferimento individuali, acido Δ H avg è unverage fase gas acidità degli acidi riferimento, acido Δ H è l'acidità fase gas per il peptide, Δ (Δ S) è il termine entropia, R è la costante universale dei gas, e T eff è la temperatura effettiva del sistema .

Figura 2. Un disegno schematico di una massa triplo quadrupolo spettrometro. ESI è la sorgente di ioni ionizzazione elettrospray. Q1 e Q3 rappresentano la prima e la terza unità di quadrupolo, rispettivamente. Al momento di eseguire l'esperimento CID, gli ioni di cluster protone-bound sono di massa selezionati da Q1, e sono guidati nella cella di collisione a collidere con gli argon (Ar) atomi trapelate nella cella di collisione, e gli ioni frammento risultante sono analizzati da Q3.

Figura 3. Gli Spettri CID per gli ioni di cluster protone-bound del peptide con due acidi di riferimento, a) [DFA • H • A 3 C] ¯ e b) [MBA • H • A 3 C] ¯. Gli spettri sono riportati in grafico la relativa abbondanza di ioni contro il valore di m / z.
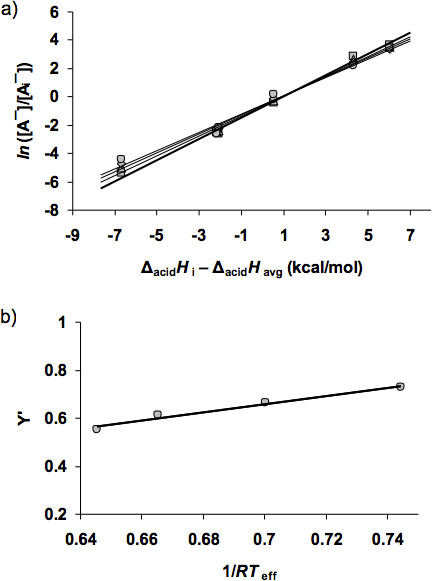
Figura 4. Le trame termo-cinetici per il peptide con sei acidi di riferimento raccolti a quattro energie di collisione a) La trama di Y = ln ([A ¯] / [A i ¯]) contro X = Δ acido H i -. Acido Δ H avg . b) La trama di Y '= [Δ acido H - Δ acido H </ Em> avg] / RT eff - Δ (Δ S) / R contro X = 1 / RT eff.
| Ah io | 11,7 eV | 17,6 eV | 23,4 eV | 29.3 eV |
| MCAH | 3.68 | 3.50 | 3,39 | 3.45 |
| Mbah | 2.83 | 2.65 | 2.45 | 2.24 |
| DFAH | -0,442 | -0,268 | -0,0921 | 0.167 |
| DCAH | -2.60 | -2.41 | -2.22 | -2.13 |
| Dban | -2.43 | -2.44 | -2.49 | -2.60 |
| TFAH | -5.41 | -5.02 | -4.71 | -4.44 |
Tabella 1. Valori di ioni rapporti di decadimento prodotto CID, ln ([A ¯] / [A i ¯]), per gli ioni di cluster del peptide con DFAH e Mbah.
Tabella 2. Valori delle piste (X) e le intercetta (Y) risultanti dalla regressione lineare del primo insieme di trame termo-cinetica.
| E Colli, eV | X 1 / RT eff | Y - [(Δ H acido - acido Δ H avg) / RT eff - Δ (Δ S) / R] |
| 11,7 | 0,744 | -0,728 |
| 17,6 | 0.700 | -0,665 |
| 23.4 | 0.665 | -0,611 |
| 29.3 | 0.645 | -0,553 |
Discussione
La misurazione di successo della acidità in fase gassosa di un peptide basa in gran parte sulla selezione di acidi riferimento adeguati. Gli acidi riferimento ideali sono composti organici strutturalmente simili con valori di acidità in fase gas ben consolidati. Gli acidi riferimento dovrebbero avere strutture simili tra loro. Ciò garantirà un simile entropia di deprotonazione per ciascuno degli acidi riferimento del set. Gli acidi di riferimento devono avere valori di acidità prossimi a quelli dei peptidi. Per brevi oligopeptidi contenente cisteina con amidata C-termini, il alogenati acidi carbossilici sono acidi di riferimento adeguati. Un passo cruciale verso esperimenti CID di successo è la formazione degli ioni di cluster protone-bound stabili con grande abbondanza. La stabilità e l'abbondanza possono essere ampiamente migliorata regolando il rapporto del peptide all'acido riferimento, la concentrazione della soluzione campione, e le condizioni strumentali (quali la tensione dell'ago, l'essiccazionetemperatura del gas, e la tensione capillare). Una condizione fondamentale strumentale è la tensione capillare (o tensione di cono per altri tipi di strumenti). Una cautela è quello di evitare l'uso di soluzioni di esempio che sono troppo concentrati.
Il metodo descritto non è limitato a oligopeptidi. Il metodo può essere applicato ad una varietà di sistemi molecolari, compresi i composti organici polari, amminoacidi e loro derivati, composti organometallici, oligonucleotidi, peptidi e polimeri che imitano. Oltre a utilizzare lo spettrometro di massa triplo quadrupolo, l'esperimento può essere eseguita anche utilizzando trappole di ioni e Q-TOF spettrometri di massa.
Il peptide utilizzato in questo esperimento è stato sintetizzato nel nostro laboratorio utilizzando il metodo standard di sintesi peptidica in fase solida 29-31. La resina Rink amide stato utilizzato come supporto solido per produrre l'ammide C-terminale. Il vantaggio del metodo è che cinetico Cuochi impurezze minori in tegli campione peptide non influenzare le misurazioni acidità, finché le impurità non hanno le stesse masse come i peptidi o gli acidi riferimento.
Le misure sperimentali possono essere accoppiati con gli studi computazionali per esaminare gli effetti conformazionali sui acidità. Studi computazionali forniscono predizioni dei conformazioni dei peptidi che corrispondono alla loro acidità calcolati. Confrontando le acidità misurati sperimentalmente con i valori calcolati, le conformazioni dei peptidi possono essere valutati.
Divulgazioni
Nulla da rivelare.
Riconoscimenti
Il lavoro è stato sostenuto dal National Science Foundation (CHE-0.749.737). L'utilizzo dello strumento è stata fornita dalla spettrometria di massa Struttura presso la University of the Pacific.
Materiali
| Name | Company | Catalog Number | Comments |
| Mass Spectrometer | Varian | 1200 L and 320 L | |
| Chloroacetic acid | Sigma-Aldrich | 402923 | |
| Bromoacetic acid | Sigma-Aldrich | B56307 | |
| Difluoroacetic acid | Sigma-Aldrich | 142859 | |
| Dichloroacetic acid | Sigma-Aldrich | D54702 | |
| Dibromoacetic acid | Sigma-Aldrich | 242357 | |
| Trifluoroacetic acid | Sigma-Aldrich | T6508 |
Riferimenti
- Forsyth, W. R., Antosiewicz, J. M., Robertson, A. D. Empirical relationships between protein structure and carboxyl pKa values in proteins. Proteins: Struct. Funct. Genet. 48 (2), 388-403 (2002).
- Huyghues-Despointes, B. M. P., Scholtz, J. M., Baldwin, R. L. Effect of a single aspartate on helix stability at different positions in a neutral alanine-based peptide. Protein Sci. 2 (10), 1604-1611 (1993).
- Takahashi, N., Creighton, T. E. On the Reactivity and Ionization of the Active Site Cysteine Residues of Escherichia coli Thioredoxin. Biochemistry. 35 (25), 8342-8353 (1996).
- Gan, Z. R., Sardana, M. K., Jacobs, J. W., Polokoff, M. A. Yeast thioltransferase - the active site cysteines display differential reactivity. Archives of Biochemistry and Biophysics. 282 (1), 110-115 (1990).
- Philipps, B., Glockshuber, R. Randomization of the Entire Active-site Helix alpha 1 of the Thiol-disulfide Oxidoreductase DsbA from Escherichia coli. J. Biol. Chem. 277 (45), 43050-43057 (2002).
- Joshi, H. V., Meier, M. S. The effect of a peptide helix macrodipole on the pKa of an Asp side chain carboxylate. J. Am. Chem. Soc. 118, 12038-12044 (1996).
- Kortemme, T., Creighton, T. E. Ionization of cysteine residues at the termini of model α-helical peptides. Relevance to unusual thiol pKa values in proteins of the thioredoxin family. J. Mol. Biol. 253 (5), 799-812 (1995).
- Gallo, E. A., Gellman, S. H. Effect of a C-Terminal Cationic Group on the Competition between α-Helical Turn and β-Turn in a Model Depsipeptide. J. Am. Chem. Soc. 116 (25), 11560-11561 (1994).
- Honig, B., Nicholls, A. Classical electrostatics in biology and chemistry. Science. 268 (5214), 1144-1149 (1995).
- Warshel, A. Electrostatic basis of structure-function correlation in proteins. Acc. Chem. Res. 14 (9), 284-290 (1981).
- Cooks, R. G., Patrick, J. S., Kotiaho, T., McLuckey, S. A. Thermochemical determinations by the kinetic method. Mass Spectrom. Rev. 13 (4), 287-339 (1994).
- Cooks, R. G., Koskinen, J. T., Thomas, P. D. The kinetic method of making thermochemical determinations. J. Mass Spectrom. 34 (2), 85-92 (1999).
- Cheng, X., Wu, Z., Fenselau, C. Collision Energy Dependence of Proton-Bound Dimer Dissociation: Entropy Effects, Proton Affinities, and Intramolecular Hydrogen-Bonding in Protonated Peptides. J. Am. Chem. Soc. 115 (11), 4844-4848 (1993).
- Cerda, B. A., Wesdemiotis, C. Li+, Na+, and K+ Binding to the DNA and RNA Nucleobases. Bond Energies and Attachment Sites from the Dissociation of Metal Ion-Bound Heterodimers. J. Am. Chem. Soc. 118 (47), 11884-11892 (1996).
- Cooks, R. G., Wong, P. S. H. Kinetic Method of Making Thermochemical Determinations: Advances and Applications. Acc. Chem. Res. 31 (7), 379-386 (1998).
- Armentrout, P. B. Entropy Measurements and the Kinetic Method: a Statistically Meaningful Approach. J. Am. Soc. Mass Spectrom. 11 (5), 371-379 (2000).
- Ren, J., Tan, J. P., Harper, R. T. Gas-Phase Acidities of Cysteine-Polyalanine Peptides I: A3,4CSH and HSCA3,4. J. Phys. Chem. A. 113 (41), 10903-10912 (2009).
- Morishetti, K. K., Huang, B. D. S., Yates, J. M., Ren, J. Gas-Phase Acidities of Cysteine-Polyglycine Peptides: The Effect of the Cysteine Position. Journal of the American Society for Mass Spectrometry. 21 (4), 603-614 (2010).
- Fersht, A. . Structure and mechanism in protein science. , (1999).
- Martin, J. L. Thioredoxin-a fold for all reasons. Structure. 3 (3), 245-250 (1995).
- Carvalho, A. P., Fernandes, P. A., Ramos, M. J. Similarities and Differences in the Thioredoxin Superfamily. Progress in Biophysics & Molecular Biology. 91 (3), 229-248 (2006).
- Bouchoux, G., Sablier, M., Berruyer-Penaud, F. Obtaining Thermochemical Data by the Extended Kinetic Method. J. Mass Spectrom. 39 (9), 986-997 (2004).
- Bouchoux, G., Desaphy, S., Bourcier, S., Malosse, C., Bimbong, R. N. B. Gas-Phase Protonation Thermochemistry of Arginine. J. Phys. Chem. B. 112 (11), 3410-3419 (2008).
- Bouchoux, G., Bimbong, R. N. B., Nacer, F. Gas-Phase Protonation Thermochemistry of Glutamic Acid. J. Phys. Chem. A. 113 (24), 6666-6676 (2009).
- Zheng, X., Cooks, R. G. Thermochemical Determinations by the Kinetic Method with Direct Entropy Correction. J. Phys. Chem. A. 106 (42), 9939-9946 (2002).
- Jones, C. M., Bernier, M., Carson, E., Colyer, K. E., Metz, R., Pawlow, A., Wischow, E. D., Webb, I., Andriole, E. J., Poutsma, J. C. Gas-phase acidities of the 20 protein amino acids. Int. J. Mass Spectrom. 267 (1-3), 54-62 (2007).
- Tan, J. P., Ren, J. Determination of the Gas-Phase Acidities of Cysteine-Polyalanine Peptides Using the Extended Kinetic Method. J. Am. Soc. Mass Spectrom. 18 (2), 188-194 (2007).
- Harrison, A. G. The gas-phase basicities and proton affinities of amino acids and peptides. Mass Spectrom. Rev. 16 (4), 201-217 (1997).
- Gutte, B. . Peptides: Synthesis, Structures, and Applications. , (1995).
- Barany, G., Merrifield, R. B. Solid-phase peptide synthesis. The Peptides. 2, 1-284 (1979).
- Chan, W. C., White, P. D. . Fmoc Solid Phase Peptide Synthesis: A Practical Approach. , (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon