Method Article
Correnti a singolo canale e Tonico GABA-attivati in fettine di cervello di ratto
In questo articolo
Riepilogo
Usiamo il patch-clamp per misurare GABA-activated monocanale correnti (GABAA canali, recettori GABA) e le correnti sinaptiche e tonico che generano nei neuroni. L'attivazione dei canali diminuisce l'eccitabilità neuronale nella salute e nella malattia 1,2,3,4.
Abstract
Il GABA A canali sono presenti in tutti i neuroni e si trovano sia a sinapsi e al di fuori delle sinapsi dove generano correnti fasica e tonica, rispettivamente 4,5,6,7 Il GABA Un canale è un pentamerica GABA-dipendenti canale del cloro. Le subunità del canale sono raggruppati in 8 famiglie (α1-6, β1-3, γ1-3, δ, ε, θ, π e ρ). Due alfa, due beta e uno da 3 subunità ° modulo funzionale del canale 8. Unendo studi di sottotipo specifico GABA-attivati monocanale molecole con studi tra cui tutte le popolazioni del GABA A canali nel neurone diventa possibile comprendere il meccanismo di base di inibizione neuronale e come viene modulato da agenti farmacologici.
Usiamo il patch-clamp 9,10 per studiare le proprietà funzionali dei canali GABA A nei neuroni vivi in fettine di ippocampo cervello e registrare il singolo canale e cellule intere correnti. Abbiamo ulteriormente esaminare come i canali sono influenzati da differenti concentrazioni di GABA, altri farmaci e fattori intra ed extracellulare. Per informazioni dettagliate descrizione teorica e pratica del patch-clamp metodo si veda The Single-Channel Registrazioni a cura di B ed E Sakman Neher 10.
Protocollo
1. Preparazione di sezioni di cervello:
Sperimentazione deve essere effettuata su sezioni di cervello da ippocampo postnatale 16 - 22 giorni vecchi ratti Wistar.
- Gli animali vengono sacrificati per decapitazione in accordo con le linee guida etiche e approvato i protocolli cura degli animali.
- Rimuovere rapidamente il cervello con una spatola e tagliare lungo la linea mediana con una lama chirurgica (# 24). Posizionare ogni emisfero su carta Whatman filtro con il taglio rivolto verso la carta.
- Mettere una goccia di colla sul disco campione e luogo nell'emisfero su di esso con la superficie tagliata rivolta verso il basso. Posizionare il disco campione nella camera di taglio del vibratome che viene riempito con un ghiacciata artificiale liquido cerebrospinale (ACSF, vedere qui sotto 3.1).
- Impostare lo spessore della fetta a 400 micron e iniziare a tagliare il cervello. Avrete bisogno di tagliare circa 2 mm di tessuto cerebrale prima di raggiungere l'ippocampo.
- Le fettine di ippocampo vengono messe in un piatto di vetro riempito con ACSF Petri. La piastra è posizionata su uno sfondo nero (ad esempio carta nera) per permettere la visualizzazione facile del dell'ippocampo. Isolare l'ippocampo dal tessuto circostante con taglienti lame chirurgiche. Fare attenzione a non spingere o tirare il tessuto.
- Fette vengono poi incubate nella soluzione ACSF a 37,0 ° C per 1 ora e poi conservati a temperatura ambiente fino a quando gli esperimenti vengono eseguiti. Durante l'incubazione un'ora, il tessuto recupera dai danni imposti dal processo di taglio.
2. Preparazione delle pipette per l'applicazione di patch:
- Pipette sono realizzati in vetro borosilicato capillari.
- La patch-pipette sono tirato su un estrattori pipetta automatica o manuale con conseguente pipette resistenza di 2 - 4 MΩ per le registrazioni cellule intere o 8-20 MΩ per singolo canale registrazioni quando è riempita con la soluzione appropriata pipetta e la soluzione è il bagno ACSF (vedi sotto, 3.1).
- Le pipette che usiamo per singolo canale registrazioni sono lucidati con un microforge dove il calore da un vetro fuso seduto sul filo di platino rende la superficie più liscia. Il vetro borosilicato è lo stesso come nella patch-pipette viene utilizzato per formare la goccia di vetro sul filo. Lucidatura le pipette in questo modo nella nostra esperienza crea pipette che formano le guarnizioni resistenza più stabile e più alto rispetto alle pipette levigati dal calore da un filo non rivestito o da un passo lucidatura nel estrattore automatico. Dimensione finale del pipette varia 8-20 MW. Pipette a cellula intera registrazioni non sono lucidati.
3. Soluzioni utilizzate negli esperimenti:
Soluzioni specifiche sono utilizzati per il single-channel e cellule intere registrazioni.
- ACSF contiene in mM: 124 NaCl, 26 NaHCO 3, 3 KCl, 1,3 MgSO 4, 2,5 Na 2 HPO 4, 2,5 CaCl 2, 10 di glucosio con pH 7,2 - 7,4 quando bolle con il 95% O 2 e il 5% di CO 2. Il ACSF a volte è anche integrato con altri nutrienti come ad esempio il lattato 11.
- Monocanale registrazioni: La soluzione è o ACSF bagno o in mM: 140 NaCl, 5 KCl, 1 MgCl 2, 1.8 CaCl 2 e 10 TES (N-tris [idrossimetil] metil-2-aminoethanesulfonic acido) pH 7.25 e altre droghe che possono essere necessari per gli esperimenti specifici La soluzione pipetta di patch cell-attached e inside-out in mm:. colina Cl 140, 5 NaCl, 1 KCl, 1 MgCl2, 1.8 CaCl 2, 10 TES pH 7.25, 200 micron saclofen (antagonista GABAB) e 0 - 1 micron GABA. Per i fuori-out patch in mM: 140 NaCl o colina Cl, 0.3 KCl, 2 MgCl 2, 0,5 CaCl 2, 5 EGTA, TES 10 pH 7,2-7,4.
- Whole-cell voltage-clamp registrazioni: La soluzione bagno:. Fette sono perfusi (2-3 ml / min) con ACSF che ora contiene anche acido kynurenic (3 mm) e altri farmaci che possono essere necessari per gli esperimenti specifici La soluzione contiene pipetta in mM: 140 CsCl, 1 CaCl 2, 3 EGTA, 0.5 KCl, 1 MgCl 2, 2 ATP-Mg, 0.3 GTP-Na, 5 QX-314 bromuro, 10 pH TES del 7,25 con CsOH.
4. Formando un Giga Ohm (GΩ) tenuta per esperimenti di patch-clamp:
Le fettine di ippocampo cervello (Fig. 1A) si svolgono presso il fondo della camera di registrazione da fili di nylon su un U filo di platino. Per visualizzare l'organizzazione dei tessuti ad esempio, il CA1 e 3 e la regione nel giro dentato dell'ippocampo le fette o le cellule specifiche, è necessario un microscopio. La maggior parte dei laboratori di utilizzare un microscopio verticale con obiettivi che vanno da 10X a 60X permettendo così di identificare regioni o cellule specifiche del tessuto. Tuttavia, per fette patch anche un microscopio dissezione può essere usata e poi visivamente a individuare una regione di patch ma non una specifica cella. Questo tipo di patch è chiamato "patch cieco". Ion entrambi i casi si alla fine è l'applicazione di patch una singola cella in una zona specifica. Il tasso di successo è simile per i due metodi. Sebbene i corpi cellulari delle cellule principali dell'ippocampo sono organizzati in lamina altamente strutturati (ad esempio CA3/CA1 strato pyramidale e identificato come bande luminose nel fetta cerebrale dell'ippocampo) sparsi tra tutti i sottocampi e gli strati dell'ippocampo sono i corpi cellulari dei inibitorio interneuroni che costituiscono circa il 10% del totale della popolazione neuronale 12. L'interneurone occasionali o glia che possono essere patchato nella cella granuli o piramidale lamina neuronali possono essere differenziati dalle cellule principali di diverse proprietà elettriche di queste cellule (vedi il libro Hippocampus 13).
- GΩ sigillo formazione. Durante questa procedura la pipetta di vetro diventa in qualche modo strettamente collegato alla membrana cellulare e nelle configurazioni di patch differenti (vedi sotto, 4 e 5) è possibile misurare l'attività del GABA-attivati i canali che si trovano nella membrana cellulare.
Mettere la pipetta nel supporto pipetta e stringere il tappo che fissa la pipetta. Impostazioni sul 200B amplificatore Axoclamp sono: V-clamp, Gain 2, Filtro 2 kHz, il potenziale azienda è 0 mV e stiamo facendo l'esperimento tramite il computer utilizzando il software PClamp. - Soffiare nel boccaglio che è collegato al tubo che collega al titolare pipetta e chiudere la valvola tra il boccaglio e il tubo. Questo crea una pressione positiva nella vostra pipetta. La pressione positiva nella pipetta ha due funzioni: in primo luogo, un flusso uscirà la pipetta e una volta che la pipetta entra nel bagno di una soluzione che aiuterà mantenendo la punta della pipetta pulita. In secondo luogo, applicando una delicata aspirazione alla membrana cellulare attraverso la patch-pipetta è una parte vitale di formazione di alta qualità, ad alta resistenza di tenuta. La tenuta spesso può essere semplicemente costituito aprendo la valvola che controlla la pressione pipetta. Per questo motivo, assicurarsi che non vi siano perdite d'aria. Si può facilmente verificare eventuali perdite prendendo il titolare con la pipetta, immergerlo in un bicchiere pieno d'acqua e soffiare nel boccaglio. Se vedete le bolle di fuga allora quella parte non è abbastanza stretta.
- Abbassare la pipetta nella soluzione bagno. Sullo schermo del computer in cui si misura la resistenza pipetta vedrete un impulso quadrato generato da un treno di impulsi 5 mV e un numero che indica la resistenza della vostra pipetta. Minore numero rappresenta aperture più grandi puntale, più grande pipette. Regolare la pipetta di offset a 0.
- Tenuta alla membrana cellulare. Identificare la regione o la cella che si sta per patch, cioè formare un sigillo. All'interno della fetta cervello si possono identificare i granuli del giro dentato o il CA1 e CA3 piramidali regioni cellula del corpo dell'ippocampo come bande luminose (vedi fig. 1A) utilizzando l'ingrandimento 10X sul microscopio o siamo in grado di identificare i singoli neuroni piramidali superficie utilizzando il ingrandimento 60X.
- Portate la vostra pipetta a fuoco in modo che si vede sia la regione / cellulare e la pipetta quando si guarda attraverso il microscopio oculari.
- Posizionare la pipetta sopra il centro della cella regione / utilizzando il grosso movimento impostazioni manipolatore e abbassare la pipetta fino a che non è solo sopra, ma non toccare il tessuto.
- Molto delicatamente abbassare la pipetta sul centro della tua regione / cella utilizzando la messa a movimento impostazioni del manipolatore e, al tempo stesso guardare lo schermo del computer e tenere traccia della vostra resistenza pipetta. Keep moving tua pipetta basso fino a visualizzare la resistenza della pipetta diventare più grande (eccesso).
- Ora, gentilmente rilasciare la pressione positiva nella pipetta aprendo la valvola. Ciò equivale ad una aspirazione delicata e spesso un giga-seal (tenuta ad alta resistenza, GΩ) forme non automatically.If, poi applicare il vuoto per il boccaglio in cui è applicato in precedenza a pressione positiva e la Giga-Seal si formerà.
- Ora avete ottenuto la cosiddetta Cell-Attached patch-clamp di configurazione (vedi fig. 1B). Regolare la compensazione capacità veloce e lento per cancellare i transitori provenienti dalla pipetta e il titolare pipetta. Sullo schermo del computer ora vedrete una traccia piatta corrente. Più alto è il valore di tenuta GΩ è, meglio il rapporto segnale-rumore si avrà nel canale singolo registrazioni.
A volte può essere vantaggioso patch all'interno della fetta dell'ippocampo. In alcuni casi le cellule possono essere più sani se non in superficie in quanto sono più protetti. Inoltre, in caso si sta studiando gli effetti dell'ambiente extracellulare sulle funzioni cellulari, come effetto della concentrazione extracellulare di GABA tonico attuale generazione dei neuroni, le patch all'interno del tessuto può essere un vantaggio. La procedura di patching è la stessa descritta sopra a parte che non si rilascia il Popressione sitive nella pipetta fino a quando la punta della pipetta è all'interno della fetta.
5. Che istituisce la cellula intera configurazione e la registrazione a cellule intere correnti:
- Nella cella-attached configurazione, modificare il potenziale pipetta a -60 mV o vicino al potenziale di membrana a riposo del vostro cellulare.
- Applicare il vuoto per la pipetta attraverso il tubo che è collegato al titolare pipetta e, al tempo stesso guardare lo schermo del computer per notare la variazione di resistenza e la capacità transienti che appaiono Una volta rotta nella cella. Quando questo accade si è in modalità cosiddetta cellula intera configurazione o Whole-Cell (Fig. 1B).
La resistenza di membrana cellulare varia da una cellula-tipo ad un altro e dipende dalla conduttanza dei canali nella membrana e quanti sono aperti. La capacità membrana cellulare varia con le dimensioni della cella. Aspirazione dovrebbe inizialmente essere delicatamente ma se è difficile da spezzare nella forza delle cellule più può essere applicata. Impulsi di aspirazione possono essere utilizzati anche. - A volte una compensazione per la resistenza che si sviluppa tra la pipetta e la cella è richiesto. Questo si chiama serie o la resistenza di accesso (R o Ra) risarcimento e può essere effettuato sia tramite il software o manualmente con una manopola di controllo sull'amplificatore. Nei nostri esperimenti abbiamo non compensano Ra, ma gli esperimenti sono rifiutati se essa varia di oltre il 25% dalla resistenza di accesso iniziale.
- GABA-attivati correnti tonico registrato in tutta la cellula-mode.
Nella cellula intera configurazione in neuroni piramidali dell'ippocampo CA1 abbiamo impostato il potenziale tenendo a - 60 mV e attendere 5 - 10 minuti che permette la soluzione di pipetta per equilibrare con l'interno della cellula. Durante questo periodo la registrazione diventa stabile. Durante l'esperimento teniamo traccia del valore della resistenza serie.
Gli esperimenti sono fatti in voltage-clamp e si misura la corrente attraverso una popolazione di canali in tutta la membrana delle cellule. Si può distinguere tra le correnti sinaptiche e extrasinaptica GABA-attivati dalla natura fasica e tonica delle correnti. L'antagonista SR95531 inibisce tutte GABA A correnti. La diminuzione della corrente di mantenimento indica il livello del GABA-attivati tonico corrente nel neurone.
Poiché siamo interessati alla tonica GABA-attivati corrente che dipende dalla extracellulare, ambiente GABA nella fetta che normalmente non patch per le cellule in superficie, ma piuttosto, le cellule all'interno della fetta. Agonisti e antagonisti che usiamo per modulare il GABA sono applicati Un canali nella soluzione del bagno e si raggiungono le cellule all'interno della fetta. Il tasso del flusso di soluzione nella camera sperimentale è di 2 - 3 ml / min.
6. Registrazione monocanale correnti:
Sperimentazione deve essere effettuata nella cella-attached, il dentro-fuori o all'esterno-out patch-clamp di configurazione (si veda qui sotto) e le correnti registrare attraverso un solo canale molecole, il singolo canale correnti. Impostazioni Axoclamp 200B, V-clamp, guadagno 500, filtro 2 o 5 kHz. Con il software PClamp controlliamo il potenziale pipetta, impostare i dati relativi alla frequenza di campionamento a non meno di 100 ms e registrare le correnti. Al fine di minimizzare il rumore in un canale registrazioni il volume della soluzione del bagno è tenuto basso in modo che ricopra solo la fetta.
- GABA-attivati i canali del Cell-Attached configurazione. Quando avete ottenuto un sigillo GΩ sulla membrana ci si trova in cella con collegamento in modalità e si può registrare dai canali che si trovano nella patch di membrana racchiusa dalla pipetta (vedi fig. 1B). Come GABA non attraversa la membrana cellulare, GABA è messo in pipetta la soluzione per attivare i canali della patch. Extrasinaptica GABA-attivati canali di attivare con una latenza fino a pochi minuti. Il potenziale patch è = - cioè il potenziale pipetta quando in PClamp si imposta il potenziale a - 40 mV, viene registrato dalla membrana come depolarizzata 40 mV.
Il vantaggio di registrazione nella cella-attached modalità è che il canale è nel suo ambiente nativo ed è in relazione con le proteine intracellulari normale e fattori. Lo svantaggio è che non sai esattamente quello che il potenziale si sta registrando in quanto non si conosce il potenziale di membrana a riposo assoluto e il potenziale attraverso la patch è determinata sia dal potenziale pipetta e il potenziale di membrana a riposo della cellula. - GABA-attivati i canali del Inside-Out di configurazione. Quando nella cella-attached modalità con delicatezza solleva la tua pipetta e spostarlo di lato e dalla fetta utilizzando i movimenti fini della micromanipolatori. Avete ora un dentro-fuori patch e in grado di registrare in modalità Inside-Out.
Si registrano dalla patch di membrana che è racchiuso dal pipetta (vedi fig. 1B). Come nella cella-attached modalità che sihanno GABA nella soluzione pipetta per attivare i canali. Ma, farmaci che attraversano il doppio strato lipidico come le benzodiazepine, i barbiturici, propofol, ecc possono essere applicati nella soluzione bagno in quanto saranno in grado di attraversare nella pipetta e modulano i canali [14]. Il potenziale di patch = - potenziale pipetta e poiché non vi è alcun potenziale di membrana a riposo sovrapposti come nella cella-attached modalità, il potenziale patch è uguale al-pipetta ad esempio il potenziale se si imposta la potenziale partecipazione in PClamp a -40 mV allora la patch potenziale è esattamente 40 mV.
Il vantaggio della configurazione inside-out è che si può applicare farmaci o enzimi per la superficie della membrana interna e esaminare se colpisce proprietà del canale. La forza di fare la inside-out patch non si applica ai all'ambiente membrana del canale rendendo la formazione di questo strappati-off configurazione patch potenzialmente più delicato per il complesso dei canali rispetto a quando l'esterno-out patch è formata (vedi sotto) . - GABA-attivati i canali del fuori-Out di configurazione. Quando nella cellula intera modalità sollevare delicatamente verso l'alto o arretrare la pipetta con i movimenti fini del micromanipolatore. Allo stesso tempo, guardare la finestra sul computer che visualizza le proprietà patch. Come si disegna la pipetta lontano dalla cella vedrete i transitori capacità scompaiono e si tornerà ad avere una tenuta GΩ. Ora avete formato un fuori-out patch e in grado di registrare in modalità Fuori-Out.
In qualche modo la membrana cellulare ha sigillato sopra l'apertura punta della pipetta, l'interno della membrana si affaccia l'interno e l'esterno pipetta originale della membrana si affaccia la camera di registrazione (Fig. 1B). Farmaci GABA e altri da esaminare sono ormai disciolti nella soluzione bagno. Il potenziale di patch = potenziale di pipetta proprio come nella cellula intera ad esempio la modalità se si imposta la potenziale partecipazione in PClamp a 40 mV allora il potenziale patch è esattamente 40 mV.
I vantaggi del fuori-out modalità è che si sa esattamente che cosa il vostro potenziale di membrana è e come l'esterno della membrana originale si affaccia sulla camera sperimentale, i farmaci da utilizzare può essere sciolto nella soluzione bagno e facilmente applicato e lavato via i canali. Gli svantaggi sono che non hai più potrebbe essere collegato al canale proteine transmembrana intracellulari e anche e fattori che possono essere necessari per la funzionalità dei canali a mano che la membrana ha dovuto sigillare-over e alcune molecole potrebbero essere stati persi o per l'ambiente membrana locale distorta in il processo. Ma, insieme le diverse configurazioni di patch permette la dissezione di proprietà del canale a livello molecolare che non è possibile con qualsiasi altro metodo oggi.
7. Analisi dei risultati:
Le correnti di singolo canale e cellule intere vengono analizzati con il software PClamp. Per le analisi di eventi sinaptici usiamo Synaptosoft (GA, USA) o AXOGraph (Sydney, Australia).
8. Rappresentante dei risultati:
Fig. 2A mostra monocanale correnti attivati da 20 nM GABA concentrazione in una cella-attached patch in neuroni dei granuli del giro dentato. La latenza di attivazione della conduttanza massima del canale è stato di 2 minuti e 38 secondi e la conduttanza massima era di 44 pS 15. La patch è stata depolarizzata da 40 mV. Fig. 2B mostra esempi di whole-cell voltage-clamp record corrente da topo neuroni dell'ippocampo che individua tonica e fasica correnti. L'antagonista GABAA SR95531 inibisce sia la extrasinaptica-(tonica) e il sinaptici generati (fasica) GABA-attivati correnti. Abbiamo applicato l'antagonista GABAA SR95531 (100 mM) a (Ba) giro dentato e neurone (Sib), insulino-trattati neurone piramidale CA1 rivelando il tonico corrente dallo spostamento della linea di base corrente indotta dal SR95531 bloccando i canali extrasinaptica (Ba, b) e la scomparsa delle correnti sinaptiche quando SR95531 blocca i canali sinaptica (Sib). In condizioni basali dei neuroni piramidali CA1 non hanno tonica GABA-attivati correnti 6 ma quando i neuroni sono esposti a concentrazioni fisiologiche di insulina 4 GABA-attivati correnti tonico sviluppare.

Figura 1A. Fetta cerebrale dell'ippocampo di ratto, le regioni identificati sono CA1 e CA3 strati di cellule piramidali e il giro dentato (DG) cell strato dei granuli. B. schematica patch-clamp configurazioni.
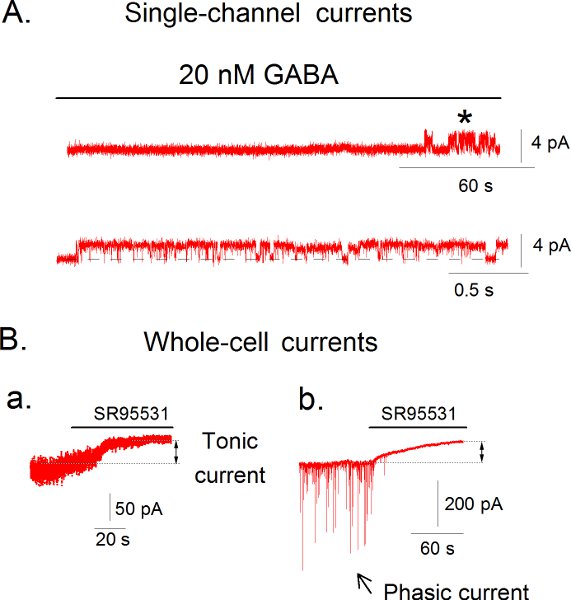
Figura 2A. Monocanale correnti attivati dal 20 nM GABA in una cella-attached patch cellule dei granuli del giro dentato in una fetta ippocampo cervello di ratto. Potenziale partecipazione è stata depolarizzata 40 mV (potenziale di pipetta = -40 mV). La stella (*, 1 ° traccia corrente) identifica da dove le correnti mostrato più veloce del tempo-scala (2traccia ° corso) è stata presa da. B. Whole-cell correnti registrate in fetta cerebrale dell'ippocampo di ratto nella cella giro dentato granuli a. e b. neurone piramidale CA1 in voltage-clamp modo il potenziale svolgimento di -60 mV. Per la CA1 esperimenti, fette sono state incubate in 1 insulina nM per 2 ore a temperatura ambiente prima di correnti sono state registrate.
Discussione
L'intera-cella corrente rappresenta l'insieme delle correnti generate da canali attivi nella cella. La farmacologia specifica e cloruro di permeabilità dei canali GABAA permette di identificare le correnti associate a questi canali. La natura transitoria di attivazione di canali sinaptica e l'attivazione tonica dei canali extrasinaptica permette di differenziare facilmente tra queste due popolazioni di canali GABAA espressi in un neurone. Tuttavia, solo con un singolo canale registrazioni si può studiare le proprietà cinetiche delle molecole canale che generano le correnti tonico. A differenza dei canali sinaptici che attivano entro 100 ms, i canali GABAA tonica sono attivati con una latenza nella gamma di minuti dal momento GABA è applicata 4,7,15,16,17,18. Questa attivazione ritardata dei risultati canali che le proprietà del canale molti non possono essere studiate usando cellule intere registrazioni. Al canale singolo livello i diversi sotto-popolazioni di canali GABAA possono essere identificati sulla base di diverse proprietà funzionali e farmacologiche. Così, prendendo un vantaggio di ciò che le diverse configurazioni di patch-clamp hanno da offrire, è possibile studiare in dettaglio la funzione molecolare e farmacologia del GABA-attivati i canali che generano le correnti toniche e sinaptica nei neuroni.
Divulgazioni
Riconoscimenti
Questo lavoro è stato finanziato dal Consiglio svedese della ricerca, Università di Uppsala e Fredrik e Ingrid Thurings Foundation. ZJ tenuto una borsa di studio post-dottorato da EXODIAB e Sällskapet Svenska för Medicinsk Forskning. Ringraziamo Frank Lee per l'assistenza tecnica.
Materiali
Diverse patch-clamp sistemi hardware e software sono disponibili e tutti funzionano utilizzando gli stessi principi di base. Nel nostro laboratorio usiamo gli amplificatori Axoclamp e il software PClamp (Molecular Devices, USA) per registrare e analizzare i nostri esperimenti. Un altro marchio popolare è amplificatori HEKA e software (HEKA Elektronik, Germania)
Microforge: Narishige MF-830 (Giappone); Vibrotome: ad esempio Leica VT1200S (Germania) o Campden Strumenti vibrotome (UK); microscopio: Nikon Eclipse E600FN; Bagnomaria; Micromanipolatori: misura e micromanipolatori Narishige (Giappone); Estrattore: DMZ- universale (Germania) o Narishige PC-10 (Giappone). Elettrodo di vetro: GC150F-15 (Harvard Apparatus, UK).
Riferimenti
- Pavlov, I., Savtchenko, L. P., Kullmann, D. M., Semyanov, A., Walker, M. C. Outwardly rectifying tonically active GABAA receptors in pyramidal cells modulate neuronal offset, not gain. J Neurosci. 29, 15341-15350 (2009).
- Chao, H. T., Chen, H., Samaco, R. C., Xue, M., Chahrour, M. Dysfunction in GABA signalling mediates autism-like stereotypies and Rett syndrome phenotypes. Nature. 468, 263-269 (2010).
- Clarkson, A. N., Huang, B. S., Macisaac, S. E., Mody, I., Carmichael, S. T. Reducing excessive GABA-mediated tonic inhibition promotes functional recovery after stroke. Nature. 468, 305-309 (2010).
- Jin, Z., Jin, Y., Mendu, K. M., Degerman, E., Groop, L., Birnir, B. Insulin reduces neuronal excitability by turning on GABA(A) channels that generate tonic current. Plos One. 6, e16188-e16188 (2011).
- Nusser, Z., Mody, I. Selective modulation of tonic and phasic inhibitions in dentate gyrus granule cells. J Neurophysiol. 87, 2624-2628 (2002).
- Semyanov, A., Walker, M. C., Kullmann, D. M. GABA uptake regulates cortical excitability via cell type-specific tonic inhibition. Nat Neurosci. 6, 484-490 (2003).
- Birnir, B., Korpi, E. R. The impact of sub-cellular location and intracellular neuronal proteins on properties of GABA(A) receptors. Curr Pharm Des. 13, 3169-3177 (2007).
- Olsen, R. W., Sieghart, W. International Union of Pharmacology. LXX. Subtypes of gamma-aminobutyric acid(A) receptors: classification on the basis of subunit composition, pharmacology, and function. Update. Pharmacol Rev. 60, 243-260 (2008).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Sakmann, B., Neher, E. . The Single-Channel Recording. , (1995).
- Zilberter, Y., Zilberter, T., Bregestovski, P. Neuronal activity in vitro and the in vivo reality: the role of energy homeostasis. Trends Pharmacol Sci. 31, 394-401 (2010).
- Spruston, N., McBain, C., Andersen, P., Morris, R., Amaral, D., Bliss, T., O'keefe, O. Structural and functional properties of hippocampal neurons. The Hippocampus Book. , (2007).
- Andersen, P., Morris, R., Amaral, D., Bliss, T., O'keefe, O. . The Hippocampus Book. , (2007).
- Eghbali, M., Curmi, J. P., Birnir, B., Gage, P. W. Hippocampal GABA(A) channel conductance increased by diazepam. Nature. 388, 71-75 (1997).
- Lindquist, C. E., Birnir, B. Graded response to GABA by native extrasynaptic GABA receptors. J Neurochem. 97, 1349-1356 (2006).
- Birnir, B., Eghbali, M., Cox, G. B., Gage, P. W. GABA concentration sets the conductance of delayed GABAA channels in outside-out patches from rat hippocampal neurons. J Membr Biol. 181, 171-183 (2001).
- Birnir, B., Eghbali, M., Everitt, A. B., Gage, P. W. B. i. c. u. c. u. l. l. i. n. e. pentobarbital and diazepam modulate spontaneous GABA(A) channels in rat hippocampal neurons. Br J Pharmacol. 131, 695-704 (2000).
- Birnir, B., Everitt, A. B., Gage, P. W. Characteristics of GABAA channels in rat dentate gyrus. J Membr Biol. 142, 93-102 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon