Method Article
Invasione di cellule umane da un agente patogeno batterico
In questo articolo
Riepilogo
Un protocollo generale per lo studio di invasione delle cellule ospiti da un agente patogeno batterico, concentrandosi su Staphylococcus aureus E cellule endoteliali umane.
Abstract
Qui si descrive il modo in cui studiare l'invasione di cellule endoteliali umane da Staphylococcus aureus batteri patogeni. Il protocollo generale può essere applicata allo studio di invasione delle cellule da qualsiasi batterio coltivabili. Le fasi in cui aspetti specifici di invasione possono essere studiati, come il ruolo di riassetto actina o caveolae, sarà evidenziata. Cellule ospiti sono coltivate in fiaschi e quando è pronto per l'uso sono seminate in piastre da 24 pozzetti contenenti coprioggetto Thermanox. Utilizzando coprioggetto permette successiva rimozione delle cellule dai pozzi per ridurre le interferenze da proteine del siero depositato sui lati dei pozzi (a cui S. aureus sarebbe allegare). I batteri sono cresciuti alla densità richiesta e lavate per eliminare ogni proteine secrete (ad esempio tossine). Coprioggetto con strati confluenti di cellule endoteliali vengono trasferiti al nuovo 24-pozzetti contenenti mezzo fresco cultura prima che l'aggiunta di batteri. I batteri e le cellule vengono poi incubate insieme per la quantità di tempo in 5% CO 2 a 37 ° C. Per S. aureus questo è in genere tra 15-90 minuti. Coprioggetto Thermanox vengono rimossi da ogni pozzetto e dip-lavati in PBS per rimuovere i batteri separati. Se il totale dei batteri associati (aderente e interiorizzate) devono essere quantificati, lamelle vengono poi poste in un pozzo fresco contenente 0,5% Triton X-100 in PBS. Pipettaggio dolce porta alla completa lisi delle cellule e batteri sono enumerate dalla diluizione seriale e piastrato su agar. Se il numero di batteri che hanno invaso le cellule è necessario, coprioggetto sono aggiunti ai pozzetti contenenti 500 microlitri terreno di coltura di tessuto integrato con gentamicina e incubazione continuato per 1 ora, che uccidono tutti i batteri esterni. Coprioggetto possono poi essere lavate, le cellule lisate e batteri enumerate dalla piastrato su agar come descritto sopra. Se l'esperimento richiede una visualizzazione diretta, coprioggetto possono essere fissate e colorate per la microscopia ottica, fluorescenza o confocale o preparati per microscopia elettronica.
Protocollo
Il protocollo seguente descrivere lo studio di invasione delle cellule endoteliali da S. aureus ma può teoricamente essere utilizzato per studiare l'invasione cellulare da qualsiasi batterio coltivabili. Fasi specifiche a S. aureus e cellule endoteliali sono indicati.
1. Preparazione dei batteri
- Cultura S. ceppi di Staphylococcus aureus per 4-16 ore (a seconda della fase di crescita necessaria) in 10 ml cervello-Heart Infusion (BHI) brodo a 37 ° C in aria con agitazione a 200 rpm. Queste condizioni di crescita sono specifici per S. aureus e potrebbero dover essere adattato per altri batteri.
- Lavare i batteri tre volte in media Dulbecco Modified Eagle (DMEM, Invitrogen) con turni si alternano di centrifugazione a temperatura ambiente (5.000 x g, 10 min), la rimozione del sopranatante cultura e risospensione del batterica pellet in un volume equivalente di DMEM. Misurare la densità ottica della sospensione risultante di batteri che possono poi essere regolato come richiesto. Per S. aureus, prepariamo una sospensione a OD 600 = 1, che corrisponde a ~ 10 9 cfu ml -1.
2. Colture cellulari endoteliali
- Cultura la linea delle cellule endoteliali EA.hy926 1 in DMEM integrato con siero fetale bovino (FBS; 10%) e L-glutamina (2 mm) a 37 ° C in 5% CO 2. In alternativa, pool primario cellule endoteliali della vena ombelicale (HUVECs) può essere acquistato da Lonza (Basilea, Svizzera) e coltivate in endoteliali medio basale integrato con il 2% FBS, estratto di cervello bovino (compresa l'eparina), umano fattore di crescita endoteliale e idrocortisone a 37 ° C in 5% di CO 2 secondo le istruzioni del produttore (Lonza). Queste condizioni di crescita sono specifici per queste cellule e potrebbero dover essere adattato per altri tipi di cellula ospite.
- Crescere le cellule endoteliali in fiasche T75 per completare la confluenza, verificato da occhi.
- Preparare il 24-pozzetti per l'inserimento del coprioggetto. Una pinza sottile (fiamma sterilizzato) sono necessari per spostare i coprioggetti, che hanno una superficie opaca e una lucida. Coprioggetto posto nei pozzetti del 24 pozzetti con la superficie opaca rivolta verso l'alto per consentire l'attaccamento delle cellule.
- Liberate le cellule dal pallone T75 con 3 ml di tripsina-EDTA (0,25%) e aggiungere 10 ml di terreno di coltura in questione.
- Aggiungere 500 ml di cellule risospese a 24-pozzetti contenenti coprioggetto di vetro Thermanox. Un fiasco T75 confluenti di cellule fornito cellule sufficiente per due piastre da 24 pozzetti, un aumento di circa 5 × 10 5 cellule per pozzetto (in 500 microlitri di media).
- Incubare le piastre per 48 ore come sopra descritto, e verificare 100% confluenza delle cellule al microscopio ottico invertito.
- Dip-wash vetrini in PBS e aggiungere nuove piastre da 24 pozzetti contenente 490 microlitri DMEM contenente 10% FBS in ciascun pozzetto.
- Per esaminare il ruolo di specifici processi metabolici invasione delle cellule, gli inibitori possono essere aggiunti alle cellule in coltura 1 ora prima l'aggiunta di batteri e concentrazione mantenuta durante il test. Ad esempio, per determinare il ruolo di riassetto actina a S. aureus invasione delle cellule endoteliali, 50 mM citocalasina D può essere aggiunto o per il ruolo di caveolae, 5 mm metil-β-ciclodestrina può essere aggiunto.
3. Invasione di analisi
- Aggiungere 10 ml di batteri lavati (un aumento di circa 2 × 10 7 ufc ml -1 S. aureus) in ogni pozzetto contenente un coprioggetto lavato con uno strato confluente di cellule endoteliali in 490 microlitri DMEM contenente 10% FBS.
- Incubare per 15-90 minuti a 37 ° C in 5% di CO 2.
- Per misurare il numero totale dei batteri associati con le cellule (aderenti e interiorizzato), dip-lavare i coprioggetti tre volte in PBS e aggiungere ai pozzi fresco contenente 500 microlitri 0,5% Triton X-100 in PBS. Per garantire le cellule completamente lisi e rilasciare tutti i batteri interiorizzato, la pipetta più volte, puntando la punta della pipetta direttamente sulla superficie del vetrino coprioggetto.
- Enumerare i batteri dal rivestimento della sospensione liquida (o diluizioni di questo se necessario) sulla superficie delle piastre TSA. Dal TX-100 sarà lyse molti batteri Gram-negativi, saponina può essere usato al posto 2.
- Per misurare il numero di batteri internalizzati, rimuovere il supernatante della coltura di ogni batterio legato pozzetti contenenti e sostituirlo con 500 microlitri DMEM/10% FBS integrato con 200 mg ml -1 gentamicina. Noi abitualmente uso gentamicina piuttosto che lysostaphin qui come è più conveniente e ci permette di passare da esperimenti utilizzando diversi tipi di batteri (stafilococchi e lattococchi ad esempio) senza dover modificare il protocollo sperimentale.
- Incubare le piastre a 37 ° C in 5% di CO 2 per 60 minuti per uccidere tutti i batteri extracellulari.
- Lavare coprioggetto 3 volte in PBS,Lyse ed enumerare da piastrato su TSA come descritto per il test di adesione di cui sopra.
- In alcuni casi può essere preferibile contare visivamente il numero di batteri mediante microscopia ottica. In questo caso, e specifico a S. invasione delle cellule aureus, l'uso lysostaphin (10 mg ml -1), invece di gentamicina per distruggere fisicamente i batteri extracellulari.
- Incubare lamelle per 20min a 37 ° C in CO 2 nella soluzione lysostaphin, quindi risciacquare e fissare con Cytopath (Cellpath).
- Inondare il coprioggetto con cristallo viola (0,5% w / v) per 5 min.
- Dip-risciacquo in acqua, asciugare e montare su vetrini. Il numero di batteri per mm 2 di confluenti cellule endoteliali può essere quantificata mediante microscopia ottica.
4. Rappresentante dei risultati:
Espressione delle proteine leganti la fibronectina (FnBPA e FnBPB) sulla superficie di S. aureus conferisce la capacità di invadere le cellule endoteliali. Un recente lavoro ha ridefinito la fibronectina dominio di legame FnBPA 3. Wild-type (WT) S. aureus 8325,4 invade le cellule endoteliali con alta efficienza, mentre un ceppo privo sia FnBPA e B (Δ FNB) hanno mostrato livelli significativamente più ridotto di internalizzazione (Figura 1A). Complementazione del mutante con FNB codifica plasmide A meno la fibronectina dominio di legame (pFnR0) non ha promosso l'invasione (Figura 1A). Al contrario, complementazione del mutante con una codifica plasmide FNB intero Un gene (pFnBA4) restaurato invasione a livelli WT (Figura 1A).
Il ruolo della FnBPA nell'invasione delle cellule endoteliali può essere dimostrata utilizzando l'espressione eterologa Lactococcus lactis host. Espressione di plasmidica FnBPA in L. lactis (pRM9 9) non ha significativamente migliorare l'adesione alle cellule endoteliali rispetto ai batteri non esprimono una FnBPA (CTL) (bar aperti, Figura 1B). Al contrario, FnBPA che esprimono L. lactis invaso le cellule endoteliali a livelli significativamente più alto rispetto il ceppo non-espressione (bar chiuso, Figura 1B).
Gli esperimenti sono stati effettuati quattro volte in duplice copia e la media ± deviazione standard è presentato. * Rappresentano dati che sono significativamente differenti (p = <0,05) da WT o valori CTL.
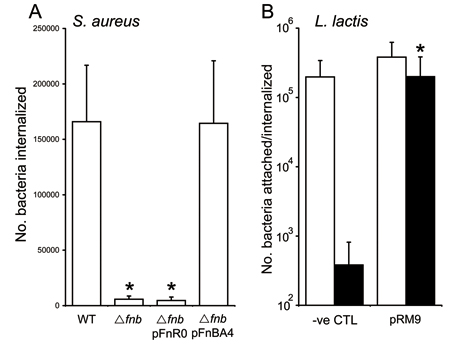
Figura 1. Invasione di EA. Hy926 cellule endoteliali da S. aureus (A) o L. lactis (B).
Discussione
Il test che descriviamo si basa sul test di protezione gentamicina, che è stato ampiamente utilizzato per studiare l'invasione delle cellule ospite da batteri. Osservazioni della incapacità degli antibiotici gentamicina e di altri per uccidere i batteri intracellulari sono state utilizzate nei primi studi l'invasione delle cellule ospiti per 4-8 batteri. L'uso di 24, 48 o anche 96-pozzetti permette la generazione di grandi quantità di dati quantitativi e riproducibile in un breve periodo di tempo ea costi relativamente bassi. Il saggio è interessante anche perché non richiede attrezzature specialistiche, può essere adattata per lavorare con vari batteri e cellule, e può essere utilizzato per studiare il ruolo dei processi cella sia batterica e host in invasione 9. Infatti, sin dai primi esperimenti, l'analisi di protezione gentamicina è stato ampiamente utilizzato per misurare la cellula ospite invasione da una serie di diversi batteri o anche combinazioni di batteri 10,11. Mentre i principi fondamentali sono gli stessi, molte sottili variazioni nel metodo sono stati segnalati. In questo articolo abbiamo descritto la nostra versione e indicato dove le modifiche possono essere necessarie per altri batteri o cellule ospiti. Quando si progetta un esperimento per misurare la cellula invasione host utilizzando questo approccio ci sono una serie di punti importanti da considerare:
Sensibilità batterica alla gentamicina. Questo può sembrare ovvio, ma è importante assicurarsi che il batterio è in fase di studio sensibili alla gentamicina alla temperatura concentrazione, e per tutta la durata di tempo da utilizzare. Nel caso di insensibilità, potrebbe essere possibile utilizzare altri antibiotici 5. Un approccio alternativo può essere quello di utilizzare enzimi litici (lysostaphin, mutanolysin, lisozima) 12.
Incubazione e l'inoculo. Quando si esegue questo test per la prima volta che è importante stabilire i tempi ottimali di incubazione, e l'inoculo dei batteri da utilizzare. Pertanto, esperimenti iniziali dovrebbe esaminare sia l'adesione e l'invasione nel tempo (5 minuti a un massimo di 6 ore). E 'anche importante valutare come l'invasione è influenzata dalla molteplicità di infezione (MOI; numero di batteri per cella). In generale è meglio usare il minor numero possibile di batteri in quanto riduce i danni alle cellule in coltura. Importanti differenze tra ceppi possono essere perse se i periodi di incubazione prolungato o di grandi dimensioni vengono utilizzati inoculi 9,13.
Danno cellulare. E 'importante lavare i batteri prima dell'uso. Tuttavia, il danno cellulare non si limita alla produzione di tossine. Invasione batterica, induzione di apoptosi e di interruzione delle normali funzioni cellulari possono causare danni cellulari. Questo può portare alla penetrazione di gentamicina nella cellula, uccidendo i batteri interiorizzato e dando l'impressione che l'invasione non si è verificato 14.
Condizioni di incubazione. La temperatura e la composizione del terreno di coltura può avere un impatto significativo sulla invasione. Per esempio, l'invasione delle cellule HeLa da Streptococcus pyogenes dipende dalla presenza di fibronectina solubile, che è tipicamente presente nel siero 15. Un'altra considerazione è la crescita dei batteri nel terreno di coltura nel corso dell'esperimento.
Cultura e quantificazione dei batteri intracellulari. Sebbene TX-100 non può uccidere i batteri intracellulari, può inibire la loro crescita. Come tale, è importante controllare la replicazione batterica su terreno solido, in presenza del detergente. Qualora interessati, può essere possibile usare concentrazioni più basse di detersivo o di utilizzare in alternativa come saponina. Un vantaggio del test di protezione gentamicina sulla colorazione viola cristallo e analisi di microscopia è che è meno laborioso, e consente il rilevamento e la differenziazione di sub-popolazioni di batteri interiorizzato. Per esempio, S. aureus può produrre sia un tipo normale colonia (NCT) o la variante piccola colonia (SCV) 16, che non sarebbero distinguibili al microscopio di singole cellule batteriche. Un vantaggio della colorazione viola cristallo e analisi di microscopia sui test di protezione gentamicina è aggregazione delle cellule possono essere considerati e che i batteri intracellulari che entrano in un 'vitale ma non coltivabili' stato verrà rilevato 17.
Esaminando il ruolo dei processi nella cellula ospite invasione batterica. Molti studi hanno impiegato inibitori della funzione della cellula ospite come citocalasina D, che interferisce con riarrangiamento actina. Tali studi possono includere anche gli anticorpi che colpiscono i recettori della superficie cellulare e knockdown siRNA di specifici geni 18. È di vitale importanza per garantire che questi trattamenti non influiscono sulla vitalità o attaccamento di cellule in coltura o avere effetti tossici sui batteri.
Direzioni future:
CONTENUTO "> Perché questo test è di solito eseguita in lastre multi-cellula e cultura, è teoricamente possibile adattare ad un high-throughput operazione di screening, che potrebbe comportare l'esame di librerie di potenziali cellule funzione inibitori, anti-infettivi o antibiotici progettate per colpire i batteri intracellulari. In alternativa, un tale approccio potrebbe essere utilizzato per lo screening di librerie di mutanti identificare i geni coinvolti nella adesione, invasione o la sopravvivenza intracellulare. In alcuni casi può essere opportuno inserire forze di taglio (flusso) nel sistema modello, per esempio quando la modellazione l'endotelio, per imitare più da vicino l'ambiente in vivo. attuali progressi nella progettazione e nella produzione di celle di flusso e microfluidica sistemi di colture cellulari offrono la possibilità di impiegare il dosaggio protezione gentamicina in ospite-patogeno modelli che incorporano forze di taglio.In sintesi, il protocollo qui descritto si basa su approcci simili utilizzati per molti anni. È ampiamente applicabile a molti tipi di cellule in coltura e specie batteriche e in grado di generare grandi quantità di dati in modo rapido ed a costi relativamente poco.
Divulgazioni
Riconoscimenti
Questo lavoro è stato finanziato dal Wellcome Trust (WT 0795880).
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 31885-023 | |
| Brain heart infusion | BioChemika | 53286 | |
| F–tal bovine serum | Invitrogen | 10091-148 | |
| HUVECs | Lonza Inc. | CC-2519 | |
| Endothelial basal medium | Lonza Inc. | CC-3121 | |
| Bovine brain extract (including heparin) | Lonza Inc. | CC-4092 | |
| Human endothelial growth factor | Lonza Inc. | CC-4017C | |
| Hydrocortisone | Lonza Inc. | CC-4035C | |
| GA-1000 | Lonza Inc. | CC-4092C | |
| Gentamicin | Invitrogen | 15710 | |
| Lysostaphin | AMBI | LSPN-50 | |
| Thermanox coverslips | Thermo Fisher Scientific, Inc. | TKT-210-330P | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Cytopath | TCS Biosciences | HC8595 | |
| Crystal violet | Sigma-Aldrich | C3886 | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | |
| T75 flasks | Thermo Fisher Scientific, Inc. | 430641 | |
| Cytochalasin D | Sigma-Aldrich | C2618 | |
| Methyl-B-cyclodextrin | Sigma-Aldrich | 332615 |
Riferimenti
- Edgell, C. J., McDonald, C. C., Graham, J. B. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc. Natl. Acad. Sci. U. S. A. 80, 3734-3737 (1983).
- Makino, S., van Putten, J. P., Meyer, T. F. Phase variation of the opacity outer membrane protein controls invasion by Neisseria gonorrhoeae into human epithelial cells. EMBO J. 10, 1307-1315 (1991).
- Schwarz-Linek, U., Werner, J. M., Pickford, A. R., Gurusiddappa, S., Kim, J. H., Pilka, E. S., Briggs, J. A., Gough, T. S., Höök, M., Campbell, I. D., Potts, J. R. Pathogenic bacteria attach to human fibronectin through a tandem beta-zipper. Nature. 423, 177-181 (2003).
- Magoffin, R. L., Spink, W. W. The protection of intracellular Brucella against streptomycin alone and in combination with other antibiotics. J. Lab. Clin. Med. 37, 924-930 (1951).
- Mandell, G. L. Interaction of intraleukocytic bacteria. Antimicrob. Agents Chemother. 52, 1673-1679 (1973).
- Vaudaux, P., Waldvogel, F. A. Gentamicin antibacterial activity in the presence of human polymorphonuclear leukocytes. Antimicrob. Agents Chemother. 16, 743-749 (1979).
- De Melo, M. A., Pechere, J. C. Effect of mucin on Campylobacter jejuni association and invasion on HEp-2 cells. Microb. Pathog. 5, 71-76 (1988).
- Shaw, J. H., Falkow, S. Model for invasion of human tissue culture cells by Neisseria gonorrhoeae. Infect. Immun. 56, 1625-1632 (1988).
- Edwards, A. M., Potts, J. R., Josefsson, E., Massey, R. C. Staphylococcus aureus Host Cell Invasion and Virulence in Sepsis is Facilitated by the Multiple Repeats within FnBPA. PLoS Pathog. 6 (6), e1000964-e1000964 (2010).
- Meyer, D. H., Sreenivasan, P. K., Fives-Taylor, P. M. Evidence for invasion of a human oral cell line by Actinobacillus actinomycetemcomitans. Infect. Immun. 59, 2719-2726 (1991).
- Edwards, A. M., Grossman, T. J., Rudney, J. D. Fusobacterium nucleatum transports noninvasive Streptococcus cristatus into human epithelial cells. Infect. Immun. 74, 654-662 (2006).
- Menzies, B. E., Kourteva, I. Internalization of Staphylococcus aureus by Endothelial Cells Induces Apoptosis. Infect. Immun.. 66, 5994-5998 (1998).
- Schröder, A., Schröder, B., Roppenser, B., Linder, S., Sinha, B., Fässler, R., Aepfelbacher, M. Staphylococcus aureus fibronectin binding protein-A induces motile attachment sites and complex actin remodeling in living endothelial cells. Mol. Biol. Cell. 17, 5198-5210 (2006).
- Molinari, G., Rohde, M., Talay, S. R., Chhatwal, G. S., Beckert, S., Podbielski, A. The role played by the group A streptococcal negative regulator Nra on bacterial interactions with epithelial cells. Mol. Microbiol. 40, 99-114 (2001).
- Cue, D., Dombek, P. E., Lam, H., Cleary, P. P. Streptococcus pyogenes serotype M1 encodes multiple pathways for entry into human epithelial cells. Infect. Immun. 66, 4593-4601 (1998).
- Eiff, C. von Staphylococcus aureus small colony variants: a challenge to microbiologists and clinicians. Int J. Antimicrob. Agents. 31, 507-510 (2008).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34, 415-425 (2010).
- Wang, B., Yurecko, R. S., Dedhar, S., Cleary, P. P. Integrin-linked kinase is an essential link between integrins and uptake of bacterial pathogens by epithelial cells. Cell. Microbiol. 8, 257-266 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon