Method Article
Crioconservazione di tessuto corticale blocchi per la generazione di altamente arricchito Culture neuronale
In questo articolo
Riepilogo
Qui, descriviamo un metodo efficiente per la crioconservazione e lo scongelamento dei blocchi di tessuto cerebrale corticale per generare altamente arricchito culture neuronali. Questo semplice protocollo fornisce la flessibilità per la generazione successiva di culture precursore neuronali, astrociti e cellule neuronali.
Abstract
In questo studio, abbiamo delineare un protocollo standardizzato per la crioconservazione di successo e scongelamento dei blocchi cortical tessuto cerebrale di generare altamente arricchito culture neuronali. Per questo protocollo di congelamento del mezzo utilizzato è del 10% dimetilsolfossido (DMSO) diluito in soluzione salina tampone di Hank (HBSS). Blocchi di tessuto corticale vengono trasferiti cryovials contenenti il mezzo di congelamento e lentamente congelati a -1 ° C / min in un tasso di controllo contenitore di congelamento. Disgelo post-elaborazione e la dissociazione dei blocchi di tessuti congelati costantemente prodotto neuronale arricchito di culture che hanno evidenziato crescita rapida neuritiche durante i primi 5 giorni di cultura e di significativa espansione della rete neuronale entro 10 giorni. Colorazione immunocitochimica con il astrociti proteina marker gliale fibrillare acida (GFAP) e il marcatore neuronale beta-tubulina di classe III, ha rivelato un alto numero di neuroni e astrociti nelle culture. Generazione di colture di cellule neurali progenitrici del tessuto dopo blocco dissociazione portato a rapida espansione neurosfere, che ha prodotto un gran numero di neuroni e astrociti in condizioni di differenziazione. Questo protocollo permette la crioconservazione semplice per una rapida, conservazione efficiente e poco costoso di blocchi di tessuto cerebrale corticale, che concede una maggiore flessibilità per la generazione successiva di culture precursore neuronali, astrociti e cellule neuronali.
Protocollo
1. Crioconservazione di tessuto corticale blocchi
Materiale di preparazione
- Preparare la soluzione salina tampone 1X Hank (HBSS) diluendo in soluzione madre 10X in acqua sterile (1:9). HBSS conservare a 4 ° C.
- Preparare il 10% medio congelamento DMSO diluendo DMSO in HBSS (1:9). Il mezzo di congelamento dovrebbe essere fresca prima di crioconservazione e conservato a 4 ° C fino a freddo.
- Una lama di rasoio in acciaio viene utilizzato per il taglio sistematico del tessuto. Prima dell'uso, la lama è sterilizzata da immersione in etanolo al 70% per 2 ore. Immediatamente prima della lavorazione dei tessuti, sciacquare la lametta con acqua sterile 3 volte. Evitare di lasciare il rasoio in acqua sterile per una quantità eccessiva di tempo, in quanto è soggetto a ossidazione.
- Un contenitore di congelamento Nalgene viene caricato con cryovials (2,5 ml) e poi portato in un armadio sterile biologica. 1 ml di acqua refrigerata media congelamento è aggiunto ad ogni flacone. Il contenitore congelamento è quindi posto a 4 ° C per almeno 2 ore.
Pulizia, Tagliere, e congelamento
- Il tessuto cerebrale essere congelati viene pulita di membrana meningea e vasi sanguigni. Utilizzare punte ago sterile per rimuovere i detriti con attenzione dal tessuto durante il lavoro in cima ad un impacco di ghiaccio. Tessuti lavabili devono essere risciacquati leggermente con HBSS freddo e trasferito in un nuovo piatto di Petri per tritare.
- Lavorare su di un impacco di ghiaccio, utilizzare una lama di rasoio sterile di tagliare rapidamente il tessuto di circa 1 mm in 3 blocchi. Lavorare con piccole porzioni di tessuto pulito in un momento risultati in un migliore controllo della procedura di taglio, con conseguente blocchi di dimensioni più uniforme.
- Aggiungere lentamente il tessuto tagliato in 50 ml di HBSS in un tubo da 50 ml. Lavare delicatamente la piastra Petri con HBSS al fine di raccogliere tutti i blocchi del tessuto residuo. Lasciare i blocchi di tessuto a scendere sul fondo del tubo, creando un poco compresso tessuto blocco pellet.
- Mentre il tessuto è assestamento, portare il contenitore refrigerato precedentemente congelamento e cryovials nella cabina di sicurezza biologica. Stappare tutti cryovials per accelerare il processo di aggiunta dei tessuti.
- Dopo che tutti i blocchi di tessuto si sono stabiliti, dolcemente aspirare il HBSS in eccesso, lasciando uno strato molto sottile di media al di sopra del pellet. Centrifugazione è sconsigliato in quanto causerà i blocchi del tessuto di aderire gli uni agli altri, diminuendo in modo significativo l'efficienza di congelamento.
- Lentamente raccogliere 200 ul dalla parte inferiore del piede libero tessuto blocco pellet utilizzando punta della pipetta con orifizi larga (taglio punta con forbici sterili). Trasferire il materiale ad una provetta Microbank ™ e passare a quella successiva, il tessuto ancora raccogliere dal fondo del pellet. E 'essenziale che l'intera procedura di assegnazione dei tessuti non prende più di 3-4 minuti per contenitore di congelamento. Questo assicura che il tessuto è esposto a DMSO solo per un breve periodo di tempo prima del congelamento. Dopo aver trasferito il tessuto per le fiale, porre il recipiente freddo-80 ° C in un freezer per almeno 4 ore. In alternativa, il contenitore di congelamento può essere lasciato una notte a -80 ° C. Ripetere la procedura per eventuali contenitori congelamento rimanenti.
- Trasferire il cryovials dal contenitore congelamento (s) ad un cryobox e posto in un serbatoio di azoto liquido per la conservazione a lungo termine.
2. Scongelamento e coltura di blocchi congelati di tessuto corticale
Materiale di preparazione
- Un giorno prima di campioni di tessuto scongelamento, poli-L-lisina rivestito Petri / coprioggetto sono preparati. In generale, per i neuroni corticali prepariamo piatti rivestiti con 500 mg / ml o 1 mg / mL. Aggiungi sufficiente poli-L-lisina soluzione (made in tampone borato) per coprire completamente il fondo del piatto. Se coprioggetto di vetro sono necessari, in modo che siano completamente sommersi sotto la poli-L-lisina soluzione. Incubare per almeno 12 ore. Prima dell'uso, sciacquare i piatti con un buon quantitativo di acqua sterile per 3 volte, 5 minuti ciascuno.
- HBSS calda è usata per pulire il tessuto scongelato e per dissociare il tessuto in sospensioni cellulari. Il volume di HBSS necessari variano a seconda della quantità di tessuto per essere scongelati, ma tipicamente 1 provetta Microbank ™ saranno diluiti in 50 mL di HBSS e sarà dissociato in 10 ml di HBSS.
- Dulbecco Modified Eagle con medie del 10% di ferro integrato bovino siero bovino (EBS) e 1% antibiotici / antimicotici (AA) miscela (DMEM (++)) dovrebbe essere collocato in un bagno d'acqua a 37 ° C.
- Medio placcatura (NB (+++)) dovrebbero essere fresco prima dell'uso. Questo terreno è preparato con l'aggiunta di 1% antibiotico / antimicotico più B27 e integratori N2.
Nota: i nomi media con l'aggiunta di croci (+) indicano l'aggiunta di additivi per la composizione di base dei media. In questo testo, DMEM (+ +) indica DMEM più 10% più 1% EBS AA, mentre NB (+++) denota NB plnoi l'1% AA più B27 più N2.
Scongelamento e coltura
- Rimuovere il cryovials dal serbatoio di azoto liquido e scongelare rapidamente a 37 ° C a bagnomaria fino a quando solo una piccola pallina di ghiaccio si osserva all'interno del contenuto del flaconcino.
- Delicatamente trasferire il contenuto della fiala da 50 mL HBSS caldo in un tubo conico. Utilizzare una punta larga orifizio per rimuovere delicatamente eventuali blocchi di tessuto residuo bloccato in provetta Microbank ™. Invertire il tubo di 3-4 volte e permettere al tessuto di raccogliere lentamente sul fondo. Tessuto deve risolvere in fretta, ma se i blocchi sono troppo piccoli non possono verificarsi e centrifugazione della luce (~ 200 g) è raccomandato.
- Aspirare HBSS eccesso.
- Aggiungere 10 ml di HBSS caldo al precipitato di tessuto e 300 ml di tripsina 0,25% e 50 ml di DNAase. Incubare in un bagno d'acqua a 37 ° C per 5 minuti, poi posto in un agitatore orbitale impostato a 80 giri e 37 ° C per altri 5 min.
- Dopo questo periodo, portare i blocchi di tessuto in una cappa di sicurezza biologica e utilizzare una pipetta 10 ml per agitare con cura i blocchi dei tessuti fino a una sospensione di cellule nuvoloso è formato. Disattivare la tripsina aggiungendo 10 ml di DMEM caldo (+ +) alla sospensione cellulare.
- Centrifugare le cellule dissociate a 1200 x g per 5 min. Aspirare ed eliminare il surnatante, risospendere il pellet cellulare in 10 ml di DMEM caldo (+ +) e quantificare il numero delle cellule utilizzando un emocitometro.
- Cellule piastra sui piatti rivestiti di poli-L-lisina. In genere, una di 60 mm piatto sarà placcato con 1x10 6 cellule.
- Permettono alle cellule di allegare al piatto / coprioggetto per circa 1 ora nel tessuto culturale incubatore. Si raccomanda di monitorare i progressi di attaccamento in un piatto ogni 10 minuti fino a quando l'attaccamento effettivo. Poi, gentilmente sostituire il mezzo con fresca DMEM (++).
- Dopo 24 ore, sostituire la DMEM (+ +) con caldo NB (+++). Variazioni medie parziali (50%) sono effettuate ogni 5 giorni con fresca NB (+++). Culture sano di solito mostrano segni di differenziazione e di crescita dei processi dopo 24 ore. In queste condizioni, ed effettuando cambiamenti medie parziali ogni 4-5 giorni, le culture può essere mantenuta per periodi di tempo prolungati fino a 4-6 settimane.
- Per la generazione di cellule precursore neuronali (NPC), un protocollo simile è usato con l'eccezione che dopo la centrifugazione, DMEM senza EBS viene utilizzato. Le cellule sono placcati in T-25 palloni DMEM/F12 (1:3) integrata con B27 e EGF (20 ng / ml) per permettere la formazione di neuropheres. Per differenziare i PNG, neurosfere sono placcati in laminina (10 ug / mL) coprioggetto rivestito in DMEM/F12 (1:3) di media integrato con N2.
3. Rappresentante Risultati
Culture sani mostrano una significativa crescita e differenziazione dopo 5 giorni dopo lo scongelamento e di solito stabilizzarsi nella sua crescita da 10 giorni (Figura 1). Immuncocytochemical colorazione di queste culture astrociti rivela numerosi (Figura 2A) e neuroni (Figura 2B) per le colture primarie umane e di ratto neuronale. Questo protocollo è adatto anche per la generazione di NPC come free-floating neurosfere (Figura 3A), che in condizioni di differenziazione, risultato in colture miste di alta qualità (Figura 3 B, C).

Figura 1. Le colture cellulari di tessuti umani congelati corticale. Blocchi congelati di tessuto corticale umano sono scongelati e placcato su vetrini rivestiti di poli-lisina e cresciuto per 10 giorni. Dal giorno 5 di espansione delle cellule è evidente e da giorno 10 confluenza è raggiunto. Scala grafica: 100 micron.
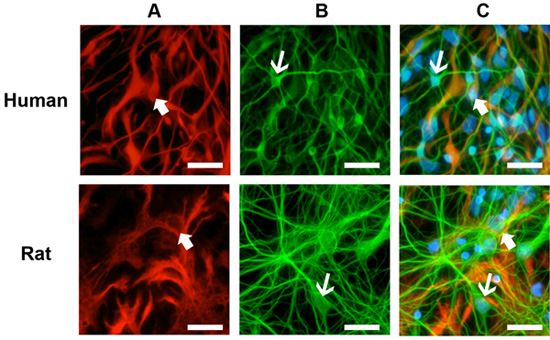
Figura 2. Colorazione immunocitochimica di colture cellulari. (A) Le culture sono state colorate con la proteina marker gliale fibrillare acida gliale (GFAP, frecce di spessore). (B) I neuroni sono stati rilevati con il marcatore neuronale beta-tubulina III (TIII, frecce sottili). (C) Sia e delle culture umane nel ratto mostrano glia abbondante e neuroni dopo 10 giorni in coltura. Anticorpi primari: topo anti-GFAP (1:1000) e di coniglio anti-TIII (1:1000). Anticorpi secondari: anti-topo Alexa 594 (1:500) e anti-coniglio Alexa 488 (1:500). Nuclei colorazione: blu Hoestch (1:1000). Scala grafica: 50 micron.
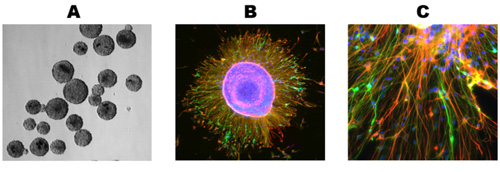
Figura 3. Generazione di neurosfere. (A) tessuto congelato è stato elaborato come descritto in precedenza e ha permesso di propagare come neurosfere. (B) neurosfere sono stati placcati in coprioggetto di vetro in condizioni di differenziazione e cresciuto per 10 giorni, con conseguente migrazione delle cellule dalla neurosfere. (C) Sia i neuroni e astrociti sono presenti ai margini in espansione di un neurosfere di differenziazione. Controcolorazione nucleare, gli anticorpi primari e secondari utilizzati come in Fig. 2.
Discussione
Crioconservazione offre l'opportunità di campioni di tessuto cerebrale preziosa banca per un uso futuro. Qui si descrive un protocollo semplice ma efficace per generare neuroni sia arricchito di culture e le cellule precursore neuronali da blocchi congelati tessuto cerebrale. Questa procedura evita i costi economici delle tecniche di crioconservazione tradizionali che utilizzano più costosi velocità controllata congelatori. Il protocollo permette la generazione di validi culture neuronali post-scongelamento, fornendo un mezzo rapido ma efficace per congelare i blocchi dei tessuti. L'intero processo di congelamento può prendere così piccolo quanto 20 minuti. In aggiunta alle colture primarie neuronali, utilizzando questo metodo effettua il blocco del tessuto può anche essere scongelati per generare NPC cresciuta come libero neurosfere galleggiante. A questo proposito, la mancanza di siero nel nostro medio congelamento assicura che le cellule sono conservate in uno stato indifferenziato. In condizioni di differenziazione, neurosfere prodotta dall'espansione surgelati mostrano tassi di differenziazione dei tessuti e del tutto paragonabile a neurosfere generate dal tessuto fresco.
Divulgazioni
Riconoscimenti
Questa ricerca è stata sostenuta da finanziamenti del Programma triennale Opportunità di ricerca presso UCI (AR e SP) e le sovvenzioni da parte dello Stato della California Iniziativa malattia di Alzheimer e il National Institutes of Health non concede. HD38466, e il morbo di Alzheimer Research Center non concede. AG16573 (JB)
Materiali
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) | Invitrogen | 11995-073 | High gluclose 1X |
| Bovine calf serum supplemented | Hyclone | SH30072.03 | For culture medium |
| Neurobasal-A Medium (1X), liquid | Invitrogen | 1088-022 | |
| B27 Supplement | Invitrogen | 17504-044 | Supplement for Neurobasal medium |
| N2 Supplement | Invitrogen | 17502-048 | Supplement for Neurobasal medium |
| Trypsin (10X) | Cellgro | 25-054CI | Tissue dissociation |
| Deoxyribonuclease 1 from bovine pancreas (DNase) | Sigma-Aldrich | D4527-30KU | Tissue dissociation |
| Hanks Balanced Salt Solution (HBSS) (10X) | GIBCO, by Life Technologies | 14065 | Cleaning tissue, washes, and freezing medium |
| Poly-L-Lysine- 500mg | Invitrogen | P2636 | Substrate for adhesion of neuronal cells |
| antibiotic-antimycotic (100X), liquid | Invitrogen | 15240-062 | To prevent contamination |
| Large orifice pipette Tips (1-200 ul) | Fisher Scientific | 02-681-141 | To prevent shear stress to cells |
| Graduated pipette tips (101-1000 ul) | USA Scientific, Inc. | 1111-2721 | |
| 21 G1 precision guide needles | BD Biosciences | 305165 | To clean tissue |
| 10 ml pipette | USA Scientific, Inc. | 1071-0810 | Individually wrapped |
| 50 ml tubes | USA Scientific, Inc. | 926-9-04 | |
| Single edge razor blade | Smith & Nephew Inc. | 67-0238 | To chop tissue |
| 60 x 15 mm polystyrene petri dish | USA Scientific, Inc. | 8609-0160 | For general culture |
| 100 x 15 mm polystyrene petri dish | USA Scientific, Inc. | 8609-0010 | For cleaning tissue |
| Cryogenic box | Nalge Nunc international | 5026-1010 | |
| Freezing container | Nalge Nunc international | 5100-0001 | "Mr. Frosty" |
| 2.0 ml cryogenic vials | Nalge Nunc international | 5012-0020 | |
| DMSO | Fisher Scientific | D128-500 | For freezing medium |
| Ethanol 200 proof | Sigma-Aldrich | E7023 | For sterilizing razor blade |
Riferimenti
- Robbins, R. J. Cryopreservation of human brain tissue. Exp Neurol. 107, 208-213 (1990).
- Ware, C. B., Nelson, A. M., Blau, C. A. Controlled-rate freezing of human ES cells. Biotechniques. 38, 879-880 (2005).
- Paynter, S. J. Principles and practical issues for cryopreservation of nerve cells. Brain Res Bull. 75, 1-14 (2008).
- Thirumala, S., Gimble, J. M., Devireddy, R. V. Cryopreservation of stromal vascular fraction of adipose tissue in a serum-free freezing medium. J Tissue Eng Regen Med. 4, 224-232 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon