Method Article
מתן חומרי הרדמה נדיפים לזחלי דג הזברה לתצפית התנהגותית
In This Article
Summary
פרוטוקול זה מציג שיטה נגישה ליצירת סביבה אטומה לגז למתן חומרי הרדמה נדיפים לזחלי דגי זברה לניסויים התנהגותיים.
Abstract
מחקר זה מתאר שיטה ייחודית למתן חומרי הרדמה נדיפים, כגון איזופלורן וסבופלורן, לזחלי דגי זברה במהלך ניסויים התנהגותיים. בעוד שדגי הזברה מציעים יתרונות רבים כאורגניזם מודל של בעלי חוליות - כולל התנהגויות מורכבות, יכולת גנטית, עוברים שקופים והתפתחות מהירה - השימוש בהם בחקר חומרי הרדמה נדיפים היה מוגבל. מתן חומרי הרדמה נדיפים דורש לעתים קרובות מכשירים מורכבים או מסורבלים שעשויים שלא להיות נגישים באופן נרחב, מה שיוצר מחסומים למחקר פרמקולוגי של חומרי הרדמה נדיפים באורגניזמים מודלים מימיים. שיטה זו מציגה טכניקה פשוטה המשתמשת ביריעות סיליקון דביקות ליצירת אטימה אטומה לגז על לוחות זכוכית של 96 בארות. התיקוף בוצע באמצעות הערכת תנועה ספונטנית, שלא הראתה הבדלים משמעותיים בין בארות אטומות לפתוחות לאורך תקופה של 90 דקות. בנוסף, ריכוז חומרי ההרדמה נשאר יציב לאורך זמן, כפי שנמדד על ידי HPLC. התוצאות המייצגות כוללות קביעה ניסויית של ערכי ריכוז אפקטיבי חציוני (EC50) עבור סבופלורן. מחקר זה מספק גישה פשוטה ונגישה לניסויים פרמקולוגיים באמצעות חומרי הרדמה נדיפים, שניתן להתאים בקלות לחקר חומרים נדיפים אחרים ונקודות קצה ניסיוניות.
Introduction
מודלים של בעלי חיים שאינם מימיים (תולעים, זבובים, מכרסמים, ארנבות, פרימטים וכו') היו מבחינה היסטורית המודלים הנפוצים ביותר לחקר פרמקולוגיה של הרדמה. בכל אחד מהמינים הללו, חומרי הרדמה נדיפים (הניתנים באמצעות שאיפת גז) מאתגרים הרבה פחות ממתן חומרי הרדמה תוך ורידיים (הניתנים בנתיבים תוך-ורידיים או תוך-צפקיים)1. בנוסף לאתגר הטכני של מתן התרופות התוך-ורידיות, השגת מצב יציב של הרדמה היא הרבה יותר קלה עם חומרים נדיפים מאשר חומרים תוך-ורידיים2.
מתן חומרי הרדמה תוך ורידיים למינים מימיים של זחלים יכול להיות מושג על ידי דיפוזיה מהמדיום המימי הסובב אותם 3,4, ולכן הוא דומה יותר למתן חומרי הרדמה נדיפים למינים שאינם מימיים. במשך שנים רבות, ראשנים (Xenopus laevis) היו המודל הנבחר לחקר חומרי הרדמה בשל קלות מתן התרופות ופרמקוקינטיקה במצב יציב שהושגה על ידי הוספת אמבטיה פשוטה של חומר ההרדמה למי הבריכה המלאכותית שלהם 5,6. עם זאת, ישנן דוגמאות מעטות יחסית לחקר חומרי הרדמה נדיפים במודל זה בשל הדרישה למכשירים אטומים לגז שלעתים קרובות בנויים במיוחד ויכולים להיות מסורבלים לשימוש 7,8.
בשנים האחרונות הפך דג הזברה למודל מועדף לחקר חומרי הרדמה תוך ורידיים בשל אותה קלות במתן תרופות בנוסף ליתרונות אחרים כמו ההתנהגויות המורכבות המתוארות היטב שלהם וזמינות יחידות מסחריות לצפייה בהתנהגויות אלה9. מחקרים רבים שנערכו לאחרונה השתמשו ביחידות תצפית זמינות מסחריות כאלה כדי לסנן תרכובות נוירואקטיביות, כולל חומרי הרדמה, תוך שימוש בפורמטים של צלחות של 96 בארות ו-24 בארות כדי לכמת את התנהגות זחלי דג הזברה 4,10,11,12,13,14,15 . שלבי הזחל מתאימים במיוחד למחקרי פרמקולוגיה בשל יכולתם להעריך תגובות התנהגותיות רבות, גודלם הקטן, תאימות התפוקה הגבוהה והמעגלים העצביים המאופיינים היטב 9,16,17. עם זאת, מגבלה משמעותית אחת במחקרים אלה של חומרי הרדמה במודל דג הזברה היא הקושי היחסי במתן חומרי הרדמה נדיפים. מגבלה זו הובילה לדוגמאות מועטות להשוואה בין חומרים נדיפים לוורידים 4,15,18. היכולת ללמוד ולהשוות בקלות את שני סוגי חומרי ההרדמה במודל של חיה אחת מוסיפה כלי חשוב להקל על חקר פרמקולוגיה מרדימה בכל המחלקות.
באופן מסורתי, חקר חומרי הרדמה תוך ורידיים במין מימי דרש ציוד מיוחד, לעתים קרובות מותאם אישית, שיכול להיות קשה לשימוש או שאינו אטום מספיק לגז כדי למנוע אובדן חומר ההרדמה למשך הניסוי. ההליך המתואר כאן מציג אמצעי חלופי נגיש לייצור אטימה אטומה לגז בתא זכוכית המתאים לתצפית על התנהגות דג הזברה באמצעות יחידת תצפית מסחרית (ראה טבלת חומרים).
Protocol
כל הניסויים בדגי הזברה נערכו בהתאם לפרוטוקולי שימוש בבעלי חיים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC). דגי זברה בוגרים הוחזקו במתקן הימי של אוניברסיטת פנסילבניה תחת פיקוח המעבדה האוניברסיטאית למשאבי בעלי חיים (ULAR). דגי זברה ארוכי סנפיר מסוג טובינגן גודלו בבית לכל הניסויים ונשמרו בתנאי גידול סטנדרטיים עם מחזור אור/חושך של 13/11 שעות עד שהגיעו ל-5 ימים לאחר ההפריה (dpf). הניסויים נערכו באמצעות שכפולים ביולוגיים, עם מצמדים שמקורם בזוגות הזדווגות נפרדים כדי להבטיח מגוון ביולוגי הולם. פרטים על הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. ייצור יריעות סיליקון דביקות
הערה: ניתן להשיג מקבילות לחומר זה (יריעת סיליקון בתוספת דבק) ממקור מסחרי, אך לעתים קרובות בהוצאה גדולה יותר ובזמינות פחותה.
- הניחו את יריעת הסיליקון 0.5 מ"מ על משטח נקי וישר.
- בדוק את הסדינים לאיתור קמטים והימנע מהם במידת האפשר.
הערה: יריעות סיליקון עם קמטים עשויות שלא להיצמד כראוי לסרט ועלולות לגרום לאיטום לא מספק של הבארות ו/או להדמיה לקויה של דג הזברה. - נקו את הסדינים עם 70% אלכוהול כדי להסיר שמן או פסולת והניחו להם להתייבש.
- בעזרת מוליך, כגון מברשת, מרחו שכבה דקה ואחידה של פריימר דבק על יריעת הסיליקון. כדי למנוע מריחת יתר, עבדו בחלקים קטנים יותר מכיוון שמקדם הדבק מתייבש במהירות (מתייצב תוך 1-5 שניות).
הערה: ללא מקדם הדבקה זה, הסרט לא יידבק כראוי ליריעת הסיליקון. - לאחר מריחת מקדם הדבק, יישר את הסרט המצופה כפול עם יריעת הסיליקון כשגב הנייר פונה כלפי מעלה.
- מרחו את הסרט בהדרגה על הסיליקון באמצעות רולר כדי להחליק את פני השטח ולהסיר בועות אוויר (לאחר המריחה הראשונית, עבודה עם סיליקון כלפי מעלה תסייע בהדמיה והסרה של בועות אוויר).
- אפשר למקדם הדבק להתרפא לחלוטין למשך 24 שעות על משטח ישר.
- חותכים את הסיליקון הדביק לרצועות ברוחב 10 מ"מ לפחות (קוטר באר 7.5 מ"מ בתוספת חפיפה מכל צד).
הערה: בעת שימוש בכל שורה שנייה של לוחית הבאר, שונות רחבה יותר ברצועות לא תשפיע לרעה על בארות בשורות סמוכות, מה שעשוי לא רק להקל על היישום אלא גם להיות הכרחי כדי להשיג איטום סביב כל היקף הבאר.- ודא שהרצועות ארוכות מספיק כדי לכסות לפחות את רוחב שורה אחת של צלחת הבאר.
הערה: אם משתמשים בצלחת באר שאינה 96 באר, כגון צלחת 24 באר או 48 בארות, ניתן לכוונן או לחתוך את גדלי הרצועות כך שיתאימו למידות הספציפיות של הצלחת, מה שמבטיח כיסוי נכון ללא קשר לגודל הצלחת.
- ודא שהרצועות ארוכות מספיק כדי לכסות לפחות את רוחב שורה אחת של צלחת הבאר.
2. הכנת פתרונות
הערה: כל תמיסות המלאי והבדיקה של חומרי הרדמה נדיפים נעשו ממש לפני הניסוי כדי למנוע אובדן ריכוז התרכובות הנדיפות .
- עבור כל תמיסה (מלאי או תמיסת עבודה), הוסף נפח של ממס לא נדיף (מי עובר E3, DMSO וכו') לבקבוקון HPLC או נצנוץ שבשילוב עם הדילול הסופי של חומר הרדמה נדיף, הנפח הכולל ימלא את הבקבוקון במידה מספקת וישאיר מרווח ראש מינימלי (ראה איור 1A).
- הוסיפו חומר הרדמה נדיף עם מזרק אטום לגז של המילטון ואטמו במהירות את הבקבוקון.
הערה: ניתן להשתמש בתמיסות מלאי בבקבוקונים עם מכסי מחיצה כדי להקל על דילולים נוספים באמצעות העברת תמיסה עם מזרקים אטומים לגז. - לאחר מכן, מערבבים את הבקבוקונים (מערבולת, סוניקציה) לפי הצורך ומאחסנים אותם באופן זמני תוך כדי הכנת צלחות דג הזברה.
3. הגדרת הניסוי ההתנהגותי
הערה: שלב זה של הפרוטוקול עשוי לדרוש תרגול מסוים. מומלץ לעבוד ללא דגים או תמיסות המכילות חומר יקר עד שנוח עם הטכניקה.
- מעבירים דג זברה אחד (5 dpf) לכל שורה שנייה של צלחת הזכוכית בת 96 בארות.
הערה: השארת כל שורה שנייה ריקה מאפשרת פוטנציאל מופחת לזיהום בארות סמוכות מזליגה מכיוון שהבארות אטומות בשלב 3.4. - הסר בזהירות את תמיסת E3 מכל באר. ניתן לעשות זאת שורה אחת בכל פעם או על הצלחת כולה אם היא מסוגלת לעבוד במהירות.
הערה: משך הזמן שבו הזחלים היו מחוץ לתמיסה צומצם כדי להפחית את הלחץ הפוטנציאלי. ניתן להשתמש בהליכים חלופיים על סמך צרכים ניסיוניים שונים, כולל הסרה חלקית בלבד של התמיסה לפני הוספת התמיסה המכילה תרופה כדי למזער את הלחץ. יש להתאים את הפרוטוקול לצרכי הניסוי, כולל זמן שיווי משקל שניתן לבעלי החיים כדי לפצות על כל לחץ פוטנציאלי, יעילות ערבוב תמיסות ודיוק הריכוזים של תמיסה המכילה תרופה, אם לא כל ה-E3 מוסר לפני הוספת תמיסת העבודה. - לאחר מכן, השתמש בפיפטה העברה כדי למלא כל באר בשורה בתמיסה הניסיונית. הקפד לא להכניס בועות. מילוי יתר של כל באר (איור 1B).
- בעזרת רצועות הסיליקון הדביקות המיוצרות בשלב 1, לחץ את הרצועה כלפי מטה במהירות (איור 1C). זה עוזר למנוע היווצרות בועות ומונע מדגים לעלות על גדותיהם לבארות סמוכות.
- לחץ בחוזקה על החלק העליון של הצלחת כדי להבטיח שכל באר אטומה.
- חזור על שלבים 2-5 עד להחלפת התמיסה ואטימות הבארות עבור כל שורה שנייה של לוחית הבאר (איור 1D).
- הפוך בעדינות את הצלחת ובדוק אם יש בועות אוויר.
הערה: נוכחותן של בועות אוויר תטשטש את ההדמיה של תנועת דג הזברה. - הנח את הצלחת ביחידת תצפית ההתנהגות (צד דבק הסיליקון כלפי מטה) ובצע את הניסוי ההתנהגותי (ראה סעיף תוצאות לפרטים).
תוצאות
השוואה לתצפית מסורתית על בארות פתוחות
על מנת להעריך האם לאיטום דבק יש השפעה כלשהי על תנועה ספונטנית, נעשתה השוואה בין הבקרות בבארות פתוחות לעומת בארות אטומות. כפי שניתן לראות באיור 2A, לא נצפה הבדל מובהק סטטיסטית בתנועה בין הקבוצות האלה למשך הזמן הסטנדרטי של ~30 דקות ששימש בניסויים המתוארים במאמר זה. מתוך הכרה בכך שפרדיגמות ניסוי אחרות עשויות להזדקק לחשיפה ניסויית ארוכה יותר, בוצע קורס זמן של שעתיים, שלא חשף הבדל סטטיסטי בתנועה עד לציון השעתיים (ראה איור 2B). משך ניסוי ארוך יותר יביא ככל הנראה להפרש גדול עוד יותר בתנועה. מחקרים קודמים כימתו את ההשפעה השלילית של היפוקסיה על התנהגות השחייה19, ובסופו של דבר פגעו בשלמות תוצאות הניסוי. לפיכך, ההשערה היא כי היפוקסיה ו/או ייצור CO2 הם הגורמים הסבירים ביותר לסטייה זו ב-SM בהשוואה לבקרות באר פתוחות. למרבה הצער, האיטום האטום לגז המונע אובדן חומר הרדמה נדיף מהבאר הסגורה מונע גם דיפוזיה של גזים אחרים לתוך או מחוץ לתמיסה הסגורה. המשמעות היא, כמובן, דיפוזיה מוגבלת שלCO2 וחמצן כפי שהם מיוצרים ונצרכים בהתאמה על ידי הדגים. זוהי מגבלה חשובה ביחס למשך הניסוי האפשרי בשיטה זו. חשוב גם לציין שעם הזמן מתחילות להיווצר בועות קטנות בבארות שהיו בעבר נטולות בועות, ככל הנראה בגלל חילוף החומרים. עם זאת, במהלך הבדיקה, בועות אלו לא הפריעו למעקב אחר דג הזברה על ידי התוכנה. נראה כי לניסויים של עד שעה וחצי (בתוספת זמן שיווי משקל) אין השפעה משמעותית על מעקב ה-SM של דגי הזברה מסוג הבר הללו, אך דגים שמפגינים יותר תנועה או שיש להם דרישות מטבוליות מוגברות אחרות עשויים שלא להתאים לניסויים באורך כזה.
ריכוז חומרי הרדמה נדיפים לאורך זמן
כדי להבטיח ריכוז עקבי של חומר הרדמה נדיף לאורך זמן, נעשה שימוש בבארות ללא דג זברה למדידת מהלך זמן של ריכוז חומר ההרדמה כפי שנקבע על ידי HPLC. אותה תמיסה נוספה לכל באר, וריכוז הסבופלורן או האיזופלורן נמדד כל 15 דקות למשך 3 שעות (כל מדידה מבאר אחרת, בניגוד למדידות חוזרות מאותה באר). כפי שניתן לראות באיור 3, כמעט אף חומר הרדמה לא אבד לאורך כל מהלך הזמן עם סבופלורן (לחץ אדים של 197 מ"מ כספית ב-25 מעלות צלזיוס), שיש לו לחץ אדים נמוך יותר מאיזופלורן (לחץ אדים של 238 מ"מ כספית ב-25 מעלות צלזיוס) שהראה אובדן של 4% ב-3 שעות. אף אחד מחומרי ההרדמה הנדיפים לא הראה אובדן ניכר במרווח של 30 דקות עד 60 דקות, האופייני לניסויים התנהגותיים רבים.
עוצמת הסבופלורן בזחל דג הזברה
טכניקה זו שימשה למדידת העוצמה של חומרי הרדמה נדיפים בדגי זברה15, ועשויה להיות עדיפה על מתודולוגיות אחרות ששימשו בעבר4. הריכוז האפקטיבי החציוני (EC50) עבור סבופלורן על ידי מדדים של תנועה ספונטנית (SM) ותנועה מעוררת (EM) מוצג באיור 4. בטכניקת באר אטומה, נקבעו ערכי EC50 של 62 מיקרומטר (95% CI: 49-81) עבור SM, ו-126 מיקרומטר (95% CI: 81-193) עבור EM. ערך ה-SM דומה ל-EC50 שדווח בעבר של 76 מיקרומטר (95% CI: 50-114). עם זאת, הערך שדווח בעבר של 240 מיקרומטר (95% CI: 169-328) עבור EM הוא כמעט כפול מהערך שהתקבל כאן4. מבלי לבצע מחקר HPLC דומה של מתודולוגיה זו (גריז ואקום וכיסוי זכוכית ליצירת אטימה אטומה), לא ניתן לומר בוודאות אם הבדל זה נובע מאובדן חומר הרדמה נדיף לאורך זמן. עם זאת, זוהי השערה רציונלית, במיוחד בהתחשב בכך שהגירוי ל- EM (ברז אקוסטי) נרשם בסוף זמן התצפית ההתנהגותית. ללא קשר לשיטת איטום הבאר, לכל אובדן של ריכוז הסבופלורן תהיה ההשפעה הגדולה ביותר בנקודות זמן מאוחרות יותר. כמובן, הבדלים אלה יכולים לנבוע מגורמים בסיסיים אחרים, כגון הרקע הגנטי של דג הזברה.

איור 1: שלבים פרוצדורליים עיקריים. (א) בעבודה עם תמיסות נדיפות נעשה תכנון דילול כדי למזער את מרווח הראש בכל בקבוקון. (B) מילוי יתר של בארות מבוצע כאשר מוסיפים תמיסות ניסיוניות לאלה שמכילים דג זברה כדי לסלק בועות אוויר. (ג) רצועות דבק סיליקון מונחות מצד אחד של הצלחת לצד השני כדי למנוע לכידת אוויר. (ד) כל שורה שנייה משמשת לניסויים למניעת זיהום בארות סמוכות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
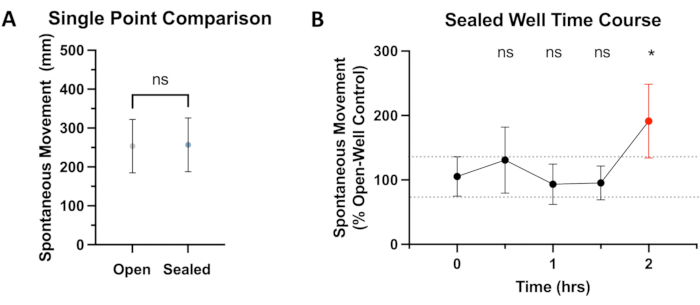
איור 2: השוואה של תנועה בבארות אטומות לעומת בארות פתוחות. (A) משווים תנועה ספונטנית כוללת מ-0 דקות ל-4 דקות לאחר שיווי משקל של 15 דקות ביחידה ההתנהגותית. תנועה של 5 ימים לאחר ההפריה (dpf) דג זברה בבארות פתוחות (254 מ"מ, 95% CI: 185-322) ובבארות אטומות (257 מ"מ, 95% CI: 186-326) אינה מראה הבדל משמעותי (P = 0.374). (B) אחרי תקופת הסתגלות של 15 דקות במערכת ההתנהגות של דג הזברה, דגים (N ≥ 36) נצפים לתנועה ספונטנית (מרחק הנסיעה הכולל) במשך תקופה של 4 דקות בתחילת כל חצי שעה. הנתונים מוצגים כאחוזי בקרה (בארות פתוחות), עם השוואות סטטיסטיות (ANOVA) שנעשו לנקודת הזמן של 0 שעות. באמצעות סף ערך P של <0.05, נצפה הבדל משמעותי בתנועה בין בארות פתוחות ואטומות בסימן 2 שעות (P = 0.0139), המודגש באדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
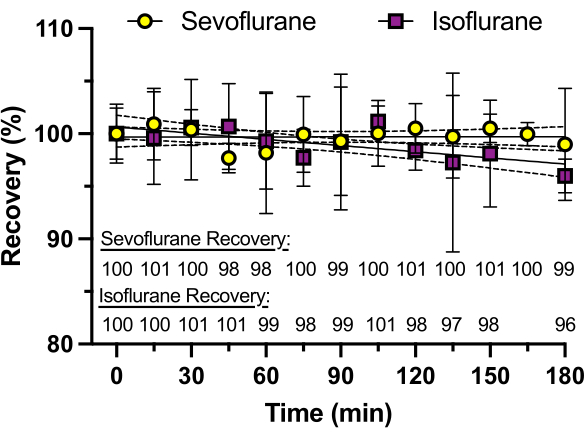
איור 3: התאוששות של סבופלורן לאורך זמן. ריכוזי הסבופלורן והאיזופלורן בלוחות באר זכוכית אטומים בדבק סיליקון נקבעים על ידי כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) לאורך תקופה של 3 שעות. אחוז התאוששות, המחושב כממוצע של שלושה שכפולים, מוצג בחלק התחתון של הגרף. איזופלורן מציג אובדן ריכוז של עד 4% לאחר 3 שעות, ככל הנראה בשל לחץ האדים הגבוה יותר שלו (238 מ"מ כספית ב-25 מעלות צלזיוס) בהשוואה לסבופלורן (197 מ"מ כספית ב-25 מעלות צלזיוס). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
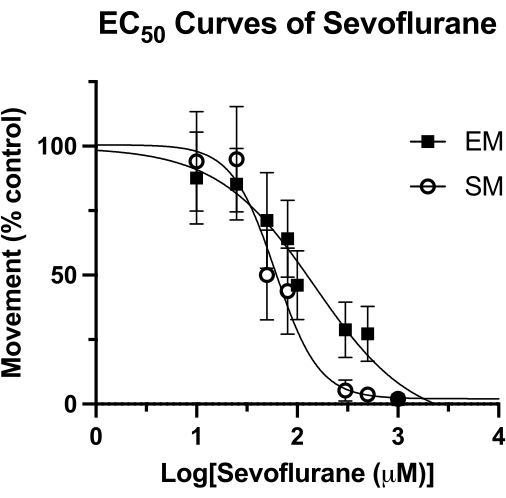
איור 4: עקומות Sevoflurane EC50 . עקומת סבופלוראןEC 50 בבארות אטומות נקבעת על סמך תנועה ספונטנית (על פני תקופה של 4 דקות), ותנועה מעוררת (פרק זמן של שנייה אחת לאחר הקשה אקוסטית) של דג זברה של 5 dpf. התנועה מותאמת לפקדי DMSO בלבד. הערך הסופי של EC50 מחושב כ-62 מיקרומטר (רווח בר-סמך 95%: 49-81) עבור תנועה ספונטנית (SM) ו-126 מיקרומטר (רווח בר-סמך 95%: 81-193) עבור תנועה מעוררת (EM). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מאמר זה מתאר שיטה למתן חומרי הרדמה נדיפים, כמו סבופלורן, לדגי זברה זחלים, ששימשה לכימות עוצמת ההרדמה הנדיפה בדגים מסוג בר. למרות שטכניקה זו פשוטה מבחינה רעיונית, ניתן לדרוש תרגול כדי להבטיח שורת בארות אטומה כראוי ונטולת בועות במסגרת זמן קצרה כדי למזער את אובדן החומרים הנדיפים. מכיוון ששיטה זו מיועדת לתרכובות נדיפות, היא דורשת לא רק מריחה זהירה של דבק הסיליקון על צלחת הבאר אלא גם הכנה מדוקדקת של פתרונות ניסיוניים כדי לייעל את הדיוק של ריכוזי תרכובות נדיפות.
לכידת אוויר עלולה לעכב הדמיה ומעקב מדויקים. בנוסף לתרגול האיטום, מילוי ובדיקה קפדניים של כל באר הם קריטיים מכיוון שלא סביר שכל בועות הקיימות לפני האיטום לא יוסרו במהלך תהליך האיטום. מילוי יתר של בארות מסייע גם במניעת לכידת אוויר בכל באר. עם זאת, מילוי יתר יתר עלול להוביל להעברה לא מכוונת של דגים לבארות סמוכות. אם זה קורה, נסה למלא פחות. מזעור מילוי יתר עודף לא רק יסייע להעברה לא מכוונת של דגים לבארות סמוכות, אלא עשוי לשפר את יעילות הדבק המשמש לאיטום בנוכחות כמויות גדולות של תמיסה עודפת. למרות שהדבק נבחר במיוחד בחלקו בשל יכולתו להיצמד למשטחים רטובים, התחלה עם פלטה נקייה ויבשה מבטיחה שאף חומר אחר לא יפריע להידבקות, ובכך משפר את השלמות הכוללת של מערך הניסוי. אם בועות עדיין נמשכות למרות היעדר בועות הרבה לפני מריחת הדבק, אופטימיזציה של מילוי יתר וטכניקת יישום דבק סיליקון, ייתכן שהסיבה לכך היא שימוש ברצועות דבק צרות מדי. רצועות שאינן רחבות מספיק עלולות לא לאטום, או לאטום בצורה לא מספקת כדי למנוע הכנסת אוויר במהלך תהליך היישום או לאחריו. הקדמה פוטנציאלית נוספת של שגיאה בטכניקה זו היא איכות האיטום המיוצר על ידי רצועות הסיליקון הדביקות, שיכולה להיגרם מקמטים בסיליקון, איטום לא מספיק של הדבק (פריימר דבק לא מספיק, זמן ריפוי או ניקוי משטחים לפני מריחת סיליקון). למרות שנראה שהדבק עצמו מספק אטימה הדוקה מספיק, ללא הסיליקון כגיבוי מגן, הדבק לבדו עלול להיכשל בעמידות נאותה למים כדי להגן מפני אמבט המים המסתובב לאורך כל הניסוי.
לוחות זכוכית מתאימים היטב ליישום זה מכיוון שבניגוד לפלסטיק רבים20, הם תואמים לחומרים הידרופוביים כמו חומרי הרדמה נדיפים, פני השטח שלהם שטוחים (בניגוד ללוחות באר פלסטיק טיפוסיים), המאפשרים הידבקות של פס הסיליקון, ויש להם תחתית שקופה (בניגוד לטפלון וכמה לוחות פלסטיק). לוחות באר קוורץ עשויים לספק בהירות אופטית מוגברת לניסויים שבהם יש צורך בהדמיה ברזולוציה גבוהה יותר. כל הנתונים לדוגמה המוצגים כאן התקבלו בלוחות זכוכית של 96 בארות, ולוחות דומים אחרים זמינים מסחרית בפורמטים גדולים יותר של בארות, אך אלה לא נבדקו על ידי המחברים. פתרונות נוספים בבאר גדולה יותר עשויים להגדיל את משך הזמן הפוטנציאלי של ניסוי בטכניקה זו עקב זמינות גדולה יותר של חמצן ועשויים גם להקל על ניסויים עם דגי זברה מבוגרים יותר, אך שינוי ניסוי בדרך זו ידרוש אימות נוסף. שינויים אחרים בטכניקה זו כוללים יישום של טכניקה זו על פרדיגמות התנהגותיות אחרות (למשל, גירויים כגון אור)21, מודלים גנטיים שונים, סוגים אחרים של מחקרים פרמקולוגיים (למשל, מתן משותף של תרופות), ואולי אפילו התאמה למחקרי הדמיה.
שיטה זו מספקת שיטה פשוטה ונגישה למתן תרכובות נדיפות לדגי הזברה לצורך תצפית התנהגותית. דגי הזברה הם מודל פופולרי יותר ויותר לחקר חומרי הרדמה, בפרט חומרי הרדמה תוך ורידיים (IV) (פרופופול, אטומידאט, קטמין וכו'). זה נובע בחלקו מהקלות במתן תרופות, אך ישנם גם שיקולים פרמקוקינטיים מופחתים בהשוואה למתן חומרי הרדמה לווריד למודלים של בעלי חיים שאינם מימיים (תולעים, זבובים, מכרסמים, בני אדם וכו') הדורשים מודלים של עירוי מבוקר מטרה למתן במצב יציב2. זה דומה למתן חומרים נדיפים בבעלי חיים אלה, שהוא פשוט כמו לשים את החיה בקופסה ולגרום להם לנשום את החומר מעורבב עם חמצן/אוויר. מתן חומרים נדיפים לבעלי חיים מימיים (דג זברה, ראשנים) מסובך יותר מכיוון שהוא דורש סביבה מימית אטומה. הבדל זה נוטה לחלק את השימוש במודלים מסוימים של בעלי חיים עבור חומרי הרדמה מסוימים, אך בשיטה המוצגת כאן, ניתן להעביר בקלות את שני סוגי חומרי ההרדמה לאותו מודל של בעלי חיים. היכולת להשוות בקלות פרדיגמות ניסיוניות שונות במודל יחיד למרות דרכי מתן שונות. זה יכול להיות מותאם גם לשימוש בחומרי הרדמה נדיפים באופן שמנצל את החוזקות האחרות של דג הזברה, כולל יכולת האחיזה הגנטית שלהם, התפתחות מהירה ועוברים שקופים, המאפשרים תצפית בזמן אמת על תגובות פיזיולוגיות. הבנת ההשפעה של חומרי הרדמה נדיפים, כגון איזופלורן וסבופלורן, בדגי הזברה יכולה לשפר את ההבנה של מנגנוני הפעולה ותופעות הלוואי שלהם. מתודולוגיה חדשנית זו מספקת מסגרת חזקה לחקירת חומרי הרדמה נדיפים בדגי זברה.
Disclosures
למחברים אין קונפליקטים לחשוף.
Acknowledgements
עבודה זו מומנה על ידי הקרן לחינוך ומחקר הרדמה (FAER). איור 1 נוצר בשנת BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
References
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved