Method Article
גישה מדורגת לביצוע ביופסיית ריאות טרנס-חזה מונחית אולטרסאונד
In This Article
Summary
ביופסיית ריאות מונחית אולטרסאונד טרנס-חזה מייצגת גישה בטוחה, חסכונית ויעילה עבור חולים המציגים נגעי ריאות תת-פלאורליים החשודים כממאירות. שימוש בתהליך שיטתי, שלב אחר שלב, הוא חיוני להשגת בחירת מטופלים אופטימלית, למזער סיכוני סיבוכים ולמקסם את דיוק האבחון.
Abstract
אבחון חולים עם נגעים רדיולוגיים בריאה, במיוחד אלה החשודים בסרטן ריאות ראשוני, הוא תרחיש קליני שכיח וקריטי. בבחירת ההליך הפולשני המתאים ביותר לקביעת אבחנה במקרים אלה, יש למצוא איזון עדין בין השגת תשואה אבחנתית גבוהה, מתן מידע על בימוי, מזעור סיבוכים פוטנציאליים, שיפור חווית המטופל ושליטה בעלויות. השילוב של אולטרסאונד חזה ככלי קליני שגרתי ברפואת הנשימה הוביל להגברת המודעות והשימוש בטכניקות פולשניות מונחות אולטרסאונד בפרוצדורות חזה, כולל ביופסיות דרך בית החזה. על ידי ביצוע גישה שיטתית ומדורגת, ביופסיית ריאות מונחית אולטרסאונד טרנס-חזה מתגלה כהליך בטוח וחסכוני עם דיוק אבחון יוצא דופן. תכונות אלה ממקמות אותה באופן קולקטיבי כטכניקה פולשנית אידיאלית כאשר הדבר אפשרי מבחינה טכנית. כתוצאה מכך, בחולים המציגים נגעי ריאה תת-פלאורליים החשודים כממאירות, ביופסיית ריאות מונחית אולטרסאונד דרך בית החזה הפכה להליך סטנדרטי בתחום הריאות הפולשניות המודרניות.
Introduction
קביעת אבחנה בחולים עם נגעים ריאתיים רדיולוגיים היא קריטית, במיוחד כאשר יש חשד לממאירות. דגימת רקמות חיונית לאישור ממאירות, קבלת מידע נוסף כמו גנוטיפ ושלב ואבחון נגעי ריאה לא ממאירים (למשל, זיהום או דלקת כלי דם)1,2.
קיימים מספר הליכים פולשניים לדגימת רקמות בחולים עם נגעי ריאות, כולל ברונכוסקופיה קונבנציונלית, ברונכוסקופיה בתוספת אולטרסאונד אנדוברונכיאלי רדיאלי (REBUS), ברונכוסקופיה ניווט אלקטרומגנטית (ENB), אולטרסאונד אנדוברונכיאלי (EBUS), אולטרסאונד אנדוסקופי (EUS), ביופסיה טרנס-חזה מונחית טומוגרפיה ממוחשבת (CT-TTNB) וביופסיה כירורגית 3,4,5,6 . בחירת ההליך האופטימלי כרוכה באיזון גורמים כמו תשואה אבחנתית, סיכוני סיבוכים, נוחות המטופל והקצאת משאבים3.
לרוב הטכניקות הללו יש מגבלות. לדוגמה, ברונכוסקופיה קונבנציונלית פחות יעילה לנגעים היקפיים, CT-TTB נושא סיכון גבוה יותר לסיבוכים (במיוחד פנאומוטורקס), והליכים כמו ENB וביופסיה כירורגית יכולים להיות יקרים 4,6,7.
ביופסיית מחט טרנס-חזה מונחית אולטרסאונד (US-TTNB) היא שיטה חלופית להשגת דגימות רקמה מנגעי ריאה. הטכניקה עצמה אינה חדשה, אך השימוש בה גדל משמעותית בחולים עם נגעי ריאות היקפיים ממקור לא ידוע, במיוחד בקרב רופאי ריאות, המשתמשים כיום באופן שגרתי באולטרסאונד חזה (TUS) לאבחון נקודתי והדרכה פרוצדורלית בסיסית בתרחישים קליניים שונים 8,9. בנוסף, ציוד אולטרסאונד זמין כעת באופן נרחב יותר, כאשר הכשרת TUS הופכת יותר ויותר רשמית ונגישה יותר לרופאים בשלב מוקדם יותר 9,10,11,12,13,14,15,16.
US-TTNB טומן בחובו מספר יתרונות פוטנציאליים. שיעורי הסיבוכים והעלויות הקשורות להליך נמוכים, בעוד שתפוקות האבחון נותרו דומות לגישות אחרות, במיוחד CT-TTB 17,18,19,19,20,2 1. עם זאת, המגבלה העיקרית שלו היא התאמתו רק לחלק מוגבל של נגעי ריאות שניתן לדמיין כראוי באמצעות TUS. לכן, לא ניתן להשתמש בו לנגעים שאינם נוגעים בצדר הקודקודי בדופן החזה, כגון כל גידול מרכזי; נגעים מאחורי מבנים בלתי חדירים לגלי אולטרסאונד, כגון עצם השכמה; או נגעים בעלי תכולת אוויר משמעותית, שגם אינם משדרים אולטרסאונד, כגון אטימות 'זכוכית קרקעית' שנראית ב-CT 8,9,17,18,19,20,22,21,22,23,24,25,26 . US-TTNB גם אינו מסוגל להעריך באופן סופי את שלב ה-N של סרטן הריאות, כלומר במקרים מסוימים, יש לשלב את ההליך עם הליך פולשני אחר כדי לספק תמונה מלאה 1,2.
עם זאת, US-TTNB נותר כלי קו ראשון חשוב ונמצא בשימוש הולך וגובר בפרקטיקה המודרנית של רפואת ריאות פולשנית בחולים נבחרים עם חשד לנגעי ריאות ממאירים 9,18.
אינדיקציות והתוויות נגד
US-TTNB מסומן כאשר כל הקריטריונים הבאים מתקיימים: (1) איחוד ריאות תת-פלאורלי שניתן לדמיין באמצעות אולטרסאונד בית החזה; (2) ביופסיית רקמת ריאה מוצדקת קלינית (למשל, לקביעת אבחנה, השגת חומר לניתוחי אבחון משלימים). אין לבצע US-TTNB כאשר מתקיים אחד או יותר מהקריטריונים הבאים: (1) אי ספיקת נשימה כרונית או חריפה בגלוי; (2) דיאתזות דימומיות; (3) טיפול מתמשך בנוגדי קרישה או מעכבי צבירת טסיות דם; (4) שיטה פולשנית נוספת לדגימת רקמות יכולה לבסס אבחנה ובו זמנית לספק N- או M-staging (למשל, EBUS/EUS-B בחולים עם חשד לסרטן ריאות וחשד למעורבות של בלוטות לימפה מדיאסטינליות).
עם זאת, יש לציין כי התוויות נגד המפורטות הן בדרך כלל יחסיות. הרופא, בהסכמה עם המטופל, צריך לשקול את ההשלכות הקליניות של קבלת ביופסיה על ידי US-TTNB ולאזן זאת מול הסיכון לסיבוכים ושיטות פולשניות או אבחנתיות פוטנציאליות אחרות שניתן לבצע במקום US-TTNB.
Protocol
הפרוטוקול המתואר להלן עוקב אחר הנחיות הטיפול בבני אדם של בית החולים האוניברסיטאי אודנסה, אודנסה, דנמרק, ואוניברסיטת דרום דנמרק, אודנסה, דנמרק. הפרוטוקול ההדרגתי המתואר להלן מייצג גישה פוטנציאלית ושיטתית לחולה טיפוסי עם חשד לסרטן ריאות שעבורו US-TTNB בוצע במסגרת אשפוז או מקרה יום. התקבלה הסכמה מדעת בכתב מהמטופל. לקחנו בחשבון את הפרקטיקות הקליניות הנוכחיות במוסדות המחברים, כמו גם תיאורים ממאמרים שפורסמו בעבר 9,13,17,26, וביקשנו להשיג איזון בין הצלחה אבחנתית סבירה, עלויות וחווית המטופל, כמתואר בהקדמה. עם זאת, ניתן וצריך לשנות את הגישה בהתאם להבדלים מקומיים בציוד הזמין, בהגדרות הקליניות, בהעדפות המטופל ובדרישות הספציפיות לחומר הביופסיה המתקבל, כולל אם יש חשד לנגע לא ממאיר. כל US-TTB צריך להתבצע גם בהתאם להנחיות ולתקנים המקומיים, הלאומיים והבינלאומיים הקיימים, במידת הצורך. הפרוטוקול תלוי בכך שיש רופא אחד שהוכשר ומוכשר לבצע US-TTNB ועוזר אחד, כגון אחות פרוצדורלית. שניהם צריכים להיות בעלי ניסיון מספיק עם ההליך וצריכים להיות בטוחים בניהול סיבוכים חריפים אפשריים.
1. הערכה טרום פרוצדורלית של מידע קליני זמין והדמיה
- לפני ביצוע ההליך ויידוע המטופל, הערך את המידע הקליני הזמין כדי לוודא שההליך מצוין ורלוונטי מבחינה קלינית.
- ודא שאין התוויות נגד מוחלטות לביצוע ההליך, כגון קרישת דם לא מתוקנת, אי ספיקת נשימה מובהקת, אלרגיות ידועות לתרופות הנדרשות להליך, או מטופל שאינו מסוגל לשתף פעולה עם ההליך.
- העריכו את נוכחותן של התוויות נגד יחסיות, ואם קיימות, וודאו שההשפעה הקלינית הפוטנציאלית של ביצוע ההליך עולה על הסיכונים הנלווים. התוויות נגד יחסיות עשויות לכלול FEV1 מופחת, שימוש בתרופות נוגדות טסיות מסוימות או מחלת ריאות בסיסית.
- סקור את הדמיית החתך הזמינה, במיוחד CT וטומוגרפיה של פליטת פוזיטרונים (PET), אם זמינה. ודא שנגע המטרה נמצא במגע עם הצדר הוויסרלי, הממוקם באזור שסביר להניח שיהיה נגיש באמצעות TUS, וניתן להגיע אליו באמצעות מחט ביופסיה.1
הערה: במידת הצורך, שקול גם אילו נגעים לביופסיה והאם יש לתעדף אזורים ספציפיים של הנגעים שנבחרו (למשל, אזורים שאינם נמקיים).
2. בקרת ציוד טרום פרוצדורלי
- ודא שכל הציוד הדרוש להליך (ראה טבלת חומרים) זמין בחדר הפרוצדורה, עם חלפים במידת הצורך.
- ודא שהציוד הדרוש לטיפול בסיבוכים חריפים, במיוחד פנאומוטורקס, כאבים עזים ודימום, זמין בחדר הפרוצדורות ומתפקד באופן מלא.
- הפעל את המכונה האמריקאית וודא שהמתמרים הרלוונטיים זמינים ומתפקדים במלואם (ראה טבלת חומרים).
3. בדיקה והסכמה של המטופל
- ודא שהוא המטופל הנכון להליך הנתון ושהחומרים הרלוונטיים (למשל, תרשים מטופל, הדמיה) ותוויות נכונים גם הם. במרכזים מסוימים, ייתכן שתידרש רשימת בדיקה לפני ההליך בהתאם להנחיות המקומיות והארציות27.
- ספק למטופל (ו/או מיופה כוח, במידת הצורך) מידע בעל פה ובכתב בנוגע להליך US-TTNB, המכסה את השלבים האישיים לפני, במהלך ואחרי ההליך.
- כמו כן, ספק מידע בעל פה ובכתב לגבי הסיבוכים הנפוצים ביותר (למשל, כאב מקומי לאחר ההליך) ונדירים אך חמורים (למשל, פנאומוטורקס, המוטורקס).
- ודא שאין אלרגיות רלוונטיות לתרופות/חומרים כלשהם המשמשים במהלך ההליך.
- תעד הסכמה מדעת בכתב להליך מהמטופל (ו/או מיופה כוח, במידת הצורך).
4. מיקום המטופל
- השתמש באתר הביופסיה הנבחר (ראה שלב 1.4) כדי לקבוע את מיקום המטופל האופטימלי להליך.
הערה: בדרך כלל, תנוחת שכיבה נבחרת לנגעים הממוקמים מלפנים או קדמיים-לרוחב. ניתן להניח את המטופל על צדו, כאשר יש לבצע ביופסיה של ההמיטורקס כלפי מעלה, לנגעים הממוקמים מאחור או אחוריים-לרוחב. - העריכו אם המטופל יוכל לשכב ולשמור על התנוחה הנחשבת אופטימלית להליך US-TTNB (ראה שלב 1.4) למשך 30 דקות לפחות.
הערה: אם התשובה לשלב 4.2 היא כן, הנח את המטופל במצב הנתון. אם התשובה היא לא, מקם את המטופל בתנוחה חלופית (למשל, ישיבה), בהנחה שעדיין יש תנוחה מקובלת להליך מנקודת המבט של המפעיל והמטופל. אם החזקת התנוחה עדיין אינה אפשרית, שקול פתרונות חלופיים לטיפול בנוחות המטופל (למשל, אופיואידים תוך ורידיים במקרה של כאב מקומי בתנוחה נתונה). לעיתים, ייתכן שיהיה צורך במעבר למודאליות חלופית, כגון CT-TTNB (איור 1).
5. אולטרסאונד בית החזה לפני ההליך
- הזן את מזהה המטופל למכשיר האולטרסאונד כדי לאפשר אחסון של תמונות/קליפים בארה"ב, אותם יש לשמור לעתים קרובות במהלך ההליך.
- בחר את המתמר האופטימלי על סמך מיקום וגודל הנגע. בדרך כלל, מתמר מעוקל בתדר נמוך (בטן) הוא אופטימלי. מתמר ליניארי בתדר גבוה יותר הוא אלטרנטיבה לחולים רזים מאוד ו/או נגעים קטנים מאוד.
- בחר הגדרה מוגדרת מראש כללית של הבטן או הריאות.
- זהה את נגע המטרה באמצעות US דו-ממדי קונבנציונלי ומטב את איכות התמונה והמיקום בארה"ב באמצעות עומק, רווח ומיקוד.
- העריכו את נגע המטרה בשיטת "גלגל עיניים" פשוטה וקבעו: (1) המראה (למשל, היפו/היפר-אקואי, דפוס מעורב), (2) התיחום שלו (למשל, מסומן היטב/מפוזר), (3) סימנים של צמיחה פולשנית ברורה (למשל, צמיחה גלויה לדופן החזה), ו-(4) סימנים עקיפים של צמיחה פולשנית אפשרית (למשל, היעדר החלקה של ריאות ללא גידול פולשני נראה לעין)9 (איור 2).
- מדוד את נגע המטרה בשני מישורים לפחות ומדוד את אורך המגע הצדר (איור 2).
- בצע הערכת דופלר צבעונית משלימה של נגע המטרה והמבנים הממוקמים באופן שטחי יותר (למשל, דופן בית החזה) ושים לב לנוכחותם: (1) סימנים של ניאו-וסקולריזציה, (2) כלי דם גדולים יותר (למשל, עורקים בין-צלעיים) שיש להימנע מהם במהלך הליך הביופסיה 9,13.
- בצע הערכה ממוקדת של ההמיטורקס הפגוע כדי לקבוע אם קיימת החלקה ריאתית, תפליט פלאורלי או פתולוגיה ברורה אחרת לפני הליך הביופסיה.
- בהתבסס על שלבים 1.4 ושלבים 5.5-5.7, בחר את האזור בתוך נגע המטרה לביופסיה.
- השתמש במערכת הנחיית הביופסיה במכונה האמריקאית כדי לסייע בבחירת זווית המחט האופטימלית. שימו לב לגודל הביופסיה הבטוח ככל הנראה (רוב מחטי החיתוך מגיעות עם אפשרות לביופסיה באורך 2 ס"מ או 1 ס"מ, כאשר האחרונה מתאימה יותר בנגעים קטנים יותר או באלה הסמוכים למבנים חיוניים).
- אשר מחדש את אופטימיזציה של התמונה לאחר בחירת זווית הביופסיה האופטימלית.
- קבע את המתמר (ראה טבלת חומרים) במיקום האופטימלי לקבלת ביופסיה וסמן את המיקום על עור המטופל.
- אם הנגע נע בסנכרון עם נשימת המטופל, בקש מהמטופל לבצע עצירת נשימה כדי להבטיח שהמטופל יוכל לעצור את נשימתו למשך זמן מספיק כדי לקבל ביופסיה (בסביבות 10-20 שניות).
6. ניטור ובטיחות המטופל
- חבר את המטופל למערכת ניטור פיזיולוגית (ראה טבלת חומרים) כדי לאפשר בדרך כלל הערכה רציפה או קבועה של: (1) רוויה, (2) דופק כולל א.ק.ג, ו-(3) לחץ דם.
- הכנס ושטוף קטטר ורידי היקפי (בדרך כלל בגודל מינימלי של 20 גרם).
7. הכנת ציוד ביופסיה
- חבר את מערכת הנחיית הביופסיה למתמר שנבחר להליך. הגדר את הזווית של מערכת הנחיית הביופסיה כך שתתאים לזווית שנבחרה בעבר במכונה האמריקאית (שלב 5.10).
- מרחו ג'ל אולטרסאונד (ראה טבלת חומרים) על המתמר ואבטחו אותו ב"מחזיק המתמר" במכונה האמריקאית.
- הכינו עגלה סטרילית וסדרו את הציוד הדרוש להליך הביופסיה (איור 3).
- ודא שהמפעיל לובש כפפות סטריליות (עם או בלי חלוק).
- יש לחטא את אזור הביופסיה ואת אזור העור שמסביב פעמיים.
- הצמד וילון כירורגי (ראה טבלת חומרים) עם חור לעור המטופל, תוך שימוש בסימן שנעשה בשלב 5.11 כמדריך.
הערה: אם המפעיל בוחר לא להשתמש בוילון כירורגי, יש לחטא שטח גדול יותר ולהניח וילון מתחת לאתר הביופסיה כדי להבטיח שכל דימום עור קל מאתר הביופסיה מוכל. - ערכו נפח מתאים של חומר הרדמה מקומית (למשל, 20 מ"ל של 1% לידוקאין, ראו טבלת חומרים) במזרק. ודא שכמות ההרדמה המקומית הניתנת למטופל אינה עולה על המינון המקסימלי המומלץ למשקלו. חבר מחט היפודרמית 21 גרם למזרק.
הערה: האורך האופטימלי של מחט 21 גרם יהיה תלוי באורך מסלול המחט מהעור לאזור הביופסיה. ברוב החולים, אורך של 10 ס"מ הוא אופטימלי. - פתח את ערכת הביופסיה הסטרילית של מתמר ארה"ב (ראה טבלת חומרים) והנח את תכולתה על השולחן הנייד הסטרילי.
- בסיוע, מקם את מכסה המתמר הסטרילי מעל המתמר, וודא שהג'ל האמריקאי שהוחל בעבר יתפזר באופן שווה בין "טביעת הרגל" של המתמר לכיסוי הסטרילי.
- הנח את שתי הרצועות האלסטיות מערכת הביופסיה הסטרילית בבסיס המתמר כדי להבטיח התאמה צמודה בין המתמר למכסה המתמר, ללא אוויר משמעותי שנלכד מתחת למכסה.
- חבר את ידית הפלסטיק מערכת הביופסיה הסטרילית של מתמר ארה"ב הן למתמר האמריקאי והן למערכת הנחיית הביופסיה האמריקאית.
- הכנס את מתאם המחט 21 G לידית הפלסטיק של מערכת מוביל הביופסיה של המתמר האמריקאי.
- מרחו ג'ל סטרילי מערכת הביופסיה הסטרילית על המתמר.
8. הזרקת חומרי הרדמה מקומית
- מקם את המתמר באזור האופטימלי שנבחר בעבר לביצוע הביופסיה וודא שזווית המחט שנבחרה ממוקמת בצורה אופטימלית ביחס לאזור הביופסיה הנבחר. אבטח את המתמר ביד המחזיקה אותו כדי להבטיח יציבות מלאה במהלך הזרקת חומר ההרדמה המקומי.
- קחו את המזרק עם חומר ההרדמה המקומי והניחו אותו במערכת הנחיית הביופסיה מבלי לקדם אותו לעור המטופל. ודא שהמזרק ממוקם בצורה שמיישרת את קצה המחט במקביל לטביעת הרגל של המתמר.
הערה: זה ממקסם את שטח הפנים של קצה המחט הנראה על מסך האולטרסאונד, ומאפשר הדמיה אופטימלית. - הודע למטופל כי יופעל הרדמה מקומית והדגיש את החשיבות להישאר בשקט גם אם היישום גורם לאי נוחות.
- הכניסו לאט את המזרק עם חומר ההרדמה המקומי לעור ולרקמה התת עורית (איור 4).
הערה: תוך כדי כך, ודא את הדברים הבאים: (1) הדמיה רציפה של קצה המחט על מסך האולטרסאונד, (2) שאיפה לפני ההזרקה כדי לאשר שההרדמה המקומית אינה מוזרקת לכלי דם, (3) התמקד במריחת רוב ההרדמה המקומית באזור התת עורי ממש מתחת לעור ובאזור השטחי בלבד לצדר הקודקודית, מכיוון שאזורים אלה הם הרגישים ביותר (איור 5). - לאחר מריחת ההרדמה המקומית, יש למשוך לאט ולהסיר את המזרק.
- הסר את המתמר מעור המטופל והמתן לפחות 3 דקות כדי להבטיח את מלוא ההשפעה של ההרדמה המקומית לפני שתמשיך.
9. הליך ביופסיה
- הסר את מתאם המחט 21 G מידית הפלסטיק של מערכת מדריך הביופסיה של המתמר האמריקאי והכנס במקום זאת את מתאם המחט 18 G.
- הכן את מחט הליבה של הביופסיה על ידי הבטחה שניתן "לטעון", "לירות" את קפיץ מחט הביופסיה ללא כוח מופרז, והודע למטופל שהצליל שנוצר כאשר מחט הביופסיה "נורה" הוא תקין.
- "טען" את מחט הביופסיה הליבה לאורך הביופסיה שנקבע מראש (בדרך כלל 1 או 2 ס"מ) כפי שנקבע בשלב 5.9.
- בעזרת אזמל מבצעים חתך קטן של כמה מילימטרים בעור המתאים לחור שהותירה המחט ממריחת חומר ההרדמה המקומי. אם החתך כואב, המתן 2 דקות נוספות ולאחר מכן בדוק שוב עם להב האזמל. אם עדיין יש כאב, יש לחזור לשלב 8.2 ולמרוח חומר הרדמה מקומי נוסף, תוך הקפדה לא לחרוג מהמינון המקסימלי המומלץ.
- קח את מחט הביופסיה המרכזית והנח אותה במערכת הנחיית הביופסיה מבלי לקדם אותה לעור המטופל.
- מקם את המתמר עם מחט הביופסיה המותקנת על עור המטופל באתר הביופסיה.
- הכנס את קצה מחט הביופסיה הליבה כמה מילימטרים לתוך החור שנוצר קודם לכן בעור באמצעות אזמל.
- התאם בזהירות את הזווית והסיבוב של המתמר תוך שמירה על מגע טוב בעור כדי להבטיח: (1) איכות תמונה אופטימלית לכל אורך מסלול המחט/ביופסיה ו-(2) מיקום אופטימלי של מסלול הביופסיה ביחס לאזור הביופסיה והימנעות ממבנים וצלעות חיוניים. לאחר מציאת המיקום האופטימלי, אבטח את המתמר ביד.
- קדם בהדרגה את מחט הביופסיה המרכזית ביד השנייה תוך מעקב צמוד אחר התקדמות קצה המחט על מסך ה-US (איור 6).
הערה: ברגע שקצה המחט ממוקם באופן שטחי לצדר הקודקוד, השלבים הבאים יהיו תלויים בשאלה אם נגע הריאות נע בסנכרון עם נשימת המטופל או אם הוא מקובע לדופן החזה. - בקש מהמטופל לעצור את נשימתו כאשר נגע המטרה ממוקם בצורה אופטימלית ביחס למסלול הביופסיה. לאחר שהמטופל עוצר את נשימתו, המשך לשלב 9.11. שים לב שיש למזער את הזמן לשלבים 9.11 עד 9.13 כדי למנוע תנועה נשימתית מקרית של הנגע בזמן החדרת מחט הביופסיה.
- קדם את קצה מחט הביופסיה דרך הצדר עד שהקצה ממוקם ממש ליד "אזור המטרה של הביופסיה" במסלול המחט.
- קדם את הסגנון הפנימי של מחט הביופסיה הליבה המתאים לאורך הביופסיה שנקבע מראש בעת "טעינה" של המחט (שלב 9.3). תוך כדי קידום הסגנון הפנימי, ודא שחריץ הדגימה ממוקם בצורה אופטימלית באזור ביופסיית המטרה (איור 7).
- הודע למטופל שמחט הביופסיה "תיורה" כעת.
- "לירות" את מחט הביופסיה הליבה ולאחר מכן לאט לאט לאחור ולהוציא את מחט הביופסיה הליבה מהמטופל. לאחר הסרת המחט, הסר גם את המתמר.
- טען מחדש את מחט הביופסיה הליבה על ידי משיכה לאחור של הבוכנה. קדם את הסגנון הפנימי והסר את דגימת הרקמה, והנח אותה במיכל הביופסיה הרלוונטי (איור 8). זה עשוי לדרוש סיוע בשימוש במחט קטנה.
- לאחר הסרת הביופסיה מחריץ הדגימה, החזר את הסגנון הפנימי, והנח שוב את מחט הביופסיה הליבה במערכת ההנחיה של ביופסיית המתמר בארה"ב.
- חזור על שלבים 9.5 עד 9.14 עד לקבלת מספר מספיק של ביופסיות.
הערה: בעת חזרה על שלב 9.8, ודא: (1) אין סימנים מיידיים לסיבוכים בארה"ב (למשל, אובדן החלקה של הריאות, מה שמרמז על פנאומוטורקס), ו-(2) התאם מעט את זווית הביופסיה (במידת האפשר) כדי לקבל ביופסיות מאזורים שונים בתוך נגע המטרה. - לאחר שהביופסיה האחרונה הונחה במיכל דגימת הביופסיה, סגור את המיכל והוסף כל חומר קיבוע/נוזל רלוונטי למיכל בהתאם למדיניות המקומית. צרף את כל תוויות הזיהוי הדרושות למטופל ולדוגמא, ובדוק שוב שהן נכונות.
10. אולטרסאונד בית החזה לאחר ההליך
- לאחר הביופסיה האחרונה, יש לבצע TUS ולהעריך אם יש סיבוכים מיידיים (למשל, פנאומוטורקס, המוטורקס) באתר הביופסיה. אם אין סימנים, יש למרוח תחבושת סטרילית כדי לכסות את חתך הביופסיה הקטן.
- כאשר המטופל במצב שכיבה, בדוק את המשטח הקדמי של ההמיטורקס לאיתור סימנים של פנאומוטורקס, וכאשר המטופל בישיבה, הערך את המשטח האחורי לסימנים של התפתחות המוטורקס.
11. תצפית ומידע על מטופלים לאחר ההליך
- אם המטופל אינו מראה תסמינים, יש לו סימנים חיוניים יציבים ואינו מראה סימני אולטרסאונד לסיבוכים מיידיים, הסר את ניטור המטופל. השאר את הצנתר הוורידי ההיקפי במקומו.
- אפשרו למטופל להתלבש בבגדיו והורו לו להמתין בחדר ההמתנה למשך שעה.
- אם, תוך שעה לאחר ההליך, המטופל לא הראה סימנים או תסמינים כלשהם ונחשב יציב מבחינה קלינית, הסר את הצנתר הוורידי ההיקפי ושחרר את המטופל עם הניירת הדרושה. אם המטופל אכן מראה סימנים או תסמינים או נחשב לא יציב מבחינה קלינית על ידי הצוות, בצע הערכות קליניות ורדיולוגיות נוספות כדי לקבוע את הצעדים הבאים.
- לפני השחרור, ודא שהמטופל וכל קרובי משפחתו הבינו את הדברים הבאים: (1) מידע בעל פה ובכתב לגבי אופן התגובה במקרה שמתפתחים סימני סיבוכים לאחר השחרור ו-(2) התוכנית מתי וכיצד המטופל יקבל את תוצאות הביופסיה שהושגה.
תוצאות
התשואה האבחנתית הכוללת של US-TTNB בחולים עם נגעי ריאות דווחה כ-88.7% במטא-אנליזה של DiBardiono et al.18. עם זאת, יש לציין כי מחקרים אחרים דיווחו על תפוקות אבחון נמוכות יותר של US-TTNB 17,23,25. הוכח כי מספר גורמים למטופלים משפיעים על התפוקה האבחנתית של US-TTNB, כולל: (1) האם יש מצב ממאיר או לא ממאיר; (2) גודל נגע המטרה; (3) נוכחות של גידול פולשני; (4) אורך המגע הצדר 17,25,28,29.
פרוטוקול US-TTNB המתואר לעיל מיועד להשגת ביופסיית מחט ליבה US-TTNB (איור 8) להערכה היסטולוגית, אך ניתן גם להשתמש באותם עקרונות להשגת שאיבת מחט טרנס-חזה מונחית אולטרסאונד (US-TTNA) להערכה ציטולוגית. מחקר יחיד הצביע על כך שהתשואה האבחנתית של US-TTNA ו-US-TTNB עשויה להשתנות בין סוגים שונים של סרטן ריאות, מה שמצביע על כך שהבחירה בטכניקת הדגימה לא תמיד תהיה עניין של השגת "הביופסיה הגדולה ביותר האפשרית"30. כמה מחקרים תיארו גישת הליך משולב שבה US-TTNA מבוצע בהתחלה, ואחריו US-TTNB באותו הליך, מה שעשוי להגדיל את תפוקת האבחון24,30.
ניתן לשלב US-TTNB גם עם אולטרסאונד משופר ניגודיות (CEUS) כהרחבה של הערכת אולטרסאונד בית החזה לפני ההליך31. הוכח כי השימוש ב-CEUS קדם-פרוצדורלי מגדיל את התשואה האבחנתית של US-TTNB32. בדומה להליכים פולשניים אחרים בחזה, ניתן לשלב US-TTNB גם עם הערכה מהירה באתר (ROSE) של דגימות הרקמה שהתקבלו כדי לשפר את יעילות האבחון33.
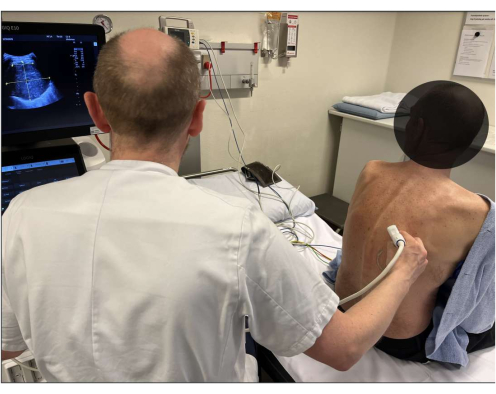
איור 1: מיקום המטופל. הערכת אולטרסאונד חזה דו-ממדית בסיסית של נגע המטרה מבוצעת לפני ההליך, ובמקביל קובעת את מיקום המטופל האופטימלי להתערבות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
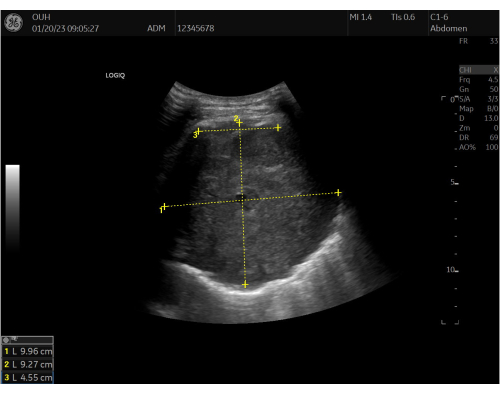
איור 2: מדידות אולטרסאונד בסיסיות. הערכת אולטרסאונד בית חזה דו-ממדית בסיסית ומדידות מוכנסות של נגע המטרה לפני ההליך. מדידות לרוחב (1), עומק (2) ואורך מגע פלאורלי (3) מסומנות בתמונת האולטרסאונד. הנגע מתואר כמבנה מוגדר היטב, מעוגל, היפר-אקואי (אפור). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: עגלת נוהל מוכנה. הציוד הנדרש להליך US-TTNB (ביופסיית מחט טרנס-חזה מונחית אולטרסאונד) מאורגן ומוכן על עגלה סטרילית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
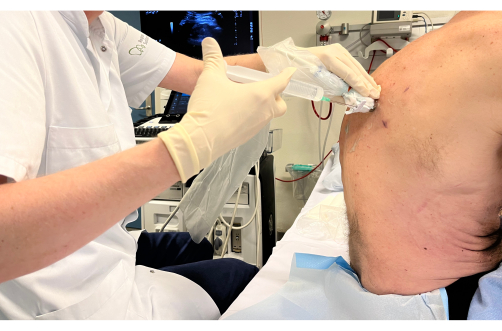
תרשים 4: הזרקת חומר הרדמה מקומית. המזרק המכיל את ההרדמה המקומית ממוקם במערכת הנחיית הביופסיה ומוזרק לעור ולרקמה התת עורית עם הדמיה רציפה של קצה המחט על מסך האולטרסאונד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: הערכת מיקום קצה המחט בהרדמה מקומית. קצה מחט ההרדמה המקומית נראה (A) באזור הגבול בין קו הצדר לגידול הריאה הבסיסי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: מיקום מחט ביופסיה ליבה. מחט הביופסיה הליבה מוכנסת בהדרגה תוך מעקב קפדני אחר התקדמות קצה המחט במסך האולטרסאונד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: מחט ביופסיה ליבה לפני ביופסיה. ביופסיית מחט הליבה נראית ממש לפני שהיא "יורה". קצה המחט (A) ממוקם כ-2 ס"מ בתוך הגידול, מה שמאפשר ביופסיית ליבה מלאה של 2 ס"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
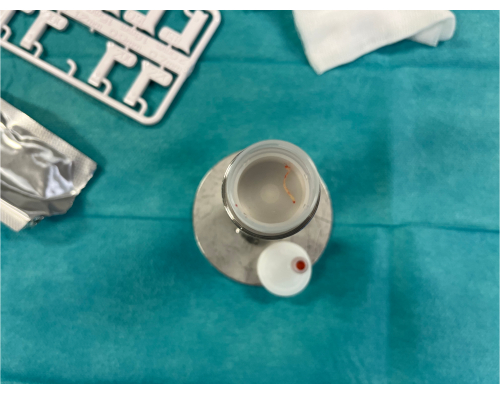
איור 8: דגימת ביופסיה ליבה שהושגה. דגימת ביופסיית ליבה של 2 ס"מ מגידול הריאה הונחה במיכל הדגימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
בחירת מטופל מתאימה והערכה ראשונית קפדנית של TUS הם שלבים חיוניים לפני ביצוע US-TTNB. אם לא ניתן לדמיין את נגע הריאות, US-TTNB אינו אפשרות מעשית. באופן אידיאלי, יש לבצע TUS לפני קביעת מועד ההליך במהלך הביקור במרפאה כדי למנוע ביטולים של הרגע האחרון בחדר הפרוצדורלי17. גישה זו מאפשרת גם תכנון מקיף יותר ומעבר פוטנציאלי להליך פולשני חלופי אם לא ניתן לדמיין את הנגע17.
שלושה מחקרים שהשוו ישירות US-TTNB עם ביופסיית מחט טרנס-חזה של טומוגרפיה ממוחשבת (CT-TTNB) מצאו תפוקות אבחון דומות 19,20,34. ממצאים אלה עולים בקנה אחד עם ההשוואה בין US-TTNB ל-CT-TTNB כחלק ממטא-אנליזה שהוזכרה קודם לכן על ידי DiBardiono et al.18.
שיעור הסיבוכים עבור US-TTNB הוא בדרך כלל נמוך מאוד17. השיעור המצטבר של חולים הסובלים מפנאומוטורקס לאחר US-TTNB צוין כ-4.4%18, נמוך משמעותית בהשוואה ישירה ל-CT-TTNB 18,19,20,21.
בעוד שמחקרים המעריכים את זמן ההליך של US-TTNB מוגבלים, בהשוואה ל-CT-TTNB, ל-US-TTNB יש זמן הליך חציוני קצר יותר20,21. מבחינת עלות, קרינה וסביבה, US-TTNB מכביד פחות משמעותית מ-CT-TTNB, החושף הן את המטופלים והן את הצוות לקרינה ויש לו טביעת רגל פחמנית גדולה יותר מאשר אולטרסאונד20,35.
למרות מחקרים רבים על חינוך, הכשרה והערכת כשירות בתחום אולטרסאונד בית החזה, מחקר המעריך באופן ספציפי היבטים אלה ביחס ל-US-TTNB הוא נדיר ואינו נכלל בתוכנית ההכשרה המוסמכת של האגודה האירופית לנשימה באולטרסאונד חזה 15,16,36,37. מחקר יחיד העריך את עקומות הלמידה של US-TTNB ומצא כי מספר מפעילים בעלי מיומנות באולטרסאונד בית החזה לא השיגו מיומנות ב-US-TTNB למרות ביצוע פרוצדורות מרובות38. לכן, עדיין יש צורך במחקר נוסף על חינוך, הכשרה והערכת מיומנויות ב-US-TTNB.
ניתן לשנות את גישת US-TTNB המתוארת על ידי שילוב אולטרסאונד משופר ניגודיות (CEUS) כחלק מהערכת אולטרסאונד בית החזה הראשונית לפני ביצוע הביופסיה. גישה זו מציעה הדמיה משופרת של אתר הביופסיה הספציפי בתוך הנגע, הבחנה מדויקת יותר בין רקמת ריאה שפירה לממאירה וזיהוי קל יותר של אזורים נמקיים31. ניתן לשלב US-TTNB מונחה CEUS בצורה חלקה בפרוטוקול המתואר לעיל, והספרות מדווחת על עלייה משמעותית בתפוקת האבחון בהשוואה ל-US-TTNB32,39 קונבנציונלי.
בעוד שהפרוטוקול שלנו התמקד בשימוש בו בחולים עם נגעים ריאתיים החשודים כממאירות בריאות, עקרונות הפרוטוקול נותרו ישימים באופן כללי בעת דגימת מבנים אחרים בחזה, כגון הצדר הקודקודי או המדיאסטינום הקדמי/עליון 9,14,17,40,41,42,43,44 . התועלת הקלינית של US-TTB והשימוש בו על ידי רופאי ריאות צפויים להתרחב בשנים הקרובות.
לסיכום, US-TTNB הוא הליך בטוח וחסכוני עם תשואה אבחנתית גבוהה בחולים עם נגעי ריאה תת-פלאורליים החשודים כממאירות. כאשר הדבר אפשרי מבחינה טכנית, יש להתייחס ל-US-TTNB כטכניקת הביופסיה הטרנס-חזה הנבחרת.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ללא.
Materials
| Name | Company | Catalog Number | Comments |
| Ambu BlueSensor R | Ambu | R-00-S/25 | ECG patches |
| BD PosiFlush SP Syringe 5 mL | BD | 306574 | Syringe with 5 mL 0.9% NaCl |
| Blunt Fill Needle with 5 Micron Filter (18 G x 11/2") | Sol-Millennium Medical Inc. | BN1815F | 18 G needle |
| C1-6VN ultrasound transducer | GE Healthcare | 5476279 | Ultrasound transducer |
| C2-9D ultrasound transducer | GE Healthcare | 5405253 | Ultrasound transducer |
| CARBON STEEL SURGICAL BLADES | Swann-Morton | 203 | Scalpel blade |
| Disinfection wipe (82% ehanol + 0.5% chlorhexidine) | Vitrex Medical A/S | 527297 | Disinfection wipe |
| Disposable needle single use (0.80 mm x 80 mm) | Misawa Medical Industry Co., Ltd. | K070001 | 80 mm 21 G hypodermic needle |
| EKO GEL | Ekkomed A/S | 29060008-29 | Ultrasound gel |
| Formalin system, buffered formalin solution 450 mL | Sarstedt | 5,11,703 | Biopsy specimen contained and relevant fixation liquid (e.g. formaldehyde) |
| GAMMEX Latex | Ansell | 330048075 | Sterile gloves |
| KD-JECT 20 mL | KD Medcial GmbH | 820209 | 20 mL syringe |
| Klorhexidin sprit 0.5% 500 mL | Fuckborg Pharma | 212045 | Disinfectant |
| Lidokain Mylan 10 mg/mL, 20 mL | Mylan | NO-6042A1 | Local anesthetic (20 mL, 2% lidocaine) |
| LOGIQ E10 | GE Healthcare | NA | High-end ultrasound machine |
| Mölnlycke BARRIER Adhesive Aperture Drape (50 x 60 cm / 6 x 8 cm) | Mölnlycke Healthcare AB | 906693 | Adhesive surgical drape with a central hole |
| Mölnlycke Gauze 10 x 10 cm | Mölnlycke Healthcare AB | 158440 | Swaps for applying disinfectant |
| Philips IntelliVue X2 | Philips | NA | Patient monitoring system |
| Raucodrape PRO 75 x 90 cm | Lohmann & Rauscher International GmbH & Co | 33 005 | Sterile drape for procedure table |
| SEMICUT 18 G x 100 mm | MDL | PD01810 | 18 G x 100 mm core biopsy needle |
| SEMICUT 18 G x 160 mm | MDL | PD01816 | 18 G x 160 mm core biopsy needle |
| S-Monovette, 25 mL, for Formalin system, (LxØ): 97 x 25 mm, with paper label | Sarstedt | 9,17,05,001 | Biopsy specimen container |
| Sterican (0.80 x 120 mm BL/LB) | Braun | 4665643 | 120 mm 21 G hypodermic needle |
| Tegaderm I.V. | 3M | 1633 | I.V. Transparent film dressing with border |
| Ultra-Pro II Disposable Replacement Kits | CIVCO | 610-608 | For use with GE Healthcare C2-9 transducer |
| Ultra-Pro II In-Plane Ultrasound Needle Guides-Multi-Angle | CIVCO | H4913BA | For use with GE Healthcare C2-9 transducer |
| Verza Needle Guidance System for VerzaLink™ Transducers | CIVCO | 610-1500-24 | For use with GE Healthcare C1-6 transducer |
| Verza Ultrasound Needle Guidance System | CIVCO | H4917VB | For use with GE Healthcare C1-6 transducer |
References
- Maconachie, R., Mercer, T., Navani, N., McVeigh, G., Guideline, C. Lung cancer: diagnosis and management: summary of updated NICE guidance. BMJ. 364, 1049(2019).
- Rasmussen, T. R., et al. Lungecancer - Visitation, Diagnose, Stadie. , (2020).
- Interventional Pulmonology. Herth, F. J. F., Shah, P. L., Gompelmann, D. , (2017).
- Juul, A. D., et al. Does the addition of radial endobronchial ultrasound improve the diagnostic yield of electromagnetic navigation bronchoscopy? a systematic review. Respiration. 101 (9), 869-877 (2022).
- Kuijvenhoven, J. C., et al. Endobronchial ultrasound for the diagnosis of centrally located lung tumors: a systematic review and meta-analysis. Respiration. 99 (5), 441-450 (2020).
- Li, Y., Yang, F., Huang, Y. Y., Cao, W. Comparison between computed tomography-guided core and fine needle lung biopsy: A meta-analysis. Medicine (Baltimore). 101 (9), e29016(2022).
- Fu, Y. F., Zhang, J. H., Wang, T., Shi, Y. B. Endobronchial ultrasound-guided versus computed tomography-guided biopsy for peripheral pulmonary lesions: A meta-analysis. Clin Respir J. 15 (1), 3-10 (2021).
- Chandrasekhar, A. J., Reynes, C. J., Churchill, R. J. Ultrasonically guided percutaneous biopsy of peripheral pulmonary masses. Chest. 70 (5), 627-630 (1976).
- Laursen, C. B., et al. European respiratory society statement on thoracic ultrasound. Eur Respir J. 57, 2001519(2020).
- Laursen, C. B., Graumann, O., Rahman, N. M. Thoracic Ultrasound - new challenges, new horizons. Ultraschall Med. 42, 226-227 (2021).
- Hallifax, R. J., et al. Physician-based ultrasound-guided biopsy for diagnosing pleural disease. Chest. 146 (4), 1001-1006 (2014).
- Corcoran, J. P., et al. Ultrasound-guided pneumothorax induction prior to local anaesthetic thoracoscopy. Thorax. 70 (9), 906-908 (2015).
- Bedawi, E. O., et al. Intercostal vessel screening prior to pleural interventions by the respiratory physician: a prospective study of real world practice. Eur Respir J. 55 (4), 1902245(2020).
- Mei, F., et al. Diagnostic yield and safety of image-guided pleural biopsy: a systematic review and meta-analysis. Respiration. 100 (1), 77-87 (2021).
- Pietersen, P. I., et al. Lung ultrasound training: a systematic review of published literature in clinical lung ultrasound training. Crit Ultrasound J. 10 (1), 23(2018).
- Pietersen, P. I., Laursen, C. B., Petersen, R. H., Konge, L. Structured and evidence-based training of technical skills in respiratory medicine and thoracic surgery. J Thorac Dis. 13 (3), 2058-2067 (2021).
- Laursen, C. B., et al. Ultrasound-guided lung biopsy in the hands of respiratory physicians: diagnostic yield and complications in 215 consecutive patients in 3 centers. J Bronchology Interv Pulmonol. 23 (3), 220-228 (2016).
- DiBardino, D. M., Yarmus, L. B., Semaan, R. W. Transthoracic needle biopsy of the lung. J Thorac Dis. 7 (Suppl 4), S304-S316 (2015).
- Yamamoto, N., et al. Efficacy and safety of ultrasound (US) guided percutaneous needle biopsy for peripheral lung or pleural lesion: comparison with computed tomography (CT) guided needle biopsy. J Thorac Dis. 11 (3), 936-943 (2019).
- Sconfienza, L. M., et al. Pleural and peripheral lung lesions: comparison of US- and CT-guided biopsy. Radiology. 266 (3), 12112077(2012).
- Lee, M. H., Lubner, M. G., Hinshaw, J. L., Pickhardt, P. J. Ultrasound guidance versus CT guidance for peripheral lung biopsy: performance according to lesion size and pleural contact. AJR Am J Roentgenol. 210 (3), W110-W117 (2018).
- Chen, C. C., Hsu, W. H., Huang, C. M., Hsu, J. Y., Chiang, C. D. Ultrasound-guided fine needle aspiration biopsy of small pulmonary nodules abutting to the chest wall. Zhonghua Yi Xue Za Zhi (Taipei). 57 (2), 106-111 (1996).
- Diacon, A. H., et al. Safety and yield of ultrasound-assisted transthoracic biopsy performed by pulmonologists. Respiration. 71 (5), 519-522 (2004).
- Koegelenberg, C. F., et al. Diagnostic yield and safety of ultrasound-assisted biopsies in superior vena cava syndrome. Eur Respir J. 33 (6), 1389-1395 (2009).
- Meena, N., Bartter, T. Ultrasound-guided percutaneous needle aspiration by pulmonologists: a study of factors with impact on procedural yield and complications. J Bronchology Interv Pulmonol. 22 (3), 204-208 (2015).
- Thoracic Ultrasound. Laursen, C. B., Rahman, N. M., Volpicelli, G. Vol 79, European Respiratory Society. (2018).
- Roberts, M. E., et al. British Thoracic society guideline for pleural disease. Thorax. , (2023).
- Dallari, R., Gollini, C., Barozzi, G., Gilioli, F. Ultrasound-guided percutaneous needle aspiration biopsy of peripheral pulmonary lesions. Monaldi Arch Chest Dis. 54 (1), 7-10 (1999).
- Liao, W. Y., et al. US-guided transthoracic cutting biopsy for peripheral thoracic lesions less than 3 cm in diameter. Radiology. 217 (3), 685-691 (2000).
- Diacon, A. H., et al. Ultrasound-assisted transthoracic biopsy: fine-needle aspiration or cutting-needle biopsy. Eur Respir J. 29 (2), 357-362 (2007).
- Laursen, C. B., Graumann, O., Moller, T. V., Davidsen, J. R. Contrast-enhanced Ultrasound-guided Transthoracic Lung Biopsy. Am J Respir Crit Care Med. 194 (5), e5-e6 (2016).
- Jacobsen, N., et al. Clinical applications of contrast-enhanced thoracic ultrasound (CETUS) compared to standard reference tests: a systematic review. Ultraschall Med. 43 (1), 72-81 (2020).
- Koegelenberg, C. F., et al. The diagnostic yield and safety of ultrasound-assisted transthoracic fine-needle aspiration of drowned lung. Respiration. 81 (1), 26-31 (2011).
- Adams, R. F., Gleeson, F. V. Percutaneous image-guided cutting-needle biopsy of the pleura in the presence of a suspected malignant effusion. Radiology. 219 (2), 510-514 (2001).
- McAlister, S., et al. The carbon footprint of hospital diagnostic imaging in Australia. Lancet Reg Health West Pac. 24, 100459(2022).
- Pietersen, P. I., et al. Development of and gathering validity evidence for a theoretical test in thoracic ultrasound. Respiration. 98 (3), 221-229 (2019).
- Pietersen, P. I., et al. Objective structured clinical examination in basic thoracic ultrasound: a European study of validity evidence. BMC Pulm Med. 23 (1), 15(2023).
- Laursen, C., et al. Learning curves for ultrasound guided lung biopsy in the hands of respiratory physicians. European Respiratory Journal. 48 (suppl 60), PA3850(2016).
- Safai Zadeh, E., et al. WFUMB technological review: how to perform contrast-enhanced ultrasound of the lung. Ultrasound Med Biol. 48 (4), 598-616 (2022).
- Ahmed, M., Daneshvar, C., Breen, D. Neck Ultrasound for the detection of cervical lymphadenopathy in sarcoidosis: an alternative to endobronchial ultrasound. J Bronchology Interv Pulmonol. 26 (3), 225-227 (2019).
- van Overhagen, H., et al. Metastases in supraclavicular lymph nodes in lung cancer: assessment with palpation, US, and CT. Radiology. 232 (1), 75-80 (2004).
- Koegelenberg, C. F., et al. The diagnostic yield and safety of ultrasound-assisted transthoracic biopsy of mediastinal masses. Respiration. 81 (2), 134-141 (2011).
- Psallidas, I., et al. A Pilot feasibility study in establishing the role of ultrasound-guided pleural biopsies in pleural infection (The AUDIO study). Chest. 154 (4), 766-772 (2018).
- Koegelenberg, C. F., et al. Direct comparison of the diagnostic yield of ultrasound-assisted Abrams and Tru-Cut needle biopsies for pleural tuberculosis. Thorax. 65 (10), 857-862 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved