Method Article
מילוי צבע DiI ככלי פשוט וזול להדמיית נוירונים חושיים ריסניים ב - C. elegans
In This Article
Summary
מילוי צבע DiI הוא שיטה נפוצה ב- C. elegans כדי לדמיין תת-קבוצה של נוירונים חושיים ריסניים, המאפשרת זיהוי של מוטציות גנטיות המשנות את מבנה או תפקוד הנוירונים התחושתיים.
Abstract
C. elegans שימש זה מכבר כמודל פשוט ונגיש לחקר המבנה העצבי והתפקודים הרבים של מערכת העצבים. מתוך 302 הנוירונים במערכת העצבים ההרמפרודיטה הבוגרת, 60 מסווגים כנוירונים חושיים ריסניים. נוירונים אלה הם מרכזיים במספר התנהגויות של C. elegans , כולל אך לא רק כימותרפיה, מכניקה ואוסמוסנסינג, הזדווגות זכרים והיווצרות דאואר. מזה כמה עשורים, חברי קהילת C. elegans משתמשים בצבע הליפופילי הפלואורסצנטי האדום DiI כדי לדמיין תת-קבוצה של נוירונים חושיים ריסניים החשופים ישירות לסביבה החיצונית. צבע זה נכנס לקצוות הריסים של הנוירונים ומתפזר בדפוס אחיד יחסית בכל הדנדריטים, גופי התאים והאקסונים. שיטה פשוטה ועוצמתית זו מהווה כלי מצוין לזיהוי מוטציות גנטיות המקנות פגמים מבניים או תפקודיים בנוירונים חושיים ריסניים. כאן, אנו מציגים גרסה יעילה של שיטת הצביעה הזו כדי לדמיין את שמונת זוגות האמפידים ושני זוגות של נוירונים פאסמידיים שנחשפים לסביבה ב-C. elegans. אנו דנים בטיפים לשימוש בשיטה זולה זו להדמיית דפוסי מילוי צבע תאיים בבעלי חיים מורדמים.
Introduction
Caenorhabditis elegans (C. elegans) קלים למניפולציה, יש להם זמני ייצור מהירים והם זולים לתחזוקה. בשל יתרונות אלה ורבים אחרים, C. elegans שימש כאורגניזם מודל מועדף לחקר תהליכים ביולוגיים רבים, במיוחד התפתחות ותפקוד מערכת העצבים. גיליון שלם בכתב העת Journal of Neurogenetics הוקדש לאחרונה להשפעות ההיסטוריות של המחקרבנושא הספציפי הזה. הם מועילים במיוחד לחקר תפקודם של ריסים ראשוניים, המעורבים בחישת תנאים סביבתיים כימיים ופיזיקליים2.
להרמפרודיטים בוגרים יש בסך הכל 302 נוירונים, 60 מהם בעלי ריסים ראשוניים בסוף התהליכים הדנדריטיים שלהם3. 60 תאי העצב הריסים הללו מסווגים כנוירונים חושיים ומעורבים בהתנהגויות רבות של C. elegans, כולל אך לא רק כימותרפיה, מכניקה ואוסמוסנסינג, הזדווגות זכרית והיווצרות דאואר 3,4. ישנן שתי תת-קבוצות של נוירונים חושיים ריסניים החשופים לסביבה החיצונית, הכוללים שישה עשר נוירונים אמפידים (8 זוגות) בראש וארבעה נוירונים פאסמידיים (2 זוגות) בזנב 3,5.
במשך כמה עשורים, חוקרים בקהילת C. elegans השתמשו בצבעים ליפופיליים, כגון הפלואורסצנט האדום 1,1'-dioctadecyl-3,3,3'3'-tetramethylindocarbocyanine perchlorate (DiI), כדי לדמיין מספר רקמות שונות בבעלי חייםחיים 6,7,8,9. כאשר בעלי חיים נחשפים ל-DiI, הצבע מתערבב בקלות ובמהירות לתוך הממברנה של הדנדריטים, האקסונים וגופי התאים של 20 נוירוני האמפיד והפאסמיד החשופים חיצונית בהתפלגות אחידה יחסית. כאשר חיות בר נחשפות ל-DiI, ניתן לדמיין את הצבע בתאי עצב אלה על ידי הדמיה פלואורסצנטית בחלון זמן רחב יחסית. אם יש חריגות מורפולוגיות או תפקודיות בריסים הראשוניים, ייתכן שהצבע לא ימלא כראוי את הנוירונים, ולכן האות עשוי להיראות חלש יותר בחלק מהתאים או בכולם, או להיעדר לחלוטין 6,7,10,11. כל אחת מהתוצאות הללו יכולה להיות אינפורמטיבית של ליקויים מבניים או תפקודיים שעשויים להיות נוכחים בתאי העצב החושיים הריסים של וריאנטים גנטיים.
כתב היד הזה נועד להדגים את הקלות שבה מילוי צבע יכול לשמש ב-C. elegans כדי להמחיש את המבנה של תאי עצב חושיים ריסניים (איור 1). יישמנו את הטכניקה הזו בחיות פראיות ומוטנטיות כדי להדגים כיצד רקעים גנטיים שונים יכולים להראות מגוון תוצאות של מילוי צבע, שלעתים קרובות קשורות לשלמות המבנית או התפקודית של תאי העצב החושיים הריסים שלהם. אנו מראים צביעה לאחר 30 דקות, 24 שעות ו-48 שעות לאחר מילוי הצבע במגוון גילאים שונים של בעלי חיים כדי לסייע בקביעת מהלך הזמן האופטימלי להדמיה חיה. אנו מספקים גם דוגמאות לקשיים שיכולים להתעורר במהלך צביעה והדמיה וטיפים למניעת נקודות בעייתיות אלה. באמצעות שימוש בשיטה זו, חוקרים במוסדות בכל גודל יכולים להתחיל לבנות על הבסיס של ביולוגיה של נוירונים חושיים ריסניים ב - C. elegans. מילוי צבע הוא פשוט וחסכוני מספיק כדי להיות משולב בפעילויות מעבדה עם סטודנטים לתואר ראשון כדי לאפשר להם את ההזדמנות לעבוד עם C. elegans ומיקרוסקופיה פלואורסצנטית עם מומחיות טכנית קודמת מינימלית. בנוסף, יש שימור משמעותי של גנים המעורבים בביולוגיה ראשונית של ריסים, ובאופן רחב יותר, תפקוד נוירונים חושיים בין בני אדם ל-C. elegans12. המשך מחקר על תפקודי גנים ריסניים ואינטראקציות גנטיות ב- C. elegans יכול בסופו של דבר לספק תובנה רבה יותר לגבי המורכבות של ריסים אנושיים13.
Protocol
1. הכנת פתרונות
- הכן את תמיסת האקונומיקה. שלב 2 מ"ל אקונומיקה, 500 מיקרוליטר של 10 מ' NaOH ו-7.5 מ"ל של dH2O בצינור צנטריפוגה של 15 מ"ל.
הערה: תמיסת אקונומיקה נשארת יציבה עד שבוע כאשר היא מאוחסנת בטמפרטורת החדר (RT). - הכן את מאגר M9. שלבו 3 גרם של KH2PO4, 6 גרם של Na2HPO4 ו-5 גרם NaCl ב-1 ליטר של מים סטריליים וחיטוי לעיקור. לאחר שהתקרר לחלוטין ל-RT, הוסף 1 מ"ל סטרילי של 1 M MgSO4.
- הכן את תמיסת מלאי DiI. הוסף 10 מ"ג DiI ל-5 מ"ל של דימתילפורממיד (DMF) לריכוז סופי של 2 מ"ג/מ"ל DiI ב-DMF. DiI רגיש לאור, לכן יש לכסות תמיד את התמיסות בנייר אלומיניום. ניתן לאחסן DiI ב-DMF ב-20 מעלות צלזיוס למשך שנים רבות ואינו דורש הפשרה בין שימושים.
זהירות: DMF הוא גם דליק וגם מזיק במגע עם העור או בשאיפה. עבדו עם תמיסה זו מתחת למכסה מנוע כימי, הרחק מלהבות פתוחות, ולבישת ציוד מגן אישי מתאים (PPE).
2. בידוד אוכלוסיות מסונכרנות על ידי הכנת אקונומיקה
הערה: אסוף את כל הציוד והפתרונות הדרושים לכל שלבי התהליך לפני ההתחלה. תכשירי אקונומיקה רגישים מאוד לזמן, כך שהחומרים הדרושים לפני תחילת התהליך מבטיחים את הצלחת הפרוטוקול.
- שטפו בעלי חיים בוגרים ללא רעב מהצלחות באמצעות 1 מ"ל של מאגר M9. אפשר לבעלי החיים להתאסף בקצה אחד של הצלחת על ידי הטיה קלה של הצלחת.
הערה: בדרך כלל, שאפו לאסוף ~50-100 בעלי חיים בוגרים לא מורעבים לקבלת יבול אמין של ביצים. עם זאת, ניתן לבצע הכנת אקונומיקה כמעט על כל מספר של בעלי חיים בוגרים. מספר בעלי החיים הבוגרים הזמינים לאיסוף יכול להשתנות מאוד בהתאם לרקע הגנטי של בעלי החיים. מספר גדול יותר של בעלי חיים שנאספו מניב בדרך כלל מספר גדול יותר של ביצים. - בעזרת פיפטת פסטר מזכוכית, אספו והעבירו את בעלי החיים במאגר M9 לצינור מיקרו-צנטריפוגה מסומן בנפח 1.5 מ"ל.
- צנטריפוגה של בעלי החיים ב -350 גרם למשך 30 שניות. מהירות זו איטית מספיק כדי לאסוף את החיות בתחתית הצינור מבלי לגרום נזק.
- רוקנים את רוב מאגר ה-M9 העודף, ומשאירים את התולעים שנאספו בתחתית הצינור ללא הפרעה.
- הוסיפו 1 מ"ל מתמיסת האקונומיקה המוכנה ואפשרו לבעלי החיים לצוף בתמיסה עד שהם מתחילים להתפרק, והפכו את הצינור באופן קבוע כדי לעודד פירוק רקמות. צפו בפירוק הרקמות ושחרור הביציות על ידי בדיקה תקופתית של הצינור תחת מיקרוסקופ מנתח. תהליך זה אורך בדרך כלל בין 5 דקות ל-10 דקות.
- ברגע שהצינור מכיל בעיקר ביצים משוחררות שנותרו רק כמה רקמות של בעלי חיים גלויים, צנטריפוגה במהירות מקסימלית למיקרו-צנטריפוגה סטנדרטית על השולחן (בדרך כלל בין 15,000-21,000 גרם) למשך 30 שניות כדי לאסוף את הביצים בתחתית.
- שפכו כמה שיותר מתמיסת האקונומיקה באמצעות פיפטה מזכוכית תוך הקפדה לא להפריע לביצים הגלולות. הוסף 1 מ"ל של מאגר M9 כדי לעצור את פירוק הביצים על ידי תמיסת האקונומיקה שנותרה.
הערה: שלבים 2.6 ו-2.7 צריכים להתבצע במהירות. עיכובים בצנטריפוגה, הסרת תמיסת אקונומיקה ושטיפה עם מאגר M9 עלולים לגרום לתפוקת ביצים נמוכה עקב השפלה. - צנטריפוגה את הצינור שוב ב -21,000 גרם למשך 30 שניות. שפכו את הסופרנטנט מבלי להפריע לביצים הגלולות.
- שטפו פעמיים נוספות עם 1 מ"ל של מאגר M9, וניקו נוזלים בין כל שטיפה מבלי להפריע לביצים הגלולות.
- לאחר הכביסה האחרונה, יש לשפוך את רוב מאגר ה-M9, ואז להשהות מחדש את הביצים בנוזל שנותר על ידי הלקשת הצינור או ניעור נמרץ.
- בעזרת פיפטת זכוכית סטרילית, העבירו טיפה מהתמיסה המכילה את הביצים אל פני צלחת NGM טרייה עם E. coli. שאפו למקם את הטיפה ליד האי קולי ולהוסיף כ -100 ביצים לצלחת. ביציות אלה מסונכרנות בערך בגיל.
הערה: במקרים בהם תפוקת הביצים גבוהה מספיק כדי שקשה להשיג 100 ביצים לטיפה, ניתן להוסיף מאגר M9 נוסף לצינור המכיל ביצים כדי לדלל את ריכוזן
3. הליך מילוי צבע
- סמן כמה צינורות מיקרו-צנטריפוגה של 1.5 מ"ל לפי הצורך עבור מספר הזנים הממולאים בצבע. צור כיסויי נייר כסף לכל צינור כדי להגן על תמיסת DiI רגישה לאור, לאחר הוספתו.
- שטפו בעלי חיים בשלב התפתחותי רצוי מלוחות ה-NGM המסונכרנים עם הגיל באמצעות כ-1 מ"ל של מאגר M9. ודא שכל צלחת מכילה כ-100 בעלי חיים שבקעו מ-100 הביצים המונחות על הצלחת במהלך סנכרון האקונומיקה. אסוף את בעלי החיים לצינורות מיקרו-צנטריפוגה של 1.5 מ"ל המסומנים כהלכה.
הערה: מילוי צבע עובד היטב במגוון רחב של שלבי התפתחות. מחקר זה מדגים מילוי צבע בבעלי חיים החל משלב הזחל 3 (L3) ועד לבוגרים (48 שעות לאחר L3). - בעלי חיים צנטריפוגה במשקל 350 גרם למשך 30 שניות כדי לאסוף אותם בתחתית הצינור.
- שפכו את מאגר ה-M9 מבלי להפריע לבעלי החיים שנאספו בתחתית הצינור.
- שטפו פעמיים נוספות עם 1 מ"ל של מאגר M9, וניקו נוזלים בין כל שטיפה מבלי להפריע לבעלי החיים שנאספו. בסבב הכביסה האחרון, שפכו כדי להשאיר 200 מיקרוליטר של מאגר M9 בצינור.
- כסו את כל הצינורות בנייר אלומיניום כדי להגן מפני חשיפה לאור והוסיפו 1 מיקרוליטר של DiI ב-DMF ישירות למאגר M9 בכל צינור.
הערה: אם משנים את הכמויות של מאגר M9 ו-DiI, הקפד לשמור על יחס של 1:200 של DiI במאגר M9. - נדנד או נער את כל הצינורות ב-RT למשך שעתיים.
- צינורות צנטריפוגה במשקל 350 גרם למשך 30 שניות לאיסוף בעלי חיים בתחתית הצינורות.
- שפכו את הנוזל המכיל את ה-DiI מצינורות המיקרו-צנטריפוגה. יש לשטוף עם מאגר M9 שלוש פעמים, תוך הסרת נוזלים בין כל שטיפה.
- לאחר הסילוק מהשטיפה הסופית, העבירו בעלי חיים בנפח קטן (~50 מיקרוליטר) של מאגר M9 לצלחות NGM טריות עם E. coli.
- אפשר לבעלי חיים להתאושש לאחר צביעה על צלחות NGM טריות למשך 30 דקות לפחות. מכסים את הצלחות בנייר אלומיניום עד לתצפית כדי לשמר את כתם ה- DiI. התבונן בבעלי חיים עד 24 שעות לאחר מילוי הצבע ללא אובדן משמעותי באות הפלואורסצנט. בשעה 48 שעות או אחריה, האות יכול להתחיל לדעוך (ראה איור 2).
4. הדמיית מילוי צבע
- הכינו אגרוז של 2% בתמיסת מים סטרילית. ממיסים את האגרוז לחלוטין באמצעות מיקרוגל.
הערה: ניתן לעשות שימוש חוזר באגרוז (2%) בתמיסת מים מספר פעמים עד שאיבוד מים חוזר מגדיל את ריכוז האגרוז עד לנקודה שבה התמיסה הופכת צמיגה מדי. - השג שקופיות זכוכית וכיסויים בגודל 22 מ"מ על 22 מ"מ להכנת רפידות אגרוז. בעזרת פיפטת זכוכית, הניחו טיפה קטנה של האגרוז המותך 2% במים על מגלשת זכוכית אחת והניחו במהירות החלקת כיסוי על גבי טיפת האגרוז. לאחר שכרית האגרוז מתמצקת במלואה, הסר את הכיסוי והשאיר את כרית האגרוז על מגלשת הזכוכית.
הערה: הימנע מהיווצרות בועות ברפידות אגרוז, מכיוון שהן עלולות לחסום את ההדמיה של בעלי חיים. - הוסף 5-10 מיקרוליטר של חומר הרדמה (10 מ"מ לבמיסול) על פני כרית האגרוז. העבירו 5-20 בעלי חיים לחומר ההרדמה, ולאחר מכן הניחו את החלקת הכיסוי בחזרה על גבי כרית האגרוז.
- התבונן בבעלי חיים באמצעות מיקרוסקופ פלואורסצנטי סטריאו, מורכב ו/או קונפוקלי, בהתאם לציוד הזמין ולצורכי הסינון וההדמיה. ל-DiI יש שיא עירור ב-550 ננומטר ושיא פליטה ב-564 ננומטר; לפיכך, צפה בו באמצעות קוביית סינון תואמת טטרמתילרודמין/ציאנין 3/חלבון פלואורסצנטי צהוב (TRITC/Cy3/YFP).
הערה: הגדרות מיקרוסקופ מתאימות, כגון זמן חשיפה, רווח ועוצמת לייזר, הדרושות להשגת תמונות ברורות של מילוי צבע יכולות להשתנות בין סוגים שונים של מיקרוסקופים וצריכות להיקבע באופן עצמאי על ידי המשתמשים לצרכים הייחודיים שלהם.
תוצאות
תולעי N2 בוגרות שצולמו 24 שעות לאחר מילוי הצבע מדגימות אות פלואורסצנטי ברור שמתפשט באופן שווה יחסית בכל תאי העצב האמפידים (איור 1A,A') ותאי העצב הפאסמידיים (איור 1D,D'). בבעלי חיים אלה ניתן להבחין בקלות בין ההקרנות הדנדריטיות וגופי התאים של נוירוני האמפיד. אין גושי צבע בבליטות הדנדריטיות, ואין הפרעות באות הפלואורסצנטי בשום חלק של הנוירונים המלאים בצבע. בתאי העצב הפאסמידיים, ניתן גם להבחין בקלות בין גופי התאים, אם כי ההקרנות הדנדריטיות יכולות לעתים קרובות להיראות חיוורות יותר מאשר באמפידים. סביר להניח שזה נובע מהמספר הקטן יותר של נוירונים פאסמידיים שמכתימים באמצעות DiI 3,5. תוצאות אלה מצביעות באופן קולקטיבי על כך שהצבע יכול להיכנס בהצלחה לנוירונים החושיים הריסים החשופים חיצונית ולאחר מכן להתפזר באופן שווה בכל מבני התאים.
כאשר בוגרים מזן YH2125, המכילים מוטציות בשני גנים, bbs-5 ו-nphp-4, הגורמים להפרעה בתפקוד הרירי, מצולמים 24 שעות לאחר מילוי הצבע, ניתן לראות מגוון תוצאות. השכיחות של כל אחת מהתוצאות הללו נקבעה בפרסום קודם10. ברוב החיות (~60%), נראה שהצבע נכנס רק לתת-קבוצה של האמפידים (איור 1B,B'). התוצאה הזו מתוארת כמילוי צבע חלקי, ולעתים קרובות כוללת גם גושי צבע (ראשי חץ לבנים, איור 1B), אותות פלואורסצנטיים לא אחידים, ואפילו היעדר מוחלט של אותות פלואורסצנטיים באזורים מסוימים של האמפידים. בחלק קטן מהחיות (~10%), הצבע לא מצליח להיכנס לאף אחד מתאי העצב של האמפיד, מה שמוביל לחוסר מוחלט של אות פלואורסצנטי, ומתואר כמילוי צבע פגום (איור 1C,C'). כאשר מעריכים מילוי צבע בתאי העצב של הפאסמיד במבוגרים YH2125, נצפתה רק אחת משתי תוצאות. כמחצית מבעלי החיים מציגים מילוי צבע רגיל הדומה לבעלי חיים בוגרים מסוג N2. המחצית הנותרת של החיות מראה חוסר באות פלואורסצנטי המעיד על מילוי צבע פגום (איור 1E,E'). מילוי צבע חלקי של נוירונים פאסמידיים לא נצפה על ידי המעבדה שלנו ולכן אינו נכלל באיור זה. התדירות הנצפית של מילוי צבע פאסמיד פגום גדולה מהתדירות הנצפית של מילוי צבע אמפיד פגום, מה שמרמז על כך שניתן לצפות במילוי צבע אמפיד חלקי או מלא ללא כל מילוי צבע פאסמיד באותה חיה10. תוצאות אלו הן דוגמאות לפגיעה במילוי צבע, מה שעשוי להצביע על פגמים במבנה או בתפקוד של נוירונים חושיים ריסניים. תוצאות כאלה מלוות לעתים קרובות בניסויים להערכת שינויים בתפקוד הנוירונים התחושתיים, כגון מבחני כימוטקסיס, ושינויים במבנה הנוירונים התחושתיים, כגון ניתוח מדווח פלואורסצנטי.
הדמיה של קבוצה של חיות N2 מסונכרנות לאורך סדרה של ימים לאחר מילוי הצבע עוזרת לזהות את נקודות הזמן הטובות ביותר לניתוח. האות הפלואורסצנטי מהצבע חזק ומפוזר באופן שווה בחיות רק 30 דקות אחרי הצביעה (איור 2A). הדמיה ב-24 שעות אחרי מילוי הצבע מראה ירידה קטנה מאוד באות הפלואורסצנטי בהשוואה לחיות מהיום הראשון (איור 2B). רק לאחר 48 שעות ניתן לזהות ירידה ניכרת באות הפלואורסצנטי (איור 2C). איור 2 גם מדגים שמילוי צבע נראה בטווח רחב של גילאים, כולל L3 (איור 2A,A'), L4 (24 שעות אחרי L3, איור 2B,B'), ומבוגרים צעירים (48 שעות אחרי L3, איור 2C,C'). קבוצה שנייה של ניסויי מילוי צבע מאשרת כי הירידה באות הפלואורסצנטי שנצפתה במהלך תקופות התאוששות ארוכות יותר אינה תוצאה של שינויים התפתחותיים ב- C. elegans. בניסויים אלה, בעלי חיים מסונכרנים לפי גיל בשלבים L3, L4 ובוגרים צעירים (48 שעות לאחר L3) מולאו בצבע ושוחזרו במשך 30 דקות לפני ההדמיה. רמה דומה של אות פלואורסצנטי נצפתה לאחר 30 דקות של התאוששות ב-L3 (איור 3A,A'), L4 (איור 3B,B') ובחיות בוגרות (איור 3C,C').
ייתכן שעדיף לצלם 24 שעות לאחר מילוי הצבע כדי למנוע תוצאה לא רצויה שניתן להבחין בה בנקודות זמן מוקדמות יותר, במיוחד 30 דקות לאחר הצביעה. אותות פלואורסצנטיים מהאמפידים והפאסמידים יכולים לפעמים להיות מוסתרים או מתגברים על ידי אותות פלואורסצנטיים שנצפו במעי (L3, איור 4A,A'; L4, איור 4B,B'). אות זה קיים עקב בליעת הצבע במהלך תהליך הצביעה וסביר יותר שייעדר לאחר תקופת מנוחה של 24 שעות עקב הפרשה.
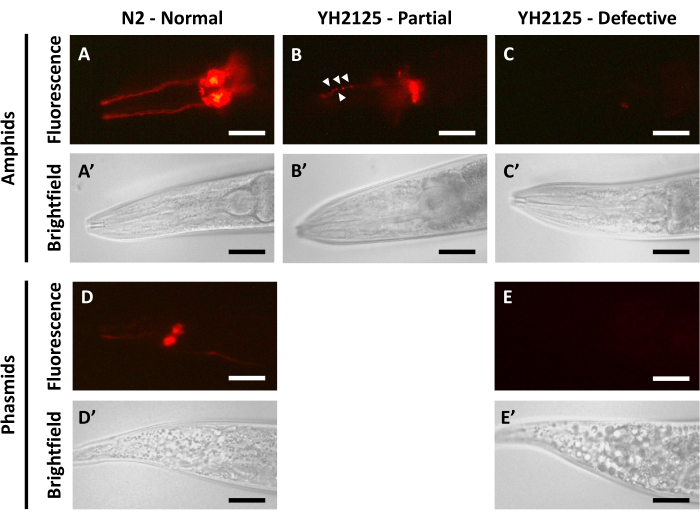
איור 1: מילוי צבע ב-C. elegans מניב תוצאות מגוונות בהתאם לרקע הגנטי. (א-ה) הדמיה 24 שעות לאחר מילוי צבע בנוירונים אמפידים (A,A') N2, (B,B',C,C') נוירונים אמפידים YH2125, (D,D') נוירונים פאסמידיים N2, ו-(E,E') נוירונים פאסמידיים YH2125. ראשי חץ לבנים (B) מצביעים על גוש של צבע DiI בדנדריטים. אות פלואורסצנטי DiI נמצא בפאנלים העליונים, והדמיית שדה בהיר נמצאת בפאנלים התחתונים. החלק הקדמי של החיה נמצא משמאל בכל הלוחות. כל בעלי החיים המוצגים כאן נמצאים בשלב הבוגר (48 שעות לאחר L4). פסי קנה מידה מייצגים 30 מיקרומטר (אמפידות) ו-45 מיקרומטר (פאסמידים). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: אותות פלואורסצנטיים בחיות מלאות צבע באופן סינכרוני פוחתים עם הזמן. הדמיה של חיות N2 מלאות בצבע בשלב L3 לאחר (A,A') 30 דקות, (B,B') 24 שעות (שלב L4) ו-(C,C') 48 שעות (בוגר צעיר). אות פלואורסצנטי DiI נמצא בפאנלים העליונים, והדמיית שדה בהיר נמצאת בפאנלים התחתונים. החלק הקדמי של החיה נמצא משמאל בכל הלוחות. פסי קנה מידה מייצגים 30 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
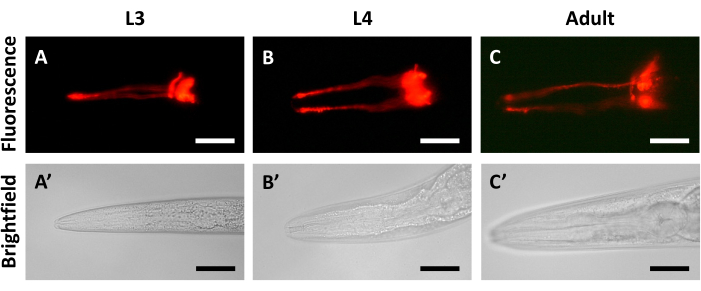
איור 3: עוצמת האות הפלואורסצנטי נשארת עקבית בשלבי התפתחות שונים. הדמיה של בעלי חיים N2 מולאו בצבע ושוחזרו במשך 30 דקות בשלב (A,A') L3, (B,B') שלב L4 ו-(C,C') שלב בוגרים צעירים. אות פלואורסצנטי DiI נמצא בפאנלים העליונים, והדמיית שדה בהיר נמצאת בפאנלים התחתונים. החלק הקדמי של החיה נמצא משמאל בכל הלוחות. פסי קנה מידה מייצגים 30 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
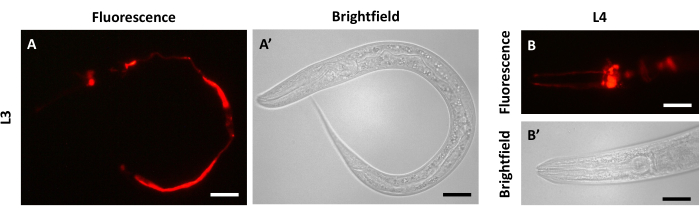
איור 4: ניתן להבחין בפלואורסצנטיות מעיים בחיות מלאות צבע 30 דקות לאחר הצביעה. הדמיה 30 דקות לאחר מילוי צבע של בעלי חיים N2 בשלב (A) L3 ו-(B) שלב L4. (A) אות פלואורסצנטי DiI בפאנל השמאלי, (A') הדמיית שדה בהיר בפאנל הימני עבור L3. (B) אות פלואורסצנטי DiI בפאנל העליון, (B') הדמיית שדה בהיר בפאנל התחתון עבור L4. החיה כולה נראית בלוחות A ו-A'. החלק הקדמי של החיה נמצא משמאל בלוחות B ו-B'. פסי קנה מידה מייצגים 30 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מילוי צבע מוצלח מסתמך על שיקול דעת מדוקדק של השלב ההתפתחותי והרקע הגנטי של בעלי החיים, כמו גם הזמן שחלף עד להדמיה. חלק מהמוטציות הגנטיות משבשות את המבנה ו/או התפקוד של תאי העצב החושיים החשופים חיצונית, וכתוצאה מכך בעלי חיים אינם מסוגלים לצבוע כראוי. לכן, מילוי צבע של מוטציות חדשות של C. elegans יכול לשמש כמזהה מעבר ראשון פשוט לפגמים במבנה או בתפקוד של נוירונים חושיים. עם זאת, מגבלה אחת של טכניקה זו היא שלא ניתן להשתמש בה כדי לקבוע איזה סוג של פגמים קיימים בנוירונים החושיים. לפיכך, יש לעקוב אחר כל פגמים במילוי צבע שהתגלו לאחרונה עם שילוב כלשהו של מבחנים התנהגותיים כדי לנתח את תפקוד הנוירונים החושיים ומדווחים טרנסגניים כדי לזהות פגמים מבניים שעלולים להיות קיימים.
כאשר מכינים בעלי חיים למילוי צבע, סנכרון נכון הוא שלב קריטי בפרוטוקול כדי להבטיח השוואה בין בעלי חיים בשלבי התפתחות דומים. סנכרון גיל על ידי הכנת אקונומיקה הוא שיטה נפוצה בקהילת המחקר של C. elegans . שיטה זו מאפשרת בידוד של עוברים מופרים ממבוגרים גרבידיים, כאשר קליפות הביצים של העוברים מגינות עליהם מפני כל השפעות מזיקות של האקונומיקה לאורך זמן חשיפה קצר14. עם זאת, חשוב במיוחד לעקוב מקרוב אחר בעלי חיים בשלב ההלבנה (שלב 2.5), מכיוון שעדיין ניתן להלבין יתר על המידה דגימות שעלולות לגרום לפירוק של עוברים בנוסף למבוגרים גרבידיים. סנכרון על ידי הכנת אקונומיקה הוא השיטה המועדפת אם עובדים עם זנים שיש להם פגמים בהטלת ביצים, שחלק מבעלי החיים עם ריסים לא מתפקדים מציגים10. לשיטה חלופית לבידוד אוכלוסיות מסונכרנות גס בזנים שאינם מציגים פגמים בהטלת ביצים, ניתן להניח 10 בעלי חיים בוגרים צעירים על צלחת NGM עם E. coli למשך מספר שעות, ולאחר מכן להסיר לאחר הטלת ביצים מספיקות.
כבר 30 דקות לאחר מילוי הצבע ניתן לבצע הדמיה, כמתואר בסוף שלב מילוי הצבע (שלב 3.11). עם זאת, בעלי חיים השוחים בצבע DiI יכולים גם לבלוע חלק מהצבע, מה שמאפשר לו להתרכז במעי, בנוסף למיקום בכל הנוירונים. זה יכול להוביל לאותות פלואורסצנטיים לא רצויים שמופיעים במעי במשך 30 דקות לפחות ועד כמה שעות אחרי מילוי הצבע (איור 4). בגלל החיסרון הזה בהדמיה מוקדמת, אנו מוצאים שהתמונות הברורות ביותר של הנוירונים, ללא אותות רקע לא רצויים, נראות לאחר 24 שעות של התאוששות. בתוך חלון של 24 שעות אחרי מילוי הצבע, האות הפלואורסצנטי מהצבע נשאר בהיר ואחיד יחסית (איור 2).
הדמיית מילוי צבע לאחר 48 שעות של החלמה עלולה להניב תוצאות לא רצויות. ראשית, האות הפלואורסצנטי מ-DiI דוהה עם הזמן, מה שמקשה במיוחד על הדמיית הדנדריטים המלאים בצבע (איור 2). נראה שהתוצאה הזו לא נגרמת על-ידי שינויים התפתחותיים בחיות (איור 3), אלא יכולה להיות תוצאה של שילוב כלשהו של דיפוזיה של צבע, פירוק צבע ומרווה פלואורסצנטית. שנית, ידוע כי C. elegans מפתח אוטופלואורסצנטיות מעיים המצטברת עם ההזדקנות15. אוטו-פלואורסצנטיות זו נראית דרך אותו סט מסננים (TRITC) כמו DiI ועלולה לגרום לקושי להבחין בין נוירונים מלאי צבע. מסיבה זו, מומלץ גם להשלים את מילוי הצבע על בעלי חיים בשלבי זחל מאוחרים (L3 או L4) או בבגרות מוקדמת, מכיוון שחלון זה של שלבי התפתחות הוא הקל ביותר להדמיה על סמך גודל בעלי החיים והכי פחות סביר שיראה אוטופלואורסצנטיות עקב הזדקנות. בחירת זמן ההתאוששות המתאים לניסויים ספציפיים ויישומי הוראה היא שלב קריטי נוסף בפרוטוקול זה שצריך להיקבע על ידי כל משתמש ייחודי.
שיטות קיימות וחלופיות למילוי צבע כוללות שימוש בצבעים ליפופיליים אחרים, כגון פלואורסצאין איזותיוציאנט (FITC) ו-3,3́ -dioctadecyloxacarbocyanine perchlorate (DiO)6,7. ניתן גם לשנות מילוי צבע באמצעות תנאי צביעה שונים כדי להגיע למטרות קשות יותר למילוי, כגון ששת נוירוני IL28, או כדי לדמיין סוגי רקמות נוספים, כגון מבנים קוטיקולריים9. ניתן להשתמש בסוגים שונים של מיקרוסקופיה כדי להמחיש מילוי צבע, בהתאם לציוד הזמין. מיקרוסקופיה תרכובת פלואורסצנטית משמשת במאמר זה והיא אפשרות נגישה בעלות נמוכה שעדיין מספקת הדמיה ברזולוציה גבוהה יחסית של דפוסי מילוי צבע. מיקרוסקופ סטריאו פלואורסצנטי תואם להקרנה מהירה בתפוקה גבוהה של מספר רב של בעלי חיים וניתן להשתמש בו כדי לכמת את תדירות הפגמים במילוי הצבע. טכניקות הדמיה ברזולוציה גבוהה יותר, כגון מיקרוסקופיה קונפוקלית, יכולות לספק מידע מדויק עוד יותר על דפוסי מילוי צבע11.
לסיכום, מילוי צבע הוא טכניקה זולה ופשוטה ליישום, מה שהופך אותה לשיטה אטרקטיבית במיוחד לשימוש בשיעורי ביולוגיה לתואר ראשון. בנוסף, זוהי טכניקה נגישה מאוד לפרויקטי מחקר עצמאיים המובלים על ידי מתמחים לתואר ראשון, כמו גם לאלה החדשים בתחום C. elegans . כתרגיל מעבדה עצמאי או כצעד אחד בפרויקט מחקר גדול יותר עם C. elegans, מילוי צבע הוא שיטה מצוינת להבנת השיבוש של התהליכים הבסיסיים המתרחשים בתאי עצב חושיים ריסניים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לננסי שאו וקמרון בריסבין (אוניברסיטת דרום אורגון). העבודה נתמכה על ידי קרנות סטארט-אפ מאוניברסיטת דרום אורגון עבור M. LaBonty. חלק מהזנים של C. elegans סופקו על ידי המרכז לגנטיקה של Caenorhabditis (CGC), הממומן על ידי המשרד לתוכניות תשתית מחקר של ה-NIH (P40 OD010440).
Materials
| Name | Company | Catalog Number | Comments |
| DiI | Biotium | 60010 | Not water soluble, make 2 mg/mL solution in DMF. Solution is light sensitive, cover with foil. Store at -20 °C. Solution good for many years. |
| Levamisole hydrochloride | Fisher | AC187870100 | 10 mM solution in M9 Buffer. Store at -20 °C. Solution good for many years. |
| M9 Buffer | IPM Scientific | 11006-517 | Available for purchase, but also easy to make in house following recipe in protocol. |
| N2 (C. elegans strain) | CGC | N2 | C. elegans wild isolate |
| YH2125 (C. elegans strain) | n/a | n/a | Strain generated in Yoder Laboratory (Bentley-Ford et al, 2021) |
References
- Alcedo, J., et al. Nature's gift to neuroscience. J Neurogenet. 34 (3-4), 223-224 (2021).
- Anvarian, Z., Mykytyn, K., Mukhopadhyay, S., Pedersen, L. B., Christensen, S. T. Cellular signalling by primary cilia in development, organ function and disease. Nat Rev Nephrol. 15 (4), 199-219 (2019).
- Inglis, P. N., Ou, G., Leroux, M. R., Scholey, J. M. The Sensory Cilia of Caenorhabditis elegans. WormBook. , (2007).
- Bae, Y. -. K., Barr, M. M. Sensory roles of neuronal cilia: cilia development, morphogenesis, and function in C. elegans. Front Biosci. 13 (15), 5959-5974 (2008).
- Altun, Z. F., Hall, D. H. Nervous System, Neuronal Support Cells. WormAtlas. , (2010).
- Perkins, L. A., Hedgecock, E. M., Thomson, J. N., Culotti, J. G. Mutant sensory cilia in the nematode Caenorhabditis elegans. Dev Biol. 117 (2), 456-487 (1986).
- Starich, T. A., et al. Mutations affecting the chemosensory neurons of Caenorhabditis elegans. Genetics. 139 (1), 171-188 (1995).
- Tong, Y. -. G., Bürglin, T. R. Conditions for dye-filling of sensory neurons in Caenorhabditis elegans. J Neurosci Methods. 188 (1), 58-61 (2010).
- Schultz, R. D., Gumienny, T. L. Visualization of Caenorhabditis elegans cuticular structures using the lipophilic vital dye DiI. J Vis Exp. (59), e3362 (2012).
- Bentley-Ford, M. R., et al. Evolutionarily conserved genetic interactions between nphp-4 and bbs-5 mutations exacerbate ciliopathy phenotypes. Genetics. 220 (1), iyab209 (2022).
- Guha, S., Pujol, A., Dalfo, E. Anti-oxidant MitoQ rescue of AWB chemosensory neuron impairment in a C. elegans model of X-linked Adrenoleukodystrophy. MicroPubl Biol. 2021, (2021).
- Chen, N., et al. Identification of ciliary and ciliopathy genes in Caenorhabditis elegans through comparative genomics. Genome Biol. 7 (12), R126-R212 (2006).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nat Rev Mol Cell Biol. 18 (9), 533-547 (2017).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Céron, J. Basic Caenorhabditis elegans methods: synchronization and observation. J Vis Exp. 64, e4019 (2012).
- Pincus, Z., Mazer, T. C., Slack, F. J. Autofluorescence as a measure of senescence in C. elegans: look to red, not blue or green. Aging (Albany NY). 8 (5), 889-898 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ISSN 2578-6326
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.