Method Article
גישה חוץ גופית לחקר תפקוד לקוי של המיטוכונדריה: מודל Cybrid
In This Article
Summary
ציברידים טרנסברוכונדריאליים הם תאים היברידיים המתקבלים על ידי התמזגות של תאים מיטוכונדריאליים מיטוכונדריאליים (mtDNA) מדולדלים (תאי rho0 ) עם ציטופלסטים (תאים מלוכדים) שמקורם בחולים הסובלים מהפרעות מיטוכונדריאליות. הם מאפשרים לקבוע את המקור הגרעיני או המיטוכונדריאלי של המחלה, הערכה של פעילות ביוכימית, ואישור של התפקיד הפתוגנטי של גרסאות הקשורות ל- mtDNA.
Abstract
מחסור בקומפלקסים של שרשרת הנשימה המיטוכונדרית המבצעים זרחון חמצוני (OXPHOS) הוא הסמן הביוכימי של הפרעות מיטוכונדריאליות אנושיות. מנקודת מבט גנטית, ה-OXPHOS מהווה דוגמה ייחודית משום שהוא נובע מהשלמה של שתי מערכות גנטיות נפרדות: דנ"א גרעיני (nDNA) ודנ"א מיטוכונדריאלי (mtDNA). לכן, פגמים ב-OXPHOS יכולים לנבוע ממוטציות המשפיעות על גנים מקודדים גרעיניים ומיטוכונדריאליים.
עבודתם פורצת הדרך של קינג ואטארדי, שפורסמה ב-1989, הראתה כי קווי תאים אנושיים שהתרוקנו מ-mtDNA (הנקראים rho0) יכולים להיות מאוכלסים מחדש על ידי מיטוכונדריה אקסוגנית כדי להשיג את מה שמכונה "ציברידים טרנסטרוכונדריאליים". הודות לציברידים אלה המכילים מיטוכונדריה שמקורם בחולים עם הפרעות מיטוכונדריאליות (MDs) וגרעינים מתאי rho0 , ניתן לוודא אם פגם קשור ל-mtDNA או ל-nDNA. cybrids אלה הם גם כלי רב עוצמה כדי לאמת את הפתוגניות של מוטציה ולחקור את השפעתה ברמה ביוכימית. מאמר זה מציג פרוטוקול מפורט המתאר יצירת cybrid, בחירה ואפיון.
Introduction
הפרעות מיטוכונדריאליות (MDs) הן קבוצה של תסמונות רב-מערכתיות הנגרמות על ידי פגיעה בתפקודים המיטוכונדריאליים עקב מוטציות בדנ"א גרעיני (nDNA) או במיטוכונדריאלי (mtDNA)1. הם בין המחלות המטבוליות התורשתיות הנפוצות ביותר, עם שכיחות של 1:5,000. מחלות הקשורות ל- mtDNA עוקבות אחר הכללים של גנטיקה מיטוכונדריאלית: תורשה אימהית, הטרופלזמה ואפקט סף, והפרדה מיטוטית2. mtDNA אנושי הוא מעגל דנ"א דו-גדילי של 16.6 קילובייט, המכיל אזור בקרה קצר עם רצפים הדרושים לשכפול ושעתוק, 13 גנים המקודדים חלבונים (כולם תת-יחידות של שרשרת הנשימה), 22 tRNA ו-2 גנים rRNA3.
אצל אנשים בריאים, יש גנוטיפ mtDNA אחד ויחיד (homoplasmy), בעוד שיותר מגנוטיפ אחד מתקיים בדו-קיום (הטרופלזמה) בתנאים פתולוגיים. מוטציות הטרופלסמיות מזיקות חייבות להתגבר על סף קריטי כדי לשבש OXPHOS ולגרום למחלות שיכולות להשפיע על כל איבר בכל איבר בכל גיל4. הגנטיקה הכפולה של OXPHOS מכתיבה תורשה: אוטוזומלית רצסיבית או דומיננטית ומקושרת X למוטציות nDNA, אימהית למוטציות mtDNA, בתוספת מקרים ספורדיים הן עבור nDNA והן עבור mtDNA.
בתחילת עידן הרפואה המיטוכונדרית, ניסוי פורץ דרך של קינג ואטארדי5 ביסס את הבסיס להבנת מקורה של מוטציה האחראית על MD על ידי יצירת תאים היברידיים המכילים גרעינים מקווי תאים סרטניים שבהם mtDNA התרוקן לחלוטין (תאי rho0) ומיטוכונדריה מחולים עם MDs. טכניקות ריצוף מהדור הבא (NGS) לא היו זמינות באותה תקופה, ולא היה קל לקבוע אם מוטציה קיימת בגנום הגרעיני או המיטוכונדריאלי. השיטה, שתוארה בשנת 1989, שימשה אז כמה חוקרים שעבדו בתחום הרפואה המיטוכונדרית 6,7,8,9; פרוטוקול מפורט פורסם לאחרונה10, אך עדיין לא נעשה סרטון. מדוע פרוטוקול כזה צריך להיות רלוונטי בימינו כאשר NGS יכול לזהות במדויק ובמהירות היכן נמצאת מוטציה? התשובה היא שדור cybrid הוא עדיין הפרוטוקול החדיש ביותר כדי להבין את התפקיד הפתוגני של כל מוטציה mtDNA חדשה, לתאם את אחוז ההטרופלזמה עם חומרת המחלה, ולבצע חקירה ביוכימית במערכת גרעינית הומוגנית שבה התרומה של הרקע הגרעיני האוטוכטוני של המטופל נעדרת11, 12,13.
פרוטוקול זה מתאר כיצד להשיג ציטופלסטים מפיברובלסטים קונפלואנטיים שמקורם בחולים הגדלים בצלחות פטרי 35 מ"מ. צנטריפוגה של הכלים בנוכחות ציטוכלאסין B מאפשרת בידוד של ציטופלסטים משועבדים, אשר לאחר מכן מתמזגים עם תאי rho0 בנוכחות פוליאתילן גליקול (PEG). לאחר מכן מטפחים את הציברידים המתקבלים בתווך סלקטיבי עד שנוצרים שיבוטים. סעיף התוצאות הייצוגיות מציג דוגמה לאפיון מולקולרי של הציברידים המתקבלים כדי להוכיח כי ה-mtDNA זהה לזה של הפיברובלסטים של המטופלים התורמים וכי ה-nDNA זהה לדנ"א הגרעיני של קו תאי ה-rho0 הגידולי.
Protocol
הערה: השימוש בפיברובלסטים אנושיים עשוי לדרוש אישור אתי. פיברובלסטים ששימשו במחקר זה נגזרו מחולי MD ואוחסנו בבנק הביולוגי המוסדי בהתאם לדרישות האתיות. ניתנה הסכמה מדעת לשימוש בתאים. בצע את כל ההליכים של תרבית תאים תחת ארון זרימה למינרי סטרילי בטמפרטורת החדר (RT, 22-25 °C (22-25 °C).22°C). השתמשו בתמיסות מסוננות סטריליות המתאימות לתרביות תאים ולציוד סטרילי. לגדל את כל קווי התאים באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2. בדיקות Mycoplasma צריכות להתבצע מדי שבוע כדי להבטיח תרבויות ללא מיקופלסמה. ניתן ליצור תאים 143BTK- rho0 כפי שתואר קודם לכן5.
1. תרבית תאים
- לפני תחילת כל הליך, ודא את נוכחות המוטציה בפיברובלסטים שמקורם בחולי MD וכמת את אחוז ההטרופלזמה או ההומופלזמה על ידי פולימורפיזם באורך שבר הגבלה (RFLP) ו/או ניתוחי ריצוף mtDNA שלמים14.
- פיברובלסטים של זרעים בארבע צלחות פטרי 35 מ"מ, שכל אחת מהן מכילה 2 מ"ל של מדיום תרבית מלאה (טבלה 1). תנו לתאים לגדול עד 80% מפגש (48 שעות).
- לגדל 143BTK- rho0 תאים ב 8 מ"ל של תוספת תרבית בינונית (טבלה 1) בצלחת פטרי 100 מ"מ.
- שמור על התאים באינקובטור ב 37 °C עם 5% CO2.
- בדוק את היעדר mtDNA בתאי rho0 על ידי ריצוף טכניקות14.
2. הטמעה של פיברובלסטים
- לעקר ארבעה בקבוקים מתאימים לצנטריפוגה של 250 מ"ל על ידי עיקור אוטוקלאב ב-121 מעלות צלזיוס למשך 20 דקות מחזור. מייבשים אותם בתנור מעבדה או ב-RT.
- מחממים מראש את הצנטריפוגה ב-37 מעלות צלזיוס.
- שטפו פעמיים את הכלים בקוטר 35 מ"מ המכילים את הפיברובלסטים, תוך שימוש ב-2 מ"ל של 1x מלח עם מאגר פוספט (PBS) ללא (w/o) סידן ומגנזיום.
- מנקים את המשטח החיצוני של הכלים עם 70% אתנול ומחכים עד שהאלכוהול יתאדה.
- מוציאים את המכסים מהכלים ואת פקקי הברגים מהבקבוקים. מניחים כל מנה, ללא המכסה, הפוכה בתחתית כל בקבוק צנטריפוגה של 250 מ"ל.
- לאט לאט מוסיפים 32 מ"ל של Enucleation Medium לכל בקבוק (טבלה 1), ומאפשרים למדיום להיכנס לתבשיל ולבוא במגע עם התאים. מוציאים את כל הבועות מהכלים באמצעות ארוכה פסטר פיפטה, ומעוגלים את הקצה בלהבת בונזן.
הערה: חשוב להסיר את הבועות כדי לאפשר למדיום להיכנס לצלחת ולבוא במגע עם התאים. - סגור כל בקבוק עם פקק הבורג והעביר אותם לצנטריפוגה.
- צנטריפוגה למשך 20 דקות ב-37 מעלות צלזיוס ו-8,000 × גרם, האצה מקסימלית, האטה איטית. שימו לב כדי לאזן את הצנטריפוגה: משקל נגד כל בקבוק. במידת הצורך, התאם את המשקל על ידי הוספת נפח מתאים של Enucleation Medium.
- במהלך צנטריפוגה, השתמשו בריק או פיפטה סרולוגית של 10 מ"ל כדי לשאוף ולהשליך את המדיום מצלחות התרבית 143BTK- rho0 ולשטוף אותן פעמיים באמצעות 4 מ"ל של 1x PBS עם סידן ומגנזיום.
- הוסף 2 מ"ל של טריפסין כדי לכסות את מונולאי התא לחלוטין.
- מניחים את הכלים באינקובטור של 37 מעלות צלזיוס למשך כ-2 דקות.
- מוציאים את הכלים מהחממה, צופים בניתוק תאים באמצעות מיקרוסקופ הפוך עבור תאים חיים (מטרות פי 4 או 10x), ומעכבים את פעילות האנזים על ידי הוספת 2 מ"ל של מדיום תרבית משלים.
- לשאוף את 4 מ"ל של תרחיף התא בצלחת עם פיפטה 10 מ"ל ולהעביר אותו לצינור חרוטי 15 מ"ל.
- ספרו את התאים באמצעות תא המוציטומטר של Burker או מונה אוטומטי.
- בסוף הצנטריפוגה (שלב 2.8), שאפו את המדיום מהבקבוקים והשליכו אותו.
- מוציאים את הכלים על ידי היפוך הבקבוקים על גזה סטרילית שרוססה בעבר ב-70% אתנול. נקו את המשטח החיצוני של הכלים והמכסים שלהם עם 70% אתנול. המתן עד שהאלכוהול יתאדה, ואז סגור את הכלים.
- לפני שתמשיך, בדוק את היווצרות הציטופלסט (רוח רפאים) באמצעות מיקרוסקופ הפוך עבור תאים חיים (מטרה 4x או 10x). חפשו פיברובלסטים מוארכים במיוחד עקב שחול הגרעינים שלהם המושרה על ידי ציטוכלאסין B.
- לכל מנה של 35 מ"מ, הוסיפו 1 × 106 מתוך 143BTK- rho0 תאים שעברו החייאה ב-2 מ"ל של 143BTK- rho0 תרבית בינונית בתוספת 5% סרום בקר עוברי (FBS).
- השאירו את הכלים למשך 3 שעות באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 ותנו לתאי 143BTK-rho0 להתיישב על רוחות הרפאים. אל תפריעו לכלים.
3. היתוך של הפיברובלסטים המוטבעים עם תאי rho 0
- לאחר 3 שעות של דגירה, לשאוף ולהשליך את המדיום מן הכלים.
- שטפו את התאים הדבקים פעמיים עם 2 מ"ל של מדיום הנשר המהונדס (DMEM) של Dulbecco עם גלוקוז גבוה בסרום או עם מדיום חיוני מינימלי (MEM).
- לשאוף ולהשליך את המדיום.
- הוסף 500 μL של תמיסת PEG (ראה טבלת החומרים) לתאים ודגירה למשך דקה אחת בדיוק.
- שאפו והשליכו את פתרון ה-PEG.
- שטפו את התאים שלוש פעמים באמצעות 2 מ"ל של DMEM גלוקוז גבוה בסרום או עם MEM.
- הוסף 2 מ"ל של Fusion Medium (טבלה 1) ודגירה לילה באינקובטור ב 37 °C עם 5% CO2.
4. בחירה והרחבה של Cybrid
- לאחר הדגירה בלילה, מוציאים את הצלחות מהאינקובטור, מנסים את התאים כמתואר לעיל (שלבים 2.9-2.13), ומעבירים את התוכן של כל מנה של 35 מ"מ למנה של 100 מ"מ למנה של 100 מ"מ.
- הוסף 8 מ"ל של בחירה בינונית (טבלה 1) והנח את הצלחות באינקובטור ב- 37 °C עם 5% CO2.
- שנה את המדיום כל 2-3 ימים.
- המתן כ-10-15 ימי סלקציה עד שיופיעו מושבות של תאים.
- הקפיאו את אחת מארבע צלחות הפטרי על ידי איסוף כל השיבוטים ויצירת תרבות "מסיבית" כגיבוי לסיברידים, שבסופו של דבר ניתן יהיה לשחזרם ולהשתמש בהם לחקירות נוספות.
- נסו את התאים בשאר מנות התרבית, ספרו וזרעו לתוך צלחת פטרי אחת או יותר ב-50-100 תאים/צלחת במדיום התרבית המשלים (טבלה 1) עד להופעת שיבוטים. תנו להם לגדול במשך כמה ימים.
- גלול את התאים הנותרים על ידי צנטריפוגה ב-1,200 × גרם למשך 3 דקות ב-RT והשליך את הסופרנאטנט.
- חילוץ דנ"א מהכדור (ראו טבלת החומרים).
- בצע גנוטיפ לפי מספר משתנה של ניתוח טנדם חוזר (VNTR) כפי שדווח בעבר15.
- קחו שיבוטים מצלחת פטרי עם גלילי שיבוט או קצה פיפטה, תוך שימוש בסטריאומיקרוסקופ כדי למנוע איגום של שיבוטים שונים, והעבירו אותם לצלחת של 96 בארות, שכל באר מכילה 200 מיקרול"ל של מדיום תרבית משלים (טבלה 1).
- הרחיבו כל שיבוט עד שיהיו מספיק תאים להקפאה ולמיצוי של דנ"א.
- אמת את אחוז המוטציה של כל שיבוט על ידי RFLP או שיטות ריצוף אחרות. באופן אידיאלי, נסו להשיג גם שיבוטים עם mtDNA מסוג פראי (0% מוטציה) וגם שיבוטים עם אחוזי מוטציה שונים, שניהם מסתכמים ב-mtDNA של מוטציה הומופלסמית (100% מוטציה). ראו איור 1 עבור דיאגרמה סכמטית של פרוטוקול יצירת cybrid.
תוצאות
יצירת cybrids דורשת 3 ימים של עבודת מעבדה בתוספת תקופת בחירה (~ 2 שבועות) ועוד 1-2 שבועות לצמיחת שיבוטים. השלבים הקריטיים הם איכות הציטופלסטים ותקופת הבחירה. המורפולוגיה של cybrids דומה לזו של התאים התורמים rho0. הקצאה של mtDNA ו- nDNA הנכונים ב- cybrids היא חובה כדי לאשר את זהות התאים. דוגמה לכך ניתנת באיור 2. במקרה זה, יצרנו ציברידים החל מפיברובלסטים שמקורם בחולה הנושא את ההטרופלסמי m.3243A>G, אחת המוטציות הנפוצות ביותר ב-mtDNA הקשורות למיופתיה מיטוכונדריאלית, אנצפלופתיה, חומצה לקטית ואירועים דמויי שבץ (MELAS). ניתוח של VNTR הראה כי cybrid nDNA זהה לזה של תאי ה-rho0 (איור 2A), ואישר את החלפת ה-nDNA של המטופל בגנום 143B. ניתן להשתמש בניתוחי RFLP ו/או ריצוף כדי להעריך את נוכחותה של מוטציית mtDNA ואת אחוז ההטרופלזמה (איור 2B,C).
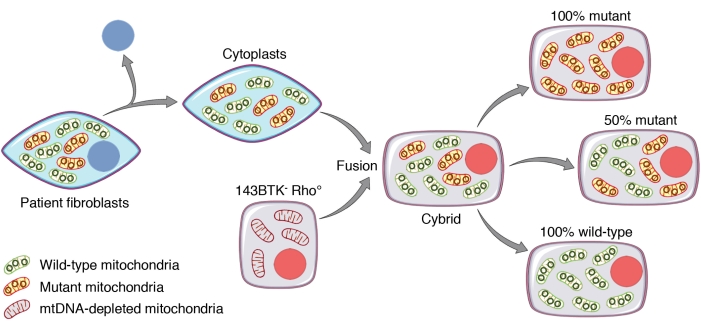
איור 1: דיאגרמה סכמטית של פרוטוקול יצירת cybrid. פיברובלסטים שמקורם בחולה מטופלים בציטוכלאזין B וצנטריפוגות כדי להשיג ציטופלסטים (תאים מלוכדים). היתוך ציטופלסמי של ציטופלסטים ותאים מדולדלים mtDNA (143BTk- rho0) מאפשר יצירת ציברידים שניתן לבודד לאחר הברירה בתווך המתאים. איסוף והגברה של שיבוטים בודדים מניבים אחוזי הטרופלזמה שונים, אשר בתיאוריה יכולים להשתנות בין 100% סוג פראי ל 100% מוטציה. קיצור: mtDNA = דנ"א מיטוכונדריאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: אפיון מולקולרי של cybrids. (A) ניתוח של מיקרו-לוויינים Apo-B מראה כי ה-nDNA המופק מהציברידים הנוצרים זהה לדנ"א הגרעיני של קו תאי ה-rho0 . (B) מפות הגבלה של HaeIII של מוצר ה-PCR המשתרעות על פני המינים m.3243A>G הקשורים ל-MELAS, המשמשים לכימות כמות ה-WT) ומיני mtDNA מסוג Mut. (C) תוצאות מייצגות של ניתוח RFLP המראות רמות הטרופלזמה m.3243A>G בשיבוטים שונים של cybrid (c1, c2, c3). קיצורים: M = סמן; bp = זוגות בסיסים; WT = סוג פראי; מוט = מוטציה; RFLP = פולימורפיזם אורך קטע הגבלה; MELAS = מיופתיה מיטוכונדריאלית, אנצפלופתיה, חומצה לקטית ואפיזודות דמויות שבץ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| קומפוזיציית מדיה | |
| מדיום תרבות שלם | הסכמה סופית. |
| DMEM גלוקוז גבוה (עם L-גלוטמין W/נתרן פירובט) | [1:1] |
| FetalClone III (מוצר סרום בקר) | 10% |
| נתרן פירובט 100 mM | 1 מ"מ |
| פניצילין-סטרפטומיצין (תמיסה 100x) | 1% |
| L-גלוטמין 200 mM (100x) | 2 מ"מ |
| תוספת מדיום תרבותי | הסכמה סופית. |
| DMEM גלוקוז גבוה (עם L-גלוטמין W/נתרן פירובט) | [1:1] |
| FetalClone III (מוצר סרום בקר) | 10% |
| נתרן פירובט 100 mM | 1 מ"מ |
| פניצילין-סטרפטומיצין (תמיסה 100x) | 1% |
| L-גלוטמין 200 mM (100x) | 4 מ"מ |
| אורידין | 50 מיקרוגרם/מ"ל |
| מדיום אנקולציה | הסכמה סופית. |
| DMEM גלוקוז גבוה (עם L-גלוטמין W/נתרן פירובט) | [1:1] |
| FetalClone III (מוצר סרום בקר) | 5% |
| נתרן פירובט 100 mM | 1 מ"מ |
| פניצילין-סטרפטומיצין (תמיסה 100x) | 1% |
| L-גלוטמין 200 mM (100x) | 2 מ"מ |
| Cytochalasin B מ Drechslera dematioidea | 10 מיקרוגרם/מ"ל |
| מדיום פיוז'ן | הסכמה סופית. |
| DMEM גלוקוז גבוה (עם L-גלוטמין W/נתרן פירובט) | [1:1] |
| FetalClone III (מוצר סרום בקר) | 5% |
| נתרן פירובט 100 mM | 1 מ"מ |
| פניצילין-סטרפטומיצין (תמיסה 100x) | 1% |
| L-גלוטמין 200 mM (100x) | 2 מ"מ |
| מדיום בחירה | הסכמה סופית. |
| DMEM גלוקוז גבוה (עם L-גלוטמין W/נתרן פירובט) | [1:1] |
| דיאליזד FBS | 5% |
| נתרן פירובט 100 mM | 1 מ"מ |
| פניצילין-סטרפטומיצין (תמיסה 100x) | 1% |
| L-גלוטמין 200 mM (100x) | 2 מ"מ |
| 5-ברומו-2'-דאוקסיורידין | 100 מיקרוגרם/מ"ל |
טבלה 1: פרטים על מדיה המשמשת ליצירת cybrid.
Discussion
ל-mtDNA יש שיעור מוטציות גבוה מאוד בהשוואה ל-nDNA בגלל היעדר היסטונים מגנים ומיקומה קרוב לשרשרת הנשימה, מה שחושף את המולקולה להשפעות חמצון מזיקות שאינן מנוגדות ביעילות על ידי מערכות התיקון16. המוטציות הפתוגניות הראשונות של mtDNA זוהו בשנת 198817,18, ומאז תוארו מספר רב של מוטציות. טכנולוגיית NGS היא גישה רלוונטית לסינון כל הגנום המיטוכונדריאלי ולזיהוי קל שלגרסאות 14. עם זאת, הערכת התפקיד הפתוגני של מוטציית mtDNA שמעולם לא תוארה יכולה להיות מאתגרת ועדיין מסתמכת על שיטות "מיושנות" כגון יצירת תאים ציבריים המתוארים בפרוטוקול זה 11,12,13. הדור הציבריד המתואר כאן משחזר את השיטות המקוריות שתוארו על ידי קינג ואטארדי5. עם זאת, פרוטוקולים אחרים מכילים שינויים קלים הקשורים בעיקר למערכות עבור enucleation תאים10. במקרים אחרים, ההאנשה מיותרת, למשל, כאשר החומר הביולוגי שמקורו בחולה מורכב מטסיות דם, שאינן מכילות גרעין19.
ציברידים טרנסטרוכונדריאליים הם בעלי מספר תכונות חשובות, מה שהופך אותם לכלי מחקר רלוונטי גם כאשר טכנולוגיות מולקולריות בעלות תפוקה גבוהה יכולות ליצור פרופיל של דנ"א ורנ"א ברמת התא הבודד. בעבודות חלוציות, cybrids שימשו כדי לבסס או לאשר את המקור הגנטי של הפרעות המוגדרות קלינית וביוכימית כהפרעות מיטוכונדריאליות 6,7,8,9,20. ואכן, המערכת מאפשרת באופן בלעדי לחקור את התרומה של מוטציית mtDNA ללא השפעת הגנים הגרעיניים של הפרובנד וברקע גרעיני הומוגני של תאי rho0.
בנוסף, ניתן לבצע מתאם כמותי בין גנוטיפ לפנוטיפ, הודות לבידוד של שיבוטים ציבריים שונים הנושאים אחוזים שונים של המוטציות. השיבוטים השונים נבחרו באמצעות Selection Medium (טבלה 1) בתוספת FBS דיאליזד ואינם מכילים אורידין ופירובט, מה שמאפשר צמיחה של תאי rho0 המתמזגים עם ציטופלסטים בלבד. לפיכך, תאי rho0 שלא התמזגו או התמזגו עם פיברובלסטים שלמים (תאים דו-גרעיניים או רב-גרעיניים), כמו גם עם שאריות של פיברובלסטים שלמים שלא התמזגו, מסולקים. ואכן, תאי rho0 מתרוקנים לחלוטין מ-mtDNA על ידי חשיפה ארוכת טווח לריכוזים נמוכים של אתידיום ברומיד, מעכב רב עוצמה של גמא-פולימראז המיטוכונדריה21.
בהיעדר שרשרת נשימה תפקודית, תאי rho0 מסתמכים אך ורק על גליקוליזה עבור דרישות האנרגיה שלהם והופכים להיות תלויי פירובט. בנוסף, תאי rho0 הפכו לאוקסוטרופיים עבור פירימידינים (אורידין הוא מבשר פירימידין) בגלל מחסור בדהידרוגנאז דיהידרואורוטאט, אנזים המתפקד בתוך המיטוכונדריה ומעורב בביוסינתזה של פירימידין. בעוד שתאי rho0 מופקים מאוסטאוסרקומה אנושית 143B תאי תימידין קינאז לקויים (TK-), פיברובלסטים, ציטופלסטים ובני כלאיים רב-גרעיניים הם TK+. לכן, תאי TK+ מוסרים עקב חשיפה ל-5-ברומו-2'-דאוקסיורידין. למעשה, אנלוגי אורידין זה מוכר על ידי TK המזרז את הזרחון של דאוקסיתימידין, המשמש לאחר מכן בביוסינתזה של DNA. תהליך זה גורם למוטציות קטלניות הגורמות למוות תאי. יתרון נוסף של cybrids הוא האפשרות להקפיא ו / או לעשות בהם שימוש חוזר במשך תקופות תרבות ארוכות ללא שינויים. יתר על כן, כמו תאי הגידול, קצב הגדילה הגבוה שלהם מקטין את משך המחקר הניסויי.
התנאי המוקדם המולקולרי להפוך את המערכת הזו לשימושית ואמינה הוא לאמת את התרומה הגנטית הנכונה של הדנ"א הגרעיני והמיטוכונדריאלי ואת כמות ה-mtDNA בציברידים המאוכלסים מחדש. כיום, ניתן לבצע זאת בקלות על ידי שימוש בטכניקות NGS המאפשרות ניתוח של כל מולקולת mtDNA להגדרת קבוצות ההפלוגות ואימות רציף של נוכחותם של כל וריאנטים פתוגניים לא רצויים אחרים בנוסף לווריאנט הנחקר. במקרה של תנאים הטרופלסמיים, ניתן להשתמש בבידוד של שיבוטים עם עומסי מוטציה שונים, הנעים באופן אידיאלי בין 0% ל -100%, כדי לתאם את אחוז המוטציה עם חומרת הפגיעה המיטוכונדרית.
מלכודות אפשריות החבויות בהליכי יצירת cybrid אלה קשורות למקור הגידול של תאי rho0 המשמשים כתורמים גרעיניים. תאים אלה הם אנאופלואידים, ולא ברור כיצד זה יכול בסופו של דבר להשפיע על תפקודים מיטוכונדריאליים ועל התרגום וההרכבה של תת-היחידות השונות של שרשרת הנשימה המקודדות על ידי הדנ"א הגרעיני והמיטוכונדריאלי, בהתאמה. באופן כללי, רצוי ליצור cybrids באמצעות תאי rho0 ממקורות שונים ולוודא כי השיבוטים שהתקבלו מציגים פנוטיפים דומים. מגבלה נוספת היא שתאי הגידול הם בעיקר גליקוליטיים בעוד שהפרעות מיטוכונדריאליות מסתמכות באופן מסיבי על OXPHOS. לכן, יש לקבוע היטב את ההשפעה של גרעין גליקוליטי (תאי rho0 ) על ההשלכות של מוטציה ב-mtDNA.
למרות המגבלות הנ"ל, הדור של cybrids חולל מהפכה בתחום הרפואה המיטוכונדרית ועדיין משמש לביסוס התפקיד הפתוגני של מוטציות mtDNA חדשות. יתר על כן, טכנולוגיית cybrid משמשת לחקר התרומה המיטוכונדרית למחלות שונות, החל מהפרעות נוירודגנרטיביות נפוצות כגון פרקינסון, אלצהיימר ומחלת הנטינגטון 22,23,24,25,26, וכלה בסרטן וטיפול אנטי סרטני 27,28.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מחקר זה בוצע במרכז לחקר מחלות ילדים מיטוכונדריאליות (http://www.mitopedia.org), במימון קרן מריאני. VT הוא חבר ברשת הייחוס האירופית למחלות נוירומוסקולריות נדירות (ERN EURO-NMD).
Materials
| Name | Company | Catalog Number | Comments |
| 5-Bromo-2'-Deoxyuridine | Sigma-Aldrich (Merck) | B5002-500MG | |
| 6 well Plates | Corning | 3516 | |
| 96 well Plates | Corning | 3596 | |
| Blood and Cell Culture DNA extraction kit | QIAGEN | 13323 | |
| Centrifuge | Beckman Coulter | Avanti J-25 | 7,200 rcf, 37 °C |
| Centrifuge bottles, 250 mL | Beckman Coulter | 356011 | |
| Cytochalasin B from Drechslera dematioidea | Sigma-Aldrich (Merck) | C2743-200UL | |
| Dialyzed FBS | Gibco | 26400-036 100mL | |
| DMEM High Glucose (w/o L-Glutamine W/Sodium Pyruvate) | EuroClone | ECB7501L | |
| Dulbecco's Phosphate Buffered Saline - PBS (w/o Calcium w/o Magnesium) | EuroClone | ECB4004L | |
| Ethanol Absolute Anhydrous | Carlo Erba | 414601 | |
| FetalClone III (Bovine Serum Product) | Cytiva - HyClone Laboratories | SH30109.03 | |
| Glass pasteur pipettes | VWR | M4150NO250SP4 | |
| Inverted Research Microscope For Live Cell Microscopy | Nikon | ECLIPSE TE200 | |
| JA-14 Fixed-Angle Aluminum Rotor | Beckman Coulter | 339247 | |
| Laboratory autoclave Vapormatic 770 | Labotech | 29960014 | |
| L-Glutamine 200 mM (100x) | EuroClone | ECB 3000D | |
| Minimum Essential Medium MEM | Euroclone | ECB2071L | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| PEG (Polyethylene glicol solution) | Sigma-Aldrich (Merck) | P7181-5X5ML | |
| Penicillin-Streptomycin (solution 100x) | EuroClone | ECB3001D | |
| Primo TC Dishes 100 mm | EuroClone | ET2100 | |
| Primo TC Dishes 35 mm | EuroClone | ET2035 | |
| Sodium Pyruvate 100 mM | EuroClone | ECM0542D | |
| Stereomicroscope | Nikon | SMZ1000 | |
| Trypsin 2.5% in HBSS | EuroClone | ECB3051D | |
| Uridine | Sigma-Aldrich (Merck) | U3003-5G |
References
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews. Disease Primers. 2, (2016).
- DiMauro, S., Davidzon, G. Mitochondrial DNA and disease. Annals of Medicine. 37 (3), 222-232 (2005).
- El-Hattab, A. W., Craigen, W. J., Scaglia, F. Mitochondrial DNA maintenance defects. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1863 (6), 1539-1555 (2017).
- Stewart, J. B., Chinnery, P. F. The dynamics of mitochondrial DNA heteroplasmy: implications for human health and disease. Nature Reviews Genetics. 16 (9), 530-542 (2015).
- King, M. P., Attardi, G. Human cells lacking mtDNA: repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Trounce, I., Neill, S., Wallace, D. C. Cytoplasmic transfer of the mtDNA nt 8993 T-->G (ATP6) point mutation associated with Leigh syndrome into mtDNA-less cells demonstrates cosegregation with a decrease in state III respiration and ADP/O ratio. Proceedings of the National Academy of Sciences of the United States of America. 91 (18), 8334-8338 (1994).
- Jun, A. S., Trounce, I. A., Brown, M. D., Shoffner, J. M., Wallace, D. C. Use of transmitochondrial cybrids to assign a complex I defect to the mitochondrial DNA-encoded NADH dehydrogenase subunit 6 gene mutation at nucleotide pair 14459 that causes Leber hereditary optic neuropathy and dystonia. Molecular and Cellular Biology. 16 (3), 771-777 (1996).
- Dunbar, D. R., Moonie, P. A., Zeviani, M., Holt, I. J. Complex I deficiency is associated with 3243G:C mitochondrial DNA in osteosarcoma cell cybrids. Human Molecular Genetics. 5 (1), 123-129 (1996).
- Pye, D., et al. Production of transmitochondrial cybrids containing naturally occurring pathogenic mtDNA variants. Nucleic Acids Research. 34 (13), 95 (2006).
- Bacman, S. R., Nissanka, N., Moraes, C. T. Chapter 18 - Cybrid technology. Methods in Cell Biology. 155, 415-439 (2020).
- Rucheton, B., et al. Homoplasmic deleterious MT-ATP6/8 mutations in adult patients. Mitochondrion. 55, 64-77 (2020).
- Xu, M., et al. Identification of a novel variant in MT-CO3 causing MELAS. Frontiers in Genetics. 12, 638749 (2021).
- Habbane, M., et al. Human Mitochondrial DNA: Particularities and diseases. Biomedicines. 9 (10), 1364 (2021).
- Legati, A., et al. Current and new Next-Generation Sequencing approaches to study mitochondrial DNA. The Journal of Molecular Diagnostics. 23 (6), 732-741 (2021).
- Boerwinkle, E., Xiong, W. J., Fourest, E., Chan, L. Rapid typing of tandemly repeated hypervariable loci by the polymerase chain reaction: application to the apolipoprotein B 3' hypervariable region. Proceedings of the National Academy of Sciences of the United States of America. 86 (1), 212-216 (1989).
- Lawless, C., Greaves, L., Reeve, A. K., Turnbull, D. M., Vincent, A. E. The rise and rise of mitochondrial DNA mutations. Open Biology. 10 (5), 200061 (2020).
- Wallace, D. C., et al. Mitochondrial DNA mutation associated with Leber's hereditary optic neuropathy. Science. 242 (4884), 1427-1430 (1988).
- Holt, I. J., Harding, A. E., Morgan-Hughes, J. A. Deletions of muscle mitochondrial DNA in patients with mitochondrial myopathies. Nature. 331 (6158), 717-719 (1988).
- Chomyn, A. Platelet-mediated transformation of human mitochondrial DNA-less cells. Methods in Enzymology. 264, 334-339 (1996).
- Sazonova, M. A., et al. Cybrid models of pathological cell processes in different diseases. Oxidative Medicine and Cellular Longevity. 2018, 4647214 (2018).
- Tarrago-Litvak, L., et al. The inhibition of mitochondrial DNA polymerase gamma from animal cells by intercalating drugs. Nucleic Acids Research. 5 (6), 2197-2210 (1978).
- Swerdlow, R. H., et al. Mitochondria, cybrids, aging, and Alzheimer's disease. Progress in Molecular Biology and Translational Science. 146, 259-302 (2017).
- Ghosh, S. S., et al. Use of cytoplasmic hybrid cell lines for elucidating the role of mitochondrial dysfunction in Alzheimer's disease and Parkinson's disease. Annals of the New York Academy of Sciences. 893, 176-191 (1999).
- Buneeva, O., Fedchenko, V., Kopylov, A., Medvedev, A. Mitochondrial dysfunction in Parkinson's disease: focus on mitochondrial DNA. Biomedicines. 8 (12), 591 (2020).
- Weidling, I. W., et al. Mitochondrial DNA manipulations affect tau oligomerization. Journal of Alzheimer's disease: JAD. 77 (1), 149-163 (2020).
- Ferreira, I. L., et al. Bioenergetic dysfunction in Huntington's disease human cybrids. Experimental Neurology. 231 (1), 127-134 (2011).
- Cruz-Bermúdez, A., et al. Spotlight on the relevance of mtDNA in cancer. Clinical & Translational Oncology. 19 (4), 409-418 (2017).
- Patel, T. H., et al. European mtDNA variants are associated with differential responses to cisplatin, an anticancer drug: implications for drug resistance and side effects. Frontiers in Oncology. 9, 640 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved