Method Article
שיטה ניתנת להרחבה לחקר הישרדות עצבית בתרבית עצבית ראשונית עם רזולוציה של תא בודד ובזמן אמת
In This Article
Summary
כאן, אנו מציגים מתודולוגיה פשוטה, חזקה ורב-תכליתית לחקירת הישרדות עצבית על מתח ציטוטוקסי בתאי עצב ראשוניים בקליפת המוח עם רזולוציה תאית בזמן אמת או בחומר קבוע.
Abstract
אובדן עצבי הוא הליבה של נוירופתולוגיות רבות, כולל שבץ מוחי, מחלת אלצהיימר ומחלת פרקינסון. שיטות שונות פותחו לחקר תהליך ההישרדות העצבית על עקה ציטוטוקסית. רוב השיטות מבוססות על גישות ביוכימיות שאינן מאפשרות רזולוציה של תא בודד או כרוכות במתודולוגיות מורכבות ויקרות. מוצגת כאן פרדיגמה ניסויית רב-תכליתית, זולה ויעילה לחקר הישרדות עצבית. שיטה זו מנצלת תיוג פלואורסצנטי דליל של הנוירונים ואחריו הדמיה חיה וכימות אוטומטי. למטרה זו, הנוירונים עוברים אלקטרופוטציה כדי לבטא סמנים פלואורסצנטיים ועוברים תרבית משותפת עם נוירונים לא אלקטרופוטיים כדי לווסת בקלות את צפיפות התאים ולהגדיל את ההישרדות.
תיוג דליל על ידי אלקטרופורציה מאפשר כימות אוטומטי פשוט וחזק. בנוסף, ניתן לשלב תיוג פלואורסצנטי עם ביטוי משותף של גן מעניין לחקר מסלולים מולקולריים ספציפיים. כאן, אנו מציגים מודל של שבץ מוחי כמודל נוירוטוקס, כלומר, בדיקת חסך חמצן-גלוקוז (OGD), שבוצעה בתא היפוקסי ביתי זול וחזק. לבסוף, שתי זרימות עבודה שונות מתוארות באמצעות IN Cell Analyzer 2200 או הקוד הפתוח ImageJ לניתוח תמונות לעיבוד נתונים חצי אוטומטי. ניתן להתאים את זרימת העבודה הזו בקלות למודלים ניסיוניים שונים של רעילות ולהגדיל אותה להקרנה בתפוקה גבוהה. לסיכום, הפרוטוקול המתואר מספק מודל מבחנה נגיש, זול ויעיל של נוירוטוקסיות, שיכול להתאים לבדיקת התפקידים של גנים ומסלולים ספציפיים בהדמיה חיה ולבדיקת תרופות בתפוקה גבוהה.
Introduction
חקר הפרעות עצביות דורש מודלים ניסיוניים הניתנים לניתוחים גנטיים, מולקולריים ותאיים. נוירונים ראשוניים בקליפת המוח הם מודל חזק מאוד לחקר הישרדות ורעילות עצבית 1,2,3,4. בתנאים המתאימים, נוירונים ראשוניים יפתחו בהדרגה קשרים סינפטיים ויציגו סימני היכר של נוירונים בוגרים. לכן, מודל זה אמין יותר מקווי תאים אימורטליים במידול הפיזיולוגיה של הנוירונים ונוח יותר למניפולציות מאשר מודלים של בעלי חיים. עם זאת, בהשוואה לקווי תאים, נוירונים ראשוניים בקליפת המוח קשים להעברה ושבריריים יחסית. יתר על כן, המורפולוגיה המורכבת של נוירונים בקליפת המוח עלולה לסבך את ההדמיה והניתוח בתרביות בצפיפות גבוהה. לעומת זאת, תרביות עצביות ראשוניות בצפיפות נמוכה קלות יותר לניתוח אך נוטות להיות שבריריות יותר.
בהתחשב בכל זה, מאמר זה מציג זרימת עבודה במבחנה במחיר סביר, רב-תכליתי וניתן להרחבה כדי למדל ולחקור הישרדות עצבית (איור 1). נקודות המפתח של פרוטוקול זה הן א) השיטה של אלקטרופורציה במבחנה של הנוירונים עם סמן פלואורסצנטי כדי לאפשר תיוג והדמיה דלילים של תאים חיים; ii) הרבגוניות שלו במודלים שונים של ציטוטוקסיות; ו-3) הניתוח האוטומטי למחצה או האוטומטי.
מערכת האלקטרופורציה (ראה טבלת החומרים) מספקת הליך פתוח וזול שאינו כולל ערכות ופתרונות ספציפיים 4,5,6. יתר על כן, ניתן להתאים שיטה זו בקלות כדי להשיג יעילות טרנספורמציה וצפיפות אופטימלית של נוירונים שעברו טרנספטציה, תוך ערבוב אלקטרופוטרי עם תאים שאינם אלקטרופוטים. התרבות המשותפת עם נוירונים נאיביים (לא אלקטרופורטיביים) משפרת משמעותית את הכדאיות של התאים האלקטרופורטיים בהשוואה לתרביות בצפיפות נמוכה. יתר על כן, הוא מאפשר תיוג דליל עם צפיפות מתכווננת של הנוירונים האלקטרופוטיים, תוך שמירה על רמה עקבית של ביטוי גנים. חשוב לכוון ל-3-5% מהנוירונים החשמליים במבחני הישרדות.
תיוג דליל מקל למעשה על האוטומציה של ניתוח התמונה מכיוון שהתאים מופרדים היטב וניתנים להבחנה בקלות. יש לציין כי פרדיגמה ניסויית זו עשויה להיות מותאמת לבדיקת גנים מרובים מעניינים על ידי תרבית משותפת של נוירונים במקביל עם סמנים פלואורסצנטיים ציטוזוליים שונים (למשל, חלבון פלואורסצנטי ציאן, חלבון פלואורסצנטי אדום (RFP), חלבון פלואורסצנטי ירוק (GFP)) באותה באר. בדומה למבחני ציטוטוקסיות אחרים (למשל, פרופידיום יודיד או לקטט דהידרוגנאז), הבדיקה המתוארת כאן מבוססת על העובדה שמוות עצבי מלווה בקרע של קרום התא. זה מעורר שחרור של חלבונים ציטוזוליים על ידי דיפוזיה וכתוצאה מכך אובדן הקרינה של GFP.
מודל חוץ גופי של שבץ מוחי, כלומר מודל OGD, מוצג כדוגמה לנוירוטוקסיות 7,8,9. פרוטוקול זה כרוך בחשיפת הנוירונים הראשוניים למאגר מלח הדומה לנוזל מוחי מלאכותי אך נטול חמצן וגלוקוז. למרות שמודל זה הוצג כדוגמה למתח נוירוטוקס, ניתן לבדוק מצבים ציטוטוקסיים שונים באותו תהליך עבודה 8,9. לבסוף, תיוג דליל מאפשר בקלות פיתוח של ניתוח הדמיה אוטומטי. כאן, הוקם פרוטוקול המבוסס על אימונופלואורסצנציה סטנדרטית וניתוח ImageJ במערך קטן יותר. לאחר מכן, זרימת עבודה זו הותאמה והוגדלה באמצעות מערכת הדמיה תאית המאפשרת ניתוח אוטומטי בהדמיה חיה במצבי תפוקה בינונית וגבוהה. לסיכום, מאמר זה מציג מתודולוגיה גמישה, משתלמת וניתנת להרחבה לחקר הישרדות עצבית במודלים ניסיוניים שונים של רעילות באמצעות הדמיה חיה וכימות אוטומטי.
Protocol
כל ההליכים המשתמשים בבעלי חיים צריכים להיות מפוקחים על ידי הוועדה לבעלי חיים ביו-אתיים של המכון ולהתבצע בהתאם לתקנות המקומיות. הנהלים המוצגים כאן אושרו על ידי הרשות המואצלת ועומדים בתקנות בספרד ובאירופה.
1. תרבית עצבית ראשונית
הערה: כל השלבים מבוצעים בתוך מכסה המנוע, תוך שימוש בחומרים ופתרונות סטריליים לשמירה על תנאים סטריליים.
- ציפוי פולי-ליזין (PLL)
- שטפו את הכיסויים (CVs, 15 מ"מ) ב-70% אתנול למשך הלילה (o/n) בשייקר מסלולי.
הערה: המהירות של שייקר המסלול אמורה להספיק כדי להזיז את קורות החיים בעדינות אך לא מהר מדי כדי למנוע נזק או שריטות של קורות החיים. הסל"ד הספציפי ישתנה בהתאם לדגם השייקר. ניתן לאחסן קורות חיים באתנול לתקופות ארוכות (חודשים). - הסר את האתנול ושטוף פעמיים במים נטולי יונים למשך 10 דקות כל אחת.
- תן לקורות החיים להתייבש בטמפרטורת החדר (RT) בצלחת פטרי של 100 מ"מ (13 CVs / צלחת בערך). ודא שקורות החיים אינם נוגעים זה בזה או בקצוות הצלחת.
הערה: ניתן לאחסן קורות חיים יבשים ב-RT לתקופות ארוכות (חודשים). - הכן את תמיסת ציר ה-PLL של 5 מ"ג/מ"ל במים, הכין מכסות ואחסן אותם ב-20 מעלות צלזיוס. יש לדלל את תמיסת המלאי ב-1x PBS לריכוז עבודה של 0.1 מ"ג/מ"ל.
הערה: ניתן לבדוק ריכוזים גבוהים יותר של עד 1 מ"ג/מ"ל PLL. - הוסף את הנפח המינימלי של PLL כדי לכסות את פני השטח של קורות החיים (ראה נפחים אופטימליים של PLL בטבלה 1). הוסף את תמיסת ה-PLL טיפתית כדי להקל על היווצרות טיפה.
הערה: ציפוי נוירונים על קורות חיים נדרש לאימונופלואורסצנטיות. עבור הדמיית זמן-lapse (למשל, עבור תא IN), התאים מצופים ישירות מעל הבאר ללא קורות חיים מכיוון שקורות החיים עשויים לנוע במהלך חלוף הזמן. במקרה כזה, הוסף את הנפח המינימלי של PLL כדי לכסות את פני השטח של כל באר.
- שטפו את הכיסויים (CVs, 15 מ"מ) ב-70% אתנול למשך הלילה (o/n) בשייקר מסלולי.
| משטח | נפח PLL (מ"ל) |
| כיסויים 15 מ"מ | 0.2 |
| כיסויים 13 מ"מ | 0.18 |
| צלחת 96 באר | 0.07 |
| צלחת 24 באר | 0.3 |
| צלחת 6 באר | 2 |
| צלחת 60 מ"מ | 4.5 |
טבלה 1: נפחים אופטימליים של פולי-L-ליזין בהתאם לשטח הפנים.
- יש לדגור למשך שעה לפחות בטמפרטורה של 37 מעלות צלזיוס.
הערה: תקופת הדגירה יכולה להיות ארוכה עד o/n. - הסר את ה-PLL מה-CVs. שטוף את קורות החיים פעמיים במים נטולי יונים למשך 10 דקות כל אחד. תנו לקורות החיים להתייבש ב-RT.
הערה: ניתן לאחסן את תמיסת ה-PLL בטמפרטורה של 4 מעלות צלזיוס לשימוש חוזר (פי 3 מקסימום). - אחסן את קורות החיים המיובשים בתוך צלחת פטרי בטמפרטורה של 4 מעלות צלזיוס (עד 7-10 ימים) או הניח אותם בתוך הבארות עם מצע ציפוי (ראה הרכב בטבלה 2 ונפחי עבודה בטבלה 3). הוסף מדיום ציפוי ישירות לבארות של צלחות 12 בארות (טבלה 3).
הערה: נוירונים רגישים מאוד לאיכות נסיוב הבקר העוברי (FBS). יש לבדוק קבוצות שונות של FBS כדי לזהות את האצווה שבה התאים נראים בריאים יותר. לאחר זיהוי כמות גדולה של FBS, מומלץ להשיג כמות גדולה ולאחסן אותה בטמפרטורה של -80 מעלות צלזיוס. ניתן להתאים פרוטוקול זה לסוגים אחרים של קורות חיים ולוחיות (ראה נפחי העבודה השונים בטבלה 3).
| ציפוי בינוני | |||
| מם | 42.5 | מ"ל | |
| 10% סרום סוסים או FBS* | 5 | מ"ל | |
| 30% גלוקוז (0,6% ריכוז סופי) | 1 | מ"ל | |
| PS (פניצילין, 10,000 יח'/מ"ל; סטרפטומיצין, 10 מ"ג/מ"ל); | 0.5 | מ"ל | |
| מדיום אלקטרופורציה | |||
| אופטי-MEM | |||
| מדיום עצבי | |||
| מדיום נוירובזאלי | 48.5 | מ"ל | |
| ב-27 | 1 | מ"ל | |
| גלוטמקס 200 מ"מ | 0.125 | מ"ל | |
| PS (פניצילין, 10,000 יח'/מ"ל; סטרפטומיצין, 10 מ"ג/מ"ל); | 0.5 | מ"ל | |
| OGD בינוני (Tasca, et al. 2014) | |||
| CaCl2 | 1 | מ"מ | |
| KCl | 5 | מ"מ | |
| NaCl | 137 | מ"מ | |
| ק"ח2פ"ד4 | 0.4 | מ"מ | |
| עד2HPO4 | 0.3 | מ"מ | |
| MgCl2 | 0.5 | מ"מ | |
| מגסו4 | 0.4 | מ"מ | |
| הפס | 25 | מ"מ | |
| נהקו3 | 4 | מ"מ | |
טבלה 2: הרכב המדיה השונים בהם נעשה שימוש.
| שטח פנים של בארות וצלחות | נפח עבודה | |||
| צלחת 96 באר | 0.32 | ס"מ2 | 0.1 | מ"ל |
| צלחת 24 באר | 1.9 | ס"מ2 | 0.5 | מ"ל |
| צלחת 12 באר | 3.8 | ס"מ2 | 1 | מ"ל |
| צלחת 6 באר | 9.5 | ס"מ2 | 2.5 | מ"ל |
| צלחת 60 מ"מ | 21.5 | ס"מ2 | 6 | מ"ל |
טבלה 3: שטח הפנים של סוגי הלוחות השונים ונפחי העבודה.
- הכנת התרבית העצבית
- מחממים מראש (37 מעלות צלזיוס) ומאזנים (באטמוספירה של 5% CO2 ) את מדיום הציפוי, המדיום העצבי ומדיום האלקטרופורציה (ראה הרכב בטבלה 2) בבקבוק פתוח חלקית בתוך חממת התא למשך שעתיים לפחות. תנו לטריפסין להתחמם ב-RT. חממו מראש את תמיסת המלח המאוזנת של האנק (HBSS) ב-37 מעלות צלזיוס באמבט מים.
- הגדר מראש את פרמטרי האלקטרופורציה (טבלה 4).
| תנאי אלקטרופורציה: דופק נקבוביות | |||||
| אורך | V | מרווח זמן | N | ד. תעריף | קוטביות |
| 2 אלפיות השנייה | 175 | 50 | 2 | 10 | פלוס |
| תנאי אלקטרופורציה: דופק העברה | |||||
| אורך | V | מרווח זמן | N | ד. תעריף | קוטביות |
| 50 | 20 | 50 | 5 | 40 | פלוס/מינוס |
טבלה 4: הגדרות אלקטרופורציה עבור NEPA21.
- דיסקציה של המוח וקצירת עכבר CD-1 embryos ב-E15 לאחר קיום יחסי מין
- להקריב את הנקבה ההרה על ידי פריקת צוואר הרחם ללא טשטוש. לעקר את הבטן עם 70% אתנול; חותכים ופותחים את הבטן במספריים חדים.
- מחלצים את הרחם ומניחים אותו בצלחת פטרי עם HBSS קר 1x. השאירו אותו על קרח בתוך מכסה המנוע של תרבית התאים עם מלקחיים נפוצים.
- הוציאו עובר מהרחם בעזרת מלקחיים ומספריים וערפו את ראשו בחיתוך בודד בעזרת מספריים.
- החזק את הראש והכניס מלקחיים (למשל, מלקחיים עדינים של דומונט) למסלול העין.
- בעזרת המחט (מזרק מחט 30 גרם) כלהב, חותכים את הברגמה ופורצים את החלק האחורי של הראש.
- הכניסו מלקחיים חדים דרך החתך אנכית לתוך הברגמה, ושברו את שכבת העור הדקה של האזור הקדמי. משוך את המלקחיים כדי לעקוב אחר הסדק האורכי בין שתי ההמיספרות מבלי לפגוע בקליפת המוח.
- השתמש במלקחיים הקטנים בזווית של 45 מעלות, מהחלק הקדמי לחלק האחורי, כדי להסיר את המוח מהראש.
- העבירו את המוח לצלחת פטרי בגודל 3.5 ס"מ עם HBSS 1x קר כקרח תחת סטריאומיקרוסקופ.
- דיסקציה של קליפת המוח
הערה: הפרוטוקול לתרבית עצבית מותאם מההליך שתואר על ידי דוטי ובנקר10.- השתמשו במלקחיים של דומונט (11 ס"מ) כדי להחזיק את התלמוס ובמחט המוטה בזווית של 45 מעלות כדי להפריד את קליפת המוח של כל המיספרה מהמוח האמצעי. ודא שקליפת המוח אינה מראה עקבות של רקמות אחרות; השתמש במלקחיים חדים כדי להסיר את קרומי המוח.
הערה: קרומי המוח יוצרים קרום אלסטי דק העוטף את המוח וניתן לזהות אותם בקלות בגלל צבעם האדום. ביצוע תנועות רכות בזיגזג יעזור להסיר את קרומי המוח. ודא שכל קרומי המוח הוסרו מכיוון שהם רעילים לתרבות. - העבירו את קליפת המוח הנקייה לצלחת פטרי נקייה בגודל 3.5 ס"מ עם HBSS 1x קר כקרח והניחו אותה על קרח.
- השתמשו במלקחיים של דומונט (11 ס"מ) כדי להחזיק את התלמוס ובמחט המוטה בזווית של 45 מעלות כדי להפריד את קליפת המוח של כל המיספרה מהמוח האמצעי. ודא שקליפת המוח אינה מראה עקבות של רקמות אחרות; השתמש במלקחיים חדים כדי להסיר את קרומי המוח.
- פירוק
- קוצצים כל קליפת המוח לשני חצאים והשתמשו במלקחיים או במחט חדה (30 גרם) כדי להקל על השפעת הטריפסין בשלב הבא.
- העבירו את החלקים ל -7 מ"ל של מאגר טריפסין-EDTA בטמפרטורת החדר בצינור של 15 מ"ל באמצעות פיפטה P1000 (חתכו 3-4 מ"מ מהקצה). המתן עד שהם ישקעו לתחתית הקצה לפני שתשחרר אותם מקצה הפיפטה. מערבבים על ידי הטיה.
- יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך 12 דקות באמבט מים. מערבבים על ידי הטיה כל 4-5 דקות.
הערה: זמן הדגירה יכול לנוע בין 12 ל -15 דקות. - הניחו לרקמה לשקוע בכוח הכבידה והסירו בזהירות את הטריפסין. שטפו את הטישו פעמיים עם 8 מ"ל של 1x HBSS וערבבו בעדינות על ידי הטיה. הסר את ה-1x HBSS בזהירות באמצעות פיפטה P1000 אך באמצעות קצה פיפטה לא חתוך.
- שטפו את הטישו פעם אחת עם 5 מ"ל של מדיום ציפוי. להתסיס על ידי הטיה. הסר את אמצעי הציפוי בזהירות באמצעות פיפטה P1000.
- מוסיפים 1.5 מ"ל מדיום ציפוי. פרק את התערובת באופן מכני באמצעות פיפטה P1000 על ידי שאיבת המדיום מתחתית הצינור ושחרורו בעדינות על הקירות למשך 8-12 פעמים לכל היותר.
- מסננים דרך מסננת תאים סטרילית (70 מיקרומטר) המונחת על צינור של 50 מ"ל. הוסף 10 מ"ל או נפח רצוי אחר של מדיום ציפוי לצינור.
- הכניסו 5 מיקרוליטר של תרחיף התאים לתא ספירת התאים, הוסיפו 5 מיקרוליטר של טריפן כחול (0.4% w/v), וספרו את התאים.
- צלחת התאים (ראה סעיף 1.6) על ידי העברת נפח מספיק של תרחיף התא כדי לקבל את מספר התאים הרצוי לאלקטרופורציה (למשל, 106 תאים) בצינור צנטריפוגה של 15 מ"ל. צנטריפוגה את התאים בטמפרטורה של 250 × גרם למשך 5 דקות. המשך לסעיף 1.6.
- ציפוי תאים
- צלחת את הצפיפות הרצויה של מתלה התאים הלא צנטריפוגה משלב 1.5.7 בכל באר המכילה את מדיום הציפוי.
הערה: בפרוטוקול זה, 100,000 עד 200,000 תאים/באר נזרעו בצלחת של 12 בארות. כהפניה, צלח לפחות 3 קורות חיים לכל תנאי ניסוי כדי לקחת בחשבון את השונות הניסיונית. סביבת ניסוי טיפוסית עשויה לכלול הדמיה של 4-5 שדות לכל CV (למשל, באמצעות מטרה של פי 20, כל שדה צפוי להיות ברוחב ~1.3 מ"מ2 ). - הזז את הצלחת במכסה המנוע של תרבית התאים לכל הכיוונים הקרדינליים כדי להפיץ את התאים בצורה אחידה.
- צלחת את הצפיפות הרצויה של מתלה התאים הלא צנטריפוגה משלב 1.5.7 בכל באר המכילה את מדיום הציפוי.
- אלקטרופורציה
הערה: ניתן להשתמש במערכות טרנספקציה אחרות. למערכת NEPA21 המשמשת בפרוטוקול זה יש את היתרון של היותה "מערכת פתוחה". המשתמש יכול לשנות את הפרוטוקול, והוא אינו דורש ריאגנטים ספציפיים לטרנספקציה של קובטות מיוחדות המשמשות לאלקטרופורציה. פרוטוקול זה שונה מ-5.- המשך משלב 1.5.9. השעו מחדש את גלולת התא עם 5 מ"ל של מדיום אלקטרופורציה בצינור של 15 מ"ל. צנטריפוגה את הצינור בחום של 250 × גרם למשך 5 דקות.
- חזור על שלב 1.7.1. השעו מחדש עם מדיום אלקטרופורציה כדי לקבל ריכוז של 106 תאים/מ"ל בכל אחת מקובטות האלקטרופורציה. מערבבים את התאים עם כמות ה-DNA הרצויה בקובטה.
הערה: לביטוי GFP, נעשה שימוש ב-3 מיקרוגרם פלסמיד לכל מיליון תאים. בגלל השונות הגבוהה, מומלץ לבדוק את הריכוז האופטימלי עבור כל פלסמיד. בין 2 ל -24 מיקרוגרם של פלסמיד למיליון תאים נבדקו. ניתן לשלב פלסמידים מגוונים באותה קובטה כדי לבצע טרנספקציה כפולה. במקרה של טרנספקציה משותפת, יש להעביר את הגן המעניין בעודף בהשוואה ל-GFP (למשל, 3:1 הוא יחס אופטימלי שיש לבדוק) כדי להבטיח שרוב התאים המבטאים GFP מבטאים במשותף את הגן המעניין. - הנח את הקובט בתא הקובט (איור 2). לחץ על כפתור התחל כדי להפעיל את התוכנית המוגדרת מראש (ראה תנאי אלקטרופורציה בטבלה 4). רשמו את ערכי הזרמים והג'אול המוצגים במסגרת 'מדידות '.
הערה: המשתמש עשוי לשנות תנאים ספציפיים. לדוגמה, הפחתת המתח עשויה להפחית את יעילות הטרנספקציה אך להגביר את ההישרדות העצבית. - הוצא את הקובט מהחדר. הוסף 500 מיקרוליטר ממדיום הציפוי לקובטה מיד לאחר האלקטרופורציה והעביר את הדגימה מהקובטה לצינור צנטריפוגה של 1.5 מ"ל באמצעות פיפטה.
הערה: ככל שהוספת המדיום מהירה יותר, כך ההישרדות לאחר אלקטרופורציה טובה יותר מכיוון שהיא עוזרת למנוע נזק לתאים. - צלחת את המספר הרצוי של תאים אלקטרופוטיים בכל באר.
הערה: צלחת בין 20,000 ל -100,000 תאים בצלחת של 12 בארות. בהתאם לתנאים, רק 5-10% מהתאים האלקטרופוטיים עשויים לשרוד. המספר המדויק צריך להיבדק ולהתאים על ידי המשתמש. - דגירה למשך 2-4 שעות בתנאים סטנדרטיים (37 מעלות צלזיוס, 5% CO2, לחות רוויה).
הערה: לאחר תקופת הדגירה, התבונן בתאים תחת המיקרוסקופ. אם התרבית בריאה, רוב התאים היו נדבקים לפני השטח ומתחילים להנביט הרחבות נויריטים גלויות. - שנה את מדיום הציפוי למדיום עצבי (נפחים והרכב בטבלה 1 ובטבלה 2, בהתאמה).
- שמירה על תאים
- כדי לרענן את המדיום, הסר מחצית מהמדיום והוסף נפח שווה של מדיום טרי מאוזן מראש לאחר 7 ימי תרבות.
- ביום העשירי של התרבית, החלף מחצית מהנפח במדיום עצבי טרי ללא תוסף הגלוטמין (ראה טבלת החומרים). חזור על שלב זה כל יומיים לאחר היום העשירי.
הערה: לאחר 10 ימים של תרבית, התאים מייצרים גלוטמט בעצמם.
2. בניית החדר ההיפוקסי
- השתמש בכל מיכל הרמטי עם מכסה בורג או מערכת איטום מקבילה למטרה זו (איור 3A). קדחו שני חורים בדופן מיכל הפלסטיק והכניסו צינור פלסטיק בכל אחד מהם. אטמו אותם בסיליקון כך שהמיכל יהיה אטום הרמטית (איור 3).
הערה: כאן נעשה שימוש במיכל פלסטיק גלילי (גודל 1 ליטר) עם מכסה בורג לבניית החדר. ודא שהמכולה גדולה מספיק כדי להכיל את קורות החיים הנדרשים לניסוי. כדי לטפל ביותר קורות חיים באותו חלל, פלטפורמות פלסטיק יכולות להיות מוערמות זו על גבי זו (איור 3A). - כדי להכין את תא הבעבוע (ראה 3.2), קדחו חור במכסה של בקבוקון, בעזרת כל מקדחה מכנית סטנדרטית עם מקדחה מעט קטנה יותר מהצינור, והכניסו צינור פלסטיק דרך החור לתוך הבקבוק. אטמו את החור עם פרפילם כדי לשמור על האיטום ההרמטי (איור 3B).
- יש לעקר את המיכל ואת הבקבוק עם 70% אתנול ולהקרין באור אולטרה סגול למשך מחזור אחד לפני השימוש בהם.
3. מחסור בחמצן-גלוקוז (OGD)
הערה: הפרוטוקול עבור OGD מותאם מ-Tasca et al.7
- הכן את תמיסת ה-OGD עם תמיסת פוספט (טבלה 2) שנוספה בעבר באנטיביוטיקה.
הערה: עבור כל צלחת 35 מ"מ, השתמש ב-5 מ"ל; עבור צלחת 100 מ"מ, השתמש ב -10 מ"ל. - הוסף את תמיסת ה-OGD בתוך תא המבעבע (איור 3B) והנח אותה בתוך אמבט מים (כבר מחומם מראש ב-37 מעלות צלזיוס). חבר את הבקבוק למקור החנקן (N2, 100%).
הערה: שים לב שמכיוון שתמיסת OGD מכילה HEPES כמאגר, היא אינה דורשת CO2. אם תמיסת ה-OGD מבוססת על מערכת חציצה ביקרבונט, השתמש ב-5% CO2 ו-95% N2 כדי להרוות את התמיסה והתא ההיפוקסיים. - רווי את תמיסת ה-OGD בחנקן מבעבע בעדינות. השאירו את התמיסה במצב מבעבע קל למשך 20-30 דקות.
- העבירו מיד את הבקבוק למכסה המנוע של תרבית התאים והוסיפו 5 מ"ל מתמיסת OGD ללא חמצן בצלחות 35 מ"מ או 10 מ"ל בלוחות תרבית של 100 מ"מ.
- העבר את קורות החיים עם התאים המתורבתים לצלחות עם OGD. מבלי לכסות את הצלחות, העבירו אותם לתא ההיפוקסיה וסגרו אותם בחוזקה אך בזהירות.
הערה: יש להשלים את שלבים 3.4 ו-3.5 במהירות האפשרית. שמור על קורות החיים הבקרה (מדיום עצבי בנורמוקסיה) בצלחות הבאר בתוך החממה. לחלופין, לחשוף את נוירוני הבקרה למדיום הנורמוקסי OGD בתוספת גלוקוז (10 מ"מ) כדי לבחון את ההשפעות של היפוקסיה ומחסור בגלוקוז באופן סלקטיבי יותר. - חבר את מערכת החנקן לתא ההיפוקסיה ובדוק שהצינורות פתוחים. רווי את החדר ב-N2 למשך מספר דקות בלחץ של 2-3 בר (למשל, 2-3 דקות; 1 בר = 750 מ"מ כספית) (איור 3C).
הערה: אל תשכח לבעבע שוב את תמיסת ה-OGD למשך 15 דקות בין מספר נקודות זמן. - הפחיתו את לחץ החנקן ל-1.3-1.5 בר וסגרו את שני הצינורות של תא ההיפוקסיה (איור 3C). השאירו את החדר בחממה למשך הזמן הנדרש (למשל, 60 דקות) בטמפרטורה של 37 מעלות צלזיוס, 5% CO2.
הערה: משך ה-OGD עשוי לדרוש התאמה בהתאם למצב הניסוי ומטרות המחקר. זמן דגירה קצר (למשל, 30 דקות) ידמה היפוקסיה קלה. שעתיים של OGD בדרך כלל קשות מאוד כלפי הנוירונים. מומלץ לבדוק משך OGD של 45 עד 90 דקות לפני תחילת המחקר. כמובן שמשך ה-OGD ישפיע על ההישרדות הכוללת ועל ההתחלה היחסית של מוות עצבי לאחר ההחלמה מ-OGD. אם המטרה היא לנתח מוות עצבי בזמן אמת, שאפו להשיג תנאי OGD שיעוררו מוות של תאים מספר שעות לאחר ההתאוששות מ-OGD לניתוח יעיל יותר. - פתח את החדר והעבר את קורות החיים לצלחת הרב-באר המקורית שלהם לצורך התאוששות. לאחר שלב זה, שקול שתי חלופות: 1) לניסויים בקנה מידה קטן, המשך לסעיף 4 לאימונופלואורסצנציה וניתוח תמונה; 2) לסינון תוכן גבוה, המשך לסעיף 5 לניתוח במנתח התאים (או בפלטפורמה מקבילה).
הערה: הדמיה חיה מספקת גישה גמישה יותר מכיוון שהיא מאפשרת ניטור בזמן אמת של נקודות הניסוי השונות.
4. אנליזה על ידי אימונופלואורסצנציה סטנדרטית ו-ImageJ
הערה: זמן ההחלמה עשוי להשתנות בין שעה ל-24 שעות בהתאם לתנאים.
- שטפו את הנוירונים עם 1x PBS למשך 10 דקות.
הערה: שלב זה הוא אופציונלי מכיוון שישנן מספר דרכים להמשיך ולנתח את התמונות. - תקן את הנוירונים עם 4% פרפורמלדהיד למשך 10 דקות ב-RT. שטוף אותם שלוש פעמים עם 1x PBS למשך 10 דקות בכל שטיפה.
הערה: מכיוון שפרפורמלדהיד רעיל, יש לעבוד מתחת למכסה מנוע כימי. - לחדור את הנוירונים על ידי הוספת 1x PBS המכיל 0.1% טריטון X-100 למשך 10 דקות. שוטפים את התאים במהירות עם 1x PBS. חזור על שלב הכביסה פעמיים למשך 10 דקות בכל כביסה.
- הוסף 350 מיקרוליטר של תמיסת חסימה (1x PBS המכיל 2% אלבומין בסרום בקר) לקורות החיים והשאיר אותם למשך 30 דקות לפחות. סובב את מלאי הנוגדנים העיקרי (AB) (5 × גרם למשך 30 שניות) וערבב אותו עם תמיסת החסימה בדילול הנדרש, למשל, אנטי-GFP ב-1:600.
- העבירו את הכיסויים לפרפילם בתא לח (קופסה עם רקמה ספוגה במים לשמירה על לחות ומניעת אידוי). בהתאם לגודל ה-CVs, הוסף בזהירות 60 או 80 מיקרוליטר של דילול הנוגדנים העיקרי לכל CV, וודא שהתאים נמצאים במגע עם הנוגדן. דגרו את קורות החיים o/n ב-4 מעלות צלזיוס.
הערה: יש ליצור טיפה על משטח ה-CV כדי לכסות את כל משטח ה-CV. הימנע מהפרעה לתאים בזמן פיפטינג של תמיסת הנוגדנים על קורות החיים. ניתן לקצר את זמן הדגירה לשעתיים ב-RT.
- העבירו את הכיסויים לפרפילם בתא לח (קופסה עם רקמה ספוגה במים לשמירה על לחות ומניעת אידוי). בהתאם לגודל ה-CVs, הוסף בזהירות 60 או 80 מיקרוליטר של דילול הנוגדנים העיקרי לכל CV, וודא שהתאים נמצאים במגע עם הנוגדן. דגרו את קורות החיים o/n ב-4 מעלות צלזיוס.
- שטפו את קורות החיים עם 1x PBS למשך 10 דקות מעל הפרפילם. חזור על שלב הכביסה פעמיים.
- לדלל את ה-AB המשני, למשל, Alexa 488 (1:500), ו-4′,6-diamidino-2-phenylindole (DAPI, 1:2,000) בתמיסת חסימה. בהתאם לגודל קורות החיים, הוסף טיפה של 60-80 מיקרוליטר של תמיסת ה-AB המשנית על התאים. דגרו את קורות החיים למשך שעה אחת בחושך ב-RT. שטפו את ה-AB וה-DAPI המשניים מהנוירונים עם PBS 1x למשך 10 דקות וחזרו על שלב זה פעמיים.
- התקן את קורות החיים במדיום הרכבה (ראה טבלת החומרים) לניתוח אימונופלואורסצנטי ואחסן אותם בחושך בטמפרטורה של 4 מעלות צלזיוס לאחר הייבוש.
- לכידת תמונות וניתוחן.
הערה: נעשה שימוש במיקרוסקופ הפוך כדי לצלם את התמונות ב-20x (איור 4A, ראה טבלת החומרים).- השתמש בתוכנת הקוד הפתוח ImageJ כדי לנתח את התמונות ולהשיג את המסיכה עבור ערוץ GFP (איור 4C).
הערה: ישנן מספר דרכים להדמיה וניתוח של הנוירונים, בהתאם לזמינות הציוד ולפורמט הניסוי. זרימת העבודה הבאה ניתנת כדוגמה בסיסית שבה המטרה היא לזהות את הסומה של נוירונים בודדים המבטאים GFP הקיימים בתמונה. הערכים הספציפיים המוצגים כאן, כגון ערך הסף וגודל החלקיקים, צריכים להיבדק על ידי המשתמש על סמך תנאי הניסוי הספציפיים שלו. בנוסף, ניתן להוסיף מסננים ושלבי עיבוד שונים. לדוגמה, מסנני ImageJ Subtract Background ו-Despeckle עוזרים לעתים קרובות בניקוי התמונה בתחילת העיבוד. אופטימיזציה של זרימת העבודה לתנאי ניסוי ספציפיים דורשת ניסיון קודם בניתוח תמונות וידע במושגים בסיסיים של ניתוח תמונה כמותית. מכיוון שמדריך מעמיק על ניתוח תמונות הוא מחוץ לתחום הפרוטוקול הנוכחי, אנו ממליצים על המשאבים הבאים: מדריך למשתמש של ImageJ, https://imagej.nih.gov/ij/docs/guide/; לדוגמאות והדרכות, https://imagej.nih.gov/ij/docs/examples/index.htm; חבילת MBF ImageJ, https://imagej.net/mbf/index.htm. - לסגמנטציה, בחר את פילוח עוצמה עם הפרמטרים הדרושים כדי לבודד את הסומה, שהוא האזור הבהיר ביותר של הנוירונים.: תפריט | תמונה | התאם | סף | הגדר סף מינימלי (למשל, 100) | לחץ על החל.
- חזור על הסף מ- 4.8.2. לכל התמונות כדי לראות את המסכה (כלומר, התמונה המקוטעת) עבור הסומה של תאי העצב (איור 4E).
- כדי לקבל את מספר התאים ששרדו בכל תמונה ולייצא את התוצאות לגיליון אלקטרוני לביצוע חישובים, בחר תפריט | ניתוח | נתח חלקיקים והזן את ערכי הפרמטרים הדרושים (למשל, גודל: 50 אינסוף פיקסלים; מעגליות: 0.5-1.00). קחו בחשבון שב- t = 0 שעות, מספר התאים שנספרו הוא המספר הכולל של התאים שזוהו, וחשב את אחוז התאים ששרדו בנקודות הזמן השונות.
הערה: סף גודל נמוך יותר שימושי לסינון עצמים קטנים יותר מהסומה (למשל, 60-80 מיקרומטר2). - השתמש בפונקציית הקלט מאקרו של ImageJ כדי להפוך את הניתוח לאוטומטי ולחזור עליו: תפריט | תוספים | פקודות מאקרו | שיא | לחץ על צור כדי ליצור את המאקרו.
- השתמש בתוכנת הקוד הפתוח ImageJ כדי לנתח את התמונות ולהשיג את המסיכה עבור ערוץ GFP (איור 4C).
5. ניתוח בזמן אמת עם IN Cell Analyzer 2200
- הכנס את צלחת 12 הבארות למנתח התאים, חבר את מערכת CO2 והגדר את הטמפרטורה על 37 מעלות צלזיוס.
הערה: ניתן להגדיל שלב זה בקלות בפלטפורמה זו, ולבצע ניסוי דומה בתאי עצב המצופים בצלחת של 96 בארות. - בחר את המטרה פי 20, בחר באופן אקראי 5 שדות לבאר (מכסה 2.33% מהבאר בדוגמה זו), ומקד אותם באופן אוטומטי עבור כל ערוץ פלואורסצנטי (פלואורסצאין איזותיוציאנט [FITC] במקרה זה). בחר את פרמטרי הרכישה (30 דקות זמן-lapse למשך 16 שעות). לחץ על התחל והמתן.
הערה: מספר שדות ההדמיה חייב להיקבע על ידי החוקר וצריך להיות מספיק כדי להסביר את השונות בתוך באר אחת. - השתמש ב- IN Cell Developertoolbox v1.9 כדי להגדיר את זרימת העבודה המתאימה לניתוח.
- לנתח את תמונות הנוירונים (ערוץ FITC) כדי ליצור מסכה לסומה של הנוירונים (איור 4).
הערה: המטרה היא לזהות את הסומה של נוירונים בודדים הקיימים בתמונה. ניתוח זה עוקב אחר שלבים המקבילים לאלה המתוארים בסעיף 4 עבור ImageJ. עיין בסעיף 4 לקבלת זרימת העבודה ושיקולים כלליים. סף העוצמה נקבע לבחירת הסומה, שהוא האזור הבהיר ביותר של הנוירונים.- לפילוח, בחר את פילוח העוצמה עם הפרמטרים הדרושים (במקרה זה, סף מינימלי של 20005.40).
- לעיבוד שלאחר העיבוד, בחרו באפשרות 'מסננת ', תוך שמירה על יעדים עם שטח גדול מערך שנקבע מראש (כאן, 189 פיקסלים (~80 מיקרומטר2)).
- בחר את הפרמטר Sum כדי לספור ולסכם את כל הנוירונים שזוהו במסכה (נוירונים ששרדו) עבור כל שדה ועבור כל השדות של באר בכל נקודת זמן של מהלך הזמן.
- ייצא את התוצאות לגיליון אלקטרוני. ב- t = 0 שעות, קח בחשבון שמספר התאים שנספרו הוא סך התאים שזוהו, וחשב את אחוז התאים ששרדו בנקודות הזמן השונות. חשב את הזמן שבו 50% מהתאים מתים כדי להקל על ההשוואה בין התנאים.
הערה: על המשתמש להתאים את הפרמטרים לשלבי הפילוח והעיבוד שלאחר העיבוד עבור תעלות פלורסנט שונות בהתאם למבנים שיש לזהות.
תוצאות
פרוטוקול זה נועד לבסס מודל מבחנה של שבץ מוחי. חשוב להשיג צפיפות עצבית נאותה, שתאפשר זיהוי של נוירונים אלקטרופוטיים בודדים כדי לנתח אותם בנפרד. גם שלב התרבות העצבית לאחר הציפוי הוא מכריע. התבגרות הנוירונים בתרבית היא פרוגרסיבית. התלות בגורמי גדילה, צמיחת נויריטים, קישוריות ופעילות אלקטרופיזיולוגית תשתנה מאוד בהתאם לשלב. בתנאים ספציפיים אלה ב-4-6 ימים במבחנה, למרות שהנויריטים מורחבים היטב, הנוירונים עדיין מאוד לא בשלים, תלויים מאוד בגורמי גדילה, ובעלי פעילות אלקטרופיזיולוגית נמוכה יחסית. בשלב זה, OGD עשוי לדמות תנאים קרובים יותר להתפתחות עוברית. ניתן להבחין בקוצים דנדריטיים ובאשכולות סינפטיים ברורים בימים 8-10 במבחנה11. ביום ה-14 במבחנה בתנאי ניסוי אלה, נוירונים בקליפת המוח בוגרים והגיעו למורכבות מלאה של קישוריות ופעילות אלקטרופיזיולוגית3. כאן, אתגרנו את תאי העצב בקליפת המוח עם OGD ביום ה-14 כדי לדמות את התנאים של מוח בוגר.
לאחר 60 דקות של OGD, הנוירונים הודגרו ב-IN Cell Analyzer 2200. נוירוני בקרה צולמו במקביל ולא הראו סימני מצוקה. בקבוצת הביקורת, הסומה והנויריטים של תאי עצב שמבטאים GFP נראים בנקודות זמן מאוחרות יותר (איור 5A). תאי עצב שנתונים ל-OGD מתחילים להראות סימנים של ניוון נויריט בנקודות זמן מוקדמות, ואחריהם אובדן הקרינה בסומה עקב קרע של קרום הפלזמה ודיפוזיה של GFP מחוץ לתאי העצב (איור 5A). בגלל עוצמת האות הגבוהה יותר, המורפולוגיה העגולה והתווית הדלילה, זרימת העבודה האנליטית הפשוטה שתוכננה עבור מחקר זה מאפשרת ניתוח חזק ומהיר של הישרדות עצבית (איור 5B). התוצאות מראות את יכולת השחזור הגבוהה בין השדות באותו CV או באר ובין קורות החיים של אותו מצב (איור 5B, טבלה משלימה S1 וטבלה משלימה S2).
לשם השוואה, איור 5C מציג כימות ידני של הנוירונים השורדים בתת-קבוצה של אותן תמונות המאמתות את הניתוח האוטומטי (איור 5B,C; הנתונים הגולמיים זמינים לפי בקשה). לפיכך, הליך זה הוא מודל אמין של שבץ מוחי במבחנה, המדמה את המוות התאי העומד בבסיס אירועים איסכמיים. יתר על כן, מודל זה פותח מספר רב של אפשרויות, שכן ניתן לבדוק תרופות או ביטוי יתר של חלבונים מסוימים (טרנספקציה משותפת בשיטת האלקטרופורציה) כדי לחקור את התגובה להיפוקסיה או לגורמים רעילים אחרים. יחד, הפרוטוקול המתואר מוצע להקמת מודל הולם לביצוע סינון בקנה מידה בינוני.

איור 1: מתאר סכמטי של פרדיגמת הניסוי. הסכימה מסכמת את השלבים העיקריים של פרדיגמה ניסויית זו. ראשית, הקמת התרבות העצבית הראשונית עם שלב האלקטרופורציה. לאחר מכן, נוירונים בוגרים נתונים ל-OGD כדי לשחזר שבץ מוחי במבחנה. לבסוף, לניתוח התמונה, מוצעות שתי אפשרויות שונות: בקנה מידה קטן, גישה חצי אוטומטית עם ImageJ בדגימות מוכתמות חיסוניות; לסינון תוכן גבוה, ניתוח אוטומטי באמצעות IN Cell Analyzer 2200. קיצורים: OGD = מחסור בחמצן-גלוקוז; RT = טמפרטורת החדר; קורות חיים = תלושי כיסוי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מערכת האלקטרופורציה. (A) המכשיר המשמש עבור אלקטרופורציה עם NEPA21. (B) הגדלה של המכשיר שבו מוכנסות הקובטות לאלקטרופורציה. (C) הקובטה המשמשת לאלקטרופורציה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: התא ההיפוקסי המותאם אישית. (A) החלקים השונים של התא ההיפוקסי. כאמור, הוא נוצר על ידי מיכל הרמטי בו ניתן להכניס פלטפורמות לטיפול בדגימות שונות. (B) תא הבעבוע ובקבוק תרבית תאים שבו תמיסת ה-OGD רוויה בחנקן. (C) סכימה זו מראה את שטף הגז להרוות את התא ב-N2 כדי להגיע למחסור בחמצן. קיצור: OGD = מחסור בחמצן-גלוקוז. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
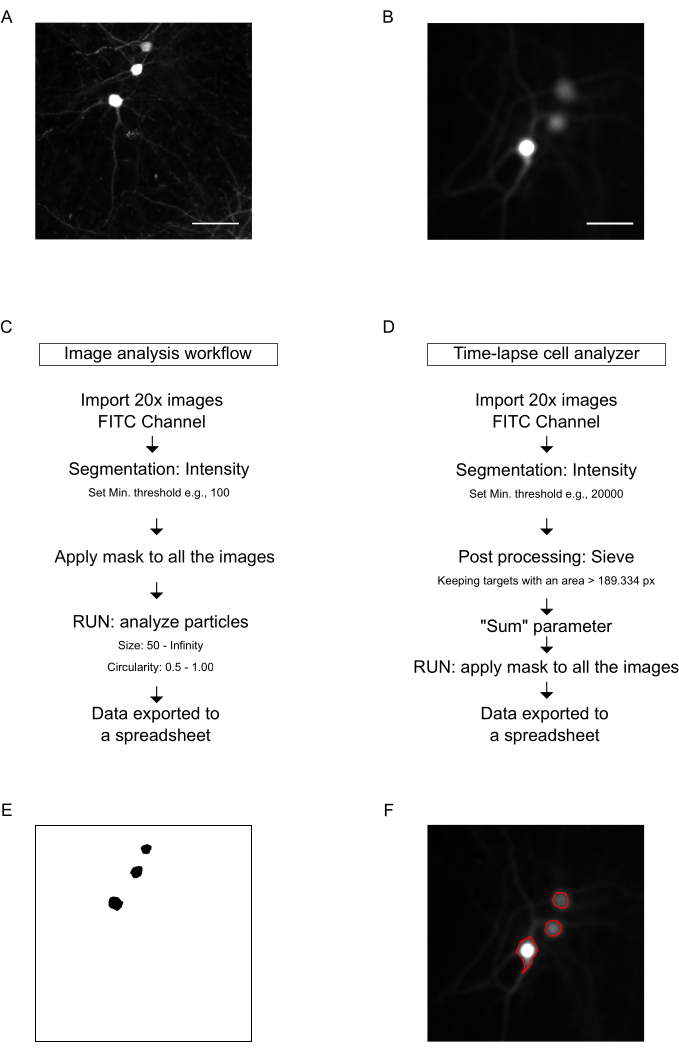
איור 4: תמונות השוואתיות וזרימת העבודה של הניתוח. תמונות מייצגות שהתקבלו ב-20x עם (A) מיקרוסקופ הפוך ו-(B) מנתח תאים. (C) זרימת עבודה שנוצרה ליצירת מסכה וניתוח התמונות המתקבלות במיקרוסקופ באמצעות תוכנת ImageJ. (ד) זרימת עבודה שנוצרה כדי ליצור מסכה ולנתח את התמונות שהתקבלו עם מנתח התאים באמצעות ארגז הכלים המשויך למפתחים v1.9. (E) תמונה מייצגת של המסיכה שנוצרה באמצעות ImageJ. (F) תמונה מייצגת של המסכה שנוצרה עם ארגז הכלים למפתחים v1.9. פסי קנה מידה = 50 מיקרומטר. קיצורים: FITC = פלואורסצאין איזותיוציאנט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
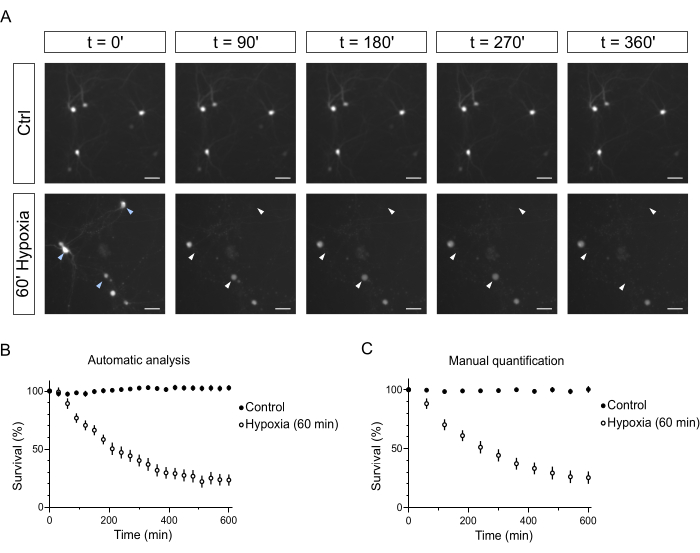
איור 5: קינטיקה של מוות תאי עצב לאחר היפוקסיה. (A) תמונות מייצגות של תאי עצב המבטאים GFP בתנאי ביקורת או נתונים להיפוקסיה במשך 60 דקות ומצולמות בנקודות זמן שונות (עד 360 דקות (')). התמונות צולמו עם IN Cell Analyzer 2200 במצב זמן-lapse (כל 30 דקות). ראשי חץ לבנים מצביעים על נוירונים שחיים בתחילת מהלך הזמן ומתים בגלל העלבון ההיפוקסי במהלך הזמן-lapse. (B) אחוז תאי עצב חיים בכל נקודת זמן של מהלך הזמן עבור תאי ביקורת ועבור תאי עצב שנתונים להיפוקסיה. נתונים אלה חושבו באופן אוטומטי לאחר הגדרת זרימת העבודה של הניתוח בתוכנת IN Cell Developer Toolbox v1.9. (C) אחוז תאי עצב חיים בכל נקודת זמן במהלך הזמן עבור תאי ביקורת ותאי עצב שנתונים להיפוקסיה. נתונים אלה חושבו ידנית לאחר הגדרת זרימת העבודה של הניתוח בתוכנת ImageJ. פסי קנה מידה = 50 מיקרומטר. קיצורים: Ctrl = בקרה; GFP = חלבון פלואורסצנטי ירוק. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה משלימה S1: נתונים גולמיים ומעובדים שהתקבלו לאחר הגדרת פרמטרי הניתוח בתוכנת IN Cell Developer Toolbox v1.9. הדגשה אדומה מצביעה על כך שיותר מ-50% מהנוירונים בשדה המנותח מתים. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S2: נתונים גולמיים ומעובדים שהתקבלו לאחר הגדרת זרימת העבודה של הניתוח בתוכנת ImageJ. הדגשה אדומה מצביעה על כך שיותר מ-50% מהנוירונים בשדה המנותח מתים. אנא לחץ כאן להורדת טבלה זו.
Discussion
פרוטוקול זה מראה דרך יעילה למידול שבץ מוחי במבחנה. כדי להשיג מטרה זו, הצענו תיוג דליל של נוירונים בקליפת המוח באמצעות מערכת האלקטרופורציה NEPA215. מדובר במערכת פתוחה המאפשרת התאמה אישית של הפרוטוקול בעלות תפעולית מינימלית בהשוואה למערכות אחרות המשתמשות בערכות או במכשירים ספציפיים. תרבית מעורבת של נוירונים נאיביים ואלקטרופוטיים מאפשרת יותר גמישות וחוסן בהשוואה לתרבית עצבית בצפיפות נמוכה. זה מאפשר לחקור את ההשפעה של גנים, מבנים וחלבונים שונים וניתן להרחבה בקלות. לדוגמה, השתמשנו בגישה דומה כדי לקבוע את תפקידו של Nrg1, גורם נוירוטרופי המתבטא על ידי נוירונים בקליפת המוח, באיתות תוך-תאי בשבץ4. יתר על כן, ניתן לערבב את התאים החשמליים בצפיפויות שונות עם תאים שאינם אלקטרופוטים כדי לקבל מספרים דלילים ומתכווננים של תאים פלואורסצנטיים בהתאם למטרת המחקר.
לדוגמא, מומלץ להשתמש בריכוז נמוך יותר לניתוח מורפולוגיה תאית. לפיכך, ניתן לראות כל נוירון מבודד, במיוחד בשלבים המאוחרים שבהם הנויריטים מורחבים במידה ניכרת. ככלל אצבע, שאפו שיהיו מספיק נוירונים פלואורסצנטיים לכימות עקבי בכל תחום הדמיה נתון (למשל, ממוצע n > 10) אך לא יותר מדי כדי שעדיין ניתן יהיה להבחין בין תאים בודדים (למשל, ממוצע n < 50). צפויה שונות מסוימת במספר הנוירונים הפלואורסצנטיים בכל שדה בהתחשב בהתפלגות הסטוכסטית של התאים הדלים בבאר. למרות שהמתודולוגיה המוצעת כאן חזקה על פני צפיפויות תאים שונות, צפיפות תאים מוגזמת היא בעייתית יותר מכיוון שהיא אינה מאפשרת למשתמש להבחין בין תאים שונים בתמונה. בעוד שמערכת האלקטרופורציה NEPA21 היא פלטפורמה גמישה וחסכונית12,13, ניתן להשתמש גם במערכות אלקטרופורציה אחרות, כגון Amaxa Nucleofector או מערכת העברת ניאון.
מאמר זה מתאר את שיטת OGD כמודל ציטוטוקסי, מודל מבחנה מבוסס של שבץמוחי 4,7. OGD הוא אחד מכמה מודלים של רעילות עצבית זמינים, והוא מאתגר את הנוירונים במבחנה עם פגיעות מרובות: היעדר גלוקוז וחמצן ומחסור בגורמי גדילה, ויטמינים, נוגדי חמצון, הורמונים ורכיבים חשובים אחרים הנמצאים בדרך כלל במדיום התרבות העצבית ובתוסף (NB27). כאן, נוירונים נאיביים שימשו כבקרות בריאות להערכת התגובה העצבית ללחץ ציטוטוקסי, כפי שתואר קודם לכן4.
בקרה זו תבטיח שהכדאיות של התרבית הראשונית תהיה אופטימלית ושתהליך ההדמיה אינו מזיק לנוירונים במקרה של מיקרוסקופיה בזמן-lapse. בנוסף, כדי להעריך באופן סלקטיבי את התגובה למחסור בגלוקוז וחמצן, ניתן לטפל בנוירוני הבקרה במדיום נורמוקסי OGD בתוספת גלוקוז7. יש לשקול בזהירות את בחירת הפקדים המתאימים ביותר בהתאם למטרות הספציפיות של הניסוי. מתואר גם בפירוט כיצד לבנות תאים היפוקסיים מותאמים אישית וזולים.
ניתן להשתמש בשיטות אחרות למודל שבץ מוחי במבחנה או מצבים נוירוטוקסיים אחרים. לדוגמה, מעכבים של שרשרת הובלת האלקטרונים (רוטנון, אנטימיצין ונתרן אזיד) או אגוניסטים של קולטני גלוטמט (N-methyl-D-aspartate) היו בשימוש נרחב8. לבסוף, מאמר זה מתאר את זרימת העבודה של הדמיה וניתוח כדוגמה מייצגת. זרימת העבודה האופטימלית עשויה להשתנות מאוד בהתאם לתנאי הניסוי וההדמיה. חוקרים יכולים להתאים ולייעל את הפרוטוקול הבסיסי הזה בהתאם לדרישות הספציפיות של הניסויים שלהם.
תיוג והדמיה דלילים של הנוירונים מפשטים מאוד את הניתוח שניתן לייעל ולהפוך בקלות לאוטומטי בפלטפורמות שונות. זה מאפשר להגדיר את הפרוטוקול בקנה מידה קטן לניתוח תמונה ולהתאים בקלות את התנאים הללו להקרנה בתפוקה גבוהה עם IN Cell או פלטפורמות דומות לבדיקת תרופות. למערכת IN Cell יתרונות רבים ומשמעותיים על פני מיקרוסקופיה קונבנציונלית לניתוח תמונה. זה מאפשר למשתמש להתאים אישית את ההגדרות, לבצע מדידות חוזרות ונשנות של אותו אזור עניין ולנתח את כל התמונות באופן חצי אוטומטי, מה שמקל על עיבוד הנתונים. מערכות הדמיה חיה אחרות, כפי שהוצג לאחרונה14, עשויות גם הן להיות מותאמות לזרימת עבודה זו. יש לציין כי GFP עשוי להיות מועבר במשותף עם סמנים ספציפיים כדי לדמיין מבנים תאיים, כגון מיטוכונדריה או סמנים סינפטיים, לניתוח מעודן יותר.
להדמיה חיה ולניתוחים בזמן אמת יש שני יתרונות עיקריים: ראשית, הם אינם דורשים שימוש בנוגדנים או ריאגנטים יקרים אחרים; שנית, הם מספקים מידע זמני על מוות תאי המאפשר השוואה מדויקת יותר בין תנאי ניסוי שונים. לדוגמה, גן ספציפי מעניין עשוי להיות משולב עם סמן ציטוזולי פלואורסצנטי אחר (למשל, RFP) ותרבית משותפת עם נוירוני בקרה פנימיים המבטאים GFP. לסיכום, פרוטוקול זה מציע דרך יעילה לשחזר את המודל הזה במבחנה של רעילות עצבית בהתחשב בפשטותו, הרבגוניות והמדרגיות שלו. הוא מתאים במיוחד לבדיקת התפקידים של גנים ומסלולים ספציפיים בהדמיה חיה ולבדיקת תרופות בתפוקה גבוהה.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
אנו רוצים להודות לקרלוס דוטי על שיתוף המומחיות שלו בתרבית עצבית. אנו מודים גם לאליסיה מרטינז-רומרו ממתקן הליבה של Cytomics של המרכז לחקר פרינסיפה פליפה (CIPF), הנתמך על ידי מימון FEDERER האירופי. הפרויקט נתמך על ידי משרד הכלכלה והתחרותיות הספרדי עבור ריאגנטים, חומרים SAF2017 ומשכורות של YDC ו-PF. PF נתמך גם על ידי המענק RyC-2014-16410. CGN ו-PF נתמכים על ידי Conselleria de Sanitat של Generalitat Valenciana, כמו גם AGM (ACIF/2019/015). אנחלה רודריגז פרייטו נתמכת על ידי משרד המדע, החדשנות והאוניברסיטאות הספרדי, עם המענק PRE2018-083562.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm petri dishes | FISHER SCIENTIFIC, S.L. | 1130-9283 | |
| 3.5 cm petri dishes | Sterilin | ||
| 75 cm2 flask | Corning | 430641U | |
| B-27 | Life Technologies | 17504-044 | |
| Cell culture plates | Corning incorporation Costar® | 3513 | |
| Cell incubator | Thermo Electron Corporation | Model 371 | |
| Cell strainer 70 µm | Falcon | 352350 | |
| Cold lights | Schott | 223488 | KL 1500 LCD |
| Coverslips (15 mm) | Marienfeld | 111530 | |
| CU500 Cuvette Chamber | Nepa Gene | ||
| CU600 Cuvette Stand Holder | Nepa Gene | ||
| DAPI | Sigma-Aldrich Quimica, S. L. | D9542-10MG | 1:2000 |
| DMSO | Panreac | A3672 | |
| Dumont Fine Forceps | FST | 11254-20 | |
| Dumont Fine Forceps | FST | 11252-00 | |
| EC-002S NEPA Electroporation Cuvettes, 2mm gap | Nepa Gene | ||
| Filter strainer | Falcon | 352350 | |
| Fine Scissors-Sharp-Blunt | FST | 14028-10 | |
| Fine Scissors-ToughCut r | FST | 14058-09 | |
| GFP chicken IgY | Aves Labs | GFP-1010 | 1:600 |
| Glucose | Sigma | 68769-100ml | |
| GlutaMAX-I Supplement 200 mM 100 mL | Fisher Scientific | 35050-061 | |
| HBSS | Thermofisher | 14175-095 | https://www.thermofisher.com/es/es/home/technical-resources/media-formulation.156.html |
| Hepes 1 M | ThermoFisher | 15630-080 | |
| Horse Serum | Invitrogen | 26050088 | |
| MEM | Thermofisher | 11095080 | https://www.thermofisher.com/order/catalog/product/11095080#/11095080 |
| Microscope slide (polilysine) | VWR | 631-0107 | Dimension: 25 x 75 x 1 mm |
| Mowiol 4-88 | Sigma-Aldrich Quimica, S. L. | 81381-250G | |
| Needles yellow, 30 gauge | BD Microlance™ 3 | 304000 | |
| NEPA21 electroporator | Nepa Gene | ||
| Neubauer chamber | Blau Brand | 717805 | |
| Neurobasal Medium | ThermoFisher | 21103-49 | |
| Opti-MEM | Invitrogen | 31985-062 | |
| Parafilm | Cole-Parmer | PM996 | |
| Paraformaldehyde (PFA), 95% | Sigma-Aldrich Quimica, S. L. | 158127-500G | Use solution: 4% |
| PEI | Polysciences | 23966-1 | |
| Plasmid for GFP | pCMV-GFP-ires-Cre, described in Fazzari et al., Nature, 2010 | ||
| Poly-L-Lysine | SIGMA | P2636 | |
| PS ( Penicillin, Streptomycin) | ThermoFisher | 15140122 | |
| Serrate forceps | FST | 11152-10 | |
| Stereomicroscope | WORLD PRECISION INSTRUMENTS | ||
| Syringes | BD Plastipak 1ml | 303176 | |
| Triton X-100 | Sigma-Aldrich Quimica, S. L. | MDL number: MFCD00128254 | Non-ionic |
| Trypsin-EDTA | ThermoFisher | 25300054 | |
| Tubes 15 mL | Fisher | 05-539-4 | |
| Tubes 50 mL | VWR | 21008-242 | |
| Tupperware | - | - | Hermetic tupperware with screw lid. SP Berner - Taper 1 L Redondo con Rosca. Any equivalent hermetic Tupperware may be purchased in any supermarket. |
| Water bath | SHELDON LABORATORY MODEL 1224 | 1641951 |
References
- Salazar, I. L., Mele, M., Caldeira, M., Costa, R. O., Correia, B., Frisari, S., Duarte, C. B. Preparation of primary cultures of embryonic rat hippocampal and cerebrocortical neurons. Bio-protocol. 7 (18), 2551(2017).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Fazzari, P., et al. Cell autonomous regulation of hippocampal circuitry via Aph1b-γ-secretase/neuregulin 1 signalling. eLife. 3, 02196(2014).
- Navarro-González, C., Huerga-Gómez, A., Fazzari, P. Nrg1 intracellular signaling is neuroprotective upon stroke. Oxidative Medicine and Cellular Longevity. 2019, 3930186(2019).
- NEPA21 transfection of cell suspensions using cuvettes. NEPAGENE Co. Ldt. , Available from: http://2017.igem.org/wiki/images/3/3a/T--TECHNION-ISRAEL--Electroporation-NEPA2_for_HPC-7.pdf (2017).
- Larson, M. A., Gibson, K. A., Vivian, J. L. In vivo validation of CRISPR reagents in preimplantation mouse embryos. Methods in Molecular Biology. 2066, 47-57 (2020).
- Tasca, C. I., Dal-Cim, T., Cimarosti, H. In vitro oxygen-glucose deprivation to study ischemic cell death. Methods in Molecular Biology. 1254, 197-210 (2015).
- Holloway, P. M., Gavins, F. N. E. Modeling ischemic stroke in vitro: the status quo and future perspectives. Physiology and Behavior. 47 (2), 561-569 (2016).
- Sommer, C. J. Ischemic stroke: experimental models and reality. Acta Neuropathologica. 133 (2), 245-261 (2017).
- Dotti, C. G., Banker, G. A. Experimentally induced alteration in the polarity of developing neurons. Nature. 330 (6145), 254-256 (1987).
- Fazzari, P., et al. Control of cortical GABA circuitry development by Nrg1 and ErbB4 signalling. Nature. 464 (7293), 1376-1380 (2010).
- Sadiq, A. A., et al. An overview: Investigation of electroporation and sonoporation techniques. 2015 2nd International Conference on Biomedical Engineering. , 1-6 (2015).
- Shi, J., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), 3044(2018).
- Fazzari, P., Mortimer, N., Yabut, O., Vogt, D., Pla, R. Cortical distribution of GABAergic interneurons is determined by migration time and brain size. Development. 147 (14), 185033(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.
