Method Article
פיברובלסט נגזר רקמת חיבור מהונדסת אנושית עבור יישומי הקרנה
In This Article
Summary
מוצג כאן פרוטוקול ליצירת רקמות חיבור מהונדסות לתרבות מקבילה של 48 רקמות בלוח רב-בארות עם מוטות כפולים, המתאימים למחקרים מכאניסטיים, מידול מחלות ויישומי סינון. הפרוטוקול תואם פיברובלסטים מאיברים ומינים שונים ומודגם כאן עם פיברובלסטים לב ראשוניים אנושיים.
Abstract
פיברובלסטים הם תאים דינמיים מאוד פנוטיפיים, אשר במהירות transdifferentiate לתוך myofibroblasts בתגובה גירויים ביוכימיים וביומכניים. ההבנה הנוכחית של תהליכים פיברוטיים, כולל פיברוזיס לב, נותרה גרועה, מה שמעכב את התפתחותם של טיפולים אנטי-פיברוטיים חדשים. מערכות מודל אנושיות ניתנות לשליטה ואמינות חיוניות להבנה טובה יותר של פתולוגיה פיברוזיס. זהו פרוטוקול רב-רב-ממד ליצירת רקמות חיבור מהונדסות (ECT) בלוח יציקה של 48 בארות כדי להקל על מחקרים על פיברובלסטים ועל הפתופיזיולוגיה של רקמה פיברוטית בסביבה תלת-ממדית (תלת-ממדית). ECT נוצרים סביב הקטבים עם נוקשות טונה, המאפשר מחקרים תחת עומס ביומכני מוגדר. תחת תנאי הטעינה המוגדרים, ניתן ללמוד התאמות פנוטיפיות הנשלטות על ידי אינטראקציות מטריצת תאים. בדיקה מקבילה אפשרית בפורמט 48-well עם הזדמנות לניתוח מסלול זמן של פרמטרים מרובים, כגון דחיסת רקמות והתכווצות נגד העומס. מפרמטרים אלה, תכונות ביומכניות כגון נוקשות רקמות וגמישות ניתן ללמוד.
Introduction
מכשול מרכזי בחקר מחלות פיברוטיות הוא היעדר מודלים ייצוגיים של רקמת תלת-ממד אנושית המספקים תובנה על התנהגותם של פיברובלסטים ונגזרותיהם הפתולוגיות. כדי לחקור תהליכים פיברוטיים, מערכות תרבות 2D סטנדרטיות הן תת-אופטימליות מאז פיברובלסטים מבודדים transdifferentiate במהירות לתוך אקטין שריר חלק α (SMA) - ביטוי myofibroblasts כאשר מתורבת על מצעים 2D שאינם תואמים1,2,3. לכן, פיברובלסטים בתרבות הדו-ממדית הסטנדרטית אינם משקפים פנוטיפ רגיל של רקמות "בריאות"3,4,5,6. תרבויות על מצעים גמישים הוצגו כדי לדמות סביבות רקמות לא סיביות (10 kPa) ופיברוטיות (35 kPa)7, אך אלה חסרות את הממד השלישי, וזה חשוב מאוד ביחס לפתופיזיולוגיה. הנדסת רקמות מספקת את ההזדמנות להתגבר על מגבלה זו על ידי מתן אפשרות לתרבות פיברובלסט בהקשר של מטריצה חוץ-תאית מוגדרת וניסוי טונה (ECM), למשל, על ידי שינויים בתאיות, הרכב ECM וריכוז ECM, שכולם יכולים לקבוע את הביומכניקה של הרקמה.
דגמי תלת-ממד שונים נוצרו באמצעות פיברובלסטים. דיסקים ומיקרוספרות צפים היו בין הראשונים והוכיחו כי קולגן שופץ ונדחס באופן תלוי זמן. פיברובלסטים מפעילים כוחות אחיזה על סיבי קולגן, תהליך אשר ניתן להקל על ידי תוספת של סוכנים פרו-פיברוטיים כגון שינוי גורם גדילה-בטא 1 (TGF-β1)8,9,10,11,12,13,14,15,16. עם זאת, תרבויות צפות בחופשיות אינן מאפשרות טעינה חיצונית מבוקרת, ולכן מהוות דגמים מתכווצים או דוחסים ללא הרף. רקמות מהונדסות דמויות גיליון פתחו את האפשרות לחקור רגולציה הומאוסטטית של תכונות ביומכניות של רקמות, כלומר באמצעות בדיקות זנים חד, דו-מיניות, רב-זמניות או מחזוריות17,18,19,20. מודלים אלה שימשו, למשל, כדי להדגים את ההשפעה של מספר התא על נוקשות הרקמה, אשר נמצאה בקורלציה חיובית עם שלמות cytoskeleton ו צמצום ציטוסקילטון18,19. עם זאת, חשוב לציין כי המרות כוח למתח מסובכות על ידי עיוות רקמות לא אחיד סביב נקודות מהדק של מתמרים כוח ונקודות עיגון. מגבלה אינהרנטית זו יכולה לעקוף על ידי עצם כלב או רקמות בצורת טבעת, המציעות אכיפת רקמות מסוימת בנקודות עיגון21,22,23. ניתן להכין רקמות בצורת טבעת על ידי הפצת הידרוג'ל קולגן לתא לתבניות בצורת טבעת. כמו הידרוג'ל קומפקטי, רקמה נוצרת סביב המוט הפנימי הבלתי ניתן לריסון של התבנית, אשר מציע עמידות עבור התכווצות רקמות נוספת24,25,26,27. לאחר דחיסה ראשונית ובדרך כלל מקסימלית, רקמות עשויות להיות מועברות גם למרווחים מתכווננים כדי לרסן עוד יותר את ה- ECT המעגלי באורך רקמות מוגדר3,24,25,26,27,28,29,30. תכונות ביופיסיות ניתן להעריך התקנים סטנדרטיים אופקי או אנכי מתח מתח עם תאי עומס מתאימים תחת זן חד כיווני או דינמי3. מכיוון שלרקמות מבנה מעגלי אחיד ברובו וניתן להחזיק אותן על סורגים/ווים (נקודות עיגון ו/או מתמרי כוח), אם כי אלה עשויים עדיין לתחום אזורי דחיסה סביב מוטות הטעינה, פורמט זה מאפשר וריאציית מאמץ אחידה יותר בהשוואה להדק3. יתר על כן, רקמות מעוגנות מעוררות צורת תא דו קוטבי, ותאים מסתגלים לכוחות הרקמה על ידי התארכות לאורך קווי כוח המקדמים אחיזה אניזוטרופית31,32,33,34,35,36. יש לנו בעבר מיושם ECT בצורת טבעת מן חולדה ופיברובלסטים לב אנושיים (CF) סביב מוט נוקשה אחד בניסויים פונקציונליים מתח-זן וביצע רווח ואובדן של מחקרי פונקציה באמצעות פיברובלסטים transduced ויראלי24,25,26 ולימודים פרמקולוגיים37. יתר על כן, אנו יכולים לזהות הבדלי מין בפיברוזיס בתיווך CF במודל ECT27.
הפרוטוקול הבא ליצירת ECT אנושי, המודגם עם CF אנושי ראשוני המתקבל כ- CF cryopreserved מספקים מסחריים (ראה טבלה של חומרים), משלב את היתרונות של רקמות בצורת טבעת עם דרך קלה ומהירה לייצר רקמות מקרוסקופיות עבור פלטפורמה של 48 באר המיועדת לבדיקות מקבילות בעלות תוכן גבוה.
חשוב לציין, מודל ECT אינו מוגבל לסוג פיברובלסט מסוים, עם השימוש המתועד בחקירה של פיברובלסטים אחרים, למשל, פיברובלסטים בעור38,39. יתר על כן, פיברובלסטים מהביופסיות של המטופל פועלים באותה מידה, ובחירת הפיברובלסטים תלויה בסופו של דבר בשאלה המדעית שיש לטפל בה.
הפלטפורמה המשמשת לדור של ECT המתואר בפרוטוקול זה היא לוח תרבית תא/רקמה 48-well זמין מסחרית (איור 1A). השיטות להכנה, culturing, וניטור היווצרות ECT ותפקוד תחת גיאומטריה מוגדרת ועומס מכני בעזרת צלחת 48-well מתוארים. ECT שנוצר מוחזקים על ידי מוטות גמישים משולבים ואת העומס המכני ניתן לכוונן על פי המטרה הסופית באמצעות מוטות עם קשיות שונה (ערך חוף 36-89), המשפיעים על נוקשות הכיפוף שלהם. פולנים עם חוף ערך של 46 מומלצים. הפרוטוקול, בנוסף, תואם עובש עגול מותאם אישית שתואר בעבר, שבו ECT מוחזק סביב מוט נוקשה אחד37. הממדים של עובש זה ניתנים באיור 1B.
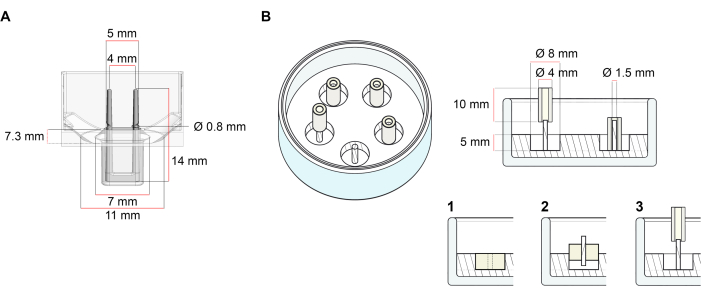
איור 1: ייצוג סכמטי של תבניות יציקה. (א) שרטוט טכני ומידות של תבנית יציקה עם שני קטבים גמישים. התבנית כוללת היקף פנימי המופרד על ידי קיר קצר המכיל מוטות תמך כפולים בגוף הראשי של התבנית. לקטבים הגמישים יש מרחק אופקי חופשי זה לזה והם מחוברים בבסיס. התבנית מאפשרת נפח יציקה של 180 μL. הבאר של כל עובש מאפשרת קיבולת נפח של לפחות 600 μL של מדיה תרבותית. קומפוזיציות חומר שונות ניתן להשתמש כדי לייצר קטבים עם נוקשות ספציפית (למשל, TM5MED-TM9MED). (ב) שרטוט טכני ומידות של תבנית בצורת טבעת עם מוט נוקשה יחיד. זוהי תבנית חלופית עם גיאומטריה ברורה וסביבה מכנית, אשר ניתן להשתמש עם פרוטוקול יציקת ECT37. שיטת הרכבת העובש בצורת טבעת הותאמה מתבניות גדולות יותר שפורסמו28,41. בקצרה, השיטה כוללת (1) חותם פוליטרפלואורואתילן (PTFE) דפוס מרווחים (קוטר 8 מ"מ) בפולידימתילסילוקסן (PDMS, סיליקון) שפכו לתוך כלים זכוכית (קוטר 60 מ"מ), ו (2) תיקון מחזיק מוט PDMS (קוטר 1.5 מ"מ) קונצנטרי בתוך החלל החלול שנוצר, אשר משמש (3) להחזיק מוט נשלף (צינור סיליקון קוטר 4 מ"מ). תוצאת החלל החלולה מאפשרת 180 μL של נפח הליהוק. כל צלחת זכוכית יכולה להכיל תבניות מוטבעות מרובות (מוצגות בצורה מופת עם 5 תבניות) ויש לה את היכולת של עד 5 מ"ל של מדיום תרבות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
כל הצעדים חייבים להתבצע בברדסים בטיחות ביולוגית Class II המותקנים במעבדות תחת רמת בלימה 1. בהתאם לתקנות המקומיות וסוג המניפולציות שיש לבצע, כגון העברת גנים בתיווך ויראלי, יש להגדיל את רמת הבלימה לרמת הבטיחות הביולוגית 2 או 3. כל התרבויות נשמרות ב 37 °C (5 °F) באינקובטור תרבית התא עם אווירה לחה של 5 % CO2 באוויר. שים לב כי אמצעי האחסון (שלבים 1 ו- 2) מסופקים עבור בקבוקון תרבית תאים T75. התאם את הכרכים לתבניות תרבות שונות בהתאם להמלצות הרגילות של תרבית התאים.
1. הפשרה וקדם ציפוי פיברובלסט לב ראשוני (CF) לתרבות חד שכבתית (5-12 ימים)
הערה: כחלופה, ניתן להשתמש בתאי HFF-1 בהתאם לפרוטוקול תת-תרבית הסטנדרטי כפי שהומלץ על-ידי הספק.
- הכן את מדיום הצמיחה פיברובלסט (FGM) על פי הוראות היצרן. לחלופין, להוסיף אנטיביוטיקה כגון 100 פניצילין U /mL ו 100 מ"ג / מ"ל סטרפטומיצין. אפשר ערבוב מלא של כל הרכיבים לפני השימוש. יש לאחסן ב-4 °C (70°F) עד 14 ימים.
- חם FGM עד 20-25 °C (70 °F).
- להפשיר את CF cryopreserved (באופן אידיאלי המכיל 1 x 106 כדי 2 x 106 / mL תאים לכל cryovial) באמבט מים ב 37 °C (כ 2 דקות, עד רק כמות קטנה של קרח נשאר במוסך.
- באמצעות פיפטה סרולוגית 2 מ"ל, להעביר את השעיית התא dropwise לתוך צינור צנטריפוגה סטרילי מתאים המכיל 10 מ"ל של FGM. לאחזור תאים אופטימלי, יש לשטוף את הקריוביאל ב-1 מ"ל של FGM ולהעביר אותו לצינור הצנטריפוגה. כמו התאים רגישים מאוד בשלב זה, resuspend באמצעות pipette סרולוגי עם קצה משעמם כדי למזער את נזקי התא על ידי מתח גזירה.
הערה: אם אמצעי ההקפאה מכיל אחוז גבוה של DMSO, ודא שלאחר חידוש התא ב- FGM, תוכן DMSO קטן מ- 1 %. לחלופין, צנטריפוגה התאים resuspended ב 300 x g במשך 5 דקות ב 20-25 °C (70 °F) עבור חילופי בינוני. לאחר מכן, שאפו את supernatant בזהירות, לסובב את הצינור כדי לנטרל את התאים גלולה, ו resuspened אותם בנפח הרצוי של FGM עבור זריעה. - זרע 0.5 x 106 תאים ב 12 מ"ל של FGM לתוך בקבוקון תרבית תא T75. אם נעשה שימוש בכלי מעבדה אחרים, התאם את מספר התא כדי לשמור על צפיפות זריעה של 6.7 x 103/cm2.
- החלף FGM כל יומיים במשך 5 ימים או עד התאים להגיע 80% השפעה.
הערה: תפוקת התא לאחר ההתרחבות תלויה בעיקר בגודל התא ובקצב ההתפשטות, אשר עשוי להיות שונה בין תורמי תאים. בדרך כלל, הליך תרבות סטנדרטי זה מאפשר אחזור של 4 x 106 עד 5 x 106 CF מבקבוק תרבית תא T75 לאחר 5 ימים של תרבות.
2. פיזור אנזימטי של CF אנושי (10-20 דקות)
הערה: שלב זה נועד ליצור השעיה של תא יחיד של CF אנושי עבור תאים מונו-שכבתיים תת פולחניים והן הכנת ECT. פרוטוקול זה עבר אופטימיזציה לתרבויות מונו-שכבתיות אנושיות ב- CF בקטעים 3-4. עבור סטנדרטיזציה אופטימלית, תת פולחן CF ב monolayer מומלץ, לפחות פעם אחת לפני הכנת ECT. פרוטוקול זה חייב להיות ממוטב עבור פיברובלסטים שמקורם בתורמים וספקים שונים. פרוטוקולי ניתוק חלופיים עשויים לכלול החלפת ריאגנטים מבוססי דיסוציאציה מבוססי סרין פרוטאז עם, למשל, אלה המכילים אנזימים פרוטאוליטיים וקולנוליטיים.
- FGM חם, PBS (Ca2+/Mg2+-חינם), וריאגנט ניתוק תאים ל 20-25 °C (20 °F).
- שאפו את המדיום מהתאים בתרבית.
- לשטוף תאים עם 6 מ"ל של PBS ולשאב.
- הוסף 6 מ"ל של ריאגנט דיסוציאציה התא לתאים ודגור במשך 3 דקות ב 20-25 °C (70 °F) עד התאים מתחילים ניתוק ניכר.
הערה: בהתאם למקור CF, פעולה זו עשויה להימשך מספר דקות. לחלופין, אם התאים אינם מתנתקים בטמפרטורת החדר, דגירה בטמפרטורה של 37 מעלות צלזיוס כדי לשפר את פעילות האנזימים. כדי להבטיח כדאיות אופטימלית לתאים, נטר את ניתוק התאים מתחת למיקרוסקופ. - נטרל פעילות אנזימטית על-ידי הוספת 6-12 מ"ל של FGM לתאים שהושמטו בריאגנט ניתוק התא. צנרת בעדינות למעלה ולמטה 4-8 פעמים באמצעות פיפטה סרולוגית 10 מ"ל כדי להבטיח השעיה תא יחיד ולהעביר תאים לתוך צינור איסוף 50 מ"ל טרי. אמת את התשואה בעזרת מיקרוסקופ והמוצ'ימומטר או מונה תאים אוטומטי בהתאם להוראות היצרן.
- צנטריפוגה השעיית התא ב 300 x g במשך 5 דקות ב 20-25 °C (5 °F).
הערה: על מנת להגיע לתשואה של תאים מספיקים ליצירת הכמות הרצויה של ECT, תאים יכולים להיות בתרבית משנה בדילול של עד 1:6 להתרחבות נוספת. תן לתאים לגדול עד 80 % השפעה הוא הגיע (כ 5-6 ימים), עם שינוי בינוני כל יומיים. לאחר מכן חזור על הפיזור אנזימטי והמשיך בשלב 2.7. כדי להמשיך בהכנת ECT. - שאפו את הסופר-טבעי והעבירו את הצינור כדי להעיף את הכדור. resuspend התאים ב FGM ב 20-25 °C כדי לקבל השעיית תא של ≥ 15 x 106/mL (כ 40 % יותר תאים מהנדרש עבור שלב 3.3.). זה מסביר את אובדן התא עקב מאמץ בשלב הבא.
- מסננים את השעיית התא באמצעות מסננת תאי רשת 40 מיקרומטר.
זהירות: agglomerates התא מזיקים להיווצרות האופטימלית של ECT. בעת שימוש בפיזור אנזימטי של פרוטוקול CF אנושי ליציקה ישירה של ECT, מאמץ השעיית התא מבטיח היעדר גושי תאים מרכזיים המפריעים להיווצרות רקמות הומוגניות. הטרוגניות יסכנו ניתוחי מתח אמינים. - ספירה חוזרת של מספר תא ולהעריך את הכדאיות של התא כדי להבטיח מספר תא אמין בהשעיה עם יכולת ≥80% להמשיך בהכנת ECT.
- השתמש במונה תאים אוטומטי כדי להעריך את מספר התא ואת הכדאיות על-ידי אי-הכללה של זרם חשמלי.
- לחלופין, השתמש בכחול טריפן (מסרטן, קטגוריית סיכון 2 - לנקוט באמצעי זהירות) בדיקת אי הכללת צבע, בעזרת מיקרוסקופ והמוציטומטר לזיהוי והספירה הישירה של קרום התא החי (קרום התא שלם שאינו כולל את הצבע) ומת (קרום התא הפגוע המאפשר קשירת הצבע לחלבונים תאיים).
- שמור את צינור האיסוף עם השעיית תא ב 20-25 °C (70 °F) ולהמשיך מיד עם שלב 3.
3. הכנת ECT (1 שעות)
הערה: סקירה סכמטית של יצירת ECT מתוארת באיור 2.

איור 2: סקירה סכמטית של דור ECT. פיברובלסטים מורחבים בתרבות הדו-כיוונית לפני השימוש בדור ה-ECT. לאחר 5-10 ימים, תאים מפוזרים אנזימטית והשעיית תאים מתיישבת מחדש בתערובת חוצצת המכילה קולגן בקר מסוג 1. תערובת ההידרוג'ל קולגן התאי מוכנסת לבארות בודדות בצלחת של 48 בארות לתרבות רקמות מהונדסות בתלת-ממד, שתוכננה כתבניות יציקה עם שני קטבים גמישים כדי לאפשר השעיית ECT באורך ובעומס מוגדרים. ECT מתורבתים בדרך כלל במשך 1 עד 20 יום לפני המדידות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הכן פתרון מלאי DMEM 10x על ידי המסת אבקת DMEM ב- ddH2O (134 מ"ג /מ"ל עבור ניסוח שצוין בטבלת החומרים) תחת סיבוב קבוע ב 37 °C (1 שעה. לחטא על ידי סינון. המניה יציבה עד 14 ימים ב 4 °C (5 °F) או -20 °C (50 °F) עד 12 חודשים.
- הכן טרי 2x DMEM על ידי דילול תמיסת מלאי DMEM 10x ועל ידי הוספת 20 % (v/v) FCS ב- ddH2O סטרילי. באופן אופציונלי, השתמש באנטיביוטיקה כגון פניצילין 200 U /mL ו 200 מ"ג / מ"ל סטרפטומיצין. עיין בטבלה 1 לקבלת נפחי צנרת. המניה יציבה עד 14 ימים בשעה 4 °C (50 °F).
הערה: בצע את שלבים 3.1. ו-3.2. לפני תחילת פיזור אנזימטי של תאים (שלב 2.) להכנת ECT.
| מגיב | ריכוז סופי | עוצמת קול (מ"ל) |
| 10× DMEM | n/a | 2 |
| FCS | 20 % (v/v) | 2 |
| פניצילין | 200 U/ML | 0.2 |
| סטרפטומיצין | 200 מ"ג/מ"ל | 0.2 |
| ddH2O | n/a | 5.6 |
| סך | n/a | 10 |
טבלה 1: קומפוזיציה של DMEM 2x.
אזהרה: כל הרכיבים לתערובת הידרוג'ל קולגן התא וצינורות צנטריפוגות חייבים להישמר על קרח לפני השימוש. זה יעזור למנוע הרכבה עצמית קולגן להתרחש לפני הפצת תערובת הידרוג'ל קולגן התא לאורך תבניות הליהוק.
- בהתבסס על טבלה 2, התאם את ההשעיה של התא לצפיפות של 8.88 x 106 תאים/מ"ל על-ידי הוספת FGM ב- 20-25 °C (20°F) להשעיית התא החל מהשלב 2.10. לאחר מכן, להזיז את צינור האיסוף עם השעיית תא לקרח.
- כדי להכין את תערובת הידרוג'ל ECT, מראש לצנן צינור צנטריפוגה 50 מ"ל על קרח ולהוסיף לו את הרכיבים השונים המפורטים בטבלה 2 בסדר הבא, הימנעות היווצרות בועת אוויר.
הערה: המספר המרבי של ECT שיש להכין תלוי במספר התא הכולל שנקבע בשלב 2.9. יש להשתמש ב-0.3 מ"ג קולגן לכל ECT, המתקבל מתמיסת מלאי המכילה 6-7 מ"ג/מ"ל. הריכוז של תמיסת מלאי הקולגן קובע את הנפח הדרוש כדי לקבל תוכן קולגן ECT אופטימלי. יש להתאים את הנפחים של רכיבי הידרוג'ל ECT האחרים בהתאם. ראה טבלה 2 לנפחים מותאמים לפי תמיסת מלאי קולגן של 6.49 מ"ג/מ"ל. אמצעי האחסון המתוארים בטבלה 2 משמשים בפרוטוקול זה כקו מנחה למופת.- Pipette חומצה מסיס קולגן סוג 1 הידרוג'ל באמצעות פיפטה סרולוגית עם קצה משעמם רחב.
- התאם את תכולת המלח של תמיסה קולגן על ידי הוספת DMEM 2x תוך ערבוב בעדינות על ידי מערבולת הצינור.
- לנטרל את ה- pH על ידי הוספת 0.2 M NaOH תוך ערבוב עדין על ידי מערבולת הצינור. מחוון אדום פנול יהפוך מצהוב לאדום.
הערה: יש לצית את נפח NaOH עבור כל אצוות קולגן בודדת לנטרול ה- pH האופטימלי. נטרול תלוי בגורמים כגון סוג חיץ והכנה, כמו גם ריכוז קולגן מוחלט, וזה משפיע על הרכבה מטריצת קולגן ואת הכדאיות התא23,40. לאחר התוכן היוני גדל על ידי תוספת של DMEM ואת ה- pH מנוטרל, ההרכבה העצמית של קולגן עוקבת ואין לשבש. לכן, לבצע את הדברים הבאים במהירות וללא הפסקות. - הוסף את השעיית התא (משלב 3.3) טיפה חכם תוך ערבוב בעדינות על ידי מערבולת הצינור.
| מספר ECT: | 1 | 6 | 24 | 48 | |
| כולל 10% עודף | |||||
| רכיבי הידרוג'ל קולגן תאי: | (μL) | (μL) | (μL) | (μL) | |
| מלאי קולגן (6.49 מ"ג/מ"ל) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0.2 מ' נאו | 3.1 | 20.5 | 81.8 | 163.7 | |
| תערובת תאים ב- FGM (8.88×106 תאים/מ"ל) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| סה"כ נפח (μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| זהו שולחן למופת כדי להכין נפח יציקה של 180 μL לכל ECT, המכיל סך של 750,000 תאים ו 0.3 מ"ג של קולגן לכל ECT. | |||||
טבלה 2: הכנת הידרוג'ל ECT (כולל 10% עודף חשבונאות עבור שגיאות pipetting).
- מערבבים את כל המתלים על ידי צנרת בעדינות למעלה ולמטה רק פעם אחת, באמצעות פיפטה סרולוגית עם קצה משעמם רחב כדי למנוע היווצרות בועה ולמזער את מתח הגיזה. ודא תערובת מלאה על ידי מערבולת בעדינות את הצינור 10 פעמים ולשמור על צינור צנטריפוגה 50 מ"ל המכיל תערובת הידרוג'ל ECT על קרח לאורך כל תהליך הליהוק.
- יש להרטיב מראש טיפ פיפטה של 1 מ"ל עם תערובת הידרוג'ל ECT ולהפיץ 180 מיקרול ממנו באופן שווה לכל תבנית של צלחת יציקה של 48-well, תוך הימנעות מכוחות גיזה מוגזמים שעלולים להשפיע על שלמות הרכבת מטריצת הקולגן ולהבטיח שהצלחת כולה תיעשה תוך 15-20 דקות.
הערה: נפח הליהוק המומלץ הוא 180 μL, אבל זה יכול להיות מורחב ל 200 μL38. לכן, כאשר מועדף, כרכים בטבלה 2 ניתן להתאים ל 200 μL באופן ששומר על אותם ריכוזים ויחס בין תאים לקולגן.- ודאו שנוצרת לולאה מלאה בתוך התבנית (איור 3A). אם תערובת ההידרוג'ל ECT מוחלת ללא הרף, תימנע היווצרות מלאה של טבעת ECT (איור 3B).
- הימנעו מלהיכנס לבאר הפנימית (איור 3C) ומהיווצרות בועות במהלך ההצינורות (איור 3D), כדי להבטיח היווצרות רקמות הומוגניות ופונקציונליות.
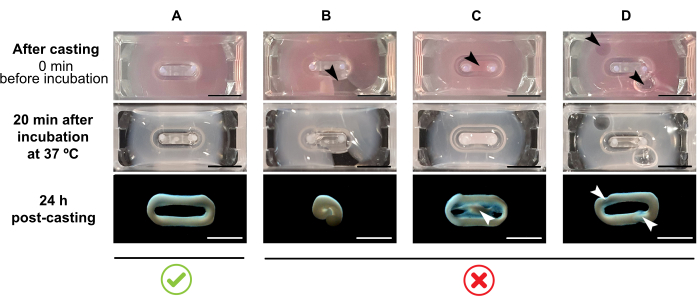
איור 3: יציקה, היווצרות הידרוג'ל ותמצית ECT בפורמט רב-טוב. הלוחות העליונים מדגימים את המראה של ECT מיד לאחר הליהוק. הלוחות האמצעיים מדגימים את המראה של ECT לאחר הדגירה במשך 20 דקות ב 37 °C (70 °F). הלוחות התחתונים מדגימים את מצב הדחיסה של ECT 24 שעות לאחר ההכנה, הוסר מהקטבים. (A) היווצרות ECT נכונה בין שני קטבים במהלך 24 h. (B-D) הראשונים דוגמאות של שגיאות pipetting המונעות היווצרות ECT נכונה. החצים הלבנים והשחורים מצביעים על פגמים מבניים של ECT עקב יציקה לא נכונה. סרגל קנה מידה: 5 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- מניחים בזהירות את צלחת הליהוק 48-well בתוך החממה תרבית התא ולתת תערובת הידרוג'ל ECT לבחון מחדש במשך 15-30 דקות. לאחר הדגירה, הוא ייראה דמוי ג'ל ואטום (איור 3, פאנל אמצעי).
- הוסף 600 μL של 37 °C חם FGM לבאר, מבלי צינור המדיום התרבותי ישירות על ECT להרכיב כמו זה יכול לגרום להפרעה ברקמות. הוסיפו בעדינות את מדיום התרבות לאורך קיר הבאר, שכן בשלב זה, אסור לנתק את ה-ECT גם מלמטה (איור 4).
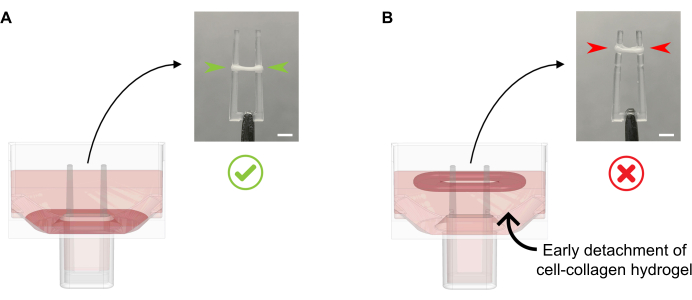
איור 4: תוספת נכונה ולא נכונה של מדיום תרבות ל-ECT הטרי. (A) בעת הוספת מדיום התרבות לאחר התגבשות ECT הראשונית (20 דקות לאחר הליהוק), יש להשאיר את ECT המרוכז ללא הפרעה בתחתית הבאר. במהלך 24 השעות הבאות, דחיסת מטריצה מונחית תאים תגרום ל- ECT להחליק במעלה הרמפה. מיקום ECT הסופי נשלט על ידי חללים קערים בגובה מוט מוגדר; זה מבטיח כי כל ECT להתיישב באותה עמדה כדי לאפשר השוואה של פעילות כיפוף מוט בתרבות ECT מקבילה. (B) יצירת ECT מנותקת מלמטה תוך הוספת מדיום התרבות במהירות רבה מדי. ECT צף יהיה קומפקטי ברמה הבינונית התרבות העליונה. כוחות קבלנים מוט לא יהיה דומה ישירות אם ECT להתיישב בעמדות שונות. סרגל קנה מידה: 2 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- דגירה עבור 24 שעות.
- החלף את המדיום כל יום לאחר מכן, עם 500 μL של FGM עד ניתוח.
הערה: לאחר השלב הראשוני של ג'לציה עצמאית לתא, CF האנושי מתחיל לדחוס עוד יותר את תערובת הידרוג'ל ECT. בתוך 24 שעות, ECT אמור להיראות דחוס במיוחד ולהעלות אותו לרמה שבה הוא מוחזק על הקטבים הגמישים (איור 3 ואיור 4A).
4. הערכת דחיסת ECT על ידי מדידת שטח חתך (CSA) (5 דקות לכל ECT).
הערה: דחיסת הרקמות מתחילה מיד לאחר הרכבת הקולגן והיא משמעותית במיוחד בשעות הראשונות. דחיסה מתארת שינויים המופעלים בעיקר על ידי דחיסה מונחית תאים של המטריצה בניצב לציר הארוך של הרקמה. פרמטר זה מוערך על-ידי קביעת האזור החתך (CSA) של ECT.
- בנקודות הזמן הרצויות, השתמשו במיקרוסקופ סטריאו כדי להקליט תמונות מקרוסקופיות של התצוגות העליונות והצדיות של ה-ECT (איור 5C).
הערה: ניתן לדמיין את ECT בתוך בארות הפולחן של צלחת הליהוק בת 48 הבארות. לחלופין, העבר את ה- ECT ללוח רב-באר תחתון שקוף להדמיה. מומלץ לדמיין את ECT על הקטבים כמו הסרת אלה מוביל לאובדן preload, וכתוצאה מכך, בתוך תקופה קצרה, הרקמה יכולה להתכווץ עוד יותר עם פיתול בסופו של דבר עקב שחרור מתח, אשר עלול לעכב הדמיה נכונה עבור ניתוחים של ממדים. - השתמש בתוכנית לעיבוד תמונה כדי לבצע ניתוח סריקת שורות. קבע קנה מידה והשתמש בכלי הקו הישר כדי לעקוב ולמדוד את קטרי ה-ECT במינימום 6 מיקומים לכל זרוע בכל מישור הדמיה (איור 5B,C).
- חשב את הקוטר הממוצע ממישורי תצוגה עליונה וצדדית וחשב CSA בהתאם למשוואת אזור אליפטית:
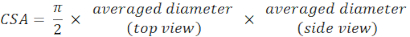
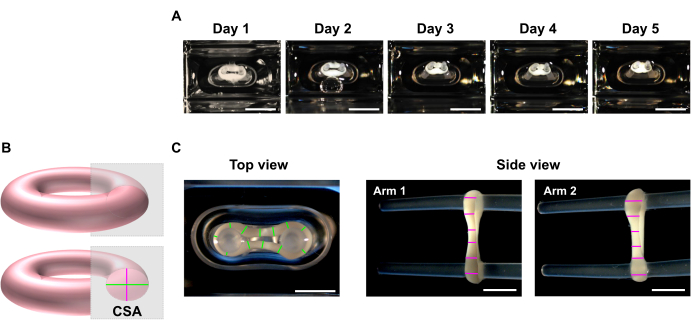
איור 5: ניטור דחיסת ECT לאורך זמן על-ידי ניתוח אזור חתך (CSA). ECT נוצרו באמצעות CF אנושי וסוג קולגן I ותרבית סביב שני קטבים גמישים במשך 5 ימים. (A) מוצגות תמונות מייצגות של בקרת ECT הממוקמות בתבניות גמישות במשך זמן של 5 ימים. סרגל קנה מידה = 5 מ"מ. תמונות שדה בהיר כאלה יכולות לשמש גם כדי לקבוע וריאציית הסטת מוט להערכת התכווצות רקמות. (B) ייצוג סכמטי של האזור החתך של ECT (קוטר תצוגה עליון בקוטר ירוק ותצוגה צדדית בוורוד). (C) תמונות מקרוסקופיות של תצוגות עליונות וצדדיות של ECT שהושגו עם סטריאומיקוסקופ ודוגמה כתבנית של ניתוח סריקת קו של קטרי הרקמות באמצעות תוכנית עיבוד תמונה. סרגל קנה מידה = 2 מ"מ. קטרים ממוצעים מחושבים מהממוצע של כל אורכי הקו הנמדדים בכל תוכנית תצוגה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. ניטור התכווצות ECT על ידי ניתוח הסטת מוט (15 דקות לכל צלחת יציקה 48-well).
הערה: תרבות ECT מבוצעת בדרך כלל במשך 5 ימים, אך ניתן להאריך אותה עוד יותר לפחות עד 20 יום. הסטת הקוטב מתרחשת עקב התכווצות הרקמה המונעת על ידי כוח התכווצות התא לכיוון המתח לאורך הציר הארוך של הרקמה. הערכה של התכווצות ECT יכולה להתבצע על ידי הדמיה בכל יום במהלך התרבות.
- צלם את לוחית הליהוק בת 48 הטובות מתחת למכשיר הקלטה עם מצלמת סריקת שטח משולבת הממוקמת במרחק קבוע, המצוידת בחיישן תמונה מונוכרום ברזולוציה גבוהה (≥ 5 מגה פיקסלים).
- השתמש במקור אור קרוב ל-UV (~390 ננומטר) כדי למקסם את הניגודיות ובכך להקל על זיהוי אוטומטי של טיפי הקטבים מכיוון שהם מכילים צבע פלואורסצנטי (איור 6A,C). אם אפשרות זו זמינה, מומלץ להדמיה של עדשות טלצנטריות כדי למזער עיוותי תמונה.
הערה: לחלופין, ניתן להשתמש בתמונות מקרוסקופיות של שדות בהירים מבארות בודדות או מהצלחת המלאה המלווה בסרגל קנה מידה לניתוח (איור 5A).
- השתמש במקור אור קרוב ל-UV (~390 ננומטר) כדי למקסם את הניגודיות ובכך להקל על זיהוי אוטומטי של טיפי הקטבים מכיוון שהם מכילים צבע פלואורסצנטי (איור 6A,C). אם אפשרות זו זמינה, מומלץ להדמיה של עדשות טלצנטריות כדי למזער עיוותי תמונה.
- מדוד את המרחק בין הקטבים מרשומות יומיות (איור 6C,D) באמצעות תוכנית עיבוד תמונה או ניתוח אוטומטי על-ידי הפעלת תמונות מוקלטות בתוכנה המסוגלות לזהות פיקסלים בהירים בעלי ניגודיות גבוהה על רקע כהה.
- חשב את הסטת המוט דרך השונות של מרחק הקטבים בהשוואה למרחק ההתחלתי ביום האפס.
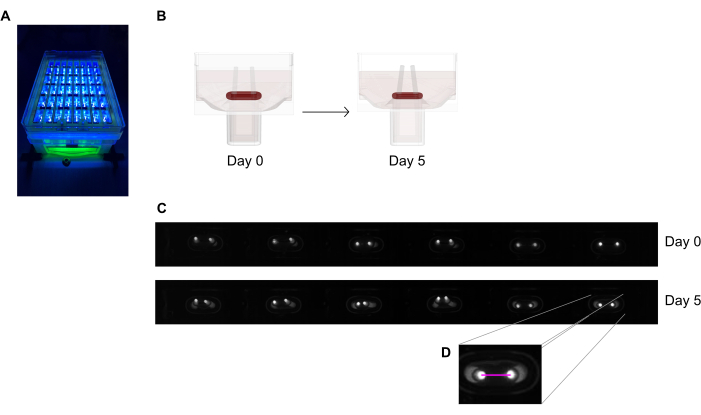
איור 6: סקירה סכמטית של הערכת התכווצות הרקמה על פי הסטת מוט. (A) הקלטה ברזולוציה גבוהה למופת של מוטות פלואורסצנטיים בלוח הליהוק בן 48 הבאר תחת עירור אור כמעט UV. שיטה זו עדיפה על פני תמונות שדה בהיר למעקב אוטומטי מדויק יותר עם קצה מוט. (B) השרטוטים הסכמטיים מדגימים כיצד דחיסת ECT והתכווצות מובילות לכיפוף מוט. (ג) שורה למופת של אותן רשומות לוחיות ביום 0 וביום החמישי לאחר הליהוק. ד. תקריב מראה כיצד למדוד את המרחק (קו ורוד) בין הקטבים באמצעות תוכנית עיבוד תמונה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הערה: שקול כי הסטת מוט נמדדת על ידי תמונת קצה בהירה היא רק הערכה של התכווצות הרקמה בשל ההבדל במישורי הדמיה. כמו כן, שים לב כי היישום של חומרים פרו-פיברוטיים כגון TGF-β1 במהלך תרבית הרקמות משפר דחיסה ECT התכווצות יכול בסופו של דבר להוביל הפרעה רקמות מוקדם.
6. הערכת נוקשות ומאפיינים ביומכניים אחרים של ECT על ידי מדידת מתיחה הרסנית וניתוח זני מתח (20 דקות לכל ECT)
הערה: עקומת מתח אופטימלית יכולה להציג שלושה אזורים: אזור בוהן, אזור אלסטי ואזור פלסטיק. דוגמה לעקומת מתח ECT מוצגת באיור 7. ניתוח עקומת מתח-זן מאפשר חילוץ פרמטרים ביומכניים חשובים של הרקמה כגון למשל, נוקשות, חוזק מרבי, גמישות, פלסטיות, הרחבה, חוסן וקשיחות.
- קציר ECT על ידי משיכת האלונקה הראשונה, כולל ECT, מתוך הבאר שלה, באמצעות מלקחיים. לאחר מכן ניתן להחזיק את האלונקה בבסיסה, וה- ECT החליק מעל קצות האלונקה באמצעות וו משובח או קצה פיפטה.
- העבר את ה- ECT לשני ווים מהודקים לזרוע הנייחת וזרוע המתמר של ריומדר ניתוח מכני דינמי מאריך (DMA) המצויד באמבט איברים מחוספס של 37 °C (בהזמנה אישית) מלא PBS (איור 7A).
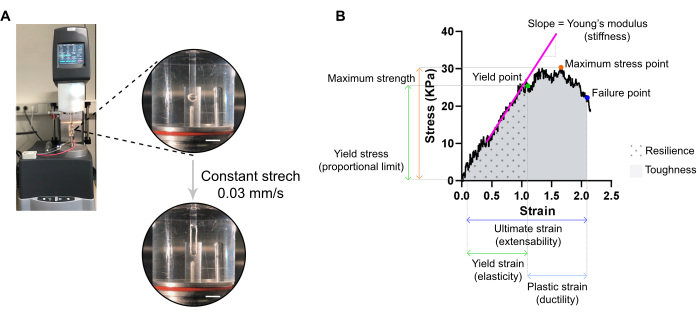
איור 7: ניתוח מדידת מתיחה הרסנית של ECT. (א) מדידת מתיחה הרסנית ריולוגית על ריומטר ריומטר ניתוח מכני דינמי מאריך (DMA). מבט עליון בעוצמה גבוהה: ECT לאחר הרכבה ב- L0 בתא סביבתי ומחובר לקוטב עליון ונמוך עבור ניתוחי מתח.. מבט הספק גבוה תחתון: ECT מתוח בקצב קבוע 0.03 מ"מ/s עד לנקודת הכישלון במתח האולטימטיבי. מוטות קנה מידה = 5 מ"מ. (B) דיאגרמת מתח-זן של ECT המציגה את הפרמטרים העיקריים שנמדדו. הגבול העליון של האזור האלסטי מתאים לנקודת התשואה ואזור הפלסטיק מורכב בין נקודת התשואה לנקודת הכשל (משיכות). השיפוע של השלב הליניארי של האזור האלסטי מתאים מודולוס של יאנג המשקף נוקשות רקמות. הכוח המרבי מתאים ללחץ המתיחה המרבי שרקמה יכולה לעמוד בו. בשל שבירת סיבים, הלחץ פוחת עד שהרקמה מגיעה לנקודת הכשל. זה קורה בזן האולטימטיבי (הרחבה) שבו ירידה פתאומית בלחץ הוא ציין עקב הקרע של הרקמה. החוסן מתאים לאנרגיה (kJ/m3) הנספגת על ידי הרקמה לפני עיוות קבוע (עד לנקודת התשואה) וניתנת על ידי האזור שמתחת לעקום (AUC) עד לזן נקודת התשואה. קשיחות תואמת את האנרגיה הכוללת (kJ/ m3) הרקמה יכולה לספוג עד לקרע והוא ניתנת על ידי AUC עד המתח האולטימטיבי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הגדר את הרומד כדי להחיל מתח חד-מיני בקצב ליניארי קבוע של כ - 1 % מהמרחק ההתחלתי בין הווים לשניה. ניתן להשתמש בקצב מתיחה קבוע של 0.03 מ"מ/s עם ממדי ECT טיפוסיים. Tare המתמר, ליזום את המתיחה ולתעד עד נקודת הקרע ECT.
שים לב: יש לרשום תמונות מקרוסקופיות של ECT (שלב 4.1. לפני בדיקת מתיחה, מכיוון שה- CSA נדרש לנורמליזציה של נתונים.
הערה: ניתוח מתח-מתח, כולל חישוב CSA, ניתן לעבד מאוחר יותר בזמן על בדיקות מתיחה. השתמש בתוכנת גיליון אלקטרוני ובתוכנת ניתוח סטטיסטית לניתוח הנתונים. - נרמל ערכי כוח נמדדים (mN) לכל ECT על-ידי ה- CSA שלו (mm2) כדי להשיג ערכי לחץ (kPa).
- התוויית ערכי לחץ כנגד מאמץ (מדד גיאומטרי של עיוות רקמות שניתן על ידי המרחק היחסי בין הוו העליון לתחתון) בגרף XY.
הערה: האורך ההתחלתי של הרקמה (מרחק בין הוו העליון לתחתון) מיד לפני המתיחה, L0, חייב להיות מותאם באופן ידני ומתאים לתחילת אזור בוהן (אזור בוהן יכול להיעדר בהתאם למאפייני הרקמה). יש לחשב כל ערך נקודת מאמץ לפי המשוואה, שבה Ltotal הוא הפער הכולל בכל נקודת מדידה:
בעת התוויית הנתונים, השתמש בערך הלחץ ב- L0 שנבחר עבור חיסור רקע. - קבעו פרמטרים ביומכניים שונים מעקומת זן הלחץ (השתמשו באיור 7B כדוגמה).
הערה: עקומת מתח יכולה להציג שלושה אזורים: בוהן, אלסטי ואזורי פלסטיק. הגבול העליון של האזור האלסטי, לפני שהרקמה מתחילה להיות שבירה זעירה, מתאים לנקודת התשואה, והמתח שלה הוא מדד של גמישות רקמות. אזור הפלסטיק מורכב בין נקודת התשואה לנקודת הכשל. הנקודה המאוחרת יותר תואמת לירידה פתאומית בלחץ עקב קרע של הרקמה, הגדרת הכתם האולטימטיבי, שהוא מדד של הרחבת רקמות. נקודת המדידה השלישית תואמת את הכוח המרבי, המוגדר על ידי הלחץ הגבוה ביותר שהרקמה יכולה לשאת מבלי לשבור במהלך המתיחה. החוסן והקשוחות, הניתנים על ידי האזור שמתחת לעקום, תואמים את האנרגיה הנספגת על ידי הרקמה עד לנקודת התשואה ועד לנקודת הכישלון, בהתאמה. עבור כל עקומה שהושגה, השיפוע של החלק הליניארי של האזור האלסטי מתאים מודולוס של יאנג, הידוע גם בשם מודולוס אלסטי, והוא מאפיין מכני המודד את נוקשות הרקמה.- לחלץ מכל עקום את ערכי XY (מתח ומתח, בהתאמה) של נקודת התשואה, נקודת הכישלון, ונקודת הלחץ המרבית.
- להעריך את המודולוס של יאנג (נוקשות ב kPa = mN·mm-2) של כל ECT מן השיפוע של החלק הליניארי של האזור האלסטי על ידי התוויית רגרסיה ליניארית של אזור זה.
- השתמש בתוכנית סטטיסטית כדי לחשב את האזור שמתחת לעקומה (AUC) כדי לקבוע הן חוסן והן קשיחות, עד לנקודת התשואה ונקודת הכישלון, בהתאמה. חשב AUC לפי השיטה הטרפזית. הגדר את תוכנית הבסיס לאפס ושקול רק את הפסגות מעל קו הבסיס, שהן לפחות 10% מהמרחק מהמינימום לערך המרבי בציר ה- Y.
הערה: מודולי של חוסן וקשיחות ניתנים על ידי σ × ε, שבו σ הוא מתח (kPa) ε הוא המתח (L / ΔL, מ"מ / מ"מ). לפיכך, חוסן וקשיחות הם האנרגיה ב kJ /m3 (kPa = kN·m-2 = kN·m-3 = kJ / m·m·m-3 = kJ / m3) נספג על ידי הרקמה לפני עיוות קבוע עד לקרע, בהתאמה.
תוצאות
ECT להגיע סביב 95% דחיסה לעומת נפח הידרוג'ל קולגן התא הראשוני בתוך 24 שעות הראשונות. דחיסת רקמות והתכווצות בתנאי בקרה ובנוכחות FCS מתבצעת מספר שעות לאחר הליהוק, ובמיוחד עולה עד היום החמישי (איור 5A). הסטת הקוטב עשויה לגדול עוד יותר במהלך 15 הימים הבאים (20 יום היה הזמן הארוך ביותר שנבדק). גודל הסטת הקוטב תלוי בסוג התא, במצב התא ובתנאי תרבית התאים והרקמות. בדרך כלל, תכונות ביומכניות נמדדות ביום 5 של תרבות, אבל כל נקודת זמן ניתן לבחור. כדוגמה ליישום של מודל ECT, הוא הראה כיצד פרוטוקול זה יכול לסייע בחקר ההשפעה של שלמות ציטוסקלטון actin על פונקציית הרקמה. ECT הוכנו בצלחת יציקה 48-well וטופלו עם מעכב פילמור אקטין Latrunculin A (Lat-A, 7 ננוגרם / מ"ל). הטיפול הפחית את דחיסת ה-ECT כפי שעולה מהעלייה המשמעותית של פי 1.7 ב-CSA בהשוואה לשליטה (איור 8A,B). יתר על כן, התכווצות הרקמות הוערכה במהלך 5 ימי התרבות. בהיעדר התרופה, ההתכווצות גדלה בהדרגה עד יום 5, והגיעה לכ -40% התכווצות. התכווצות רקמות מושפעות Lat-A, וכתוצאה מכך רק ~ 20 % התכווצות מקסימלית (איור 8A,C). בדיקות מאמץ מתח חד-כיווניות הרסניות בוצעו ביום החמישי. מעקומת מתח אופיינית כמו אלה המתקבלים עבור ECT (איור 7B), ניתן לחלץ מספר פרמטרים ביומכניים. באופן מופתי, הוכח כי עיכוב של פילמור אקטין הוביל להפחתה משמעותית של ~ 50 % נוקשות רקמות על השליטה (איור 8D). יחד, הנתונים המופתיים מראים כי שלמות הציטוס שלד actin חיונית לדחיסת ECT, התכווצות, וקשיחה.

איור 8: עיכוב של פילמור אקטין משפיע על דחיסת ECT, התכווצות ונוקשות. ECT שנוצר עם CF אנושי וסוג קולגן הייתי תרבותי במשך 5 ימים סביב שני קטבים גמישים בנוכחות או היעדר של 7 ng / mL Latrunculin-A (Lat-A). (A) מוצגות תמונות מייצגות של הפקד ו- ECT המטופל המוצבות בקטבים גמישים לאחר 5 ימים. סרגל קנה מידה = 2 מ"מ. (B) אזורים חוצי חתך (CSA) חושבו מתמונות מקרוסקופיות (n = 22). (ג) הסטת הקוטב חושבה על פני תקופה של 5 ימים. ערכים ניתנים כאמצעי±SEM (n = 22). שינויים משמעותיים הוערכו על ידי ANOVA דו כיווני עם בדיקות פוסט הוק של Dunnett (*p<0.05 לעומת Control) להשוואות מרובות. (D) רקמות היו נתונות למדידות מתיחה הרסניות rheological ואת המודולי של יאנג הוחזרו מניתוח זן מתח (n = 16). (B ו - D) תיבות מציינות את הרביע התחתון והעליון. קו אופקי בכל תיבה מייצג את CSA החציוני ואת הנוקשות, בהתאמה. האמצעים עבור כל קבוצה מסומנים על-ידי +. קווים אנכיים הנמתחים מכל תיבה מייצגים את הערכים המינימליים והמקסימום הנמדדים. שינויים משמעותיים ב-B ו-D נבחנו על ידי מבחן t-t דו-זנבי ללא שינוי (*p<0.05). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המוצג מתאר את הדור של ECT מ- CF האנושי העיקרי, המאפשר לחקור את ההשפעה המכנית של תאים אלה על סביבת המטריצה החוץ-תאית שלהם ולהיפך.
הפיברובלסטים צריכים להיות מורחבים כדי להניב תאים מספיקים לניסויי ECT המתוכננים (0.75 x 106 תאים / ECT). עבור הרבייה הטובה ביותר, מומלץ מראש תרבית קפואה או רקמה נגזר פיברובלסטים בתרבות מונו-שכבתית דו-ממדית למשך סטנדרטי עד 80% השפעה בתוך כל מעבר ולפני השימוש שלהם בדור ECT (פרוטוקול שלב 3). עבור culturing ראשי CF-monolayers ו-נגזר ECT בפרט, מומלץ להשתמש מדיום מסחרי ותוספי מזון המתאימים CF (ראה טבלה של חומרים). תוספי בינוני עם סרום הוא קריטי כדי להבטיח את הרחבת CF בתרבויות 2D סטנדרטיות. שימוש בתנאי סרום או סרום נמוכים בתרביות תלת-ממד, כולל דור ECT ותרבות נוספת, יכול להיחשב בהתאם לסוג הפיברובלסט שנבחר. עם זאת, בעת שימוש CF עבור דור ECT, מומלץ לפחות לכלול סרום הידרוג'ל הליהוק עבור דחיסת רקמות ראשונית נכונה.
מגבלה אחת בהליך קשורה להרחבת CF בתרבות הדו-טראומטית הדרושה ליצירת ECT, מה שמוביל בדרך כלל להמרה של פיברובלסטים למיופיברובלסטים (המצוין על ידי SMA משופר ויצירת סיבי מתח הקשורים4). בשל transdifferentiation המתמשך שלהם, לשקול כי פיברובלסטים בקטעים שונים יכול לתת תוצאות שונות בעת שימוש כדי ליצור ECT. במודל ECT, יש להפלות שני תהליכים. לאחר השעיה בהיווצרות הידרוג'ל קולגן ו- ECT, התאים מסתגלים לסביבתם בתלת-ממד והפנוטיפ של מיופיברובלסט עשוי להיות הפוך לפחות חלקית. בשלב התרבות הבא, התאים עשויים לעבור שוב מתג בכיוון פנוטיפי הפוך, במיוחד באמצעות קטבים עם נוקשות גוברת או על ידי תוספת של גורמים פרו-פיברוטיים (כגון TGF-β1). האפשרות לכוון את ההסתגלות הפנוטיפית הדינמית יוצרת הזדמנות לנתח את המנגנונים המולקולריים הבסיסיים והמבוקרים ביומכניים. מחקרים כאלה עשויים בסופו של דבר לאפשר מידול של תנאים פיברוטיים וזיהוי התערבויות פרמקולוגיות או ריפוי גנטי המתמקדות בפיברוזיס איברים. השימוש פיברובלסטים ממוצאים שונים עשוי לאפשר עוד יותר את החקירה של תהליכים שבבסיס פיברוזיס ספציפי לרקמות. יישום של פיברובלסטים או תאים סטרומיים אחרים לא רק ממקור שונה, אלא גם ממינים שונים מאפשר מחקרים בין מינים של מנגנונים שבבסיס פיברוזיס או אינטראקציות מטריצת תאים. עם זאת, יש לציין כי באמצעות תאים ראשוניים מבני אדם, יש לקחת בחשבון את ההבדלים הבין-אישיים בין התאים. כשל בהתכווצות רקמות (ראה גם להלן) אינו בהכרח גורם לשגיאה ניסיונית, אך יכול לנבוע ממאפייני ההתכווצות המהותיים של קו התא הבודד. לכן, תמיד עדיף להשתמש בתאים מתורמים שונים כדי לאפשר אפליה של מנגנונים כלליים והבדלים תלויי תורמים. בדומה לשונות של התוצאות המתקבלות, אשר יכול לנבוע מן הביולוגיה האישית של התא, חשוב להזכיר כי כל החומר הביולוגי יכול להראות שונות משמעותית. לכן, מומלץ לבצע בדיקה מקבילה של החומר ממגרשים שונים, לפחות כאשר יש צורך לשנות את המגרש.
יתר על כן, רקמות הגדלות על זוגות המוט מציגות אזורים "זרוע" ו "מוט" שונים מבחינה מבנית וביומכנית. נותר לקבוע עד כמה אזור הקוטב תורם לניסויים מתיחה.
תהליך הכנת הרקמות חייב להיות מהיר ביסודיות כדי למנוע gelation בטמפרטורת החדר. ג'לציה הידרוג'ל קולגן התא מונע בעיקר על ידי הרכבה עצמית קולגן, בעיקר תא עצמאי29. זהו הצעד הראשון במהלך היווצרות רקמות, וזה צריך להתרחש במהלך הראשון 15-30 דקות פעם להציב אינקובטור תרבות. פיברילוגנוזיס קולגן וג'לציה מושפעים, למשל, הידרוקסילציה של פרולינים וליזינים, ותלויים מאוד בסוג קולגן, חוזק יוני, pH וטמפרטורה, המשפיעים על קשירה של סיבים וגודל נקבובית של רשת הקולגן42. זה יכול בסופו של דבר להשפיע על רכיב התא, ובכך על המבנה ואת המאפיינים המכניים של הרקמות. בעת בחירת מקורות קולגן והרכב כימי של קולגן ממקור טבעי, חשוב לזהות פתרון קולגן אמין ואיכותי להנדסת רקמות. השימוש בסוג בקר מסחרי חומצה solubilized I קולגן מומלץ בריכוז מלאי משוער של 6-7 מ"ג / מ"ל. עם זאת, פתרונות קולגן אחרים עם ריכוז של ≥ 4 מ"ג /מ"ל עשויים גם הם להיות תואמים עם זה. מספר גורמים אחרים כגון טוהר, שלמות מולקולרית, סוכן solubilizing, וגיל המדף יכול להשפיע על זמן הדגירה הדרוש לשחזור (התגבשות) של תערובת הידרוג'ל ECT, אשר בשום פנים ואופן לא יעלה על 1 שעה כדי למנוע משקעים התא. לקבלת תוצאות מיטביות, יש לאחסן ולטפל בפתרונות המכילים קולגן במהירות של 4 ±2 °C (7%). שלמות הקולגן יכולה להיות משובשת אם קפוא או מטופל בטמפרטורת החדר וכתוצאה מכך למנוע פיברילוגנזה וג'לציה הידרוג'ל. לאחר נטרול pH ושיקום התאים בהידרולג'ל הקולגן, צנרת במהלך הליהוק חייבת להיות עדינה מכיוון שכוחות גיזה חזקים עשויים להשפיע על שלמות מבנה הקולגן והרכבת המטריצה. שונות בין קבוצות של קולגן או ספקים שונים יכולה להשפיע על היווצרות ECT. מומלץ לבדוק הידרוג'ל קולגן כדי לברר תכונות עיבוי אידיאלי לפני השימוש בהכנת ECT. יתר על כן, כדי להבטיח נטרול pH מתאים, נפח NaOH חייב להיות titrated עבור כל אצוות קולגן בודדים. באופן כללי, בקרות איכות נוספות מומלצות, למשל, ניתוח SDS-PAGE לחקירת שלמות קולגן וריכוז וריכוז וריאולוגיה של גיזה כדי לקבוע את המאפיינים הצמיגים של פתרון הקולגן.
לאחר השלב הראשוני של התגבשות הידרוג'ל עקב הרכבה עצמית של קולגן, רכיב התא מניע דחיסת מטריצה נוספת. אם ECT לא לדחוס באופן גלוי בתוך 24 שעות לאחר הליהוק, זה עשוי להיות קשור הכדאיות התא. מומלץ 80% לפחות הכדאיות של התא. ודא כדאיות התא לאחר ניתוק אנזימטי של תאי קלט כדי להשיג דחיסת רקמות נכונה ופונקציונליות. בפרוטוקול זה, ECT נוצרים עם 0.75 × 106 תאים בנפח סופי של 180 μL לרקמה, אך ייתכן שיידרשו מספרי תאים שונים בהתאם למקור התאים (למשל, תורם CF, ספקים). לכן, מומלץ לבצע ניסוי טיטריון תא בהתחלה. בדרך כלל, מגוון של תאים מ 150,000 עד 750,000 ניתן לבדוק להיווצרות אופטימלית דחיסה של הרקמות. בדרך כלל, פרוטוקול זה משתמש 0.3 מ"ג של קולגן לכל ECT המתאים 1.67 מ"ג / מ"ל קולגן בנפח סופי של 180 μL. במידת הצורך, ניתן לבדוק את היחס בין מספר התא לריכוז הקולגן (ריכוז קולגן מ-0.14 ל-0.4 מ"ג לרקמה). יתר על כן, להבטיח נטרול נכון של קולגן חומצה אצטית solubilized במהלך הכנת הידרוג'ל כמו pH לקוי עלול להיות מזיק עבור הכדאיות התא.
כפי שמוצג באיור 3 (החלונית התחתונה), ייתכן ש-ECT לא ייווצר באופן אחיד. לאחר שחזור התא בתערובת הידרוג'ל קולגן מנוטרל pH, תהליך הג'לציה מתפתח אפילו ב 4 °C (70 °F) והואץ בטמפרטורת החדר (פעם יצוק לתוך התבנית). ודא כי הליך הליהוק הושלם בתוך 15-20 דקות. ג'ל בטרם עת יעכב צנרת נכונה של התערובת בשל צמיגות מוגברת. בעת הטלת הידרוג'ל קולגן התא הצמיג, טיפ פיפטה רטוב מראש עם הידרוג'ל או להשתמש קצה פיפטה שמירה נמוכה, ולעקוב באמצעות אותו קצה כדי להטיל ECT מרובים. תרגול זה יפחית את השונות בנפח ההידרוגל ואת היווצרות הבועות במהלך ההתפרצות (איור 3D). ודאו להשלים את הלולאה בתוך התבנית ליצירת ECT בצורת טבעת (איור 3A-B). בנוסף, ודא כי השעיית תא הקלט הוא הומוגני וללא אגרגטים בכל שלבי הליהוק. מערבבים לעתים קרובות את תערובת מימן קולגן התא על ידי מערבולת הצינור תוך ביצוע הליך הליהוק לתוך צלחת יציקה 48-well. לבסוף, gelation במהלך הדגירה ב 37 °C (50 °F) צריך להתרחש מקסימום בתוך 15-30 דקות. אם תהליך זה לוקח יותר זמן, הסיכוי של משקעים התא עולה, לייצר רקמות מאוכלסות בצורה לא אחידה.
יתר על כן, רקמות מאוכלסות בצורה לא אחידה והפצה לא אחידה של הידרוג'ל קולגן התא לתוך התבניות יכול להוביל מורפולוגיה לא סדירה של ECT, ו ECT לא יכול להתכווץ באופן אחיד לאורך צלחת יציקה 48-well. עמדת ECT על הקטבים הגמישים יכולה גם להשפיע על רמות ההתכווצות ולתרום לתופעה דומה. אם ה-ECT היוצר מתנתק מלמטה תוך הוספת מדיום תרבות, הוא עשוי לצוף וידחוס מעל נקודת העיגון של הקטבים באמצעות כוח כיפוף מוגדר (איור 4). זה עלול להוביל הסטת מוט יתר על המידה ולעורר שונות בין רקמות / ניסויים. כדי למנוע זאת, הידרוג'ל צריך להיות בזהירות על ידי מדיום התרבות דרך קיר הבאר.
Disclosures
GLS ו- SL ניסחו את כתב היד. כל המחברים תרמו לפיתוח הפרוטוקול וערכו את כתב היד. TM, MT, ו- WHZ הם יועצים מדעיים ל- GmbH הרב. WHZ הוא המייסד ובעל המניות של GmbH הרב.
Acknowledgements
עבודה זו נתמכה על ידי אגודת הלב הגרמנית (מלגת המחקר DGK ל- GLS) ועל ידי קרן המחקר הגרמנית (DFG באמצעות פרויקט IRTG 1816 עבור GLS ו- AD; DFG 417880571 ו DFG TI 956/1-1 עבור MT; SFB 1002 TP C04 עבור הר ו- WHZ; SFB 1002 TP S01 עבור WHZ; ו EXC 2067/1-390729940J עבור WHZ). WHZ נתמך על ידי המשרד הפדרלי הגרמני למדע וחינוך (BMBF באמצעות הפרויקט IndiHEART), ואת פונדציה Leducq (20CVD04). MT, WHZ ו- SL נתמכים על ידי המרכז הגרמני לחקר הלב וכלי הדם (DZHK).
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved