Method Article
Mise en place de modèles de rats imitant les thérapies hormonales d’affirmation de genre
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le protocole décrit le développement de deux modèles de rongeurs imitant les thérapies hormonales d’affirmation de genre par l’administration sous-cutanée de testostérone ou d’œstradiol plus acétate de cyprotérone (utilisé dans les thérapies humaines pour les personnes transgenres) : fixation des doses, identification des biomarqueurs pertinents et évaluation des effets.
Résumé
Les personnes transgenres (TG) sont des personnes dont l’identité de genre et le sexe assigné à la naissance ne correspondent pas. Ils subissent souvent une hormonothérapie d’affirmation de genre (GAHT), une intervention médicale qui permet l’acquisition de caractéristiques sexuelles secondaires plus alignées avec leur identité de genre individuelle, fournissant des résultats cohérents dans l’amélioration de nombreuses variables socio-psychologiques. Cependant, le GAHT cible différents systèmes corporels, et certains effets secondaires sont enregistrés, bien qu’ils ne soient pas encore entièrement identifiés et caractérisés. Par conséquent, les personnes TG subissant une GAHT peuvent être considérées comme un sous-groupe sensible de la population et une attention particulière doit être accordée dans le cadre de l’évaluation des risques, par exemple par l’utilisation de modèles animaux ciblés. Le présent travail décrit les procédures mises en place pour mettre en œuvre deux modèles de rats imitant le GAHT : le modèle démasculinisant-féminisant (dMF) imitant le GAHT pour les femmes TG et le modèle déféminisant-masculinisant (dFM) imitant le GAHT pour les hommes TG. Les modèles ont été mis en œuvre par l’administration des mêmes hormones que celles utilisées pour le GAHT humain, à savoir le β-estradiol plus l’acétate de cyprotérone pour le dMF et la testostérone pour le dFM, par les mêmes voies d’exposition pendant une période de 2 semaines. Les rats sont contrôlés quotidiennement pendant le traitement pour évaluer leur état de santé et leurs comportements potentiellement agressifs. Au moment du sacrifice, le sang et les tissus cibles ont été prélevés et stockés pour des analyses biochimiques, moléculaires et histopathologiques. Des paramètres spécifiques au sexe, à savoir le nombre de spermatozoïdes et les dimensions clitoridiennes, ont également été évalués. De plus, les isoformes du CYP450, exprimées exclusivement et/ou préférentiellement dans le foie de rat mâle et femelle, sont identifiées et caractérisées comme de nouveaux biomarqueurs afin de vérifier le succès de la GAHT et d’établir le modèle. L’implication de la thyroïde a également été explorée comme une cible clé dans le système endocrinien.
Introduction
La perception psychologique de l’individu d’être un homme, une femme, ni l’un ni l’autre, les deux ou quelque part entre les deux1 s’appelle l’identité de genre. Il peut correspondre au sexe biologique (cisgenre) ou être différent (transgenre - TG). Un homme TG est un individu né en tant que femme mais qui s’identifie comme un homme. Une femme TG naît en tant qu’homme mais s’identifie comme une femme2. On estime qu’à l’heure actuelle, il y a 25 millions de personnes TG dans le monde3, la plupart d’entre elles souffrant de dysphorie de genre, un état psychologique caractérisé par une incongruence entre leur genre et celui qui leur a été attribué à la naissance4, qui peut entraîner une discrimination sociale et des difficultés au travail et dans la famille, conduisant souvent à la dépression. anxiété et stress5. Pour de telles raisons, les personnes TG subissent souvent une hormonothérapie d’affirmation de genre (GAHT) et/ou une chirurgie d’affirmation de genre. La GAHT chez les hommes TG est caractérisée par l’administration de testostérone (T) (tableau 1), et chez les femmes TG, d’œstrogènes (E2) et d’antiandrogènes (tableau 2)6.
Le GAHT dure généralement toute la vie de l’individu, agissant en permanence sur le système endocrinien 7,8. Il est donc important d’analyser l’impact du GAHT sur la santé des personnes TG et ses effets potentiels à long terme. De plus, les personnes TG sont exposées, comme la population générale, à des contaminants chimiques - en particulier, les perturbateurs endocriniens (DE) - qui ciblent le système endocrinien en tant que GAHT, entraînant une surstimulation9.
Les DE sont un groupe de produits chimiques affectant les organismes et/ou leur descendance en modifiant différents processus hormonaux et métaboliques, tels que la sécrétion, l’activation, la synthèse, la libération et la liaison d’hormones naturelles. Étant donné que les troubles de l’érection sont répandus dans l’environnement, les aliments et les produits d’usage quotidien (p. ex., bouteilles et contenants en plastique, doublures de boîtes de conserve métalliques, détergents, produits ignifuges, aliments, jouets, cosmétiques et pesticides, etc.), la population générale est exposée en permanence tout au long de la vie10. De plus, même une exposition à de faibles doses de PE peut entraîner des lésions tissulaires et organiques, et un phénomène courant associé à l’exposition aux DE est l’apparition d’effets spécifiques au sexe chez les animaux de laboratoire et chez les humains11. À titre d’exemple, l’exposition au bisphénol A (BPA), un matériau en contact avec les aliments, est liée à des risques pour la santé tels que l’endométriose et le syndrome des ovaires polykystiques chez les femmes, ainsi qu’à une fertilité réduite, en raison de ses effets œstrogéniques12. Chez les hommes, le BPA peut abaisser les niveaux et diminuer la qualité du sperme13. De plus, les pesticides sont associés à un risque plus élevé de cancer du sein chez les femmes et à des problèmes de fertilité importants chez les hommes13. Jusqu’à présent, il n’existe pas d’outils spécifiques pour étudier les effets toxicologiques des contaminants environnementaux, y compris les PE, chez les personnes TG9.
La présente étude vise à décrire les méthodes et les paramètres retenus pour le développement de deux modèles animaux de TG : un modèle démasculinisant-féminisant (dMF) et un modèle déféminisant-masculinisant (dFM). En particulier, le choix des doses appropriées, du moment et du mode d’administration des hormones sur la base des thérapies humaines actuelles est évalué14. De plus, les biomarqueurs tissulaires et fonctionnels qui définissent les modèles de manière unique sont identifiés et caractérisés. En outre, l’efficacité et la tolérabilité du traitement chez l’animal ainsi que la sélection des marqueurs les plus appropriés pour une utilisation dans des études à long terme sont décrites en détail, ainsi que les techniques utilisées à ces fins.
Afin de caractériser les modèles, les critères d’évaluation suivants sont analysés : taux sérique de testostérone (T) (le meilleur biomarqueur pour évaluer le succès de la GAHT dans les deux modèles 9,15) ; taux sérique d’œstradiol (E2) (les deux modèles) ; l’hormone stimulant la thyroïde (TSH) et la thyroxine (T4) (modèle dMF) ; numération des spermatozoïdes (modèle dMF) ; dimension clitoridienne (modèle dFM) ; Analyse histopathologique des organes reproducteurs, du foie et de la thyroïde (pour les deux modèles). De plus, l’expression génique des isoformes du cytochrome P450 hépatique spécifiques au sexe suivantes (CYP450s, pour les deux modèles) est également analysée16,17 : CYP2C11 (spécifiquement exprimée dans le foie masculin), CYP3A18 (exprimée 25 fois plus dans le foie masculin que dans le foie féminin), CYP2C12 (spécifiquement exprimée dans le foie féminin) et CYP2C6 (principalement exprimée dans le foie féminin, mais présente à des niveaux inférieurs, également chez le mâle).
Protocole
Les études sont réalisées conformément à la directive 2010/63/UE, au décret législatif italien n° 26 du 4 mars 2014 et aux principes de bonnes pratiques de laboratoire (BPL) de l’OCDE. Le protocole de l’étude a été approuvé par le ministère italien de la Santé (autorisation n° 806/2021-PR). Ici, 16 jeunes rats Sprague-Dawley sexuellement matures des deux sexes (304 rats mâles ± 13 g et 190 rats femelles ± 7 g, âgés de 8 à 9 semaines) sont achetés et logés dans deux par cage dans des conditions de laboratoire standard (22 ± 0,5 °C, 50 % à 60 % d’humidité relative, 12 h d’alternance sombre-lumière avec 12 à 14 changements d’air par heure) avec de l’eau et de la nourriture disponibles à volonté. Dans toutes les cages, pour l’enrichissement environnemental de chaque animal, insérez des blocs de bois et remplacez-les chaque semaine.
REMARQUE : Les animaux âgés de 8 à 9 semaines ont été choisis car la GAHT peut commencer à l’adolescence (stades Tanner 2 à 3), correspondant à 8-9 semaines chez les rongeurs, et elle dure longtemps, potentiellement toute la vie des personnes TG9.
1. Dimensionnement des groupes et soins aux animaux
- Utiliser les jeunes rats adultes mâles et femelles Sprague-Dawley (âgés de 8 à 9 semaines) comme modèle, car le rat est l’espèce préférée indiquée par l’OCDE (p. ex., la ligne directrice 421 Essai de dépistage de la toxicité pour la reproduction et le développement) et la seule espèce de rongeur proposée et prise en compte dans la ligne directrice 407 de l’OCDE (étude de toxicité par voie orale de 28 jours à dose répétée chez les rongeurs, mise à jour avec les paramètres de détection des EI).
- Utilisez le logiciel G*Power pour le dimensionnement du groupe. Pour les modèles dFM et dMF, sélectionnez quatre groupes d’essai : un groupe témoin (C) et trois groupes d’animaux traités avec différentes doses de GAHT. Effectuez le dimensionnement en référence à la comparaison entre deux groupes (dose de traitement par rapport à C) avec le test de Mann-Whitney, un niveau de signification bilatéral alpha = 0,0167 (correspondant à alpha = 0,05 avec la correction de Bonferroni appliquée aux 3 comparaisons entre chaque dose de traitement et le C), et une puissance 1-bêta = 0,80.
- Le nombre calculé de rats/groupes est le suivant :
pour le modèle dFM, animaux/groupe n=4, selon Kinnear et al.18 indiquant après 2 semaines de traitement, les niveaux suivants : dans le groupe témoin : 0,2 ± 0,3 ng/mL, dans le groupe hormonothérapie : 16 ± 5 ng/mL (moyenne ± écart-type), correspondant à une dimension d’effet mesurée avec le d = 4,46 de Cohen (effet très important).
pour le modèle dMF : animaux/groupe n=3, selon Gómez et al.19 indiquant après 2 semaines de traitement, les niveaux suivants : groupe témoin : 1,901 ± 0,413 ng/mL et groupe d’hormonothérapie : 0,043 ± 0,023 ng/mL (erreur type moyenne ±) correspondant à une dimension d’effet mesurée avec d = 6,35 de Cohen (effet très important). - Pour aligner les deux modèles, choisissez n=4 animaux par sexe/groupe, pour un total de N = 32 animaux.
- Le nombre calculé de rats/groupes est le suivant :
- Après 1 semaine d’acclimatation, répartir les rats par sexe en deux groupes expérimentaux (dMF et dFM, 4 rats/groupe), chacun composé d’un C (mâle témoin, CM et femelle témoin, CF) et de trois groupes de traitement du GAHT sélectionné.
- Surveillez tous les rats 2 fois par jour (à 8 h 30 et à 16 h) pour vérifier l’état de santé général et l’agressivité potentielle due à l’administration de GAHT. Enregistrez le poids corporel (p.c.) et la consommation d’aliments 2 fois par semaine, à l’aide d’une balance analytique avec la fonction de pondération dynamique optimale pour le poids des animaux de laboratoire.
- Dans le modèle expérimental dFM, mesurer le diamètre clitoridien de tous les rats immédiatement avant le début du traitement (point 0) et à la fin du traitement (point 13), à l’aide d’une jauge numérique pour des lectures de précision.
- Pesez tous les animaux avant le sacrifice et, dans le modèle dMF, retirez immédiatement après le sacrifice l’épididyme afin d’effectuer le comptage des spermatozoïdes.
2. Sélection et préparation de la dose
- Utilisez les trois doses d’hormones suivantes à administrer aux rats dFM : 5, 10,5 et 22,5 mg/kg par semaine, pour le modèle dMF, utilisez les trois niveaux de dose sélectionnés (DL) suivants : DL1 E2 0,045 mg/kg + CPA 0,2 mg/kg, DL2 E2 0,09 mg/kg + CPA 0,2 mg/kg et DL3 E2 0,18 mg/kg + CPA 0,2 mg/kg.
REMARQUE : Toutes les doses sont sélectionnées en tenant compte des principales directives cliniques humaines utilisées pour les personnes TG15 et des données limitées disponibles dans la littérature. - Préparez toutes les solutions mères chaque semaine à l’aide d’une hotte de sécurité chimique. Mélangez correctement toutes les substances dans l’huile de sésame en tant que véhicule, en assurant leur solubilisation complète.
REMARQUE : Pour les deux modèles, utilisez un calculateur de conversion de dose (https://dosecal.cftri.res.in/) pour entrer la dose à convertir, l’espèce pour laquelle la dose a été réglée, l’espèce animale et le poids pour lequel convertir la dose. Pour le modèle dFM (Tableau 3), hormonothérapie humaine, une dose maximale de 100 mg de T par semaine20. La dose calculée chez le rat est de 10,5 mg/kg de T par semaine. La deuxième dose est de 22,5 mg/kg par semaine chez le rat18. La troisième dose est de 5 mg/kg par semaine, identifiée en maintenant le facteur de 2,1 entre les deux doses calculées. Pour le modèle dMF, voir le tableau 4, les doses sont basées sur les schémas thérapeutiques recommandés pour les humains21 et les données disponibles dans le cadre d’études in vivo 14,19,22.
3. Traitement des animaux
- Effectuez l’administration sous-cutanée de T (pour le modèle dFM) et E2 plus CPA (pour le modèle dMF) en pinçant et soulevant la peau au site d’injection, formant une sorte de rideau. Ensuite, insérez l’aiguille d’une seringue de 1 mL parallèlement au dos de l’animal. Une fois à l’intérieur, injectez lentement le volume requis (100 μL pour T ; 200 μL pour E2+CPA)23.
- Traiter les animaux de la façon suivante : pour le modèle dFM, administrer le T énanthate dissous dans l’huile de sésame (véhicule) 2 fois/semaine pendant 2 semaines (100 μL pour chaque injection sous-cutanée de T). Pour le modèle dMF, administrer E2 plus l’acétate de CPA dissous dans de l’huile de sésame (véhicule) 5 fois/semaine pendant 2 semaines (200 μL pour chaque injection sous-cutanée). Traitez les rats du groupe C de la même manière avec le véhicule uniquement (huile de sésame).
4. Prélèvement sanguin, sacrifice et prélèvement de tissus
- Après 2 semaines de traitement, juste avant le sacrifice, utilisez un système d’anesthésie gazeuse et anesthésez tous les animaux. Induire l’anesthésie par une dose variant de 2 % à 3,5 % d’isoflurane dans 100 % d’oxygène à un débit de 1,5 L/min jusqu’à la perte des réflexes dans une chambre d’induction en polystyrène transparent. Placez le rat en position couchée sur le coussin chauffant et régulez la dose d’isoflurane à une dose d’entretien variant de 1,5 % à 3,5 % administrée par un masque nasal standard pour rats tout au long de la procédure de prélèvement sanguin intracardiaque.
- Préparez une seringue de 5 mL avec une aiguille de 21G, en éliminant le vide. En sondant le cœur avec les doigts, insérez soigneusement l’aiguille dans la paroi thoracique latérale perpendiculairement au corps à peu près au point des coudes fléchis, entre les côtes 5 et 6. Une fois à l’intérieur du ventricule cardiaque, le sang pénètre dans la seringue par capillarité. Rétractez le piston de la seringue lentement et continuellement jusqu’à ce que le sang prélève.
- Après le prélèvement sanguin, placez les rats dans la chambre de CO2 afin d’effectuer l’euthanasie par asphyxie au CO2 avec un taux de remplissage de 30 % à 70 % de déplacement du volume de la chambre par minute. Après 2-3 min, vérifiez la mort des animaux en surveillant la respiration et le rythme cardiaque24.
- Après le sacrifice, placez chaque animal sur la table de dissection en position couchée, les pattes avant vers le haut et les pattes arrière vers le bas, et fixez-les avec des épingles. Saupoudrez l’abdomen de l’animal d’une solution désinfectante.
- Exciser les organes suivants : testicules, épididyme, utérus, ovaires, foie et thyroïde. Pesez-les et conservez-les dans des tubes de 50 ml avec 35 ml de formol tamponné à 10 % (tous les organes) ou de solution de Bouin (testicules uniquement) ou collectez-les dans des tubes cryogéniques (un organe/tube) et congelez-les immédiatement dans de l’azote liquide (pour un stockage à -80 °C).
- Tout d’abord, coupez la peau avec des ciseaux sur la ligne médiane, du pubis au haut de l’abdomen. Faites deux coupes latérales sur la cage thoracique et réfléchissez la peau des deux côtés de l’incision pour exposer les viscères thoraciques.
- Retirez d’abord les organes reproducteurs ; Chez les rats mâles, retirer les testicules, organes appariés de forme ovale situés dans la cavité abdominale, en position intra-abdominale (sac scrotal). Coupez et appuyez sur le sac scrotal pour vous assurer que les testicules dépassent, puis saisissez-les doucement. Tenez la graisse viscérale avec une pince, puis coupez les testicules loin des viscères. Après l’excision, pesez et conservez les testicules dans la solution de Bouin pour une analyse histopathologique.
- Chez les rats femelles, saisissez d’abord délicatement l’utérus, puis coupez les ovaires (qui sont situés à l’extrémité des deux cornes utérines) du tissu adipeux viscéral. Après l’excision, pesez les ovaires.
- Chez les rats femelles et mâles, passez du côté droit de la cavité abdominale, où se trouve le foie. Le foie est un organe multilobulé et il est possible d’identifier de nombreuses parties : médiale gauche (plus petite), latérale gauche (majeure), médiale droite (plus petite), latérale droite (majeure), caudée et lobe carré25. Saisissez le foie avec une pince en prenant soin de ne pas le casser. Saisissez le processus xiphoïde avec une pince et coupez complètement le diaphragme avec des ciseaux.
- Utilisez des pinces pour soulever le processus xiphoïde et extraire le foie de la cavité abdominale. Séparez le foie du diaphragme avec des ciseaux. Après cela, pesez le foie et stockez-le.
- Pour l’extraction de la thyroïde, à l’aide de ciseaux, coupez perpendiculairement le long du cou de l’animal, retirez la peau et la musculature et coupez doucement les extrémités de la trachée, dans laquelle se trouve la glande thyroïde. Conservez la thyroïde pour une analyse plus approfondie26.
- Effectuez le comptage des spermatozoïdes comme décrit ci-dessous.
- Après l’ablation des testicules, saisissez l’épididyme, qui est attaché au bord postérieur du testicule respectif et contenu dans le scrotum.
- Dans cette expérience, des échantillons de sperme sont prélevés sur la queue de l’épididyme droit. Au moment du prélèvement, nettoyez la queue de la graisse et du tissu conjonctif à l’aide de ciseaux, séparez-la de la partie restante et placez-la dans une boîte de Pétri (35 mm x 10 mm) contenant 1 ml de DMEM. Couper aux ciseaux et couler à l’aide d’une pipette Pasteur pour faciliter la libération du contenu.
- Transférez tout le liquide obtenu dans un tube de 15 mL et portez le volume à 10 mL avec du DMEM (facteur de dilution 1:10=0,1). Pipeter le contenu pour homogénéiser et créer une suspension. Après une légère secousse, prélever 10 μL de suspension pour charger la chambre Neubauer. Chargez l’appareil photo et après 3 minutes de chargement de l’appareil photo, lancez le comptage.
5. Test immuno-enzymatique (ELISA)
- Prélever des échantillons de sang (environ 2 à 5 mL par animal) dans des tubes de 2 mL et les laisser coaguler à température ambiante pendant 1 h. Faites tourner tous les échantillons de sang dans une centrifugeuse 2x pendant 15 min à 4 °C et 3000 x g.
- Le sang centrifugé a un aspect multicouche avec trois couches de couleurs différentes. La couche supérieure est constituée de plasma (généralement jaune ou transparent), la partie liquide du sang ; la couche sous le plasma peut avoir une coloration blanchâtre ou grise et est la couche leucocytaire. La couche inférieure contient des globules rouges et la couleur peut apparaître rouge foncé ou rouge vif. Pour déterminer les taux d’hormones sexuelles, prélevez le sérum de tous les échantillons à l’aide d’une pipette (sans toucher la couche leucocytaire ou les couches érythrocytaires), divisez-les en aliquotes (500 μL) et conservez-les à -80 °C.
- Dans les deux modèles, effectuer un test ELISA pour détecter et/ou mesurer la présence de protéines, d’anticorps ou d’antigènes dans l’échantillon pour la détermination des hormones sexuelles. Utilisez la méthode directe et suivez les instructions de chaque kit ELISA. Dans cette étude, les taux sériques des hormones suivantes ont été déterminés chez le rat : E2, estradiol de rat ELISA ; T, souris/rat Testostérone Elisa ; TSH, Rat ELISA Kit et T4, Rat ELISA Kit.
6. Analyse histopathologique
- Préparer des lames histologiques de tissus selon les procédures suivantes.
- Fixez les échantillons de l’utérus, de l’ovaire, de la thyroïde et du foie au moment de l’extraction dans du formol tamponné à 10 % pendant au moins 48 h.
ATTENTION : Travailler sous une cagoule chimique. N’inhalez pas la substance/le mélange. Évitez de générer des vapeurs/aérosols. - Laver les échantillons à l’eau courante pendant 1 h, puis les stocker dans de l’alcool éthylique à 80 % (C2H5OH) jusqu’au traitement, afin de préserver la structure protoplasmique des altérations résultant de la mort cellulaire.
- Fixez les testicules dans la solution de Bouin composée de 15 mL de solution saturée d’acide picrique, 5 mL de formol concentré (33 % à 40 %) et 1 mL d’acide acétique glacial pendant 48 h. Laver les échantillons avec de l’alcool éthylique à 80 %.
ATTENTION : Travailler sous une cagoule chimique. - Effectuez l’inclusion dans de la paraffine solide à l’aide d’un processeur de tissu automatique. À la fin du processus d’inclusion, placez les échantillons dans de petits récipients métalliques dans lesquels de la paraffine fondue a été versée et refroidissez sur une plaque congelée, formant les blocs pour la coupe. Orientez-les en fonction de la section de coupe souhaitée.
- Après cela, coupez les échantillons à l’aide d’un microtome rotatif. Prélevez des coupes de 5 à 6 μm à l’aide de petits pinceaux, étalez-les dans de l’eau à 37 °C pendant quelques secondes et placez-les sur des lames de verre de microscope. Laissez les lames s’égoutter perpendiculairement pendant quelques minutes et séchez-les au four à 36 °C pendant au moins 1 h.
- Effectuez la coloration à l’hématoxyline et à l’éosine comme décrit ci-dessous.
- Déparaffiniser les lames en les trempant dans un agent nettoyant d’origine terpénique (substitut de xylène) pendant 5 min.
- Réhydratez les lames en les trempant dans la série suivante d’éthanol graué. Pour chaque solution, 2 min par trempette : 100 % d’éthanol, 95 % d’éthanol, 80 % d’éthanol, 50 % d’éthanol et de l’eau distillée.
REMARQUE : Il peut s’agir d’un point d’arrêt pour le protocole, et les lames peuvent être laissées à RT dans l’eau pendant plusieurs heures. En option, les lames peuvent également être stockées à 4 °C dans l’eau. - Placez les lames dans l’hématoxyline de Mayer pendant 5 min. Transférez-les immédiatement dans le récipient avec de l’eau du robinet pendant 5 min. Faites couler l’eau du robinet dans le coin arrière du récipient le plus éloigné des sections. Videz périodiquement le récipient jusqu’à ce que la coloration violette dans l’eau ne soit plus présente.
REMARQUE : Pour éviter que des sections ne se décollent des diapositives, ne faites pas couler de l’eau directement sur les lames. - Placez les lames dans la solution aqueuse d’éosine Y à 1 % pendant 2 min. Transférez les lames dans de l’eau distillée pendant 15 s. Déshydratez les lames en les trempant dans la série suivante d’éthanol graué. Pour chaque solution, 15 s par trempette : 50 % d’éthanol, 80 % d’éthanol, 95 % d’éthanol.
- Placez les lames dans 100 % d’éthanol pendant 1 minute et changez-les en 100 % d’éthanol frais pendant 1 minute supplémentaire. Placez les lames dans un agent nettoyant d’origine terpénique (substitut de xylène) pendant 2 min et changez-le en un agent nettoyant frais d’origine terpénique (substitut de xylène) pendant encore 2 min. Retirez une lame à la fois et placez une lamelle.
- Couvrez les sections avec un support de montage et placez une lamelle au bas de la diapositive.
REMARQUE : Assurez-vous que le support de montage tire la glissière en position. Si la lamelle n’est pas plate, tapotez-la doucement pour la mettre en place. Épongez tout excès de support de montage à l’aide d’une serviette en papier. - Trempez une lingette nettoyante dans l’agent nettoyant d’origine terpénique (substitut de xylène) et essuyez le dos de la lame pour éliminer tout milieu égoutté. Placez la diapositive à plat sur une surface solide mobile, comme un morceau de carton. Ajoutez une lamelle à toutes les lames restantes comme décrit à l’étape 6.7.6. Laissez les glissières sécher et le support de montage durcir à RT dans la hotte.
ATTENTION : Travailler sous une cagoule chimique.
- Après la coloration, recouvrez les échantillons d’une lamelle et évaluez-les à l’aide d’un microscope optique. Des changements histopathologiques ont été décrits en fonction de la distribution, de la gravité et des caractéristiques morphologiques.
- Évaluer les blessures de manière semi-quantitative, à l’aide d’une échelle d’évaluation de 5 points (de 0 à 4), en tenant compte de la gravité des changements en fonction de critères expliqués par Shackelford et coll.27 et résumés comme suit :
Grade 0 : aucun changement
Grade 1 : changement minimum. L’effet est à peine visible sur les tissus ; petit et peu fréquent. Affecte une partie du tissu inférieure ou égale à 10 %.
Grade 2 : changement de lumière. Représente un petit changement histologique. Ce grade est utilisé lorsque le tissu, ou sa structure, a montré un changement de volume entre 11 % et 20 %.
Grade 3 : changement modéré. Le changement est évident dans les tissus. Le degré indique la présence de variations entre 21 % et 40 % du tissu ou de sa structure
Grade 4 : changement marqué. Changement histologique écrasant du tissu ou de sa structure. Les variations affectent 41 % à 100 % des tissus. - Effectuer une analyse histomorphométrique quantitative sur l’utérus, l’ovaire, le testicule et la thyroïde. Examinez des coupes de tissus à l’aide d’un système d’analyse d’images appliqué à un microscope optique et suivez les étapes décrites ci-dessous.
- Utérus : À l’aide d’un objectif 2x, mesurez la surface totale de chaque section transversale de la corne utérine droite, du myomètre externe et interne et de la lumière utérine. Calculez l’aire de l’endomètre et du myomètre et le rapport entre l’aire de l’endomètre et le myomètre28.
- Ovaire : Utilisez l’une des sections entières en position centrale de l’ovaire pour révéler les follicules à différents stades de développement ; compter les follicules primaires, secondaires, du corps jaune, de Graaf et atrésiques à l’aide d’un objectif 4x. Effectuer la classification des follicules selon Fortune29. De plus, mesurez l’aire de l’ovaire pour chaque échantillon et sa densité folliculaire (nombre de follicules/surface de l’ovaire x 100)30.
- Testicule : À l’aide de l’objectif 10x, mesurez 20 tubules/échantillon ; De plus, mesurez la surface lumineuse totale, la surface totale, le diamètre longitudinal et le diamètre transversal28.
- Thyroïde : Mesurer les paramètres suivants : densité folliculaire (rapport entre le nombre de follicules et une zone donnée, objectif 10x) ; hauteur indirecte des cellules folliculaires (rapport moyen de la surface folliculaire et de la surface colloïdale dans cinq follicules choisis au hasard/échantillon objectif 40x) ; le rapport moyen entre les surfaces de l’épithélium folliculaire et le nombre de noyaux (dans le même follicule pour déterminer la maturation folliculaire) ; Hauteur des cellules folliculaires (moyenne de cinq cellules dans cinq follicules/échantillon choisis au hasard, 64x objectif)31.
7. Expression des gènes
- Pour les deux modèles, effectuez l’analyse de l’expression génique à l’aide d’échantillons de foie conservés à -80 °C. Suivez le protocole de purification totale de l’ARN à l’aide d’un kit, à partir d’un lysat de tissu animal.
- Pour obtenir le lysat hépatique, broyez l’échantillon de tissu (10 mg) avec un minipinner, ajoutez 600 μL de RL BUFFER (fourni avec le kit) à l’échantillon de tissu et continuez à broyer jusqu’à ce que l’échantillon soit homogénéisé.
- Immédiatement après l’extraction, quantifier l’ARN obtenu et évaluer sa qualité (pour la dénaturation ou la présence d’éventuels résidus protéiques) à l’aide d’un fluorospectromètre. Effectuez des lectures d’absorbance spectrophotométriques aux longueurs d’onde de 260 nm et 280 nm, où les acides nucléiques et les protéines absorbent respectivement.
- Après l’évaluation de la concentration totale d’ARN, à l’aide d’un kit de synthèse d’ADNc suivant les instructions du fabricant, transcrire à l’envers le volume approprié contenant 1 μg d’ARN total de chaque échantillon en ADNc.
- Analysez l’ADNc obtenu par RT-PCR.
- Pour analyser l’expression génique des gènes d’intérêt, des amorces directes et inverses spécifiques ont été conçues pour chaque gène cible, ainsi que pour le gène de référence glycéraldéhyde phosphate déshydrogénase exprimé constitutivement (GAPDH). Utilisez l’application web Primer-BLAST (www.ncbi.nlm.nih.gov/tools/primer-blast) pour choisir les meilleures amorces qui garantiraient la spécificité de l’appariement uniquement au gène d’intérêt et obtenir les oligonucléotides synthétisés par un fournisseur commercial. Les séquences des paires d’amorces utilisées sont présentées dans le tableau 5.
- Remettre en suspension les amorces lyophilisées avec de l’eau distillée exempte de RNAse à une concentration finale de 100 mM. Utilisez un kit dédié pour effectuer une analyse qPCR. Réaliser les réactions dans un volume final de 20 μL, en diluant l’ADNc recuit 1:40. Chargez chaque échantillon en double dans des plaques de PCR à 96 puits.
- Effectuez des cycles qPCR sur thermocycleur en suivant ce programme : 1 cycle à 95 °C pendant 10 min ; 40 cycles à 95 °C pendant 15 s, 58 °C pendant 30 s et 72 °C pendant 1 min. A la fin, effectuez un cycle de dissociation de 55°C à 95°C (30 s/°C) pour vérifier la spécificité du produit amplifié. À l’aide du logiciel dédié de la machine, obtenez des valeurs de cycle de seuil (Seuil de Cycle, Ct) pour chaque échantillon. Exprimer les résultats sous la forme ΔΔ Ct (delta delta Ct) selon la formule de Pfaffl32 :
Gène cible ΔCt = Contrôle Ct - Traité par Ct
Gène de référence ΔCt = Contrôle Ct - Traité par Ct
ΔCt = ΔCt Gène cible - ΔCt Gène de référence
8. Analyse des données
- Effectuez la gestion des données à l’aide d’un tableur. Effectuer des analyses à l’aide d’un logiciel d’analyse statistique. Concevez des graphiques à l’aide d’un logiciel spécifique.
- Représentent le gain de poids corporel, la consommation alimentaire, le poids absolu et relatif des organes, les taux sériques d’hormones, les données morphométriques tissulaires et les données d’expression génique sous forme de moyenne ± d’écart-type. Effectuer une analyse de Kruskal-Wallis non paramétrique, suivie de comparaisons par paires a posteriori (test de Mann-Whitney).
- Analysez les données histologiques à l’aide d’un test exact de Fisher à 2 voies pour identifier les différences significatives par rapport au groupe témoin, y compris les échantillons qui sont attribués à une catégorie sans aucune référence aux gradations de gravité (incidence totale des résultats). Utilisez le test de tendance de Cochran-Armitage pour identifier la tendance dose-réponse. Considérez les différences entre les groupes comme significatives si la valeur p est < 0,05.
Résultats
Comme l’ont démontré Tassinari et al.14 et Tammaro et al.33, les résultats suivants ont montré le succès de la GAHT sur les rats et la pertinence des modèles.
Aucune mortalité ou comportement anormal, tel que l’agressivité, n’est enregistré, et aucun signe clinique de toxicité ou de souffrance (par exemple, diminution de l’activité, piloérection et apparence non soignée) n’est observé14.
Les concentrations plasmatiques de T chez les rats mâles adultes et les rats femelles pendant l’œstrus et le proestrus sont de 5,71 ± 0,84 ng/ml et de 1,24 ± 0,29 et 0,80 ± 0,36 ng/ml, respectivement34. Le taux moyen circulant de T chez les rats gonadiques intacts est de 3,5 ± 0,5 ng/mL35. Les niveaux T et E2 mesurés chez les rats témoins dans les deux modèles se situaient dans la plage physiologique indiquée dans la littérature33. La plage physiologique d’E2 chez les rats femelles se situe entre 5 et 140 pg/mL36. La plage physiologique d’E2 chez les rats mâles se situe entre 2 et 175 pg/mL37.
Modèle dFM
Compte tenu de la variation du diamètre clitoridien, calculée comme la différence entre le diamètre mesuré le dernier jour (point 13) et le premier jour de traitement (point 0), le diamètre est augmenté dans tous les groupes de traitement (DL1 = 0,45 ; DL2 = 095 ; DL3 = 2,05 mg di T par administration) par rapport au groupe C (tableau 6).
Le gain en poids corporel est significatif dans les groupes DL2 et DL3 par rapport au groupe C ; La consommation d’aliments a considérablement augmenté dans le groupe DL3 par rapport au groupe C (figure 1).
Les taux sériques T ont augmenté dans tous les groupes de traitement, atteignant la plage du cisgenre correspondant (C MÂLE = MÂLE TÉMOIN) ; Les taux d’E2 ont diminué dans tous les groupes de traitement, atteignant la plage des cisgenres correspondants (figure 2).
Le poids absolu et relatif de l’ovaire a diminué dans les groupes DL2 et DL3 par rapport au groupe C (tableau 7 ; Figure 3), avec une diminution du poids absolu de l’utérus dans le groupe DL2 (tableau 7).
L’analyse histopathologique des ovaires dans le groupe DL3 a montré une augmentation significative dose-dépendante des vaisseaux hyperémiques par rapport au groupe C. Le groupe DL3 a montré une augmentation significative du nombre de follicules primaires et secondaires, et une diminution significative des follicules de Graaf par rapport au groupe C (tableau 8).
L’utérus présentait une augmentation des vaisseaux hyperémiques, de manière significative dans le groupe DL3. Les zones de lumière, les zones de myomètre, les zones d’endomètre et la hauteur de l’épithélium luminal sont réduites dans tous les groupes de traitement (tableau 8).
L’analyse de l’expression génique a montré une régulation à la hausse significative des gènes spécifiques au sexe masculin (Cyp2C11 ; Cyp3A18)17 dans les groupes DL2 et DL3 et une régulation négative significative du gène spécifique du sexe féminin (Cyp2C12)14 dans les groupes DL2 et DL3 par rapport au groupe C (Figure 4).
Modèle dMF
Aucun décès ou effet clinique indésirable n’a été enregistré pour le modèle dMF. Le nombre de spermatozoïdes est diminué en fonction de la dose et statistiquement dans tous les groupes de traitement (DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg E2 + CPA) par rapport au groupe C (Figure 5).
Le gain de poids corporel et la consommation alimentaire ont diminué de manière significative dans tous les groupes de traitement (DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg E2+CPA) par rapport au groupe C (figure 6).
Les taux sériques T sont significativement diminués, et les taux sériques E2 sont statistiquement augmentés dans tous les groupes de traitement (DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg E2 + CPA) par rapport au groupe C (Figure 7). Comme prévu, aucune différence n’est observée entre les taux sériques T des groupes de traitement et ceux du groupe C féminin.
Les taux sériques de TSH augmentent en fonction de la dose dans tous les groupes de traitement, de manière significative dans le groupe DL2 et avec une signification limite dans le groupe DL3 (p = 0,06) par rapport au groupe C (Figure 8).
Le poids absolu des testicules est significativement diminué dans tous les groupes de traitement (DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg E2 + CPA) par rapport à C ; aucune différence de poids relatif n’est observée entre les traitements et les groupes C (tableau 9).
La déplétion des cellules germinales et l’augmentation de la dégénérescence des tubules dans les testicules sont observées de manière dose-dépendante avec l’analyse histopathologique. (DL1, échantillon 1/4 : grade 1 ; DL2, échantillons 2/4 : grade 1 ; DL3, échantillons 2/4 : grade 1 plus échantillons 2/4 : grade 2) et diminution statistiquement significative de la surface de la lumière tubule dans le groupe DL3 par rapport au groupe C (tableau 10 ; Figure 9).
L’analyse histopathologique de la thyroïde a révélé une hypertrophie des cellules folliculaires avec des follicules centraux serrés et plus petits que la normale dans tous les groupes de traitement (DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg E2 + CPA) par rapport au groupe C (Figure 10). La densité folliculaire dans tous les groupes de traitement est considérablement augmentée avec une augmentation du nombre de follicules. Cependant, la dimension du follicule est diminuée avec la réduction de la surface du follicule et du colloïde dans tous les groupes de traitement par rapport au groupe C. La hauteur de la cellule t de l’épithélium et la surface des follicules ne sont pas affectées (tableau 10).
L’analyse de l’expression génique indique que Cyp2c11 (isoforme spécifique au mâle) est régulé à la baisse dans le groupe DL3 et que Cyp3a18 (isoforme à prédominance masculine) est significativement régulé à la baisse dans tous les groupes de traitement (Figure 11A,B). Cyp2c12 (isoforme spécifique à la femelle) est régulé à la hausse dans tous les groupes de traitement, statistiquement significatif dans DL1 et DL2 (Figure 11C), le Cyp2c6 (isoforme prédominante féminine) est significativement régulé à la hausse dans le groupe DL2 par rapport à C (Figure 11D).

Figure 1 : Données générales de toxicité dans le modèle déféminisant-masculinisant. (A) Prise de poids corporel de rats femelles Sprague-Dawley traités par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine pendant 2 semaines : C : 0-huile de sésame ; DL1 : 0,45 ; DL2 : 0,95 ; DL3 : 2,05 mg. (B) Consommation alimentaire de rats femelles Sprague-Dawley traités par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine, pendant 2 semaines : CF : 0-huile de sésame ; DL1 : 0,45 ; DL2 : 0,95 ; DL3 : 2,05 mg. Les données sont présentées sous forme de moyenne ± d’écart-type. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié au lieu de14. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Taux sériques d’hormones dans le modèle déféminisant-masculinisant (dFM). Évaluation biochimique des hormones par test ELISA de rats femelles Sprague-Dawley traités par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine, pendant 2 semaines : C : 0-huile de sésame ; DL1 : 0,45 ; DL2 : 0,95 ; DL3 : 2,05 mg et C MÂLE (mâle témoin) 0 mg. (A) testostérone, (B) œstradiol. Les données sont présentées sous forme de moyenne ± d’écart-type. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié au lieu de14. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Caractéristiques histopathologiques ovariennes. Ovaire de rats femelles Sprague-Dawley traités par voie sous-cutanée 2 fois par semaine pendant 2 semaines avec (A) du panel d’huile de sésame 0 et (B) 2,05 mg d’énanthate de testostérone. Barre d’échelle 10 μm (grossissement d’origine : 20x ; coloration à l’hématoxyline et à l’éosine). Ce chiffre a été modifié au lieu de14. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Expression génique dans le modèle féminisant-masculinisant. Analyse de l’expression génique des gènes (A) Cyp2c11 et Cyp3a18 spécifiques aux mâles et (B) des gènes Cyp2c6 et Cyp2c12 spécifiques aux femelles par PCR en temps réel dans des foies de rats femelles traités par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine, pendant 2 semaines : huile de sésame C 0, DL1 0,45, DL2 0,95 et DL3 2,05 mg. Les données sont présentées sous forme de valeurs moyennes de ΔΔCt ± d’écart-type, avec des échantillons de contrôle comme calibrateurs et GAPDH comme gène de référence. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié au lieu de14. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Nombre de spermatozoïdes. (A) Nombre de spermatozoïdes de rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol plus de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Les données sont présentées sous forme de moyenne ± d’écart-type. Signification statistique : * p < 0,05 Test de Mann-Whitney. (B) Des photos microscopiques claires du nombre de spermatozoïdes dans la chambre de Neubauer (grossissement initial 10x ; aire de 1/16 mm2). Cette figure a été modifiée de33. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Données générales sur la toxicité dans le modèle de démasculinisation-féminisation. (A) Gain de poids corporel (PC) chez des rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol et de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : témoin (C) : huile de sésame 0, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. (B) Consommation alimentaire. Les données sont présentées sous forme de moyenne ± d’écart-type. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié par rapport à33. Veuillez cliquer ici pour voir une version agrandie de cette figure.
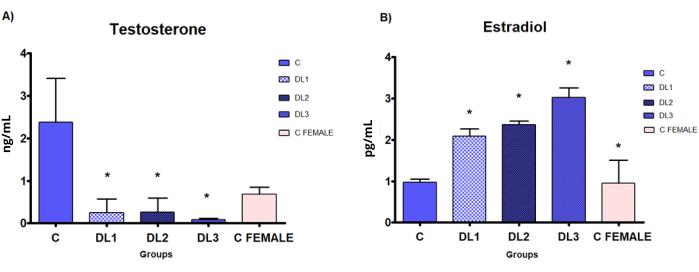
Figure 7 : Taux sériques d’hormones dans le modèle démasculinisant-féminisant. Évaluation biochimique des hormones par test ELISA chez des rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol et de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. (A) testostérone, (B) œstradiol. Les données sont présentées sous forme de moyenne ± d’écart-type. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié par rapport à33. Veuillez cliquer ici pour voir une version agrandie de cette figure.
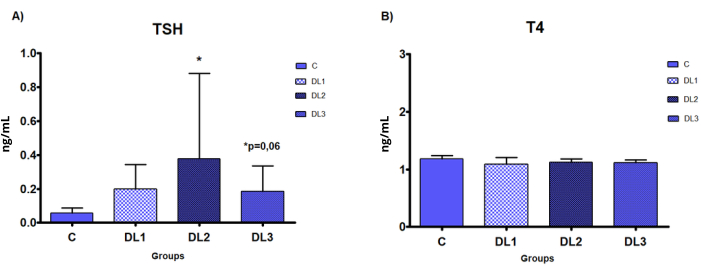
Figure 8 : Niveaux sériques de biomarqueurs thyroïdiens dans le modèle démasculinisant-féminisant. Évaluation biochimique des hormones par test ELISA chez des rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol et de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. (A) TSH, (B) T4. Les données sont présentées sous forme de moyenne ± d’écart-type. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié par rapport à33. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9 : Caractéristiques histopathologiques du testicule. Dégénérescence des tubules testiculaires avec appauvrissement des cellules germinales chez les rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol et de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : huile de sésame 0, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Barre d’échelle 10 μm (grossissement initial 10x ; coloration à l’hématoxyline et à l’éosine). Ce chiffre a été modifié par rapport à33. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : Caractéristiques histopathologiques de la thyroïde. Hypertrophie thyroïdienne chez les rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol et de l’acétate de cyprotérone 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Barre d’échelle 10 μm (grossissement d’origine 10x ; coloration à l’hématoxyline et à l’éosine). Ce chiffre a été modifié par rapport à33. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 11 : Expression génique dans le modèle démasculinisant-féminisant. Analyse de l’expression génique des gènes (A) spécifiques aux mâles Cyp2c11 ; (B) Cyp3a18 et (C) gènes spécifiques féminins Cyp2c12 et (D) Cyp2c6 par PCR en temps réel dans des foies de rats mâles traités par voie sous-cutanée avec différentes doses d’œstradiol plus d’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Les données sont présentées sous forme de valeurs moyennes de ΔΔCt ± d’écart-type, avec des échantillons de contrôle comme calibrateurs et GAPDH comme gène de référence. Signification statistique : * p < 0,05 Test de Mann-Whitney. Ce chiffre a été modifié au lieu de14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Hormonothérapie pour l’homme transgenre : voie d’administration, formulation et posologie Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Hormonothérapie pour les femmes transgenres : voie d’administration, formulation et posologie Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Doses hormonales du modèle déféminisant-masculinisant. Doses sélectionnées pour le modèle dFM chez des rats femelles Sprague-Dawley traités par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine pendant 2 semaines : Contrôle (C) huile de sésame 0 ; DL1 0,45, DL2 0,95 et DL3 2,05 mg. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Niveaux de dose d’hormones du modèle démasculinisant-féminisant. Doses choisies pour le modèle dMF chez des rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol et de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 5 : Apprêts avant et arrière. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 6 : Dimensions du clitoris. Variation du diamètre clitoridien observée en millimètres (mm) chez des rats femelles Sprague-Dawley lorsque différentes doses de testostérone énanthate 2x ont été administrées par voie sous-cutanée pendant une semaine pendant 2 semaines : C 0-huile de sésame ; DL1 0,45, DL2 0,95 et DL3 2,05 mg. Signification statistique : § p < 0,05 Test exact de Fisher ; # p < 0,05 tendance linéaire ; * p < 0,05 Test de Mann-Whitney. n : nombre. SD : écart-type. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 7 : Poids absolu et relatif de l’ovaire et de l’utérus. Poids absolu et relatif de l’ovaire et de l’utérus de rates femelles Sprague-Dawley traitées par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine pendant 2 semaines : C 0-huile de sésame, DL1 0,45, DL2 0,95 et DL3 2,05 mg. Signification statistique : § p < 0,05 Test exact de Fisher ; ## p < 0,01 tendance linéaire ; * p < 0,05 Test de Mann-Whitney. n : nombre. SD : écart-type. Ce tableau a été modifié au lieu de14. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 8 : Données histopathologiques du modèle déféminisant-masculinisant. Paramètres histopathologiques dans les organes cibles de rats femelles Sprague-Dawley traités par voie sous-cutanée avec différentes doses d’énanthate de testostérone 2 fois par semaine pendant 2 semaines : huile de sésame C 0, DL1 0,45, DL2 0,95 et DL3 2,05 mg. Signification statistique : § p < 0,05 Test exact de Fisher ; ## p < 0,01 tendance linéaire ; * p < 0,05 Test de Mann-Whitney. n : nombre. SD : écart-type. Ce tableau a été modifié au lieu de14. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 9 : Poids absolu et relatif des testicules. Poids absolu et relatif des testicules de rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol plus de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Signification statistique : * p < 0,05 Test de Mann-Whitney. N : numéro d’échantillon ; SD : écart-type. Ce tableau a été modifié par rapport à33. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 10 : Données histopathologiques du modèle démasculinisant-féminisant. Données histopathologiques des testicules et de la thyroïde de rats mâles Sprague-Dawley traités par voie sous-cutanée avec du valérate d’œstradiol plus de l’acétate de cyprotérone, 5 fois par semaine pendant 2 semaines : Contrôle (C) : 0-huile de sésame, DL1 : 0,045 + 0,2, DL2 : 0,09 + 0,2 et DL3 : 0,18 + 0,2 mg. Signification statistique : § p < 0,05 Test exact de Fisher ; ° p = 0,08, * p < 0,05 Test de Mann-Whitney ; ## p < 0,01 Test de tendance de Cochran-Armitage. N : numéro d’échantillon ; SD : écart-type. Ce tableau a été modifié par rapport à33. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
La mise en œuvre de modèles de rongeurs imitant la GAHT est cruciale pour étudier la susceptibilité et la vulnérabilité spécifiques potentielles des personnes TG et les résultats à long terme des thérapies, qui durent généralement toute leur vie.
Étant donné le faible nombre d’études similaires dans la littérature, le point critique de cette expérience est la sélection des doses pour établir les modèles ; Ces doses doivent être suffisamment faibles pour être compatibles avec une administration à long terme chez les animaux sans causer d’effets indésirables, de toxicité et/ou de mort. Un autre point critique est la meilleure voie d’administration à adopter, en tenant compte de la voie préférée chez l’homme. En effet, bien que dans le modèle dFM, le T soit administré selon la pratique clinique chez les hommes TG15Dans le modèle dMF, la voie d’administration ne chevauchait pas la pratique clinique chez les femmes TG15. D’autres expériences sont nécessaires pour établir une méthode plus fiable. En fait, les deux modèles de rats sont conçus pour imiter autant que possible les traitements humains. Ils fournissent des données essentielles sur l’impact des deux GAHT sur plusieurs fonctions de l’organisme, notamment la reproduction, l’homéostasie thyroïdienne et le métabolisme hépatique, comblant ainsi une partie de l’écart existant.
Plusieurs mesures supplémentaires peuvent être appliquées pour améliorer les deux modèles et les rendre encore plus robustes et transférables à l’homme. Par exemple, l’utilisation de l’administration sous-cutanée par l’implantation de réservoirs de polymères qui libèrent E2 ou T de manière quotidienne contrôlée, ce qui imite étroitement les patchs de libération d’hormones largement utilisés en milieu clinique aujourd’hui15. De plus, l’allongement de la durée du traitement peut mieux simuler l’exposition chronique des patients qui choisissent de subir des GAHT.
Une mention spéciale doit être faite concernant l’expression des CYP hépatiques spécifiques au sexe, qui sont utilisés pour évaluer le succès des thérapies. En fait, ce paramètre a été défini et développé pour la première fois dans le présent travail et représente un outil précieux pour confirmer la mise en œuvre des modèles.
Enfin, d’autres études sont nécessaires pour évaluer la réversibilité des perturbations de la reproduction dues à la GAHT afin d’améliorer la préservation de la fertilité des personnes TG qui décident d’avoir des enfants38.
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée sans aucune relation commerciale ou financière susceptible de créer un conflit d’intérêts.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| Analytical balance ABJ 320-4NM | Kern | Z741091 | |
| Bouin | Biooptica | 05-M01008 | |
| Centrifuge 5415 R | Eppendorf | For eppendorf | |
| Cyproterone Acetate | Sigma-Aldrich | C3412 | |
| D-MEM medium | Gibco | ||
| ExcelTaq 2X Fast Q-PCR Master Mix (SYBR, ROX), 200 RXN | Smobio | TQ1210 | |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| GraphPad Prism software version 5.0 for Windows | GraphPad Software | ||
| Hematoxylin | Biooptica | 05-06002/L | |
| Heosin | Biooptica | 05-10007/L | |
| Imaging Software | Nikon | NIS-BR | |
| JMP 10 statistical software | SAS Institute | ||
| Microm | Thermo Scientific | HM 325 | |
| Microscopy | Nikon Microphot FX | ||
| Mouse/Rat Testosterone ELISA | Biovendor | RTC001R | 96T |
| NanoDrop 1000 Spectrophotometer | Thermo Scientific | ND-1000 | |
| Paraffina | Biooptica | 087910 | |
| Portable Balances SCOUT STX2202 | OHAUS | 30253064 | |
| Primers | Life Technologies | Designed by PrimerBlast | |
| Rat Estradiol ELISA | Biovendor | RTC009R | 96T |
| Rat TSH(Thyroid Stimulating Hormone) ELISA Kit | ELK Biotechnology | ELK2283 | 96T |
| Rat TSH(Thyroid Stimulating Hormone) ELISA Kit | ELK Biotechnology | ELK2283 | 96T |
| SensiFASTcDNA Synthesis Kit | Bioline | BIO-65053 | 50 reaction |
| Sesam Oil | ACROS | AC241000010 | |
| Sprague Dawley rats male and female | Envigo | 8/9 weeks old | |
| Standard diets | Mucedola | 4RF18 | |
| T4(Thyroxine) ELISA Kit | ELK Biotechnology | ELK8716 | 96T |
| Testosterone enanthate | Sigma-Aldrich | T3006 | |
| Thermal Cycler LineGene 9600 Plus Bioer | Aurogene | ||
| Tissue processor | Shandon Excelsior ES, Thermo Scientific) | ||
| Total RNA purification KIT | Norgen | 17200 | 50 column |
| Victor 3 Multilabel reader | Perkin Elmer | ||
| β-Estradiol 17-valerate | Sigma-Aldrich | E1631 |
Références
- Rokach, A., Patel, K. . Human sexuality: Function, dysfunction, paraphilias, and relationships. , (2021).
- American Psychological Association. Guidelines for psychological practice with transgender and gender nonconforming people. Am Psychol. 70 (9), 832-864 (2015).
- Ammari, T., Sluiter, E. C., Gast, K., Kuzon, W. M. Female-to-male gender-affirming chest reconstruction surgery. Aesthet Surg J. 39 (2), 150-163 (2019).
- Garg, G., Elshimy, G., Marwaha, R. . Gender Dysphoria. , (2023).
- Chan, A. S. W., Wu, D., Lo, I. P. Y., Ho, J. M. C., Yan, E. Diversity and inclusion: Impacts on psychological wellbeing among lesbian, gay, bisexual, transgender, and queer communities. Front Psychol. 13, 726343 (2022).
- Unger, C. A. Hormone therapy for transgender patients. Transla Androl Urol. 5 (6), 877 (2016).
- Sofer, Y., et al. Gender‐affirming hormone therapy effect on cortisol levels in trans males and trans females. Clin Endocrinol. 100 (2), 164-169 (2024).
- Pirtea, P., Ayoubi, J. M., Desmedt, S. T. &. #. 8. 2. 1. 7. ;., Sjoen, G. Ovarian, breast, and metabolic changes induced by androgen treatment in transgender men. Fertil Steril. 116 (4), 936-942 (2021).
- Tassinari, R., Maranghi, F. Rodent model of gender-affirming hormone therapies as specific tool for identifying susceptibility and vulnerability of transgender people and future applications for risk assessment. Int J Environ Res Public Health. 18 (23), 12640 (2021).
- Schug, T. T., Janesick, A., Blumberg, B., Heindel, J. J. Endocrine disrupting chemicals and disease susceptibility. J Steroid Biochem Mol Biol. 127 (3-5), 204-215 (2011).
- van Larebeke, N., Fucic, A. . Challenges in endocrine disruptor toxicology and risk assessment. , (2020).
- You, H. H., Song, G. Review of endocrine disruptors on male and female reproductive systems. Comp Biochem Physiol C Toxicol Pharmacol. 244, 109002 (2021).
- Sifakis, S., Androutsopoulos, V. P., Tsatsakis, A. M., Spandidos, D. A. Human exposure to endocrine disrupting chemicals: effects on the male and female reproductive systems. Environ Toxicol Pharmacol. 51, 56-70 (2017).
- Tassinari, R., et al. Risk assessment of transgender people: Development of rodent models mimicking gender-affirming hormone therapies and identification of sex-dimorphic liver genes as novel biomarkers of sex transition. Cells. 12 (3), 474 (2023).
- T’Sjoen, G., Arcelus, J., Gooren, L., Klink, D. T., Tangpricha, V. Endocrinology of transgender medicine. Endo Rev. 40 (1), 97-117 (2019).
- Dhir, R. N., Shapiro, B. H. Interpulse growth hormone secretion in the episodic plasma profile causes the sex reversal of cytochrome P450s in senescent male rats. Proc Natl Acad Sci. 100 (25), 15224-15228 (2003).
- Robertson, G. R., Farrell, G. C., Liddle, C. Sexually dimorphic expression of rat CYP3A9 and CYP3A18 genes is regulated by growth hormone. Biochem Biophys Res Comm. 242 (1), 57-60 (1998).
- Kinnear, H., et al. A mouse model to investigate the impact of testosterone therapy on reproduction in transgender men. Human Reprod. 34 (10), 2009-2017 (2019).
- Gómez, &. #. 1. 9. 3. ;., et al. Effects of adult male rat feminization treatments on brain morphology and metabolomic profile. Hormones Behav. 125, 104839 (2020).
- T'Sjoen, G., et al. European society for sexual medicine position statement "Assessment and hormonal management in adolescent and adult trans people, with attention for sexual function and satisfaction". J Sex Med. 17 (4), 570-584 (2020).
- Coleman, E., et al. Standards of care for the health of transgender and gender diverse people, version 8. Int J Transgender Health. 23 (sup 1), S1-S259 (2022).
- Sudhakar, D., Huang, Z., Zietkowski, M., Powell, N., Fisher, A. R. Feminizing gender‐affirming hormone therapy for the transgender and gender diverse population: An overview of treatment modality, monitoring, and risks. Neurourol Urodynamics. 42 (5), 903-920 (2023).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Laboratory Animal Sci. 50 (5), 600-613 (2011).
- Hickman, D. L. Minimal exposure times for irreversible euthanasia with carbon dioxide in mice and rats. J Am Assoc Laboratory Animal Sci. 61 (3), 283-286 (2022).
- Vdoviaková, K., et al. Importance rat liver morphology and vasculature in surgical research. Med Sci Monit. 22, 4716 (2016).
- Fiette, L., Slaoui, M. Necropsy and sampling procedures in rodents. Methods Mol Biol. 691, 39-67 (2011).
- Shackelford, C., Long, G., Wolf, J., Okerberg, C., Herbert, R. Qualitative and quantitative analysis of nonneoplastic lesions in toxicology studies. Toxicol Pathol. 30 (1), 93-96 (2002).
- Tassinari, R., et al. short-term exposure to titanium dioxide nanoparticles in Sprague-Dawley rat: focus on reproductive and endocrine systems and spleen. Nanotoxicology. 8 (6), 654-662 (2014).
- Fortune, J. The early stages of follicular development: activation of primordial follicles and growth of preantral follicles. Animal Reprod Sci. 78 (3-4), 135-163 (2003).
- Maranghi, F., et al. Effects of the food contaminant semicarbazide following oral administration in juvenile Sprague-Dawley rats. Food Chem Toxicol. 47 (2), 472-479 (2009).
- Rasinger, J., et al. Low dose exposure to HBCD, CB-153 or TCDD induces histopathological and hormonal effects and changes in brain protein and gene expression in juvenile female BALB/c mice. Reprod Toxicol. 80, 105-116 (2018).
- Pfaffl, M. W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 29 (9), e45 (2001).
- Tammaro, A., et al. Risk assessment of transgender people: implementation of a demasculinizing–feminizing rodent model including the evaluation of thyroid homeostasis. Biology Direct. 19 (1), 5 (2024).
- Falvo, R. E., Kaltenbach, C. C., Pancoe, W. L. Determination of testosterone concentration in the plasma of normal and androgen-sterilized female rats, using a competitive protein binding technique. Neuroendocrinology. 10 (4), 229-234 (1972).
- Gibbs, R. B. Testosterone and estradiol produce different effects on cognitive performance in male rats. Horm Behav. 48 (3), 268-277 (2005).
- Ström, J. O., Theodorsson, A., Ingberg, E., Isaksson, I. M., Theodorsson, E. Ovariectomy and 17β-estradiol replacement in rats and mice: a visual demonstration. J Vis Exp. (64), e4013 (2012).
- Cooke, P. S., Nanjappa, M. K., Ko, C., Prins, G. S., Hess, R. A. Estrogens in male physiology. Physiol Rev. 97 (3), 995-1043 (2017).
- Raja, N. S., Rubin, E. S., Moravek, M. B. A Review of animal models investigating the reproductive effects of gender-affirming hormone therapy. J Clin Med. 13 (4), 1183 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon