Method Article
Visualisation tridimensionnelle assistée par ordinateur dans le traitement du cancer de la thyroïde localement avancé
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans le diagnostic et le traitement du cancer de la thyroïde localement avancé, l’application de la reconstruction tridimensionnelle assistée par ordinateur peut fournir des informations supplémentaires sur la portée de la tumeur et les caractéristiques anatomiques, aidant ainsi à l’évaluation des risques et à la planification chirurgicale.
Résumé
Le diagnostic et le traitement du carcinome thyroïdien localement avancé sont difficiles. Le défi réside dans l’évaluation de la portée de la tumeur et la formulation d’un plan de traitement individualisé. La visualisation tridimensionnelle (3D) a un large éventail d’applications dans le domaine de la médecine, bien qu’il y ait des applications limitées dans le cancer de la thyroïde. Nous avons précédemment appliqué la visualisation 3D pour le diagnostic et le traitement du cancer de la thyroïde. Grâce à la collecte de données, à la modélisation 3D et à l’évaluation préopératoire, nous pouvons obtenir des informations 3D concernant le contour de la tumeur, déterminer l’étendue de l’invasion tumorale et effectuer une préparation préopératoire adéquate et une évaluation des risques chirurgicaux. Cette étude visait à démontrer la faisabilité de la visualisation 3D dans le cancer de la thyroïde localement avancé. La visualisation 3D assistée par ordinateur peut être une méthode efficace pour une évaluation préopératoire précise, le développement de méthodes chirurgicales, la réduction de la durée de la chirurgie et la réduction des risques chirurgicaux. De plus, il peut contribuer à l’éducation médicale et à la communication médecin-patient. Nous croyons que l’application de la technologie de visualisation 3D peut améliorer les résultats et la qualité de vie des patients atteints d’un cancer de la thyroïde localement avancé.
Introduction
Le cancer de la thyroïde est la septième tumeur maligne la plus fréquente en Chine1, et la chirurgie est la méthode de traitement la plus importante 2,3. La résection complète de la tumeur est fortement associée à des taux de survie élevés et à une bonne qualité de vie chez les patients atteints d’un cancer de la thyroïde localement avancé 3,4 ; Cependant, ce type de résection est difficile. Le cou contient des organes et des tissus importants, tels que la trachée, l’œsophage et l’artère carotide commune. La résection d’un cancer avancé de la thyroïde est encore plus risquée et difficile compte tenu de la proximité de ces tumeurs avec des organes importants et de gros vaisseaux sanguins dans le cou et le médiastin 5,6. Ainsi, une évaluation préopératoire adéquate est nécessaire.
Actuellement, la tomodensitométrie (TDM), la résonance magnétique (IRM) et l’échographie Doppler couleur, qui sont largement utilisées dans les milieux cliniques, fournissent une vue bidimensionnelle (2D), ce qui limite l’évaluation du volume tumoral et des limites et des relations avec les structures environnantes importantes 7,8. Une expérience clinique substantielle et des essais et erreurs efficaces sont nécessaires avant que les chirurgiens puissent traduire des images 2D dans l’espace 3D. La visualisation 3D assistée par ordinateur peut utiliser l’imagerie 2D pour créer un modèle 3D plus intuitif qui peut être utilisé pour la planification préopératoire et la sélection du plan de traitement, rendant ainsi la communication médecin-patient plus intuitive et réduisant les désaccords médecin-patient. Bien que le modèle fournisse une visualisation 3D, il est intangible. Cette évaluation et cette préparation préopératoires guidées par 3D peuvent raccourcir le temps chirurgical et réduire les risques chirurgicaux. L’approche 3D a été largement utilisée en chirurgie hépatobiliaire, en orthopédie et en chirurgie buccale et maxillo-faciale 9,10. Dans le cancer de la thyroïde, la visualisation 3D est actuellement utilisée pour aider au diagnostic par ultrasons et à la formulation de plans chirurgicaux 11,12,13,14,15.
Par conséquent, nous pensons que la visualisation 3D peut être facilement appliquée au diagnostic et au traitement du cancer de la thyroïde localement avancé. Cette méthode de visualisation comprend l’acquisition par tomodensitométrie, la modélisation 3D assistée par ordinateur et l’évaluation préopératoire à l’aide de modèles 3D. Les modèles 3D peuvent être utilisés pour déterminer les difficultés chirurgicales, les risques chirurgicaux et l’état fonctionnel postopératoire potentiel. Les chirurgiens peuvent s’engager dans une communication détaillée entre le médecin et le patient, la formulation d’un plan chirurgical et la préparation chirurgicale correspondante16. De plus, cette méthode permet de fournir une évaluation préopératoire adéquate des patients, de réduire les risques chirurgicaux et d’améliorer la satisfaction des patients sans augmenter le traumatisme du patient.
Protocole
Ce protocole d’étude a été approuvé par le comité d’éthique de l’hôpital du cancer du Sichuan (date d’approbation : 27 septembre 2019). Toutes les procédures impliquant des participants humains ont été effectuées conformément aux normes éthiques des comités de recherche institutionnels et nationaux, ainsi qu’à la Déclaration d’Helsinki de 1964 et à ses amendements ultérieurs. Le consentement éclairé écrit de tous les patients a été obtenu avant la chirurgie.
1. Critères d’inclusion et d’exclusion
- Inclure les patients si (1) ils ont un cancer de la thyroïde confirmé pathologiquement et nécessitent un traitement chirurgical ; (2) ils ont une infiltration tumorale locale étendue, telle que T3-T4 (American Joint Committee on Cancer TNM stading, huitième édition), ou si des lésions métastatiques ont envahi des structures importantes telles que la trachée, l’œsophage et les gros vaisseaux ; (3) eux et les membres de leur famille se portent volontaires pour la visualisation 3D assistée par ordinateur ; et (4) ils n’avaient aucune contre-indication à l’anesthésie.
- Exclure les patients s’ils ne subissent pas de traitement chirurgical.
2. Acquisition d’images
- Obtenez des images TDM simples et améliorées (y compris les phases veineuse et artérielle) des patients à l’aide d’un système de TDM en spirale à 256 couches. Les paramètres de balayage sont les suivants : 120 kV, 120 mA, matrice 512 x 512, épaisseur de couche de 0,625 mm, seuil de 150 HU et délai de balayage artériel de 10 à 20 s.
- Obtenez les données de balayage du système CT au format DICOM.
3. Modélisation 3D assistée par ordinateur
- Importez les données dans le logiciel de visualisation 3D (Figure 1A).
- Cliquez sur le bouton Ouvrir pour sélectionner le document contenant les données du patient au format DICOM. Importez les données dans le logiciel.
- Traitez les données pour le lissage gaussien si les données d’origine contiennent beaucoup de bruit d’image (Figure 1B). Sélectionnez les données avec le bouton droit de la souris, puis cliquez sur le bouton Lissage gaussien .
- Reconstruisez individuellement différentes structures de la zone cible (poitrine et cou).
- Sélectionnez différents modèles (par exemple, peau et os) dans le logiciel en fonction de la structure à reconstruire (Figure 2A).
- Définissez la couleur, le seuil maximal et le seuil minimum en fonction de la structure reconstruite sur CT (Figure 2B). Définissez des seuils différents pour l’os et la peau. Ajustez les seuils supérieur et inférieur en fonction de l’effet de prévisualisation observé (Figure 2C).
- Cliquez sur le bouton Calcul pour terminer la reconstruction préliminaire du modèle 3D (Figure 2D).
- Modifiez les données segmentées.
- Une fois que les données de segmentation des structures telles que les vaisseaux sanguins, la peau et les os sont obtenues (figures 3A-C), utilisez le bouton Algorithme de lissage pour optimiser les données segmentées et vous assurer que les bords en dents de scie reconstruits correspondent au tissu réel.
- Ensuite, utilisez le bouton Navigation en un clic pour localiser les images 2D et 3D (Figure 3D) et déterminer si l’effet de segmentation était précis. Utilisez l’outil Plume ou Pinceau pour corriger les calques incorrects (Figure 3E).
NOTE : La modélisation 3D est réalisée après l’obtention des données de segmentation de toutes les structures.
4. Évaluation préopératoire
- Visualisez le modèle 3D et portez une attention particulière au volume et à l’emplacement de la tumeur et aux relations entre la tumeur et les tissus adjacents à l’aide des fonctions de grossissement, de rotation, de transparence tissulaire et de séparation et d’une combinaison de diverses structures. Par exemple, observez l’étendue de l’invasion tumorale dans l’artère carotide commune, l’œsophage et la trachée.
- Déterminer l’étendue de la résection chirurgicale, le degré de déficience fonctionnelle après la résection et le plan de traitement adjuvant postopératoire en fonction de l’évaluation du modèle 3D. Mettre en place une communication médecin-patient efficace et intuitive pour satisfaire les attentes du patient et expliquer le plan de traitement du chirurgien.
5. Intervention chirurgicale
- Enlever la tumeur selon le plan préopératoire et les observations peropératoires de la tumeur et des organes vitaux affectés.
- Effectuer une chirurgie de réduction tumorale avec marquage peropératoire pour un traitement adjuvant postopératoire en l’absence d’un plan de réparation.
- Réparer les défauts causés par la résection et effectuer une reconstruction fonctionnelle si nécessaire en fonction du plan opératoire et de la situation peropératoire.
Résultats
De décembre 2017 à juillet 2021, 23 patients atteints d’un cancer de la thyroïde localement avancé ont fait l’objet d’une modélisation 3D. Sur ces 23 patients, 4 ont été exclus de la chirurgie en raison des risques chirurgicaux, et les 19 autres patients ont été traités par chirurgie après modélisation 3D (tableau 1). Les 19 patients avaient tous un cancer de la thyroïde localement avancé, dont 14 pour lesquels il s’agissait du diagnostic initial, 16 qui présentaient des degrés divers de dyspnée et 18 qui avaient de grosses tumeurs dans le cou (tumeur primitive de la thyroïde ou ganglion lymphatique métastatique) qui avaient envahi les tissus environnants. L’évaluation pathologique postopératoire a révélé que 11 patients avaient un carcinome thyroïdien différencié, 2 un carcinome médullaire de la thyroïde, 5 un carcinome thyroïdien indifférencié ou peu différencié et 1 un carcinome papillaire de la thyroïde avec histiocytose à cellules de Langerhans. L’utilisation préopératoire de la modélisation 3D a facilité une communication efficace entre le médecin et le patient. Toutes les interventions chirurgicales ont été réalisées avec succès et toutes les récupérations postopératoires se sont déroulées sans heurts, sans décès périopératoire.
Comme décrit dans le rapport de cas dans la sous-section suivante, un modèle 3D présente des avantages distincts par rapport à la tomodensitométrie préopératoire et aux observations peropératoires pour déterminer les relations entre la tumeur et les vaisseaux sanguins, la trachée et l’œsophage. De plus, il fournit des informations précises sur la présence et l’étendue de l’invasion tumorale.
Exemple de présentation de cas
L’analyse cytologique d’une biopsie préopératoire par ponction d’un homme de 50 ans hospitalisé depuis 1 mois en raison d’une masse dans la fosse sus-claviculaire droite a suggéré un carcinome papillaire de la thyroïde. L’angiographie par tomodensitométrie a suggéré la fusion de plusieurs ganglions lymphatiques dans la fosse sternale supérieure, le médiastinum supérieur et la racine cervicale droite ; l’enveloppement de la veine brachiocéphalique droite et du segment inférieur de la veine jugulaire interne droite avec la tumeur ; rétrécissement local de la veine jugulaire interne droite ; déplacement et rétrécissement local de l’artère sous-clavière droite ; et la contiguïté de l’artère carotide commune droite à la tumeur, avec une atteinte vers le bas de la plèvre à partir de ce point.
Compte tenu du grand nombre de vaisseaux impliqués dans la tumeur, ce patient a choisi de commencer un traitement ciblé (chlorhydrate d’anlotinib). Un nouvel examen par angiographie par tomodensitométrie après sept cycles de traitement ciblé a révélé que, par rapport à la ligne de base, les multiples ganglions lymphatiques fusionnés dans la fosse sternale supérieure et le médiastin supérieur à la racine cervicale droite étaient devenus légèrement plus petits ; l’espace entre l’artère sous-clavière droite et l’artère carotide commune droite et la tumeur était devenu légèrement plus grand (Figure 4) ; et l’adhérence de la veine brachiocéphalique droite avait diminué.
À l’aide des données de tomodensitométrie, l’équipe chirurgicale a réalisé une modélisation 3D assistée par ordinateur (Figure 5). L’évaluation multidimensionnelle du modèle 3D a révélé que la tumeur avait envahi la veine jugulaire interne droite, qui devait être réséquée, et que l’ablation d’une partie de la paroi de la veine sous-clavière droite était nécessaire, la perméabilité étant maintenue par des sutures directes. Aucune invasion tumorale dans l’artère carotide commune droite ou le tronc brachiocéphalique n’a été observée. À la suite d’un traitement ciblé, l’artère sous-clavière droite est restée déplacée et a montré un envahissement tumoral persistant, ce qui signifie que cette artère présentait un risque de lésion peropératoire. Il a été déterminé qu’une réparation peropératoire de la paroi vasculaire ou une reconstruction vasculaire autologue pouvait être réalisée. Aucune invasion trachéale ou œsophagienne évidente n’a été observée.
Après une communication préopératoire adéquate, y compris en ce qui concerne le risque d’hémorragie peropératoire massive et de dysfonctionnement du membre supérieur droit, le patient a accepté de subir une intervention chirurgicale. La veine jugulaire interne droite a été excisée et une partie de la paroi de la veine brachiocéphalique droite a été enlevée lors de la chirurgie ; Le mur latéral a été réparé par la suite. En peropératoire, l’artère sous-clavière droite a été rompue et une réparation de pontage à l’aide de la veine jugulaire interne droite a été réalisée (Figure 6).
La pathologie postopératoire suggérait un carcinome papillaire avec métastases ganglionnaires (T3bN1bM0, stade I), exposant le patient à un risque élevé de récidive. Une inhibition postopératoire de l’hormone stimulant la thyroïde et un traitement à l’iode radioactif ont été recommandés. Après environ 1 mois, le gonflement postopératoire du membre supérieur droit a été résolu et l’artère sous-clavière droite est restée non obstruée.

Figure 1 : Importation des données. (A) Les données au format de fichier DICOM sont importées dans le logiciel de visualisation 3D en cliquant sur le bouton Ouvrir (flèche rouge). (B) Si les données d’origine contiennent beaucoup de bruit d’image, elles sont traitées dans le menu de droite du logiciel de lissage gaussien (flèche rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Reconstruction du logiciel. (A) La partie qui sera reconstruite via l’algorithme de seuil du module de reconstruction du logiciel est sélectionnée. (B) Le seuil maximum et le seuil minimum sont définis (dans la case rouge), ainsi que la couleur (flèche jaune). (C) Les seuils supérieur et inférieur sont ajustés (dans l’encadré rouge). (D) Cliquez sur le bouton Calcul (flèche rouge) pour terminer la reconstruction préliminaire du modèle 3D. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 3. Correction manuelle. (A-C) Les données de segmentation des structures, y compris (A) les vaisseaux sanguins, (B) la peau et (C) les os, sont obtenues. (D) Le bouton de navigation en un clic (dans la zone rouge) est utilisé pour localiser les images 2D et 3D (flèche jaune). (E) L’exactitude de l’effet de segmentation est examinée. De plus, l’outil Plume ou Pinceau (flèche jaune) est utilisé pour corriger les calques incorrects. Veuillez cliquer ici pour voir une version agrandie de cette figure.
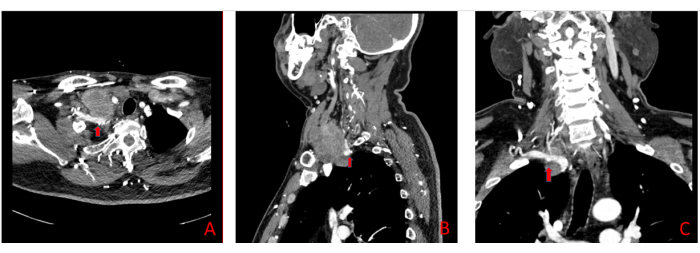
Figure 4 : Images tomodensitométriques de l’échantillon. TDM révélant que l’artère sous-clavière droite (flèche rouge) est probablement enveloppée d’une tumeur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
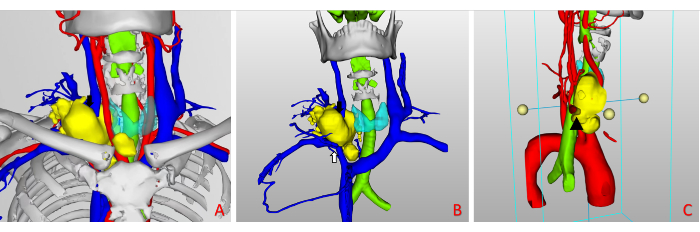
Figure 5 : Évaluation préopératoire. (A,B) Le modèle 3D révèle une tumeur enveloppant la veine jugulaire interne droite (flèche noire) et envahissant la paroi de la veine brachiocéphalique droite (flèche blanche). (C) L’artère sous-clavière droite reste envahie par la tumeur (indiquée par le symbole du triangle noir sur la figure 5C) ; Il n’y a pas d’invasion tumorale dans l’artère carotide commune droite ou le tronc brachiocéphale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
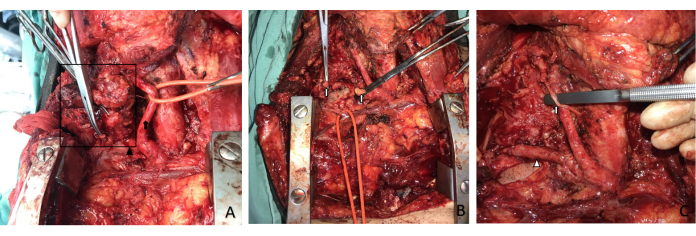
Figure 6 : Chirurgie. (A) L’artère carotide commune droite (flèche noire) est bien protégée, tandis que la veine jugulaire interne droite et l’artère sous-clavière (triangle noir) sont envahies par la tumeur (dans la boîte noire). (B) La veine jugulaire interne droite est excisée et une partie de la paroi de la veine brachiocéphalique droite est enlevée pendant la chirurgie. Une résection de la manche de l’artère sous-clavière droite est réalisée (flèche blanche). (C) Une réparation de pontage à l’aide de la veine jugulaire interne droite est réalisée (triangle blanc), tandis que le nerf laryngé récurrent droit est réparé à l’aide du nerf vague (flèche blanche). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Données démographiques et cliniques des 19 patients ayant subi une visualisation 3D. Abréviations : 3D = tridimensionnel ; PTC = carcinome papillaire de la thyroïde ; CSC = carcinome épidermoïde ; CMT = carcinome médullaire de la thyroïde ; PDTC = carcinome thyroïdien peu différencié ; FTC = carcinome folliculaire de la thyroïde. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Pour le carcinome différencié de la thyroïde (DTC) récidivant et métastatique, le traitement chirurgical est toujours privilégié17. Le taux de survie spécifique à 5 ans des patients ayant subi une résection DTC et R0 est de 94,4 %, ce qui est significativement plus élevé que celui des patients ayant subi une résection R1 (67,9 %)2. Le contrôle de la maladie dans le cou est crucial pour obtenir une meilleure qualité de vie et une survie spécifique à la maladie pour les patients4. Le carcinome médullaire de la thyroïde est principalement traité par chirurgie. Par conséquent, la résection tumorale complète est d’une grande importance dans le carcinome thyroïdien différencié et médullaire18.
Pour les patients présentant des symptômes évidents tels que la dyspnée et l’hémoptysie chez lesquels une résection complète est impossible, la chirurgie palliative locale peut entraîner des conditions optimales pour un traitement ultérieur12. Par conséquent, la chirurgie a de la valeur dans le cas d’une infiltration locale étendue du cancer de la thyroïde. Cependant, l’invasion de plusieurs structures importantes du cou, telles que la trachée, l’œsophage, l’artère carotide commune, etc., détermine le potentiel d’ablation complète de la tumeur ; qui peuvent ensuite être envisagées pour permettre une évaluation préopératoire adéquate du plan de traitement et de la qualité de vie postopératoire. Une évaluation préopératoire concernant la possibilité d’une tumeur résiduelle avant le traitement postopératoire aide également au contrôle de la tumeur5.
À l’heure actuelle, le cancer de la thyroïde localement avancé dans le cou est généralement évalué à l’aide d’une échographie couleur, d’une tomodensitométrie et d’une IRM, qui sont complétées par une fibrolaryngoscopie et une œsophagoscopie pour évaluer le degré d’atteinte intraluminale du larynx, de la trachée et de l’œsophage5. L’échographie couleur, la tomodensitométrie et l’IRM produisent des images 2D, qui sont limitées dans leur visualisation du volume et de l’invasion de la tumeur. L’évaluation de ces images 2D nécessite une formation et des compétences cliniques approfondies. Des limites et des incertitudes subsistent même lorsque ces images sont évaluées par des médecins spécialistes de l’imagerie et des chirurgiens expérimentés.
Le développement récent de la visualisation numérique 3D a été activement adopté en médecine, et la visualisation 3D est actuellement largement utilisée dans l’hépatocholangiolithiase, le cancer de la vésicule biliaire, le cancer de la tête pancréatique et les tumeurs rétropéritonéales10,19. Par rapport aux images 2D traditionnelles, un examen complet d’un modèle 3D utilisant la rotation et la transparence sélective pour révéler les tissus et les organes tumoraux permet de mieux comprendre les relations entre la tumeur et les tissus environnants. À l’aide d’un tel modèle 3D, un plan opératoire peut être formulé et mis en pratique, réduisant ainsi les saignements peropératoires, accélérant la préparation préopératoire et fournissant un traitement individualisé.
Un modèle 3D préopératoire peut aider à définir clairement l’étendue de la résection tissulaire peropératoire, toute tumeur résiduelle possible et la fonction probable des organes postopératoires, ce qui est avantageux pour la communication médecin-patient, ainsi que pour assurer le meilleur pronostic et la meilleure qualité de vie pour les patients. Par exemple, la dyspnée est un symptôme courant chez les patients atteints d’un cancer de la thyroïde localement avancé. La relation entre la dyspnée et l’invasion tumorale du nerf laryngé, du larynx et de la trachée récurrents doit être évaluée en préopératoire4. Les différences dans le degré d’invasion peuvent déterminer si une trachéotomie et une trachéotomie permanente sont nécessaires6. Différentes chirurgies affectent directement la prononciation postopératoire des patients, la qualité de la voix et le style de respiration20. L’évaluation préopératoire précise des limites tumorales peut aider à protéger la fonctionnalité de la parole et de la respiration tout en assurant une résection complète de la tumeur. Comme la tomodensitométrie ou l’IRM ne peuvent pas être utilisées pour juger efficacement de la profondeur d’envahissement de la paroi des voies respiratoires, un modèle 3D est un bon outil complémentaire pour ces modalités d’imagerie. Une blessure à l’artère carotide commune peut même entraîner la mort. Le modèle 3D peut démontrer la relation entre la tumeur et les vaisseaux. Sur la base de cette relation, la chirurgie peut être interrompue ou des vaisseaux sanguins artificiels peuvent être préparés.
Dans le cas d’un cancer de la thyroïde localement avancé, la visualisation 3D présente plusieurs avantages. Pour les patients nécessitant une réparation postopératoire de la trachée et de l’os, un modèle 3D est utile pour la simulation chirurgicale préopératoire, la fabrication de plaques de guidage chirurgicales peropératoires et la formulation de plans de réparation postopératoires. De plus, la visualisation 3D peut être utilisée avec la réalité virtuelle hybride et d’autres technologies pour la navigation peropératoire en temps réel, ce qui permet le chevauchement du modèle 3D avec l’anatomie réelle des patients.
Bien que la technologie de visualisation 3D montre des résultats cliniques prometteurs, certaines limites restent à surmonter. Le coût estimé de la modélisation 3D est d’environ 410 $ US. Différents éditeurs de logiciels peuvent facturer des frais légèrement différents, ce qui augmente les coûts pour les patients. De plus, il existe une courbe d’apprentissage dans la modélisation 3D. Actuellement, la visualisation 3D est basée sur des données obtenues à partir de technologies 2D, telles que la tomodensitométrie, l’IRM et l’échographie couleur. Lorsque le contraste entre une tumeur et les tissus environnants est inadéquat, les images de limite peuvent ne pas être suffisamment précises et certaines petites structures peuvent ne pas être clairement affichées.
En conclusion, la technologie de visualisation 3D est précieuse dans le diagnostic et le traitement du cancer de la thyroïde localement avancé, l’évaluation de la résécabilité tumorale et de la portée de l’invasion, la planification de la résection et de la réparation, et l’évaluation des dommages fonctionnels potentiels du patient. Cette technologie peut aider les patients à comprendre leur état et les risques chirurgicaux et le pronostic associés. De plus, cela peut raccourcir la courbe d’apprentissage pour les médecins en début de carrière. Cependant, la taille de l’échantillon dans la présente étude était petite et les résultats de suivi à long terme font défaut. Pour remédier aux limites de la technologie de visualisation 3D dans les applications cliniques, des recherches supplémentaires sont nécessaires.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs n’ont aucune reconnaissance.
matériels
| Name | Company | Catalog Number | Comments |
| Brilliance 256-layer spiral CT system | Philips Healthcare, Andover, MA, USA | N/A | Used for plain and enhanced CT imaging |
| 3D-Matic digital medical software application | Anhui King Star Digital S&T Co. Ltd. | N/A | Used for computer-aided 3D visualization reconstruction |
Références
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center. 2 (1), 1-9 (2022).
- Haugen, B. R., et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 26 (1), 1(2016).
- Haddad, R. I., et al. Thyroid carcinoma, Version 2.2022, NCCN Clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network: JNCCN. 20 (8), 925-951 (2022).
- Wang, L. Y., et al. Operative management of locally advanced, differentiated thyroid cancer. Surgery. 160 (3), 738-746 (2016).
- Shindo, M. L., et al. Management of invasive well-differentiated thyroid cancer: an American Head and Neck Society Consensus Statement. AHNS Consensus Statement. Head & Neck. 36 (10), 1379-1390 (2014).
- Li, X., Song, Q. Principles and strategies in surgical management of differentiated thyroid cancer invading upper areodigestive tracts. Chinese Journal of Otorhinolaryngology. Head and Neck Surgery. 52 (06), 478-480 (2017).
- Yamanaka, J., Saito, S., Fujimoto, J. Impact of preoperative planning using virtual segmental volumetry on liver resection for hepatocellular carcinoma. World Journal of Surgery. 31 (6), 1251-1257 (2007).
- Fang, C., et al. Efficacy of three dimensional visualization technique assisted hepatectomy for the treatment of primary liver cancer. Chinese Journal of Surgery. 53 (8), 574-579 (2015).
- Gong, Y., Mao, X., Yang, B., Jiang, Q., Yin, B. Application progress of digital medicine in orthopedic surgery. Chinese Journal of Joint Surgery (Electronic Edition). 2, 266-270 (2018).
- Study Group of Pancreatic Surgery in Chinese Society of Surgery of Chinese Medical Association, Pancreatic Committee of Chinese Research Hospital Association, Digital Medicine Branch of Chinese Medical Association, Digital Medicine Committee of Chinese Research Hospital Association. Expert consensus of precise diagnosis and treatment for pancreatic head cancer using three-dimensional visualization technology. Chinese Journal of Surgery. 55 (12), 881-886 (2017).
- Lyshchik, A., Drozd, V., Reiners, C. Accuracy of three-dimensional ultrasound for thyroid volume measurement in children and adolescents. Thyroid. 14 (2), 113-120 (2004).
- Yi, Y. S., et al. Comparison of two- and three-dimensional sonography for the prediction of the extrathyroidal extension of papillary thyroid carcinomas. Korean Journal of Internal Medicine. 31 (2), 313-322 (2016).
- Han, R. J., et al. Comparisons and combined application of two-dimensional and three-dimensional real-time shear wave elastography in diagnosis of thyroid nodules. Journal of Cancer. 10 (9), 1975-1984 (2019).
- Cai, N., et al. Application of thyroid three-dimensional reconstruction for endoscopic thyroidectomy. Journal of Laparoscopic Surgery. 17 (6), 408-411 (2012).
- Chen, Y. B., et al. Application of computer-aided design (CAD) and three-dimensional (3D) visualization technologies in the diagnosis and treatment of refractory thyroid tumors. Cancer Management and Research. 12, 6887-6894 (2020).
- Zanon, M., et al. Three-dimensional virtual planning for nodule resection in solid organs: A systematic review and meta-analysis. Surgical Oncology. 38, 101598(2021).
- Chinese Society of Clinical Oncology (CSCO) diagnosis and treatment guidelines for persistent/recurrent and metastatic differentiated thyroid cancer working group. Chinese Society of Clinical Oncology (CSCO) diagnosis and treatment guidelines for persistent/recurrent and metastatic differentiated thyroid cancer 2018 (English version). Chinese Journal of Cancer Research. 31 (1), 99-116 (2019).
- Chinese Thyroid Association, Chinese College of Surgeons, Chinese Medical Doctor Association, the Society of Thyroid Cancer of China Anti-Cancer Association, Chinese Research Hospital Association Thyroid Disease Committee. Expert consensus on the diagnosis and treatment of medullary thyroid carcinoma (2020 edition). Chinese Journal of Practical Surgery. 40 (9), 2012(2020).
- Chinese Society of Digital Medicine, Liver Cancer Committee of Chinese Medical Doctor Association, Clinical Precision Medicine Committee of Chinese Medical Doctor Association, Digital Intelligent Surgery Committee of Chinese Research Hospital Association. Clinical practice guidelines for precision diagnosis and treatment of complex liver tumor guided by three-dimensional visualization technology (version 2019). Journal of South Medical University. 40 (3), 297-307 (2020).
- Scharpf, J., et al. Comprehensive management of recurrent thyroid cancer: An American Head and Neck Society consensus statement: AHNS consensus statement. Head & Neck. 38 (12), 1862-1869 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon