Method Article
Absorption de dose de l’exposition aux composés à base de platine et de ruthénium chez le poisson-zèbre par spectrométrie de masse à plasma à couplage inductif avec des applications plus larges
Dans cet article
Résumé
L’augmentation du taux d’analyses pharmacocinétiques et toxicocinétiques des métaux et des composés à base de métaux chez le poisson-zèbre peut être avantageuse pour les études de traduction environnementales et cliniques. La limitation de l’absorption inconnue d’exposition à l’eau a été surmontée en effectuant une analyse des métaux traces sur les tissus digérés du poisson-zèbre à l’aide de la spectrométrie de masse plasmatique à couplage inductif.
Résumé
Les métaux et les composés à base de métaux comprennent de multiples xénobiotiques pharmaco-actifs et toxicologiques. De la toxicité des métaux lourds aux agents chimiothérapeutiques, la toxicocinétique de ces composés a une pertinence à la fois historique et moderne. Le poisson-zèbre est devenu un organisme modèle attrayant pour élucider la pharmacocinétique et la toxicocinétique dans les études d’exposition environnementale et de traduction clinique. Bien que les études sur le poisson-zèbre aient l’avantage d’être plus performantes que les modèles de rongeurs, le modèle comporte plusieurs contraintes importantes.
L’une de ces limitations est inhérente au schéma posologique à base d’eau. Les concentrations d’eau de ces études ne peuvent pas être extrapolées pour fournir des dosages internes fiables. Les mesures directes des composés à base de métaux permettent une meilleure corrélation avec les réponses moléculaires et biologiques liées aux composés. Pour surmonter cette limitation pour les métaux et les composés à base de métaux, une technique a été développée pour digérer le tissu larvaire du poisson zèbre après exposition et quantifier les concentrations de métaux dans les échantillons de tissus par spectrométrie de masse plasmatique à couplage inductif (ICPMS).
Les méthodes ICPMS ont été utilisées pour déterminer les concentrations métalliques de platine (Pt) du cisplatine et du ruthénium (Ru) à partir de plusieurs nouveaux agents chimiothérapeutiques à base de Ru dans les tissus du poisson-zèbre. De plus, ce protocole distinguait les concentrations de Pt qui étaient séquestrées dans le chorion de la larve par rapport au tissu du poisson-zèbre. Ces résultats indiquent que cette méthode peut être appliquée pour quantifier la dose de métal présente dans les tissus larvaires. En outre, cette méthode peut être ajustée pour identifier des métaux ou des composés à base de métaux spécifiques dans un large éventail d’études d’exposition et de dosage.
Introduction
Les métaux et les composés à base de métaux continuent d’avoir une pertinence pharmacologique et toxicologique. La prévalence de l’exposition aux métaux lourds et son impact sur la santé ont augmenté de façon exponentielle les recherches scientifiques depuis les années 1960 et ont atteint un niveau record en 2021. Les concentrations de métaux lourds dans l’eau potable, la pollution atmosphérique et l’exposition professionnelle dépassent les limites réglementaires mondiales et demeurent un problème pour l’arsenic, le cadmium, le mercure, le chrome, le plomb et d’autres métaux. De nouvelles méthodes pour quantifier l’exposition environnementale et analyser le développement pathologique continuent d’être très demandées 1,2,3.
Inversement, le domaine médical a exploité les propriétés physiochimiques de divers métaux pour le traitement clinique. Les médicaments à base de métaux ou les médicaments à base de métaux ont une riche histoire d’usages médicinaux et ont montré une activité contre une gamme de maladies, avec le plus grand succès que les agents chimiothérapeutiques4. Le plus célèbre des métallodicaments, le cisplatine, est un médicament anticancéreux à base de Pt considéré par l’Organisation mondiale de la santé (OMS) comme l’un des médicaments essentiels au monde5. En 2010, le cisplatine et ses dérivés Pt ont eu un taux de réussite allant jusqu’à 90% dans plusieurs cancers et ont été utilisés dans environ 50% des schémas de chimiothérapie 6,7,8. Bien que les agents chimiothérapeutiques à base de Pt aient eu un succès irréfutable, la toxicité limitant la dose a mis en branle des études sur des médicaments alternatifs à base de métaux avec une administration et une activité biologiques raffinées. Parmi ces alternatives, les composés à base de Ru sont devenus lesplus populaires 9,10,11,12.
De nouveaux modèles et de nouvelles méthodes sont nécessaires pour suivre le rythme des besoins en matière d’études pharmacocinétiques et toxicocinétiques sur les métaux. Le modèle du poisson-zèbre se situe à l’intersection de la complexité et du débit, étant un vertébré à haute fécondité avec 70% d’homologie génétique conservée13. Ce modèle a été un atout en pharmacologie et en toxicologie, avec des criblages approfondis pour divers composés pour la découverte de plomb, l’identification de cibles et l’activité mécaniste 14,15,16,17. Cependant, le criblage à haut débit des produits chimiques repose généralement sur des expositions à l’eau. Étant donné que l’absorption peut varier en fonction des propriétés physicochimiques du composé en solution (c.-à-d. photodégradation, solubilité), cela peut constituer une limitation majeure de la corrélation entre l’administration de la dose et la réponse.
Pour surmonter cette limitation de la comparaison de la dose aux vertébrés plus élevés, une méthodologie a été conçue pour analyser les concentrations de métaux traces dans le tissu larvaire du poisson-zèbre. Ici, les courbes dose-réponse des critères d’évaluation létaux et sublétaux ont été évaluées pour le cisplatine et de nouveaux composés anticancéreux à base de Ru. La létalité et l’éclosion retardée ont été évaluées pour des concentrations nominales de 0, 3,75, 7,5, 15, 30 et 60 mg/L de cisplatine. L’accumulation de Pt dans le tissu de l’organisme a été déterminée par l’analyse ICPMS, et l’absorption par l’organisme des doses respectives était de 0,05, 8,7, 23,5, 59,9, 193,2 et 461,9 ng (Pt) par organisme. De plus, les larves de poisson zèbre ont été exposées à 0, 3,1, 6,2, 9,2, 12,4 mg/L de PMC79. Ces concentrations ont été déterminées analytiquement pour contenir 0, 0,17, 0,44, 0,66 et 0,76 mg/L de Ru. Ce protocole a également permis de distinguer les concentrations de Pt séquestré dans le chorion des larves par rapport au tissu du poisson zèbre. Cette méthodologie a permis de fournir des données fiables et robustes pour comparer l’activité pharmacocinétique et toxicocinétique entre un agent chimiothérapeutique bien établi et un nouveau composé. Cette méthode peut être appliquée à une large gamme de métaux et de composés à base de métaux.
Protocole
La souche AB de poisson-zèbre (Danio rerio) a été utilisée pour toutes les expériences (voir la table des matériaux), et le protocole d’élevage (#08-025) a été approuvé par le Rutgers University Animal Care and Facilities Committee.
1. Élevage de poisson-zèbre
- Élever et maintenir le poisson-zèbre dans un système d’habitat aquatique en recirculation sur un cycle de lumière:10 h d’obscurité de 14 h.
- Purifier l’eau du robinet municipale par filtration au sable et au carbone pour obtenir de l’eau du système de pêche. Maintenir l’eau du système aquatique à 28 °C, <0,05 ppm de nitrite, <0,2 ppm d’ammoniac et pH entre 7,2 et 7,7.
- Nourrissez le poisson-zèbre avec un régime de kystes Artemia éclos, de crevettes en saumure et de flocons de poisson.
2. Protocole dose-réponse du poisson-zèbre (Figure 1)
- Préparer une solution d’eau d’œuf de poisson zèbre, soit un milieu E3, soit de l’eau d’œuf à base de sel de mer de stock à une concentration de 60 μg/mL dissoute dans de l’eau désionisée18. Évitez l’utilisation de bleu de méthylène.
REMARQUE: Grâce à l’ICPMS, une interférence isobare de l’eau d’œuf de poisson zèbre a été identifiée pour les oxydes de strontium, qui se chevauchaient avec un isotope du ruthénium. Un rinçage minutieux des larves avant l’analyse en aval a amélioré ce problème. Le milieu E3 peut être un choix plus facile pour certains en raison de la composition exclusive des sels de mer commerciaux. - Dissoudre le métal ou les composés à base de métal dans de l’E3 ou de l’eau d’œuf. Vortex pour briser tout matériau d’agrégat et homogénéiser la solution.
REMARQUE: Dans l’expérience décrite ci-dessous, le PMC79 et le cisplatine ont été dissous à des concentrations maximales de 12,4 mg / L et 60 mg / L avec une concentration maximale de 0,5% de diméthylsulfoxyde (DMSO) pour résister à la précipitation.- Diluer les métaux lourds ou les composés à base de métaux, tels que le PMC79 et le cisplatine, avec de l’E3 ou de l’eau d’œuf, en préparant au moins 5 doses de concentration.
- Commencez par de faibles concentrations de solutions mères dans un véhicule pur (c.-à-d. DMSO), puis diluez avec de l’E3 ou de l’eau d’œuf. Examinez attentivement les concentrations finales du véhicule.
REMARQUE: Certains composés à base de métaux, tels que le cisplatine, se dégradent rapidement et leurs solutions doivent être fraîches quotidiennement. ATTENTION : Manipulez les métaux lourds et les agents chimiothérapeutiques avec soin. Examinez la fiche signalétique (FS) spécifique pour le métal d’intérêt. Le cisplatine peut provoquer une irritation des yeux et de la peau, être mortel s’il est avalé et peut entraîner une toxicité dans les reins, le sang, les organes hématopoïétiques et les tissus fœtaux. Évitez de respirer des vapeurs et le contact avec les yeux, la peau et les vêtements. Portez des gants et des vêtements imperméables, ainsi que des lunettes de sécurité ou des lunettesde protection 19.
- Commencez par de faibles concentrations de solutions mères dans un véhicule pur (c.-à-d. DMSO), puis diluez avec de l’E3 ou de l’eau d’œuf. Examinez attentivement les concentrations finales du véhicule.
- Diluer les métaux lourds ou les composés à base de métaux, tels que le PMC79 et le cisplatine, avec de l’E3 ou de l’eau d’œuf, en préparant au moins 5 doses de concentration.
- Installez des bassins de reproduction l’après-midi avant l’expérience dans le rapport idéal de 2 femelles pour 1 mâle avec un diviseur en place entre les sexes20.
- Tirez sur le séparateur lorsque les lumières s’allument pour le cycle du matin.
- Laissez le poisson-zèbre se reproduire.
REMARQUE: La durée de la reproduction dépend du stade d’exposition initial requis. Pendant 3 h après la postfertilisation, permettre la reproduction pendant environ 2 h. Les œufs atteindront 3 HPF après le nettoyage et la ségrégation des œufs. - Déplacez le poisson reproducteur dans un aquarium propre.
- Recueillez les œufs en versant l’eau du réservoir à travers une passoire.
- Inverser la passoire au-dessus d’une boîte de Pétri et utiliser un flacon de gicleurs rempli d’E3 ou d’eau d’œuf pour rincer les œufs dans le plat.
- Nettoyez le plat de la nourriture et des déchets avant l’utilisation expérimentale.
- Randomiser environ vingt embryons de 3 HPF par dose dans des flacons de verre individuels à l’aide d’une pipette de transfert et d’une petite quantité d’eau.
- Une fois que tous les embryons sont dans des flacons, retirez toute l’eau d’œuf et remplacez-la par une solution posologique suffisante pour qu’il y ait environ 1 pouce de solution au-dessus de la hauteur de l’œuf.
REMARQUE: La nécessité de la déséchorionation doit être soigneusement examinée. Voir la section de discussion pour plus de détails. - Observez quotidiennement les embryons pour détecter les lésions ou la létalité. En raison du développement rapide du poisson-zèbre embryonnaire, obtenez des images quotidiennes à l’aide de n’importe quelle configuration de microscope / caméra à fond clair pour identifier les lésions mineures entre les jours.
- À la fin de la dose-réponse (4 à 5 jours après la fécondation [dpf], conformément à la ligne directrice21 de l’Organisation de coopération et de développement économiques [OCDE],), mélanger 3 à 5 larves avant l’euthanasie pour un échantillonnage composite. Euthanasier par refroidissement rapide par congélation instantanée dans de l’azote liquide.
REMARQUE: L’euthanasie par surdosage de MS-222 ou de méthanesulfonate de tricaïne peut potentiellement interférer avec l’analyse ICPMS en aval. Les méthodes d’euthanasie à refroidissement rapide sont encouragées pour ce protocole afin de réduire la possibilité d’interférence. - Effectuez 3 lavages de tissu avec de l’eau de haute pureté (comme l’osmose inverse) pour éliminer l’excès de composé de l’extérieur du tissu.
- Déplacez les échantillons dans des tubes centrifuges en polypropylène de 15 mL résistants aux acides et aux micro-ondes. Veillez à éliminer tout excès d’eau car tout liquide restant peut diluer l’acide nitrique et, par conséquent, le potentiel oxydant de l’acide lors de la dégradation des tissus.
REMARQUE: À ce stade, les tissus peuvent être conservés à -20 °C jusqu’à une analyse plus approfondie. Pour les métaux naturellement abondants, le nettoyage des tubes dans un bain d’acide nitrique à 5% avant utilisation améliorera les niveaux de fond ambiant.
3. Digestion des tissus et évaluation de l’ICPMS (Figure 2)
- Ajouter environ 0,25 mL aux tubes centrifuges en polypropylène de 15 mL pour un maximum de 10 larves (~100 μg) d’acide nitrique de haute pureté (69 %). Ultrasons pendant 1 h pour prédigérer les échantillons en utilisant les paramètres suivants: sortie de bain à ultrasons: 85 W; 42 kHz ± 6 %; plage de température: 19-27 °C.
ATTENTION : Portez une protection auditive pendant la sonication. L’acide nitrique provoque de graves brûlures des voies respiratoires, des yeux et de la peau. Portez un équipement de protection complet et travaillez dans la hotte ou dans des endroits suffisamment ventilés. Il peut être inflammable avec d’autres matériaux. L’acide nitrique doit être manipulé exclusivement dans une hotte pour éviter l’exposition aux vapeurs produites pendant la digestion. Ne pas inhaler ou ingérer.- Effectuer de courts cycles de digestion des tissus (intervalles de 5 minutes) dans un digesteur à micro-ondes sans danger pour les acides jusqu’à ce que tous les tissus soient visiblement oxydés (c.-à-d. solution uniforme jaune clair).
REMARQUE: Le protocole micro-ondes du tableau 1 est recommandé d’être effectué trois fois et comprend un intervalle de refroidissement de 5 minutes entre chaque étape de chauffage. - Surveillez attentivement l’intégrité des tubes pour éviter la rupture et effectuez de courtes rotations dans la centrifugeuse (313 × g pendant 1 min) entre les cycles pour déplacer la condensation acide vers le fond du tube.
REMARQUE: Si le tissu est difficile à digérer (en particulier les chorions), 30% de peroxyde d’hydrogène de haute pureté peut être utilisé après la digestion acide. Utilisez le peroxyde d’hydrogène (6,75 mL) pour diluer la concentration d’acide à 3,5 % et laissez les échantillons reposer toute la nuit dans une hotte aspirante. Le peroxyde d’hydrogène se décompose en H2O et convient à l’analyse ICPMS. De plus, les métaux de remplacement peuvent mieux se dissoudre dans l’acide chlorhydrique ou un mélange d’acide chlorhydrique et d’acide nitrique (c.-à-d. aqua regia). Le peroxyde d’hydrogène est nocif s’il est avalé et cause de graves lésions oculaires. Portez une protection de la peau et des yeux22,23.
- Effectuer de courts cycles de digestion des tissus (intervalles de 5 minutes) dans un digesteur à micro-ondes sans danger pour les acides jusqu’à ce que tous les tissus soient visiblement oxydés (c.-à-d. solution uniforme jaune clair).
- Une fois que le tissu est visiblement oxydé (c.-à-d. solution uniforme et jaune clair), diluer les échantillons dans une hotte à 3,5 % d’acide nitrique à l’aide de 6,75 mL d’eau de haute pureté et de vortex pour bien mélanger.
REMARQUE: À ce stade, les échantillons peuvent être conservés à température ambiante. Cette étape n’est pas nécessaire si du peroxyde d’hydrogène a été ajouté pour faciliter la digestion à l’étape 3.1. - Effectuer une courbe d’étalonnage en 7 points appariée par matrice (plage de concentration de 0,001 à 10 ppb) à l’aide d’un étalon élémentaire certifié (c.-à-d. Pt ou Ru, selon le dosage) avec le métal d’intérêt et les isotopes optimaux pour tenir compte de toute interférence isobare potentielle.
- En utilisant une concentration en stock de l’étalon élémentaire aqueux certifié (Ru, Pt = 1000 ppb), prenez une aliquote de 0,1 mL et pipetez dans un nouveau tube de centrifugeuse de 15 mL. Diluer avec de l’acide nitrique à 3,5 % jusqu’à un volume final de 10 mL pour produire une solution étalon à 10 ppb.
- À l’aide de la crosse de 10 ppb, effectuer les dilutions en série suivantes : solutions étalons de 0,1, 1,0 et 5,0 ppb dans de l’acide nitrique à 3,5 %.
- À l’aide de la crosse 0,1, effectuer les dilutions en série suivantes : 0,001, 0,005 et 0,01 ppb dans des solutions étalons à 3,5 % d’acide nitrique.
- Préparer l’instrument ICPMS (voir le Tableau des matériaux) pour l’analyse des échantillons comme suit:
- Avant de démarrer l’instrument, assurez-vous que la vanne de gaz Argon est ouverte, que tous les tubes sont bien connectés et que l’acide nitrique propre à 5% est ouvert pour rincer les tubes et la verrerie entre les analyses d’échantillons.
- Vérifiez l’état de la torche et des cônes, et assurez-vous que la boîte de torche est bien verrouillée et que le tube de drainage de la chambre de pulvérisation est correctement connecté à la péripompe.
- Ouvrez le logiciel (voir la table des matériaux).
- Vérifiez les lectures de vide et assurez-vous que toutes les turbopompes fonctionnent à 100%.
- Cliquez sur DÉMARRER dans la fenêtre État du système de contrôle du plasma pour lancer la séquence de démarrage, allumer la pompe à plasma, le refroidisseur de plasma, purger le nébuliseur et allumer le plasma. Attendez que le plasma soit allumé et stable lorsque la fenêtre d’état indique que la séquence de démarrage est terminée. À ce stade, observez les points verts de la fenêtre État du système qui indiquent que tous les blocs d’alimentation sont allumés.
- Dans la barre de menus, cliquez sur Contrôler |'échantillonneur automatique dans le menu déroulant. Entrez dans la position du rack d’échantillonneur automatique pour le tube contenant 5% d’acide nitrique. Laissez l’acide pénétrer dans le plasma.
- Dans la barre de menus, cliquez sur Scans | Aimant dans le menu déroulant. Dans la fenêtre MagnetScan , tapez 115 dans la position de masse du marqueur et cliquez sur Entrée. Laissez l’aimant balayer sur toute la plage de masse pendant 115po (114,6083 à 115,3749) pendant 30 minutes pendant que l’instrument se réchauffe.
- Après 30 minutes, utilisez la commande d’échantillonneur automatique pour passer à la position d’une solution de réglage multi-éléments de 1 ppb. Aspirez la solution d’accord et accordez l’instrument pour optimiser la lecture du signal. Réglez la position de la torche (X, Y, Z) de manière à ce que la torche soit alignée avec le centre des cônes et le débit du nébuliseur (~ 30 psi) dans la fenêtre de contrôle Plasma . Effectuez les ajustements nécessaires dans la fenêtre Réglage de l’optique ionique pour la source, le détecteur et l’analyseur.
- Une fois la lecture du signal optimisée (~1,2 × 106 comptes/s pour 1 ppb sur 115In), cliquez sur Arrêter dans la fenêtre Magnet Scan .
- Cliquez sur Calibrer l’aimant et sélectionnez Basse résolution dans la fenêtre contextuelle.
- Cliquez sur OK et ouvrez le fichier « Étalonnage de masse (basse résolution).smc » pour calibrer l’aimant.
REMARQUE: L’étalonnage de l’aimant mesurera les nombres / s et ajustera une courbe à travers la plage de masse suivante: 7Li à 238U. - Cliquez sur Enregistrer | Permet d’appliquer l’étalonnage actuel de l’aimant aux analyses. Si vous mesurez des échantillons inconnus avec une vaste gamme de concentrations, effectuez un étalonnage de détecteur pour comparer les signaux de comptage d’impulsions ioniques à de faibles concentrations aux signaux ioniques atténués produits à des concentrations plus élevées. Analysez les échantillons une fois le réglage et l’étalonnage terminés.
- Dans la barre de menus, cliquez sur Acquisition de données.
- Cliquez sur Configuration de la méthode dans le menu déroulant. Utilisez une méthode existante fournie par le fabricant ou créez une méthode basée sur les éléments d’intérêt. Si nécessaire, ajustez le mode d’analyse, le temps d’arrêt, le délai de commutation, le nombre de balayages/cycles, la résolution, le mode de détection et la masse de stationnement pour les réglages du déflecteur.
- Cliquez sur Enregistrer pour enregistrer les paramètres de la méthode. Optimisez les paramètres pour chaque métal et isotope. Voir le tableau 2 pour les paramètres de fonctionnement spécifiques utilisés dans cette étude.
- Dans la barre de menus, cliquez sur Acquisition de données.
- Cliquez sur Batch Run dans le menu déroulant. Vous pouvez également cliquer sur l’icône BATCH sous la barre de menus. Importez les paramètres de lot à partir d’une feuille de calcul ou créez une séquence dans la fenêtre Exécution par lots . Entrez le type d’échantillon, la position du rack d’échantillonneur automatique, le temps de transfert, le temps de lavage, les répliques, l’ID d’échantillon et le fichier de méthode.
- Organisez le traitement du lot dans l’ordre suivant : solutions étalons pour la courbe d’étalonnage (0,001-10 ppb Pt ou Ru), suivies d’une norme de contrôle de la qualité, puis d’échantillons inconnus.
REMARQUE : Les solutions standard sont mesurées en nombre(s) sur l’ICPMS, et une régression linéaire est ajustée à travers les normes avec un écart type relatif (DSR) > 0,999. Les inconnues sont également mesurées en nombre/s et résolues pour la concentration en ppb à l’aide de la régression linéaire de la courbe d’étalonnage, y = mx + b. Le traitement des données peut également être effectué à l’aide du logiciel référencé. - Surveiller la dérive de l’instrument et la reproductibilité des échantillons en incluant une norme de contrôle de la qualité de 0,5 ppb tous les 5 à 10 échantillons.
REMARQUE: Les normes de contrôle de la qualité appropriées doivent être un matériau de référence étalon certifié différent de l’étalon utilisé dans la courbe d’étalonnage.
| Watts | Pouvoir | Compte-rendu |
| 300 | 50% | 5 |
| 300 | 75% | 5 |
| 300 | 0% | 5 |
| 300 | 75% | 5 |
Tableau 1 : Protocole de digestion par micro-ondes pour la masse tissulaire larvaire. Des échantillons larvaires de poisson-zèbre ont été digérés dans 0,25 mL d’acide nitrique. Ce tableau a été modifié par rapport à 24.
Résultats
Ces résultats ont déjà été publiés24. Des études sur l’absorption tissulaire ont été menées avec des expositions à base d’eau de cisplatine et d’un nouveau composé anticancéreux à base de Ru, PMC79. La létalité et l’éclosion retardée ont été évaluées pour les concentrations nominales de cisplatine 0, 3,75, 7,5, 15, 30 et 60 mg/L de cisplatine. L’accumulation de Pt dans le tissu de l’organisme a été déterminée par l’analyse icPMS, et le tissu de l’organisme contenait des doses respectives de 0,05, 8,7, 23,5, 59,9, 193,2 et 461,9 ng (Pt) par organisme (figure 3). La détermination analytique des concentrations nominales de cisplatine n’a pas été évaluée, compte tenu de la stabilité connue du cisplatine.
Un retard d’éclosion a été observé à toutes les concentrations de cisplatine. Des expériences supplémentaires ont été menées pour les concentrations de Pt avec et sans décchorionation manuelle. Après la décchorionation, les chorions ont été collectés et analysés séparément pour pt. Les doses non létales de cisplatine utilisées pour les études de déchorionation ont déterminé que 93 à 96 % de la dose totale de cisplatine administrée s’était accumulée dans le chorion avec la dose restante dans le tissu larvaire (figure 4).
Les larves de poisson zèbre ont été exposées à 0, 3,1, 6,2, 9,2, 12,4 mg/L de PMC79. Ces doses ont été choisies en déterminant les dérivés d’une CI50, comme décrit précédemment16. Ces concentrations ont été déterminées analytiquement pour contenir 0, 0,17, 0,44, 0,66 et 0,76 mg/L de Ru. Contrairement à la courbe dose-réponse du cisplatine, aucun retard d’éclosion n’a été observé chez les larves exposées au PMC79. Les chorions n’ont pas été inclus dans l’analyse du ruthénium car ils se sont naturellement dégradés avant la collecte larvaire. Les chercheurs peuvent inclure l’analyse des chorions sans éclosion retardée en déchorionant et en collectant des chorions à 24 dpf. La masse de métal dans les tissus larvaires analysée à chaque concentration était de 0,19, 0,41 et 0,68 ng (Ru) par larve (figure 5). Un résumé des paramètres toxicologiques, y compris les concentrations létales et/ou les doses pour 50 % de la population (CL50/DL50), les concentrations efficaces ou les doses pour 50 % des populations (EC50/ED50) et la dose la plus faible pour effet nocif observé (DLSL) se trouve dans le tableau 3.
| Cisplatine | PMC79 | |||||
| Nominal (mg/L) | μM | Pt (ng) / organisme | Ru analytique (mg/L) | μM | Ru (ng) / organisme | |
| LC50/LD50 | 31 (IC à 95 % : 20,5-34,0) | 158 (IC à 95 % : 105-174) | 193 (± 130) | 0,79 (IC à 95 % : 0,43-1,20) | 7,8 (IC à 95 % : 4,2-11,8) | NA |
| CE50 | 4.6 | 12.5 | NA | NA | NA | NA |
| LOAEL | 3.75 | 15.3 | 8,7 (± 4) | 0.17 | 1.7 | 0,19 (± 0,05) |
Tableau 3 : Détermination de l’absorption de la solution et de la métallofose associée aux paramètres toxicologiques. La DL50 a été déterminée par une analyse en équivalent métal du Pt et du Ru pour le cisplatine et le PMC79, respectivement. Les concentrations de CL50 pour le PMC79 ont été déterminées analytiquement. Toutefois, aucune détermination analytique des concentrations nominales de cisplatine n’a été effectuée; compte tenu de la stabilité connue du cisplatine en solution, on a supposé que les concentrations nominales et mesurées en solution seraient équivalentes. Le critère d’évaluation de l’éclosion retardée pour l’exposition au cisplatine a été évalué en termes deDE 50 et de LOAEL. Les concentrations de PMC79 dans la LELU ont été déterminées analytiquement. La LELU comprenait des lésions telles qu’une hémorragie le long de la veine caudale et de l’artère caudale de la queue, une courbure de la colonne vertébrale et un œdème du sac vitellin. Tous les intervalles de confiance à 95 % ont été calculés à l’aide de la méthode de Wilcoxon de Litchfield. Ce tableau a été modifié par rapport à 24. Abréviations : IC = intervalle de confiance; CL50 = Concentration létale pour 50 % de la population; DL50 = Dose létale pour 50 % de la population; EC50 = Concentration effective pour 50 % de la population; LOAEL = niveau d’effet indésirable observé le plus bas.

Figure 1 : Protocole dose-réponse du poisson-zèbre. Ce protocole utilise une approche modifiée adaptée du FET de l’OCDE. Fabriqué avec Biorender. Abréviation : OCDE = Organisation de coopération et de développement économiques; FET = toxicité aiguë de l’embryon de poisson. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 2 : Digestion des tissus et évaluation de l’ICPMS. Le protocole de digestion est efficace pour digérer un échantillon composite de larves de poisson zèbre. Abréviation : ICPMS = spectrométrie de masse à plasma à couplage inductif. Créé avec Biorender. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Dose-réponse au cisplatine. (A) Pourcentage moyen d’éclosion retardée à 5 dpf corrélé aux équivalents Pt moyens déterminés par organisme. (B) Pourcentage de létalité moyenne à 5 dpf corrélée aux équivalents Pt moyens par organisme. Moyenne en pourcentage : N = 40 par dose. Pt (ng) par organisme : >4 échantillons composites par dose. Deux répliques expérimentales ont été réalisées, dont les gammes sont affichées. Ce chiffre a été modifié par rapport à 24. Abréviation : dpf = jours après la fécondation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Comparaison du Pt (ng) présent dans les larves et le chorion après exposition à 7,5 ou 15 mg/L. Larves ou chorions composites >3 par échantillon; de gauche à droite N = 13, 10, 10 et 11. Les barres d’erreur représentent l’écart-type. Le test de somme de rang de Mann-Whitney P < 0,001 entre les larves et le chorion pour les deux doses. Ce chiffre a été modifié par rapport à 24. Veuillez cliquer ici pour voir une version agrandie de cette figure.
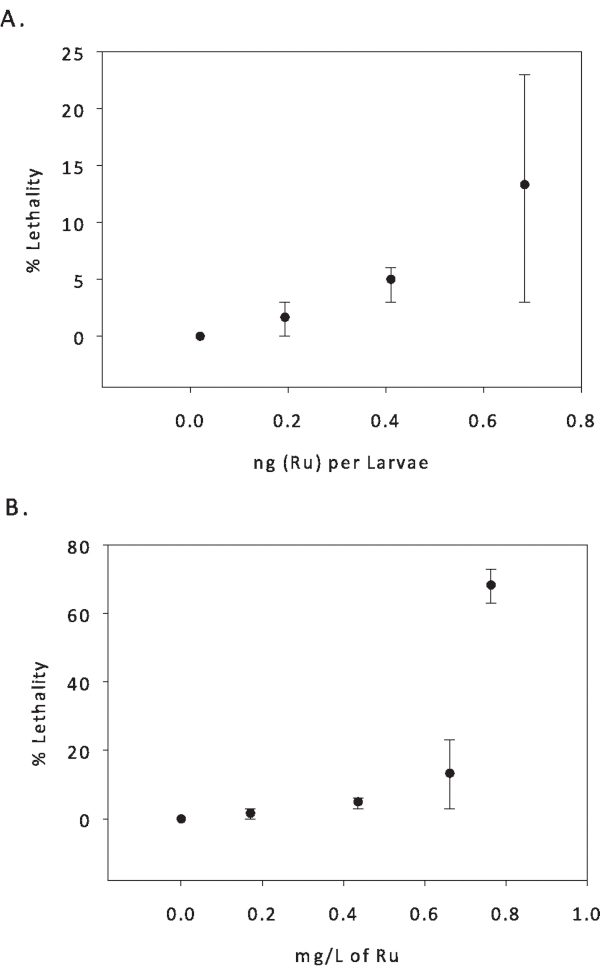
Figure 5 : Dose-réponse de PMC79. (A) La létalité moyenne en pourcentage a été corrélée aux équivalents Ru moyens déterminés analytiquement en solution (mg/L). (B) La létalité moyenne en pourcentage à 5 jours après la fécondation de la même expérience a été corrélée aux équivalents Ru moyens par larve. Létalité : N = 40 par dose. Ru (mg/L) : N = 6 échantillons composites par dose. Ru (ng) par larve >4 échantillons composites par dose. Deux répliques expérimentales ont été réalisées, dont les gammes sont affichées. Ce chiffre a été modifié par rapport à 24. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Temps de séjour par pic | 4 ms |
| Délai de commutation / crête (x10micros) | 2 |
| Nombre de balayages | 350 |
| Nombre de cycles | 1 |
| Résolution de l’instrument | 300 |
| Mode de détection | Atténué, Saut de déflecteur |
| Messe du parc | 98.90594 |
| Élément (isotopes) | Pt (192, 194, 195, 196), Ru (99, 100, 101, 102) Sr (84) |
Tableau 2 : Paramètres de la méthode ICPMS. Paramètres d’analyse des isotopes Pt et Ru pour déterminer les concentrations tissulaires de cisplatine et de PMC79, respectivement. Sr a été inclus pour surveiller les interférences isobares associées à la composition de l’eau du réservoir. Ce tableau a été modifié par rapport à 24. ICPMS = spectrométrie de masse à plasma à couplage inductif.
Discussion
Le protocole décrit ici a été mis en œuvre pour déterminer l’administration et l’absorption de médicaments anticancéreux à base de métal contenant du Pt ou du Ru. Bien que ces méthodes aient déjà été publiées, ce protocole traite de considérations et de détails importants pour adapter cette méthodologie à une gamme de composés. Le protocole de l’OCDE, associé à la digestion des tissus et à l’analyse ICPMS, nous a permis de déterminer que le PMC79 était plus puissant que le cisplatine et entraînait une accumulation tissulaire disparate, suggérant des mécanismes distincts. De plus, comme la dose délivrée de cisplatine a été quantifiée, les résultats dose-réponse ont été extrapolés aux populations de patients. Les doses sublétales (p. ex. LOAEL) étaient comparables aux concentrations posologiques intraveineuses chez les patients24.
Bien que cette méthode puisse être appliquée à un large spectre de métaux et de composés à base de métaux, une étude minutieuse des propriétés physicochimiques de l’analyte doit être prise en considération. Les composés à base de métal peuvent être très difficiles à dissoudre, et divers véhicules peuvent être utilisés pour éviter cela. Les concentrations dans les véhicules, comme le DMSO, devront peut-être être à des concentrations plus élevées que celles recommandées dans le protocole de l’OCDE. À ce titre, il est important de maintenir une dose non toxique en surveillant de près l’élaboration des témoins; le balancement continu des embryons pendant l’exposition atténue les précipitations. De plus, les composés organométalliques peuvent ne pas être stables en solution aqueuse. Si le processus de dégradation est inconnu, des études impliquant un renouvellement de la solution de 24 heures peuvent être envisagées ou comparées à des courbes dose-réponse sans renouvellement.
Il est recommandé de suivre l’Essai de toxicité aiguë sur les embryons (FET) numéro 23621 de l’OCDE. Cependant, des modifications peuvent être apportées pour répondre à des objectifs spécifiques. Les récipients en verre évitent de confondre les variables toxicologiques, telles que le plastique et les plastifiants, et n’adsorbent pas les métaux aussi fortement, ce qui éliminerait les analytes de l’eau des œufs. Pour les composés qui se photodégradent, comme le cisplatine, il peut être bénéfique de mener l’exposition sans cycle de lumière.
Il y a beaucoup de discussions dans la littérature concernant la nécessité de la décection dans les études dose-réponse du poisson-zèbre 25,26,27. Les arguments en faveur de la déséchorionation à 24 hpf suggèrent que le chorion limite la perméabilité des composés, générant ainsi des résultats faussement négatifs ou des courbes dose-réponse augmentées. Bien que ces points aient du mérite, mener des études sans déschorionation peut fournir un aperçu mécaniste. Ces études suggèrent que le cisplatine s’accumule dans le chorion des embryons en raison de son activité alkylante (Figure 2). Les adduits qui en résultent renforcent la structure, ce qui retarde l’éclosion. Cependant, le PMC79 et d’autres médicaments anticancéreux à base de Ru n’ont pas causé ce phénomène27. Bien que de nombreux agents chimiothérapeutiques adoptent leur activité anticancéreuse par alkylation, l’absence d’éclosion retardée après l’exposition au PMC79 indiquait un mécanisme disparate. Les études avec ou sans déchorionation doivent être soigneusement examinées ou menées en parallèle.
La digestion des tissus en aval et l’analyse ICPMS doivent être prises en compte en permanence. Il est suggéré d’éviter d’utiliser des réactifs pouvant causer des interférences isobares et de mettre en œuvre des méthodes alternatives. Les réactifs utilisés au cours des études dose-réponse peuvent avoir un impact ou réagir avec l’acide nitrique et son potentiel oxydant ou contribuer à des interférences isobares. Il a été découvert que la solution saline utilisée pour fabriquer l’eau d’œuf générait des oxydes de strontium (Sr), qui se chevauchaient avec un isotope spécifique de Ru24. Réduire les concentrations de sel ou nettoyer soigneusement les larves peut améliorer ce problème. Pour ces raisons, il est suggéré d’éviter le bleu de méthylène antimicrobien ou l’agent euthanasiant, la tricaïne. Au lieu de cela, autoclavez et aérez ensuite l’eau de l’œuf pour éliminer les microbes ou euthanasier les larves par refroidissement rapide. Il est important à cette étape d’obtenir des courbes isotopiques standard linéaires avec des interférences isobares minimales pour l’analyte d’intérêt.
Une limitation importante de ce protocole est que les composés organométalliques seront oxydés de telle sorte que seul le métal reste. En tant que tel, les études de métabolisme ne peuvent pas être menées. Bien que le protocole puisse être considéré comme à débit moyen, la partie dose-réponse peut être accélérée à l’aide de systèmes automatiques d’administration de produits chimiques et d’imagerie. Ce protocole est une méthodologie naissante qui peut être modifiée et affinée pour un large éventail de composés métalliques et à base de métaux pour les études pharmaco- et toxicocinétiques.
Déclarations de divulgation
Il n’y a aucun conflit d’intérêts à divulguer par l’un des auteurs.
Remerciements
Financement : NJAES-Rutgers NJ01201, NIEHS Training Grant T32-ES 007148, NIH-NIEHS P30 ES005022. De plus, Brittany Karas est soutenue par la bourse de formation T32NS115700 du NINDS, NIH. Les auteurs remercient Andreia Valente et la Fondation portugaise pour la science et la technologie (Fundação para a Ciência e Tecnologia, FCT; PTDC/QUI-QIN/28662/2017) pour la fourniture de PMC79.
matériels
| Name | Company | Catalog Number | Comments |
| AB Strain Zebrafish (Danio reri) | Zebrafish International Resource Center | Wild-Type AB | Wild-Type AB Zebrafish |
| ACS Grade Nitric Acid | VWR BDH Chemicals | BDH3130-2.5LP | Nitric Acid (68-70%); used to make 10% HNO3 acid-bath solution for soaking/pre-celaning centrifuge tubes |
| Aquatox Fish Diet (Flake) | Zeigler Bros, Inc. | Flake food to be mixed in a 1:4 ratio of Aquatox Fish Diet to TetraMin Tropical Flakes and used as feed | |
| Artemia cysts, brine shrimp | PentairAES | BS90 | Brine shrimp eggs sold in 15-ozz, vacuum-packed cans to be hatched and used as feed |
| ASX-510 Autosampler for ICPMS | Teledyne CETAC | Automatic sampler with conifgurable XYZ movement, flowing rinse station, and 0.3 mm inner dimension probe. Compatible with Nu AttoLab software for programmable batch analyses. | |
| Centrifuge | Thermo Scientific | CL 2 | Thermo Scientific CL 2 compact benchtop centrifuge with variable speed range up to 5200 rpm; used to bring sample and acid condensate to the bottom of the centrifuge tube bewteen microwave digestion intervals; aids in sample retention |
| Centrifuge tubes | VWR | 21008-105 | Ultra high performance polypropylene centrifuge tubes with flat cap; 15 mL volume; leak-proof with conical bottom |
| Class A Clear Glass Threaded Vials | Fisherbrand | 03-339-25B | Individual glass vials for exposure containment |
| Dimethyl Sulfoxide | Millipore Sigma | D8418 | Solvent or vehicle for hydrophobic compounds |
| Fixed Speed Vortex Mixer | VWR | 10153-834 | Vortex mixer; used to homogenize sample after acid digestion and dilution |
| High Purity Hydrogen Peroxide | Merk KGaA, EDM Millipore | 1.07298.0250 | Suprapur Hydrogen peroxide (30%); used for sample digestion |
| High Purity Nitric Acid | EDM Millipore | NX0408-2 | Omni Trace Ultra Nitric Acid (69%); used for sample digestion |
| Instant Ocean Sea Salt | Spectrum Brands, Inc. | Instant Ocean® Sea Salt | Egg water solution contains instand ocean sea salt with a final concentration of 60 µg/ml |
| Mars X Microwave Digestion System | CEM, Matthews, NC | Microwave acid digestion system used to digest and homogenize samples under uniform conditions. For this methodology the open vessel digestion method was completed using single-use polypropylene centrifuge tubes at low power (300 W). | |
| Multi-element Solution 3 | SPEX CertiPREP | CLMS-3 | Contains 10 mg/L Au, Hf, Ir, Pd, Pt, Fu, Sb, Sr, Te, Sn in 10% HCl/1% HNO3; used as a quality control standard for Pt and Ru analyses |
| Nu Instruments AttoM High Resolution Inductively Coupled Plasma Mass Spectrometer (HR-ICP-MS) | Nu Instruments/Amatek | Double focussing magnetic sector inductively coupled plasma mass spectrometer with flexible low to high resolution slit system, and dynamic range detector system. Data processing and quantification is done using NuQuant companion software. | |
| Platinum (Pt) standard solution, NIST 3140 | National Institute of Standards and Technology | 3140 | Prepared from ampoule containing 9.996 mg/g Pt in 10% HCl; ; used as a quality control standard for Pt analyses |
| Platinum (Pt) standard solution, single-element | High Purity Standards | 100040-2 | Contains 1000 mg/L Pt in 5% HCl |
| Ruthenium (Ru) standard solution, single-element | High Purity Standards | 100046-2 | Contains 1000 mg/L Ru in 2% HCl |
| TetraMin Tropical Flakes | Tetra | 77101 | Flake food to be mixed in a 1:4 ratio of Aquatox Fish Diet to TetraMin Tropical Flakes and used as feed |
| Trace Metal Grade Nitric Acid | VWR BDH Chemicals | 87003-261 | Aristar Plus Nitric Acid (67-70%); used for rinse solution in ASX-510 Autosampler |
| Ultrasonic water bath | VWR | B2500A-DTH | Ultrasonic water bath used to aid in acid digestion prior to microwave digestion |
Références
- Rehman, K., Fatima, F., Waheed, I., Akash, M. S. H. Prevalence of exposure of heavy metals and their impact on health consequences. Journal of Cellular Biochemistry. 119 (1), 157-184 (2018).
- Anyanwu, B. O., Ezejiofor, A. N., Igweze, Z. N., Orisakwe, O. E. Heavy metal mixture exposure and effects in developing nations: an update. Toxics. 6 (4), 65 (2018).
- Doherty, C. L., Buckley, B. T. Translating analytical techniques in geochemistry to environmental health. Molecules. 26 (9), 2821 (2021).
- Boros, E., Dyson, P. J., Gasser, G. Classification of metal-based drugs according to their mechanisms of action. Chem. 6 (1), 41-60 (2020).
- Robertson, J., Barr, R., Shulman, L. N., Forte, G. B., Magrini, N. Essential medicines for cancer: WHO recommendations and national priorities. Bulletin of the World Health Organization. 94 (10), 735-742 (2016).
- Wheate, N. J., Walker, S., Craig, G. E., Oun, R. The status of platinum anticancer drugs in the clinic and in clinical trials. Dalton Transactions. 39 (35), 8113-8127 (2010).
- Brown, A., Kumar, S., Tchounwou, P. B. Cisplatin-based chemotherapy of human cancers. Journal of Cancer Science & Therapy. 11 (4), 97 (2019).
- Ghosh, S. Cisplatin: The first metal based anticancer drug. Bioorganic Chem. 88, 102925 (2019).
- Abid, M., Shamsi, F., Azam, A. Ruthenium complexes: an emerging ground to the development of metallopharmaceuticals for cancer therapy. Mini Reviews in Medicinal Chemistry. 16 (10), 772-786 (2016).
- Alessio, E., Messori, L. NAMI-A and KP1019/1339, two iconic ruthenium anticancer drug candidates face-to-face: a case story in medicinal inorganic chemistry. Molecules. 24 (10), 1995 (2019).
- Alessio, E., Mestroni, G., Bergamo, A., Sava, G. Ruthenium antimetastatic agents. Current Topics in Medicinal Chemistry. 4 (15), 1525-1535 (2004).
- Lin, K., Zhao, Z. -. Z., Bo, H. -. B., Hao, X. -. J., Wang, J. -. Q. Applications of ruthenium complex in tumor diagnosis and therapy. Frontiers in Pharmacology. 9, 1323 (2018).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wiley, D. S., Redfield, S. E., Zon, L. I. Chemical screening in zebrafish for novel biological and therapeutic discovery. Methods in Cell Biology. 138, 651-679 (2017).
- Bambino, K., Chu, J. Zebrafish in toxicology and environmental health. Current Topics in Developmental Biology. 124, 331-367 (2017).
- Rubinstein, A. L. Zebrafish assays for drug toxicity screening. Expert Opinion on Drug Metabolism & Toxicology. 2 (2), 231-240 (2006).
- Cassar, S., et al. Use of zebrafish in drug discovery toxicology. Chemical Research in Toxicology. 33 (1), 95-118 (2020).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edition. , (2000).
- Material safety data sheet: cisplatin injection). Pfizer Available from: https://cdn.pfizer.com/pfizercom/products/material_safety_data/PZ01470.pdf (2011)
- Nasiadka, A., Clark, M. D. Zebrafish breeding in the laboratory environment. ILAR Journal. 53 (2), 161-168 (2012).
- OECD. Test No. 236: Fish embryo acute toxicity (FET) test. OECD Guidelines for the Testing of Chemicals Available from: https://www.oecd-ilibrary.org/environment/test-no-236-fish-embryo-acute-toxicity-fet-test_9789264203709-en (2013)
- EMD Millipore Corporation. Material Safety Data Sheet: OmniTrace Nitric Acid. EMD Millipore Corporation. , (2013).
- Safety data sheet: Hydrogen peroxide 30% Suprapur. EMD Millipore Corporation Available from: https://www.merckmillipore.com/IN/en/product/Hydrogen-peroxide-300-0 (2014)
- Karas, B. F., et al. A novel screening method for transition metal-based anticancer compounds using zebrafish embryo-larval assay and inductively coupled plasma-mass spectrometry analysis. Journal of Applied Toxicology. 39 (8), 1173-1180 (2019).
- Henn, K., Braunbeck, T. Dechorionation as a tool to improve the fish embryo toxicity test (FET) with the zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Toxicology & Pharmacology: CBP. 153 (1), 91-98 (2011).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Karas, B. F., Hotz, J. M., Buckley, B. T., Cooper, K. R. Cisplatin alkylating activity in zebrafish causes resistance to chorionic degradation and inhibition of osteogenesis. Aquatic Toxicology. 229, 105656 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon