Method Article
Kinetx : un cadre logiciel combiné de dosage et d’analyse de cytométrie en flux permettant de mesurer quantitativement et de catégoriser l’activation plaquettaire en temps réel.
Dans cet article
Résumé
Les plaquettes réagissent rapidement à une gamme de stimuli. Cet article décrit un test de la fonction plaquettaire basé sur la cytométrie en flux en temps réel et un nouveau logiciel open source sur mesure (Kinetx) pour permettre des mesures cinétiques quantitatives de la libération de granules plaquettaires, de la liaison au fibrinogène et du flux de calcium intracellulaire.
Résumé
Les plaquettes réagissent rapidement aux lésions vasculaires et subissent une activation en réponse à une gamme de stimuli pour limiter la perte de sang. De nombreux tests de la fonction plaquettaire mesurent les réponses des paramètres après une période de temps définie et non le taux d’activation plaquettaire. Cependant, la vitesse à laquelle les plaquettes convertissent les stimuli extracellulaires en une réponse fonctionnelle est un facteur essentiel pour déterminer l’efficacité avec laquelle elles peuvent répondre à une blessure, se lier à un thrombus en formation et signaler le recrutement d’autres plaquettes. Cet article décrit un test de la fonction plaquettaire basé sur la cytométrie en flux qui permet l’acquisition simultanée de données et la stimulation d’échantillons, et utilise un logiciel open source sur mesure nouvellement développé (Kinetx) pour permettre des mesures cinétiques quantitatives de la libération de granules plaquettaires, de la liaison au fibrinogène et du flux de calcium intracellulaire. Kinetix a été développé en sont afin que les utilisateurs puissent modifier des paramètres tels que le degré de lissage, l’identification de points de données périphériques ou des échelles de temps. Pour aider les utilisateurs qui ne sont pas familiers avec l’environnement R, l’analyse des données Kinetix peut être effectuée à l’aide d’une seule commande. Ensemble, ces éléments permettent de mesurer et de catégoriser avec précision et reproductibilité les mesures d’activation plaquettaire en temps réel, telles que la vitesse, l’accélération, le temps jusqu’au pic de calcium et les changements de forme qualitatifs. Les mesures cinétiques de l’activation plaquettaire donnent un aperçu unique du comportement des plaquettes au cours des premières étapes de l’activation et peuvent fournir une méthode de prédiction du recrutement des plaquettes dans un thrombus en formation.
Introduction
Les plaquettes jouent un rôle central dans l’hémostase et génèrent une réponse rapide et multidimensionnelle aux lésions vasculaires 1,2. Les tests actuels de la fonction plaquettaire mesurent divers aspects de la réactivité plaquettaire, représentatifs de leurs actions hémostatiques in vivo. Traditionnellement, la fonction plaquettaire a été évaluée à l’aide de tests finaux qui mesurent la liaison au fibrinogène, la libération de granules ou l’agrégation plaquettaire dans les plaquettes stimulées pendant suffisamment longtemps pour atteindre une activation maximale 3,4. Ces tests ne tiennent pas compte du temps nécessaire aux plaquettes pour convertir les stimuli extracellulaires en signaux intracellulaires et en flux de calcium, puis se dégranuler et se lier au thrombus en croissance. Le sang s’écoule à un taux de cisaillement allant jusqu’à 20 dynes/cm3 dans les veines et 80 dynes/cm3 dans les grosses artères5, ce qui souligne la nécessité pour les plaquettes de contrer ce débit rapide en détectant, traitant et répondant rapidement aux stimuli extracellulaires pour se lier en un thrombus en formation et soutenir sa croissance continue.
Le taux d’activation plaquettaire peut varier indépendamment de l’étendue maximale de l’activation plaquettaire. La kinase liée à l’intégrine (ILK) est une protéine impliquée dans la régulation des intégrines β1 et β3 dans les plaquettes 6,7. L’inhibition ou la délétion spécifique de l’ILK in vivo a démontré que le taux, mais pas l’étendue maximale de l’activation plaquettaire, était affecté en l’absence d’ILK8 fonctionnelle. Des différences entre le taux d’agrégation et le niveau maximal d’agrégation ont également été identifiées chez des souris déficientes en CALDAG GEFI 9,10, une molécule de signalisation impliquée dans la régulation de la signalisation de l’intérieur vers l’extérieur via RAP111.
Ces résultats démontrent que le taux plaquettaire et les niveaux d’activation maximale peuvent être autonomes et que les mesures de l’activation maximale peuvent ne pas être descriptives du comportement des plaquettes jusqu’à présent. Ces différences dans le temps nécessaire aux plaquettes pour s’activer peuvent profondément affecter leur liaison initiale au thrombus en croissance, ce qui a un impact sur l’architecture et la taille globale du thrombus. Ces variations entre le taux plaquettaire et l’activation maximale soulignent la nécessité d’un test pour mesurer avec précision le taux d’activation plaquettaire et peuvent être utilisés pour détecter les variances au sein de la population.
Cet article décrit une méthode qui mesure avec précision l’activation plaquettaire et le flux de calcium en temps réel et calcule une gamme de paramètres, y compris la vitesse à laquelle les plaquettes s’activent et le temps nécessaire aux plaquettes pour atteindre le taux maximal d’activation et le flux de calcium maximal. Ces mesures cinétiques de l’activation plaquettaire donnent un meilleur aperçu du comportement des plaquettes au cours des premières étapes de la formation d’un thrombus et fournissent une méthode pour prédire la rapidité avec laquelle les plaquettes peuvent être recrutées dans un thrombus en formation.
Protocole
Ce protocole a utilisé du sang total humain et des plaquettes provenant de donneurs sains sans problèmes de santé sous-jacents et ne prenant aucun médicament connu pour interférer avec la fonction plaquettaire après consentement éclairé écrit, et a été approuvé par le comité d’éthique de la recherche de l’Université de Reading.
1. Prélèvement sanguin et préparation du plasma riche en plaquettes
- Prélever le sang périphérique dans un récipient contenant 3,2 % de citrate de sodium
- Jeter les premiers 3 ml.
- Laissez reposer le sang à 30 °C pendant 30 min avant la centrifugation.
- Préparez le plasma riche en plaquettes (PRP) par centrifugation à 140 x g pendant 20 min à température ambiante avant l’incubation à 37 °C pendant la durée du test, qui a été terminée dans les 60 minutes suivant la centrifugation.
2. Préparation de l’instrument
REMARQUE : Un système fluidique non pressurisé est essentiel pour la cytométrie en flux en temps réel, car les plaquettes sont stimulées simultanément pendant que le cytomètre en flux enregistre les événements.
- Utilisez un cytomètre en flux non pressurisé pour effectuer une cytométrie en flux en temps réel.
- Pour effectuer le test à 37 °C, fixez un tapis de dissection de souris à la platine pour placer la plaque à 96 puits. Chauffer le tapis à 37 °C pendant toute la durée du dosage.
- Placez une plaque à 96 puits sur le tapis chauffant pour permettre une incubation continue à 37 °C (figure 1)
3. Préparation du dosage
- Liaison du fibrinogène et expression de la P-sélectine
- Enduire une plaque de microtitrage en polypropylène à fond rond de 96 puits, non traitée, avec 5 % d’albumine sérique bovine (BSA) dans une solution saline tamponnée Hepes (HBS ; 10 mM Hepes pH 7,4 ; 150 mM NaCl, 5 mM KCl, 1 mM MgSO4·7H20) pendant la nuit à 4 °C.
- Préparez le mélange d’anticorps dans un HBS contenant 5 mM de glucose (HBS-G). Ajouter un anticorps anti-fibrinogène marqué à l’isothiocyanate de fluorescéine (FITC-FGN ; dilution 1 : 37,5 (v/v)) et une anti-P-sélectine marquée à l’allophycocyanine (APC) (APC-CD62P ; dilution 1 : 37,5 (v/v)) à HBS-G (volume final : 225 μL) et incuber dans une plaque de 96 puits à 37 °C.
- Immédiatement avant le prélèvement des événements, ajouter du PRP au mélange d’anticorps HBS-G à une dilution de 1:600 (v/v).
REMARQUE : Un faible volume de PRP est nécessaire pour s’assurer que la limite d’événements n’est pas dépassée et réduire l’agrégation plaquettaire dans l’échantillon. La dilution plaquettaire a été examinée dans des études pilotes et n’affecte pas le taux d’activation. - Incuber le mélange d’activation contenant FITC-FGN (dilution 1 : 37,5 (v/v)) et APC-CD62P (dilution 1 : 37,5 (v/v)) et l’agoniste à 37 °C. Les agonistes comprennent la thrombine (thr ; 0,0012-1 U/mL) en présence du peptide Gly-Pro-Arg-Pro (GPRP ; 1,18 mM), du peptide lié au collagène réticulé (CRP-XL ; 0,004-10 μg/mL), de l’adénosine diphosphate (ADP ; 0,04-4 μM), de l’épinéphrine (epi ; 20-200 μM), de la 9,11-didésoxy-11α,9α-époxyméthanoprosprostaglandine F2α (U46619 ; 0,02-5 μM) et du peptide activateur du récepteur de la thrombine 6 (TRAP-6 ; 0,04-10 μM).
- Flux de calcium
REMARQUE : Ce test a été effectué à l’aide d’un kit de dosage de calcium commercial (Table des matériaux)- Enduire une plaque de microtitrage en polypropylène à fond rond de 96 puits, non traitée, avec 5 % de BSA dans une solution saline tamponnée Hepes pendant une nuit à 4 °C.
- Pour préparer le colorant de dosage du calcium, ajoutez 100 mL de tampon de dosage du calcium et 2 mL de solution mère de probénécide (250 mM) dans une bouteille de réactif de calcium pour obtenir 2 fois la solution de chargement de réactif de calcium.
- Pour préparer Fluo-4/HBS-G, diluer le colorant de dosage du calcium avec HBS-G dans un rapport de 1:1, filtrer à travers un filtre de 0,22 μM. Ajouter 225 μL de Fluo-4/HBS-G dans les puits appropriés d’une plaque à 96 puits à 37 °C.
- Incuber le PRP à 37 °C pendant 30 min à une dilution 1:1 avec Fluo-4/HBS-G.
- Préparez le mélange d’activation dans Fluo-4/HBS-G et incubez à 37 °C. Les agonistes comprennent la thrombine (1 U/mL) en présence de GPRP, CRP-XL (0,5 μg/mL), l’ADP (1 μM), l’épinéphrine (20 μM), l’U46619 (1 μM) et le TRAP-6 (1 μM).
- Immédiatement avant le prélèvement des événements, ajouter du PRP/Fluo-4/HBS-G à la dose de 225 μL du mélange Fluo-4/HBS-G à une dilution finale du PRP (après addition d’agonistes) de 1:600 (v/v ; 0,5 mL dans 300 mL du volume final).
4. Procédure d’analyse et collecte des données
- Réglez le cytomètre en flux sur un débit « lent » avec un nombre moyen de 1000 événements par seconde (eps) et un maximum de 3000 eps. Réglez le seuil sur 20000 pour éviter d’enregistrer des débris de cellule.
- Calculez la population de plaquettes à l’aide de diagrammes de diffusion directe (FSC) et de diffusion latérale (SSC). Pour la collecte de données, tracez le FSC-A en fonction du SSC-A pour déterminer avec précision la population de plaquettes et le FL1 ou le FL4 en fonction du temps pour enregistrer les événements fluorescents au fil du temps.
- Le cytomètre en flux prend 14 s pour commencer à enregistrer les événements ; après cela, laisser l’instrument enregistrer les événements dans chaque puits pendant 5 secondes supplémentaires avant d’ajouter rapidement 75 μL du mélange d’activation à l’aide d’une pointe de chargement de gel pour assurer un mélange spontané (Figure 1).
- Collectez les événements pendant 5 min et configurez les tracés pour enregistrer le canal 488 (FL1 ; filtre 533/30 - FITC-fibrinogène/FLUO-4) en fonction du temps et le canal 633 (FL4 ; filtre 675/25 - APC-P-selectin) en fonction du temps.
- Enregistrez les données de tracé pour les canaux 488 et 633 à partir de chaque canal ainsi que les fichiers CSV.
5. Analyse des données
- Téléchargez la dernière version de Kinetx12.
REMARQUE : Le téléchargement comprend tout le code requis pour analyser les données générées par le test et est accompagné d’un ensemble de données expérimentales provenant de dix donneurs et de résultats générés par leur analyse (ces résultats peuvent être régénérés et validés via les procédures suivantes) (Figure 2). - Configurer l’environnement R
- Utilisez le langage de programmation R via l’environnement RStudio. Installez R13, RStudio14 et les paquets suivants : ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych. Assurez-vous que tous les packages prérequis ont été correctement installés.
- Créer des métadonnées : placez un fichier texte (appelé wellData.txt) dans le même répertoire que les données. Il décrit les agonistes, leurs concentrations, les anticorps éventuels et le dosage (fonction ou calcium) utilisé pour générer chaque fichier CSV.
- Placez un deuxième fichier texte ('IsotypeData.txt') dans le même répertoire et définissez les isotypes. Les fichiers fournis dans le téléchargement ('data/wellData.txt' et 'data/IsotypeData.txt') peuvent servir de modèle, étant facilement adaptables à d’autres agonistes, inhibiteurs et concentrations.
- Analyser les données : Kinetx comprend trois fonctions telles que définies aux étapes 5.2.5 à 5.2.7.
- kinetxProcess.R : Cette fonction traite les données brutes de cytométrie fonctionnelle en flux. Pour exécuter, tapez kinetxProcess('data location','where to place outputs','FL1' (pour FITC-anti-fibrinogen, ou 'FL4' (pour APC-CD62P)
- kinetxProcessCalcium.R : Cette fonction analyse et étiquette les données de flux de calcium. Pour exécuter, tapez kinetxProcessCalcium('emplacement des données','où placer les sorties','FL1')
- kinetxSummary.R : Cette fonction récapitule les données. Pour exécuter, tapez kinetxSummary('data location','where to place outputs','FL1').
- Pour exécuter toutes les fonctions ci-dessus (5.2.5-5.2.7) sur les données de test, utilisez le script (test. R).
REMARQUE : Les deux premières fonctions produisent des chiffres pour chaque donneur qui montrent les données brutes plus les courbes ajustées. Tous les résultats et une feuille de calcul qui résume les données sont placés à l’emplacement de sortie.
Résultats
L’analyse de la cytométrie fonctionnelle en flux en temps réel révèle des différences dans la forme des courbes d’activation entre agonistes et entre donneurs
L’analyse des données fonctionnelles (exposition à la sélectine P et liaison au fibrinogène) à l’aide de Kinetx supprime les points de données qui sont hors des plages raisonnables (>200000 ou <1) et <2,80 s (le temps zéro étant réglé à ce point), normalise les données à la médiane des isotypes et ajuste une courbe de moyenne mobile lisse (via la fonction loess). Kinetx attribue également des mesures et des catégories basées sur la forme de la ligne lissée ajustée, les valeurs absolues et les taux de variation comme suit : (1) RoC - augmentation moyenne de la ligne lissée au cours des 120 premières s ; (2) étiquette - catégorise les réponses comme rapides, moyennes ou lentes en fonction des seuils de 40 et 80 pour FL1 et 5 et 10 pour FL4 ; (3) EarlyRoC - augmentation moyenne de la ligne lissée au cours des 20 premières s ; (4) forme - faibles répondeurs, croissants, linéaires ou décroissants (Figure 3A) - Les faibles répondeurs étant déterminés comme FL1 < 4000 ou FL4 < 1000, les étiquettes croissantes, linéaires et décroissantes sont déterminées en fonction de : formeMétrique - RoC(120 secondes)/EarlyRoC, où forme croissanteMétrique >2, forme linéaireMétrique entre 0,9-2 et forme décroissanteMétrique <0,9 ; (5) Produire une feuille de calcul résumant les données en indiquant le niveau et le taux de variation à 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, isotype médian, les taux maximum et minimum de changement et d’accélération et toutes les étiquettes et catégories.
La liaison au fibrinogène plaquettaire et l’exposition à la P-sélectine pendant 5 minutes après l’activation en réponse à une concentration unique des agonistes ADP, TRAP-6, CRP-XL, épinéphrine et U46617 ont été analysées chez 30 donneurs. Les paramètres de la liaison au fibrinogène et de l’exposition à la P-sélectine en réponse à différents agonistes montrent une variation considérable dans la forme de la réponse (Figure 3). Les plaquettes stimulées par TRAP-6 et ADP ont montré une accélération plus rapide de la liaison au fibrinogène, qui pour de nombreux donneurs a ralenti à des moments ultérieurs (Figure 3B). La liaison du fibrinogène en réponse à la CRP-XL, à la thrombine et à l’épinéphrine était plus susceptible de montrer un taux de réponse croissant ou linéaire. De nombreux donneurs ont montré un délai relativement long pour la CRP-XL avant que le taux de liaison du fibrinogène ne s’accélère rapidement. La réponse à U46619 a souvent été classée comme faible. En revanche, l’exposition à la P-sélectine était plus susceptible de présenter un taux de réponse linéaire ou croissant à tous les agonistes, à l’exception de l’U46619 qui présentait encore une fois de faibles niveaux de réponse (figure 3C).
Le flux de calcium intracellulaire pendant l’activation plaquettaire peut être mesuré avec précision à l’aide de la cytométrie en flux en temps réel
L’analyse des données du test de flux calcique supprime les points de données qui sont hors des plages raisonnables (< 2,80 s le temps zéro étant réglé à ce point), puis ajuste une courbe de moyenne mobile lisse (via la fonction loess). Kinetx attribue des mesures, et des catégories sont attribuées en fonction de la forme des lignes lisses ajustées, des valeurs absolues et des taux de changement comme suit : (1) catégorie - qui décrit la forme de la réponse calcique en fonction de l’augmentation précoce, du maximum et de la chute finale par rapport au maximum, décrite comme linéaire, maximale ou soutenue (Figure 4A) ; (2) taux - qui décrit le taux de changement dans les 30 secondes rapides et est défini comme aucun changement, lent, moyen ou rapide (avec coupure à 10, 40 et 80). Kinetx produit également une feuille de calcul résumant les données en fournissant le niveau et le taux de changement à 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, les taux maximum et minimum de changement et d’accélération et toutes les étiquettes et catégories, ainsi qu’en produisant une figure des données pour chaque donateur. Des exemples de flux calcique mesurés par cette méthode chez 30 individus ont de nouveau montré des schémas d’activation différents entre les individus et les agonistes (Figure 4B). La CRP-XL a donné une réponse calcique principalement soutenue, tandis que la réponse à TRAP-6 a le plus souvent montré une réponse maximale. Tous les autres agonistes ont généré une réponse principalement linéaire.
La cytométrie en flux en temps réel identifie les différences dans les niveaux maximaux d’activation en réponse à différents agonistes et concentrations
Les résultats démontrent que le test de cytométrie en flux en temps réel a la capacité de détecter les différences dans les niveaux maximaux de liaison au fibrinogène (Figure 5A) et d’exposition à la P-sélectine (Figure 5D), en réponse à une stimulation via différents récepteurs (10 μg/mL CRP-XL contre 3 U/mL de thrombine P < 0,001 ; 10 μg/mL DE CRP-XL contre 1 U/mL de thrombine P < 0,001). Ils montrent également que le dosage est sensible aux différences de concentration d’agonistes, où les niveaux de liaison maximale au fibrinogène et d’exposition à la P-sélectine sont augmentés en réponse à des concentrations d’agonistes plus élevées (liaison du fibrinogène - CRP-XL - 0,004 μg/mL contre 0,4, 5, 10 μg/mL, P < 0,01 ; thrombine - 0,0012 U/mL contre 1 et 3 U/mL, P < 0,01 ; ADP - 0,04 μg/mL contre 1 et 4 μM, P < 0,05).
Le test de cytométrie en flux en temps réel est suffisamment sensible pour détecter la variabilité du taux d’activation plaquettaire chez les donneurs
Le taux maximal d’activation plaquettaire a été déterminé en ajustant une moyenne mobile lissée (loess) aux données de fluorescence, puis en l’utilisant pour calculer le taux maximal de liaison au fibrinogène et d’exposition à la sélectine P (figures 5B, E). Les données démontrent une variation considérable entre les donneurs individuels, et le test de cytométrie en flux est suffisamment sensible pour détecter cette variation. Les résultats indiquent que l’augmentation de la concentration d’agonistes a peu d’effet sur le taux maximal de liaison du fibrinogène (Figure 5B). En revanche, le taux maximal d’exposition à la P-sélectine augmente avec une concentration plus élevée de thrombine et de CRP-XL, mais pas avec des concentrations croissantes d’ADP (figure 5E).
Les variations du temps de latence de l’activation plaquettaire peuvent être détectées à l’aide de la cytométrie en flux en temps réel
Le temps jusqu’au taux maximal d’activation plaquettaire a été déterminé en calculant les points temporels auxquels le taux maximal de liaison au fibrinogène et d’exposition à la P-sélectine ont été atteints (figures 5C, F). Le taux maximal de liaison au fibrinogène et d’exposition à la sélectine du P varie d’un donneur à l’autre, en particulier à des concentrations d’agonistes plus faibles. La stimulation des plaquettes avec des concentrations croissantes de CRP-XL montre que des concentrations plus élevées d’agonistes prennent moins de temps pour atteindre le taux maximal de liaison du fibrinogène avec moins de variabilité entre les donneurs ; cependant, cette tendance n’est pas observée avec la stimulation de la thrombine ou de l’ADP (Figure 5C). L’essai démontre que, dans certaines circonstances, l’augmentation de la concentration d’agoniste diminue le temps nécessaire pour que l’activation plaquettaire commence (temps de latence) sans modifier le taux maximal d’activation plaquettaire et que ces deux mesures peuvent être évaluées à l’aide de cet essai.

Figure 1 : Cytométrie en flux réel en laboratoire humide. (A) du sang total anticoagulé a été (B) centrifugé pour obtenir du plasma riche en plaquettes (PRP). (C) Du PRP dilué contenant des anticorps appropriés ou des colorants indicateurs de calcium a été placé dans une plaque de 96 puits, chargé sur un cytomètre en flux non pressurisé et maintenu à 37 °C à l’aide d’un tapis de dissection. Les échantillons ont été stimulés lors de l’acquisition avec un mélange d’activation contenant des anticorps ou un colorant calcique et un agoniste, rapidement ajouté au puits à l’aide d’une pointe de chargement de gel pour assurer un mélange spontané. (D) Les événements ont été collectés pendant 5 minutes et des fichiers CSV des données de chaque puits ont été enregistrés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
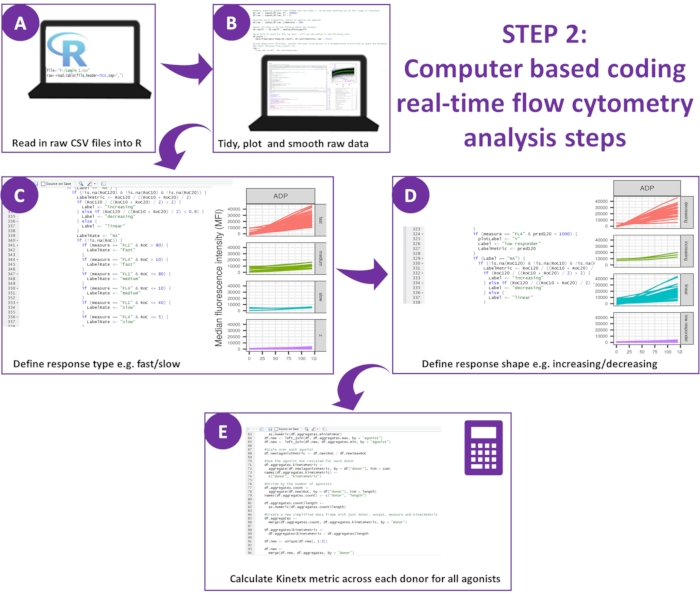
Figure 2 : Schéma de l’analyse des données. (A) L’environnement R a été configuré et les métadonnées ont été créées. (B) Les données aberrantes ont été supprimées et une courbe de moyenne mobile lisse (loess) a été installée. (C) Le type de réponse et (D) la forme de la réponse ont été définis. E) Des indicateurs ont été calculés, exportés et des chiffres ont été générés pour chaque donateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Résultat représentatif de l’analyse Kinetx de la liaison en temps réel du fibrinogène plaquettaire et de l’expression de la P-sélectine. (A) En plus de fournir des paramètres tels que le taux de variation maximal (RoC) et le RoC à divers points temporels, Kinetx catégorise également la forme de la courbe pour fournir des informations supplémentaires sur l’activation des plaquettes qui sont difficiles à capturer en une seule mesure. Les données représentatives de 30 individus montrent la variation typique observée dans la liaison en temps réel du fibrinogène plaquettaire (B) et l’expression de la sélectine (C) en réponse aux agonistes ADP, TRAP-6, CRL-XL, épinéphrine et U46617. Veuillez cliquer ici pour voir une version agrandie de cette figure.
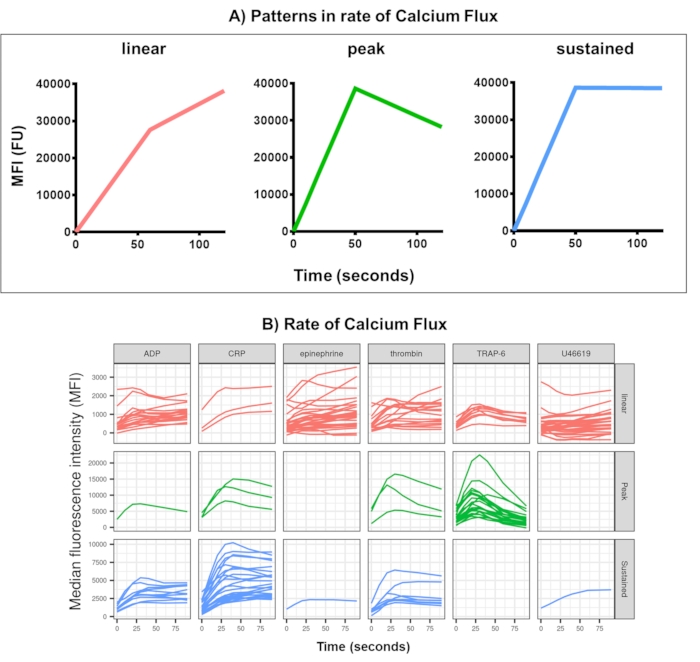
Figure 4 : Résultat représentatif de l’analyse Kinetx du flux de calcium plaquettaire en temps réel. (A) En plus de fournir des mesures telles que le taux de variation maximal (RoC) et le RoC à divers points temporels, Kinetx catégorise également la forme de la courbe de flux calcique pour fournir des informations supplémentaires sur l’activation des plaquettes qui sont difficiles à capturer en une seule mesure. Les données représentatives de 30 individus montrent la variation typique observée dans le flux calcique plaquettaire (B) en temps réel en réponse aux agonistes ADP, TRAP-6, CRL-XL, épinéphrine et U46617. Veuillez cliquer ici pour voir une version agrandie de cette figure.
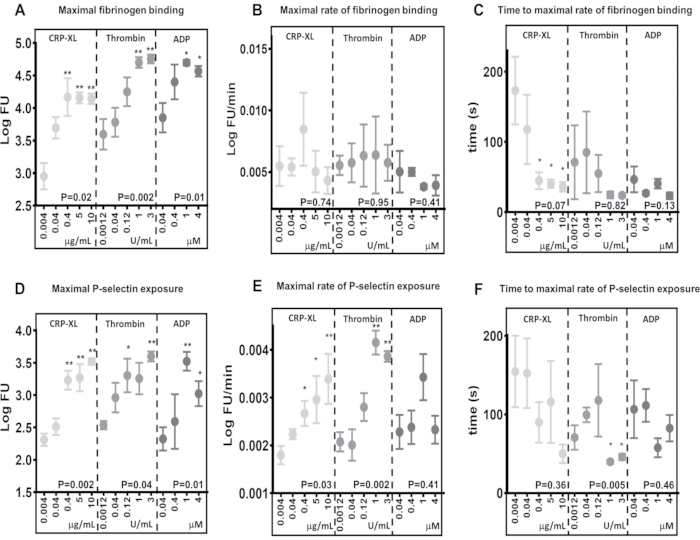
Figure 5 : La concentration d’agonistes détermine l’activation plaquettaire maximale, mais pas le taux d’activation plaquettaire. L’activation plaquettaire maximale - liaison au fibrinogène (A) ou exposition à la sélectine P (D) - a été significativement modifiée positivement par la concentration d’agonistes (CRP-XL, thrombine ou ADP). Le taux d’activation plaquettaire (B et E) et le temps nécessaire pour atteindre le taux maximal d’activation plaquettaire (C et F) n’ont montré aucune relation ou une relation plus faible avec la concentration changeante d’agonistes. Les valeurs P montrent la signification sur toute la plage de concentration (test de Kruskal-Wallis), et les astérisques indiquent une différence significative (test de comparaison multiple) entre les valeurs individuelles et la concentration la plus faible. * P < 0,05, ** P < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La vitesse à laquelle les plaquettes détectent, traitent et répondent aux stimuli d’activation peut être un déterminant essentiel de la formation de thrombus. Des études antérieures ont montré que l’inhibition des éléments de signalisation qui ont un impact sur le taux, mais pas sur l’étendue finale de l’activation plaquettaire, entraîne la formation de thrombus8 instables. De nombreux tests de la fonction plaquettaire mesurent l’étendue de l’activation et de l’agrégation plaquettaires en réponse à différentes affections et traitements ; Cependant, ceux-ci ne tiennent pas compte de la vitesse à laquelle les plaquettes s’activent et du temps nécessaire pour que ce processus complexe se produise 3,4. Les tests innovants basés sur la cytométrie en flux développés ici surveillent de manière reproductible l’activation plaquettaire au fil du temps et la traduisent en une gamme de mesures pour calculer le taux maximal d’activation plaquettaire et le temps nécessaire aux plaquettes pour atteindre ce taux maximal et devenir complètement activées.
Les données présentées mettent en évidence la capacité du test en temps réel à identifier les variations entre les différentes réponses au type d’agoniste et à la concentration et entre les individus. De nombreux rapports antérieurs ont montré que la réactivité plaquettaire est très variable entre les individus normaux15,16, ce qui indique que le taux d’activation plaquettaire peut également varier considérablement au sein de la population. Les données de cette étude démontrent que le taux de dégranulation et de liaison du fibrinogène aux plaquettes semble être encore plus variable que les niveaux maximaux d’activation plaquettaire. Cela montre que la cytométrie en flux en temps réel peut également être utilisée comme un outil précieux et fiable pour identifier les variances du taux plaquettaire dans la population et détecter les effets de différents agents inhibiteurs ou pro-activateurs sur le taux plaquettaire comme moyen supplémentaire de mesurer la fonction plaquettaire.
Lorsque la fonction plaquettaire est mesurée à l’aide de tests finaux, des comparaisons peuvent être faites sur l’étendue de la liaison du fibrinogène ou de la libération de granules entre différents agonistes. Les courbes de loess comparant la liaison du fibrinogène au cours des 5 premières minutes de l’activation plaquettaire démontrent la capacité du test en temps réel à mettre en évidence plus de détails dans les différences de cinétique d’activation plaquettaire que les tests à paramètre unique ne peuvent pas mesurer.
Les données recueillies à partir du test en temps réel démontrent que la vitesse à laquelle le fibrinogène se lie aux plaquettes suit un schéma légèrement différent, en fonction de la voie d’activation (Figure 3). Afin d’évaluer avec précision la cinétique d’activation plaquettaire, il est essentiel d’utiliser un cytomètre en flux non pressurisé qui permet l’acquisition simultanée de données et la stimulation d’échantillons. Il est également essentiel que les agonistes soient ajoutés rapidement pour assurer un mélange quasi instantané et complet de l’agoniste et des plaquettes. La stimulation avec de la thrombine, de l’ADP et de l’épinéphrine produit une courbe similaire, représentant une initiation rapide de la signalisation en réponse à la sensibilisation des récepteurs, ce qui entraîne la liaison du fibrinogène aux plaquettes à un rythme rapide et régulier. En revanche, les plaquettes stimulées par la CRP-XL sont initialement très lentes à se lier au fibrinogène après la sensibilisation initiale des récepteurs ; Cependant, le taux de liaison du fibrinogène augmente rapidement après ce délai initial. La stimulation plaquettaire avec U46619, un mimétique de TXA2, entraîne un taux initial rapide de liaison du fibrinogène, qui diminue rapidement jusqu’à un taux très lent conduisant à une augmentation légère et constante de la liaison du fibrinogène au fil du temps.
Kinetx a été conçu pour être open-source, reproductible et facile à mettre en œuvre afin de contourner les problèmes liés aux logiciels propriétaires, tels que le coût et le manque de flexibilité. En tant que tel, il devait être développé avec un logiciel qui n’était pas propriétaire. R a été choisi car il est largement utilisé par les biologistes, facile à installer, gratuit et open-source. Cet environnement open source permet aux utilisateurs maîtrisant R de modifier des paramètres tels que le degré de lissage, l’identification de points de données périphériques ou des échelles de temps. Cependant, pour aider les chercheurs qui ne sont pas familiers avec R, Kinetix a également été développé afin que l’analyse puisse être effectuée via une seule commande (soit kinetxProcess, soit kinetxProcessCalcium, selon les données analysées). Le logiciel Kinetix présenté ici peut calculer une gamme de mesures, y compris les valeurs pour les niveaux maximums, le taux et l’accélération de la liaison au fibrinogène ou de l’exposition à la P-sélectine et les points temporels auxquels ces maximums se produisent. La cinétique de l’activation plaquettaire en réponse à différentes voies de stimulation peut être comparée plus précisément à l’aide de ces chiffres.
Les comparaisons entre différentes stimulations agonistes dans les niveaux maximaux de liaison du fibrinogène et les taux de liaison du fibrinogène aux plaquettes sont de bons exemples de cas où le taux d’activation plaquettaire peut varier indépendamment de la liaison maximale. En comparant la liaison maximale du fibrinogène après 5 minutes de stimulation avec 0,04 μM d’ADP (3,85 LogFU) et 0,04 μg/mL DE CRP-XL (3,70 LogFU), les deux agonistes ont donné une quantité similaire de fibrinogène lié (Figure 5A). Les taux maximaux de liaison du fibrinogène montrent une différence encore plus mineure (0,04 μM ADP - 0,0050 LogFU/minute ; 0,04 μg/mL CRP-XL - 0,0054 LogFU/min), indiquant que le taux global de liaison du fibrinogène est similaire entre ces deux stimulations (Figure 5B). Cependant, lorsque l’on compare le temps de latence de l’activation plaquettaire, il y a une nette différence montrant que CRP-XL (117 s à la vitesse maximale) accélère à une vitesse beaucoup plus lente que l’ADP (47 s à la vitesse maximale) (Figure 5C). Ainsi, il devient clair que la stimulation ADP entraîne une réponse initiale beaucoup plus rapide (P < 0,001) par rapport à la CRP-XL. Lorsqu’elles sont observées ensemble, ces mesures de la cinétique plaquettaire en réponse à deux agonistes différents décrivent une réponse initiale rapide à la stimulation ADP qui s’accélère lentement et reste à un rythme régulier. En revanche, la stimulation par CRP-XL entraîne un taux initial d’activation lent, qui s’accélère rapidement beaucoup plus tard, conduisant finalement à un taux global et à des niveaux de liaison du fibrinogène similaires à ceux de l’ADP. Ces différences entre les niveaux maximaux, la vitesse et l’accélération de la liaison du fibrinogène démontrent qu’un certain nombre de paramètres sont impliqués dans la mesure de la rapidité avec laquelle les plaquettes s’activent. Le test en temps réel et l’analyse Kinetx permettent de mesurer et de comparer ces paramètres, de décrire le temps écoulé entre la sensibilisation des récepteurs et la réponse plaquettaire, et de comparer cela entre différentes voies de signalisation.
L’augmentation de la concentration d’agonistes n’a pas d’effet significatif sur le taux de liaison du fibrinogène aux plaquettes. Cependant, le temps nécessaire pour atteindre le taux maximal de liaison du fibrinogène diminue à mesure que la concentration d’agonistes augmente, ce qui suggère que les plaquettes se lient au fibrinogène à un rythme régulier et que la saturation des récepteurs joue un rôle plus important dans la rapidité avec laquelle les plaquettes se lient au fibrinogène.
Le test et l’analyse du flux de calcium décrits sont des tests de calcium rapides et faciles à réaliser qui peuvent être incorporés en tant qu’échantillons supplémentaires dans le test en temps réel, ce qui permet d’analyser la liaison du fibrinogène calcique et plaquettaire et la P-sélectine dans la même série d’échantillons. Le package d’analyse sur mesure fournit une évaluation approfondie de la cinétique des flux calciques, y compris la forme de la réponse, la réponse maximale et le temps nécessaire pour obtenir une réponse maximale. Ces paramètres peuvent ensuite être comparés pour déterminer s’ils varient entre les donneurs et en réponse à divers agents pharmaceutiques. Le flux de calcium dans les plaquettes a déjà été étudié dans les plaquettes à l’aide d’une variété de tests basés sur la cytométrie en flux 17,18,19. Aliotta et al.14, décrivent un test élégant capable d’analyser la cinétique de plusieurs ions intracellulaires. Le dosage du calcium présenté ici s’appuie sur ces tests précédemment publiés en incluant le package d’analyse permettant une plus grande flexibilité, une exploration plus approfondie des données avec l’avantage d’une analyse à haut débit pour plusieurs donneurs dans un court laps de temps.
Des études antérieures ont démontré que l’inhibition ou l’absence de certaines molécules de signalisation entraîne une altération du taux d’activation plaquettaire, ce qui se traduit directement par la formation de thrombus 8,9. Dans le passé, la cinétique d’activation plaquettaire pouvait être mesurée par cytométrie en flux sur un certain nombre de points temporels fixes qui peuvent ensuite être utilisés pour calculer et comparer, par exemple, le taux d’extériorisation de GPIIbIIIa en réponse à différents agonistes20. Le test en temps réel et l’analyse Kinetx décrits dans cet article fournissent une méthode simple, librement disponible et précise pour mesurer à la fois le taux et le point final de l’activation plaquettaire à partir des plaquettes au repos. Ceci est probablement important pour identifier les variations physiologiquement pertinentes de la fonction plaquettaire qui peuvent passer inaperçues lorsque seules les lectures du point final sont mesurées.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce projet a été soutenu par la British Heart Foundation (PG/16/36/31967, RG/20/7/34866 et RG/15/2/31224).
matériels
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
Références
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon