Method Article
Un modèle murine d’une blessure de brûlure reconstruite avec une greffe de peau allogénique
Dans cet article
Résumé
Le but de cette étude était de développer un modèle murin de la cicatrisation des brûlures. Une brûlure thermique a été induite sur la peau dorsale des souris à l’aide d’un modèle de laiton préchauffé. Le tissu brûlé a été débrided et recouvert d’une greffe de peau récoltée à partir de la queue d’une souris de donneur génétiquement similaire.
Résumé
Les blessures superficielles triviales guérissent sans complications par l’intention primaire. Les blessures profondes, telles que les brûlures d’épaisseur complète, guérissent par intention secondaire et nécessitent le débridement chirurgical et la greffe de peau. L’intégration réussie de la greffe de donneur dans un lit de blessure de destinataire dépend du recrutement opportun des cellules immunitaires, de la réponse angiogénique robuste et de la nouvelle formation extracellulaire de matrice. Le développement de nouveaux agents thérapeutiques, qui ciblent certains processus clés impliqués dans la cicatrisation des plaies, sont entravés par l’absence de modèles précliniques fiables avec une évaluation objective optimisée de la fermeture des plaies. Ici, nous décrivons un modèle peu coûteux et reproductible de la blessure expérimentale de brûlure de pleine épaisseur reconstruite avec une greffe de peau allogénique. La blessure est induite sur la surface dorsale des souris de type sauvage consanguine anesthésiées des arrière-plans BALB/C et SKH1-Hrhr. La brûlure est produite à l’aide d’un modèle en laiton mesurant 10 mm de diamètre, qui est préchauffé à 80 °C et livré à une pression constante pendant 20 s. L’eschar de brûlure est excisé 24 heures après la blessure et remplacé par une greffe d’épaisseur complète récoltée à partir de la queue d’une souris donneur génétiquement similaire. Aucun équipement spécialisé n’est nécessaire pour la procédure et les techniques chirurgicales sont simples à suivre. La méthode peut être implémentée et reproduite sans effort dans la plupart des milieux de recherche. Certaines limitations sont associées au modèle. En raison de difficultés techniques, la récolte de greffes de peau d’épaisseur fendue plus minces n’est pas possible. La méthode chirurgicale que nous décrivons ici permet la reconstruction des plaies de brûlure utilisant des greffes de peau pleine épaisseur. Il peut être utilisé pour effectuer des tests thérapeutiques précliniques.
Introduction
Le débridement chirurgical et la greffe de peau sont des pratiques cliniques courantes utilisées dans la gestion des blessures chroniques1, brûlures2, et des blessures aiguës telles que les blessures traumatiques3. La greffe de peau se réfère à la procédure chirurgicale, qui implique l’enlèvement de la peau saine d’une partie du corps et le transférer à une autre. Les greffes de donneurs remplacent le tissu perdu et fournissent un échafaudage structurel pour la migration et la croissance cellulaires. Après l’intégration dans le site récepteur, les greffes de peau remplacent la barrière cutanée perdue en offrant une protection contre l’invasion microbienne, les effets nocifs de l’environnement externe et la perte excessive d’humidité4. L’intégration réussie de greffe de peau dépend de plusieurs facteurs. Ceux-ci incluent des réponses immunitaires adéquates en présence d’infections microbiennes et la résolution opportune de l’inflammation, l’angiogenèse robuste au site de blessure et l’établissement des anastomoses vasculaires entre le lit de destinataire et la greffe de donneur5. Comme la greffe commence à se dégrader, les cellules cutanées résidentes doivent être remplacées par des cellules capables de produire une nouvelle matrice extracellulaire. Dans le même temps, les kératinocytes épidermiques doivent ramper au-dessus de la matrice nouvellement produite pour former le néo-épiderme et ré-épithélialiser la blessure. Il est donc évident que la migration efficace des cellules du lit receveur vers la greffe du donneur est un autre facteur déterminant qui influence l’incorporation réussie de greffe. Compte tenu du grand nombre de facteurs impliqués dans la cicatrisation des plaies6, qui peut être impossible à contrôler dans les essais humains en raison de limitations éthiques, des modèles de greffe de peau expérimentale préclinique sont nécessaires. Le développement de modèles précliniques de la cicatrisation des plaies brûlées et de la greffe de peau associée sera important pour la compréhension des mécanismes complexes impliqués dans la réparation des tissus cutanés et essentiels pour l’essai de nouveaux agents thérapeutiques. Les modèles in vitro de la cicatrisation des plaies sont incapables d’imiter avec précision la complexité du tissu cutané. Les modèles animaux in vivo sont un outil d’investigation indispensable pour comprendre les mécanismes impliqués dans la réparation des tissus.
Plusieurs méthodes de la technique de greffe de peau ont été développées chez les rongeurs pour imiter l’excision chirurgicale et la reconstruction de blessure de brûlure7,8,9. Cependant, la plupart des procédures précédemment décrites n’ont pas réussi à induire une blessure thermique de brûlure avant la greffe de peau. Au lieu de la blessure de brûlure, une blessure excisionnelle pleine épaisseur a été induite, qui a ensuite été reconstruite avec une allogreffe de peau pleine épaisseur7. Divers repères anatomiques tels que l’oreille, la queue et le dos ont été utilisés pour la récolte de la peau du donneur chez les rongeurs7,8. Différentes techniques de fixation et de stabilisation de greffe ont été rapportées, y compris une « technique sans suture »9, des sutures7 et de la colle chirurgicale10,11,12.
Le but de cette étude était de développer un modèle murin d’une blessure de brûlure d’épaisseur complète qui récapitulerait l’approche d’étalon-or actuelle dans le traitement de brûlure, qui implique l’excision non viable de tissu et la greffe de peau. Une brûlure thermique a été induite sur la surface dorsale d’une souris à l’aide d’un modèle en laiton préchauffé. L’eschar de brûlure a été excisé et remplacé par une greffe d’épaisseur complète récoltée à partir de la queue d’une souris de donneur. Ce modèle expérimental présente trois avantages clés. Tout d’abord, plus d’une blessure de brûlure peut être induite sur le dos de la souris bénéficiaire, et quatre greffes de peau de donneur peuvent être récoltées à partir d’une seule queue de la souris de donneur. Cela signifie que plusieurs traitements expérimentaux et témoins peuvent potentiellement être comparés à l’aide des mêmes animaux receveurs et donneurs. Selon la voie d’administration souhaitée, le traitement témoin peut inclure l’administration locale ou systémique du véhicule ou le contrôle placebo (p. ex., application topique de pommade, sous-cutanée, intrapéitoneal ou injection intraveineuse de solution). Deuxièmement, le moment du traitement et le point final de l’expérience peuvent être contrôlés. Troisièmement, ce modèle dépend de la reconstruction des plaies à l’aide de greffes pleine épaisseur récoltées à partir de la queue, qui sont connus pour avoir une plus grande probabilité d’incorporation réussie dans le site du donneur par rapport à la peau récoltée à partir du dos13. Cela peut être dû au nombre inférieur de cellules épidermiques de Langerhans, qui jouent un rôle clé dans l’immunobiologie cutanée, et sont associés au rejet de greffe de peau14.
Le modèle proposé de cicatrisation des plaies et d’intégration des greffes pourrait bien être appliqué aux souris transgéniques et knock-out. L’utilisation de souris génétiquement modifiées aidera à élucider les rôles que certains gènes peuvent jouer lors de la réparation des plaies. L’application exogène des préparations topiques de blessure ou de l’administration sous-cutanée des anticorps thérapeutiques au site de la blessure peut également être considérée.
En raison de difficultés techniques, les greffes de peau d’épaisseur fendue composées de l’épiderme et d’une partie du derme sont difficiles à obtenir chez les souris. Les greffes de peau de pleine épaisseur se composant de l’épiderme et du derme de pleine épaisseur sont connues pour exiger un lit de blessure bien vascularisé pour l’intégration réussie. L’incapacité de récolter des greffes de peau d’épaisseur fractionnée chez les souris peut être considérée comme une limitation de ce modèle. La fixation de la greffe de peau au lit de blessure de destinataire a été réalisée par l’application de la colle adhésive chirurgicale, qui est associée à moins de trauma et de dégradation rapide par rapport à d’autres moyens de fixation de tissu15. Des études antérieures ont montré que la suture est associée à une fixation plus forte des tissus que la colle chirurgicale à 24 h après la procédure chirurgicale15, qui peut être considéré comme un inconvénient de la procédure. Cependant, à des délais ultérieurs, la force biomécanique des plaies traitées avec un adhésif chirurgical devient comparable aux sutures15 et mieux que la fixation de base16. Après la fixation des tissus avec la colle chirurgicale, les blessures doivent être recouvertes d’un pansement. Bien que les blessures sur la surface dorsale de la souris soient difficiles à atteindre pour l’animal, l’habillage de blessure, d’autre part, est facile à manipuler et à enlever pour l’animal. Des changements fréquents d’habillage de blessure peuvent être justifiés.
L’hypothermie induite par l’anesthésie chez les petits rongeurs est un phénomène bien documenté17. L’hypothermie est un effet secondaire de cette procédure, qui provoque des complications, et compromet potentiellement la santé animale et la qualité des données. Par conséquent, cette méthode justifie la mise en œuvre de stratégies de gestion de la température, surtout si des SKH1-Hrhr glabres sont utilisées.
La limitation la plus importante de l’utilisation de souris pour imiter la fermeture des plaies humaines est la différence entre l’anatomie de la peau et la physiologie. Les blessures de souris guérissent principalement par contraction, tandis que les blessures humaines guérissent par la formation de tissu de granulation et la rééthelisation18. Pour tenir compte de cet écart, le modèle actuel peut être modifié et utilisé en combinaison avec un anneau d’attelle étroitement collé autour de la plaie pour prévenir la contraction de la peau19. Compte tenu de certains avantages et inconvénients de ce protocole in vivo, ce modèle pourrait servir d’outil pour étudier certains processus impliqués dans la cicatrisation des plaies qui sont impossibles à étudier in vitro.
Protocole
Toutes les expériences ont été approuvées par le ministère Français de l’Enseignement supérieur et de la Recherche (numéro d’étude : 122162017111616517670v2 et DAP180012). Toutes les souris ont été logées à leur arrivée dans des cages en plastique et ont eu droit à une période d’acclimatation de 7 jours avant l’étude. La salle des animaux a été maintenue à un cycle clair/foncé de 12/12 h (lumières allumées à 07:00). De la nourriture et de l’eau du robinet ont été fournis ad libitum. Les souris BALB/c et SKH1-Hrhr ont été nourries à un régime traditionnel à base de blé et de soja. La litière de sciure de scie a été fournie avec du matériel de nidification.
1. Préparation de l’équipement
- Préparer un dispositif de combustion pour la procédure et le régler à 80 °C à l’aide du contrôleur de température (Figure 1A). Vérifiez la température du modèle en laiton (figure 1B,C)à l’aide de la caméra thermique infrarouge.
- Assurez-vous que le manomètre numérique fonctionne correctement.
- Couvrir la scène d’un drapé chirurgical et ajuster la hauteur de la table (figure 1A).
2. Soins préopératoires et intraopératoires des animaux
- Acquérir des souris BALB/c et SKH1-Hrhr, âgées de 6 à 8 semaines.
- Ajouter la suspension de paracétamol à 3 mg/mL à l’eau potable et fournir 12 heures avant et jusqu’à 72 heures après la procédure.
- À l’aide d’une seringue de 1 mL et d’une aiguille de 26 G, administrer de la buprénorphine sous-cutanéement à 0,05 μg/g 30 min avant la procédure et toutes les 6 heures pendant les 72 premières heures suivant la procédure.
- À l’aide d’une seringue de 1 mL et d’une aiguille de 26 G, administrer la lidocaïne au dorsum de la souris et 2-3 mm distal à la zone de la brûlure. Injecter de la lidocaïne à 0,05 μg/g sous-cutanéement 15 min avant l’induction de la plaie brûlée.
- Anesthétiser les souris à l’aide d’une injection intrapéritonéale de xylazine à 10 mg/kg et de kétamine 100 mg/kg. Utilisez une seringue de 1 mL et une aiguille de 26 G pour administrer l’injection.
- Étape critique : Placez la souris anesthésiée sur un tampon chauffé et gardez la souris au chaud pour prévenir l’hypothermie pendant les 30 premières minutes après l’induction de l’anesthésie et pendant au moins 15 minutes après la récupération de l’anesthésie. En plus de la garniture chauffée, d’autres modalités, y compris les lampes thermiques,les liquides chauds circulants ou de l’air, et les réservoirs de chaleur pré-réchauffés peuvent être utilisés pour réguler la température corporelle.
- Appliquer du gel de lubrification sur les yeux de la souris pour prévenir la déshydratation de la cornée.
- Utilisez le réflexe de retrait de pincement d’orteil pour évaluer la profondeur de l’anesthésie.
- À l’aide d’une seringue de 1 mL et d’une aiguille de 26 G, administrer 200 μL de solution de ringer lactated complétée par 5 % de dextrose. Administrer le remplacement du liquide sous-cutanéement immédiatement après l’induction de l’anesthésie et 6 heures après la procédure pour prévenir la déshydratation.
3. Induction de brûlure de brûlure d’épaisseur complète
- Raser la souris anesthésiée avec les coupe-cheveux.
- Appliquer la crème de dépilation sur la surface dorsale de la souris pendant 1 minute. Essuyez la crème à l’aide de gaze stérile et nettoyez la zone avec un morceau de gaze humide. Éponger la peau avec un peu de gaze jusqu’à ce qu’elle soit sèche.
- Placez la souris sur la scène recouverte d’un drapé chirurgical et déplacez la scène vers le haut plus près du modèle de laiton préchauffé.
- Appliquer le modèle circulaire en laiton à l’arrière de la souris (80 °C pour 20 s) en utilisant une pression constante de 0,15 N (figure 2).
- Étape critique : Immédiatement après l’induction de brûlure, placez l’animal anesthésié sur le tampon chauffé pour prévenir l’hypothermie et garder la souris au chaud pendant et après la procédure. Une fois récupéré de l’anesthésie, retourner la souris dans la cage.
- Étape critique : Fournir un régime en purée sur le plancher de la cage pendant les 72 premières heures après l’intervention chirurgicale. Les souris sont parfois réticentes à atteindre jusqu’à un tube sipper pour boire de l’eau après une blessure de brûlure.
4. Récolte de la greffe de donneur
- Faire une incision longitudinale avec un scalpel dans la partie supérieure de la queue de la souris donneuse et enlever doucement la peau à l’aide de forceps chirurgicaux.
- Placer la peau de la queue dans une boîte de Pétri stérile remplie de 10 mL de solution saline stérile de 0,9%. Utilisez une règle pour mesurer les greffes individuelles et couper la peau de la queue en morceaux, chacun mesurant 15 mm, à l’aide d’un scalpel.
- Une fois préparées, conservez les greffes de peau dans une solution saline de 0,9 % à 4 °C pendant jusqu’à 2 heures.
5. Excision chirurgicale et greffe de peau
- Vingt-quatre heures après l’induction de brûlure, préparer la souris pour l’anesthésie par inhalation d’isoflurane. Placez la souris dans la chambre d’induction et induisez l’anesthésie à l’aide de 5% d’isoflurane dans 100% d’oxygène à un débit de 4 L/min. Pour maintenir l’anesthésie pendant la chirurgie, utilisez 2% d’isoflurane à 2 L/min.
- Placez un drapé chirurgical sur la souris et découpez une fenêtre pour exposer le champ chirurgical. En utilisant la technique aseptique, écouvillonner la plaie d’abord avec de l’iode povidone, puis avec 70% d’alcool.
- Prenez doucement le tissu brûlé avec une paire de pinces chirurgicales et excisez tous les tissus nécrotiques et non viables avec des ciseaux chirurgicaux stériles et des pinces à épiler. Retirez la couche de panniculus carnosus de l’hypoderme pour créer un lit de destinataire stable.
- Placez la greffe de peau sur le lit de blessure fraîchement préparé. Tirez doucement la peau environnante vers la greffe de peau à l’aide de pinces chirurgicales. Appliquer un peu d’adhésif chirurgical pour attacher la greffe au lit de la plaie et presser doucement pour aligner les bords de la peau. Étape critique : La taille du lit de blessure doit être légèrement plus grande que la taille de la greffe de peau pour assurer l’engreffement réussi.
- Permettre à la souris de se remettre de l’anesthésie. Étape critique: Placez la souris sur un pavé chauffant. Gardez la souris au chaud pendant et après la procédure pour prévenir l’hypothermie.
- Appliquer un pansement inerte de gaze de paraffine et un pansement secondaire adhésif sur la plaie greffée.
- Placez la souris dans une cage individuelle. Étape critique : Fournir un régime en purée sur le plancher de la cage pendant les 72 premières heures après l’intervention chirurgicale et surveiller quotidiennement.
- Fournir des jouets et enrichir l’environnement.
6. Imagerie numérique et collecte des plaies post mortem
- Photographiez les blessures à l’aide d’un appareil photo numérique en plaçant une règle à côté de la plaie (figure 3).
- À la fin de l’expérience, euthanasier les animaux par l’exposition au dioxyde de carbone et à la dislocation cervicale. Étape critique: L’action de traction excessive de la peau pendant la dislocation cervicale peut endommager la greffe.
- À l’autopsie, excise chirurgicalement les blessures dorsales de brûlure au fascia à l’aide de ciseaux. Blessures en deux. Fixer la moitié dans 10% de formaline tamponnée et le processus pour l’histologie et l’immunohistochimie. Congeler rapidement l’autre moitié dans l’azote liquide pour l’extraction de l’ARN et la quantitation des protéines et le conserver à -80 °C.
7. Histologie de peau, immunohistorique et visualisation de collagène
- Incorporer des échantillons de peau dans la paraffine, couper à 4 sections de μm et placer sur des lames chargées positivement.
- Utilisez des diapositives tachées d’hématoxyline et d’éosine pour évaluer le taux de rééthelialisation (% de la plaie d’origine). La zone de la plaie recouverte de néo-épiderme peut être exprimée en pourcentage de la plaie entière (figure 4). Utilisez une application de microscope numérique et un logiciel ImageJ pour effectuer l’analyse microscopique des sections.
- Utiliser des sections histologiques (4 μm d’épaisseur) préparées à partir de tissus fixes et de paraffine et les soumettre à l’immunohistochimie.
- Pour évaluer l’expression du collagène I et de la fibronectine chez les plaies, appliquer des anticorps primaires et incuber pendant 1 h. La détection peut être effectuée par des anticorps secondaires conjugués à la peroxydase de raifort spécifiques à l’espèce (HRP) ou à la phosphatase alcaline (AP).
- Réagissez les sections avec : (i) HRP,3,3'-diaminobenzidine (DAB) ou (ii) AP, Bond Polymer Affine Red (Table of Materials), qui donne une couleur rouge vif (Figure 5). Numérisez les sections à l’aide d’un instrument et analysez avec l’application de microscope numérique et ImageJ.
- Pour permettre l’évaluation histologique du dépôt de collagène, effectuer la coloration trichrome sur les sections histologiques à l’aide d’un kit commercial.
- Pour la visualisation des fibres de collagène, utilisez la microscopie multiphoton et la technique de deuxième génération harmonique (Figure 5). Utilisez un microscope multiphoton pour l’imagerie tissulaire comme précédemment décrit20. Utilisez un laser Ti:Sapphire avec une longueur d’onde centrale à 810 nm comme source laser pour générer des signaux de fluorescence excités deuxième harmonique et à deux photons (TPEF).
- Utilisez un faisceau laser équipé d’un objectif 25x/0.95 W pour collecter et exciter la deuxième génération harmonique (SHG) et TPEF. Détecter les signaux tels que décrits précédemment21 par les détecteurs pmt NDD. Utilisez un logiciel pour le contrôle de balayage laser et l’acquisition d’images.
Résultats
Les résultats démontrent que le protocole développé est une méthode simple, qui permet l’induction d’une blessure de brûlure d’épaisseur complète chez les souris. Les brûlures sont induites à l’aide d’un modèle en laiton préchauffé (Figure 1A-C). La zone brûlée apparaît comme une blessure circulaire avec un eschar blanc et une zone hyperémique. La taille de la brûlure est légèrement plus grande à 24 heures après la brûlure à la suite du phénomène bien décrit connu sous le nom de progression des brûlures, qui est peut-être due à l’inflammation aiguë22. Après l’excision, les brûlures sont reconstruites à l’aide d’une greffe de peau allogénique (figure 3). Le jour 7 après la blessure de brûlure, les blessures deviennent vascularisées5, qui est une indication de l’engreffement réussi. Les kératinocytes épidermiques migrent de la peau adjacente de destinataire dans l’effort pour fermer la blessure et combler l’écart entre les deux bords des blessures. L’analyse microscopique de la section tachée de H et E des blessures a révélé que la longueur du néo-épiderme devient significativement plus longue le jour 7 après brûlure par rapport au jour 3 après brûlure (Figure 4B). Avant d’effectuer une grande étude, il est fortement recommandé que les chercheurs réalisent une étude pilote, qui permet l’exploration d’une nouvelle intervention, l’évaluation de la faisabilité, l’identification des modifications à la méthode pour assurer la reproductibilité. Les effets statistiquement significatifs sont difficiles à détecter dans les échantillons plus petits, alors que l’augmentation de la taille de l’échantillon est un moyen d’accroître la puissance statistique d’un test. Par exemple, pour détecter une différence statistiquement significative (p < 0,05) dans le taux de réé epithélialisation des plaies (figure 4)entre les groupes, la taille de l’échantillon devrait se trouver entre six et huit souris par groupe. Toutes les expériences doivent être répétées au moins deux fois. Comme les cellules productrices de matrice, telles que les fibroblastes, migrent du tissu receveur dans la greffe, les composants clés de la matrice extracellulaire, y compris le collagène I et la fibronectine deviennent fortement exprimés dans la matrice nouvellement formée (Figure 5).

Figure 1 : Configuration de l’appareil en feu. (A) Placement et mise en place du dispositif de combustion. Le dispositif de combustion est connecté au contrôleur de température et est fixé au monomètre numérique pour permettre la surveillance de la pression. Le dispositif de combustion est suspendu au-dessus d’une scène réglable – surface plane sur laquelle les souris sont placées pour l’induction de la brûlure. (B-C) Une image de gros plan du modèle en laiton utilisé pour induire des brûlures de blessure. (C) Le diamètre du modèle en laiton est de 1 cm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
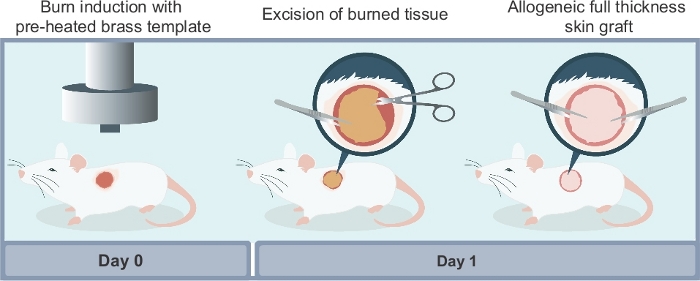
Figure 2 : Illustration schématique des différentes étapes requises pour reproduire le modèle expérimental décrit dans cet article. Il y a trois étapes principales de la procédure : (i) l’induction de la plaie de brûlure à l’aide d’un modèle de laiton préchauffé; ii) l’excision chirurgicale du tissu nécrotique non viable à 24 heures après la brûlure; (iii) reconstruction chirurgicale de blessure utilisant une greffe de peau allogénique pleine épaisseur récoltée à partir d’une souris de donneur. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
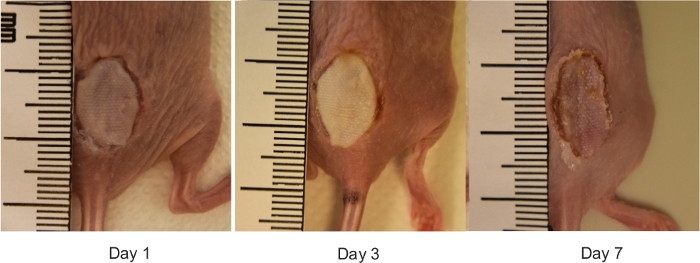
Figure 3 : Vue macroscopique des blessures reconstruites de brûlure de souris. Images numériques représentatives des blessures de brûlure reconstruites avec des greffes de peau allogéniques les jours 0, 1, 3 et 7 après des dommages de brûlure. La règle sur les images est en millimètres. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
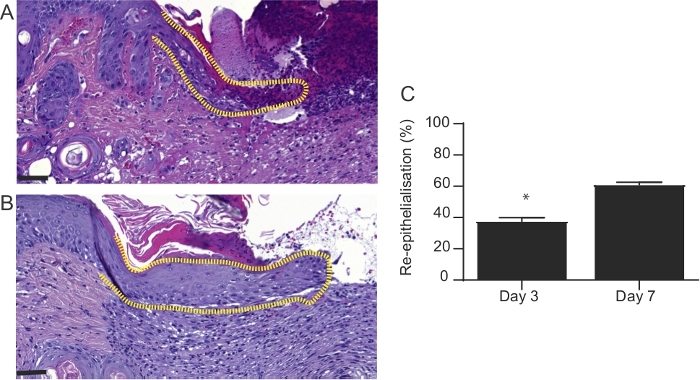
Figure 4 : Aspect microscopique des blessures à 3 et 7 jours après brûlure. Sections tachées de H&E de blessures 3 et 7 jours après les brûlures. La longueur du néo-épiderme (ligne pointillée) est significativement augmentée dans (A) jour 3 blessures par rapport à (B) jour 7 blessures. Dans (A) et (B), la barre d’échelle est de 100 μm. (C) Représentation graphique du pourcentage de réé epithélialisation de la plaie. Ceci a été évalué en mesurant la longueur du néo-épiderme au jour 3 et 7 de blessure post-brûlure et exprimé en pourcentage de la longueur entière de blessure. Les résultats représentent la moyenne ± S.E.M. (n = 6 souris dans le groupe du jour 3; n = 6 souris dans le groupe du jour 7, *p < 0,05; T-test de l’étudiant). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
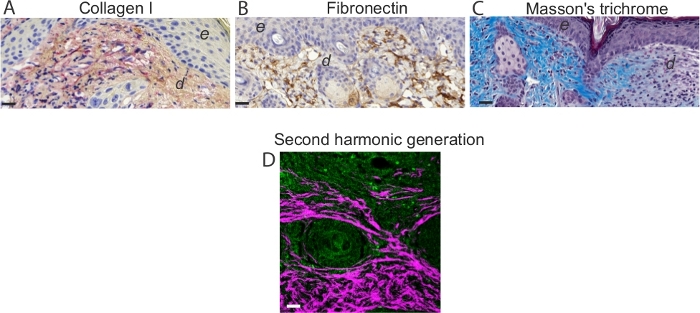
Figure 5 : Évaluation de la matrice extracellulaire et de la visualisation du collagène I. Images représentatives de l’analyse immunohistorique le jour 7 blessures de souris tachées pour (A) collagène et (B) fibronectine. Notez la coloration rouge intense dans les cellules I-positives en forme de fuseau allongé. Notez la coloration brune dans les cellules fibronectine-positives dans le derme des blessures de jour 7. Barre d’échelle = 50 μm dans toutes les images. Dans (A) et (B), e dénote l’épiderme et d dénote derme. (C) Visualisation des fibres de collagène et évaluation histologique du dépôt de collagène. (D) Représentant TPEF/SHG image de collagène du jour 7 blessures de souris. L’acquisition simultanée de TPEF/SHG à l’aide de polarisation circulaire et de signaux SHG a été traitée de manière sélective afin d’obtenir une distribution binaire de SHG après l’application d’un seuil. Les images TPEF (vertes) et SHG (blanc) étaient pseudo-colorées et superposées. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Selon la classification d’épaisseur des brûlures23, les brûlures d’épaisseur complète sont caractérisées par une implication évidente de toute l’épaisseur de la peau et d’une partie du tissu sous-cutané. Ce type de blessure ne peut guérir que par contraction ou avec la greffe de peau2. Une limite inhérente à la méthode décrite dans cet article est que seules les greffes de pleine épaisseur, par opposition aux greffes d’épaisseur fendue, qui sont souvent utilisées dans le cadre clinique, ont été récoltées à partir de la queue d’une souris. Cela était dû à la difficulté technique, car la peau de la souris est trop mince pour obtenir des greffes d’épaisseur fendue. Il faut souligner que les greffes de pleine épaisseur nécessitent un lit de plaie bien vascularisé, tandis que les greffes de peau d’épaisseur fendue sont capables de survivre aux sites de donneur avec moins de vascularité24. Des études antérieures ont montré qu’une brûlure induite à l’arrière de la souris était associée à une formation robuste de nouvelle vascularisation5. Ceci suggère qu’une zone bien vascularisée, telle que le dorsum de la souris, pourrait être considérée comme le point de repère anatomique pour l’induction des blessures de brûlure.
La profondeur des plaies brûlées est un facteur important à considérer. La profondeur de la brûlure doit être cohérente entre les souris individuelles. La reproductibilité de la profondeur de la plaie de brûlure dépend de la température du gabarit en laiton, de la pression et de la durée de l’exposition à la chaleur. La profondeur de la brûlure doit être vérifiée histologiquement. Il est important de garder à l’esprit que la pression excessive ou l’exposition prolongée de la peau au modèle de laiton préchauffé peut blesser le tissu sous-jacent. Le tissu entourant la colonne vertébrale, y compris les composants du système nerveux central et périphérique, est sensible à la chaleur et, s’il est endommagé, il peut entraîner une paralysie de la jambe arrière.
Bien qu’aucune mortalité postopératoire n’ait été directement associée à la procédure chirurgicale, un petit nombre de souris SKH1-Hrhr glabres, qui sont particulièrement sensibles au froid, ont développé l’hypothermie et n’ont pas réussi à récupérer après l’anesthésie générale. Par conséquent, la chaleur supplémentaire doit être fournie pendant tous les événements esthétiques et une surveillance constante est nécessaire pendant que la souris est anesthésiée.
La méthode décrite dans cette étude n’a pas été associée à l’infection chirurgicale de site. Cependant, la technique aseptique doit être employée pour empêcher le transfert des micro-organismes dans la blessure chirurgicale pendant la période périopératoire. L’inoculation de la plaie avec des micro-organismes bioluminescents ou fluorescents peut être incorporée dans la procédure. Cette technique peut être utile dans l’étude des organismes infectieux et de leur pathogénie25. Par exemple, l’addition exogène ou l’injection de bactéries bioluminescentes, peut permettre la surveillance de la charge microbienne à l’aide de l’imagerie animale entière in vivo25. Étant donné que les cheveux de souris sont connus pour interférer avec la fluorescence animale entière in vivo et l’imagerie de bioluminescence, les souris SKH1-Hrhr glabres sont des hôtes idéaux pour les études impliquant des reporters fluorescents ou bioluminescents.
Les échantillons de tissus de plaies peuvent être prélevés à différents moments et traités pour l’analyse histologique et immunohistochimique. Les protéines et l’ARN peuvent être isolés de la biopsie de la peau et les techniques de biologie moléculaire peuvent être utilisées pour évaluer l’expression des molécules clés impliquées dans la cicatrisation des plaies.
Dans la présente étude, nous avons décrit un modèle expérimental de cicatrisation des plaies de brûlures et d’engreffement allogénique de la peau. Cette procédure peut être modifiée et servir de modèle pour les études précliniques.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Ce travail a été soutenu par La Direction Générale de L’Armement, l’Agence de l’Innovation de Défense et l’École Polytechnique. Nous remercions notre collègue Yann Plantier de l’École Polytechnique qui a fourni un aperçu et une expertise qui ont grandement contribué à la production du dossier vidéo. Les auteurs remercient M. Benoit Peuteman et Mme Charlotte Auriau de l’INSERM Lavoisier (SEIVIL) US 33, Hôpital Paul Brousse, Villejuif pour leur expertise en matière de bien-être et de soins des animaux fournies dans le cadre de ce projet.
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml syringue | Terumo | SS + 01T1 | |
| 26 G needle | Terumo Agani | NN-2613R | 1/2'' - 0,45 X 12mm |
| 96X21 mm Petri Dish | Dutscher | 193199 | |
| Animal Weighing scale | Kern | EMB 5.2K5 | |
| BALB/c mouse | Janvier labs | BALB/cAnNRj | 6-weeks old |
| Biopsy foam pads 30.2X25.4X2mm | Simport | M476-1 | |
| Bond polymer Refine Red | Leica Biosystems | DS9390 | |
| Brass block | BVG | custom-designed | Circular 10 mm in diameter |
| Buprenorphine (BUPRECARE) | Axience | FR/V/6328396 3/2011 | administered subcutaneously at a dose of 0.05 μg/ g |
| Burning apparatus Kausistar 400 | TraçaMatrix | 34010 | |
| CaseViewer | 3DHISTECH Ltd. | 3Dhistech, Budapest, Hungary | |
| Collagen I antibody | Abcam | ab34710 | Recommanded concentration 1:50; 1:200 |
| D-(+)- glucose (Dextrose) | Sigma Aldrich | G-8769-100 ml | |
| DAB | Leica Biosystems | AR9432 | |
| Digital camera | NIKON | D3400 | objective: SIGMA 18-250mm F3.5-6.3 DC MACRO C45 |
| Depilating cream | Veet | ||
| Disposable scalpels | Swann Morton | 6601 | |
| DPBS | PAN biotech | P04-36300 | |
| Ethanol absolute | VWR chemicals | 20821.310 | |
| Fibronectin antibody | Abcam | ab23750 | Recommanded dilution 1:1000 |
| Filter 0.22um | Sartorius | 16532 | |
| Fine Scissors | F.S.T. | 14094-11 | |
| Forceps Dumont | F.S.T. | 11295-10 | |
| Hair clippers | AESCULAP | B00VAQ4KUY (ISIS) | |
| Heating pad | Petelevage | 120070 | |
| Isofluorane | Piramal healthcare | FR/V/03248850/2011 | |
| Ketamine | Imalgene | FR/V/0167433 4/1992 | surgical anesthetic, administered intraperitoneally at a dose of 100mg/kg |
| Lactated Ringers solution | Flee-Flex | 1506443 | |
| Lamina multilabel slide scanner | Perkin Elmer | ||
| LAS software | Leica | version 2.7.3 | |
| Leica Bond III | Leica Biosystem | 1757 | |
| Leukosilk dressing | BSN medical | 72669-01 | |
| Lidocaine | Aguettant | N01BB02 | local analgesic, administered subcutaneously at a dose of 0.05 μg/ g |
| Manometer | Kern | HDB-5K5 | |
| Masson Trichrome Staining kit | Sigma-Aldrich | HT15-1KT | |
| Micromesh Biopsy cassettes | Simport | M507 | |
| Multiphoton inverted stand Leica SP5 microscope | Leica microsystems | DM500 | Scanner 8000Hz NDD PMT detectors |
| Non adhering dressing Adaptic | Systagenix | A6222 | 12.7cm X 22.9 cm |
| Ocrygel | Tvm France | ### | |
| Paracetamol 300mg | Dolliprane | Liquiz | |
| Paraformaldheyde 4% | VWR chemicals | 1169945 | |
| Povidone-iodine | MEDA pharma | D08AG02 | diluted to 1:2 |
| SKH1-Hrhr mouse | Charles river | 686SKH1-HR | 6-weeks old |
| Slides | Thermoscientific | AGAA000080 | |
| Surgical adhesive | BSN medical | 9927 | |
| Sterile Gauze | Hartmann | 418545/9 | 10 X 10 cm |
| Sterile water | Versylene Fresenius | B230521 | |
| Surgical drape | Hartmann | 2775161 | |
| Ti:Sapphire ChameleonUltra | Coherent | DS 16-02-16 F | 690-1040 nm |
| Thermal imaging Camera | Testo | Testo 868 | |
| Xylazine (Rompum 2%) | Bayer | FR/V/ 8146715 2/1980 | surgical anesthetic, administered intraperitoneally at a dose of 10 mg/kg |
Références
- Shakir, S., et al. Indications and Limitations of Bilayer Wound Matrix-Based Lower Extremity Reconstruction: A Multidisciplinary Case-Control Study of 191 Wounds. Plastic and Reconstructive Surgery. , (2019).
- Greenhalgh, D. G. Management of Burns. New England Journal of Medicine. 380 (24), 2349-2359 (2019).
- Bosse, M. J., et al. An analysis of outcomes of reconstruction or amputation after leg-threatening injuries. New England Journal of Medicine. 347 (24), 1924-1931 (2002).
- Braza, M. E., Fahrenkopf, M. P. . StatPearls. , (2019).
- Duchesne, C., Banzet, S., Lataillade, J. J., Rousseau, A., Frescaline, N. Cold atmospheric plasma modulates endothelial nitric oxide synthase signalling and enhances burn wound neovascularisation. Journal of Pathology. 249 (3), 368-380 (2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 266 (2014).
- Pakyari, M., et al. Local Expression of Indoleamine 2,3, Dioxygenase Prolongs Allogenic Skin Graft Take in a Mouse Model. Advances in Wound Care. 8 (2), 58-70 (2019).
- Pakyari, M., et al. A new method for skin grafting in murine model. Wound Repair and Regeneration. 24 (4), 695-704 (2016).
- McFarland, H. I., Rosenberg, A. S. Skin allograft rejection. Current Protocols in Immunology. , (2009).
- Cristobal, L., et al. Local Growth Hormone Therapy for Pressure Ulcer Healing on a Human Skin Mouse Model. International Journal of Molecular Sciences. 20 (17), (2019).
- Melican, K., Aubey, F., Dumenil, G. Humanized mouse model to study bacterial infections targeting the microvasculature. Journal of Visualized Experiments. (86), (2014).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Larsen, C. P., et al. Migration and maturation of Langerhans cells in skin transplants and explants. Journal of Experimental Medicine. 172 (5), 1483-1493 (1990).
- Leonard, D. A., Kurtz, J. M., Cetrulo, C. L. Vascularized composite allotransplantation: towards tolerance and the importance of skin-specific immunobiology. Current Opinion in Organ Transplantationt. 18 (6), 645-651 (2013).
- Stoikes, N., et al. Biomechanical evaluation of fixation properties of fibrin glue for ventral incisional hernia repair. Hernia: The Journal of Hernias and Abdominal Wall Surgery. 19 (1), 161-166 (2015).
- Foster, K., et al. Efficacy and safety of a fibrin sealant for adherence of autologous skin grafts to burn wounds: results of a phase 3 clinical study. Journal of Burn Care & Research. 29 (2), 293-303 (2008).
- Caro, A. C., Hankenson, F. C., Marx, J. O. Comparison of thermoregulatory devices used during anesthesia of C57BL/6 mice and correlations between body temperature and physiologic parameters. Journal of the American Association for Laboratory Animal Science. 52 (5), 577-583 (2013).
- Grada, A., Mervis, J., Falanga, V. Research Techniques Made Simple: Animal Models of Wound Healing. Journal of Investigative Dermatology. 138 (10), 2095-2105 (2018).
- Wang, X., Ge, J., Tredget, E. E., Wu, Y. The mouse excisional wound splinting model, including applications for stem cell transplantation. Nature Protocols. 8 (2), 302-309 (2013).
- Ruzehaji, N., et al. Pan PPAR agonist IVA337 is effective in prevention and treatment of experimental skin fibrosis. Annals of the Rheumatic Diseases. 75 (12), 2175-2183 (2016).
- Ruzehaji, N., et al. Combined effect of genetic background and gender in a mouse model of bleomycin-induced skin fibrosis. Arthritis Research & Therapy. 17, 145 (2015).
- Singer, A. J., Burn Boyce, S. T. Wound Healing and Tissue Engineering. Journal of Burn Care & Research. 38 (3), 605-613 (2017).
- Shakespeare, P. Burn wound healing and skin substitutes. Burns. 27 (5), 517-522 (2001).
- Sun, B. K., Siprashvili, Z., Khavari, P. A. Advances in skin grafting and treatment of cutaneous wounds. Science. 346 (6212), 941-945 (2014).
- Miller, R. J., et al. Development of a Staphylococcus aureus reporter strain with click beetle red luciferase for enhanced in vivo imaging of experimental bacteremia and mixed infections. Scientific Reports. 9 (1), 16663 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon