Method Article
Amplification isothermale à médiatographie en boucle pour le dépistage de Salmonella dans les aliments pour animaux et la confirmation de Salmonella de l’isolement culturel
Dans cet article
Résumé
L’amplification isothermale à base de boucle (LAMP) est un test isothermal d’amplification de l’acide nucléique (iNAAT) qui a suscité un grand intérêt dans le domaine de la détection des pathogènes. Ici, nous présentons un protocole Salmonella LAMP validé en laboratoire comme une méthode rapide, fiable et robuste pour le dépistage de Salmonella dans les aliments pour animaux et la confirmation de salmonella présumée de l’isolement culturel.
Résumé
L’amplification isothermale à médie en boucle (LAMP) est apparue comme un puissant test d’amplification de l’acide nucléique pour la détection rapide de nombreux agents bactériens, fongiques, parasitaires et viraux. Salmonella est un agent pathogène bactérien préoccupant pour la salubrité des aliments dans le monde entier, y compris les aliments pour animaux. Il s’agit d’un protocole Salmonella LAMP validé en laboratoire qui peut être utilisé pour dépister rapidement la présence de salmonelloses chez les animaux et qui peut également être utilisé pour confirmer les isolats présumés de Salmonella récupérés dans toutes les catégories d’aliments. L’analyse LAMP cible spécifiquement le gène d’invasion de Salmonella (invA)et est rapide, sensible et très spécifique. Les DNA modèles sont préparés à partir de bouillons d’enrichissement d’aliments animaux ou de cultures pures d’isolats présumés de Salmonella. Le mélange de réapprovisionnement LAMP est préparé en combinant un mélange maître isothermal, des amorces, un modèle d’ADN et de l’eau. L’analyse LAMP fonctionne à une température constante de 65 °C pendant 30 min. Les résultats positifs sont surveillés par fluorescence en temps réel et peuvent être détectés dès 5 min. L’analyse LAMP présente une tolérance élevée aux inhibiteurs des aliments ou des cultures animales, servant de méthode rapide, fiable, robuste, rentable et conviviale pour le dépistage et la confirmation de Salmonella. La méthode LAMP a récemment été intégrée au chapitre 5 du Manuel d’analyse bactériologique (BAM) de la Food and Drug Administration des États-Unis.
Introduction
L’amplification isothermale à médiés en boucle (LAMP) est un nouveau test d’amplification de l’acide nucléique isothermique (iNAAT) inventé en 2000 par un groupe de scientifiques japonais1. Grâce à la formation d’une structure d’ADN en boucle de tige spécifique à la cible au cours des étapes initiales, LAMP utilise une polymése d’ADN qui déplace les brins pour amplifier efficacement ce matériau de départ de façon quasi exponentielle, ce qui donne10 9 copies de la cible en moins de 1 h1. Par rapport à la réaction en chaîne de polyméseau (PCR), un NAAT largement utilisé, LAMP possède plusieurs avantages. Tout d’abord, les réactions lamp sont effectuées dans des conditions isothermales. Cela évite la nécessité d’un instrument sophistiqué de cycle thermique. Deuxièmement, LAMP est très tolérant aux médias culturels et aux substancesbiologiques 2 avec une robustesse démontrée pour les applications cliniqueset alimentaires 3,4. Cela simplifie la préparation de l’échantillon et minimise les faux résultats négatifs5. Troisièmement, LAMP est accessible à de multiples plates-formes de détection, telles que la turbidité, la colorimétrie, la bioluminescence, la fluorescence et les microfluidiques6. Quatrièmement, LAMP est très spécifique car il utilise quatre à six amorces spécialement conçues pour cibler six à huit régionsspécifiques 1,7. Cinquièmement, LAMP est ultrasensible et de nombreuses études ont rapporté sa sensibilité supérieure au PCR ou pcr8 en temps réel. Enfin, LAMP est plus rapide avec de nombreux analyses adoptant maintenant un temps de course standard de 30 min tandis que les analyses de type PCR prennent généralement 1−2 h8.
Ces caractéristiques attrayantes ont alimenté l’application de LAMP dans de vastes zones de détection d’agents pathogènes, y compris le diagnostic in vitro9, le diagnostic des maladies animales10et les tests alimentaires etenvironnementaux 11. Notamment, une lampe tuberculeuse (LAMP pour Mycobacterium tuberculosis)a été recommandée par l’OMS comme test de remplacement valide pour la microscopie d’expectorations-frottis pour les diagnostics de tuberculose pulmonaire dans les milieuxpériphériques 12. L’application LAMP s’étend également au-delà de l’identification microbienne pour inclure la détection d’allergènes, d’espèces animales, de résistance aux médicaments, d’organismes génétiquement modifiés et de pesticides13.
Salmonella nontyphoïde est un agent pathogène zoonotique qui a d’importants problèmes de salubrité et de santé publique dans le mondeentier14. Il a également été identifié comme un danger microbien important dans les aliments pour animaux (c.-à-d. aliments pour animaux)15,16. Pour prévenir les maladies ou les éclosions de Salmonella causées par des aliments humains et des aliments pour animaux contaminés, il est impératif d’avoir des méthodes rapides, fiables et robustes pour tester Salmonella dans une variété de matrices. Au cours de la dernière décennie, des efforts considérables ont été déployés à l’échelle internationale pour le développement et l’application d’essais Salmonella LAMP dans un large éventail de matrices alimentaires, comme l’a récemment résumé un examenapprofondi 8. Plusieurs essais salmonella LAMP, y compris celui présenté ici, ont complété avec succès la validation multi-laboratoires suivant des lignes directrices internationales bien établies17,18,19,20.
Notre analyse Salmonella LAMP cible spécifiquement le gène d’invasion salmonella invA (numéro d’adhésion GenBank M90846)21 et est rapide, fiable et robuste dans plusieurs matricesalimentaires 4,22,23,24,25,26. La méthode a été validée dans six matrices d’aliments pour animaux dans une étude précollaborative26 et dans les aliments secs pour chiens dans une étude collaborative multi-laboratoire19. Par conséquent, la méthode Salmonella LAMP présentée ici a récemment été incorporée au Manuel d’analyse bactériologique (BAM) de la Food and Drug Administration (FDA) des États-Unis (BAM) Chapitre5 Salmonella27 à deux fins, l’une comme méthode de dépistage rapide de la présence de Salmonella dans les aliments pour animaux et l’autre comme méthode de confirmation fiable pour salmonella présumée isolée de tous les aliments.
Protocole
REMARQUE : Un mélange de réaction LAMP contient de la polymése d’ADN, du tampon, du MgSO4,des dNTP, des amorces, du modèle d’ADN et de l’eau. Les quatre premiers reagents sont contenus dans un master mix isothermal(Table of Materials). Les amorces sont préméxées à l’interne pour devenir un mélange d’amorce (10x). Les modèles d’ADN peuvent être préparés à partir de bouillons d’enrichissement d’échantillons d’aliments animaux à des fins de dépistage ou de cultures d’isolats présumés de Salmonella à des fins de confirmation. En outre, un contrôle positif (ADN extrait de toutes les souches de référence salmonella, par exemple Salmonella enterica serovar Typhimurium ATCC 19585 [LT2]) et un contrôle sans modèle (CNT; eau stérile de qualité moléculaire) sont inclus dans chaque course LAMP.
1. Préparation de modèles d’ADN
- Pour préparer des modèles d’ADN à partir d’enrichissements alimentaires d’animaux, suivez ces étapes.
- Pesez 25 g d’échantillon d’aliments pour animaux (p. ex., aliments secs pour chats, aliments secs pour chiens, aliments pour bovins, aliments pour chevaux, aliments pour volailles et aliments pour porcs) dans un sac filtre stérile(tableau des matériaux),ou équivalent. Placer le sac dans un grand récipient ou une grille pour le soutenir pendant l’incubation.
- Ajouter 225 mL d’eau peptone tamponnée stérile (BPW). Bien mélanger en tourbillonnant et en massant brièvement les mains. Laisser reposer à température ambiante pendant 60 ± 5 min.
- Bien mélanger en tourbillonnant et déterminer le pH à l’aide d’un papier d’essai. Réglez le pH, si nécessaire, à 6,8 ± 0,2 avec stérile 1 N NaOH ou 1 N HCl. Incuber à 35 ± 2 °C pendant 24 ± 2 h.
- Bien mélanger en faisant tourbillonner le sac contenant des bouillons d’enrichissement alimentaire pour animaux. Transférer 1 mL du côté filtré du sac dans un tube de microcentrifugeuse. Vortex brièvement.
- Extraire l’ADN à l’aide d’un réacctiqueurde préparation d’échantillon( Tableau des matériaux ) comme suit.
- Centrifugeuse à 900 x g pendant 1 min pour enlever les grosses particules et transférer le supernatant dans un nouveau tube de microcentrifugeuse.
- Centrifugeuse à 16.000 x g pendant 2 min et jeter supernatant.
- Suspendre la pastille dans 100 μL du réageni de préparation de l’échantillon et chauffer à 100 ± 1 °C pendant 10 min dans un bloc thermique sec.
- Laisser refroidir à température ambiante et conserver les extraits d’ADN échantillon à -20 °C.
- Pour préparer des modèles d’ADN à partir de cultures présumées de Salmonella, suivez ces étapes.
- Obtenez des isolats présumés de Salmonella de l’isolement de la culture dans tous les aliments suivant la section D de salmonella du chapitre 5 de la FDA : Isolement de Salmonella27.
- Salmonella présumée inoculée isole sur une plaque d’agar non sélective (p. ex., gélose sanguine, gélose nutritive et gélose de soja trypticase) et couve à 35 ± 2 °C pendant 24 ± 2 h.
- Transférer plusieurs colonies simples à 5 mL de bouillon de systé trypticase (BST) ou de bouillon d’infusion cardiaque cérébrale (BHI) et incuber à 35 ± 2 °C pendant 16 ± 2 h.
REMARQUE : Cette étape peut être facultative si la culture présumée de Salmonella est pure. Dans ce cas, les modèles d’ADN peuvent être préparés en suspendant plusieurs colonies simples dans 5 mL de BST et en chauffant 500 μL de la suspension à 100 ± 1 °C pendant 10 min dans un bloc thermique sec. Continuez avec l’étape 5 ci-dessous. - Transférer 500 μL de la culture nocturne dans un tube de microcentrifugeuse et chauffer à 100 ± 1 °C pendant 10 min dans un bloc thermique sec.
- Laisser refroidir à température ambiante et conserver isoler les extraits d’ADN à -20 °C.
- Pour préparer l’ADN de contrôle positif, suivez des étapes semblables à celles ci-dessus pour préparer des modèles d’ADN provenant de cultures présumées de Salmonella avec une étape de dilution supplémentaire.
- Inoculer S. Typhimurium ATCC 19585 (LT2) ou toute souche de référence Salmonella sur une plaque d’agar non sélectionné (p. ex., gélose sanguine, gélose nutritive et gélose de systépticase) et incuber à 35 ± 2 °C pendant 24 ± 2 h.
- Transférer plusieurs colonies simples à 5 mL de bouillon TSB ou BHI et incuber à 35 ± 2 °C pendant 16 ± 2 h pour atteindre ~109 CFU/mL.
- Diluer en série la culture du jour au lendemain dans de l’eau peptone de 0,1 % pour obtenir~10 7 CFU/mL.
- Transférer 500 μL de cette dilution dans un tube de microcentrifugeuse et chauffer à 100 ± 1 °C pendant 10 min dans un bloc thermique sec.
- Refroidir à température ambiante et conserver l’ADN de contrôle positif à -20 °C.
2. Préparation du mélange d’amorce (10x)
- Obtenez des amorces LAMP synthétisées commercialement (Sal4-F3, Sal4-B3, Sal4-FIP, Sal4-BIP, Sal4-LF et Sal4-LB) avec purification standard de desalting(tableau 1).
| Nom de l’amorce | Description | Séquence (5'-3') | Longueur (pb) |
| Sal4-F3 | Amorce extérieure vers l’avant | GAACGTGTCGCGGAAGTC GAACGTGTGTCGGAAGTC GAACGTGTGTCGCGGAAGTC GA | 18 |
| Sal4-B3 | Amorce extérieure arrière | CGGCAATAGCGTCACCTT | 18 |
| Sal4-FIP | Amorce intérieure avant | GCGCGGCATCCGCATCAATA-TCTGGATGGTATGCCCGG | 38 |
| Sal4-BIP | Amorce intérieure arrière | GCGAACGGCGAAGCGTACTG-TCGCACCGTCAAAGGAAC | 38 |
| Sal4-LF | Amorce avant de boucle | TCAAATCGGCATCAATACTCA-TCTG | 25 |
| Sal4-LB | Amorce arrière de boucle | AAAGGGAAAGCCAGCTTTACG AAAGGGAAAGCCAGCTTTACG AAAGGGAAAGCCAGCTTTACG | 21 |
Tableau 1 : Amorce LAMP pour le dépistage de Salmonella dans les aliments pour animaux et la confirmation de Salmonella de l’isolement culturel. Les amorces sont conçues sur la base de la séquence Salmonella invA (numéro d’adhésion genbank M90846).
- Préparer des solutions de stock de chaque amorce (100 μM) en réhydratant l’amorce avec une quantité appropriée d’eau stérile de qualité moléculaire. Bien mélanger en tourbillonnant pendant 10 s et conserver à -20 °C (-80 °C pour le stockage à long terme).
- Préparer le mélange d’amorce (10x) selon une feuille de travail (Tableau 2). Ajoutez des volumes appropriés de solutions de stock d’amorce et d’eau stérile de qualité moléculaire dans un tube de microcentrifugeuse. Bien mélanger tous les reagents en vortexant pendant 10 s.
| Composant | Stock conc. (μM) | Primer mix conc. (μM) | Volume (μL) |
| Amorce Sal4-F3 | 100 | 1 | 10 |
| Amorce Sal4-B3 | 100 | 1 | 10 |
| Amorce Sal4-FIP | 100 | 18 | 180 |
| Amorce Sal4-BIP | 100 | 18 | 180 |
| Amorce Sal4-LF | 100 | 10 | 100 |
| Amorce Sal4-LB | 100 | 10 | 100 |
| Eau de qualité moléculaire | N/A | N/A | 420 |
| Total | N/A | N/A | 1000 |
Tableau 2 : Feuille de travail pour la préparation du mélange d’apprêt LAMP (10x). Les amorces sont énumérées dans le tableau 1.
- Aliquot le mélange d’amorce 10x à 500 μL par tube de microcentrifugeuse et conserver à -20 °C.
3. Assemblage d’une réaction LAMP
REMARQUE : Pour prévenir la contamination croisée, il est fortement recommandé de séparer physiquement les zones utilisées pour préparer le mélange principal LAMP et ajouter des modèles d’ADN. La figure 1 est un diagramme LAMP.

Figure 1 : Diagramme schématique du flux de travail salmonella LAMP. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
- Préparation et configuration d’exécuter
- Banc propre avec isopropanol et une solution de dégradation de l’ADN et de la DNase (Table of Materials). Nettoyer les pipettes et les porte-bandes à tube (Table of Materials) avec la solution dégradante de l’ADN et de la DNase.
- Décongeler le mélange maître isothermal, le mélange d’amorce (10x), l’eau de qualité moléculaire, l’ADN de contrôle positif, et les modèles d’ADN à température ambiante.
- Allumez l’instrument LAMP(Table of Materials) et appuyezsur l’écran d’ouverture pour accéder à l’écran d’accueil. Suivez ces étapes pour créer une course.
REMARQUE: Un modèle de l’instrument LAMP a 2 blocs (A et B) avec 8 échantillons dans chaque bloc et un autre modèle a un seul bloc qui accueille 8 échantillons (Tableau des matériaux).- Appuyez sur LAMP+Anneal et sélectionnez Modifier pour saisir des informations d’échantillon.
REMARQUE : Le profil de course LAMP par défaut consiste en une amplification à 65 °C pendant 30 min et une phase anneale de 98 °C à 80 °C avec 0,05 °C de décrément par sec. - Appuyez sur chaque ligne d’échantillon pour activer le curseur et saisir les informations pertinentes de l’échantillon, en utilisant l’icône de bloc AB pour passer entre les deux blocs d’instruments LAMP.
- Appuyez sur l’icône Vérifier lorsque toutes les informations de l’échantillon ont été saisies.
REMARQUE : En option, la configuration de l’exécuter (appelé « Profil », qui contient des informations d’échantillon ainsi que le profil d’exécuter LAMP par défaut) peut être sauvegardée pour une utilisation ultérieure. Appuyez sur l’icône Enregistrer et donnez au profil un nom unique. Lors de l’essai de ce même ensemble d’échantillons la prochaine fois, une nouvelle course peut être lancée à l’aide du profil enregistré. Appuyez sur l’icône Dossier en bas à gauche de l’écran d’accueil et sélectionnez Profil pour charger les profils enregistrés.
- Appuyez sur LAMP+Anneal et sélectionnez Modifier pour saisir des informations d’échantillon.
- Assemblage de réaction LAMP
REMARQUE : Lorsque vous utilisez les deux blocs d’instruments LAMP (A et B, un total de 16 échantillons), préparez le mélange principal LAMP pour 18 échantillons. Si vous n’utilisez qu’un seul bloc d’instruments LAMP (8 échantillons au total), préparez le mélange maître LAMP pour 10 échantillons. Pour les autres numéros d’échantillon, ajustez le volume en conséquence pour tenir compte de la perte de pipetage. Toujours inclure un contrôle positif et un CNT dans chaque course LAMP. Il est recommandé de dupliquer chaque échantillon dans des séries LAMP indépendantes.- Préparer le mélange maître LAMP selon une feuille de travail (Tableau 3). Ajouter les volumes appropriés du mélange maître isothermal, du mélange d’amorce et de l’eau de qualité moléculaire dans un tube de microcentrifugeuse et un vortex doucement pendant 3 s. Centrifugeuse brièvement.
- Placez la bande de tube dans le porte-bandes et distribuez 23 μL du mélange maître LAMP à chaque puits.
- Vortex tous les modèles d’ADN et centrifugeuse brièvement. Ajouter 2 μL de modèle d’ADN au puits approprié et bien capuchon.
- Retirez la bande de tube du support et feuilletez le poignet pour vous assurer que tous les réhésifs se sont mis en commun au fond du tube.
- Chargez la bande de tube dans le bloc d’instruments LAMP, en veillant à ce que les bouchons soient sécurisés avant de fermer le couvercle.
| Composant | Conc de travail. | Réaction finale conc. | Volume par échantillon (μL) | Volume pour 18 échantillons (μL) | Volume pour 10 échantillons (μL) |
| ISO-001 mélange maître isothermal | 1.67x | 1x (1x) | 15 | 270 | 150 |
| Mélange d’amorce | 10x (10x) | 1x (1x) | 2.5 | 45 | 25 |
| Eau de qualité moléculaire | N/A | N/A | 5.5 | 99 | 55 |
| Master mix subtotal | N/A | N/A | 23 | 414 | 230 |
| Modèle d’ADN | N/A | N/A | 2 | N/A | N/A |
Tableau 3 : Feuille de travail pour la préparation du mélange de réaction LAMP. Le mélange d’amorce (10x) est préparé selon le tableau 2 à l’aide de solutions de stock d’amorce énumérées dans le tableau 1.
4. Run LAMP
REMARQUE : Au cours d’une course LAMP, des lectures de fluorescence sont acquises à l’aide du canal FAM. Les valeurs de temps à pointe(Tmax; min) sont déterminées automatiquement par l’instrument pour le moment où le rapport de fluorescence atteint la valeur maximale de la courbe de taux d’amplification. Le Tm (°C) est la température de fusion/annealing du produit amplifié final.
- Cliquez sur l’icône Exécuter en haut à droite de l’écran et sélectionnez le bloc contenant la bande de tube (s) pour démarrer l’exécuter LAMP.
- En option, pendant que la réaction est en cours, appuyez sur lesonglets Température, Amplification et Anneal pour voir les changements dynamiques de différents paramètres pendant l’exécuter LAMP.
- Une fois la course terminée, appuyez sur les onglets Amplification et Anneal pour voir l’amplification complète et les courbes anneales et appuyez sur l’onglet Résultats pour afficher les résultats.
- En option, pour la tenue de dossiers, enregistrez le numéro d’exécuter situé en haut à gauche de l’écran, en utilisant le format de « numéro de number_run de série d’instruments », par exemple « GEN2-2209_0030 ».
5. Interprétation des résultats du LAMP
REMARQUE : Les résultats lampadaires peuvent être consultés directement et/ou à l’aide d’un logiciel LAMP(Tableau des matériaux).
- Pour interpréter les résultats lamp sur le tableau de bord, suivez ces étapes.
- Appuyez sur l’icône Dossier en bas à gauche de l’écran d’accueil et sélectionnez Journal pour naviguer vers l’emplacement du fichier pour charger l’exécuter LAMP d’intérêt.
REMARQUE : Les courses LAMP sont organisées par date, à partir de l’année. - Observez les cinq onglets associés à chaque course : Profil, Température, Amplification, Annealet Résultats.
REMARQUE : Les onglets Profil et température affichent les températures programmées et réelles, respectivement, dans les puits de l’échantillon au fur et à mesure de la réaction lampadaire. Les onglets Amplification et Anneal montrent des lectures de fluorescence et des changements dans la fluorescence pendant les phases d’amplification et d’anneal, respectivement. L’onglet Résultats affiche une vue tabulaire des résultats LAMP. - Appuyez sur l’onglet Résultats pour observer les résultats lamp pour chaque puits.
NOTE: Il ya trois colonnes (Eh bien, amplification, et Anneal). La colonne « Amplification » indique les valeurs de temps à pointe(Tmax; min:sec) pour chaque échantillon (« Eh bien ») et la colonne « Anneal » montre les températures de fusion/annealing(Tm; °C) pour tout produit amplifié dans ce puits. - Interpréter les résultats du LAMP et rendre compte des résultats finaux du LAMP comme suit.
- Examinez d’abord les puits de contrôle. Le puits NTC doit avoir un T max viergetandis que T mpeut être vide (les deux modèles d’instruments LAMP) ou < 83 °C (seulement pour le modèle d’instrument LAMP avec deux blocs). Le puits de contrôle positif devrait avoir Tmax entre 5 et 10 min et T mautour de 90 °C.
- Examiner les puits d’échantillonnage. Tous les échantillons avec le Tm correct (environ 90 °C) et le Tmax (entre 5−30 min) sont considérés positifs pour Salmonella.
- Rapportez les résultats finaux du LAMP en fonction des résultats des séries en double. Si les séries en double ont des résultats cohérents, les résultats finaux du LAMP peuvent être communiqués. Si les pistes en double sont incohérentes, répétez les deux séries indépendamment. Si les résultats sont encore incohérents, l’échantillon doit être considéré comme positif présumé pour Salmonella et devra passer par la confirmation de la culture.
- Appuyez sur l’icône Dossier en bas à gauche de l’écran d’accueil et sélectionnez Journal pour naviguer vers l’emplacement du fichier pour charger l’exécuter LAMP d’intérêt.
- Pour interpréter les résultats lamp à l’aide du logiciel, suivez ces étapes.
- Cliquez sur l’icône Ordinateur sur le panneau gauche et naviguez vers l’emplacement du fichier pour charger l’exécuter LAMP d’intérêt.
REMARQUE : L’ordinateur avec le logiciel installé n’a pas besoin d’être connecté à l’instrument LAMP pour analyser les résultats de LAMP, c’est-à-dire que l’accès à distance est disponible. Les courses LAMP sont organisées par date. - Observez les sept onglets associés à chaque course : Profil, Température, Amplification, Taux d’amplification, Anneal, Dérivé Anneal, et Résultat.
REMARQUE : À l’semblable à la vue du tableau de bord, les onglets Profil et température affichent les températures programmées et réelles, respectivement, dans les puits de l’échantillon au fur et à mesure de la réaction lampadaire. Les onglets Amplification/Amplification Et Anneal/Anneal Derivative montrent des lectures de fluorescence ou des changements dans la fluorescence pendant les phases d’amplification et d’anneal, respectivement. L’onglet Résultats affiche une vue tabulaire des résultats LAMP qui diffèrent légèrement de la vue du tableau de bord. - Appuyez sur l’onglet Taux d’amplification pour afficher graphiquement les ratios de fluorescence par temps. Cliquez sur l’icône Paramètre en haut à droite de l’écran et ajustez le « rapport de seuil de détection maximale » de 0,020 à 0,010.
REMARQUE : L’ajustement est nécessaire pour s’assurer que tous les pics valides sont identifiés et que les résultats obtenus à l’aide du logiciel correspondent à ceux affichés sur le tableau de bord. - Appuyez sur l’onglet Résultat pour observer les résultats lamp pour chaque puits.
REMARQUE : Il y a quatre colonnes (nom graphique, numéro de puits, nom de puits et valeur maximale). La partie supérieure de la colonne « Valeur maximale » indique « Temps d’ampli »(Tmax; min:sec) pour chaque échantillon (« Bien nom ») tandis que la partie inférieure montre « Dérivé anneal »(Tm; °C) pour tout produit amplifié dans ce puits. - Interpréter les résultats du LAMP et faire rapport des résultats finaux de la LAMP suivant des étapes similaires à celles de l’utilisation du tableau de bord, à une exception près, que le puits du CNT et d’autres échantillons négatifs devraient avoir un T m vierge, car les paramètres du logiciel LAMP éliminent ces résultats Tm < 83 °C. De même, tous les échantillons avec le Tm correct (environ 90 °C) et le Tmax (entre 5−30 min) sont considérés positifs pour Salmonella.
- Cliquez sur l’icône Ordinateur sur le panneau gauche et naviguez vers l’emplacement du fichier pour charger l’exécuter LAMP d’intérêt.
Résultats
La figure 2 et la figure 3 montrent des graphiques/tableaux LAMP représentatifs affichés sur les deux plateformes. Dans cette série LAMP, les échantillons S1 à S6 sont 10 fois dilutions en série de S. enterica serovar Infantis ATCC 51741 allant de 1,1 x 106 CFU à 11 CFU par réaction. Le contrôle positif est S. enterica serovar Typhimurium ATCC 19585 (LT2) à 1,7 x 104 CFU par réaction et NTC est de qualité moléculaire de l’eau.
Comme le montrent la figure 2E et la figure 3G, lespuits du CNT et du PC sont des contrôles valides. Le puits NTC a blanc Tmax tandis que T m est < 83 °C sur le tableau de bord LAMP et blanc dans le logiciel LAMP, ce qui suggère un résultat négatif. Le puits PC a Tmax de 7 min 45 sec et T m de ~ 90 °C sur les deux plates-formes, ce qui suggère un résultat positif. Les échantillons S1 à S6 ont Tmax entre 6 min 30 sec et 12 min 15 sec, tous étant salmonella-positif.
Après des séries en double d’un même ensemble d’échantillons, les résultats finaux de lamp sont rapportés pour ces échantillons. Cette course lamp représentative montre que LAMP détecte avec succès Salmonella avec un large éventail de concentrations dans les échantillons.

Figure 2 : Résultats du LAMP représentatif affichés sur le tableau de bord LAMP. (A) L’onglet Profil affiche le profil de température programmé. (B) L’onglet Température affiche les températures réelles dans les puits de l’échantillon au fur et à mesure de la réaction lampadaire. (C) L’onglet Amplification affiche les lectures de fluorescence pendant l’amplification LAMP. (D) L’onglet Anneal montre des changements dans la fluorescence (dérivé) au cours de la phase anneale. (E) L’onglet Résultats affiche une vue tabulaire des résultats LAMP. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
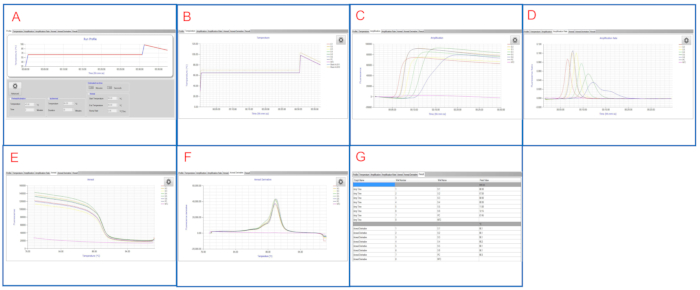
Figure 3 : Résultats lamp représentatifs consultés dans le logiciel LAMP. (A) L’onglet Profil affiche le profil de température programmé. (B) L’onglet Température affiche les températures réelles dans les puits de l’échantillon au fur et à mesure de la réaction lampadaire. (C) L’onglet Amplification affiche les lectures de fluorescence pendant l’amplification LAMP. (D) L’onglet Taux d’amplification montre des changements dans la fluorescence (rapport de fluorescence) pendant l’amplification LAMP. (E) L’onglet Anneal montre des lectures de fluorescence pendant la phase anneale. (F) L’onglet Dérivé Anneal montre des changements dans la fluorescence (dérivé) au cours de la phase anneale. (G) L’onglet Résultat affiche une vue tabulaire des résultats LAMP. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Nous avons présenté ici une méthode LAMP simple, rapide, spécifique et sensible pour le criblage et la confirmation de Salmonella dans les aliments pour animaux et la culture pure, respectivement. Avec la commodité d’un mélange maître isothermal qui contient quatre réamorts clés, et un prêt-à-utiliser, mélange d’apprêt préparé à l’interne, l’assemblage d’une réaction LAMP ne nécessite que quelques étapes pipetting (Figure 1). Le temps de course total, y compris l’amplification et les phases anneales, est inférieur à 38 min(figure 2A, B et figure 3A,B). Les résultats positifs sont surveillés par fluorescence en tempsréel (figure 2C et figure 3C,D)et peuvent être détectés dès 5 min26. La phase anneale sert de confirmation supplémentaire de la spécificité lamp puisque seuls les échantillons avec tm correct (environ 90 °C) sont déclarés positifs(figure 2D, E et figure 3E−G). Des sensibilités de 1 cellule de Salmonella dans la culture pure et et de 1 CFU/25 g dans la nourriture animale ont été rapportées précédemment26.
Comme LAMP est très efficace et génère une grande quantité d’ADN1, ilest essentiel que les meilleures pratiques de laboratoire soient utilisées pour prévenir la contamination croisée, ce qui peut inclure la séparation physique des zones pour la préparation du mélange maître LAMP et l’ajout de modèles d’ADN, en évitant de générer des aérosols, en utilisant des pointes de pipette filtrante, en changeant souvent de gants et en s’abstenant d’ouvrir des tubes de réaction LAMP après amplification.
La spécificité de cette méthode Salmonella LAMP a déjà été testée à l’aide de 300 souches bactériennes (247 Salmonella de 185 serovars et 53 nonSalmonella)et s’est démontrée 100% spécifique26. Notamment, des différences significatives dans tmax ont été observées entre les deux espèces de Salmonella, S. enterica et Salmonella bongori,et parmi la sous-espèce S. enterica, en particulier le sous-général arizonae (IIIa)26. Néanmoins, il s’agissait encore de résultats positifs valides selon les règles d’interprétation des résultats du LAMP. Dans notre étude collaborative multi-laboratoire dans les aliments secs pour chiens qui a impliqué 14analystes 19, des échantillons ayant des résultats incohérents dans les courses lamp en double ont été parfois observés. Ceux-ci impliquaient généralement des échantillons avec des résultats positifsretardés( Tmax > 15 min). Répéter les deux courses indépendamment généralement résolu le problème. Plus rarement, nous avons observé des échantillons avec tm correct, mais pas ou irrégulière tvaleursmax (< 5 min). Ceci a été habituellement provoqué par des bulles d’air dans le tube de réaction.
Tout au long du cycle de vie de l’élaboration, de l’évaluation, de l’étude précollaborative et de la validation multilaborative de la méthode LAMP, nous avons observé une tolérance élevée de LAMP aux inhibiteurs de divers aliments pour animaux ou matrices alimentaires et médias culturels4,19,22,23,24, soulignant la robustesse de la méthode et collaborant à de nombreuses autres études à l’échelle mondiale8. Ceci est supérieur par rapport à PCR ou PCR en temps réel, qui nécessite généralement un contrôle d’amplification interne pour s’assurer que les résultats négatifs ne sont pas dus à l’inhibitionmatricielle 28. De plus, LAMP a démontré une spécificité et une sensibilité similaires (ou supérieures) par rapport au PCR ou au PCR en temps réel dans la grande majorité des études8. Le coût des reagents LAMP est d’environ 1 $ par réaction. Les instruments LAMP utilisés dans ce protocole sont petits, peu d’entretien et portables. Ils peuvent manipuler n’importe quelle méthode isothermale d’amplification qui emploie la détection de cible par mesure de fluorescence, LAMP inclus. À l’aide du logiciel LAMP, des rapports complets peuvent être générés en format multiple (pdf, texte et image).
La validation de la méthode est une étape cruciale avant qu’une nouvelle méthode puisse être adoptée pour une utilisation courante. Il convient de noter que le protocole LAMP rapporté ici a complété avec succès la validation multi-laboratoire19. Avec l’incorporation récente de ce protocole LAMP dans le bam chapitre 5 salmonella27de la FDA des États-Unis, on s’attend à ce que la méthode gagne une utilisation beaucoup plus large, à la fois comme méthode de dépistage rapide dans les aliments pour animaux et comme méthode de confirmation fiable pour les isolats présumés de Salmonella de toutes les catégories d’aliments.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents. Les opinions exprimées dans ce manuscrit sont celles des auteurs et ne reflètent pas nécessairement la politique officielle du ministère de la Santé et des Services sociaux, de la Food and Drug Administration des États-Unis ou du gouvernement des États-Unis. La référence à tout matériel, équipement ou procédé commercial ne constitue en aucune façon une approbation, un approbation ou une recommandation de la Food and Drug Administration.
Remerciements
Les auteurs remercient les membres du Sous-comité de validation des méthodes de microbiologie (MMVS) et du Bacteriological Analytical Manual (BAM) de la FDA d’avoir examiné de façon critique les études de validation de la méthode Salmonella LAMP.
matériels
| Name | Company | Catalog Number | Comments |
| Brain heart infusion (BHI) broth | BD Diagnostic Systems, Sparks, MD | 299070 | Liquid growth medium used in the cultivation of Salmonella. |
| Buffered peptone water (BPW) | BD Diagnostic Systems, Sparks, MD | 218105 | Preenrichment medium for the recovery of Salmonella from animal food samples. |
| DNA AWAY | Thermo Fisher Scientific, Waltham, MA | 7010 | Eliminates unwanted DNA and DNase from laboratory bench, glassware, and plasticware without affecting subsequent DNA samples. |
| Genie Explorer software | OptiGene Ltd., West Sussex, United Kingdom | Version 2.0.6.3 | Supports remote operation of Genie instruments including LAMP runs and data analysis. |
| Genie II or Genie III (LAMP instrument) | OptiGene Ltd., West Sussex, United Kingdom | GEN2-02 or GEN3-02 | A small instrument capable of temperature control up to 100 °C with ± 0.1 °C accuracy and simultaneous fluorescence detection via the FAM channel. Genie II has 2 blocks (A and B) with 8 samples in each block. Genie III has a single block that accommodates 8 samples. |
| Genie strip | OptiGene Ltd., West Sussex, United Kingdom | OP-0008 | 8-well microtube strips with integral locking caps and a working volume of 10 to 150 µl. |
| Genie strip holder | OptiGene Ltd., West Sussex, United Kingdom | GBLOCK | Used to hold Genie strips when setting up a LAMP reaction, the aluminum holder can also be used as a cool block. |
| Hydrochloric acid (HCl) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SA48-500 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Heat block | Thermo Fisher Scientific, Waltham, MA | 88-860-022 | Heats samples at 100 ± 1 oC for DNA extraction. |
| Incubator | Thermo Fisher Scientific, Waltham, MA | 3960 | Standard laboratory incubator. |
| ISO-001 isothermal master mix | OptiGene Ltd., West Sussex, United Kingdom | ISO-001 | An optimized master mix to simplify the assembly of a LAMP reaction, containing a strand-displacing GspSSD DNA polymerase large fragment from Geobacillus spp., thermostable inorganic pyrophosphatase, reaction buffer, MgSO4, dNTPs, and a double-stranded DNA binding dye (FAM detection channel). |
| Isopropanol | Thermo Fisher Scientific, Waltham, MA | A416 | Disinfects work surfaces. |
| LAMP primers | Integrated DNA Technologies Inc., Coralville, IA | Custom | LAMP primers with detailed information in Table 1. |
| Microcentrifuge | Eppendorf North America, Hauppauge, NY | 22620207 | MiniSpin plus personal microcentrifuge. |
| Microcentrifuge tubes | Thermo Fisher Scientific, Waltham, MA | 05-408-129 | Standard microcentrifuge tubes. |
| Molecular grade water | Thermo Fisher Scientific, Waltham, MA | AM9938 | Used in making primer stocks, primer mix, and LAMP reaction mix. |
| Sodium hydroxide (NaOH) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SS266-1 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Nonselective agar (e.g., blood agar, nutrient agar, and trypticase soy agar) | Thermo Fisher Scientific, Waltham, MA | R01202 | Solid growth medium used in the cultivation of Salmonella. |
| Peptone water | BD Diagnostic Systems, Sparks, MD | 218071 | Dilutes overnight Salmonella cultures to make positive control DNA. |
| Pipettes and tips | Mettler-Toledo Rainin LLC, Oakland CA | Pipet Lite LTS series | Standard laboratory pipettes and tips. |
| PrepMan Ultra sample preparation reagent | Thermo Fisher Scientific, Waltham, MA | 4318930 | A simple kit used for the rapid preparation of DNA templates for use in a LAMP reaction. |
| Salmonella reference strain LT2 | ATCC, Manassas, VA | 700720 | Salmonella reference strain used as positive control. |
| Trypticase soy broth (TSB) | BD Diagnostic Systems, Sparks, MD | 211768 | Liquid growth medium used in the cultivation of Salmonella. |
| Vortex mixer | Scientific Industries, Inc., Bohemia, NY | SI-0236 | Standard laboratory vortex mixer. |
| Whirl-pak filter bag | Nasco Sampling Brand, Fort Atkinson, WI | B01318 | Filter bags to hold animal food samples for preenrichment. |
Références
- Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research. 28 (12), 63(2000).
- Kaneko, H., Kawana, T., Fukushima, E., Suzutani, T. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances. Journal of Biochemical and Biophysical Methods. 70 (3), 499-501 (2007).
- Francois, P., et al. Robustness of a loop-mediated isothermal amplification reaction for diagnostic applications. FEMS Immunology and Medical Microbiology. 62 (1), 41-48 (2011).
- Yang, Q., Wang, F., Prinyawiwatkul, W., Ge, B. Robustness of Salmonella loop-mediated isothermal amplification assays for food applications. Journal of Applied Microbiology. 116 (1), 81-88 (2014).
- Nagamine, K., Watanabe, K., Ohtsuka, K., Hase, T., Notomi, T. Loop-mediated isothermal amplification reaction using a nondenatured template. Clinical Chemistry. 47 (9), 1742-1743 (2001).
- Zhang, X., Lowe, S. B., Gooding, J. J. Brief review of monitoring methods for loop-mediated isothermal amplification (LAMP). Biosensors & Bioelectronics. 61, 491-499 (2014).
- Nagamine, K., Hase, T., Notomi, T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Molecular and Cellular Probes. 16 (3), 223-229 (2002).
- Yang, Q., Domesle, K. J., Ge, B. Loop-mediated isothermal amplification for Salmonella detection in food and feed: Current applications and future directions. Foodborne Pathogens and Disease. 15 (6), 309-331 (2018).
- Mori, Y., Notomi, T. Loop-mediated isothermal amplification (LAMP): Expansion of its practical application as a tool to achieve universal health coverage. Journal of Infection and Chemotherapy. 26 (1), 13-17 (2020).
- Mansour, S. M., Ali, H., Chase, C. C., Cepica, A. Loop-mediated isothermal amplification for diagnosis of 18 World Organization for Animal Health (OIE) notifiable viral diseases of ruminants, swine and poultry. Animal Health Research Reviews. 16 (2), 89-106 (2015).
- Kumar, Y., Bansal, S., Jaiswal, P. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Comprehensive Reviews in Food Science and Food Safety. 16 (6), 1359-1378 (2017).
- WHO. The use of loop-mediated isothermal amplification (TB-LAMP) for the diagnosis of pulmonary tuberculosis: policy guidance. , Available from: http://www.who.int/tb/publications/lamp-diagnosis-molecular/en (2016).
- Kundapur, R. R., Nema, V. Loop-mediated isothermal amplification: Beyond microbial identification. Cogent Biology. 2, 1137110(2016).
- WHO. Salmonella (non-typhoidal) fact sheet. , Available from: http://www.who.int/mediacentre/factsheets/fs139/en (2018).
- FAO/WHO. Executive summary report of the joint FAO/WHO expert meeting on hazards associated with animal feed. , Available from: http://www.fao.org/3/a-az851e.pdf (2015).
- FDA. Compliance Policy Guide Sec. 690.800 Salmonella in Food for Animals. , Available from: https://www.fda.gov/downloads/iceci/compliancemanuals/compliancepolicyguidancemanual/ucm361105.pdf (2013).
- Bird, P., et al. Evaluation of the 3M molecular detection assay (MDA) 2 - Salmonella for the detection of Salmonella spp. in select foods and environmental surfaces: collaborative study, first action 2016.01. Journal of AOAC International. 99 (4), 980-997 (2016).
- D'Agostino, M., et al. Validation of a loop-mediated amplification/ISO 6579-based method for analysing soya meal for the presence of Salmonella enterica. Food Analytical Methods. 9 (11), 2979-2985 (2016).
- Ge, B., et al. Multi-laboratory validation of a loop-mediated isothermal amplification method for screening Salmonella in animal food. Frontiers in Microbiology. 10, 562(2019).
- D'Agostino, M., Diez-Valcarce, M., Robles, S., Losilla-Garcia, B., Cook, N. A loop-mediated isothermal amplification-based method for analysing animal feed for the presence of Salmonella. Food Analytical Methods. 8 (10), 2409-2416 (2015).
- Galan, J. E., Ginocchio, C., Costeas, P. Molecular and functional characterization of the Salmonella invasion gene invA: homology of InvA to members of a new protein family. Journal of Bacteriology. 174 (13), 4338-4349 (1992).
- Chen, S., Wang, F., Beaulieu, J. C., Stein, R. E., Ge, B. Rapid detection of viable salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification. Applied and Environmental Microbiology. 77 (12), 4008-4016 (2011).
- Yang, Q., Chen, S., Ge, B. Detecting Salmonella serovars in shell eggs by loop-mediated isothermal amplification. Journal of Food Protection. 76 (10), 1790-1796 (2013).
- Yang, Q., et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection of Salmonella in produce. Food Microbiology. 46, 485-493 (2015).
- Yang, Q., Domesle, K. J., Wang, F., Ge, B. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time. BMC Microbiology. 16 (1), 112(2016).
- Domesle, K. J., Yang, Q., Hammack, T. S., Ge, B. Validation of a Salmonella loop-mediated isothermal amplification assay in animal food. International Journal of Food Microbiology. 264, 63-76 (2018).
- Andrews, W. H., Jacobson, A., Hammack, T. S. Bacteriological Analytical Manual. Chapter 5: Salmonella. , Available from: http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm070149.htm (2020).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon