Method Article
Imagerie des vésicules extracellulaires par microscopie de force atomique
Dans cet article
Résumé
Une procédure étape par étape est décrite pour l'immobilisation sans étiquette des exosomes et des vésicules extracellulaires à partir d'échantillons liquides et leur imagerie par microscopie de force atomique (AFM). Les images de l'AFM sont utilisées pour estimer la taille des vésicules de la solution et caractériser d'autres propriétés biophysiques.
Résumé
Les exosomes et autres vésicules extracellulaires (VEV) sont des complexes moléculaires constitués d'une vésicule de membrane lipidique, de sa décoration de surface par des protéines membranaires et d'autres molécules, et d'un contenu luminaire diversifié hérité d'une cellule parente, qui comprend des ARN, protéines et les ANN. La caractérisation des tailles hydrodynamiques des véhicules électriques, qui dépend de la taille de la vésicule et de sa couche coronale formée par des décorations de surface, est devenue routinière. Pour les exosomes, le plus petit des véhicules électriques, la différence relative entre les tailles hydrodynamiques et vésicules est significative. La caractérisation de la taille des vésicules par l'imagerie par électron de transmission cryogénique (cryo-TEM), une technique d'étalon-or, demeure un défi en raison du coût de l'instrument, de l'expertise requise pour effectuer la préparation de l'échantillon, l'imagerie et data, et un petit nombre de particules souvent observées dans les images. Une alternative largement disponible et accessible est la microscopie de force atomique (AFM), qui peut produire des données polyvalentes sur la géométrie tridimensionnelle, la taille, et d'autres propriétés biophysiques des vésicules extracellulaires. Le protocole développé guide les utilisateurs dans l'utilisation de cet outil d'analyse et décrit le flux de travail pour l'analyse des véhicules électriques par l'AFM, qui comprend la préparation de l'échantillon pour l'imagerie des véhicules électriques sous forme hydratée ou desséchée, l'immobilisation électrostatique de vésicules sur un substrat, l'acquisition de données, son analyse et son interprétation. Les résultats représentatifs démontrent que la fixation des véhicules électriques sur la surface modifiée du mica est prévisible, personnalisable et permet à l'utilisateur d'obtenir des résultats de dimensionnement pour un grand nombre de vésicules. Le dimensionnement de la vésicule basé sur les données de l'AFM s'est avéré compatible avec l'imagerie cryo-TEM.
Introduction
Les vésicules extracellulaires (VE) sont présentes dans tous les liquides organiques, y compris le sang, l'urine, la salive, le lait et le liquide amniotique. Les exosomes forment une classe de district d'EV différenciés des autres véhicules électriques par la biogenèse endosomale, les marqueurs de la voie endosomal, et la plus petite taille parmi tous les véhicules électriques. La taille des exosomes est souvent rapportée avec une variabilité substantielle entre les études. Les résultats de dimensionnement ont été jugés dépendants de la méthode, reflétant la différence dans les principes physiques utilisés par différentes techniques analytiques pour estimer les tailles EV1,2. Par exemple, l'analyse du suivi des nanoparticules (NTA), la technique de caractérisation de la taille la plus utilisée, estime la taille des véhicules électriques comme leurs diamètres hydrodynamiques, qui caractérisent la résistance à la mobilité Brownienne des véhicules électriques dans la solution. Un diamètre hydrodynamique plus grand d'une vésicule implique sa mobilité plus faible en liquide. La couche coronale autour des vésicules, composée de protéines de surface et d'autres molécules ancrées ou adsorbées à la surface de la membrane, entrave considérablement la mobilité et augmente la taille hydrodynamique des véhicules électriques. En termes relatifs, cette augmentation est particulièrement importante pour les exosomes3, comme l'illustre la figure 1.
L'imagerie par électron de transmission cryogénique (cryo-TEM) est une technique définitive pour caractériser la taille et la morphologie des vésicules dans leurs états hydratés. Cependant, le coût élevé de l'instrumentation et l'expertise spécialisée nécessaire pour l'utiliser correctement motivent l'exploration de techniques alternatives qui peuvent image hydratée EV. Un nombre relativement faible d'EV observés ou caractérisés dans les images cryo-TEM acquises est un autre inconvénient notable de cette technique.
La microscopie par force atomique (AFM) visualise la topographie tridimensionnelle des véhicules électriques hydratés ou desséchés4,5,6 en scannant une sonde à travers le substrat pour raster l'image des particules à la surface. Les étapes essentielles du protocole pour caractériser les véhicules électriques par l'AFM sont décrites dans cette étude. Avant d'imagerie des vésicules en liquide, ils doivent être immobilisés sur un substrat soit en s'attachant à une surface fonctionnalisée, en piégeant dans un filtre, ou par attraction électrostatique7. La fixation électrostatique sur un substrat chargé positivement est une option particulièrement pratique pour l'immobilisation des exosomes connus pour avoir un potentiel zeta négatif. Cependant, les mêmes forces électrostatiques qui immobilisent les vésicules extracellulaires à la surface déforment également leur forme, ce qui rend l'analyse des données post-imagerie essentielle. Nous élaborons ce point en décrivant l'algorithme qui estime la taille des vésicules globulaires dans la solution en fonction des données de l'AFM sur la forme déformée des exosomes immobilisés à la surface.
Dans le protocole développé, la procédure pour l'immobilisation électrostatique robuste des vésicules est présentée et suivie par les étapes nécessaires pour effectuer l'imagerie de force atomique dans les états hydratés ou desséchés. Les facteurs qui influencent la concentration de surface des vésicules immobilisées sont identifiés. Les conseils sont donnés sur la façon d'effectuer l'immobilisation électrostatique pour les échantillons avec différentes concentrations de véhicules électriques dans la solution. La sélection de conditions expérimentales permettant l'estimation des distributions empiriques de probabilité de différentes propriétés biophysiques basées sur un nombre suffisamment élevé de vésicules immobilisées est discutée. Des exemples d'analyse post-imagerie des données de l'AFM sont donnés. Plus précisément, un algorithme est décrit pour déterminer la taille des vésicules dans la solution basée sur la caractérisation AFM des véhicules électriques immobilisés. Les résultats représentatifs montrent la cohérence du dimensionnement de la vésicule par l'AFM avec les résultats de l'imagerie cryo-TEM.
Protocole
1. Isolement des véhicules électriques d'un biofluide
- Isoler les véhicules électriques par l'une des méthodes établies, telles que l'ultracentrifugation différentielle8, précipitations, ou chromatographie de taille-exclusion9.
- Confirmer la présence de biomarqueurs de surface et de lumière attendus et l'absence de biomarqueurs indiquant une contamination croisée de la préparation. Confirmer la morphologie bicouche lipidique des particules isolées par microscopie électronique.
REMARQUE : Lors de l'isoler des exosomes, la distribution de la taille hydrodynamique mesurée par l'analyse du suivi des nanoparticules (NTA) ou la diffusion dynamique de la lumière devrait se situer dans la plage prévue. Les détails de l'isolement EV et exosome sont au-delà de la portée de ce protocole. La méthode choisie dépendra de questions expérimentales et de l'objectif de l'étude10. Les étapes suivantes fournissent une illustration concrète de la procédure visant à enrichir les exosomes par les précipitations du milieu de croissance des cellules cancéreuses du sein MCF-7 à l'aide d'une trousse de précipitations disponible dans le commerce (Tableau des matériaux). - Avant l'expansion de la culture cellulaire, entreposez les cellules cancéreuses du sein MCF-7 dans de l'azote liquide. Décongeler les cellules à la sous-culture.
- Après des pratiques aseptiques, effectuer le placage cellulaire sur des plaques de 150 mm. Utilisez le milieu decroissance composé du milieu essentiel minimum de l'Aigle, de l'insuline recombinante humaine de 0,01 mg/mL et du sérum bovin fœtal sans exosome.
- Aérer la culture de 95% d'air et 5% de CO2 et incuber à 37 oC.
- Après que les cellules sont réglées (environ 24 h après le placage), changer le support. Divisez la plaque à 1:10 ratio et la culture dix plaques, chacune contenant 20 ml de médias.
- Les prises de support et de mise en commun de 9 de ces plaques (180 ml) à une confluence de70à 80 % lorsque les cellules sont encore en phase de croissance.
- Diviser les supports en 60 ml et 120 ml, en répartir en 30 ml/tube et centrifuger à 3 000 x g pendant 15 min.
- Transférer le supernatant de chaque tube dans un nouveau tube stérile de 50 ml et effectuer l'isolement exosome.
- Isoler les exosomes par précipitation selon les protocoles publiés (voir, par exemple, la référence11) ou suivre les instructionsdufabricant si un kit d'isolement commercial(tableau des matériaux)est utilisé. Dans ce dernier cas, le milieu cellulaire centrifugeà 3 000 x g pendant 15 min. Retirez les supernatants et jetez les cellules et les débris cellulaires.
- Ajouter la solution de précipitation (rapport de volume de 1:5) au supernatant, mélanger et réfrigérer toute la nuit.
- Centrifugeuse à 1 500 x g pendant 30 min à température ambiante. Jeter le supernatant après centrifugation.
- Faire tourner le reste de la pastille exosome pendant 5 min à 1 500 x g. Sans déranger la pastille, retirez la solution de précipitation restante par aspiration.
- Resuspendre la pastille en 100à500 oL de tampon salin tampon salin (PBS) tampon tampon tampon tampon tampon de phosphate (PBS) et diviser en plusieurs aliquots au besoin pour l'analyse en aval.
- Procéder immédiatement à l'immobilisation de surface des exosomes isolés pour la formation image d'AFM. Si nécessaire, congeler les aliquots à -80 oCpour une utilisation ultérieure tout en prenant des précautions pour éviter d'endommager l'échantillon pendant le cycle de gel-dégel.
2. Fixation de surface des vésicules extracellulaires
- Utilisez du ruban adhésif recto-verso, de l'époxy ou un adhésif alternatif pour attacher fermement un disque de mica à un disque magnétique de spécimen en acier inoxydable (STM) du microscope magnétique AFM/scanning ( STM).
- Cleave disc mica en utilisant un rasoir pointu ou un couteau utilitaire, ou en attachant un ruban adhésif à la surface supérieure, puis le pealing hors pour enlever une couche de matériau.
REMARQUE : L'une ou l'autre méthode devrait révéler une surface vierge en enlevant une fine couche de mica précédemment exposée à l'environnement. Après la procédure, l'attachement du mica au disque de spécimen métallique AFM/STM doit rester ferme. - À température ambiante, traitez la surface supérieure du mica pendant 10 s avec une solution de 100 oL de 10 ml NiCl2, qui modifie la charge de surface de négative à positive.
- Blot NiCl2 solution avec une lingette sans papier sans papier ou de papier buvard. Laver la surface du mica 3x avec de l'eau déionisée (DI) et la sécher avec un jet d'azote sec.
REMARQUE : Il est bon de scanner la surface modifiée avec l'AFM pour confirmer qu'elle est exempte de contaminants. - Placer le disque de spécimen d'AFM avec le mica modifié à la surface attaché dans un plat de Petri.
- Diluer l'échantillon exosome de l'étape 1.14 avec 1x PBS pour obtenir une concentration entre 4,0 x 109 et 4,0 x10 10 particules par mL de solution. Valider la concentration de particules diluées à l'aide de ntA.
- Former une goutte de sessile à la surface du mica en vidant 100 l de la solution exosome diluée d'une pipette.
- Placer le couvercle sur le plat de petri et le sceller avec un film de paraffine pour réduire l'évaporation de l'échantillon. Incuber l'échantillon de 12à18 h à 4 oC.
REMARQUE : La densité de surface des exosomes immobilisés augmentera avec le temps d'incubation et la concentration des véhicules électriques dans le liquide. Un temps d'incubation plus long peut être nécessaire si des exosomes sont présents dans l'échantillon à des concentrations plus faibles. - Après l'incubation, aspirez 80à90 % de l'échantillon sans perturber la surface. À ce stade, les exosomes seront électrostatiquement immobilisés sur le substrat de mica.
- Avant l'imagerie hydraté e Vs, rincer la surface avec 1x PBS. Répéter 3x. Prenez soin de garder l'échantillon hydraté tout au long du processus de rinçant.
- Après avoir lavé la surface du mica avec 1x PBS, retirer 80 %à90 % du liquide et une pipette de 40 l de PBS 1x frais pour couvrir l'échantillon.
- Lors de l'imagerie des véhicules électriques desséchés, rincez le substrat avec de l'eau DI. Répéter 3x.
REMARQUE : Le rinçant à l'eau DI empêchera la formation de cristaux de sel et le dépôt de solutés à la surface au fur et à mesure que le substrat sèche. - Avant l'imagerie dessiccated EV, aspirer autant de liquide que possible sans toucher la surface et sécher le reste avec un flux d'azote sec.
3. Imagerie AFM
- Pour imager les véhicules électriques desséchés, sélectionnez un porte-à-faux conçu pour la numérisation dans l'air en tapant et en mode d'imagerie sans contact et montez-le sur le porte-sonde.
REMARQUE : Les caractéristiques d'un porte-à-faux d'exemple figurant dans table des matériaux (123 m de longueur, 40 m de largeur, 7 nm de rayon de pointe et 37 N/m de ressort constant) peuvent être utilisées comme guide lors de la sélection d'une sonde compatible avec l'instrumentation AFM disponible.- Placez la préparation à partir de l'étape 2.13 sur la scène AFM. Le disque magnétique en acier inoxydable immobilisera l'échantillon sur la scène. Prévoyez du temps pour que la préparation et la scène s'équilibrent thermiquement.
- Utilisez le mode de tapotement pour scanner une surface suffisamment grande de la surfacedumica. Par exemple, choisissez une superficie de 5 x 5 m, rastered en 512 lignes à un taux d'analyse de 1 Hz. Acquérir à la fois la hauteur et les images de phase car ils fournissent des informations complémentaires sur la topographie et les propriétés de surface de l'échantillon.
REMARQUE : Le temps d'analyse augmentera avec la zone d'image et le nombre de lignes sélectionnées pour former l'image, mais diminuera avec le taux d'analyse défini comme le nombre de lignes numérisées par seconde. Les taux d'analyse rapide peuvent avoir un impact sur la qualité de l'image. Par conséquent, la vitesse de rastering devrait sensiblement équilibrer le compromis entre le temps d'acquisition et la qualité de l'image.
- Pour imager les vésicules hydratées, sélectionnez un porte-à-faux approprié pour la numérisation d'échantillons mous et hydratés et montez le porte-porte-porte-porte-couleurs sur un porte-sonde conçu pour la numérisation dans les liquides.
REMARQUE : Lors de la sélection d'une sonde compatible avec l'instrumentation AFM disponible, les spécifications de la sonde figurant dans Tableau des matériaux (porte-à-faux triangulaire de 175 m de longueur nominale, largeur de 22 m, rayon de pointe de 20 nm, constante de ressort de 0,07 N/m, et optimisé pour l'imagerie avec la fréquence d'entraînement dans la gamme entre 4 à 8 kHz) peut être utilisé comme un guide.- Mouillez la pointe du porte-à-faux avec 1x PBS pour réduire la probabilité d'introduire des bulles d'air dans le liquide pendant la numérisation.
- Placez la préparation à partir de l'étape 2.11 sur la scène AFM. Le disque magnétique en acier inoxydable immobilisera le mica attaché contenant des véhicules électriques immobilisés à sa surface.
- Prévoyez du temps pour que la préparation et l'étape De l'AFM s'équilibrent thermiquement.
- Imagez la surface du mica hydraté en mode tapant. Acquérir à la fois la hauteur et les images de phase.
REMARQUE : La qualité de l'imagerie est influencée par l'instrumentation, la sonde sélectionnée et les paramètres d'analyse. Lors de l'optimisation des conditions de numérisation, les choix suivants peuvent être utilisés comme point de départ : 5 x 5 m de surface numérisés en 512 lignes avec un taux d'analyse et une fréquence d'entraînement de 0,8 à 1,0 Hz entre 4 et 8 kHz.
4. Analyse d'image
REMARQUE : Les étapes suivantes de traitement et d'analyse des données sont appliquées aux images de hauteur acquises. Une procédure similaire peut être adaptée pour analyser les données de phase. La description ci-dessous est spécifique à Gwyddion12, un logiciel libre et open source disponible sous GNU General Public License. Des capacités similaires sont disponibles dans les outils logiciels alternatifs.
- Aller à Data Process, modes SPM, Astuce et choisissez Astuce modèle (Figure 2). Sélectionnez la géométrie et les dimensions de la pointe utilisée pour scanner l'échantillon et cliquez sur OK.
- Corriger les artefacts d'érosion de la pointe en effectuant la reconstruction de surface. Ouvrez l'image. Dans le menu, sélectionnez Data Process, modes SPM, Astuce, puis choisissez Surface Reconstruction et cliquez sur OK (Figure 3).
- Alignez le plan d'imagerie pour qu'il corresponde au plan XY de laboratoire en supprimant l'inclinaison du substrat des données d'analyse. Pour accomplir cette tâche, sélectionnez Processus de données, Niveau et choisissez le niveau de l'avion (Figure 4).
- Alignez les lignes de l'image en sélectionnant Data Process, Correct Data, puis choisissez Align Rows. Plusieurs options d'alignement sont disponibles (Figure 5). Par exemple, Median est un algorithme qui trouve une hauteur moyenne de chaque ligne d'analyse et la soustrait des données.
- Aller à Data Process, Correct Data et choisissez Supprimer les cicatrices (Figure 6), qui supprime les erreurs de numérisation courantes connues sous le nom de cicatrices.
- Alignez la surface du mica à la hauteur zéro, Z '0, en sélectionnant la base aplatie dans le menu de déclassement de niveau accessible à partir du processus de données (figure 7).
- Identifiez les véhicules électriques sur la surface numérisée en utilisant le menu déroulant Mark by Threshold in Grains (figure 8A). Cet algorithme identifie les exosomes immobilisés en surface comme des particules dépassant du substrat à surface zéro par la hauteur au-dessus du seuil choisi par l'utilisateur. Sélectionnez un seuil dans la plage comprise entre 1 et 3 nm, ce qui éliminera la plupart des interférences d'arrière-plan. De plus petits seuils sont utilisés avec un fond plus propre.
REMARQUE : Le seuil de la figure 8A est de 1,767 nm. Le résultat de l'identification exosome MCF-7 avec ce seuil est montré dans la figure 8B. Gwyddion offre plusieurs alternatives au seuil en tant qu'algorithme pour identifier automatiquement les vésicules dans l'image, y compris le seuil automatisé (méthode d'Otsu), la détection des bords et l'algorithme de bassin versant.
REMARQUE : Les agglomérats de particules, s'ils sont présents dans l'image de l'AFM, peuvent être masqués et exclus de l'analyse. - Effectuer la caractérisation géométrique et dimensionnelle des véhicules électriques identifiés à l'aide des algorithmes de distribution disponibles accessibles à partir du menu Grains.
REMARQUE : Gwyddion fournit des outils pour évaluer la distribution des propriétés scalaires, aréales, volumétriques et autres des véhicules électriques immobilisés dans un état hydraté ou désisté. Un exemple de propriété de valeurs scalaires est illustré dans la figure 9, qui donne la distribution des hauteurs maximales dans l'empreinte de chaque exosome identifié. - Exportez les données de l'AFM de Gwyddion pour une analyse spécialisée par d'autres outils informatiques et des programmes informatiques personnalisés.
Résultats
La fixation de surface des véhicules électriques est une étape critique dans la séquence d'imagerie. L'immobilisation de surface électrostatique des exosomes, connue pour avoir un potentiel négatif de zeta, se produira robustement après que le substrat du mica soit modifié pour avoir une charge positive de surface. Sans le traitement avec NiCl2 pour donner des changements positifs de surface, l'immobilisation des véhicules électriques sur le substrat s'est avérée inefficace. L'image de hauteur de la figure 10A, acquise dans l'air après que l'échantillon exosome MCF-7 contenant 2,59 x 10vésicules par mL de PBS a été incubée pendant 12 h sur une surface non modifiée de mica fraîchement clivé, montre très peu de vésicules restantes sur le surface après qu'il a été nettoyé avec de l'eau DI. Les vésicules visibles à la figure 10A sont, très probablement, le résultat d'une aspiration incomplète de l'eau DI, qui a suspendu les vésicules non fixées à la surface, puis les a déposés sur le substrat au fur et à mesure qu'il s'évaporait.
Après avoir modifié la charge de surface avec du chlorure de nickel, il est conseillé de confirmer que la surface reste exempte de contaminants après le traitement. L'image de hauteur de la figure 10B (obtenue dans l'air) donne un exemple de surface propre après avoir été traitée avec NiCl2, puis lavée trois fois avec de l'eau DI. La rugosité de la surface dérivée de la cation était inférieure à 0,3 nm, ce qui est conforme au rapport précédent13.
L'impact positif dramatique de la modification de la charge de surface sur l'efficacité de la fixation des exosomes MCF-7 est illustré par la figure 10C,D. Ces deux panneaux montrent les balayages de hauteur acquis dans l'air après que l'échantillon, précédemment représenté dans la figure 10A, a été incubé pendant 24 h et 12 h, respectivement, sur la surface traitée avec du chlorure de nickel.
Le temps qu'un échantillon donné est incubé sur la surface traitée détermine la concentration de surface (vésicules par zone) des véhicules électriques immobilisés. L'image de hauteur de la figure 10C illustre le cas d'une couverture de surface excessivement dense par les vésicules immobilisées obtenues après que l'échantillon d'exosome MCF-7 décrit a été incubé pendant 24 h. Un certain nombre d'algorithmes reposent sur un substrat suffisamment inoccupé entre les grains pour effectuer la correction d'image et l'analyse des données. Par exemple, le nivellement et le déplacement du substrat vers le plan zéro, la correction de ligne et l'estimation du volume des grains nécessitent la surface plane intermédiaire pour effectuer des calculs précis. Lorsque la concentration des vésicules immobilisées est aussi élevée que dans la figure 10C,ces algorithmes ne fonctionneront pas de façon fiable. Un exemple de concentration adéquate de la surface des vésicules immobilisées à partir du même échantillon MCF-7 est illustré dans l'image de hauteur de la figure 10D, qui a été obtenue après une incubation plus courte (12 h).
Le post-traitement des données Brutes aFM acquises est nécessaire pour corriger les erreurs de numérisation courantes. La description suivante est spécifique à Gwyddion. Des fonctionnalités similaires sont disponibles dans d'autres outils d'analyse de données AFM/SPM.
Dans Gwyddion, la fonction Plane Level est utilisée pour corriger une inclinaison dans le substrat. Une telle correction de fond est accomplie en trouvant d'abord le plan du substrat en utilisant tous les points de données de l'image, puis en le soustrayant des données brutes. La correction le long des lignes d'analyse est effectuée par la fonction Align Rows. Par exemple, l'un des algorithmes implémentés effectue l'alignement en calculant la hauteur médiane de chaque ligne d'analyse, puis en soustrayant le résultat de la ligne correspondante de données d'image. La contribution des failles locales dans la boucle de rétroaction peut être supprimée en appliquant la fonction Supprimer les cicatrices, qui comble les lacunes dans les données alignées et élimine les cicatrices en comparant les données dans les lignes d'analyse adjacentes. Le déplacement du substrat vers l'altitude Z -0 peut être accompli par une combinaison d'une facette et d'un nivellement polynomial de la surface après avoir masqué les grains et d'autres caractéristiques. L'outil Flatten Base de Gwyddion effectue cette tâche de manière autonome ou avec un masque spécifié par l'utilisateur. Après les corrections de fond et de ligne décrites, les vésicules électrostatiquement fixées peuvent être identifiées sur le substrat en exécutant la fonction de grains de marque.
La figure 11A et la figure 11B montrent des images de hauteur et de phase d'exosomes MCF-7 hydratés immobilisés sur une surface de mica et acquis en PBS en utilisant le mode de mise à l'eau. Un total de 561 vésicules hydratées ont été identifiés dans la zone numérisée à l'aide de l'algorithme Threshold de la fonction Mark Grains avec la valeur seuil fixée à 20%. Le décalage de phase de la réponse de la sonde à la fréquence d'entraînement est sensible aux variations localisées de rigidité dans les échantillons mous. La cohérence entre les images de hauteur et de phase, vue dans la figure 11A,B, est donc une confirmation importante que les grains représentés sont, en effet, des vésicules molles immobilisées sur le substrat.
La figure 11C montre la section transversale de l'image de hauteur à travers des exosomes situés sur la ligne blanche de la figure 11A. Alors que les exosomes dans un biofluide ont une géométrie globulaire1,14,15,16, leur forme sur le substrat est sévèrement déformée par l'attraction électrostatique à la charge positive surface. La géométrie oblate en bande aux vésicules immobilisées de crêpes est encore illustrée dans la figure 11D par l'image de hauteur en gros plan (et sa section transversale) d'un exosome en boîte à la figure 11A. L'image de phase correspondante est affichée dans la figure 11E. La fonction empirique de densité de probabilité (pdf) des hauteurs de pointe au-dessus de la surface pour les 561 vésicules hydratées identifiées dans l'analyse AFM est indiquée dans la figure 12A. La valeur moyenne de cette distribution est de 7,9 nm, ce qui équivaut à peu près au double de l'épaisseur d'un bicouche phospholipide17 en l'absence de forces déformantes.
La zone sur le substrat occupé par un exosome immobilisé a été approximative comme un cercle avec le diamètre égal à la distance moyenne du « centre de masse » de la vésicule à sa limite sur la surface du mica. La répartition de ces diamètres de projection est indiquée à la figure 12A et a la moyenne égale à 69,6 nm. La hauteur obtenue et les distributions de diamètre quantifient en outre l'impact significatif de l'immobilisation de surface électrostatique sur la forme déformée des exosomes immobilisés.
La robustesse et la répétabilité des procédures du protocole ont été confirmées en réanalysant le même échantillon de MCF-7 trois fois, de la préparation de l'échantillon à l'imagerie, chaque répétition produisant des résultats statistiquement similaires à ceux de la figure 12.
La déformation des vésicules immobilisées causée par les forces électrostatiques peut être compensée ou interprétée pour donner un aperçu des propriétés des véhicules électriques représentés. Par exemple, les données de l'AFM peuvent être utilisées pour estimer la taille globulaire des vésicules de la solution. Comme point de départ, nous pouvons calculer le volume encapsulé par les enveloppes membranaires de vésicules immobilisées. Le volume se trouve en intégrant la différence entre le niveau de surface des vésicules identifiées et l'élévation du substrat en dessous d'elles. Le niveau du substrat sous les vésicules n'est pas directement accessible, mais peut être estimé par le Laplace ou l'interpolation alternative des points de données pour le substrat inoccupé entourant les vésicules. Dans Gwyddion, un tel calcul de volume est effectué à l'aide de la fonction Distribution de diverses caractéristiques des grains. Le résultat exporté de Gwyddion peut alors être cartographié dans les diamètres des sphères équivalentes de volume.
L'application de l'algorithme décrit aux données de l'AFM pour 561 vésicules MCF-7 hydratées analysées a produit la distribution des diamètres des sphères équivalentes de volume indiquées dans la figure 12B. Cette distribution estime la taille des vésicules membranaires sous leur forme globulaire innée sous forme de biofluide avant leur fixation électrostatique sur la surface du mica. Le dimensionnement de la vésicule obtenu à partir de l'analyse des données de l'AFM a été comparé aux résultats de l'imagerie cryo-TEM du même échantillon et s'est avéré être en accord étroit3 (figure 12B). La comparaison des diamètres hydrodynamiques mesurés par la NTA avec la taille des vésicules obtenues (Figure 1) indique que la mobilité des exosomes est beaucoup plus faible que ce à quoi on pourrait s'attendre à partir de la taille de leurs vésicules déterminée s'il s'agit de l'AFM et du cryo-TEM. Mesures. La différence entre les tailles hydrodynamiques et vésicules caractérise l'épaisseur de la couche coronale entourant les vésicules exosomal.

Figure 1 : Comparaison des diamètres hydrodynamiques et géométriques des véhicules électriques. La taille géométrique de la vésicule exosomal est sensiblement plus petite que sa taille hydrodynamique déterminée à partir de sa diffusion dans un liquide. La différence est la couche coronale formée par des molécules membranaires et adsorbées qui entravent la mobilité des véhicules électriques. Ce chiffre est modifié à partir de la référence3 et réimprimé avec permission.
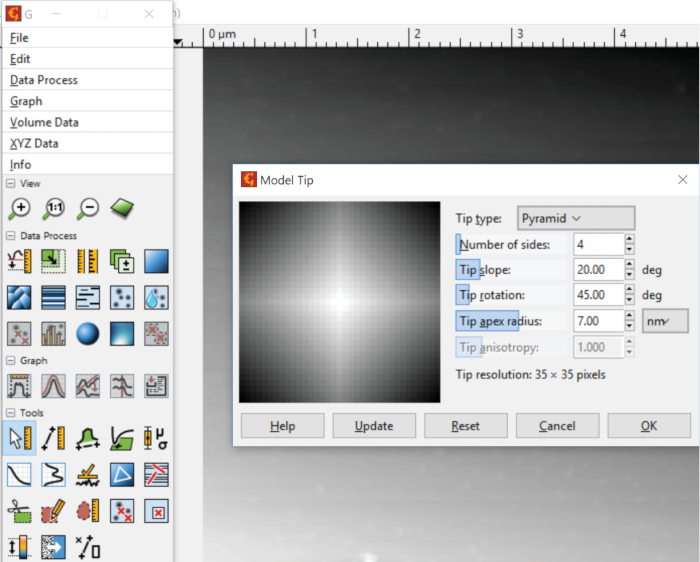
Figure 2 : Propriétés de la sonde AFM. La géométrie et les dimensions de la sonde AFM peuvent être spécifiées à l'aide de la fonction Astuce modèle. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Correction de l'artifact d'imagerie causé par la convolution d'échantillon de pointe. En effectuant la reconstruction de surface,les données AFM acquises peuvent être corrigées pour les artefacts de pointe. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
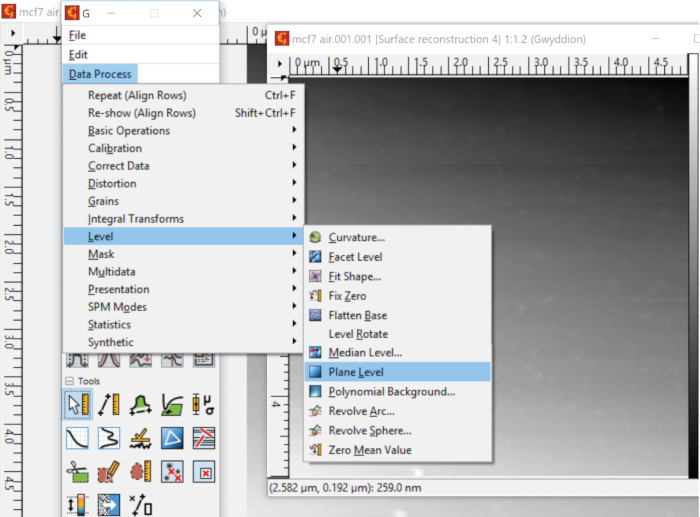
Figure 4 : Correction d'une inclinaison dans le substrat. Le niveau de l'avion détermine le plan du substrat et le soustrait des données de l'AFM. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
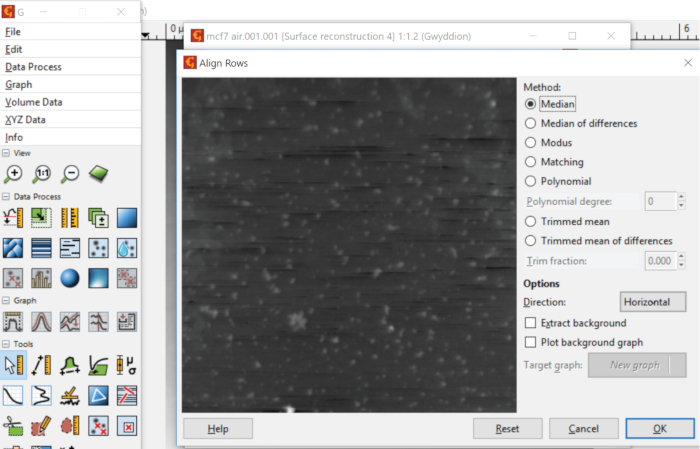
Figure 5 : Correction des désalignements dans les lignes d'analyse. Un algorithme conventionnel pour aligner les données d'analyse est de trouver une hauteur moyenne le long de chaque ligne d'analyse et soustrait le résultat de la rangée correspondante de points de données dans l'image. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Correction des lacunes dans les données alignées. Les erreurs courantes de numérisation, connues sous le nom de cicatrices, peuvent être supprimées des données de l'AFM en appliquant la fonction Supprimer les cicatrices. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
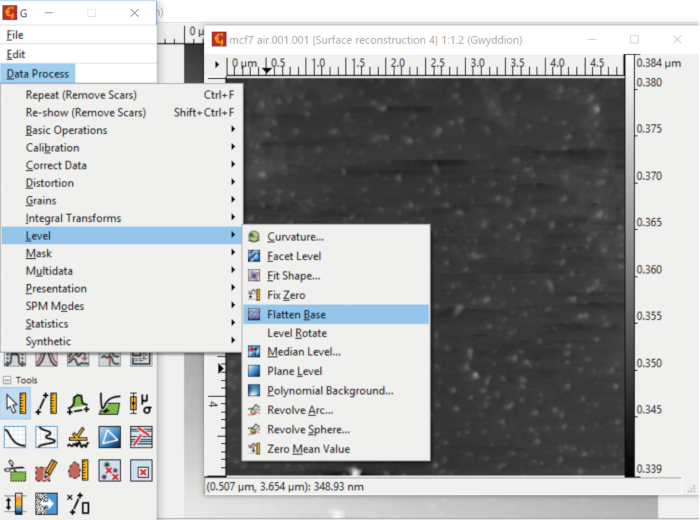
Figure 7 : Alignement d'un substrat à faible altitude. L'option aplatisseur de base dans le menu Niveau permet à l'utilisateur de placer la surface du substrat au niveau de base correspondant à la hauteur zéro. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Identification des vésicules immobilisées sur la surface numérisée. (A) Les exosomes immobilisés à la surface sont identifiés comme des grains dépassant au-dessus du substrat par un seuil de hauteur sélectionné par l'utilisateur spécifié dans Mark by Threshold. (B) Le résultat de l'identification. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
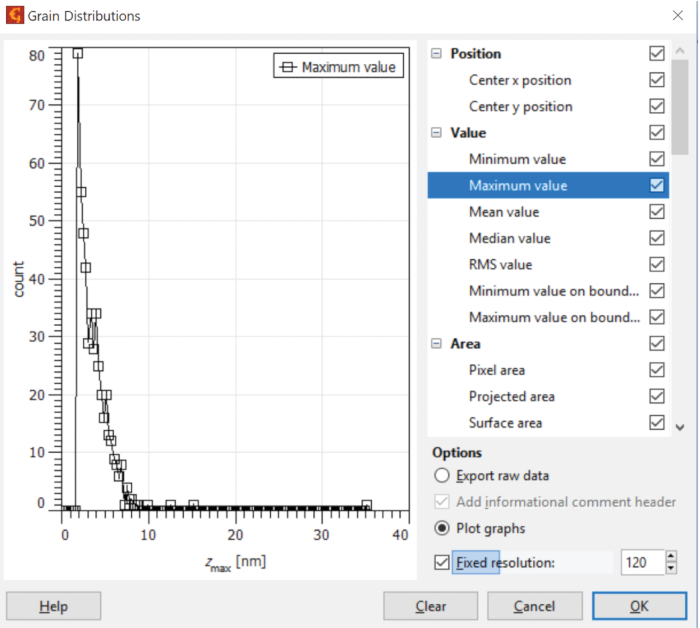
Figure 9 : Analyse des données de l'AFM. La répartition des hauteurs maximales au-dessus du substrat dans la zone occupée par les exosomes identifiés est illustrée par l'outil Distributions de grains. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 10 : Impact de la modification de la surface et de la concentration ev de la densité de surface des vésicules immobilisées. (A) L'image de hauteur AFM du substrat de mica fraîchement clivé après 12 h d'incubation avec l'échantillon exosome DE MCF-7 suivi du nettoyage avec l'eau d'EdI et le séchage. L'immobilisation des véhicules électriques du liquide au substrat est inefficace sans donner une charge positive à la surface du mica. Peu de particules observées dans l'analyse sont probablement le résultat de l'élimination incomplète de l'échantillon MCF-7 avant que le substrat ne soit séché. (B) L'analyse de hauteur de la surface du mica dans l'air après le traitement au chlorure de nickel montre le substrat exempt de contaminations. Les panneaux (C) et (D) montrent les scans de hauteur AFM obtenus après la modification de la charge de surface et de l'incubation avec le même échantillon DE MCF-7 que dans le panneau (A) pour 24 h et 12 h, respectivement. La concentration de surface des vésicules immobilisées est excessivement dense après 24 heures d'incubation. L'incubation de 12 h conduit à moins d'exosomes immobilisés à la surface et les données d'analyse qui sont plus faciles à analyser avec précision. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
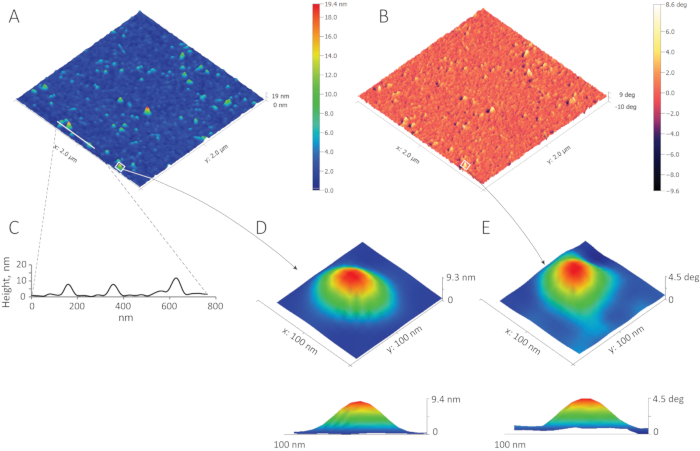
Figure 11 : Images AFM d'exosomes MCF-7 hydratés électrostatiquement immobilisés sur la surface modifiée du mica. (A) L'image de hauteur. (B) L'image de phase AFM correspondante confirme que les grains de l'image de hauteur sont des nanoparticules molles, comme on devrait s'y attendre pour les vésicules membranaires. (C) Les données de hauteur pour les trois vésicules traversées par la ligne indiquée dans le panneau (A) illustrent une forme aplatie causée par l'attraction électrostatique des exosomes à la surface chargée positivement du mica modifié. (D) La distorsion de forme est apparente dans une vue agrandie la vésicule immobilisée en boîte dans le panneau (A) et sa section transversale. L'image de phase de la même vésicule est montrée dans (E). Ce chiffre est modifié à partir de la référence3 et réimprimé avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
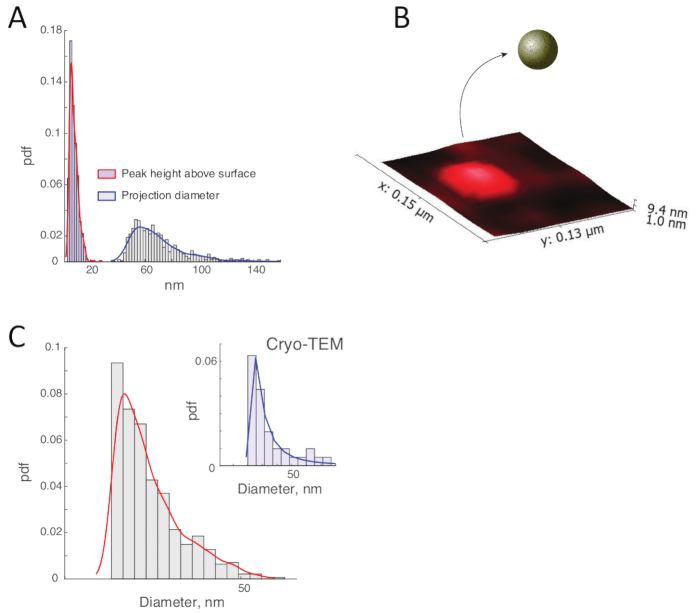
Figure 12 : Caractérisation dimensionnelle des vésicules hydratées immobilisées à la surface et estimation de leur taille globulaire dans la solution. (A) La répartition des hauteurs de pointe au-dessus de la surface (courbe rouge) a la moyenne égale à 7,9 nm. La zone occupée par des exosomes immobilisés a 69,6 nm de diamètre moyen (courbe bleue). (B) L'image de hauteur aFM pour l'un des exosomes immobilisés illustre sa forme très oblate causée par des forces électrostatiques. La taille globulaire des vésicules exosomales dans la solution peut être estimée en faisant correspondre les volumes enfermés par des enveloppes de membrane sphériques et immobilisées de surface. (C) La répartition de la taille des vésicules globulaires dans la solution (courbe rouge) a été déterminée à partir des données de l'AFM de 561 vésicules immobilisées. Les tailles de vésicule dans les images cryo-TEM (courbe bleue) sont compatibles avec les résultats de l'AFM. Ce chiffre est modifié à partir de la référence3 et réimprimé avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 13 : Artefacts de ségrégation de la concentration de surface et de taille lors du dépôt passif des véhicules électriques à partir du liquide qui s'évapore. (A) L'image de microscopie électronique à balayage (SEM) montre que la concentration de surface des exosomes déposés passivement à partir d'un liquide de séchage est variable spatialement lorsque l'immobilisation de surface d'un biofluide suspendu n'est pas effectuée. (B) Le dépôt passif d'EV à partir d'un échantillon de séchage provoque la ségrégation de la taille des vésicules. La variabilité de taille substantielle est quantifiée par les fonctions de densité de probabilité (pdf) pour les vésicules dans différentes régions de l'image (A) définies par des lignes diagonales blanches. Ce chiffre est modifié à partir de la référence1 et réimprimé avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
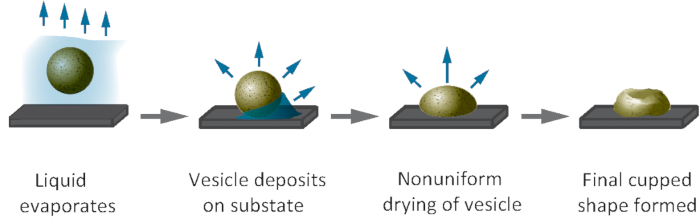
Figure 14 : Géométrie en forme de tasse de vésicules desséchées déposées passivement à la surface pendant l'évaporation liquide. La dessiccation de surface des vésicules qui n'ont pas été immobilisées par des forces électrostatiques est connue pour avoir comme conséquence un aspect en forme de tasse souvent observé dans des images seM des VÉHICULES électriques. Ce chiffre est modifié à partir de la référence1 et réimprimé avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
L'immobilisation des véhicules électriques à partir d'un fluide biologique, d'un balayage de surface et d'une analyse d'image sont les étapes essentielles du protocole élaboré pour la caractérisation des véhicules électriques par aFM en liquide. Le nombre de vésicules propices aux échelles d'imagerie AFM avec la surface imageetée et la concentration de surface des vésicules immobilisées sur le substrat. Compte tenu d'un potentiel zeta négatif des véhicules électriques et des exosomes18,nous préconisons la fixation électrostatique des véhicules électriques à partir d'échantillons liquides vers le substrat AFM. L'immobilisation est efficace lorsque la surface est chargée positivement. Avant l'immobilisation de la VE, la charge de surface positive peut devoir être transmise au substrat, comme dans le cas du mica, un minéral de silicate en couches avec formule générale KAl2(AlSi3O10)(OH)2. La surface du mica fraîchement clivée est proche de parfaitement plate, ce qui est idéal pour l'imagerie des nanoparticules par l'AFM, mais sa charge de surface est négative et, par conséquent, doit être modifiée. Le protocole décrit la procédure pour donner un changement de surface positif au substrat d'AFM. Les résultats représentatifs montrent une amélioration marquée de la fixation des véhicules électriques d'un biofluide au substrat de mica modifié.
Lors de l'imagerie des vésicules hydratées, il est important de minimiser l'évaporation de l'échantillon qui provoque les artefacts de dépôt de surface et les flux convectifs et augmente la concentration liquide des vésicules avec le temps, conduisant à une concentration de surface plus élevée de les véhicules électriques immobilisés plus que prévu, en particulier pendant les incubations prolongées. Les porte-sondes explicitement conçues pour les échantillons liquides éliminent ou ralentissent l'évaporation et doivent être utilisées pour imager les véhicules électriques hydratés. Les liaisons non spécifiques à la sonde de balayage sont réduites en présence d'espèces ioniques. Par conséquent, lors de l'imagerie des véhicules électriques hydratés, il est préférable de couvrir le substrat avec un milieu tampon, comme LE PBS, au lieu de l'eau DI.
Importance de l'immobilisation de surface
L'immobilisation constante et prévisible des véhicules électriques sur le substrat modifié élimine la principale source de variabilité dans les résultats de l'AFM. Toutes les étapes en aval, de la numérisation à l'analyse des données, sont plus facilement contrôlées par la sélection de l'instrumentation, des sondes, des paramètres de numérisation, ainsi que par la séquence et les algorithmes d'analyse de données. L'utilisateur doit être conscient de la variabilité en amont des échantillons biologiques et des protocoles d'isolement des véhicules électriques, qui sont des questions importantes au-delà de la portée de ce travail.
Nous recommandons d'effectuer l'immobilisation de surface de EV sur la surface du mica modifié à partir d'échantillons liquides, même lorsque l'objectif est de caractériser les vésicules desséchées dans l'air - le besoin est moins évident puisque les vésicules seront inévitablement déposer sur n'importe quel substrat que le liquide s'évapore. En fait, les résultats de l'AFM pour les EV desséchés obtenus sans modifier les charges de surface du mica, qui est une étape préalable pour l'immobilisation électrostatique des véhicules électriques à partir d'un liquide, ont été signalés au cours des19,20,21 dernières . Cependant, lorsque les véhicules électriques ne sont pas fixés à la surface à partir de l'échantillon liquide, leur dépôt passif par évaporation produira des artefacts collectivement connus sous le nom d'effet d'anneau de café22. Deux artefacts de ce type, qui se produisent à mesure qu'un liquide de séchage recule, sont illustrés dans l'image SEM (figure 13A) d'exosomes de sérum déposés par évaporation sur une surface de verre chargée négativement. Des variations significatives de la concentration de surface des vésicules précipitées sont immédiatement apparentes. Le deuxième artefact, quantifié à la figure 13B,est la variabilité considérable de la taille des vésicules dans différentes zones du périmètre de l'échantillon séché. Compte tenu de ces artefacts, la caractérisation par l'AFM des vésicules déposées passivement à partir d'un liquide de séchage peut produire des résultats biaisés ou incohérents à moins que toute la surface initialement occupée par un échantillon liquide maintenant séché ne soit numérisée.
Deux autres questions devraient être prises en considération lors de l'imagerie des échantillons desséchés obtenus sans immobilisation ferme des vésicules sur le substrat. Rappelons que notre protocole demande aux utilisateurs de bien laver la surface avec de l'eau DI après que les vésicules sont immobilisées à partir d'un échantillon liquide. Cette étape vise à empêcher les solutés ioniques et autres non vésiculaires de former des dépôts de surface lors de l'évaporation de biofluides complexes avec une osmolarité considérable. Si les véhicules électriques ne sont pas réparés, un lavage complet détachera un grand nombre de vésicules de la surface, ce qui pourrait biaiser les résultats et laisser trop peu de particules pour l'analyse. Une autre difficulté commune, réduite par l'immobilisation des véhicules électriques sur la surface modifiée du mica avant l'imagerie AFM, est l'adhérence des particules à la sonde23 et les artefacts trompeurs causés par ce phénomène.
Contrôle de la densité de surface des véhicules électriques immobilisés
Les deux facteurs facilement contrôlables identifiés dans le protocole permettent à l'utilisateur de personnaliser la concentration de surface des véhicules électriques immobilisés sur le substrat mica modifié : la concentration des vésicules dans l'échantillon liquide et le temps d'incubation de l'échantillon sur le substrat. Une forte densité de vésicules immobilisées, obtenue avec des temps d'incubation plus longs et une concentration plus élevée de véhicules électriques dans le liquide, augmente le nombre de vésicules analysées lors de la numérisation et la puissance statistique des conclusions obtenues par l'analyse de l'AFM données. Dans le même temps, une concentration de surface excessivement dense, comme dans le cas indiqué à la figure 10C où les particules recouvrent étroitement toute la surface sans zones intermédiaires du substrat, complique l'analyse de l'image et l'interprétation des résultats et peut conduire à la numérisation d'artefacts causés par l'interaction entre les particules étroitement espacées.
Influence du dépistage électrostatique et de la mobilité hydrodynamique des véhicules électriques
Le contrôle transparent de la concentration en surface des véhicules électriques immobilisés en fonction des facteurs qui l'influencent permet à l'utilisateur de personnaliser les conditions expérimentales pour répondre aux besoins spécifiques d'une étude. Lors de la personnalisation, il est important de reconnaître que l'immobilisation de surface électrostatique est un processus limité par le transport influencé par la force ionique du biofluide.
La concentration d'espèces ioniques et chargées positivement inversement inversement la longueur de Debye sur laquelle les charges de surface et de vésicule sont examinées. Au-delà de cette longueur, les forces électrostatiques sont négligeables. La couche limite de l'attraction électrostatique du substrat sera beaucoup plus petite dans le PBS riche en ions que dans l'eau DI. Cette différence implique qu'après une courte incubation correspondant au temps nécessaire pour épuiser la couche de liquide où se font sentir les attractions électrostatiques, une densité de surface des véhicules électriques immobilisés de la suspension dans l'eau DI sera plus élevée que celle de PBS suspension, en supposant que la concentration des véhicules électriques est la même dans les deux liquides. En d'autres termes, plus de vésicules doivent être immobilisées pour épuiser une couche d'attraction plus épaisse dans l'eau DI que dans pbS dans des conditions autrement identiques.
Une fois que les vésicules sont épuisées de la couche limite, l'immobilisation devient un processus entièrement limité par le transport. Dans ce régime, le taux de dépôt ne dépendra pas du milieu suspendu (p. ex., d'eau DI ou PBS) tant que la viscosité est la même et que le transport est entièrement diffusif. Cependant, le transport des vésicules dans la couche limite d'attraction peut ne pas être entièrement diffusif. Par exemple, si l'échantillon dans une goutte de sessile sur le substrat AFM s'évapore partiellement pendant l'incubation, le fluide à l'intérieur de la goutte sera soumis à l'écoulement entraîné par évaporation, et le transport des vésicules vers le substrat aura, à la fois, contributions diffuses et convectives. Lorsque l'évaporation n'est pas suffisamment contrôlée, la contribution d'un transport convectif sera considérable, et le taux d'immobilisation sera plus élevé que prévu. L'impact du transport convectif changera avec l'épaisseur de la couche d'attraction, qui elle-même dépend de la teneur ionique du liquide. De plus, l'évaporation améliorera l'immobilisation de la vésicule sur le substrat en concentrant les véhicules électriques dans la solution. À des concentrations plus élevées de VE, le gradient de concentration entre la couche d'attraction et le liquide adjacent augmentera, créant une plus grande force de conduite thermodynamique à la migration des vésicules vers le substrat.
Les vésicules immobilisées peuvent représenter un échantillon liquide avec un biais. Pour le cas où le taux d'immobilisation est limité par la diffusion, les vésicules de plus petite taille hydrodynamique, déterminées par la combinaison de la taille de la vésicule et de l'épaisseur de la couche coronale qui l'entoure (figure 1), sont plus susceptibles d'entrer dans le d'attraction en raison de leur mobilité plus élevée. Par conséquent, après la période d'épuisement initiale, les petits véhicules électriques hydrodynamiques seront surreprésentés sur le substrat par rapport à leur contribution à la population de véhicules électriques dans l'échantillon liquide. Notez qu'une taille hydrodynamique plus petite ne pointe pas automatiquement vers les véhicules électriques avec des tailles plus petites de vésicule en raison de l'hétérogénéité dans l'épaisseur de la couche coronale3. La représentation biaisée est évitée avec de longues incubations qui épuisent toute la population de véhicules électriques dans le liquide par son immobilisation sur le substrat. Lorsqu'un utilisateur vise à immobiliser tous les véhicules électriques du biofluide, afin d'éviter une couverture excessivement dense de la surface avec les vésicules immobilisées, il peut être nécessaire de réduire la concentration de VE dans le liquide en dessous de la plage suggérée dans le protocole.
Déformation des véhicules électriques sur le substrat
Les vésicules extracellulaires dans leur état hydraté indigène et après dessiccation peuvent être caractérisées par l'AFM, comme décrit dans le protocole. Les forces électrostatiques24 qui immobilisent les véhicules électriques sur la surface du mica déforment également leur forme de la géométrie globulaire dans laquelle ils existent dans la solution. L'impact de la dessiccation sur la taille et la morphologie des véhicules électriques immobilisés peut être analysé en rescannant la même surface avant et après que l'échantillon soit autorisé à sécher.
Il est instructif d'examiner l'impact de la préparation de l'échantillon sur la forme des véhicules électriques desséchés. Les véhicules électriques électrostatiquement immobilisés maintiennent la géométrie très oblate après le séchage, mais sont encore aplatis par la dessiccation. La hauteur au-dessus de la surface des vésicules desséchées devient plus petite que dans la figure 12A, tandis que leur zone d'empreinte augmente (données non montrées). D'autre part, lorsque les vésicules sont déposées passivement pendant l'évaporation liquide et sans immobilisation préalable à la surface, elles ont tendance à atteindre une géométrie en forme de tasse lors de la dessiccation, comme cela a longtemps été observé dans les images SEM et, plus récemment, dans l'AFM Scans. Cette forme en coupe est maintenant reconnue comme un artefact de préparation d'échantillon25 causé par la non-uniformité des forces capillaires pendant la dessiccation de surface, comme l'explique mécaniquement la figure 141.
Analyse et interprétation d'images des données de l'AFM
Les réponses aux forces électrostatiques et capillaires agissant pour fausser la forme des véhicules électriques fournissent des informations précieuses sur les propriétés structurelles et compositionnelles des véhicules électriques. Par exemple, un ensemble multidimensionnel de caractéristiques biophysiques, telles que la taille déformée et la forme extraite des données de l'AFM, ont été récemment utilisés pour démontrer la faisabilité de différencier les exosomes sécrétés par différentes cellules hôtes5. Les distorsions peuvent également être prises en compte et compensées. Par exemple, nous avons montré comment utiliser les données AFM pour caractériser la taille globulaire des vésicules dans la solution en estimant les diamètres des sphères qui encapsulent le même volume que les exososmes immobilisés3.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs reconnaissent le soutien financier de la National Science Foundation (numéro iGERT-0903715), de l'Université de l'Utah (Department of Chemical Engineering Seed Grant et du Graduate Research Fellowship Award) et du Skolkovo Institute of Science et la technologie (Skoltech Fellowship).
matériels
| Name | Company | Catalog Number | Comments |
| AFM/STM Controller | Bruker | Multimode Nanoscope V | This AFM controller supports imaging of biological samples in liquid and air. |
| AFM/STM metal specimen discs (10 mm) | TedPella | 16207 | Metal specimen disc on which a mica disk is attached by a double-sided tape or other means. |
| AFM/STM Mica discs (10 mm) | TedPella | 50 | Highest quality grade V1 mica, 0.21mm (0.0085”) thick. Interleaved, in packages of 10. Can be mounted on AFM/STM discs. Available in four diameters |
| AFM probe for imaging in the air | Bruker | TESP-V2 | High quality etched silicon probes for tapping mode and non-contact mode for scanning in the air. |
| AFM probe for soft sample imaging in liquid | Bruker | MLCT | Soft silicon nitride cantilevers with silicon nitride tips, which are well-suited for liquid operation. The range in force constants enables users to image extremely soft samples in contact mode as well as high load vs distance spectroscopy. |
| Double sided tape | Spectrum | 360-77705 | Used to fix the mica disk on the metal specimen disc. |
| ExoQuick-TC | System Biosciences | EXOTC50A-1 | ExoQuick-TC is a proprietary polymer-based kit designed for exosome isolation from tissue culture media. |
| Glass probe AFM holder for imaging in liquid | Bruker | MTFML-V2 | This glass probe holder is designed for scanning in fluid with the MultiMode AFM. The holder can be used in peak force tapping mode, contact mode, tapping mode, and force modulation. The probe is acoustically driven by a separate piezo oscillator for larger amplitude modulation. The holder is supplied with two ports, required fittings, and accessories kit for adding and removing fluids. |
| Gwyddion | Czech Metrology Institute. | Version 2.52 | Open Source software for visualization and analysis of data fields obtained by scanning probe microscopy techniques. |
| Lint-free blotting paper | GE Healthcare Whatman | Grade GB003 Blotting Paper | Use this blotting paper to remove NiCl2 after the modification of the mica's substrate. |
| Lint-free cleanroom wipes | Texwipe | AlphaWipe TX1004 | Use these polyester wipes for surface cleaning. |
| Nickel(II) chloride (NiCl2) | Sigma-Aldrich | 339350 | Powder used to make 10 mM NiCl2 in DI water |
| Phosphate Buffered Saline (1x) | Gibco | 10010023 | PBS, pH 7.4 |
Références
- Chernyshev, V. S., et al. Size and shape characterization of hydrated and desiccated exosomes. Analytical and Bioanalytical Chemistry. 407, 3285-3301 (2015).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10, 881-906 (2018).
- Skliar, M., et al. Membrane proteins significantly restrict exosome mobility. Biochemical and Biophysical Research Communications. 501, 1055-1059 (2018).
- Parisse, P., et al. Atomic force microscopy analysis of extracellular vesicles. European Biophysics Journal. 46, 813-820 (2017).
- Ito, K., et al. Host Cell Prediction of Exosomes Using Morphological Features on Solid Surfaces Analyzed by Machine Learning. Journal of Physical Chemistry B. 122, 6224-6235 (2018).
- Sharma, S., LeClaire, M., Gimzewski, J. K. Ascent of atomic force microscopy as a nanoanalytical tool for exosomes and other extracellular vesicles. Nanotechnology. 29, 132001 (2018).
- Meyer, R. L. Immobilisation of living bacteria for AFM imaging under physiological conditions. Ultramicroscopy. 110, 1349-1357 (2010).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A., et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current protocols in cell biology. Chapter 3 (Unit 3.22), (2006).
- Taylor, D. D., Zacharias, W., Gercel-Taylor, C. Exosome isolation for proteomic analyses and RNA profiling. Methods in Molecular Biology. 728, 235-246 (2011).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 8, 1535750 (2019).
- Weng, Y., et al. Effective isolation of exosomes with polyethylene glycol from cell culture supernatant for in-depth proteome profiling. The Analyst. 141, 4640-4646 (2016).
- Nečas, D., Klapetek, P. Gwyddion: an open-source software for SPM data analysis. Open Physics. 10, 181-188 (2012).
- Hsueh, C., Chen, H., Gimzewski, J. K., Reed, J., Abdel-Fattah, T. M. Localized nanoscopic surface measurements of nickel-modified Mica for single-molecule DNA sequence sampling. ACS Applied Materials and Interfaces. 2, 3249-3256 (2010).
- Conde-Vancells, J., et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes. Journal of Proteome Research. 7, 5157-5166 (2008).
- Zhou, Y., et al. Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro. Stem Cell Research & Therapy. 4, 34 (2013).
- Coleman, B. M., Hanssen, E., Lawson, V. A., Hill, A. F. Prion-infected cells regulate the release of exosomes with distinct ultrastructural features. FASEB Journal. 26, 4160-4173 (2012).
- Briegel, A., et al. Universal architecture of bacterial chemoreceptor arrays. Proceedings of the National Academy of Sciences. 106, 17181-17186 (2009).
- Akagi, T., et al. On-Chip Immunoelectrophoresis of Extracellular Vesicles Released from Human Breast Cancer Cells. PLOS ONE. 10, e0123603 (2015).
- Sharma, S., et al. Structural-mechanical characterization of nanoparticle exosomes in human saliva, using correlative AFM, FESEM, and force spectroscopy. ACS Nano. 4, 1921-1926 (2010).
- Radeghieri, A., et al. Cultured human amniocytes express hTERT, which is distributed between nucleus and cytoplasm and is secreted in extracellular vesicles. Biochemical and Biophysical Research Communications. 483, 706-711 (2017).
- Woo, J., Sharma, S., Gimzewski, J. The Role of Isolation Methods on a Nanoscale Surface Structure and Its Effect on the Size of Exosomes. Journal of Circulating Biomarkers. 5, 11 (2016).
- Deegan, R. D., et al. Capillary flow as the cause of ring stains from dried liquid drops. Nature. 389, 827-829 (1997).
- Johnson, C. A., Lenhoff, A. M. Adsorption of Charged Latex Particles on Mica Studied by Atomic Force Microscopy. Journal of Colloid and Interface Science. 179, 587-599 (1996).
- Pastré, D., et al. Adsorption of DNA to Mica Mediated by Divalent Counterions: A Theoretical and Experimental Study. Biophysical Journal. 85, 2507-2518 (2003).
- van der Pol, E., Böing, A. N., Harrison, P., Sturk, A., Nieuwland, R. Classification, functions, and clinical relevance of extracellular vesicles. Pharmacological Reviews. 64, 676-705 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon