Method Article
Utilisation de puces microfluidiques plastique prémontées pour compartimenter les neurones murins primaires
Dans cet article
Résumé
Ce protocole décrit l’utilisation de jetons en plastique de la culture et de compartimenter les neurones murins primaires. Ces puces sont prémonté, facile à utiliser et compatible avec haute résolution, en direct et l’imagerie de fluorescence. Ce protocole décrit comment plaque de neurones de l’hippocampe au sein de ces puces rat et exécuter immunostaining, axotomie et l’isolement fluidique.
Résumé
Méthodes microfabriques à compartimenter les neurones sont devenus des outils essentiels pour de nombreux chercheurs en neurosciences. Ce protocole décrit l’utilisation d’une puce en plastique prémontée disponible dans le commerce pour compartimenter les neurones hippocampal cultivés primaires de rat. Ces jetons en plastique, contenus dans l’empreinte d’une lame de microscope ordinaire, sont compatibles avec la haute résolution, en direct et l’imagerie de fluorescence. Ce protocole montre comment rétrograde des neurones étiquette via les axones isolés à l’aide d’un virus de la rage mis à jour le codant pour une protéine fluorescente, créez des micro-environnements isolés dans un compartiment et exécutez axotomie et immunocytochimie sur puce. Les neurones sont cultivées pour > 3 semaines dans les jetons en plastique, illustrant la compatibilité de ces puces pour les cultures de neurones à long terme.
Introduction
La culture traditionnelle neurone s’approche résultat dans l’excroissance aléatoire des axones et les dendrites, qui empêchent l’étude des neurones dans leur morphologie polarisée unique. Microfabriques compartiments périphériques sont devenus des outils de recherche bien établi et très utilisé pour les chercheurs en neurosciences dans les 10-15 dernières années (les publications de prestige sélectionnées sont référencé1,2,3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17). ces dispositifs compartimenter les neurones et fournir une méthode pour manipuler physiquement et chimiquement les régions subcellulaires des neurones, dont les corps cellulaires, dendrites, axones et synapses18,19. Ils fournissent également plusieurs paradigmes expérimentaux qui ne sont pas possibles en utilisant des cultures au hasard, y compris les études de transport axonal, synthèse protéique axonale, blessure/régénération axonale et signalisation axon-à-soma. La configuration de base 2-compartiment se compose de deux canaux microfluidiques parallèles séparés par une série de petits micro-rainures perpendiculaire. Primaires ou de cellules souches dérivées de neurones sont plaqués dans l’un des canaux microfluidiques, de régler et fixer à la surface inférieure de l’appareil et étendre les neurites au cours des jours. De nombreux cônes de croissance trouver leur chemin dans les micro-rainures, qui sont assez petits pour qu’elles empêchent les corps cellulaires entrant. Parce que les cônes de croissance sont physiquement limité et impossible de faire demi-tour dans les micro-rainures, ils se développent directement dans le compartiment adjacent (compartiment axonal) où ils sont isolés.
Historiquement, ces dispositifs ont été moulés en utilisant poly(dimethylsiloxane) (PDMS) partir d’un moule de maître photolitographie modelé et sont faits maison dans les laboratoires des enquêteurs ou achetés dans le commerce. Parmi les principaux inconvénients de l’utilisation de PDMS est son hydrophobicité20. PDMS peut être faite hydrophile temporairement, mais ensuite rapidement devient hydrophobe quelques heures dans un milieu non aqueux20. Pour cette raison, les appareils doivent annexer à une lamelle de verre ou autre substrat adéquat au moment de l’utilisation. Pré-assemblés puces compartiments en plastique sont maintenant disponibles dans le commerce (par exemple, XonaChips) en plastique moulé par injection. Ces puces sont faits en permanence hydrophiles, simplifiant pipi au dispositif et permettant à l’Assemblée avant de la puce avec une fine pellicule de copolymère d’oléfine cyclique (COC) entourant les canaux microfluidiques sur le fond. Ces puces sont fabriqués dans un plastique optiquement transparent approprié pour l’imagerie de fluorescence à haute résolution.
Ce protocole vise à démontrer l’utilisation des puces microfluidiques plastique prémontées pour plusieurs paradigmes expérimentaux effectuée à l’aide des neurones hippocampal ou corticales murines. Ce protocole décrit comment rétrograde des neurones d’étiquette à l’aide d’un virus de la rage modifiés au sein de la puce. Axotomie pour l’étude des lésions axonales et la régénération sont également décrites. Enfin, ce protocole indique comment exécuter immunostaining fluorescence avec l’appareil.
Protocole
NOTE : Une représentation schématique de la puce de compartiments en plastique est illustrée à la Figure 1 a, B. La puce est la taille d’une lame de microscope ordinaire (75 × 25 mm). Les caractéristiques de la puce, y compris les canaux principaux ou des compartiments, des puits et des micro-rainures sont étiquetés et sont fournis pour référence ultérieure. La figure 1 est une photographie de la puce démontrant l’isolement fluidique des compartiments.
1. préparation et revêtement des compartiments-Chips
- Dans un cabinet de bio-sécurité, placez le jeton dans une boîte de Pétri ou autre récipient stérile.
- Ajouter 100 µL de revêtement des solution à haut à gauche des puits de la puce et laissez-le s’écouler à travers le chenal principal vers le mitoyen bien.
Remarque : La solution de revêtement préalable sert à enduire préalablement les canaux microfluidiques pour éliminer les risques de piégeage de bulles d’air dans le circuit. - Remplir la partie inférieure gauche bien avec 100 µL de revêtement des solution. Attendre 5 min pour permettre à la solution de couler à travers les micro-rainures.
- Ajouter 100 µL de pré enduit de solution à la tige droite bien et laissez-le s’écouler à travers le chenal principal vers le mitoyen bien. Remplir le puits inférieur droit avec 100 µL de revêtement des solution.
- Aspirer la solution de chaque puits. Aspirez loin les principaux canaux d’éviter de retirer le liquide des canaux principaux (Figure 2 a). Immédiatement ajouter 150 µL d’une solution saline tamponnée au phosphate (PBS) dans le coin supérieur gauche. Attendre 1,5 min.
ATTENTION : Ne pas aspirer tout le liquide des canaux principaux ci-joint. - Ajouter 150 µL PBS dans le coin inférieur gauche puits. Attendre 5 min pour permettre aux liquides de s’écouler à travers les micro-rainures. Ajouter 150 µL PBS à la tige droite bien. Ajouter 150 µL de PBS pour abaisser juste bien. Attendre 10 min.
- Répétez les étapes 1,5 à 1,6 pour un deuxième lavage de PBS.
- Vérifier la puce sous un microscope de culture tissulaire des bulles se forment dans les principaux canaux. Si les bulles sont présentes, effectuez les procédures ci-dessous. Si aucune bulle n’est présents, passez à l’étape 1.9.
- Aspirer les PBS provenant des puits de la pêche à la pointe de pipette loin de l’ouverture (Figure 2 a) d’un canal.
- Déposer 100 µL de pré enduit solution dans le puits supérieur, la pêche à la pointe de la pipette près du chenal d’ouverture (Figure 2 b). Les bulles doivent se déplacer à travers le canal dans le puits inférieur. Attendre 1,5 min.
- Répétez les étapes 1,3 à 1,8.
- Aspirer les PBS provenant des puits de la pêche à la pointe de pipette loin de l’ouverture (Figure 2 a) d’un canal.
- Ajouter 100 µL de 0,5 mg/mL poly d-lysine (PDL) à la partie supérieure gauche des puits de la puce. Attendre 1,5 min. remplissage inférieur gauche bien avec 100 µL de PDL.
- Ajouter 100 µL de PDL dans le puits supérieur droit de la puce. Attendre 1,5 min. Ajouter 100 µL dans le puits inférieur droit.
- Fermez la boîte de Pétri et placer la puce dans un incubateur à 37 ° C pendant 1 h.
- Répétez les étapes de lavage PBS 1.5-1.6 deux fois pour enlever l’excès PDL.
- Aspirer les PBS de l’appareil.
- Immédiatement ajouter 100 µL de milieux de culture cellulaire à haut à gauche des puits de la puce. Attendez bien 1,5 min. ajouter des médias à la partie inférieure gauche. Ajouter des données à la partie supérieure droite bien. Attendre 1,5 min. Ajouter 100 µL de milieu dans le puits inférieur droit de la puce.
- Placez le jeton dans un incubateur à 37° C jusqu’au moment de cellules de la plaque.
2. ensemencement des neurones dans les compartiments puces
- Préparer la suspension cellulaire des neurones de l’hippocampe rat dissociés selon les protocoles établis21,22 pour obtenir une densité de ~ 12 × 106 cellules/mL.
Remarque : Utilisation de la densité des cellules suspension entre 3 et 12 × 106 cellules/mL est possible. Si l'on utilise une densité plus faible, le volume de suspension cellulaire à ajouter à la puce peut être augmenté (voir ci-dessous). La procédure décrite ci-dessous est applicable pour murines neurones corticaux ou hippocampe dissociées. La densité des cellules optimales pour d’autres types de neurones peut-être varier. - Supprimez la majorité des médias dans chaque puits de la puce, en laissant environ 5 µL à chaque puits. Aspirez loin les principaux canaux d’éviter de retirer le liquide des canaux principaux (Figure 2 a).
ATTENTION : Ne pas aspirer le liquide des principaux canaux fermés. Bulles d’air peuvent être emprisonnées dans la puce si le fluide est aspiré des canaux principaux. - Charger 5 µL de suspension cellulaire dans le coin supérieur droit bien et une autre 5 µL de suspension cellulaire dans le puits inférieur droit (total de ~ 120 000 cellules). Charger les cellules en supprimant près du chenal principal (Figure 2 b). Vérifier sous microscope pour s’assurer que les neurones sont dans le chenal principal. Attendre 5 min permettre les cellules d’attacher.
Remarque : Les neurones peuvent être chargés dans des compartiments. À des fins d’explication, le compartiment somatique est le chenal principal sur le côté droit, mais un compartiment peut être utilisé comme le compartiment somatique. Utilisation des plus faibles densités cellulaires jusqu'à 60 000 cellules par puce est possible. Jusqu'à 10 µL de cellules suspension peut-être être ajoutée à chaque bien du compartiment somatique en combinaison avec une suspension de cellules avec moins de cellules que celle décrite précédemment. - Ajouter environ 150 µL de milieux de culture neuronale à chacun du upper et lower puits à droite et puis ajouter 150 µL de médias à chacun du upper et lower puits à gauche. Mettre la puce dans le plateau humidifiée dans un incubateur à 37 ° C 5 % CO2 .
- Après 24h, effectuer un changement de support en enlevant des médias provenant des puits. Assurez-vous que le chenal principal reste rempli. Ajouter 150 µL de médias dans chaque cupule haut de la page et remplissez les puits à fond.
- Replacez la puce dans l’incubateur pour le nombre de jours souhaité.
NOTE : Surveiller les médias tous les deux jours pour s’assurer qu’elle reste rose clair. Si le média est jaunâtre, remplacez 50 % de celle-ci avec les supports neufs. Si le niveau du liquide est bas, assurez-vous qu’il y a une humidité adéquate et appropriée confinement secondaire des puces pour éviter une évaporation. Réduire ou même éliminer, milieu change est possible en utilisant un confinement secondaire et/ou en couvrant le plat contenant la puce avec le polytétrafluoroéthylène (PTFE)-film de FEP.
3. rétrograde marquage des neurones dans la puce
NOTE : Marquage rétrograde peut être effectuée à l’aide de plusieurs techniques, y compris à l’aide de virus de la rage et la toxine de choléra mis à jour le. Ci-dessous est mode d’étiquetage neurones aide virus de la rage-mCherry ou - eGFP G-supprimé. Manipuler des matériaux potentiellement infectieux conformément aux directives de l’organisation locale. Une formation supplémentaire peut être exigée.
- Milieux de culture neuronale frais chaud à 37 ° C. Estimer ~ 400 µL de médias par puce.
- Diluer 100 000 unités virales du virus de la rage modifiés dans un total de 50 µL en utilisant les médias tirés soit bien du compartiment axonal.
NOTE : Dispose de conseils et de tubes en contact avec le virus selon le protocole de l’organisme agréé. - Doucement, pipette les médias restants provenant des puits du compartiment axonal et magasin dans une centrifugeuse tube à 37 ° C.
- Ajouter 150 µL de frais médias chauds et les 50 µL de virus dilué dans le compartiment axonal. Incuber pendant 2 h à 37 ° C incubateur.
- Retirez les supports contenant des virus et jetez-le correctement.
NOTE : Bulles d’Air peuvent être emprisonnées dans la puce si le fluide est aspiré des canaux principaux. - Doucement ajouter 75 µL de supports neufs dans un axone bien et laissez-le s’écouler bien d’autre l’axone.
- Retirez intermédiaire de l’axone deuxième bien et éliminer correctement.
- Répétez les étapes 3.6 et 3.7 une fois.
- Ajouter des médias stockés en arrière dans le compartiment axonal. Ajouter environ 50 µL les supports neufs, si nécessaire, pour maintenir le volume adéquat et retourner les cellules dans l’incubateur.
NOTE : Expression de la protéine fluorescente est visible en 48 h et persiste pendant 8 jours. Neurones peuvent être projetés jusqu'à 30 min à température ambiante dans les milieux de culture neuronale. Milieux de culture peut aussi être remplacé avec du réchauffé CO2-independent hiberner E avec B27 et imagés pour plus. Neurones peuvent aussi être photographiées dans une chambre environnementale bien humidifiée à 37 ° C et 5 % de CO2. Dans ce cas, l’humidification est essentielle pour minimiser les pertes par évaporation dans les puces, qui est aggravée par la chaleur et peuvent compromettre la santé de neurone.
4. fluidique Isolation du compartiment Axonal dans la puce
- Retirez 20 µL de la partie inférieure gauche bien du compartiment axonal et place dans la cupule supérieure droite du compartiment somatique. Attendre 2 min pour les flux au sein de chaque canal de s’équilibrer.
- Retirer 50 µL de médias du compartiment axonal. Ajouter 0,3 µL d’hydrazide maléique 1 mM Alexa Fluor 488 à ce média, mélanger par pipette et retourner vers le compartiment axonal. La puce est prête pour l’imagerie.
Remarque : Les autres composés d’intérêt peuvent être ajoutés. Ajout d’un colorant fluorescent dont le poids moléculaire similaire comme étant le composé d’intérêt est recommandé afin de surveiller l’isolement fluidique au fil du temps.
5. effectuer une axotomie au sein de la puce
- Retirez le support du compartiment axonal maintenant l’embout de la pipette de l’entrée du chenal principal (Figure 2 a) et stockez-la dans un tube à centrifuger.
- Aspirer le compartiment axonal complètement, en plaçant la pipette d’aspiration près de l’entrée du chenal principal du compartiment axonal (Figure 2 b). Continuer d’aspiration pour les 1-2 min. s’assurer que la solution est complètement enlevée du compartiment.
Remarque : La pression de vide pour l’aspiration doit être au moins 18 pouces-Hg pour la procédure axotomie travailler correctement. - Remplacer le compartiment axonal avec les médias stockées et confirmer que les axones sont rompus en regardant la puce sous un microscope.
Remarque : Si les bulles se forment dans le compartiment axonal lors du remplacement des médias, répétez les étapes 5.1-5.2. - Remettez la puce dans l’incubateur.
6. fluorescence immunomarquage au sein de la puce
- Préparer la solution de fixation 4 % formaldéhyde dans du PBS (4 % de formaldéhyde, 1 µM MgCl2, 0,1 µm CaCl2, saccharose 120 mM)
- Enlever la plupart des médias dans les puits de la puce (ne pas sécher les compartiments intérieurs).
- Immédiatement ajouter 100 µL de solution de fixation sur les puits supérieurs des compartiments axonales et somatiques.
- Après 1 min, ajouter 100 µL de solution de fixation dans les puits à fond. Difficulté pendant 30 min à température ambiante.
- Enlever la plupart de la solution par les puits de la puce (ne pas sécher les compartiments intérieurs). Immédiatement ajouter 150 µL de PBS à chacun des puits supérieurs des compartiments axonales et somatiques. Attendre 2 min pour les PBS d’affluer dans les puits à fond.
- Répétez l’étape 6.5 deux fois.
- Enlever la plupart de la PBS provenant des puits de la puce. Immédiatement ajouter 150 µL de PBS avec 0,25 % TritonX-100 à chacun des puits supérieurs des compartiments axonales et somatiques. Attendre 15 min.
- Enlever la plupart de liquide provenant des puits de la puce et immédiatement ajouter 150 µL de solution de saturation (10 % de sérum de chèvre normal dans du PBS) à chacun des puits supérieurs des compartiments axonales et somatiques. Attendre 15 min.
Remarque : Des solutions efficaces de blocage devrait être spécifique de l’anticorps secondaire, par exemple, pour un anticorps secondaire de anti-mouton âne, utiliser le sérum de l’âne dans la solution de blocage. - Enlever la plupart de liquide provenant des puits de la puce et immédiatement ajouter 100 µL d’anticorps primaire (ou anticorps) dans le sérum de chèvre normal de 1 % dans du PBS à chacun des puits supérieurs des compartiments axonales et somatiques. Couvrir pour minimiser l’évaporation et attendre pendant 1 h à température ambiante ou à 4 ° C durant la nuit.
- Enlever la plupart de la solution par les puits de la puce (ne pas sécher les compartiments intérieurs). Immédiatement ajouter 150 µL de PBS à chacun des puits supérieurs des compartiments axonales et somatiques. Attendre 5 min pour les PBS d’affluer dans les puits à fond.
- Répétez l’étape 6.10 deux fois.
- Enlever la plupart de liquide provenant des puits de la puce et immédiatement ajouter 100 µL d’anticorps secondaire (ou anticorps) dans du PBS dans chacun des puits supérieurs des compartiments axonales et somatiques. Couvrir pour minimiser l’évaporation et attendre pendant 1 h à température ambiante.
Remarque : Reportez-vous aux instructions du fabricant pour la dilution recommandée des anticorps secondaires. - Répétez les étapes 6.10-6.11.
- Si image dans 1 jour d’immunomarquage, garder la puce remplie avec du PBS. Si la puce sera stocké plus de 1 jour avant l’imagerie, envelopper le plat contenant la puce dans le film de paraffine pour éviter l’évaporation et conserver à 4 ° C jusqu’au moment de l’image.
- Pour une conservation plus longue durée d’échantillons, les supports de montage (par exemple, Fluoromount-G) peut être utilisé.
- Enlever la plupart de liquide provenant des puits de la puce. Utiliser une pipette en plastique jetable 1 mL pour ajouter 2 gouttes de montage de médias pour chacun des puits supérieurs des compartiments axonales et somatiques.
- Inclinez la puce afin d’encourager le flux des médias à travers les chaînes de montage. Après 5 min, verser 2 gouttes dans les puits à fond. Attendre 1 h avant l’imagerie.
Remarque : Après l’utilisation de supports de montage il sera impossible re-détecter les autres cibles.
Résultats
Après environ 5-7 jours de croissance des neurones dans la puce, la croissance axonale est évidente. Les puces sont compatibles avec l’imagerie de contraste de phase comme l’a démontré à la Figure 3, qui montre la croissance neuronale à 24 jours. Les puces sont également compatibles avec fluorescence imaging (Figure 4, Figure 5, Figure 6et Figure 7). Trois jours après l’infection de virus de la rage via le compartiment axonal, neurones mCherry positifs avec les axones s’étendant dans le compartiment axonal ont été projetés dans la puce (Figure 4). Afin de démontrer la capacité d’isoler assistés les compartiments, un colorant fluorescent de faible poids moléculaire (Alexa Fluor 488 hydrazide) a été ajouté au compartiment axonal. Ces résultats sont comparables à la chambre de base PDMS17 et démontrent l’adéquation de la puce en plastique pour contraste de phase et l’imagerie de fluorescence.
Pour illustrer la croissance neuronale avec les jetons en plastique et les dispositifs PDMS, nous avons des cultures de neurones dans les deux plates-formes et surveiller la croissance neuronale au fil du temps. La figure 5 illustre la croissance neuronale de 3 à 22 jours en culture ; Ces résultats sont représentatifs des 3 expériences indépendantes. La croissance neuronale est comparable dans les deux plates-formes jusqu'à 15 jours en culture, mais à la culture plue âgés (> 21 jours) des axones isolés au sein de la puce en plastique apparaissent plus saines avec moins perler (Figure 5 a). Pour visualiser davantage les axones dans les compartiments axonales, nous immunocolorées pour la β-tubuline III qui montre une saine croissance axonale dans le plastique puces at 22 jours de culture (Figure 5 b).
Études de blessures et la régénération axonale sont communs à l’aide de dispositifs microfluidiques compartimenté. Afin de démontrer la pertinence de ces études utilisant les puces, rétrograde étiquetées neurones étaient projetés avant et 24 h après l’axotomie (Figure 6). Une ampoule de rétraction et la régénération axonale sont les deux axotomie suivants évident. Ces résultats correspondent aux données publiées à l’aide de périphériques PDMS14,17.
Immunocytochimie est une technique courante effectuée dans les compartiments multiples dispositifs de visualiser la localisation des protéines. Après 24 jours de culture, neurones dans les puces ont été fixées et colorées pour les marqueurs synaptiques excitatrices et inhibitrices, vGlut1 et vGat, respectivement (Figure 7). Les neurones rétrograde mCherry marqués étaient aussi imagés (Figure 7). L’imagerie a effectué un disque de rotation confocal avec un objectif à immersion à huile 60 × silicone, démontrant la capacité d’effectuer l’imagerie haute résolution. Ce qui est important, des épines dendritiques étaient évidents dans une région agrandie, ce qui démontre que les neurones cultivés dans les puces sont formaient des synapses matures.

Figure 1 : Une puce microfluidique à deux compartiments pré-assemblés, plastique pour compartimenter les neurones. (A) représentation schématique de la puce compartiments montrant les emplacements des puits supérieurs et inférieurs. (B) un schéma élargie de la puce montrant les principales chaînes (ou compartiments) et micro-rainures qui relient les compartiments. Les principaux canaux sont environ 1,5 mm × 7 × 0,060 mm (L × L × H). La largeur et la hauteur de la micro-rainures sont environ 0,01 mm × 0,005 mm, respectivement. La durée de la micro-rainures varie selon la configuration, 0,15 mm à 0,9 mm. (C) une photo d’une puce représentante de compartiments contenant le colorant de colorant dans chaque compartiment démontrant la capacité à assistés ou chenal principal alimentaire chaque canal de l’isolat. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Pipetage techniques nécessaires lors de l’utilisation des copeaux de compartiments en plastique. (A) en ajoutant et en aspirant les médias pour les lavages, l’embout de la pipette devrait être orienté de l’entrée du chenal principal comme indiqué. (B) lorsque les neurones de chargement ou d’effectuer une axotomie, l’embout de la pipette doit être orientée vers l’entrée du chenal principal. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
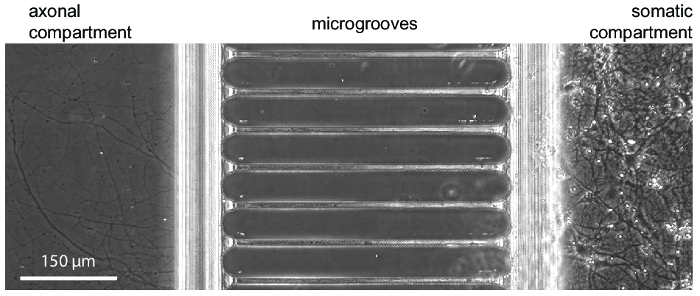
Figure 3 : Une micrographie de contraste de phase montrant la croissance neuronale typique au sein de la puce à 24 jours en culture. Neurones embryonnaires de l’hippocampe ont été ensemencées dans le compartiment de droite somatique. Croissance de l’axone est visible dans le compartiment axonal en commençant à 5-7 jours. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Rétrograde des neurones marqués express mCherry protéine fluorescente et étendre des axones dans un compartiment isolé assistés axonal. (A) une micrographie de fluorescence fusionnée montrant vivants neurones marqués rétrogrades infectés par un virus de la rage mCherry mis à jour le brièvement appliqué au compartiment axonal. Les neurones étaient imagés 3 jours après l’infection à 21 jours de culture. Créant un microenvironnement isolé dans le compartiment de l’axone est démontrée par l’application d’une teinture de faible poids moléculaire, hydrazide maléique Alexa Fluor 488. (B) une image fusionnée de (A) y compris une image de (DIC) de contraste interférentiel différentiel afin de visualiser la région micro-rainures de la puce. Les images ont été acquises avec laser scanning microscope confocal à l’aide d’une huile de silicone 30 × / 1,05 N.A. (ne = 1,406) porte-objectif. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Comparaison de side-by-side de croissance neuronale dans les compartiments périphériques PDMS et de copeaux de plastique. (A) Phase micrographies de contraste des deux plateformes prises à 3, 7, 15 et 22 jours de culture. Au fond, une région de grossissement plus élevée, prise à partir des images à 22 jours est incluse pour illustrer la croissance axonale à cet âge dans les deux plates-formes. Axones au sein de la puce sont plus continues et apparaissent plus sains que dans le dispositif PDMS à cet âge. (B) une micrographie d’immunofluorescence inverti de β-tubuline III colorées des axones dans le compartiment axonal du dispositif de PDMS et puce en plastique à 22 jours de culture. Les images ont été acquises avec un tourne disque confocal système d’imagerie utilisant un 20 x / 0,45 N.A. porte-objectif. Toutes les barres d’échelle sont 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Axotomie et la régénération des neurones de l’hippocampe au sein de la puce de compartiments en plastique. (En haut) Les neurones étaient rétrogrades étiquetés à l’aide d’un virus de la rage mis à jour le mCherry et ensuite photographié avant axotomie à 24 jours de culture. Des images ont été pseudocolored à l’aide de la table de correspondance de couleur « Feu ». (En bas) Même neurone photographié sur le panneau supérieur a été imagé 24h post-axotomie. Les lignes pointillées blanches montrent les bords de la barrière de microsillons. Axotomie a eu lieu à l’emplacement de la ligne pointillée gauche. La pointe de flèche blanche indique une ampoule de rétraction. La flèche blanche indique une régénération axonale. Les images ont été acquises avec un rotation disque d’imagerie système confocal à l’aide d’une lentille d’objectif 20 × / 0,45 N.A.. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
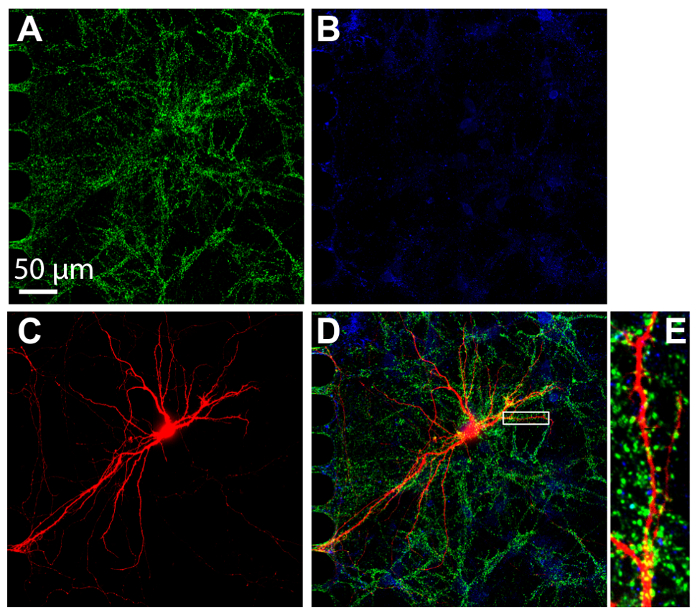
Figure 7 : Forme entre neurones hippocampal cultivés dans des copeaux de compartiments en plastique de synapses. Immunomarquage a été effectué à 24 jours de culture et imagé dans le compartiment somatique à l’aide d’une lentille de 60 × silicone huile d’immersion. Neurones expriment (A) le marqueur de la synapse excitatrice, vGlut1 (vert) et (B) le marqueur de la synapse inhibitrice, vGAT (bleu). (C) rétrograde étiqueté mCherry neurones (en rouge) ont été infectés par le virus de la rage mis à jour l’appliqué au compartiment axonal. (D) une micrographie de fluorescence fusionnée de vGlut1, vGat et mCherry. (E) la région agrandie en (ré) indiquée avec une boîte blanche présente des épines dendritiques, les sites qui reçoivent des entrées synaptiques d’autres neurones. Les images ont été acquises avec un rotation disque d’imagerie système confocal à l’aide d’une huile de silicone 60 × / 1.3 N.A. (ne = 1,406) porte-objectif. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Copeaux de compartiments en plastique | Compartiments périphériques PDMS |
| isoler les axones | isoler les axones |
| établir des micro-environnements | établir des micro-environnements |
| neurones axotomize | neurones axotomize |
| optiquement transparent | optiquement transparent |
| compatible avec l’imagerie à haute résolution | compatible avec l’imagerie à haute résolution |
| compatible avec la microscopie en fluorescence | compatible avec la microscopie en fluorescence |
| entièrement assemblé | Assemblée de substrat nécessaire |
| les axones sains > 21 jours | les axones sains > 14 jours |
| surface de culture hydrophile | hydrophobe |
| imperméable de gaz | gaz perméable |
| micro-rainures arrondie et canaux | micro-rainures droites |
| moins d’étapes préparation | haut est amovible pour la coloration dans les micro-rainures |
| non compatible avec ablation laser | absorption de petites molécules et des solvants organiques |
| non compatible avec les huiles à base d’huile minérale d’immersion (huiles silicones sont très bien) |
Tableau 1 : Comparaison de plastique et de plates-formes compartiments PDMS pour la culture des neurones.
Discussion
Copeaux de compartiments en plastique offrent une option facile à utiliser pour compartimenter les neurones, fournissant des cultures de neurones à long terme (> 3 semaines). Ce protocole détaille comment la culture de neurones murins corticales et hippocampe au sein de ces puces. La création des micro-environnements solubles et comment rétrograde des neurones de l’étiquette, axotomie et effectuer l’immunocytochimie ont également été examinées. Ce qui est important, ces puces sont compatibles avec haute résolution, fluorescence et l’imagerie live.
Copeaux de compartiments en plastique offrent bon nombre des mêmes fonctions que les dispositifs à base de PDMS compartimenté, mais ont des avantages, inconvénients et certains traits distinctifs. Le tableau 1 fournit une comparaison des fonctionnalités de puce en plastique et de dispositifs à base de PDMS. Tout d’abord, les puces sont pré-assemblés et faits définitivement hydrophiles, qui facilite le mouillage, ce qui les rend plus faciles à utiliser. Le plastique n’est pas gaz perméable, à la différence de PDMS, donc si des bulles forment inopinément dans les canaux, ils n’échappent pas facilement et doivent être enlevés. Une solution de revêtement pré contenant principalement l’éthanol et certains autres agents exclusifs élimine la formation de bulles.
Imagerie des projections suivante transduction de protéines fluorescentes a été réalisée dans les puces (Figure 4) en direct et il n’y avait aucun autofluorescence détectable du plastique. Une mise en garde est que les huiles d’immersion avec la puce pour objectifs d’ouverture numérique élevée doivent être base d’huile de silicone et pas base d’huile minérale. L’huile minérale peut provoquer un effet indésirable avec le copolymère d’oléfine cyclique. Pour l’imagerie du fond clair, il est important de noter que les micro-rainures dans la puce sont arrondies aux extrémités et il y a un effilé graduelle de l’axe z des principaux canaux vers la barrière de microsillons, causant une réfraction de lumière à chaque extrémité de la micro-rainures pendant fond clair d’imagerie (Figure 3). Parce que la puce est prémontée, pénétration d’anticorps dans les micro-rainures taille micron peut être inégale (comme pour les dispositifs à base de PDMS en permanence sous douane) ; ainsi, l’analyse quantitative suite immunostaining doit être effectuée dans les canaux/compartiments. Immunostaining des projections neuronales dans les micro-rainures peut être amélioré en créant une différence de volume entre les compartiments pour faciliter l’écoulement des anticorps et des fluorophores dans les micro-rainures.
Déclarations de divulgation
.T. est l’inventeur de la chambre/puce microfluidique (US 7419822 B2) et est membre de Xona Microfluidics, LLC. V.P. est un employé de Xona Microfluidics, LLC. J.H. est membre de Xona Microfluidics, LLC. T.N. déclare sans intérêts financiers concurrents. Publication de libre accès de cet article est sponsorisée par Xona Microfluidics.
Remerciements
Les auteurs reconnaissent une assistance technique ou éditoriale de Taylor Wilt (Xona), Smita Paranjape (UNC-Chapel Hill), Joyce Ciechanowski (Xona) et Brad Taylor (Xona). Les auteurs reconnaissent le soutien de Xona Microfluidics, LLC et le National Institute of Mental Health (R42 MH097377). Imagerie a été partiellement soutenue par le Confocal et Multiphoton Imaging Core Facility de NINDS Center Grant P30 NS045892 et NICHD Center Grant (U54 HD079124). Le contenu est la seule responsabilité des auteurs et ne représente pas nécessairement l’opinion officielle de la National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
Références
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes? Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. Culturing Nerve Cells. , Second edition, MIT Press. (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon