Method Article
Métabolisme de cartographie : Surveiller l’activité de la Lactate déshydrogénase directement dans le tissu
Dans cet article
Résumé
Les auteurs décrivent un protocole pour cartographier la distribution spatiale de l’activité enzymatique d’une enzyme qui génèrent nicotinatmide adénine dinucléotide phosphate (NAD(P)H) + H + directement dans les échantillons de tissus.
Résumé
Cartographie de l’activité enzymatique dans le temps et l’espace est essentiel pour comprendre les bases moléculaires du comportement de cellules dans les tissus normaux et la maladie. Essais in situ de l’activité métabolique peuvent fournir des informations sur la distribution spatiale de l’activité métabolique dans un mouchoir en papier. Ici, nous fournissons un protocole détaillé pour surveiller l’activité de l’enzyme lactate déshydrogénase directement dans les échantillons de tissus. Déshydrogénase de lactate est un déterminant important de la question de savoir si glucose consommé sera converti en énergie par la glycolyse aérobie ou anaérobie. Une solution contenant du lactate et NAD est fournie pour une section de tissus congelés. Cellules avec haute lactate déshydrogénases convertira le lactate fourni en pyruvate, tandis que simultanément conversion fourni nicotinamide adénine dinucléotide (NAD) à NADH et un proton, qui peut être détecté, basée sur la réduction des nitrotetrazolium bleu en formazan, qui est visualisé comme un précipité bleu. Les auteurs décrivent un protocole détaillé pour surveiller l’activité de la lactate déshydrogénase dans la peau de souris. Application de ce protocole, nous avons constaté que l’activité de la lactate déshydrogénase est riche en cellules souches quiescentes follicule pileux dans la peau. Elle applique le protocole aux cellules souches embryonnaires de souris cultivées ont révélé une coloration plus élevée dans les cellules souches embryonnaires cultivées que les fibroblastes embryonnaires de souris. Analyse d’aorte fraîchement isolés de souris a révélé une coloration dans les cellules musculaires lisses perpendiculaire à l’aorte. La méthodologie fournie peut être utilisée pour mapper spatialement l’activité des enzymes qui génèrent un proton dans le tissu congelé ou fraîche.
Introduction
Comprendre les emplacements au sein des tissus dans lesquels enzymes ont une activité élevée ou faible est indispensable pour la physiologie et le développement de la compréhension. Niveaux de transcription ou de la protéine sont souvent utilisés comme substituts à l’activité enzymatique. Alors que ces études peuvent être informatifs, ils ne fournissent pas d’informations qui peuvent être essentielles pour la détermination de l’activité de l’enzyme, comme les modifications post-traductionnelles, la présence de complexes protéiques, ou la localisation subcellulaire de l’enzyme. Lorsque l’activité enzymatique est mesurée directement, il est souvent contrôlé dans les lysats de protéines homogénéisé qui n’est plus contiennent des informations sur des cellules individuelles dans le mélange ou la distribution spatiale des cellules ayant une activité au sein d’un tissu haute ou basse.
Ici, nous fournissons un protocole détaillé pour cartographier la distribution spatiale de l’activité enzymatique dans un échantillon de tissu. La méthodologie est basée sur des études antérieures montrant que les sels de tétrazolium peuvent être utilisés pour localiser l’activité des déshydrogénases, réductases et oxydases en tissus congelés1. Avec ces méthodes, un formazan insolubles dans l’eau se forme lorsque les protons sont transférés à un tétrazolium sel2,3. Glucose-6-phosphate déshydrogénase génère NADPH et un proton et a été détecté avec activité de tétrazolium. Glucose-6-phosphate déshydrogénase a été contrôlé dans les hépatocytes flet européen4, dans les poumons de5 des cellules alvéolaires de type 2 et les néphrons du rein5. Sels de tétrazolium ont également été utilisés pour surveiller l’activité de la transcétolase en tissus congelés6. Une approche similaire a été récemment utilisée pour surveiller l’activité des déshydrogénases multiples dans le même tissu sur diapositives adjacentes7.
Nous décrivons ici une méthode pour utiliser les sels de tétrazolium pour surveiller la distribution spatiale de l’activité de la lactate déshydrogénase (Figure 1). Lactate déshydrogénase peut convertir pyruvate généré par la glycolyse de lactate et la réaction inverse. Activité de la lactate déshydrogénase est par conséquent un facteur déterminant de l’entrée du pyruvate dans le cycle des acides tricarboxyliques contre sa sécrétion comme le lactate. Les taux de lactate dans le sang sont souvent utilisés pour diagnostiquer un éventail de maladies, y compris le cancer8,9,10, car il peut indiquer que la maladie ou blessure a des cellules endommagées et l’enzyme a été libéré.
Il existe quatre gènes de lactate déshydrogénase : LDHA, LDHB, LDHC et LDHD11. LDHA et LDHB seraient apparus de duplication d’un début de gène LDHA12. LDH est active comme un tétramère et LDHA et LDHB peuvent former des HOMOTETRAMERES et heterotetramers entre eux. LDHA est rapporté avoir une affinité plus élevée pour le pyruvate, tandis que LDHB est rapporté pour avoir une affinité plus élevée pour le lactate et préférentiellement convertir lactate et pyruvate13. Le promoteur LDHA contient des sites de liaison pour la transcription facteurs HIF1α, cMYC et FOXM111. En outre, comme de nombreuses autres enzymes glycolytiques14,15, LDH peut être modifié par des modifications post-traductionnelles. Récepteur de facteur de croissance fibroblastique 1 peut phosphoryler LDHA à Y10, qui favorise la formation de tétramère, ou Y83, qui favorise la NADH substrat liaison16. LDHA peut également être acétylées17. Pour ces raisons, une compréhension complète de l’activité LDH exige une surveillance non seulement le taux de protéines LDH, mais aussi bien l’activité de l’enzyme.
Outre la méthode que nous présentons ici, les autres approches ont été utilisées pour surveiller l’activité de la lactate déshydrogénase. Activité de la lactate déshydrogénase peut être surveillée par spectrophotométrie en protéines homogénéisé lysat. La génération du NADH lactate est convertie en pyruvate peut être mesurée selon l’absorbance à 340 nm, tandis que la disparition du NADH peut être surveillée comme le pyruvate est converti en lactate18. Activité de la lactate déshydrogénase a également été suivie avec l’imagerie par résonance magnétique (IRM). 13 C-pyruvate peut être administré et la conversion du pyruvate de lactate peut être surveillée comme le ratio de [1 -13C] lactate / [1 -13C] pyruvate. Élevé des ratios de [1 -13C] lactate / [1 -13C] pyruvate ont été observés dans le cancer des tissus19. Alors que les approches axées sur le MRI peuvent fournir des informations sur l’activité de la lactate déshydrogénase dans des conditions normales et les tissus de la maladie, les méthodes n’ont pas la résolution nécessaire pour déterminer le niveau d’activité dans certaines cellules. La méthodologie proposée ici peut fournir des informations sur l’activité de la lactate déshydrogénase dans les zones de tissus et même dans des cellules individuelles.
À l’aide de tests d’activité sur place , nous avons constaté que l’activité de la lactate déshydrogénase est élevée dans les cellules souches de souris peau20le follicule pileux. Nous avons également utilisé la méthode pour surveiller l’activité de la lactate déshydrogénase dans les cellules souches embryonnaires cultivées et trouvé que l’activité est plus élevée dans les cellules souches que la couche de conducteur. Enfin, surveiller l’activité de la lactate déshydrogénase dans les aortes de souris fraîche et observé une coloration dans les cellules musculaires lisses. Nous décrivons ici un protocole détaillé pour surveiller l’activité de la lactate déshydrogénase dans la peau de souris congelées.
Protocole
Toutes les expériences décrites ont été approuvées par le Comité de protection de l’Animal à l’Université de Californie à Los Angeles.
1. générer des diapositives de peau de souris congelées
- Euthanasier souris conformément à la politique de l’institution.
Remarque : Suivez la politique institutionnelle pour vêtements de protection. Tous les protocoles impliquant des animaux doivent être approuvés par le Comité institutionnel de protection Animal. - Enlever les poils de la souris avec une tondeuse de poils.
- Faire des incisions dans la peau à l’aide de ciseaux. À l’aide de pince, soulever la peau de la souris. À l’aide de ciseaux, coupez la section de la peau.
- Remplir le cryomold avec gel réactif composé (voir Table des matières).
- Place les sections de peau en cryomolds rempli à l’aide de pinces à bec. Orienter la peau des tranches de tissu vont générer une coupe transversale de la peau de l’épiderme au derme, hypoderme et musculaire (Figure 2).
Remarque : si possible, montage expérimental et contrôle de la souris ensemble dans la même cryomold afin qu’ils puissent être sectionnés sur la même lame et traitées ensemble. Prendre soin de ne pas pour créer de bulles. - Placer des cryomold sur la surface plane d’un bloc de glace carbonique dans un bac à glaçons et laisser geler. Continuer à observer l’orientation de la peau. Ajuster si nécessaire.
Remarque : Porter des gants cryogéniques lors de la manipulation de glace sèche. - Transfert cryomolds dans un congélateur-80 ° C pour le stockage. Les échantillons peuvent être maintenues dans le congélateur pendant environ 3 mois, sans perte significative de l’activité enzymatique. Ne laissez pas les coupes congelées de sécher.
- À l’aide d’un cryostat à-20 ° C, tranche de tissu pour créer des sections 7-10 µm d’épaisseur pour la meilleure peau morphologie21.
2. préparation des diapositives pour la coloration
- Mettre en place l’ensemble des diapositives à tester. Inclure une diapositive de contrôle sur lesquels NAD sera retenu et contrôle une autre diapositive sur laquelle le substrat, le lactate, seront retenus. Comprend une lame de contrôle positif d’un bloc de tissus congelés précédemment étudié.
- Brièvement Difficulté diapositives contenant des sections de la peau avec 4 % de formol pendant 5 min par pipetage 1 mL de 4 % de formol dans la diapositive, ou lors du traitement de plusieurs diapositives, en trempant les diapositives dans un récipient contenant 4 % de formol.
Remarque : La fixation assurera que la peau ne pas décoller de la glisse pendant les suivantes procédures et préserver la morphologie de la peau.
ATTENTION : Formol est un agent cancérigène et dangereux ; porter des gants, ne le laissez pas toucher votre peau et effectuez cette étape sous une hotte chimique. - Lavez-les diapositives au moins 1 phosphate mL tampon saline, pH 7,4, par glissière soit par la pipette ou trempage.
3. préparer la Solution de coloration
- Réactifs ensemble vortex pour l’activité de la lactate déshydrogénase coloration (50 mM Tris pH 7,4, 750 µM NADP, 80 µM phénazine méthosulfate (PMS), chlorure de nitrotetrazolium bleu 600 µM et 30 mM de lactate) dans un tube de taille appropriée selon la quantité de coloration solution nécessaire.
Note : 1 mL est suffisante pour recouvrir entièrement une diapositive. - Préparer une deuxième solution où tous les réactifs sont présents sauf NAD. Préparer une solution de troisième dans lequel tous les réactifs sont présents sauf lactate.
4. Incuber les lames dans la Solution de coloration
- Pipette de doucement la solution colorante ou des solutions de contrôle sur les lames préparées couvrant l’article dans son intégralité (1 mL est suffisant pour une diapositive). Si plusieurs diapositives sont traités ensemble, tremper toutes les diapositives dans la solution colorante en même temps (Assurez-vous que le conteneur a suffisamment de solution pour recouvrir entièrement la section de tissu).
- Incuber les lames dans un environnement humidifié à 37 ° C dans l’obscurité. Si la solution de coloration est sur le dessus de la lame, placez la dans un environnement humidifié pour éviter l’évaporation.
5. surveiller les diapositives
- Surveiller la conversion de la solution colorante du clair au bleu par inspection visuelle. Lorsque les échantillons ont atteint le niveau souhaité de bleu, arrêter la réaction en enlevant la solution colorante.
Remarque : Pour les peaux, 10 min est suffisant. Le temps dépendra de l’orgue et l’activité enzymatique. - Rincer les lames avec une solution saline tamponnée au phosphate de pipetage (1 mL est suffisant pour chaque diapositive) ou trempage.
Remarque : Tous les échantillons qui seront comparés les uns aux autres doivent être maintenues dans la solution colorante pour le même laps de temps.
6. contre-coloration et monter
- Pipette contre-colorant sur les diapositives lorsque les diapositives ont atteint un niveau approprié de bleu.
Remarque : Les colorants qui transforment les noyaux rouges ou verts fournira bon contraste avec le bleu, créé par le formazan precipitant. - Monter avec des solutions aqueuses ou montage moyenne22non aqueux. Il suffit d’une à trois baisses (40-50 µL) du milieu de montage selon la taille de la lamelle couvre-objet.
7. l’image diapositives et quantifier
- Image glisse sous un microscope optique. Prendre des photographies d’expérimentales et des échantillons de contrôle et tous les contrôles négatifs à 10 X, 20 X et 40 X grossissement.
- Déterminer l’intensité des taches bleues dans différentes régions avec analyse d’images.
Résultats
Nous avons déjà rapporté les résultats des tests d’activité sur place dans la peau de souris20. Comme illustré à la Figure 3, nous avons observé des niveaux élevés d’activité de la lactate déshydrogénase dans les cellules souches du follicule pileux à la base du follicule pileux lorsque les procédures décrites ci-dessus ont été suivies. Ces conclusions ont été corroborées par cellule à fluorescence activé tri de peau pour les cellules souches follicule pileux et confirmant l’activité lacticodéshydrogénase élevée dans le compartiment des cellules souches avec des tests d’activité sur les cellules triées.
D’après nos constatations que les cellules souches du follicule pileux ont élevé lactate déshydrogénases, nous avons étendu nos études sur les cellules souches embryonnaires cultivées. Agissant comme une couche de conducteur de fibroblastes embryonnaires de souris ont été analysés, seul ou en présence de cellules souches embryonnaires. Pour analyser les cellules cultivées, le milieu a été aspiré, et les cellules ont été brièvement fixe et incubées en présence de lactate déshydrogénase, solution de coloration comme décrit ci-dessus. Nous avons observé l’activité lacticodéshydrogénase élevée dans les cellules souches embryonnaires par rapport à la souris fibroblastes embryonnaires (Figure 4).
Nous avons également appliqué le protocole de coloration des tissus fraîchement isolées. Les aortes de souris ont été disséqués et éventrés. Les navires ont été ouverts et immobilisés afin que l’intérieur lumière des aortes était accessible. Des échantillons ont été incubés avec Hank Solution saline équilibrée contenant 0,5 % Triton-X pendant 10 min, puis avec le lactate déshydrogénase coloration solution pour 10 min. Lactate déshydrogénase coloration solution a été appliquée sur le tissu frais. Après incubation, les images ont été recueillies, présentant une coloration dans les cellules musculaires lisses (Figure 5).
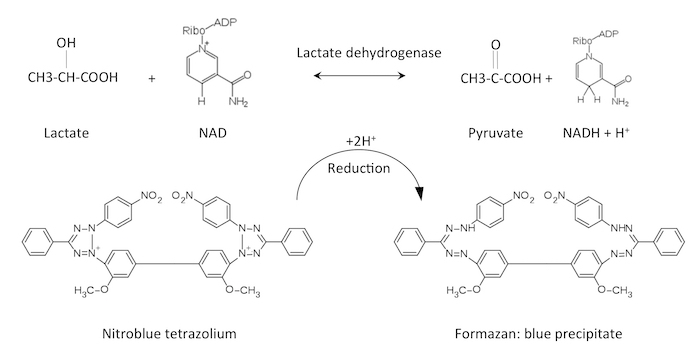
Figure 1 : Activité chimique du lactate déshydrogénase et sa détection. Lactate déshydrogénase convertit lactate + NAD pyruvate + NADH + H+. Le proton est généré réduira le nitrobleu de tétrazolium en formazan, qui se forme un précipité bleu. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Schématique d’orienter la peau de souris en cryomolds. Peau de la souris doit être orientée dans cryomolds afin que chaque section coupée contiendra une section transversale de la peau entière de l’épiderme, derme, hypoderme et le muscle. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Lactate déshydrogénase de coloration de la peau de souris révèle une activité élevée dans les cellules souches follicule pileux. La peau de souris a été gelée dans cryomolds et incubée avec lactate déshydrogénase coloration solution contenant du lactate. Activité de la lactate déshydrogénase était importante dans les cellules souches follicule pileux. (A, B) Deux images d’analyse d’activité de lactate déshydrogénase de peau de souris. (C, D) Deux images du contrôle de coloration avec le substrat lactate retenu. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Activité lacticodéshydrogénase élevée dans les cellules souches embryonnaires de souris cultivées. Cultivé sur une couche de conducteur de fibroblastes embryonnaires de souris irradiées de cellules souches embryonnaires de souris cultivées ont été analysés pour l’activité de la lactate déshydrogénase. Forte activité a été observée dans les cellules souches contre les fibroblastes. Fibroblastes embryonnaires de souris ont montré des niveaux similaires de coloration avec ou sans irradiation. Des images ont été prises avec un objectif 20 X. Echelle = 50 µm. (A, B, D, E) fibroblastes embryonnaires de souris et les cellules souches. (C, F) Fibroblastes embryonnaires de souris seules. (A-C) Des images ont été prises après 7 minutes d’incubation avec la solution de coloration. (D-F) Des images ont été prises après 20 minutes d’incubation avec la solution de coloration. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Activité lacticodéshydrogénase élevée dans les cellules musculaires lisses entourant l’aorte souris. Les aortes ont été isolés de souris euthanasiés. Navires ont été fixés pendant 2 minutes en 2 % paraformaldéhyde et lavés 3 x 10 minutes saline tamponnée au phosphate x 1. Navires ont été incubées avec la solution saline équilibrée de Hank avec 0,5 % Triton-X et lavés 3 x 5 minutes dans une solution saline tamponnée au phosphate. Lactate déshydrogénase, solution de coloration a été ajouté et les échantillons ont été incubés pendant 10 min à 37° C et lavé 3 x 5 min avec une solution saline tamponnée au phosphate de 1 x. Échantillons ont été fixés ensuite pendant 1 heure à 2 % de paraformaldéhyde, lavé 3 x 5 min avec 1 x solution saline tamponnée au phosphate et imagé. (A) solution de Lactate déshydrogénase contenant du lactate. (B) solution de Lactate déshydrogénase sans lactate comme témoin négatif. Pour chaque section, il y a une image de grossissement plus bas sur la gauche et une zone désignée est montrée avec un grossissement supérieur à droite. (A, B) Solution complète lactate déshydrogénase contenant du lactate a été utilisée pour la coloration. B est qu'une image agrandie de la zone indiquée en solution de Lactate déshydrogénase A. (C, D) image sans lactate a été utilisée pour la coloration comme témoin négatif. D est une image agrandie du secteur indiqué dans C. A et C ont été prises avec 20 objectifs X (barre d’échelle = 50 µm) et B et D ont été prises avec un objectif X 40 (barre d’échelle = 20 µm). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La méthode décrite ici peut être utilisée pour surveiller l’activité de la lactate déshydrogénase ou d’autres enzymes métaboliques qui génèrent le NADH ou le NADPH, dans différents types de cellules dans un tissu ou dans les différentes parties d’un tissu au fil du temps. Lactate déshydrogénase est une enzyme importante pour comprendre la biologie des cellules souches et de tumeurs, et la possibilité de surveiller l’activité de la lactate déshydrogénase dans des cellules individuelles est susceptible de fournir des renseignements importants sur la fonction de cette enzyme.
Un avantage important du présent protocole par rapport aux autres méthodes est que la capacité de surveiller l’activité enzymatique, plutôt que juste l’abondance protéique, peut se traduire par des informations plus concluantes sur non seulement où les lactate déshydrogénases sont présent, mais où ils sont réellement fonctionnels. L’approche décrite ici est cumulable avec l’immunohistochimie, afin que le niveau d’une protéine sélectionnée, par exemple, un marqueur de lignée de cellules, est déterminé dans les mêmes échantillons de tissu comme activité de la lactate déshydrogénase. Par rapport aux approches axées sur le MRI pour surveiller l’activité de la lactate déshydrogénase, protocole prévu a l’avantage qu’il peut offrir une plus grande résolution spatiale et aident à déterminer les cellules spécifiques dans un tissu qui ont une activité enzymatique élevée . Par rapport aux approches au métabolisme de cartographie basée sur des substrats fluorogéniques, détection de signal avec le protocole décrit n’est pas limitée par autofluorescence1. Miller et co-auteurs effectué une analyse similaire de la dépendance temporelle et la dépendance de substrat de cinq différentes enzymes en surveillant la conversion en formazan7. Les réactions ont été découverts à suivre des principes stoechiométriques de cinétique enzymatique. Miller et autres auteurs éminents enzymes mitochondriales des enzymes mitochondriales-non de co-localisation avec coloration mitochondrial7. Ils utilisé le chlorure de 5-Cyano-2,3-di-(p-tolyl)tetrazolium (CCT) comme un réactif de détection suivi par microscopie confocale pour la localisation sous-cellulaire co analyse7.
La méthode décrite a des inconvénients aussi bien. Tandis que l’IRM basée sur des approches peuvent être utilisées dans les organismes vivants, l’approche décrite nécessite des tissus congelés ou frais. Des tissus congelés conviennent seulement pour quelques mois parce que l’activité des enzymes se dégrader au fil du temps, même lorsque congelés. En outre, parce que le substrat est fourni en excès, l’approche fournit des informations sur « potentiel d’activité » en supposant que le substrat est présent. Si les concentrations du substrat sont limitatives, la répartition de l’activité observée avec ce dosage peut s’écarter de la quantité d’activité qui se produit physiologiquement. En outre, s’il y a différentes isoformes de la même enzyme qui effectuent la même activité enzymatique, la méthode présentée ici n’est pas en mesure de distinguer entre eux. Par exemple, la méthode présentée ne peut pas faire la distinction entre l’activité de LDHA versus LDHB. Une approche à l’adresse que ce problème serait d’utiliser génétiquement machiné souris dans lequel une seule enzyme isoforme est génétiquement inactivée.
Nous avons expérimenté avec PMS, un transporteur d’électrons photochimiquement stable qui intervient dans le transfert d’électrons entre NADH et tétrazolium colorants23. Alors que certains scientifiques ont rapporté que le PMS inhibe l’activité de glucose 6-phosphate déshydrogénase et qu’il trouve inutile PMS5, nous avons trouvé le PMS être précieux pour la localisation de l’enzyme et l’inclure dans notre protocole. Certains autres auteurs ont rapporté à l’aide d’alcool polyvinylique pour limiter la diffusion du glucose 6-phosphate déshydrogénase enzyme1. Dans nos expériences, nous n’avons pas trouvé l’alcool polyvinylique d’être utile et éliminé il.
Quelques étapes sont cruciales pour le succès de la coloration. Une question importante est de s’assurer que les échantillons de tissus sont placés correctement dans le cyromolds. Sections de peau convient plat afin que les tranches coupées à travers la peau. En outre, si plusieurs sections doivent être préparées, il est idéal si elles sont intégrées au sein de la cryomold même si elles peuvent être tranchés ensemble sur la même lame. Cela aidera à éliminer les variations induites par l’épaisseur de la lame qui est coupée avec du cryostat. Il est également important de s’assurer que le tissu qui a conservé une activité enzymatique.
Le meilleur moment pour mettre fin à la réaction doit être déterminé empiriquement. Il est nécessaire de suivre de près les diapositives au cours de la période d’incubation et de déterminer le moment opportun pour ajouter contre-colorant et monter les diapositives basées sur l’intensité de la coloration bleue. Si les échantillons sont trop légèrement teintés, il ne sera pas possible de déterminer si l’activité est. Si les échantillons sont overstained, le précipité de formazan peut se propager, rendant difficile de déterminer les domaines spécifiques qui étaient initialement riches en activité.
Nous prévoyons que ce protocole sera précieux pour les scientifiques avec un large éventail de questions sur le rôle du métabolisme. Les applications incluent des coloration pour l’activité métabolique et de marqueurs de lignée de cellules ou de marqueurs de prolifération, évaluer les contributions des différentes enzymes avec des modèles génétiques, évaluer la localisation subcellulaire de l’activité enzymatique, surveillance activité enzymatique dans les tissus malades ou au cours du développement.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt concurrentes de divulguer.
Remerciements
HAC était le savant Milton E. Cassel de la Rita Allen Foundation (http://www.ritaallenfoundation.org). Ce travail a été financé par des dons au HAC de National Institute de R01 de Sciences médicales générales GM081686, R01 AR070245, National Institute of (médecine générale) Sciences R01 GM0866465, l’Eli, Edythe large Centre de médecine régénérative & Stem Cell Research Collines de rose et Hal Gaba awards), Health Center/UCLA ILEC NIH Grant UL1TR000124, la leucémie Lymphoma Society, Impact l’Iris Cantor féminines octroie de la Jonsson Comprehensive Cancer Center à WEL et HAC. Recherche rapporté dans cette publication a été financée par le National Cancer Institute de la National Institutes of Health, sous attribution numéro P50CA092131. Les bailleurs de fonds n’avaient aucun rôle dans la conception de l’étude, la collecte de données et analyse, décision de publier ou préparation du manuscrit. HAC est membre de l’Eli & Edythe large Centre de médecine régénérative & Stem Cell Research, l’Institut de biologie moléculaire de UCLA et le programme interministériel de bioinformatique de UCLA.
matériels
| Name | Company | Catalog Number | Comments |
| Surgical instruments | For collecting skin from euthanized mice | ||
| Tissue-tek cryomold 25 mm x 20 mm x 5 mm | Fisher Scientific | NC9511236 | For freezing mouse skin |
| Tissue-Tek O.C.T. compound | Fisher Scientific | NC9638938 | For mounting cryomolds |
| Ice bucket | Fisher Scientific | 07-210-106 | |
| Dry Ice | |||
| Polysine Adhesion Slide | Fisher Scientific | 12-545-78 | |
| 4% formalin | Fisher Scientific | 23-245-684 | Dilluted in water |
| phosphate buffered saline, pH 7.4 | |||
| vortex | |||
| Tris base | Fisher Scientific | 23-245-684 | |
| NAD | Sigma-Aldrich | N7004 | |
| Phenazine methosulfate | Sigma-Aldrich | P9625 | |
| Nitrotetrazolium blue chloride | Sigma-Aldrich | N6876 | |
| Lithium L-lactate | Sigma-Aldrich | L2250 | Substrate |
| 37°C incubator (or tissue culture incubator) | |||
| Braziliant! Counter stain | Anatech | 861 | Counter stain |
| Mounting medium | Vector Laboratories | H-5000 | |
| Cover slips for slides | Fisher Scientific | 12-544D | |
| Light microscope |
Références
- Boonacker, E., Van Noorden, C. J. Enzyme cytochemical techniques for metabolic mapping in living cells, with special reference to proteolysis. J Histochem Cytochem. 49, 1473-1486 (2001).
- Seidler, E. The tetrazolium-formazan system: Design and histochemistry. Prog Histochem Cytochem. 24, 1-86 (1991).
- Van Noorden, C. J. F., Frederiks, W. M. Enzyme Histochemistry: A Laboratory Manual of Current Methods. , Bios. (1992).
- Winzer, K., Van Noorden, C. J., Kohler, A. Quantitative cytochemical analysis of glucose-6-phosphate dehydrogenase activity in living isolated hepatocytes of European flounder for rapid analysis of xenobiotic effects. J Histochem Cytochem. 49, 1025-1032 (2001).
- Negi, D. S., Stephens, R. J. An improved method for the histochemical localization of glucose-6-phoshate dehydrogenase in animal and plant tissues. J Histochem Cytochem. 25, 149-154 (1977).
- Boren, J., et al. In situ localization of transketolase activity in epithelial cells of different rat tissues and subcellularly in liver parenchymal cells. J Histochem Cytochem. 54, 191-199 (2006).
- Miller, A., et al. Exploring metabolic configurations of single cells within complex tissue microenvironments. Cell Metab. , (2017).
- Shen, J., et al. Prognostic value of serum lactate dehydrogenase in renal cell carcinoma: a systematic review and meta-analysis. PLoS One. 11, e0166482(2016).
- Zhang, X., et al. Prognostic significance of serum LDH in small cell lung cancer: A systematic review with meta-analysis. Cancer Biomark. 16, 415-423 (2016).
- Petrelli, F., et al. Prognostic role of lactate dehydrogenase in solid tumors: a systematic review and meta-analysis of 76 studies. Acta Oncol. 54, 961-970 (2015).
- Valvona, C. J., Fillmore, H. L., Nunn, P. B., Pilkington, G. J. The regulation and function of lactate dehydrogenase A: Therapeutic potential in brain tumor. Brain Pathol. 26, 3-17 (2016).
- Markert, C. L., Shaklee, J. B., Whitt, G. S. Evolution of a gene: Multiple genes for LDH isozymes provide a model of the evolution of gene structure, function and regulation. Science. 189, 102-114 (1975).
- Read, J. A., Winter, V. J., Eszes, C. M., Sessions, R. B., Brady, R. L. Structural basis for altered activity of M- and H-isozyme forms of human lactate dehydrogenase. Proteins. 43, 175-185 (2001).
- Holness, M. J., Sugden, M. C. Regulation of pyruvate dehydrogenase complex activity by reversible phosphorylation. Biochem Soc Trans. 31, 1143-1151 (2003).
- Yi, W., et al. Phosphofructokinase 1 glycosylation regulates cell growth and metabolism. Science. 337, 975-980 (2012).
- Fan, J., et al. Tyrosine phosphorylation of lactate dehydrogenase A is important for NADH/NAD(+) redox homeostasis in cancer cells. Mol Cell Biol. 31, 4938-4950 (2011).
- Zhao, D., et al. Lysine-5 acetylation negatively regulates lactate dehydrogenase A and is decreased in pancreatic cancer. Cancer Cell. 23, 464-476 (2013).
- Vanderlinde, R. E. Measurement of total lactate dehydrogenase activity. Ann Clin Lab Sci. 15, 13-31 (1985).
- Nelson, S. J., et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-(1)(3)C]pyruvate. Sci Transl Med. 5, 198ra108(2013).
- Flores, A., et al. Lactate dehydrogenase activity drives hair follicle stem cell activation. Nat Cell Biol. , (2017).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. CSH Protoc. 2008, pdb prot4991 (2008).
- Espada, J., et al. Non-aqueous permanent mounting for immunofluorescence microscopy. Histochem Cell Biol. 123, 329-334 (2005).
- Hisada, R., Yagi, T. 1-Methoxy-5-methylphenazinium methyl sulfate. A photochemically stable electron mediator between NADH and various electron acceptors. J Biochem. 82, 1469-1473 (1977).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon