Method Article
Un modèle de souris d’une Obstruction intestinale partielle
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Occlusions intestinales sont une obstruction partielle ou complète de l’intestin qui peut causer des douleurs abdominales, nausées, vomissements et empêchant le passage des selles. Cette procédure de création intestinales partielles obsructions chez la souris est fiable en étudiant les mécanismes qui sous-tendent la croissance des cellules pathologiques et la mort dans l’intestin.
Résumé
Les occlusions intestinales, qui entravent ou bloquent le mouvement péristaltique, peuvent être causées par des adhérences abdominales et plus gastro-intestinal (GI) maladies, y compris des croissances tumorales. Cependant, transformant des mécanismes cellulaires impliqués dans et causés par, occlusions intestinales sont mal comprises. Plusieurs modèles animaux d’occlusions intestinales ont été développées, mais le modèle murin est la plupart du coût/temps efficace. Le modèle de souris utilise l’implantation chirurgicale d’une obstruction intestinale partielle (PO) qui a un taux de mortalité élevé si elle n’est pas réalisée correctement. En outre, souris recevant la chirurgie PO ne se développent pas hypertrophie si un blocus approprié est employé pas ou pas correctement placé. Nous décrivons ici un protocole détaillé pour la chirurgie de PO qui produit fiables et reproductibles des occlusions intestinales avec un taux de mortalité très faible. Ce protocole utilise un anneau de silicone placé chirurgicalement qui entoure l’iléon qui bloque partiellement les mouvements digestifs dans l’intestin grêle. L’obstruction partielle rend l’intestin deviennent dilatés en raison de l’arrêt du mouvement digestive. La dilatation de l’intestin induit hypertrophie de muscle lisse du côté oral de la bague qui progressivement se développe sur deux semaines jusqu'à ce qu’elle entraîne la mort. Le modèle de souris PO chirurgical offre un modèle in vivo de tissu intestinal hypertrophique utile pour étudier les changements pathologiques des cellules intestinales, y compris les cellules musculaires lisses (SMC), cellules interstitielles de Cajal (CIC), PDGFRα+et neuronale cellules lors du développement d’une occlusion intestinale.
Introduction
Occlusions intestinales sont un blocage partiel ou complet dans l’intestin de petite ou grande, qui empêche les aliments digérés, fluides et gaz de se déplacer à travers les intestins1. En raison de l’obstruction, l’obstruction provoque la paroi intestinale pour devenir épaissi, rétrécissement de la lumière2. Une occlusion intestinale peut se produire à la suite de chirurgies abdominales ou pelviennes qui provoquent la formation de tissu d’adhérences abdominales ou de troubles gastro-intestinaux tels que les maladies inflammatoires de l’intestin (maladie de Crohn), hernies, volvulus, diverticulite, sténose, invagination intestinale, constipation, fécalome, pseudo-occlusion, cancers et tumeurs3,4,5. Les occlusions intestinales dans ces cas entraînent souvent l’hypertrophie de la musculeuse de la tunique de l' intestin6.
PO de la lumière provoque une distension intestinale et augmente l’épaisseur de la couche de muscles lisses autour de l’obstruction en réponse à la nécessité de poursuivre le péristaltisme fonctionnelle7,8,9,10, 11,12,13. Modèles animaux de PO intestinale ont été développés pour étudier hypertrophie de muscle lisse au souris7rats10, cochons d’Inde11, chiens12et chats13 qui constamment se développent une hypertrophie similaire au sein de la couches de muscles intestinaux.
Un modèle murin de PO intestinale est la façon la plus rentable de générer et d’étudier les occlusions intestinales en vivo. Obstruction de l’intestin grêle est effectuées chez la souris à l’aide d’un anneau de silicone placé chirurgicalement entourant l’iléon. Les souris PO a montré une augmentation rapide du nombre de cellules (hyperplasie) et une augmentation dans l’épaisseur de la couche musculaire (hypertrophie) après chirurgie de PO8,15. SMC sont des cellules primaires en plastique qui sont développent dans les couches musculaires lisses en réponse à des conditions hypertrophique14, mais autres cellules comme ICC et cellules PDGFRα+ qui sont étroitement associées à la SMC, sont également remplis à nouveau. Nous avons déjà signalé que les souris PO développent une hypertrophie dans l’intestin grêle, dans laquelle SMC sont dédifférenciées en cellules PDGFRα+ qui sont hautement proliférante7,15,16. À l’inverse, ICC sont dégénéré et perdu au sein des couches de muscle lisse hypertrophié durant l’élaboration du obsruction intestinal,7. Un autre avantage majeur du modèle PO est sa capacité à induire des changements dans le système nerveux entérique et multiplication des patrons moteurs neurogènes. La multiplication majeur neurogène patron moteur dans l’intestin grêle de la souris est le complexe moteur migratoire (MMC), qui est neurogène et ne requiert pas de ICC ou ondes lentes électriques17. Le modèle PO peut donner un aperçu clair de comment les MMCs et nerfs entériques sont remodelés par une obstruction partielle.
Ici, nous vous proposons un protocole murin pour la chirurgie intestinale PO à l’aide d’un anneau de silicone. Souris recevant la chirurgie PO fiable produisent une hypertrophie de la musculeuse de la tunique de l’intestin grêle. Au sein du muscle hypertrophique, SMC, ICC, PDGFRα+et les cellules neuronales sont considérablement remodelées.
Protocole
Le protocole suivant a été approuvé par le Comité utiliser (IACUC) à l’Université du Nevada-Reno (UNR) des ressources animales et d’institutionnels animalier et est conforme à toutes les directives éthiques institutionnelles relatives à l’utilisation des animaux de recherche.
1. les animaux.
- Obtenir des souris C57BL/6 de maturité (4-6 semaines) pesant entre 20-30 g. maison de la colonie de souris de laboratoire dans une animalerie centralisée à ressources animales de l’UNR.
2 chirurgie de l’Obstruction partielle
NOTE : Les chirurgies sont effectuées dans une salle dédiée aux interventions chirurgicales. Tous les instruments chirurgicaux sont stérilisés à l’autoclave avant la chirurgie. Gants et blouses stériles doivent être portées par tout le personnel dans la salle de chirurgie en permanence.
- Préparation pour la souris chirurgicale
- Vérifier le système de livraison anesthésique afin d’assurer l’approvisionnement en oxygène et isoflurane est suffisant pour la procédure. Allumez l’alimentation en oxygène. Allumez le débitmètre gaz et ajustez-la à 500-1000 mL/min. Place l’animal dans la chambre de l’induction et sceller la partie supérieure.
- Allumez le vaporisateur isoflurane à 5 % et surveiller l’animal jusqu'à ce qu’il devienne couché. Le système de livraison anesthésique Placez-vous dans le cône de nez.
- Vider la chambre d’induction des gaz résiduel avec l’oxygène, puis éteignez la ligne de chambre induction tout en gardant la ligne du cône de nez ouvert.
- Retirer l’animal de la chambre et placez-la pommade ophtalmique sur les yeux de l’animal.
- Placez le cône de nez sur un coussin chaud préchauffé lorsque le gaz continue de s’écouler.
- Changer le débit d’oxygène à 100-200 mL/min, avec 2-3 % isoflurane. Si l’animal commence à se déplacer, gentlyrestrain l’animal avec le cône de nez sur jusqu'à ce que complètement anesthésiés à nouveau.
- Surveiller la respiration et la réponse à la stimulation au cours de la procédure et ajustez le pourcentage d’isoflurane (2-5 %), selon vos besoins. Niveau anesthetization animal est surveillé par le manque de réflexe pincée orteil avant la chirurgie est pratiquée.
- Injecter par voie intrapéritonéale médecine de la douleur (buprénorphine, 1 µg/g de poids corporel) loin du lieu de l’incision.
- Appliquer lotion d’enlèvement de cheveux sur l’abdomen à l’aide d’un coton-tige. Laissez la se reposer lotion pendant 3-5 min sur la souris, puis enlever les poils à l’aide de tampons de gaze et de coton. Répétez cette étape jusqu'à ce que tous les cheveux a été retiré de l’abdomen de la souris.
- Nettoyer la peau avec de l’éthanol 70 % à l’aide de tampons de gaze et de coton. Appliquer la solution antiseptiques ou povidone-iode pour nettoyer l’abdomen.
- Chirurgie de l’obstruction partielle
- Drapez le site chirurgical en utilisant 25 x 50 cm papier stérile avec un 2,5 x 2,5 cm ouverture au milieu pour le domaine de la chirurgie. Fixez le drapé à l’animal en plaçant des bandes stériles aux limites de l’ouverture et la peau.
- Faire une incision abdominale de ~3.0 cm, longitudinalement à l’aide d’un scalpel de lame n15, veiller à ce que seule la peau est incisée et en évitant de couper dans la couche musculoperitoneal en ce moment.
- À l’aide de pinces et ciseaux chirurgicaux, séparez avec précaution la peau de la couche de musculoperitoneal sans causer aucune incision à la couche musculoperitoneal. Après les couches ont été suffisamment séparés (environ 1 cm x 4 cm), identifiez la linea alba sur la couche musculoperitoneal et la coupe ~ 2 cm le long de la linea alba pour exposer la cavité intrapéritonéale à l’aide de micro-pinces et ciseaux.
- Soigneusement, localiser et identifier le caecum. Lentement et délicatement retirer le caecum de la cavité intrapéritonéale avec micro-pinces, ce qui porte le côlon proximal et l’iléon avec le caecum dehors sur le drap stérile. Immédiatement, humidifier le tissu intestinal avec gaze imbibé saline stérile de 0,9 % et garder les tissus exposés humidifié en permanence alors qu’ils sont à l’extérieur de la cavité abdominale.
- Localiser et identifier le mésentère entre l’iléon et le côlon proximal. Faire une incision (~ 1 cm) en parallèle et juste en dessous, l’iléon, dans le mésentère et évitez de couper n’importe quel système vasculaire.
- Prendre un anneau de silicone autoclavable (6 mm de longueur, diamètre extérieur 4 mm, 3,5 mm de diamètre intérieur). Couper longitudinalement pour ouvrir le tube et l’anneau avec une micro-pince.
- Insérez une extrémité de l’anneau ouvert dans l’incision dans le tissu du mésentère. Retourner l’anneau à une forme d’anneau terminé en apportant une extrémité en contact avec un autre, avec l’iléon entouré par l’anneau.
- S’assurer que l’anneau de silicone entoure complètement l’iléon, fermer l’anneau avec la suture et replacez soigneusement les intestins dans la cavité intrapéritonéale.
- Fermeture de la chirurgie
- Effectuez un simple suture continue sur la couche de musculoperitoneal le long de la linea alba pour fermer la musculoperitoneal enroulés avec une suture résorbable. Lorsque la suture est terminée, nettoyez tout saignement avec gaze imbibé saline stérile de 0,9 %.
- Pour fermer complètement la plaie, avec une suture nylon distinct, effectuer une suture simple continue sur la peau.
- Après ont effectué les deux sutures, nettoyer la plaie avec la nouvelle swabstick ou povidone-iode.
- Injecter par voie intrapéritonéale des antibiotiques (gentamicine, 150 μL / souris basée sur 20-30 g de poids corporel).
- Après l’achèvement de la procédure, éteignez le vaporisateur isoflurane et permettre à l’animal de respirer seulement s’écoulant oxygène jusqu'à ce qu’il commencer prendre conscience.
- Une fois l’animal éveillé, placer l’animal dans une zone de récupération distinct avec support thermique jusqu'à ce que complètement guéri.
3. après les opérations observation.
- Après l’achèvement de la chirurgie, déplacer les animaux à un incubateur dans une salle de réveil où la température et l’humidité sont réglementés. Surveiller les animaux après l’opération toutes les 15 min pour la première heure, puis toutes les 30 minutes pour la deuxième heure, tandis que les animaux sont dans l’incubateur.
- Dès que l’observation prescrite est terminée, déplacer les animaux pour leur propre cage individuelle et assurer le suivi quotidien des signes cliniques de la douleur,18et à veiller à ce que la plaie chirurgicale est la guérison correctement sans aucun signe de complications ( déhiscence) présents.
Résultats
Obstruction partielle (PO) a été chirurgicalement induite chez les souris âgés d’un mois en plaçant un anneau de silicone autour de l’iléon à proximité du sphincter iléo-caecale. Cet anneau a créé une obstruction partielle dans l’iléon. Opérations de Sham (SO) ont aussi été réalisées sans un anneau sur l’âge et le sexe égalé souris et ces souris n’ont pas montré des symptômes similaires à ceux observés chez les souris de PO. Souris se remit rapidement d’une chirurgie PO en quelques heures. Ils ont montré aucun des changements de comportement évidents ou une faiblesse dans la première semaine, mais après la première semaine, ils ont progressivement commencé à montrer des signes de PO : un abdomen distendu et la production de pellets moins nombreux et plus petits fécales. Souris de PO ont été sacrifiés à 8 et 13 jours post-PO la chirurgie ainsi que des souris témoins SO. L’intestin grêle était partiellement rempli et distendu à la chirurgie post-PO 8 jours et entièrement rempli et distendu à la chirurgie post-PO 13 jours, comparée à Soo control souris (Figure 1 a). Formation de boulettes fécales dans le colon de 8 et 13 souris chirurgie de jours post-PO a été réduite par rapport aux souris témoins de SO (Figure 1 b). Tissu iléal qui était juste en amont de l’anneau a été disséqué et le muscle lisse a été analysé par l’hématoxyline et éosine (H & E) coloration. La couche de muscle lisse a été à la chirurgie post-PO 8 jours et hypertrophiée hypertrophiée beaucoup plus loin à la chirurgie post-PO 13 jours (Figure 2). Nous avons également observé des changements SMC, ICC, PDGFRα+et les cellules neuronales dans la tunique musculeuse chez les souris PO grâce à l’utilisation d’immunochimie. Chaque cellule a été étiqueté avec marqueurs spécifiques du type cellulaire : MYH11 (SMC), KIT (ICC), PDGFRA (cellules PDGFRα+ ) et PGP9.5 (neurones). SMC se trouvent à trois couches de tissus : muscle longitudinal (LM), muscle circulaire (MC) et la muscularis mucosae (MM) dans l’iléon. SMC ont été progressivement croît à un rythme rapide dans chacune des trois couches à 8 et 13 jours post-PO la chirurgie (Figure 3). En ce qui concerne le CIEC, leurs sous-populations sont situées dans le plexus musculaire profond (DMP), région myentérique (MY) et région sous-séreux (SS). Toutefois, ICC-DMP, ICC-MY et ICC-SS ont dégénéré au sein des couches intra/intermusculaires (Figure 3). Semblables à des sous-populations d’ICC, sous-populations de cellules PDGFRα+ (PαC) sont situées dans le DMP, MY et SS. Chez les souris PO, PαC-DMP, mon PαC et PαC-SS ont été dynamiquement remodelés au sein des couches intermusculaires de souris PO : ils étaient de plus en plus à la chirurgie post-PO 8 jours et a dégénéré à la chirurgie post-PO 13 jours (Figure 3). Enfin, le plexus myentérique (MP), plexus sous-muqueux (SP), neurones sous-séreux (SS) et les neurones moteurs entériques (REM) étaient significativement perdus dans les régions inter/intramusculaire de souris PO à 8 et 13 jours post-PO la chirurgie (Figure 3).

Figure 1. Une obstruction intestinale partielle induite chirurgicalement dans un modèle murin. PO a été induite par la chirurgie de PO. Souris d’un mois ont été anesthésiés, leur abdomen a été ouvert par une incision, un anneau de silicone a été placé autour de l’iléon et l’ouverture a été fermé par suture. Souris qui subit une intervention chirurgicale ont été autorisés à récupérer pendant 8 ou 13 jours. Âge et le sexe correspondant donc souris ont été opérés de la même manière que les souris PO sauf il n’y avait aucun placement d’un anneau. (A) brut images du tube digestif chez les souris qui subit la PO ou chirurgie de SO. Les images sont des souris, à 8 et 13 jours post-opératoire (B) digestif disséqué des souris dans A. intestin grêle en amont de l’anneau a été dilatée à 8 et 13 la chirurgie post-PO jours et pelotes fécales dans le colon étaient aussi plus petits à la fois 8 et 13 jour post-PO chirurgie comme par rapport aux souris chirurgie post-SO 13 jours en raison de l’anneau de silicone partiellement obstructive. Barreaux de l’échelle est 0,5 cm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
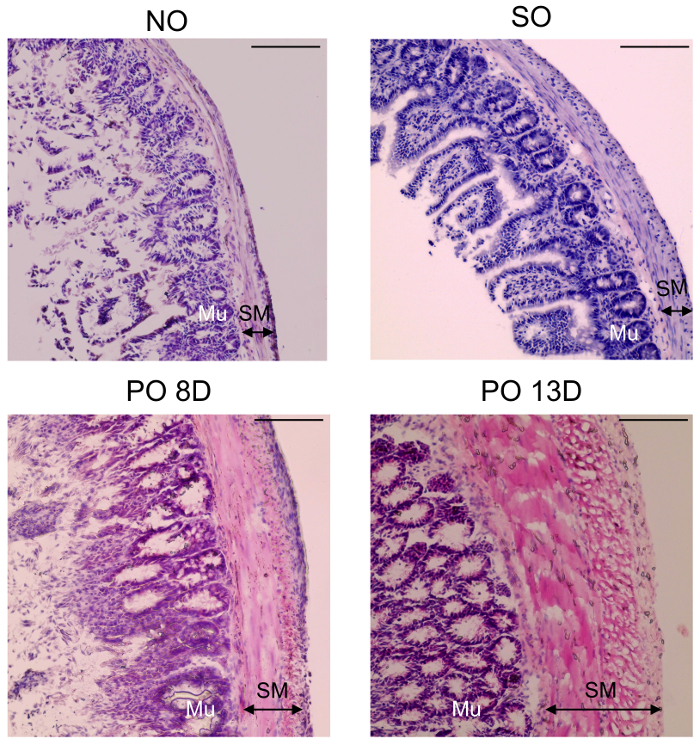
Figure 2. Couche de muscle lisse a changé dans le modèle murin chirurgical. Aucune opération (non) souris et représentant H & E la coloration des coupes iléales de PO intestinale, donc. Muscle lisse (SM) et les couches de la muqueuse (Mu) sont plus épais chez les souris de PO à 8 et 13 jours post-PO la chirurgie que ceux dans SO et aucune souris. Barreaux de l’échelle est 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
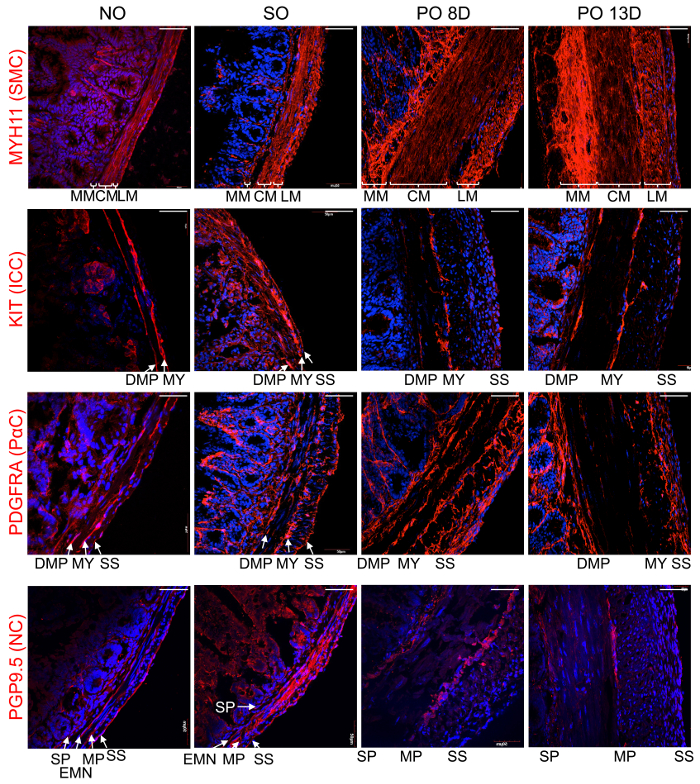
Figure 3. Un remodelage cellulaire dynamique dans l’hypertrophie de muscle lisse induite par une obstruction intestinale partielle. Représentante confocale à balayage laser images de hypertrophiques coupes iléales, de PO, donc et sans souris. Immunohistochimique coloration avec des anticorps (rouge) de MYH11 (SMC), KIT (ICC), PDGFRA (cellules PDGFRα+ ) ou PGP9.5 (NC, les cellules neuronales), co colorées au DAPI (bleu). SMC dans la muqueuse, muscularis (MM), muscle circulaire (MC) et couches de muscles longitudinaux (LM), ainsi que les cellules PDGFRα+ dans le plexus musculaire profond (DMP), région myentérique (MY) et région sous-séreux (SS) se développaient dans l’iléon hypertrophique à 8 et 13 jours post-PO chirurgie tout en ICC DMP, MY et SS, plexus myentérique (MP), plexus sous-muqueux (SP), sous-séreux NC (SS) et les neurones moteurs entériques (REM) ont dégénéré. Barreaux de l’échelle est 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
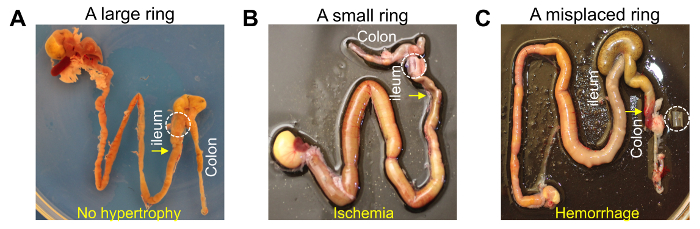
Figure 4. Résultats des anneaux de silicone qui sont trop grandes, trop petites ou mal placée sur le côlon. (A) aucune hypertrophie de muscle lisse se développe dans l’iléon, si la bague est trop grande pour provoquer l’obstruction. L’anneau fait peu ou pas de blocage de l’iléon. (B) l’ischémie intestinale se développe dans l’iléon, si l’anneau est trop petit. L’anneau fait un blocage presque complet de l’iléon, qui peut endommager les tissus et provoquer la mort précoce avant que se développe une hypertrophie. (C) hypertrophie de muscle lisse développé dans le côlon en raison d’une bague déplacée. L’anneau sur le côlon a été ramenée de lumière contenu (fèces), qui a endommagé des vaisseaux du mésentère et provoqué une hémorragie massive dans le côlon. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous avons démontré que les souris ayant reçu la chirurgie intestinale de PO systématiquement et de façon reproductible développent hypertrophie de muscle lisse intestinal, qui imite une obstruction intestinale humaine. Chirurgies de l’occlusion intestinale ont été développés pour différents animaux dont7de la souris, rats10, cobayes11, chiens chats et12 13. Le modèle murin d’obstruction intestinale a temps, coût, taille et phénotypiques avantages par rapport aux autres modèles d’animaux plus gros. Le développement de l’hypertrophie chez des souris ou des rats prend seulement 10-14 jours10, comparée à 2-4 semaines en cochons d’Inde, chiens et chats11,12,13. Coût pour l’achat et l’entretien de souris est aussi un énorme avantage financier par rapport aux autres modèles. En outre, les souris sont petites et faciles à manipuler pour la chirurgie de PO. Surtout, souris recevant la chirurgie PO progressivement et largement développent hypertrophie dans l’intestin grêle, tandis que les autres grands animaux développer une croissance moins importante.
Il y a plusieurs facteurs clés à considérer lors d’une tentative de produire une hypertrophie fiable grâce à la chirurgie intestinale de PO. Plusieurs groupes de recherche ont utilisé des anneaux de différentes tailles et placé un anneau à divers endroits le long de l’intestin pour créer une obstruction partielle7,9,10,11,12, 13,14. Toutefois, un anneau de silicone de taille optimale devrait servir pour la souris l’anneau crée peu ou pas de blocage dans l’iléon où hypertrophie que partiellement, ou jamais, mis au point (Figure 4 a). À l’inverse, quand un anneau était trop petit, qu'il a créé près de blocage complet de l’iléon qui induit une ischémie intestinale et/ou endommager la muqueuse provoquant une septicémie, conduisant à la mort précoce moins d’une semaine (Figure 4 b). Nous avons utilisé un anneau de silicone d’une taille spécifique (6 mm de longueur, diamètre extérieur 4 mm, 3,5 mm de diamètre intérieur) âgé d’un mois chez la souris (Table des matières). Différentes tailles d’anneaux devraient être testés et utilisés pour la souris de différentes tailles afin de créer un blocage optimal dans l’iléon. Un autre facteur clé est l’emplacement de la bague sur l’intestin. L’iléon, à proximité de la valve iléo-caecale, est le meilleur endroit pour placer l’anneau afin de produire avec force toute obstruction partielle. Autres régions, comme le jéjunum ou les différentes régions de l’iléon de valve iléo-caecale, ont eu un anneau similaire placé sur eux afin d’induire une hypertrophie7. Cependant, en raison de la surface séreuse de l’intestin étant très lubrifié par le liquide péritonéal, un anneau placé sur ces parties de l’intestin facilement se déplace à cause de la force contractile de l’intestin, poussant les matières fécales à travers. Comme l’anneau est poussé vers le bas de la longueur de l’intestin, il coupe les artères mésentériques innervés dans la région de myentérique de l’intestin, provoquant des hémorragies. Quand un anneau est inséré à la fin de l’iléon à côté de la valve iléo-caecale, il est physiquement empêché de se déplacer plus loin par la nature encombrante du caecum. Le caecum peut être facilement situé et sorti de l’abdomen dans la chirurgie afin de localiser la région de valve iléo-caecale car le caecum se connecte à l’iléon et le côlon proximal. L’iléon et le côlon relié au caecum ressemblent assez et un anneau peut accidentellement être placé sur le côlon proximal au lieu de l’iléon. Lorsqu’un anneau a été perdue sur le côlon proximal, comme on le voit aussi sur le jéjunum, l’anneau a été poussé vers le bas et endommagé les artères mésentériques, provoquant des hémorragies (Figure 4). Pour éviter cet égarement, l’iléon doit toujours être correctement situé et identifié avant que l’anneau est mis en place. L’iléon se jette dans le milieu du caecum tandis que le colon se heurte à un côté de la pochette du caecum.
Ce protocole de chirurgie PO est considéré comme une chirurgie majeure pour les souris. Tous les instruments chirurgicaux et les matériaux doivent être stérilisés avant utilisation, et la chirurgie doit être effectuée dans l’environnement propre, d’une salle de chirurgie dédiée afin de minimiser la contamination, qui peut conduire à l’infection et l’inflammation chez les souris. En outre, un analgésique devrait bénéficier à des souris après la chirurgie. Nous avons choisi d’utiliser une version lente de la buprénorphine, qui est efficace jusqu'à 7-8 h22. En outre, après la chirurgie, les souris ont difficulté à mâcher et à avaler des aliments solides. Pour vers le haut à la chirurgie après 5 jours, les souris devraient être fournis avec adoucie alimentaire (aliments solides avec un peu d’eau ajoutée pour ramollir la nourriture) et passés à une alimentation solide normale après 5 jours.
Notre chirurgie intestinale de PO fournit un modèle de hypertrophie in vivo pour occlusion intestinale dans laquelle SMC, ICC, et cellules PDGFRα+ sont anormalement remodelés. Ce modèle PO est également idéal pour comprendre comment les neurones entériques sont modifiés par le PO et la façon dont les principales activités motrices sont affectées dans les petits et gros intestin23. Ces cellules peuvent être remodelés dynamiquement dans certaines pathologies, ainsi que sous des conditions de culture15,16. Nous avons observé que ces cellules chez des souris de SO s’est comporté un peu différemment que les souris normales sans opération (Figure 2 et Figure 3). La plupart occlusion intestinale chez l’homme se produit par des adhérences abdominales mis au point après la chirurgie, conduisant à une hypertrophie de muscle lisse3,4,5,21. Après chirurgie de SO, nous avons également constaté que SMC, ICC et PDGFRα+ cellules étaient légèrement hypertrophiques dans l’intestin grêle, comparativement à aucune (Figure 3), suggérant que la chirurgie elle-même peut induire une hypertrophie de muscle lisse intestinal. Si c’est le cas, la chirurgie n’est pas un complet contrôle négatif pour la chirurgie de PO. PAS aussi bien que SO devrait être utilisé comme une comparaison à l’intestin de PO.
En résumé, nous avons trouvé un coût/temps efficace, fiable et reproductible PO protocole chirurgical chez les souris robuste génère des occlusions intestinales. Au cours du développement de l’obstruction, SMC, ICC, PDGFRα+, ainsi que les cellules neuronales sont dynamiquement remodelés dans les diverses couches de tissu et locales. Ce modèle obstruction in vivo offre de nouvelles perspectives sur notre connaissance des variations phénotypiques comment se produisent dans obstruée intestin au niveau cellulaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier Benjamin J Weigler, D.V.M., Ph.d. et Walt Mandeville, D.M.V. (ressources animales & Campus fréquentant vétérinaire, Université du Nevada, Reno) pour leurs excellents services animaliers a fourni aux souris ainsi que leurs avocats sur interventions chirurgicales.
matériels
| Name | Company | Catalog Number | Comments |
| Surgical drape | Medical and veterinary supplies | SMS40 | 40”X100 yards |
| Underpad, econ, pro plus | Medical and veterinary supplies | MSC281224 | 17x24” |
| Iris scissors | Braintree scientific, Inc | SC-i-130 | |
| Iris scissors | Vantage | V95-304 | |
| Dumont electronic & jeweler tweezers | Dumont | 98-180-3 | |
| Braided absorbable suture | Covidien polysorb | SL-5687G | 5-0, polyglactin |
| Nylon non-absorbable mono filament | AD surgical | S-N618R13 | 6-0, nylon |
| Surgical blade | Dynarex | No.15 | |
| Needle holder | Jacobson microvascular | 36-1342TC | 8.5 inch |
| Scalpel handle | Flinn scientific | AB1049 | |
| Microsurgical scissor | WPI | 503305 | |
| Petrolatum ophthalmic ointment | Puralube VET | 3.5 g | |
| Fluriso (isoflurane) | Vetone | V1 502017 | 250 ml |
| Steri-strip reinforced skin closure | 3M | R1547 | |
| Surgical gloves | Medline | MSG2270 | |
| Ear loop face mask | The safety zone | RS700 | |
| Avant gauze non-woven sponges | Caring | PRM25444 | |
| Surgical cup | Admiral craft OYC-2 | 725-A42 | 2.5 oz |
| Swabstick | ChloraPrep | 260103 | 2% w/v Chlorhexidine Gluconate (CHG) and 70% v/v Isopropyl Alcohol (IPA) |
| Cotton tipped applicator | Puritan | 806-WC | |
| Buprenorphine | Zoo pharm | BZ8069317 | 1 mg/ml |
| Gentamycin sulfate | Vetone | G-6336-04 | 100 mg/ml |
| Fast acting gel cream remover | Veet | 8111002 | |
| Syringe | AHS | AH01T2516 | 1 ml with needle |
| Silicon ring | VWR | 60985-720 | 6 mm in length, 4 mm exterior diameter, 3.5 mm interior diameter |
| C57BL/6 mice | The Jackson Laboratory | 4-6 weeks old |
Références
- Millat, B., Guillon, F. Physiopathology and principles of intensive care in intestinal obstructions. Rev Prat. 43, 667-672 (1993).
- Tonelli, P. New developments in Crohn's disease: solution of doctrinal mysteries and reinstatement as a surgically treatable disease. 1. The process is not a form of enteritis but lymphedema contaminated by intestinal contents. Chir Ital. 52, 109-121 (2000).
- Limsrivilai, J. Meta-analytic Bayesian model for differentiating intestinal tuberculosis from Crohn's disease. Am J Gastroenterol. 112, 415-427 (2017).
- Dvorak, D., Adamova, Z., Bar, T., Slovacek, R. Internal hernia as a cause of small bowel obstruction. Rozhl Chir. 96, 34-36 (2017).
- Massani, M., Capovilla, G., Ruffolo, C., Bassi, N. Gastrointestinal stromal tumour (GIST) presenting as a strangulated inguinal hernia with small bowel obstruction. BMJ Case Rep. , (2007).
- Chen, J., Chen, H., Sanders, M., Perrino, B. A. Regulation of SRF/CArG-dependent gene transcription during chronic partial obstruction of murine small intestine. Neurogastroenterol Motil. 20, 829-842 (2008).
- Chang, I. Y., et al. Loss of interstitial cells of Cajal and development of electrical dysfunction in murine small bowel obstruction. J Physiol. 536 (Pt 2), 555-568 (2001).
- Liu, D. H., et al. Voltage dependent potassium channel remodeling in murine intestinal smooth muscle hypertrophy induced by partial obstruction. PLoS One. 9 (2), e86109(2014).
- Guo, X., et al. Down-regulation of hydrogen sulfide biosynthesis accompanies murine interstitial cells of Cajal dysfunction in partial ileal obstruction. PLoS One. 7, e48249(2012).
- Yang, J., Zhao, J., Chen, P., Nakaguchi, T., Grundy, D., Gregersen, H. Interdependency between mechanical parameters and afferent nerve discharge in hypertrophic intestine of rats. Am J Physiol-Gastr L. 310, G376-G386 (2016).
- Zhao, J., Liao, D., Yang, J., Gregersen, H. Biomechanical remodeling of obstructed guinea pig jejunum. J Biomech. 43, 1322-1329 (2010).
- Bowen, E. J., et al. Duodenal Brunner's glade adenoma causing chronic small intestinal obstruction in a dog. J Small Anim Pract. 53, 136-139 (2012).
- Bettini, G., et al. Hypertrophy of intestinal smooth muscle in cats. Res Vet Sci. 75, 43-53 (2003).
- Macdonald, J. A. Smooth muscle phenotypic plasticity in mechanical obstruction of the small intestine. J Neurogastroenterol Motil. 20, 737-740 (2008).
- Ha, S. E., et al. Transcriptome analysis of PDGFRα+ Cells identifies T-types Ca2+ channel CACNA1G as a new pathological marker for PDGFRα+ cell hyperplasia. PLoS One. 12, e0182265(2017).
- Park, C., et al. Serum response factor is essential for prenatal gastrointestinal smooth muscle development and maintenance of differentiated phenotype. J Neurogastroenterol Motil. 21, 589-602 (2015).
- Spencer, N. J., Sanders, K. M., Smith, T. K. Migrating motor complexes do not require electrical slow waves in the mouse small intestine. J Physiol. 553, 881-893 (2003).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Terez, S. D., Notari, L., Sun, R., Zhao, A. Mechanisms of smooth muscle responses to inflammation. Neurogastroenterol Motil. 24, 802-811 (2012).
- Chen, W., et al. Smooth muscle hyperplasia/hypertrophy is the most prominent histological change in Crohn's fibrostenosing bowel strictures: A semiquantitative analysis by using a novel histological grading scheme. J Crohns Colitis. 11, 92-104 (2017).
- Huizinga, J. D., Chen, J. H. Interstitial Cells of Cajal: Update on Basic and Clinical Science. Curr Gastroenterol Rep. 16, 363(2014).
- Jirkof, P., Touvieille, A., Cinelli, P., Arras, M. Buprenorphine for pain relief in mice: repeated injections vs sustained-release depot formulation. Lab Animal. 49, 177-187 (2015).
- Spencer, N. J., Dinning, P. J., Brookes, S. J., Costa, M. Insights into the mechanisms underlying colonic motor patterns. J Physiol. 594, 4099-4116 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon