Method Article
Un protocole pour un suivi en temps réel 3D seule particule
Dans cet article
Résumé
Détails de ce protocole la construction et l’exploitation d’un microscope de suivi en temps réel 3D seule particule capable de suivi échelle nanométrique fluorescent sondes à grande vitesse par diffusion et taux de comptage de photons de faible.
Résumé
Une seule particule tridimensionnelle en temps réel suivi (RT-3D-SPT) a le potentiel pour faire la lumière sur les processus rapides et 3D dans les systèmes cellulaires. Bien que diverses méthodes de RT-3D-SPT ont été présentés ces dernières années, haute vitesse de suivi 3D diffusant des particules à des taux de comptage de photons de faible reste un défi. En outre, des configurations de RT-3D-SPT sont généralement complexes et difficiles à mettre en œuvre, limitant leur application généralisée aux problèmes biologiques. Ce protocole présente un système de RT-3D-SPT nommé 3D dynamique Photon localisation Tracking (3D-DyPLoT), qui permet de suivre les particules à haute vitesse par diffusion (jusqu'à 20 µm2/s) au taux de comptage de photons de faible (jusqu'à 10 kHz). 3D-DyPLoT emploie un déflecteur d’electro-optiques 2D (2D-EOD) et une lentille de gradient acoustique accordable (TAG) d’entraînement axé sur un seul laser spot dynamiquement en 3D. Combiné avec un algorithme d’estimation de position optimisée, 3D-DyPLoT pouvez verrouiller sur les particules unique avec suivi haute vitesse et la précision de localisation haute. En raison de l’excitation unique et mise en page de chemin d’accès détection simple, 3D-DyPLoT est robuste et facile à mettre en place. Ce protocole décrit comment construire 3D-DyPLoT étape par étape. Tout d’abord, la disposition optique est décrite. Ensuite, le système est calibré et optimisé par une perle fluorescente de 190 nm avec la NANOPOSITIONNEUR piézoélectrique de balayage. Enfin, pour illustrer la 3D en temps réel suivi de capacité, 110 perles fluorescentes nm sont suivis dans l’eau.
Introduction
L’émergence des techniques avancées d’imagerie a ouvert une fenêtre pour visualiser la structure toujours plus détaillée des phénomènes cellulaires, tout le chemin jusqu’au niveau moléculaire. Méthodes telles que la reconstruction optique stochastique microscopie (tempête)1,2,3, localisation photoactivation microscopie (PALM)4,5,6,7 , structurée illumination microscopie (SIM)8,9,10,11et a stimulé des émissions appauvrissement microscopie (STED)12,13, 14 ont largement dépassé la limite de diffraction à livrer des détails sans précédent dans la structure et la fonction des cellules vivantes. Toutefois, complète compréhension de la façon dont ces systèmes comportent nécessite des informations dynamiques ainsi que des informations structurelles. Les méthodes de Super-résolution énumérés ci-dessus impliquent un compromis entre la résolution spatiale et résolution temporelle, limitant la précision temporelle avec laquelle les processus dynamiques peuvent être sondées. Une méthode qui fournit la haute précision spatiale et la résolution temporelle est RT-3D-SPT15,16,17,18,19,20, 21,22,23,24,25,26,27,28,29. Ici, nous font une distinction entre les traditionnelles 3D-SPT30 et traditionnel de RT-3D-SPT. 3D-SPT nécessite simplement une série chronologique de données d’images en trois dimensions (ce qui peuvent être acquis soit à l’aide d’un microscope confocal ou un microscope à épifluorescence compte tenu de la configuration de droite). Dans traditionnel 3D-SPT, les coordonnées de la particule sont déterminées après la collecte de données en recherchant la particule dans la pile de chaque image et en concaténant les emplacements dans les volumes successifs pour créer une trajectoire. Pour ces méthodes, l’ultime résolution temporelle est déterminée par le taux d’imagerie volumétrique. Pour les microscopes confocaux, c’est facilement sur l’échelle de secondes à quelques dizaines de secondes. Pour les méthodes épifluorescence, dans laquelle le chemin optique est manipulé afin que les informations d’emplacement axial peuvent être extraite, la résolution temporelle est limitée par le temps d’exposition ou l’affichage de caméra. Ces méthodes épifluorescente sont limitées à la plage sur laquelle axiales renseignements peuvent être recueillis, bien que les progrès récents dans la phase de plan de Fourier masques conception et optique adaptative étend ces gammes de 10 microns ou plus31,32 , 33 , 34.
En revanche, le RT-3D-SPT ne dépend pas acquérir une pile d’images 3D et de trouver des particules après coup. Au lieu de cela, localisation en temps réel les informations est extraites par l’intermédiaire de détecteurs monopoint et rétroaction est appliquée à efficacement « verrouiller » la particule du volume focal de l’objectif grâce à l’utilisation d’un stade piézoélectrique highspeed. Cela permet une mesure continue de la position de la particule limitée seulement par le nombre de photons peuvent être collectées. En outre, cette méthode permet interrogatoire spectrale de la particule lorsqu’elle se déplace sur de longues plages. RT-3D-SPT en vigueur oblige de travaux s’apparente à un piège optique sans force pour objets nanométriques, dans lequel la particule est continuellement sondée et mesurée en temps réel sans nécessiter de grandes puissances ou optique. Étant donné que RT-3D-SPT fournit un moyen de l’interrogatoire continu des objets vite diffusif (jusqu'à 20 µm2/s),25,29 en trois dimensions à photon faible nombre taux20,29, 35, elle devrait fournir une fenêtre dans les processus biologiques rapides ou transitoires tels que le transport intracellulaire de marchandises, liaison ligand-récepteur et la dynamique extracellulaire des virions unique. Toutefois, à ce stade, l’application de la RT-3D-SPT a été limitée à la poignée de groupes de travail pour faire progresser cette technologie.
Un des obstacles sont la complexité de la mise en page optique requis par les méthodes de RT-3D-SPT, qui sont variés. Pour la plupart des méthodes, la rétroaction optique est fournie par un stade piézoélectrique. Comme les mouvements petite particule fait à X, Y, ou Z, lectures de détecteurs monopoint sont converties en fonctions de l’erreur et nourris à haute vitesse à un NANOPOSITIONNEUR piézoélectrique, qui en déplace l’échantillon pour contrer efficacement les mouvement de la particule, verrouillant en place par rapport à l’objectif. Pour mesurer les petits mouvements de positions x, Y et Z, soit plusieurs détecteurs (4 ou 5 selon la mise en œuvre)15,18,21 , soit plusieurs spots d’excitation (2-4, la partie inférieure qui peut être appliquée si un amplificateur à verrouillage est utilisé pour extraire des X et position Y en utilisant une rotation laser spot)25,28 s’appliquent. Le chevauchement de ces taches de détection et d’émission multiples compliquent les systèmes à aligner et à entretenir.
Ici, nous présentons une méthode de verrouillage de cible à grande vitesse 3D-SPT avec un design optique simplifié appelé 3D-DyPLoT29. 3D-DyPLoT utilise un 2D-EOD et un TAG lentille36,37,38 pour déplacer dynamiquement une tache laser focalisé dans le volume focal objective à un rythme élevé (50kHz XY, 70kHz Z). Combinant la position de foyer de laser et de l’heure d’arrivée de photon permet la position 3D de la particule à obtenir rapidement même au taux de comptage de photons de faible. 2D-jeo actionne la mise au point du laser à tour modèle39 avec une taille de carrés de 1 x 1 µm dans le plan X-Y un chevalier et l’objectif de TAG déplace le focus de laser dans le sens axial avec une plage de 2 à 4 µm. La position de la particule 3D est obtenue avec une estimation de position optimisée algorithme29,40 en 3D. Le contrôle du 3D dynamique mouvement laser spot, photon de l’avalanche photodiode (APD), calcul de position de la particule en temps réel, retour de scène piézoélectrique et enregistrement des données sont exécutées sur un field programmable gate array (FPGA).Dans ce protocole, nous expliquent comment construire un microscope 3D-DyPLoT étape par étape, y compris un alignement optique, étalonnage avec particules fixes et enfin libre suivi de particules. Comme une démonstration, 110 perles fluorescentes nm ont été suivis en permanence dans l’eau pour les minutes à la fois.
La méthode décrite ici est un choix idéal pour n’importe quelle application où il est souhaitable de suivre en permanence une sonde fluorescente se déplaçant rapidement à des niveaux faibles de lumière, y compris les virus, les nanoparticules et vésicules comme des endosomes. Contrairement aux méthodes précédentes, il n’y a qu’une seule excitation et la voie de détection unique, ce qui rend simple alignement et entretien. En outre, la zone de détection grande permet ce microscope ramasser facilement diffuser rapidement les particules, tandis que la capacité de suivre les niveaux de signal faible (jusqu'à 10 kHz) rend cette méthode idéale pour les applications de basse lumière29.
Protocole
1. configurer la mise en page et alignement
- Installation et collimation de l’excitation de suivi laser
- Fixer le laser sur la table optique à l’aide d’une monture de construction artisanale. La monture est une plaque d’aluminium simple avec trous pour la tête du laser et la table optique. Le laser doit être fermement fixé à une monture en métal pour la stabilité et la dissipation thermique. Pour ce travail, utiliser un laser à état solide 488 nm pour l’éclairage (Figure 1), bien que la longueur d’onde peut être sélectionné pour convenir à un fluorophore particulière ou d’expérimenter. Un facteur critique est que la longueur d’onde laser correspondre à la gamme de travail 2D-NEM, qui est déterminée principalement par la plaque nervurée entre les deux déflecteurs (Figure 1: W2). Le laser à 488 nm peut exciter efficacement la verte ou jaune protéine fluorescente (GFP/YFP), qui sont les étiquettes fluorescentes communes dans les expériences de cellules vivantes.
- Ajuster la hauteur du faisceau laser et la direction à l’aide d’une paire de miroirs diélectriques (Figure 1: M). Veillez à ce que le faisceau laser est parallèle à la table optique et l’ajuster à une hauteur adéquate.
Remarque : La hauteur doit être choisie selon la plateforme microscope. Cette hauteur doit être maintenue pour tous les miroirs suivants utilisés dans le présent protocole, bien qu’il ne sera pas explicitement déclaré. - Collimater la poutre avec une paire de lentilles (Figure 1: L1 et L2). La longueur focale des objectifs doivent être choisie avec soin pour éviter le spot laser étant coupé par l’ouverture de la 2D-EOD. Découpage est évident par un changement dans la forme du faisceau laser après avoir traversé la 2D-EOD. La qualité de collimation ici est très importante car les aberrations seront amplifiées par les lentilles et toute divergence se dégraderait les performances de la déviation 2D-EOD. Idéalement, collimater le faisceau en concentrant le faisceau jusqu'à un point situé au moins à 20 mètres.
- Placer un sténopé (Figure 1: PH) de taille appropriée à la mise au point de la première lentille de collimation (Figure 1: L1).
- Choisissez un sténopé de taille appropriée. La taille du trou d’épingle peut être choisie selon le calcul suivant :
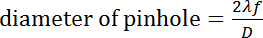
Où λ est la longueur d’onde du laser, f est la focale de l’objectif premier, et D est le diamètre du faisceau d’entrée. - Monter le sténopé sur une scène de translation 3D afin qu’il puisse être placé précisément au foyer de la première lentille de collimation.
- Ajustez la position de la trou d’épingle. Placez un mesureur de puissance de laser après le trou d’épingle et ajustez la position de trou d’épingle dans XYZ pour optimiser l’affichage du compteur électrique. Si on observe un anneau de diffraction, il bloque avec un iris placé avant la 2D-EOD.
- Choisissez un sténopé de taille appropriée. La taille du trou d’épingle peut être choisie selon le calcul suivant :
- Installation de polariseur de Glan-Thompson
- Mettre le polariseur de Glan-Thompson (Figure 1: GP) après la seconde lentille de collimation (Figure 1: L2) pour nettoyer la polarisation du faisceau laser. Tourner le polariseur pour trouver une transmission maximale avec le wattmètre.
- Installation du DOE
- Utiliser 2 SEMP (Figure 1: EOD1 & EOD2) pour faire dévier le laser dans les directions X et Y. Optimiser la transmission de laser en ajustant le lacet, tangage et hauteur de chaque NEM.
- Aligner les deux SEMP à l’égard de l’autre en utilisant le repère d’alignement fourni par le fabricant sur le côté de chaque déflecteur.
- Appliquer un motif de test pour le contrôleur de la 2D-EOD pour inspecter la sortie de l’EOD. Cela peut être tournée de chevalier (Figure 2) via le FPGA décrites ci-dessous ou une simple onde sinusoïdale produite par un générateur de fonction. Pour des performances optimales, la déviation par chaque déflecteur devrait être parallèle au sens de le X ou de Y de la NANOPOSITIONNEUR piezo. Cette orientation est dictée par la direction angulaire des déflecteurs autour de l’axe de transmission. Pour faire pivoter le sens de débattement sans bouger le 2D-NEM, placer un prisme colombe après la 2D-EOD pour aligner les axes de déviation pour les axes de NANOPOSITIONNEUR piezo.
- Installation de plaque demi-onde
- Posez une plaque de demi-onde (Figure 1: W1) entre le polariseur de Glan-Thompson (Figure 1: GP) et la polarisation du faisceau 2D-jeo pour aligner le laser entrant avec les axes de la déflexion de la 2D-EOD. Placez un objectif de longue focal (300 mm) après la 2D-EOD et placer une caméra sCMOS à la mise au point du laser. Activez ensuite la 2D-EOD pour générer tour du chevalier décrite ci-dessous (Figure 2). Tournez la plaque demi-onde jusqu'à ce qu’une distribution de laser uniformément carré est observée sur la caméra.
- Installation d’un faisceau dépensant lentille paire et paire de lentille de relais
- Placez une paire de lentilles (Figure 1: L3 et L4) après la 2D-EOD pour élargir le faisceau pour combler l’ouverture arrière de la lentille de l’objectif (Figure 1: Lo) et une autre paire de lentilles (Figure 1: L5 et L6) à Relais du plan focal de l’objectif de microscope. N’oubliez pas de laisser assez d’espace entre ces deux paires de lentilles que la lentille du TAG sera installée entre eux dans une étape ultérieure.
- Installer le filtre dichroïque, séparateur de faisceau de 10/90, en se concentrant lentille, APD, objectif et filtre d’émission de fluorescence pour compléter le parcours de détection.
- Installer le filtre dichroïque (Figure 1: DC) afin de refléter le laser vers l’objectif. Aligner le laser pour aller tout droit à travers le centre de la lentille de l’objectif à l’aide de deux Iris sur le dessus et le fond d’un tube de longue focale.
- Installer un séparateur de faisceau de 10/90 (Figure 1: BS) par dont 10 % de la lumière est réfléchie pour l’imagerie par une caméra sCMOS (décrit ci-dessous) et 90 % de la traverse à l’APD pour le suivi.
- Aligner la DGPA. Concentrer le laser sur un lamelle couvre-objet de la lentille de l’objectif. Utilisez la réflexion de la lamelle couvre-objet pour aligner des éléments tout en aval en mettant une lamelle à la mise au point objective et en vérifiant l’intensité de l’affichage de la DPA. Après le séparateur de faisceau, installer la DGPA concentrant (Figure 1: L7) suivie de l’APD sur une scène de translation 3D. Placez la lentille de telle sorte que la réflexion du laser de l’objectif passe par le centre de la lentille.
- Placer la lentille TAG entre les deux paires de lentilles (entre Figure 1: L4 et L5) comme mentionné avant et illustré à la Figure 1. Régler le lacet, tangage, hauteur et position latérale de sorte que le faisceau passe perpendiculairement à travers le prisme du centre du TAG.
2. préparation de l’échantillon.
- Préparation de la particule fixe
- Diluer les perles fluorescentes de 190 nm à ~ 5 × 108 perles/mL dans du PBS. Ajouter 400 µL de solution de perles sur une lamelle couvre-objet et le montage sur le porte-échantillon de la scène piézoélectrique (le volume de billes dépendra le porte-échantillon ; le diamètre de la chambre de porte échantillon utilisé ici est de 18 mm). Pour les perles utilisées ici, PBS entraîne les particules de se déposer sur la lamelle couvre-objet.
- Préparation de particules mobiles gratuit
- Diluer les perles fluorescentes de 110 nm à ~ 5 × 108 perles/mL avec de l’eau distillée. Ajouter 400 µL de solution de perles sur un lamelle couvre-objet et montez sur le porte-échantillon de la scène piézoélectrique.
3. optimiser les paramètres de suivi
- Balayage de trame fixé les particules
- Mettre un échantillon de particules fixe sur le microscope.
- Allumer le laser micropositionneur contrôleur, piezo NANOPOSITIONNEUR contrôleur, contrôleur d’objectif TAG et contrôleur de NEM. Notez que l’ordre n’est pas critique. Exécutez le NANOPOSITIONNEUR piezo en boucle fermée.
- Raster scan l’échantillon dans XYZ à l’aide d’un programme de logiciel numérisation personnalisée (Figure S3, logiciel disponible sur demande auprès des auteurs), qui actionne le 2D-EOD à tour un chevalier (Figure 2), recueille le compte de la DPA, pousse le piezo NANOPOSITIONNEUR et effectue le calcul de position (Figure S2). La taille de palier est de 40 nm et la plage de balayage est de 2 µm.
- Pour placer la lamelle à la mise au point de l’objectif, enlever le filtre d’émission de fluorescence et utilisez la réflexion du laser de la lamelle couvre-objet pour maximiser l’intensité du signal en fonction de la position Z de l’autre. Après avoir placé l’échantillon dans le plan focal, introduire à nouveau le filtre d’émission de fluorescence.
- Ouvrez le programme de numérisation. Définir la plage de balayage et de la taille d’étape en tapant le numéro dans le « démarrer », « finir » et « étape ». Tout d’abord définir une large gamme de balayage et la taille de palier pour localiser une particule (par exemple, 10 x 10 µm estimés avec la taille de palier 200 nm). Après avoir trouvé la particule, rétrécir la plage de balayage et diminuer la taille de palier (par exemple, 2 x 2 µm estimés avec la taille de palier 100 nm). Cliquez sur le bouton « scan » pour effectuer un scan 3D raster pour trouver l’objet fluorescent.
- Paramètres de lentille de TAG (voir aussi la Figure 3)
- Cliquez sur le logiciel de commande de lentilles de TAG. Cliquez sur « connect », « sous tension » dans l’ordre.
- Pour modifier la phase de sortie du signal déclencheur, il est nécessaire de changer le mode de déclenchement de sortie. Tout d’abord modifier le mode de « RGB » à « Multiplane » et puis remodifier. Maintenant, la phase peut être changé (Figure 3 b).
- Régler la phase de sortie à 0 °, 90 ° et 270 °. Alors que les trois phases qui couvrent l’espace des phases peuvent être utilisés, ces trois sont trouvent à travailler bien empiriquement (Figure 3C).
- Sélectionnez le paramètre de fréquence de 68 500 Hz.
- Pour trouver la fréquence optimale, il est souvent nécessaire de changer la fréquence de recherche. Cliquez sur « avancé », « réglage ». Changer le ' Max. FREQ(Hz)' de la colonne 0 de 70 000 Hz à 71 500 Hz. Cela peut être réglé pour quelle gamme de fréquences est approprié. Cliquez sur « Enregistrer d’étalonnage », « quitter calibrage » (Figure 3d).
- Pour rendre le nouvel étalonnage efficace, passer la résonance à une autre fréquence (par exemple, 189 150 Hz) et ensuite commuté sur le paramètre de fréquence de 68 500 Hz (Figure 3e).
- Changer l’amplitude progressivement à 35 %. Cliquez sur « Verrouiller la résonance ». Une fois la fréquence est verrouillée, cliquez sur « Débloquer résonance » (Figure 3e). L’objectif de TAG est prêt à l’emploi maintenant.
- Pour calibrer, modifier les paramètres qui sont utilisés dans l’estimation pour rendre la position estimée égale à la position réelle, comme illustré à la Figure 4e, f. entrée de la gamme de balayage de x, y, et z puis cliquez sur le « scan » bouton pour analyser l’échantillon dans XYZ pour déplacer le particules à travers le faisceau laser mobile. La position de la particule comme il est scanné par le biais de la mise au point du laser devrait convenir avec la position de la particule estimatif déterminée par la boucle d’estimation de position (Figure S1). La relation entre la position estimée et la position réelle (Figure 4D) peut être extraites d’images de position estimée (Figure 4f). Si les positions sont en désaccord, ajuster les valeurs de position de laser (ch.k) utilisé dans la boucle d’estimation de position (Figure S1).
- Aligner la lentille de la balise
- Lorsque le contrôleur de lentille de TAG est désactivée, le raster scanné images de particules (décrits ci-dessous) avant d’installer la lentille TAG et après que installation TAG lentille devrait regarder identique. Ensuite, exécuter le pile de particules fluorescentes Z numérisation en déplaçant l’objectif avec le NANOPOSITIONNEUR de z pour régler la position et l’angle de lentille TAG (Figure 4). Régler la position de la lentille de TAG jusqu'à ce qu’il n’y a aucune dérive dans les images de particules dans le plan XY dans la direction Z, qui est atteinte quand il n’y a aucun changement dans la position XY de la particule en fonction de la position Z (Figure 4D). Le système de suivi est prêt à l’emploi après l’alignement de la lentille de TAG.
- Installation de sCMOS caméra de surveillance de particules
- Installer une caméra de sCMOS pour visualiser les particules alors qu’ils sont suivis. Installer la sCMOS qu’une fois tous les composants du système de poursuite ont été installés et optimisés.
4. en temps réel suivi 3D de diffuser librement des nanoparticules
- Mettre le 110 nm libre déplacement échantillon de particules sur le microscope.
- Allumez, laser, micro-positionneur contrôleur, piezo NANOPOSITIONNEUR contrôleur, contrôleur d’objectif TAG et contrôleur de NEM. Exécutez le NANOPOSITIONNEUR piezo en boucle ouverte. Configurez le logiciel de lentille de TAG selon l’étape 3.2.
- Ouvrez et exécutez le logiciel de suivi (disponible sur demande auprès des auteurs). Régler la position de paramètres d’estimation sur leurs valeurs optimisées, qui ont été trouvés dans la Section 3.
- Pour placer la lamelle à la mise au point de l’objectif, enlever le filtre d’émission de fluorescence et utilisez la réflexion du laser de la lamelle couvre-objet pour maximiser l’intensité du signal en fonction de la position Z de l’autre. Après avoir trouvé la lamelle, augmenter la mise au point position 15 µm pour concentrer le laser de la lamelle couvre-objet et dans la solution. Introduire à nouveau le filtre d’émission de fluorescence.
- Définissez les constantes de commande incorporé. Les constantes de commande incorporé peuvent être définies à partir de faible valeur et augmente progressivement jusqu'à ce que les oscillations sont visibles dans les affichages de position de la particule. Une fois que les oscillations soient respectées, définir les constantes de commande incorporé à 80 % de la valeur causant les oscillations. Valeurs typiques sera d’environ 0,012 pour le « gain intégral « XY et 0,004 pour le Z « gain intégral ».
- Définir les seuils de suivi au « Seuil de la piste » et « Piste Minimum » et commencer l’expérience de suivi en cliquant sur « Recherche » et « Auto Track ». Le seuil pour le suivi de terminaison a la valeur légèrement supérieur à la concentration de fond et le seuil de déclenchement de suivi est environ deux fois supérieur à l’arrière-plan. Ici, le seuil de déclenchement de suivi se situe entre 3 kHz et le seuil pour mettre fin à la trajectoire est de 1,5 kHz.
Résultats
Fixe particule balayage (Figure 4) et diffusant librement 110 nm fluorescent suivi (Figure 5) ont été effectuées selon le protocole ci-dessus. La particule de numérisation a été réalisée en déplaçant les photons NANOPOSITIONNEUR et bin piézoélectriques tandis que calculer simultanément de la particule estimé position à chaque point dans l’analyse. L’image de balayage montre un carré de même intensité (Figure 4 a) et les positions estimées montrent une relation linéaire avec la position réelle de la particule intervalle de 1 × 1 × 2 µm en x, y et z, direction (Figure 4 b–f).
Pour illustrer le suivi en temps réel, les particules fluorescentes de 110 nm ont été suivis dans l’eau par 3D-DyPLoT (Figure 5 a, b). L’analyse du déplacement (MSD) moyenne quadratique montre un comportement linéaire typique caractéristique du mouvement brownien (Figure 5C). MSD analyse des 30 trajectoires a montré un diamètre moyen de hydrodynamique de 110 nm, en bon accord avec les spécifications des fabricants pour la taille des nanoparticules fluorescentes suivis (Figure 5 d). En outre, 1 film montre les afficheurs NANOPOSITIONNEUR piézoélectrique en temps réel et synchronisé sCMOS images pour une 2 min longue trajectoire d’une particule fluorescent diffusant librement de 110 nm.
En plus d’être en mesure de suivre avec la grande vitesse, lente des particules mobiles peuvent être localisées avec une grande précision. Figure 6 a - d illustre l’application du système 3D-DyPLoT à particules fixes avec les mêmes paramètres de rétroaction que celui utilisé pour la grande vitesse de suivi, montrant une précision de 17,6, 26,4 et 53,4 nm en X, Y et Z, respectivement avec les taux de comptage de photons de 105. Figure 6e - h indique la précision sous le contrôle de rétroaction réduite par un facteur de 10, efficacement échangeant vitesse pour précision et présentant une précision de 6.5, 8,3 et 10,5 nm en X, Y et Z, respectivement.

Figure 1. Schéma du système de tracking 3D. Le 2D-NEM (EOD1 & EOD2) et la lentille de TAG (balise) faire dévier le laser dans les directions XY et Z, respectivement. L’APD (APD) est utilisé pour collecter des photons de fluorescence, qui sont envoyés dans le FPGA (FPGA). FPGA est utilisée pour l’algorithme de calcul de position, comptage de photons, contrôle de la 2D-EOD ainsi que contrôle et lecture de NANOPOSITIONNEUR piézoélectrique (NSxy et NZz). Autres composants marqués dans la figure : miroirs (M) ; lentilles (L #) ; sténopé (PH) ; Polariseur de Glan-Thompson (GP) ; plaque de demi-onde (W1) ; filtre dichroïque (DC) ; objectif (OL, 100 X NA = 1,49) ; filtre d’émission de fluorescence (F) ; séparateur de faisceau (BS) ; Stade de micropositionneur XY (MSxy) ; Stade de micropositionneur Z (MSz). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
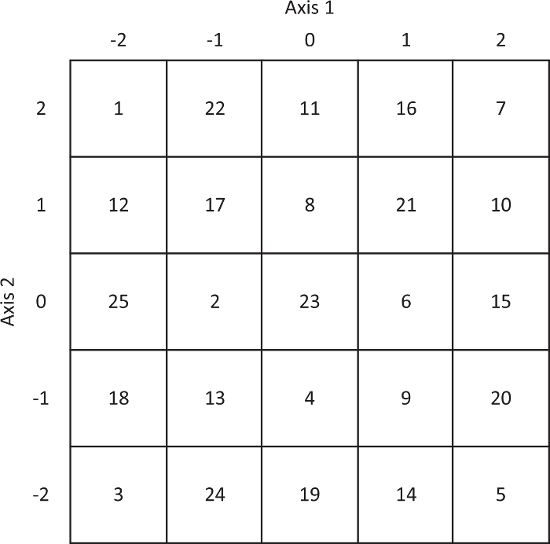
Figure 2. Coordonnées de la tour du chevalier de la mise en œuvre en 3D-DyPLoT. Axes 1 et 2 doivent être alignées le long de l’axe X ou Y par un alignement correct de la 2D-EOD. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3. Paramètres du logiciel TAG lentille. Voir section 4.2 TAG lentille paramètres pour plus d’informations. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4. Estimation de numérisation et de position particule. (a) image de balayage de 190 fluorescentes nm perles avec 2D-EOD conduite le laser dans un 1 × 1 µm carré modèle tour du chevalier. Intensité de la fluorescence est dénotée par couleur. Unité : kHz. (b) Estimation de xk, position de la particule par rapport au centre de la 2D-EOD scan en micromètres. La couleur en b, cet d indique la position estimée. Unité : µm. (c) Estimation de yk en micromètres. (d) Estimation de zk, position de la particule par rapport au centre axial de la lentille de TAG scanner en micromètres. position (e) estimée particule position yk en fonction de la scène en moyenne sur l’ensemble du réseau de (c). Notez que la position de la particule estimée acquise de l’algorithme d’estimation de position (j,k) est d’accord avec la position réelle. position (f) estimée particule position zk en fonction de la scène en moyenne sur l’ensemble du réseau de (d). La position estimée indique une relation linéaire avec la position réelle de la particule de 1 × 1 × 2 µm gamme en direction de X, Y et Z. Notez que la position de la particule estimée acquise de l’algorithme d’estimation de position (zk) est d’accord avec la position réelle. La position estimée montre une relation linéaire avec la position réelle de la particule intervalle de 1 × 1 × 2 µm en X, Y et la direction de Z. L’échelle blanche bars etune–(c) représentent 500 nm et la barre d’échelle noire en (d) représente 2 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

La figure 5.Suivi de particules fluorescentes de 110 nm dans l’eau avec 3D-DyPLOT. (un) trajectoire 3D d’une NANOPARTICULE fluorescent diffusant librement 110 nm dans l’eau. (b) intensité de fluorescence en fonction du temps pour la trajectoire en (un). (c) MSD de la trajectoire (un). La ligne bleue est la MSD mesurée tandis que la ligne rouge en pointillés est meilleure ligne ajustement par régression linéaire. (d) TMS analyse des 30 trajectoires, montrant un diamètre moyen de hydrodynamique de 110 nm, en bon accord avec la taille des nanoparticules fluorescentes suivis. Le diamètre des particules a été calculé en utilisant la relation d’Einstein-Stokes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
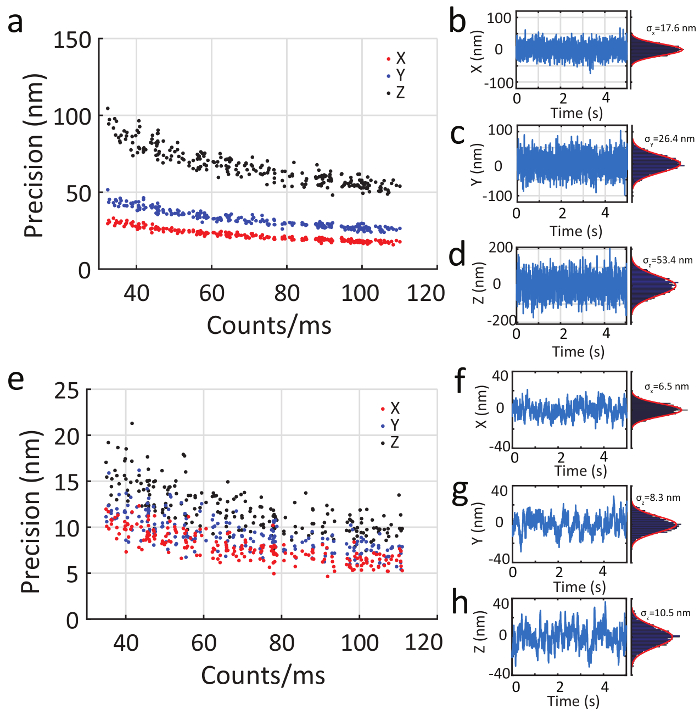
Figure 6. Précision de suivi de particules fixe. (un) A particule fixe est suivie par 3D-DyPLoT au taux de comptage différent. La précision est nm (b) 17,6 x, (c) 26.4 nm en Y et (d) 53,4 nm en Z à un taux d’émission de 100 kHz. (e) en sondant les processus lents, la commande de rétroaction constante (KI) peut être réduite par un facteur de 10 pour augmenter la précision. En vertu de cette commande de rétroaction réduite, la précision est nm (f), 6,5 x et (g), 8,3 nm en Y (h) 10,5 nm en Z à un taux d’émission de 100 kHz. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Figure S1. S’il vous plaît cliquez ici pour télécharger ce fichier.
Figure S2. S’il vous plaît cliquez ici pour télécharger ce fichier.
Figure S3. S’il vous plaît cliquez ici pour télécharger ce fichier.
Des informations complémentaires. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Bien que beaucoup de variétés de particule unique 3D, méthodes de suivi est apparues ces dernières années, robuste suivi en temps réel de diffusion 3D haute vitesse au taux de comptage de photons de faible avec une simple configuration est encore un défi, qui limite son application aux important biologique problèmes. La méthode 3D-DyPLoT décrit dans cette adresses ces défis de plusieurs façons. Tout d’abord, les voies de l’excitation et la détection sont simplifiés grandement par rapport aux autres implémentations rendant l’alignement simple et robuste. Deuxièmement, le mouvement laser spot et l’algorithme d’estimation de position fournissent des estimations précises pour la position pour la boucle de rétroaction, rendant la rétroaction plus stable. Troisièmement, la plage de détection efficacement de grandes (1 x 1 x 4 µm) du spot laser dynamiquement mobile permet un suivi des particules de mouvement rapides. Pour savoir pourquoi cette zone de détection grande est critique, il est important de considérer le temps de réponse intrinsèque de la NANOPOSITIONNEUR piézoélectrique. Stades piézoélectrique haute vitesse ont des résonances de l’ordre de 1 kHz, limitant le temps de réponse est de l’ordre de 1 m à 1 ms, une NANOPARTICULE de 100 nm avec un coefficient de diffusion de 4 µm2/s, diffusera en moyenne 90 nm du centre de la diffraction-li volume de détection FÉRIEURE. C’est seulement le déplacement moyen et véritablement aléatoire proposition exposera pas beaucoup plus grands que cela, conduisant à la particule laissant le volume focal et se terminant la trajectoire actuelle. La situation est encore pire pour les particules plus petites, où toujours plus grandes étapes par diffusion thermiques conduisent à une perte de suivi. La zone de détection effectivement grand permet le système de suivi surmonter le décalage étape piézoélectrique intrinsèque et récupérer de grands sauts par diffusion dans la position de la particule, augmente la robustesse globale du mécanisme de suivi. Enfin, la zone de numérisation grand permet au système de ramasser facilement de nouvelles particules, permettant des trajectoires consécutives à acquérir rapidement et de grands ensembles de données compilées.
L’utilisateur doit garder à l’esprit qu’il y a quelques étapes cruciales. Tout d’abord, l’alignement de la 2D-EOD et la lentille de TAG sont essentiels. Les deux doivent être bien alignées pour obtenir la précision optimale. Deuxièmement, les paramètres qui sont utilisés dans l’estimation de la position dans la particule fixe étape d’analyse doivent être bien calibrés (voir Figure 4). La position de la particule estimée doit correspondre à la position de la particule correspondant au centre de la plage de balayage laser. Enfin, les constantes intégrante de rétroaction (KI) doivent être accordés avec précaution, commençant par une petite valeur, puis montée en puissance jusqu'à ce que les oscillations sont observées, puis s’interrompant à environ 80 % de cette valeur.
Il y a quelques mises en garde sur la 3D-DyPLoT à garder à l’esprit selon l’application désirée. Alors que l’estimation de la position optimisée est conçue pour être utilisé avec le mouvement brownien, il convient aussi bien vers le mouvement directionnel. L’algorithme peut être directement appliqué à n’importe quel type de mouvement puisque c’est seulement l’incertitude de la position qui est supposé pour être gaussienne, pas la position de la particule réelle. Pour les cas où l'on s’attend à mouvement linéaire persistante, un terme additionnel peut être ajouté à ce terme de prédiction dans l’algorithme d’estimation de position (Voir l' équation 3 dans les Informations complémentaires).
La sélection des paramètres de la balise et 2D-EOD doit être examinée attentivement lorsque vous configurez la 3D-DyPLoT. Une importance toute particulière est à la fois bin pour tour de chevalier scanné par la 2D-EOD. Dans un scénario idéal, tour du chevalier serait synchronisé à la période de la lentille de TAG pour s’assurer d’échantillonnage efficace. Toutefois, il est essentiel de tenir compte du temps de réponse de la 2D-NEM à l’étape des changements de tension. Pour l’unité utilisée ici, il y a un temps de réponse de 2-3 µs après que la tension est appliquée avant l’endroit désiré soit atteint. Au moment de 20 µs de bin, c’est environ 10-15 % de l’époque de la collection. Réduire le temps pour qu’elle corresponde à la période de lentille de TAG de ~ 14 µs augmente la fraction de temps bin, ce qui est le temps de latence de la 2D-EOD. Cela conduit à des valeurs incorrectes de la position de laser et de la position incorrecte estimations.
Un autre facteur pour l’expérimentateur de garder à l’esprit est la résolution temporelle. Tandis que les données présentées ici sont recueillies à un débit de 100 kHz, l’ultime résolution temporelle est définie en fin de compte par lesquels les données sont utilisées pour la mesure de position. Si la lecture de la NANOPOSITIONNEUR est utilisée comme la position de la particule (Figure 6), la résolution temporelle va dépendre de la valeur de la constante de commande incorporé. Par exemple, pour le contrôle intégral illustré à la Figure 6 a–d, la réponse du stade est de l’ordre de 1 ms, alors que pour la Figure 6e–h, c’est l’ordre de 10 m si plus vite la résolution temporelle est désirée, puis le Photon par photon résultat de l’algorithme d’estimation de position fera la corrélation avec le taux de comptage de photons. Par exemple, un taux d’émission de 10 kHz donne 100 µs résolution temporelle et un taux d’émission de 100 kHz donne une résolution temporelle de 10 µs. En outre, depuis la précision suit un  relation41, la précision spatiale et temporelle sont couplés. En conséquence, la luminosité de la sonde détermine la précision à la fois spatiale et temporelle.
relation41, la précision spatiale et temporelle sont couplés. En conséquence, la luminosité de la sonde détermine la précision à la fois spatiale et temporelle.
Dans ce protocole, nous décrit l’installation, mise en page et l’alignement d’une haute vitesse en temps réel 3D seule particule suivi méthode qui utilise un 2D-EOD et lentille de TAG pour déplacer dynamiquement une tache laser focalisé pour réaliser l’estimation de position de la particule rapide. Nous décrit ensuite les méthodes d’optimisation de préparation et de paramètre échantillon. 3D-DyPLoT fournit une méthode relativement simple et robuste pour verrouiller à déplacement rapide et humbles émettant des particules par diffusion. La disposition optique simple lui permet d’être facilement ajoutés sur la voie latérale de n’importe quel statif existant afin qu’il peut être combiné avec des modules d’imagerie. Avec ce protocole, nous espérons que RT-3D-SPT peut être que plus largement mis en œuvre par plusieurs chercheurs pour répondre rapidement, trois dimensions processus biologiques.
Déclarations de divulgation
Les auteurs déclarent sans intérêts financiers concurrents.
Remerciements
Ce travail a été soutenu par le National Institute of General Medical Sciences, de la National Institutes of Health, sous le numéro R35GM124868 de la sentence et de Duke University.
matériels
| Name | Company | Catalog Number | Comments |
| 2D Electro-optic Deflector | ConOptics | M310A | 2 required |
| Power supply for EOD | ConOptics | 412 | Converts FPGA ouput to high voltage for EOD |
| TAG Lens | TAG Optics | TAG 2.0 | Used to deflect laser along axial direction |
| XY piezoelectric nanopositioner | MadCity Labs | Nano-PDQ275HS | Used for moving the sample to lock the particle in the objective focal volume in |
| Z piezoelectric nanoposiitoner | MadCity Labs | Nano-OP65HS | Used to move the objective lens to follow the diffusing particle |
| Micropositioner | MadCity Labs | MicroDrive | Used to coarsely position sample and evaluate |
| Objective Lens | Zeiss | PlanApo | High numerical aperture required for best sensitivity. 100X, 1.49 NA, M27, Zeiss |
| sCMOS camera | PCO | pco.edge 4.2 | Used to monitor the particle's position |
| APD | Excelitas | SPCM-ARQH-15 | Lower dark counts beneficial |
| Field programmable gate array | National Instruments | NI-7852r | |
| Software | National Instruments | LabVIEW | |
| Tracking excitation laser | JDSU | FCD488-30 | |
| Lens | ThorLabs | AC254-150-A-ML | L1 |
| Lens | ThorLabs | AC254-200-A-ML | L2 |
| Pinhole | ThorLabs | P75S | PH |
| Glan-Thompson Polarizer | ThorLabs | GTH5-A | GT |
| Half-wave plate | ThorLabs | WPH05M-488 | WP |
| Lens | ThorLabs | AC254-75-A-ML | L3 |
| Lens | ThorLabs | AC254-250-A-ML | L4 |
| Lens | ThorLabs | AC254-200-A-ML | L5 |
| Lens | ThorLabs | AC254-200-A-ML | L6 |
| Dichroic Mirror | Chroma | ZT405/488/561/640rpc | DC |
| Fluorescence Emission Filter | Chroma | D535/40m | F |
| 10/90 beamsplitter | Chroma | 21012 | BS |
| PBS | Sigma | D8537 | |
| 190 nm fluorescent nanoparticles | Bangs laboratories | FC02F/9942 | |
| 110 nm fluorescent nanoparticles | Bangs laboratories | FC02F/10617 | |
| Coverslip | Fisher Scientific | 12-545A | |
| Powermeter | Thorlabs | PM100D | |
| CMOS | Thorlabs | DCC1545M | |
| Iris | Thorlabs | SM1D12D | |
| Microscope | Mad City Labs | RM21 |
Références
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods. 3 (10), 793-796 (2006).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Jones, S. A., Shim, S. H., He, J., Fast Zhuang, X. W. Fast, three-dimensional super-resolution imaging of live cells. Nat. Methods. 8 (6), 499-505 (2011).
- Hess, S. T., Girirajan, T. P. K., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91 (11), 4258-4272 (2006).
- Shtengel, G., Galbraith, J. A., Galbraith, C. G., Lippincott-Schwartz, J., Gillette, J. M., Manley, S., et al. Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. Proc. Natl. Acad. Sci. U.S.A. 106 (9), 3125-3130 (2009).
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nat. Methods. 5 (5), 417(2008).
- Shao, L., Kner, P., Rego, E. H., Gustafsson, M. G. L. Super-resolution 3D microscopy of live whole cells using structured illumination. Nat. Methods. 8 (12), 1044(2011).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339(2009).
- Schermelleh, L., Carlton, P. M., Haase, S., Shao, L., Winoto, L., Kner, P., et al. Subdiffraction multicolor imaging of the nuclear periphery with 3D structured illumination microscopy. Science. 320 (5881), 1332-1336 (2008).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82-87 (2000).
- Persson, F., Bingen, P., Staudt, T., Engelhardt, J., Tegenfeldt, J. O., Hell, S. W. Fluorescence Nanoscopy of Single DNA Molecules by Using Stimulated Emission Depletion (STED). Angew. Chem. 50 (24), 5581-5583 (2011).
- Hein, B., Willig, K. I., Hell, S. W. Stimulated emission depletion (STED) nanoscopy of a fluorescent protein-labeled organelle inside a living cell. Proc. Natl. Acad. Sci. U.S.A. 105 (38), 14271-14276 (2008).
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proc. Natl. Acad. Sci. U.S.A. 97 (15), 8206-8210 (2000).
- Welsher, K., Yang, H. Multi-resolution 3D visualization of the early stages of cellular uptake of peptide-coated nanoparticles. Nat. Nano. 9 (3), 198-203 (2014).
- Welsher, K., Yang, H. Imaging the behavior of molecules in biological systems: breaking the 3D speed barrier with 3D multi-resolution microscopy. Faraday Discuss. 184 (0), 359-379 (2015).
- Xu, C. S., Cang, H., Montiel, D., Yang, H. Rapid and quantitative sizing of nanoparticles using three-dimensional single-particle tracking. J. Phys. Chem. C. 111 (1), 32-35 (2007).
- Cang, H., Xu, C. S., Montiel, D., Yang, H. Guiding a confocal microscope by single fluorescent nanoparticles. Opt. Lett. 32 (18), 2729-2731 (2007).
- Cang, H., Wong, C. M., Xu, C. S., Rizvi, A. H., Yang, H. Confocal three dimensional tracking of a single nanoparticle with concurrent spectroscopic readouts. Appl. Phys. Lett. 88 (22), 223901(2006).
- Han, J. J., Kiss, C., Bradbury, A. R. M., Werner, J. H. Time-Resolved, Confocal Single-Molecule Tracking of Individual Organic Dyes and Fluorescent Proteins in Three Dimensions. ACS Nano. 6 (10), 8922-8932 (2012).
- Wells, N. P., Lessard, G. A., Goodwin, P. M., Phipps, M. E., Cutler, P. J., Lidke, D. S., et al. Time-Resolved Three-Dimensional Molecular Tracking in Live Cells. Nano Lett. 10 (11), 4732-4737 (2010).
- Lessard, G. A., Goodwin, P. M., Werner, J. H. Three-dimensional tracking of individual quantum dots. Appl. Phys. Lett. 91 (22), (2007).
- McHale, K., Mabuchi, H. Intramolecular Fluorescence Correlation Spectroscopy in a Feedback Tracking Microscope. Biophys. J. 99 (1), 313-322 (2010).
- McHale, K., Mabuchi, H. Precise Characterization of the Conformation Fluctuations of Freely Diffusing DNA: Beyond Rouse and Zimm. J. Am. Chem. Soc. 131 (49), 17901-17907 (2009).
- McHale, K., Berglund, A. J., Mabuchi, H. Quantum Dot Photon Statistics Measured by Three-Dimensional Particle Tracking. Nano Lett. 7 (11), 3535-3539 (2007).
- Juette, M. F., Bewersdorf, J. Three-Dimensional Tracking of Single Fluorescent Particles with Submillisecond Temporal Resolution. Nano Lett. 10 (11), 4657-4663 (2010).
- Katayama, Y., Burkacky, O., Meyer, M., Bräuchle, C., Gratton, E., Lamb, D. C. Real-Time Nanomicroscopy via Three-Dimensional Single-Particle Tracking. ChemPhysChem. 10 (14), 2458-2464 (2009).
- Perillo, E. P., Liu, Y. -L., Huynh, K., Liu, C., Chou, C. -K., Hung, M. -C., et al. Deep and high-resolution three-dimensional tracking of single particles using nonlinear and multiplexed illumination. Nat Commun. 6, (2015).
- Hou, S., Lang, X., Welsher, K. Robust real-time 3D single-particle tracking using a dynamically moving laser spot. Opt. Lett. 42 (12), 2390-2393 (2017).
- Chenouard, N., Smal, I., de Chaumont, F., Maska, M., Sbalzarini, I. F., Gong, Y., et al. Objective comparison of particle tracking methods. Nat Meth. 11 (3), 281-289 (2014).
- Shechtman, Y., Weiss, L. E., Backer, A. S., Sahl, S. J., Moerner, W. E. Precise 3D scan-free multiple-particle tracking over large axial ranges with Tetrapod point spread functions. Nano Lett. 15 (6), 4194-4199 (2015).
- Lee, H. -lD., Sahl, S. J., Lew, M. D., Moerner, W. E. The double-helix microscope super-resolves extended biological structures by localizing single blinking molecules in three dimensions with nanoscale precision. Appl. Phys. Lett. 100 (15), 153701(2012).
- Pavani, S. R. P., Thompson, M. A., Biteen, J. S., Lord, S. J., Liu, N., Twieg, R. J., et al. Three-dimensional, single-molecule fluorescence imaging beyond the diffraction limit by using a double-helix point spread function. Proc. Natl. Acad. Sci. U.S.A. 106 (9), 2995-2999 (2009).
- Sancataldo, G., Scipioni, L., Ravasenga, T., Lanzanò, L., Diaspro, A., Barberis, A., et al. Three-dimensional multiple-particle tracking with nanometric precision over tunable axial ranges. Optica. 4 (3), 367-373 (2017).
- Balzarotti, F., Eilers, Y., Gwosch, K. C., Gynnå, A. H., Westphal, V., Stefani, F. D., et al. Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes. Science. 355 (6325), 606(2017).
- Duocastella, M., Theriault, C., Arnold, C. B. Three-dimensional particle tracking via tunable color-encoded multiplexing. Opt. Lett. 41 (5), 863-866 (2016).
- Duocastella, M., Sun, B., Arnold, C. B. Simultaneous imaging of multiple focal planes for three-dimensional microscopy using ultra-high-speed adaptive optics. BIOMEDO. 17 (5), (2012).
- Mermillod-Blondin, A., McLeod, E., Arnold, C. B. High-speed varifocal imaging with a tunable acoustic gradient index of refraction lens. Opt. Lett. 33 (18), 2146-2148 (2008).
- Wang, Q., Moerner, W. E. Optimal strategy for trapping single fluorescent molecules in solution using the ABEL trap. Appl. Phys. B. 99 (1), 23-30 (2010).
- Fields, A. P., Cohen, A. E. Optimal tracking of a Brownian particle. Opt. Express. 20 (20), 22585-22601 (2012).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophys. J. 82 (5), 2775-2783 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon