Method Article
Microstructurées dispositifs pour Microinjection optimisée et l’imagerie des larves de poisson zèbre
Dans cet article
Résumé
Microinjection des embryons de poisson-zèbre et des larves est une technique cruciale mais difficile utilisée dans de nombreux modèles de poisson-zèbre. Nous présentons ici une gamme d’outils de micro-échelle pour aider à la stabilisation et l’orientation du poisson-zèbre pour microinjection et l’imagerie.
Résumé
Poisson zèbre sont apparus comme un puissant modèle de diverses maladies humaines et un outil utile pour un nombre croissant d’études expérimentales, s’étendant sur la biologie du développement fondamentale grâce aux grands écrans chimiques et génétiques. Cependant, beaucoup d’expériences, en particulier celles relatives à l’infection et des modèles de xénogreffes, dépendre de la microinjection et l’imagerie des embryons et des larves, qui sont laborieux techniques qui requièrent des compétences et l’expertise. Afin d’améliorer la précision et le débit des cours techniques de microinjection, nous avons développé une série de dispositifs microstructurées à orienter et à stabiliser les embryons de poisson-zèbre à 2 jours après la fécondation (dpf) en orientation ventrale, dorsale ou latérale avant le mode opératoire. Pour vous aider dans l’imagerie des embryons, nous avons également conçu un appareil simple avec les canaux qui orientent le poisson-zèbre 4 latéralement en parallèle contre une lamelle de verre. Ensemble, les outils que nous vous présentons ici démontrent l’efficacité des approches photolithographiques pour générer des dispositifs utiles pour l’optimisation des techniques de poisson-zèbre.
Introduction
Poisson zèbre ont émergé comme un puissant modèle pour beaucoup de domaines, des études fondamentales biologie du développement à grande échelle génétique et chimique écrans1,2. Les manipulations génétiques courantes, telles que la surexpression du gène, précipitation, CRISPR/Cas9 mutagénèse et transgénèse dépendent de la microinjection de matériel génétique dans le zygote unicellulaire, qui a conduit au développement de simple, facile à utiliser, dans le commerce outils disponibles pour orienter et stabiliser les oeufs pour injection3. Autres approches, notamment la transplantation et l’infection, nécessitent souvent la microinjection dans plus tard stade embryons et des larves à l’aide de la plus grande jauge aiguilles capillaire4. Cependant, l’utilisation d’aiguilles de calibre plus gros présente des défis techniques importants, car il est plus difficile de pénétrer le tissu cible sans pousser ou rouler l’embryon. Dans ces conditions, obtenir la tension de l’eau approprié pour stabiliser l’embryon tout en évitant le séchage au cours de la procédure est difficile et les embryons peut-être être pas idéalement orienté pour injection dans le tissu cible.
Après microinjection, il est souvent utile dépister des embryons injectées pour sélectionner celles qui ont été injectés avec succès et de capturer des images de l’instant initial. Pour relever ces défis, nous avons développé une gamme d’appareils microstructurées qui aident à stabiliser les 2 embryons dpf dans différentes orientations pour microinjection5, ainsi que pour le dépistage rapide basé sur une image après l’injection.
Pour obtenir une résolution structurelle suffisante dans ces dispositifs, nous avons utilisé des techniques photolithographiques. Couramment utilisé dans les industries microélectroniques et plus récemment extrapolés à la fabrication de la microfluidique, ces approches peuvent atteindre les structures verticales allant de 1-1 000 µm, une échelle, bien adaptée à la manipulation des embryons de poisson-zèbre et des larves. Tous les appareils ont été fabriqués à l’aide de polydiméthylsiloxane (PDMS), ce qui est bon marché, physiquement robuste, biologiquement inerte et transparent.
Tableaux de surfaces microstructurées (MSAs) ont été mis en forme comme des blocs de PDMS avec une surface supérieure à motifs, analogue aux canaux simples dans les blocs d’agarose couramment utilisés pour le microinjection d’oeuf. Pour le dépistage après l’injection, 6 appareils d’imagerie peuvent être disposés dans un plat de 6 puits à fond de verre standard. Ces appareils sont conçus pour faciliter le chargement des embryons, alors que la procédure de déchargement permet idéalement sauvetage d’embryons spécifiques, facilitant l’imageur approches de dépistage d’une manière plus conviviale que ces dispositifs précédemment développé par le Beebe laboratoire6.
Protocole
Microinjection des larves a été approuvée par le sous-comité d’hôpital général Massachusetts sur recherche animalier sous protocole 2011N000127.
1. Fabrication de dispositifs
Remarque : Tous les assistée par ordinateur (CAD) fichiers de dessin utilisés pour la conception des masques de photolithographie décrites ici (Figure 1) sont disponibles en téléchargement. Voir Table des matières pour les liens.
- Fabriquer la plaquette maître moule dans une salle blanche de classe 1 000 à l’aide de techniques photolithographiques standard7. Pour les tableaux de la microstructure et les canaux, mires de la résine photosensible négative axée sur l’époxy séquentiellement en 3 couches à l’aide de 3 masques séparés, selon les instructions du fabricant : 100 µm pour les fonctionnalités peu profondes, 200 µm pour les caractéristiques moyennes et 400 µm pour les caractéristiques profondes. Pour l’appareil d’imagerie, modèle deux couches à l’aide de 400 µm pour les fonctionnalités peu profondes et 600 µm pour les caractéristiques profondes.
- Scotchez la gaufrette dûment remplie à la base d’un 15 cm boîte de Pétri pour effectuer le cast (Figure 2).
2. préparation des tableaux de surfaces microstructurées - PDMS
- Pour fabriquer des dispositifs utilisables, cast polydiméthylsiloxane (PDMS), à l’aide de la plaquette maître comme un moule. Mélanger 50 g de monomère PDMS avec 5 g de l’initiateur et bien mélanger dans un plastique pesant plat avec une fourchette en plastique.
- Versez le mélange soigneusement sur le moule.
- Dégazer dans un dessiccateur à vide à 16-25 inHg (54-85 kPa) pendant 1 h.
- Pour guérir le PDMS, cuire au four à 65 ° C pendant au moins 3 h. Le PDMS devrait guérir en solide ferme mais souple.
- Découpez soigneusement autour de l’appareil sur la plaquette maître à l’aide d’un scalpel, en veillant à maintenir le contact entre la pointe du scalpel et la surface de gaufrette. À l’aide de pinces, éplucher la réplique PDMS loin de la plaquette et le transfert à un propre 10 cm boîte de Pétri, côté fonctionnalité haut (Figure 3).
- Traiter l’appareil avec le plasma d’oxygène à l’aide d’un four à plasma pour 35 s pour réduire l’hydrophobicité.
- Couvrir avec une moyenne d’embryon de poisson zèbre (E3) 168 mg/l de méthanesulfonate d’éthyle le 3-aminobenoate (MS-222, pH 7,5). Enlever toutes les bulles de caractéristiques plus profonds par l’écoulement de l’eau sur la surface de l’appareil à l’aide d’une pipette de transfert.
3. préparation des tableaux de surfaces microstructurées - Agarose
- Pour faire un moule négatif de PDMS, tout d’abord traiter un dispositif PDMS avec le plasma d’oxygène.
-
Traiter l’appareil PDMS avec 1H, 1H, 2H, 2H- Perfluorooctyltriethoxysilane (PFDTS) vapeur de silane pour créer une surface inerte8. Brièvement :
- Placez le PDMS pour être traité fonctionnalité-côté-vers le haut dans une chambre à vide dans une hotte aspirante.
- À côté du PDMS, placez un petit plat en verre ou en aluminium ouvert, et soigneusement Pipeter 200 µL de PFDTS (silane de 98 %) dans le plat.
ATTENTION : PFDTS silane est très volatil, réagit violemment avec l’eau, inflammable et cause de graves dommages de la peau et les yeux au contact. FS de lire en détail avant de l’utiliser. - Fermer la chambre à vide et vide pendant 15-30 min, ou jusqu'à ce que le silane PFDTS disparaisse complètement.
- Placez l’appareil dans une boîte de Pétri et utiliser comme un moule pour PDMS frais, préparé comme indiqué au point 2.1 à 2.3.
- Cuire au four à 65 ° C pendant au moins 3 h, puis peler la couche entière de PDMS fraîches depuis le périphérique traité et placer dans un plat de Pétri fraîches. Cela peut alors servir un moule négatif pour effectuer un cast d’agarose.
- Pour préparer un gel d’agarose, faire bouillir une solution de 2 % d’agarose gélifiant dans E3 température faible dans un four à micro-ondes jusqu'à ce que l’agarose est entièrement dissous.
- Versez l’agarose chaud sur la moule négatif de PDMS et éliminez les bulles dans le gel d’agarose couvrant l’appareil en agarose chaud qui coule sur les fonctionnalités avec une pipette de transfert.
- Une fois que les bulles disparaissent, conserver au réfrigérateur à 4 ° C pour définir l’agarose.
- Supprimez le bloc d’agarose du moule négatif de PDMS en se déformant les PDMS de dessous à la main, transvaser le bloc d’agarose dans une nouvelle boîte de Pétri et humide avec E3 contenant MS-222.
4. préparation du PDMS, dispositifs d’imagerie
- Pour fabriquer des dispositifs utilisables, cast PDMS, en utilisant la plaquette maître comme un moule. Mélanger 50 g de monomère PDMS avec 5 g d’initiateur (même que celui utilisé à l’étape 2.1) et mélanger soigneusement dans un plastique pesant plat avec une fourchette en plastique.
- Versez le mélange soigneusement sur le moule.
- Dégazer dans un dessiccateur à vide à 16-25 inHg (54-85 kPa) pendant 1 h.
- Pour guérir le PDMS, cuire au four à 65 ° C pendant au moins 3 h. Le PDMS devrait guérir en solide ferme mais souple.
- Couper les appareils de la plaquette du Master et poinçonner des ports à l’aide d’un poinçon de 1,5 mm.
- Traiter les appareils et un fond en verre 6 puits bien plate avec le plasma d’oxygène pour 35 s, comme indiqué au point 2.6.
- Coller un dispositif caractéristique incliné à chaque lamelle de verre de la plaque 6 puits en le plaçant sur une plaque de cuisson 85 ° C pendant 10 min.
Remarque : Pour confirmer une liaison réussie, appliquer une pression ferme sur le côté de l’appareil collé à l’aide de pinces. L’appareil doit rester attachée à la lamelle de verre.
5. Culture de poisson-zèbre
- Embryons de poisson-zèbre culture à dpf 2 à l’aide de techniques standard3.
- Les embryons de Dechorionate à l’aide de forceps ou 1 mg/mL de protéase mélangent (voir Table des matières)3 au moins 30 à 60 minutes avant le chargement de dispositif, pour leur permettre de redresser.
- Anesthésier les embryons à l’aide de solution mère (168 mg/L) : MS-222 (pH 7.5) en ajoutant 1 mL de 25 X à l’E3 dans leur boîte de Pétri.
6. orientation du poisson-zèbre sur surfaces microstructurées - Divot tableaux
- Préparer le bloc PDMS de l’étape 2.7 (Figure 3 a) dans sa boîte de Pétri, telle qu’elle est couverte par une couche mince (1-2 mm) de l’E3, ce qui permet une manipulation plus facile des embryons.
- Transfert obligatoire nombre d’embryons (généralement 10 à 20 par État) sur la surface du bloc PDMS à l’aide d’une pipette de transfert.
- À l’aide d’un outil de micromanipulation (boucle de cheveux ou similaire), poussez les embryons dans les mottes de gazon microstructurées (Figure 3 a). Utilisation des mottes de gazon est particulièrement adaptée aux orientations dorsale et ventrale.
Remarque : Pour les mottes de gazon avec un resserrement fit (dorsale et ventrale), essayez les embryons de positionnement sur la surface du bloc en parallèle à la fourchettes et puis les rouler en position à l’aide d’une boucle de cheveux. Poussant plus profondément dans les fourchettes à gazon vont aidera à garder stable.
7. orientation du poisson-zèbre sur surfaces microstructurées - canaux microstructurés
- Retirer le bloc PDMS à motifs avec chaînes microstructurées (Figure 3 b) à l’aide d’une pipette de transfert jusqu'à ce que le niveau de l’E3 descend en dessous du bord du bloc, mais est toujours présent dans le réservoir et les canaux et en couche mince sur le PDMS de E3.
- Transférer 10 embryons d’étape 5.3 dans le réservoir à l’aide d’une pipette, en veillant à ne pas faire déborder les bords.
- À l’aide d’une boucle de cheveux, manipuler chaque embryon dans l’entonnoir à l’entrée du canal approprié et orienter de telle sorte que la tête de l’embryon est vers le canal et l’embryon a l’orientation appropriée à son entrée dans le canal.
- Glissez chaque embryon vers le bas de la chaîne à l’aide d’une boucle de cheveux jusqu'à ce qu’il atteigne l’orientation micro-caractéristiques dans les parois du canal qui aident à maintenir en place. Utilisation des canaux microstructurées est particulièrement recommandée pour l’orientation latérale.
Remarque : Pour réduire l’embryon glisser durant la microinjection, essayez de régler le montant de la tension superficielle en puisant E3 dans le réservoir.
8. la microinjection de poisson-zèbre
-
Préparer les aiguilles de microinjection.
- Faites de verre borosilicaté microcapillaire aiguilles utilisant un micropipettes comme décrit précédemment4. Les aiguilles qui en résulte doivent être conique jusqu'à un point situé à une extrémité, avec une longueur conique d’environ 10 mm.
- Préparer la solution à doser, dans ce cas 100 nM chemoattractant (N-formylméthionine-leucyl-phénylalanine (fMLP) ou leukotriène B4 (LTB4)) et 100 nM de 70 kDa, traceur des dextran Rhodamine dans du PBS.
- Charger 5 µL de solution dans l’aiguille à l’aide d’une pipette finement effilée Astuce (voir table des matières).
- Monter l’aiguille dans un micromanipulateur monté sur un support magnétique et relié à un microinjector de picopump.
- Briser la pointe de l’aiguille à un angle de 45 ° en pinçant l’extrémité effilée avec une pince.
- Ajuster la taille d’un bolus injection 1 nL en réglant le temps d’injection sur le contrôleur de picopump.
- Ajustez l’angle de l’aiguille de microinjection. Un angle de l’aiguille de 45 ° sur le contrôleur de micromanipulation est généralement un bon point de départ, avec l’aiguille parallèle à la longueur de l’embryon. Un angle plus raide peut être utilisé pour minimiser le mouvement latéral de l’embryon au cours de la microinjection.
- Contrôle de la boîte de Pétri avec la main gauche et le micromanipulateur aiguille avec la droite, amener l’aiguille aussi près que possible au lieu prévu de microinjection, dans ce cas la vésicule otique.
Remarque : La vésicule otique peut être identifiée comme l’orgue oblongue postérieure de le œil contenant deux petits sombres oblongues structures distinctes (otolithes). - En utilisant le contrôleur de micromanipulation, pénétrer le tissu cible (dans ce cas la vésicule otique) tel que la pointe de l’aiguille est dans la vésicule et injecter le volume prédéfini à l’aide de la pédale de commande picopump.
Remarque : Si le tissu résiste à la pénétration, essayez tapotant doucement le bouton de contrôleur de micromanipulation. - Pour libérer les embryons, flux E3 sur toute la surface du haut vers le bas à l’aide d’une pipette de transfert, ou en agitant le plat tel que les embryons sont libérés dans l’E3 environnantes.
- Transférer les embryons dans un plat de recouvrement de l’E3 sans MS-222, à l’aide d’une pipette de transfert.
9. sélection des embryons utilisant le PDMS dispositif d’imagerie
- Amorcer le dispositif de l’étape 4.7 par écoulement E3 (+ MS-222) via le port. Cela peut être fait en utilisant une pipette 1 000 µL ou une pipette en pointe étroite.
- Remplir le puits avec E3 + MS-222, jusqu'à ce que l’appareil est couvert.
- Remettre les 4 embryons injectées d’étape 8,7 dans chaque bien en utilisant une pipette de transfert. Les embryons peuvent être anesthésiés avant si vous le souhaitez en incubant en E3 + MS-222 pendant 1-2 min avant le chargement (étape 5.3).
- À l’aide d’un outil de micromanipulation (boucle de cheveux ou similaire), orienter les embryons à l’entrée des canaux d’imagerie dans l’orientation désirée (queue en premier ou tête la première, selon l’appareil utilisé) et poussez-les partiellement dans l’appareil (Figure 4 a). Cela aidera à attirer uniformément dans l’appareil.
- Dessiner E3 à travers le dispositif du port à l’aide d’une pipette de µL 1 000 ou d’une pipette de transfert jusqu'à ce que les embryons sont entraînés dans les chaînes dans le bon sens d’imagerie (Figure 4 b).
Remarque : Attention à ne pas sucer les embryons au-delà du point de piégeage, cela endommagera les embryons et modifier leur orientation. - Transfert de puits-plaque à microscope pour l’imagerie (Figure 4).
-
Image à l’aide d’un microscope inversé à fluorescent.
- Régler un grossissement en choisissant l’objectif approprié. 10 X est généralement un grossissement utile d’imagerie zebrafish migration neutrophiles.
- Ajuster l’intensité de la source lumineuse et la durée d’exposition pour chaque canal afin que chaque signal est clair, mais pas saturé.
- Capturer des images pour chaque canal. Ici, nous avons utilisé la protéine fluorescente verte (GFP, Ex : 470/22, Em : 525/50), Texas Red (TxRed, Ex : 585/29, Em : 628/32) et les canaux de transmission. Multicanal images peuvent être combinées au cours de post-traitement (Figure 4 b-I).
Résultats
L’approche décrite ici illustre la conception (Figure 1) et la fabrication de dispositifs à utiliser avec 2 dpf zebrafish, utilisant photolithographique (Figure 2) et techniques de soft-lithographiques (Figure 3). Cette méthode permet de tester rapidement de nombreuses itérations de conception et les modifications et altérations et optimisation des dimensions de la microstructure à utiliser avec le poisson-zèbre à d’autres stades de développement peuvent étendre leur application.
Nous montrons l’utilisation de ces dispositifs pour les techniques de microinjection difficiles et l’imagerie pratique. La vésicule otique (Figure 4, blanche en pointillés) fournit un site utile, privilège immunitaire et isolé pour tester les neutrophil recrutement zebrafish9. Pour tester la capacité des neutrophiles zebrafish pour répondre à la norme chimioattractants, 100 nM de fMLP et LTB4 étaient micro dans les vésicules otiques de 2 embryons de poisson-zèbre de dpf (Figure 4F, J), en utilisant le dispositif de canal microstructurés ( Figure 1) pour stabiliser les embryons dans l’orientation latérale. Injections ont été tracées à haut poids moléculaire dextran Rhodamine et effectuées dans des embryons de Tg(mpx:EGFP) pour faciliter la visualisation des neutrophil recrutement. Action des embryons (Figure 4, H) et les embryons injectés avec Rhodamine seul (Figure 4E, I) ont été utilisés comme témoins négatifs. Après microinjection, les embryons ont été transférés dans l’appareil d’imagerie de canal (Figure 1 a, B) et photographié à l’aide d’un microscope à fluorescence EVOS (Figure 4) à 30 min et 5 h après injection (Figure 4- G et Figure 4 H-K, respectivement). Comme prévu, un petit nombre de neutrophiles fluorescents ont été recruté à la vésicule otique mock-injecté à la validant au début (Figure 4I), probablement en raison de dommages par l’intermédiaire de recrutement. Fait intéressant, le traceur de dextran Rhodamine a été observé à s’accumuler dans les otolithes pendant l’expérience. Pour les deux chimioattractants (Figure 4F, J), les neutrophiles ont été recrutés en plus grand nombre, particulièrement en réponse à LTB4 (Figure 4F).
Les résultats représentatifs indiqués ici démontrent l’utilisation réussie de cette méthode pour la microinjection et imagerie du poisson-zèbre. Dans le cadre de tests de recrutement neutrophiles zebrafish, application de ces outils en combinaison avec détaillée des techniques d’imagerie live et sophistiqué cell migration analyse10 peut fournir une plate-forme utile pour de futures expériences dans ce domaine.

Figure 1 : dessin (CAD) conception des masques de photolithographie assistées par ordinateur. (A-C) Conception CAO pour microstructurées surfaces mottes de gazon pour le positionnement latéral (A), ventrales (B) et dorsale (C) orientations. Différentes lignes colorées représentent des dessins de CAO masque pour des caractéristiques différentes, avec vert 100 µm, bleu 200 µm et hauteurs de fonction rouge 400 µm. Echelle = 500 µm. (D-F) Conception CAO pour les canaux microstructurées pour positionnement dorsal (F) orientations latérale (D) et ventrale (E). Différentes lignes colorées représentent des dessins de masque pour des caractéristiques différentes, avec vert 100 µm, bleu 200 µm et hauteurs de fonction rouge 400 µm. Echelle : 500 µm. (G-j’ai) conception de CAO pour l’imagerie des dispositifs conçus pour chargement tête baissée (G) ou de la queue en premier (H et I). Lignes bleues représentent 400 µm caractéristiques, tandis que les lignes rouges représentent 600 µm caractéristiques. Les flèches indiquent le sens dans lequel les larves sont chargés. Echelle = 200 µm. Ce chiffre a été modifié par Ellett et al. 5 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
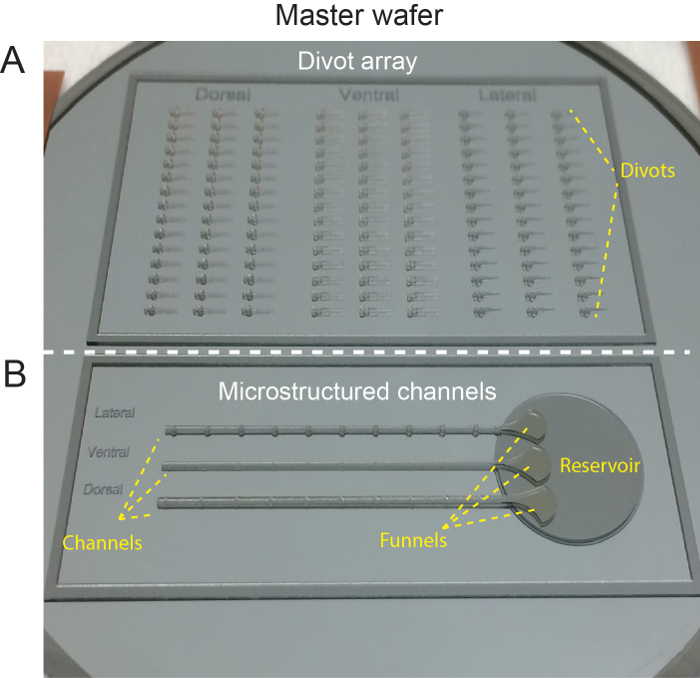
Figure 2 : plaquette maître Silicone. (A) la partie supérieure des caractéristiques montre wafer maître pour orienter les larves en mottes de gazon. (B) article de maître plaquette montrant la conception pour les canaux microstructurées de fond. Ce chiffre a été modifié par Ellett et al. 5 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : dispositifs de PDMS microstructurées. (A), PDMS bloc cast du maître plaquette montrant les mottes de gazon pour orienter les larves. (B) PDMS bloquer cast de maître plaquette montrant les canaux de la microstructure. Ce chiffre a été modifié par Ellett et al. 5 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : résultats représentatifs : imagerie recrutement des neutrophiles de poisson-zèbre après livraison de microinjection des chimioattractants dans la vésicule otique. (A-B) Chargement et montage des embryons pour l’imagerie. Dispositif de (A), la tête la première avec des embryons de prêts pour le chargement, avec la port indiqué (flèche noire). (B) le chargé des embryons après que qu’ils ont été entraînés dans la position (flèche jaune). (C) les plaques de fond en verre 6 puits avec dispositifs sur microscope d’imagerie. Ce format permet d’imagerie de 4 latéralement orientée embryons par puits (total 24 embryons), à l’aide d’un microscope inversé standard. (D-G) Neutrophiles (EGFP-vert) dans une action (D) embryon et suivant microinjection de la vésicule otique de dextran Rhodamine (arrowhead blanc rouge, ouvert) seul (E), 100 nM LTB4 (F) et 100 nM fMLP (G) 30 min après l’injection (mpi). (H-K) Neutrophiles (EGFP-vert) dans un action embryon (H) et 5 h après vésicule otique microinjection de dextran Rhodamine (arrowhead blanc rouge, ouvert) seule (j’ai), 100 nM LTB4 (J) et 100 nM fMLP (K) 5 h post injection ( HPI). Echelle = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous décrivons ici l’utilisation de périphériques, nous avons développé récemment pour faciliter 2 dpf zebrafish microinjection5et mettre en place un dispositif simple montage sans gel d’agarose pour l’imagerie commode d’embryons. Ces outils mettent en évidence l’utilité des techniques photolithographiques pour la fabrication de dispositifs utiles pour les techniques de poisson-zèbre.
Nous avons identifié les dispositifs MSA particulièrement utile pour l’injection de cellules ou de particules sujettes à agrégation au sein de l’aiguille de la microinjection, tels que les conidies fongiques ou de cellules cancéreuses humaines, qui nécessitent l’utilisation d’une aiguille de calibre plus gros pour la livraison. Injection dans la vésicule otique (Figure 4) présente un défi particulier, que des embryons roulent souvent au contact avec l’aiguille. Nous constatons que l’utilisation de canaux microstructurées qui orientent et stabiliser le poisson-zèbre dans un latéral orientation a grandement amélioré le débit et la précision de cette technique dans nos mains.
Pour l’imagerie rapide de zebrafish orienté latéralement à des moments différents, tels que l’évaluation du recrutement neutrophil ou métastases de xénogreffes, évitant d’agarose a augmenté de cohérence de montage entre les embryons et les chances réduites d’endommagement au cours du l’imagerie post sauvetage. Ces dispositifs aussi prometteuses pour l’imagerie laps temps prolongé et ont été utilisés avec succès capturer des images multicanaux, Multiplan, avec mouvement des poissons un minimum sur une période de 12 h. Parce qu’ils ne sont pas limités par l’agarose, élongation active des larves au cours de cette période (~ 300 µm de 54-78 hpf)11 est libre et peut procéder normalement.
Les étapes plus critiques dans la préparation et l’utilisation de ces outils sont communs à l’usage de la plupart des dispositifs microfluidiques PDMS basé : dispositifs doivent être entièrement mouillés et éviter les bulles. Pour éviter ces problèmes, mouiller les dispositifs en E3 immédiatement après que qu’ils sont fabriqués, tandis que la surface hydrophilicité conférée par traitement au plasma oxygène est toujours présente. Re-traitement par plasma oxygène permet également de rétablir transitoirement hydrophilicité ans PDMS dispositifs.
Les géométries précises utilisées ici profiter de la haute résolution des techniques photolithographiques, mais l’utilisation actuelle de limite des dessins de poisson-zèbre au cours de la deuxième fécondation après jour. Re-conception de géométries basé sur la plateforme actuelle permettrait à orientation réussie du 1 dpf et 3 dpf de microinjection. L’orientation des plus flottable 4 dpf larves avec gonflé la vessie natatoire serait probablement plus difficile et exigent des géométries douillettes en combinaison avec une tension plus élevée de l’eau. Des dispositifs complexes intégrant des flux ou passer l’aspirateur pourraient fournir une autre approche applicable à un large éventail de stades de développement, mais nécessitent également l’utilisation des pompes et des tuyaux, augmentant les coûts et les risques de défaillance du dispositif.
PDMS est un matériau économique, utile pour la fabrication de dispositifs comme ceux décrits ici, fournissant la biocompatibilité, la transparence et la réutilisation. Un inconvénient de l’utilisation de dispositifs PDMS pour poisson-zèbre est hydrophobe, ce qui peut rendre difficiles les entretien des couches superficielles de l’E3 sur la surface de l’appareil. Ce problème peut être évité en effectuant un cast des dispositifs de microinjection dans l’agarose, bien que cela limite la réutilisabilité et augmente la fragilité des dispositifs. Une variante préférée serait l’identification d’un traitement de surface biocompatible qui augmente la hydrophilicité de PDMS12, ou l’utilisation d’un substrat en plastique approprié.
Méthodes actuelles de microinjection de poisson-zèbre à dpf 2 utilisent soit de tension de l’eau4 ou canaux simple coulées dans l’agarose à l’aide de moules commerciaux pour immobiliser et positionner les larves. Ces approches fournissent un contrôle limité de l’orientation et peuvent être compliquées par un dessèchement rapide des embryons. Les microstructures intégrées dans les mottes de gazon et canaux utilisés ici visent à orienter et à immobiliser les larves sans dépendant entièrement du tension de l’eau, réduisant ainsi le risque de séchage. Mottes de gazon effectuées à l’aide de moules imprimés 3D avaient déjà été utilisés pour l’orientation d’embryons à des fins d’imagerie13bien que la profondeur de ces mottes rendait inaccessibles pour la microinjection.
Utilisation des systèmes microfluidiques pour l’imagerie de poisson-zèbre devient de plus en plus courante14.
Plusieurs intermédiaires systèmes ont été développés pour permettre l’observation du développement du poisson zèbre au fil du temps avec la possibilité d’introduire des composés sur demande15,16,17. Des dispositifs plus complexes ont été conçus pour les embryons de tableau dans leur chorion, qui fournit une géométrie sphérique simple qui peut être facilement manipulée avec un débit relativement élevé dans ces systèmes18,19. Plusieurs groupes ont développé des plates-formes de parant et d’imagerie zebrafish stade larvaire dans diverses orientations6,20, la plus facile à utiliser est la micropompe passive « Zèbre » système mis au point par le laboratoire de Beebe6 . Contrairement au système ZEBRA, le dispositif que nous décrivons ici utilise d’aspiration, généré à l’aide d’une pipette de transfert standard, pour dessiner les larves dans les canaux, pendant le chargement parallèle plutôt que séquentiel des larves permet le sauvetage des larves individuels, l’imagerie par appliquer un flux positif à travers le même port. En outre, notre approche nécessite une plus petite empreinte, dispositifs PDMS peuvent se greffer sur plaques 6 puits conventionnels fond en verre pour l’imagerie.
Le protocole expérimental actuel utilise des dispositifs distincts de microinjection et d’imagerie principalement afin qu’ils peuvent être utilisés avec l’équipement conventionnel de la microinjection et norme inversé des microscopes. Approches de microfluidique de microinjection automatisée d’oeufs de poisson-zèbre déjà existent21, et en combinaison avec des méthodes de type de « poisson-piège » pour parant extrêmement précis et l’orientation des larves de20, il est prévisible que les dispositifs intégrant imagerie et injection de larve automatisée peuvent aussi devenir un jour une réalité.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêt.
Remerciements
Les auteurs tiennent à remercier David Langenau qui généreusement l’espace aquarium ; Eric Stone, John C. Moore et Qin Tang pour aident avec la maintenance de poisson-zèbre et réactifs et Anne Robertson Elliott Hagedorn du laboratoire de Leonard Zon pour se procurer la souche de poisson-zèbre utilisée ici. Ils tiens également à remercier Octavio Hurtado pour obtenir des conseils sur les techniques photolithographiques. FE a été financée par les bourses de recherche de l’Hôpital Shriners pour enfants et l’Association américaine de l’australien. Ce travail a été financé par les NIH grant GM92804.
matériels
| Name | Company | Catalog Number | Comments |
| Dow Corning Sylgard 184 Polydimethylsiloxane (PDMS) | Ellsworth Adhsives | 184 SIL ELAST KIT 0.5KG | For casting the devices. Kit includes PDMS monomer and Initiator |
| Low gelling temperature agarose | Sigma Aldrich | A9414-10G | For casting agarose devices |
| PFDTS silane | Sigma Aldrich | 448931-10G | For casting of negative PDMS molds |
| Tricaine (MS-222) | Sigma Aldrich | E10521-10G | To anesthetize zebrafish |
| Rhodamine Dextran 70,000 Da | ThermoFisher | D1818 | To trace microinjections |
| Leukotriene B4 (LTB4) | Cayman Chemicals | 20110 | Neutrophil chemoattractant |
| N-Formylmethionine-leucyl-phenylalanine (fMLP) | Sigma Aldrich | F3506-50MG | Neutrophil chemoattractant |
| 15 cm Petri dish | Fisher scientific | 08-757-148 | For Casting from the master wafer |
| Glass-bottom 6-well plates | MatTek | P06G-0-20-F | For imaging devices |
| Borosilicate glass microcapillaries | World Scientific Instruments | TW-100-4 | For microinjection needles |
| Transfer pipettes | Sigma Aldrich | Z350796 | For transferring zebrafish embryos |
| Microloader tips | Fisher scientific | E5242956003 | For loading the microinjection needles |
| Harris Uni-Core 1.5 mm punch | Ted Pella Inc. | 15111-15 | To punch ports in PDMS imaging devices |
| No. 11 Scalpel | Fine Science Tools | 10011-00 | For cutting PDMS |
| Dumont No. 5 Forceps | Fine Science Tools | 11252-10 | For dechorionating embryos and breaking microinjection needle tips |
| Marzhauser Micromanipulator | ASI | MM33-R | For manipulating microinjection needle |
| Magnetic stand | MSC | SPI - 87242624 | For mounting micromanipulator |
| MPPI-3 Picopump controller | ASI | MPPI-3 | To control microinjection volume and timing |
| EVOS inverted fluorescent microscope | ThermoFisher | EVOS FL | To image injected embryos |
| Dissecting microscope | Nikon | SMZ745 | For visualizing microinjecion |
| AutoCAD software | Autodesk | Download AutoCAD files from: https://dx-doi-org.remotexs.ntu.edu.sg/10.6084/m9.figshare.4282853 and on the ZFIN community protocols wiki page: https://wiki.zfin.org/display/prot/ZFIN+ Protocol+Wiki |
Références
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8 (5), 353-367 (2007).
- Dang, M., Fogley, R., Zon, L. I. Identifying Novel Cancer Therapies Using Chemical Genetics and Zebrafish. Adv Exp Med Biol. 916, 103-124 (2016).
- Westerfield, M. The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , University of Oregon. (2000).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. (61), (2012).
- Ellett, F., Irimia, D. Microstructured Surface Arrays for Injection of Zebrafish Larvae. Zebrafish. 14 (2), 140-145 (2017).
- Bischel, L. L., Mader, B. R., Green, J. M., Huttenlocher, A., Beebe, D. J. Zebrafish Entrapment By Restriction Array (ZEBRA) device: a low-cost, agarose-free zebrafish mounting technique for automated imaging. Lab Chip. 13 (9), 1732-1736 (2013).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J Vis Exp. (119), (2017).
- Shao, G., Wu, J., Cai, Z., Wang, W. Fabrication of elastomeric high-aspect-ratio microstructures using polydimethylsiloxane (PDMS) double casting technique. Sens Actuators A Phys. 178, 230-236 (2012).
- Bhuiyan, M. S., et al. Acinetobacter baumannii phenylacetic acid metabolism influences infection outcome through a direct effect on neutrophil chemotaxis. Proc Natl Acad Sci U S A. 113 (34), 9599-9604 (2016).
- Henry, K. M., et al. PhagoSight: an open-source MATLAB® package for the analysis of fluorescent neutrophil and macrophage migration in a zebrafish model. PloS one. 8 (8), e72636(2013).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dynam. 203 (3), 253-310 (1995).
- Hemmilä, S., Cauich-Rodríguez, J. V., Kreutzer, J., Kallio, P. Rapid, simple, and cost-effective treatments to achieve long-term hydrophilic PDMS surfaces. Applied Surface Science. 258 (24), 9864-9875 (2012).
- Masselink, W., Wong, J. C., Liu, B., Fu, J., Currie, P. D. Low-cost silicone imaging casts for zebrafish embryos and larvae. Zebrafish. 11 (1), 26-31 (2014).
- Yang, F., Gao, C., Wang, P., Zhang, G. J., Chen, Z. Fish-on-a-chip: microfluidics for zebrafish research. Lab Chip. 16 (7), 1106-1125 (2016).
- Wielhouwer, E. M., et al. Zebrafish embryo development in a microfluidic flow-through system. Lab Chip. 11 (10), 1815-1824 (2011).
- Shen, Y. C., et al. A student team in a University of Michigan biomedical engineering design course constructs a microfluidic bioreactor for studies of zebrafish development. Zebrafish. 6 (2), 201-213 (2009).
- Li, Y., et al. Zebrafish on a chip: a novel platform for real-time monitoring of drug-induced developmental toxicity. PLoS One. 9 (4), e94792(2014).
- Akagi, J., et al. Miniaturized embryo array for automated trapping, immobilization and microperfusion of zebrafish embryos. PLoS One. 7 (5), e36630(2012).
- Akagi, J., et al. Fish on chips: Microfluidic living embryo array for accelerated in vivo angiogenesis assays. Sens Actuators B Chem. 189, 11-20 (2013).
- Lin, X., et al. High-throughput mapping of brain-wide activity in awake and drug-responsive vertebrates. Lab Chip. 15 (3), 680-689 (2015).
- Noori, A., Selvaganapathy, P. R., Wilson, J. Microinjection in a microfluidic format using flexible and compliant channels and electroosmotic dosage control. Lab Chip. 9 (22), 3202-3211 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon