Method Article
Mise en place du poisson-zèbre larvaire comme modèle Animal pour enquêter sur Trypanosoma cruzi motilité In Vivo
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans ce protocole, fluorescent étiquetés T. cruzi ont été injectées dans des larves de poisson zèbre transparent, et la motilité de parasite a été observée in vivo à l’aide de la microscopie de fluorescence nappe de lumière.
Résumé
La maladie de Chagas est une infection parasitaire causée par Trypanosoma cruzi, dont la motilité n’est pas seulement importante pour la localisation, mais aussi pour la liaison cellulaire et l’invasion. Actuelle des modèles animaux pour l’étude de T. cruzi permettent observation limitée des parasites in vivo, représente un défi pour le comportement parasite compréhension pendant les étapes initiales de l’infection chez les humains. Ce protozoaire a un stade flagellaire en vecteurs et hôtes mammifères, mais il n’y a aucune étude décrivant sa motilité in vivo. L’objectif de ce projet était d’établir un modèle de poisson-zèbre vertébrés vivants afin d’évaluer la motilité de T. cruzi dans le système vasculaire. Poisson-zèbre transparent larves ont été injectés avec fluorescent étiqueté trypomastigotes et observé à l’aide de la microscopie de fluorescence de nappe de lumière (LSFM), une méthode non invasive pour visualiser des êtres vivants avec une haute résolution optique. Les parasites pourraient être visualisées pendant de longues périodes de temps en raison d’un risque relativement faible de cette technique de photovieillissement comparée à confocale ou microscopie à épifluorescence. T. cruzi parasites ont été observés voyageant dans le système circulatoire du live poisson zèbre dans différentes tailles de vaisseaux sanguins et le jaune. Ils pourraient également considérer associées à la paroi du sac vitellin et à la valve atrioventriculaire malgré les forces fortes associées à des contractions cardiaques. LSFM de T. cruzi-larves de poisson zèbre inoculés est une méthode utile qui permet de visualiser la circulation des parasites et d’évaluer leur tropisme, schémas de migration et mobilité dans l’environnement dynamique du système cardio-vasculaire d’un animal vivant.
Introduction
La maladie de Chagas est causée par le protozoaire parasite T. cruzi. Dans le monde environ 6 à 7 millions de personnes sont infectées par T. cruzi. La maladie se transmet principalement en Amérique latine, mais a été rapportée dans les États-Unis, Canada et nombreux européenne ainsi que certains pays du Pacifique occidental, principalement en raison de la migration des individus infectés1. Chagas est en grande partie vectorielle et transmises aux humains par contact avec les excréments d’insectes hematophagic dans la sous-famille des Triatominae, communément appelé « kissing bugs ». Cependant, T. cruzi peut également être transmis par l’intermédiaire de transfusions sanguines, transfert vertical de la mère à l’enfant, ou ingestion d’aliments contaminés par des parasites2. La phase aiguë de l’infection est principalement asymptomatique ou symptomatique constitutivement et dure de 6 à 8 semaines, après quoi l’engagement du système immunitaire contrôle la charge parasitaire, mais n’élimine pas complètement l' infection3. La plupart des individus, puis entrez une phase chronique asymptomatique ; Cependant, presque 30 % des patients développent une phase chronique symptomatique, dans lequel le système cardiaque et moins fréquemment le systèmes digestif et nerveux sont compromis4. Ce scénario représente un défi pour le contrôle et le traitement des maladies, puisqu’il n’existe aucun vaccin, et il n’y a que deux médicaments efficaces pour Chagas : benznidazole et nifurtimox. Les deux traitements nécessitent une administration prolongée et peuvent avoir des effets secondaires graves2.
Meilleure compréhension du comportement de T. cruzi , comportement in vivo , est essentielle pour déterminer la migration parasitaire, attachement cellulaire et invasion au sein de l’hôte ; absence de in vivo modèles limite le développement de nouvelles approches thérapeutiques. Des études in vitro de l’infection par T. cruzi ont montré que la motilité des trypomastigotes est importante pour la liaison aux membranes des cellules hôtes et l’invasion cellulaire subséquente5. Épuisement énergétique en trypomastigotes en co-culture avec une lignée de cellules sensibles a été montré pour réduire invasion cellulaire6. Fait intéressant, dans trypanosomatidés, mouvement flagellaire également a été caractérisé comme un mécanisme de fraude contre le parasite spécifique anticorps7.
Motilité flagellaire a été étudiée in vitro à Trypanosoma brucei, étroitement apparenté parasite qui provoque la trypanosomiase africaine,8. Des études in vitro de la motilité des ces trypanosomes a montré que la simulation des conditions de sang ou de liquides organiques, y compris la viscosité et la présence d’obstacles représentatifs des globules, est importante pour le mouvement vers l’avant parasite9 . Comme des encore il n'a pas été possible de visualiser la circulation des parasites dans le sang in vivo.
Les larves de poisson zèbre sont un modèle puissant pour l’étude d’interactions hôte-pathogène in vivo. Ils sont petits, peu coûteux et relativement facile à élever en comparaison avec les autres modèles de vertébrés établis pour la maladie de Chagas. Poisson zèbre ont un système immunitaire inné et adaptatif semblable aux humains, mais leur système immunitaire adaptatif commence à se développer à 4 jours après la fécondation (dpf) et n’est pas mature pour encore plusieurs semaines10. Au début du développement, lorsque seuls les macrophages sont présents, il y a une grande fenêtre pour l’étude de comportement parasite sans interférence immunitaire immédiate10. Cependant, le plus grand avantage de l’utilisation des larves de poisson zèbre comme modèle vertébré pour étudier le comportement de l’agent pathogène se trouve dans leur transparence optique, ce qui les rend susceptibles de microscopiques de dépistage et d’imagerie11. En outre, il existe plusieurs outils pour manipuler les poissons génétique. Par exemple, la souche de Casper est une lignée mutante de poissons zèbres sans pigmentation, rendant l’animal complètement transparente et utile pour la visualisation des organes individuels et suivi en temps réel des cellules injectées12.
Une limitation clée d’observation longitudinale des parasites rapidement mobiles en direct zebrafish utilisant confocale ou microscopie à épifluorescence réside dans l’impossibilité de l’imagerie à acquisition haute vitesse et les profondeurs de pénétration importante avec bonne qualité d’image et faible risque du photovieillissement. Nappe de lumière fluorescence micsroscopy (LSFM) est une technique d’imagerie émergente qui surmonte ces limites afin de permettre à ces observations. En utilisant l’un des objectifs pour détecter la fluorescence et un deuxième objectif illumination orthogonale qui éclaire seulement le plan focal de l’objectif de détection, il est possible d’obtenir des sections optiques de haute résolution que dans un microscope confocal, mais significativement réduite photovieillissement, même à l’égard de la microscopie de fluorescence incidente13. La technique LSFM utilisée ici est appelée seul avion Illumination microscopie (SPIM), dans laquelle une mince feuille de lumière éclaire un plan unique dans les larves de poisson zèbre.
L’objectif de cette méthodologie doit établir zebrafish larvaire comme un modèle d’infection non viable pour comprendre la motilité de T. cruzi et leurs comportements en vivo. Pour ce faire, nous avons injecté des larves de poisson zèbre transparent avec fluorescent étiquetés trypomastigotes, la forme cellulaire responsable de l’infection chez les humains et identifié le mouvement de T. cruzi dans la circulation cardio-vasculaire du poisson-zèbre à l’aide de LSFM.
Protocole
les protocoles suivants ont été approuvés par l’animalier institutionnel et utilisation Comité de Los Andes Université (CICUAL). Niveau de biosécurité 2 (BSL-2) lignes directrices doivent être strictement respectées pour empêcher la contamination par l’agent pathogène T. cruzi.
Remarque : entretien et soin des animaux : Casper zebrafish, une souche génétiquement modifiée de poisson-zèbre (Danio rerio) est utilisé dans le présent protocole en raison de leur transparence optique valable dans tous les stades de développement. Poissons sont manipuler avec soins optimaux des conditions pour l’espèce 14, dans un 14 h lumière à 10 h foncé cycle, à 28 ± 1 ° C, un pH (7.0 à 7.4) contrôlées multi-réservoir recirculation d’aqueduc. Les animaux sont nourris deux fois par jour avec live artémia (Artemia salina) et enrichies en nourriture d’élevage. Tous les protocoles ont été approuvés par CICUAL Universidad de Los Andes (C.FUA_14-017).
1. préparation de l’eau oeuf
sel d’aquarium de 0,6 g/L de- préparer à inverser l’osmose inverse (RO) ou l’eau désionisée (DI) et ajoute la solution de bleu de méthylène de 0,01 mg/L.
Remarque : La conductivité mesurée doit affleurer de 400-500 µS/cm et le pH à 7,2-7,9. Pour abaisser le pH, aérer l’eau de le œuf pendant quelques heures.
2. Préparation de la Solution Stock de tricaïne
solution mère de tricaïne 0,4 %- Prepare en dissolvant les 400 mg tricaïne (MS-222) à 97,9 mL d’eau distillée (ddH 2 O). Lorsque la poudre est entièrement dissout, ajuster le pH à 7.0 à l’aide de 2,1 mL 1M Tris (pH 9,0) et réfrigérer la solution.
3. Préparation de 1,0 % faible Point de fusion Agarose
- dissoudre la poudre d’agarose point fusion faible dans l’oeuf l’eau à une concentration finale de 1,0 %. Chauffer le mélange au micro-ondes ou sur une plaque chauffante avec continue en remuant jusqu'à ce que la solution d’agarose apparaît homogène.
- Stocker les aliquotes à 4 ° C pour pas plus d’une semaine.
4. Accouplement de dosage et collecte d’embryons
- trois jours avant les injections mis en place des accouplements à l’aide de paires en bonne santé des poissons mâles et femelles dans les réservoirs d’élevage. Enrichissement avec billes de verre et de plantes artificielles améliore la fraye. Accouplements devraient être mis en place au cours de l’après-midi et laissés toute la nuit.
- Le lendemain matin, recueillir les oeufs pondus par la vidange du réservoir à travers une passoire et laver les oeufs avec l’eau de le œuf. Enlever tous les oeufs en inversant la crépine et verser de l’eau oeuf à travers la passoire dans une boîte de Pétri. Pour conserver les embryons sains, nettoyer leur eau en enlevant les débris et les embryons morts avec une pipette en plastique.
- Transférer les embryons dans un incubateur à une température stable de 28,5 ° C afin de permettre le développement des embryons selon le poisson-zèbre de normes mise en scène 15. Examiner les embryons deux fois par jour et rejeter non-viables oeufs pour maintenir l’embrayage en bonne santé.
5. Embryon Dechorionation
Remarque : cette procédure est nécessaire si les embryons n’ont pas éclos au moment de l’injection. Dans cette procédure, " larves " sont les animaux hors de leur chorion de 48 h après la fécondation (hpf) onward.
- Le jour de l’expérience, placez la boîte de Pétri contenant les embryons sains dans un stéréoscope dissection.
- Saisir les extrémités opposées du chorion avec deux pinces pointus (Dumont #5), et délicatement lacrymogènes et tirer le chorion. Environ 5-6 larves sont injectés à la fois et en général 3-4 sont imagés.
- Enlever les chorions de l’eau à l’aide d’une pipette en.
6. Préparation du matériel d’Injection
- préparer 1,0 mm aiguilles utilisant des capillaires en verre à paroi fine et un dispositif d’extracteur de micropipette avec les paramètres suivants : 2 poids légers + 1 poids lourd, tirez dessus 2 mm + 5 mm bas pull, 75,9 ° C (étape 1) + (78,2 ° C Étape 2). Stocker des aiguilles dans une boîte de Pétri sur une bande de modeler. L’aiguille idéal devrait avoir une pointe étroite, T. cruzi mesurent environ 20 x 1-3 µm et passera facilement à travers l’aiguille. La longueur de la pointe peut varier : un embout plus long est utile pour atteindre des structures profondes, mais une pointe plus courte sera plus rigide facilitant l’injection pour l’utilisateur.
Remarque : La taille de pointe aiguille dépend de la température : une température plus élevée pour l’étape 2 se traduit par un embout plus long et plus fin. - Préparer une solution à 1,5 % d’agarose dans ddH 2 O et versez-la dans une boîte de Pétri de 10 cm. Couvrir d’une profondeur d’environ 1,0 cm.
- Recouvrir un moule de microinjection préfabriqués de l’agarose et laisser solidifier.
- Soulever le moule de microinjection préfabriqués sur et ajouter eau oeuf pour le stockage à 4 ° C. Cela empêche l’agarose ne se dessèchent pas.
- Eau oeuf ajouter à la solution mère de tricaïne à une concentration finale de 150 mg/L. magasin à 4 ° C.
7. Culture de cellules pour la croissance du Parasite
- Parasites sont maintenues dans une lignée de cellules humaines astrocytome (LCR-1718) à l’aide de la méthode décrite par Vargas-Zambrano et al. 16
- commencer la culture de cellules humaines dans des flacons de culture T25 (surface habitable = 25 cm 2) à une densité de 2 x 10 5 ou 4 x 10 5 cellules dans 4 mL de milieu RPMI 1640 avec 10 % de sérum de veau foetal (FCS), complétée avec 2 mM de L-glutamine, 4,5 g/L de glucose, 10 mM HEPES, pyruvate de 1 mM et 1 % la pénicilline-streptomycine (appelés " toutes les médias "). Incuber les cultures astrocytome à 37 ° C dans un environnement de 2 5 % CO.
- Une fois une monocouche confluente, détacher les cellules à l’aide de 2 mL de 0,25 % de trypsine-EDTA en incubant eux pendant 3 min à 37 ° C. visuellement cocher cellules de détachement et bloquer la solution de trypsine à l’aide de 3 mL de milieu RPMI 1640 avec 10 % de FCS dans un tube de 15 mL.
- Centrifuger la suspension cellulaire pendant 5 min à 1 350 x g.
- Laver le culot cellulaire qui en résulte dans un milieu DMEM dans un tube de 15 mL et centrifuger pendant 5 min à 1 350 x g à 22 ° C.
- Compter les cellules manuellement dans une chambre de Neubauer et recherchez de viabilité dans un microscope optique avec grossissement de 40 X.
- Doucement remis en suspension cellulaire de granule dans 4 mL de médias complet et utilisez-le pour créer de nouvelles cultures de cellules à l’aide de 2 x 10 5 cellules par flacon de culture T25.
8. T. cruzi Culture et l’étiquetage des produits
- Parasites sont une souche à l’origine provenant d’un humain infecté et caractérisée comme souche de T. cruzi DA (MHOM/CO/01/DA), génotype TcI unité discrète de dactylographie (DTU) 16. Après 3 ou 4 jours de culture, recueillir les parasites mobiles du surnageant de culture de cellules humaines astrocytome et centrifuger pendant 5 min à 1 350 x g. jeter le milieu.
Remarque : Les Parasites en milieu complet peuvent être utilisés pour re-culture dans un rapport 1:1 avec cellules d’un astrocytome dans les flacons de culture T25. - Doucement Resuspendre le culot dans 10 mL stérile 1 x salin de tampon Phosphate (PBS) avec 0,1 % FCS et centrifuger pendant 5 min à 1 350 x g.
- Jeter le surnageant et remettre en suspension dans 1 mL de PBS. Prendre 10 µL pour compter les parasites nageant libres dans une chambre de Neubauer.
- Prendre le reste des parasites remises en suspension (990 µL) et ajouter 1 µL de carboxyfluorescéine diacétate de Succinimidyl Ester (CFSE), concentration finale 5.0 µM. Incuber pendant 10 min à température ambiante.
Remarque : Stock CFSE à 5 mM doit être aliquotés et entretenu à -20 ° C. - à pellets les parasites (1 350 x g, 5 min). Reconstituer le culot de parasite en effleurant le tube et les laver dans 10 mL de 1 x PBS-0.1% FCS suivie d’une rotation ultérieure (1 350 x g, 5 min).
- Jeter le surnageant et doucement Resuspendre le culot de parasite marqués en 1 X PBS avec le volume approprié pour obtenir une concentration finale d’environ 10-20 parasites/nL injectable.
- Utiliser un petit volume (∼ 10 µL, environ 1 x 10 4 -2 x 10 4 parasites) des trypomastigotes afin d’évaluer la viabilité et l’étiquetage. Un microscope à fluorescence inversé peut être utilisé pour une visualisation directe des parasites. Dans le mode lumière transmis, vérifier que les parasites se déplacent. Dans le mode de fluorescence, utilisez le filtre de l’Isothiocyanate de fluorescéine (FITC) pour évaluer l’étiquetage parasite.
9. Injection de larves de poisson zèbre
- Parasite de chargement
- prendre 10 µL de parasites de la remise en suspension (100 µL) et de les charger dans les aiguilles de verre scellé à l’aide d’une pointe de pipette 10 µL microloader.
- Introduire l’aiguille de verre dans le porte-aiguille du micromanipulateur, utiliser un support magnétique et placer à côté du stéréoscope.
- Using pince fine sous le stéréoscope, couper l’aiguille créant un émoussé ouvert fin et mesurer la taille des gouttes pour obtenir un volume d’injection de 1 nL (ce qui équivaut à un diamètre de talon de 0,12-0,13 mm lorsqu’elle est mesurée à l’huile minérale, 17). Un embout plus long est préférable pour que l’aiguille peut atteindre des structures profondément à l’intérieur du poisson sans agresser le tissu. Dans ce protocole, une aiguille émoussée est utilisée, mais peut servir aussi bien une aiguille biseautée.
- Montage
- anesthésier les larves de 48 hpf, avec tricaïne 150 mg/L. Vérifiez qu’ils ne répondent pas au toucher, mais faire en sorte que le cœur bat.
- Placer les larves dans le moule d’agarose microinjection dans une position latérale.
- Placer le porte-aiguille à côté le stéréoscope et régler le micromanipulateur afin que la pointe de l’aiguille est au centre du champ de vision. Déplacer la boîte de Pétri préparé en étapes 6.2 à 6.4 afin que le jaune larvaire se trouve à proximité de la pointe de l’aiguille. Vérifier l’état de la larve à veiller à ce que le cœur continue de battre.
- Définir les valeurs de microinjector comme suit : injection 9,6 livres par pouce (psi) de pression ; maintient la pression : 20 lb/po2 ; 100 ms plage de déclenchement ; valeur de période de 1,9 (correspond à 10,9 ms). Le volume d’injection doit être comprise entre 1-3 nL, avec environ 10-20 parasites/nL.
10. Injection du Parasite
- Inject le poisson dans la partie supérieure-antérieure du jaune à la gaine de Cuvier. Cette étape doit être pratiquée afin d’assurer la survie animale après l’injection. Il faut environ 10 min pour injecter avec succès des larves de 5-6.
- Comme un contrôle, injecter des larves de 1-2 avec le même volume de véhicule (solution de 1 PBS x).
- Transférer immédiatement la larve des œufs de l’eau.
11. LSFM montage d’injecté larves
- transférer la larve injectée avec parasites à une boîte de Pétri vide et retirer délicatement l’eau environnante avec une pipette en plastique et du papier absorbant. Immédiatement ajouter 100 µL de préchauffé 1,0 % d’agarose point de fusion bas (reportez-vous à l’étape 3 pour préparation d’agarose) pour couvrir la larve. S’assurer que l’agarose n’est pas plus de 40 ° C.
- Insérer un fil droit dans un verre de 1.0 mm capillaire et utilisez-la comme un piston pour aspirer la larve en position verticale. Veillez à laisser une petite quantité de gel d’agarose au-dessus de la larve. Attendez que l’agarose se solidifie avant d’exposer la larve (cela nécessitera quelques minutes). Si nécessaire, faire sortir l’excès d’agarose au-dessous de la larve et coupez-le off
- Placer le capillaire dans le porte-échantillon microscope et retirer l’extrémité contenant la larve, jusqu'à ce qu’il se bloque gratuite de capillaire. La chambre de l’échantillon doit être remplie avec la solution de tricaïne (150 mg/L) et la température réglée à 28 ° C.
- Position de la larve en face de la pupille de l’objectif de la détection à l’aide d’un système de XYZ-micromanipulateur. Pour les rotations autour de l’axe vertical, utilisez une platine de rotation. Positionnement de la larve doit se faire en mode lumière transmise pour identifier clairement les structures larvaires.
12. LSFM Imaging d’injecté Parasites
mode- changement de fluorescence et d’ajuster l’intensité de l’éclairage ainsi que la durée d’exposition à diminuer le photovieillissement et optimiser la résolution temporelle. Pour ces expériences particulières, nous avons utilisé une puissance de 2,8 à 3,0 mW pour l’échantillon et exposés chaque image pendant 200 ms en utilisant une caméra avec 6,45 µm pixels et efficacité quantique ~ 70 % dans les longueurs d’onde de détection. Ces paramètres devraient se traduire par des images correctement exposées à environ 5 images/s. Assurez vous d’utiliser un objectif avec la plus forte ouverture numérique possible.
- Démarrer une acquisition vidéo de la région d’intérêt (ROI). Dans notre cas, parasites sont observées attachée à vannes et librement mobiles autour de la zone de cœur. Il est recommandé de prendre une vidéo d’un seul plan au fil du temps, ou d’utiliser le système micromanipulateur ou piézo-galvo à concentrer des plans différents, tandis que le parasite se déplace.
Remarque : Cette procédure est utile pour les délais d’acquisition court jusqu'à 2 h. Pour l’acquisition à long terme, les larves doivent être montés à l’aide de méthodes alternatives 20.
13. Traitement et analyse des données acquises d’images
Remarque : traitement de l’Image a été réalisée sur un ordinateur personnel avec un processeur de 2,90 GHz, 8,00 Go de mémoire et une carte vidéo avec 1,00 Go de mémoire.
- Ouvrir l’acquis dataset dans le logiciel de choix de traitement d’image. L’air libre logiciel Fidji est recommandée pour LSFM informatique et analyse 21.
- Dans le logiciel d’analyse image, régler les niveaux de luminosité et de contraste pour améliorer les images.
Remarque : Aucun des paramètres fixes ne sont utilisés dans ce cas, mais en sélectionnant le " Auto " option peut être utile d’obtenir une amélioration initiale. - Sélectionner le ROI.
Remarque : Pour le suivi des différents parasites, les Fidji ont les deux plugins de suivi automatique et manuel disponibles.
14. Récupération des larves imagés
- enlever la larve soigneusement de l’agarose à l’aide de pinces fines et un outil de boucle de cheveux. Transférer le poisson à l’eau œufs frais et vérifiez pour la récupération après 15 min. retourner la larve à l’incubateur à 28 ± 0,5 ° C.
- Sinon, passez à l’euthanasier les larves imagés avec une surdose de tricaïne. Ensuite, introduire les larves dans une solution d’hypochlorite de sodium (6,15 % NaClO) pendant 5 min tuer le parasite. Disposer selon l’institution ' les protocoles standard de s.
Résultats
Conditions optimales pour l’Injection :
Groupes de larves de poisson zèbre ont été injectés à 24, 48, 72, 96 et 120 hpf, sur différents sites anatomiques et leur survie a été examiné chaque jour pendant 5 jours. Après 5 jours après l’injection, les embryons injectés à 24 hpf a 6,25 % survie (2/32), alors que 95 % (38/40) des larves injectés à 48 hpf ont survécu. Comme un contrôle, les larves ont été injectés avec solution 1 PBS x comme un véhicule. Il n’y a aucune différence de survie entre les véhicules à injection et injection parasite des larves, n’indiquant aucun effet parasite dépendant sur les taux de survie des poissons (p = 0,08). Larves injectés entre 72 à 120 hpf avaient les taux de survie comparable à 48 larves hpf-injecté à volume constant d’injection. De toutes les méthodes présentées ici, 48 larves hpf ont été utilisées en raison de leur facilité de manipulation et ayant développé des organes et la peau facilement pénétrable sans dommage évident après l’injection.
Larves injectés à 48 hpf ont été injectés dans l’espace péricardique, queue musculaires, ventricule du cerveau postérieur, vésicule otique, notochorde et conduit de Cuvier dans le sac vitellin. Il n’y a aucune différence dans la survie des larves injecté à différents sites anatomiques. Toutefois, la région la plus rapide et plus facile d’injecter a été que le canal de Cuvier situé dans la partie antérieure du sac vitellin (Figure 1, Movie 1). Des injections à cet endroit a permis l’introduction des volumes plus élevés, avec un moindre risque de blessures aux structures vitales. En outre, entre 24-72 hpf, cette région est un site optimal pour accéder directement à la vascularisation en développement et cœur,11.
Visualisation du parasite à l’aide de LSFM :
Moins de 8-10 min après injection de T. cruzi dans le canal de Cuvier, parasites ont été identifiés chez les larves de poisson zèbre utilisant LSFM en raison de leur signal fluorescent CFSE et la transparence optique des larves. Après l’inoculation, les parasites ont été observés que soit respecté des murs autour de l’appareil circulatoire ou voyageant dans le sens de la circulation sanguine (Figure 2, Figure 3). Quand un parasite reste attaché à une structure cardiaque, comme la valve auriculo-ventriculaire, elle oscille avec des contractions du cœur, ce qui indique que les mécanismes moléculaires de l’adhérence des parasites pourraient être efficaces pour notre modèle de vertébrés (film 2, film 3 Film supplémentaire 1). T. cruzi a aussi adhéré aux parois de la vésicule vitelline larvaire ( Figure 2, le film 2), une structure qui sera plus tard réabsorbée et faire partie de l' intestin du poisson-zèbre22. Cela pourrait être similaire à ce qui se passe au cours de la phase chronique de la maladie chez les humains infectés, où les parasites sont trouvent dans les cardiomyocytes et dans le système nerveux digestif23,24. Lorsqu’il est ne pas attaché, les parasites ont dérivé à travers le flux sanguin dans la même direction que les érythrocytes ( Figure 3, séquence 4). Parasites, a peuvent être observés dans des bateaux de tailles différentes des poissons, mais sont plus abondants dans l’espace péricardique et dans la région de vitellus adjacent contenant du débit sanguin ( Figure 2, Figure 3, film supplémentaire 2).
10 min après l’injection, il est plus difficile à spots unique formes du parasite en raison de leur distribution le long de la vascularisation et une incapacité à rapidement écran différents sièges anatomiques du poisson en raison d’un champ de vision limité de la LSFM (grossissement 40 X ). Après 24 h après injection (hpi), le signal CFSE commence à s’accumuler dans la région près de l’intestin en développement (complémentaire figure 1).
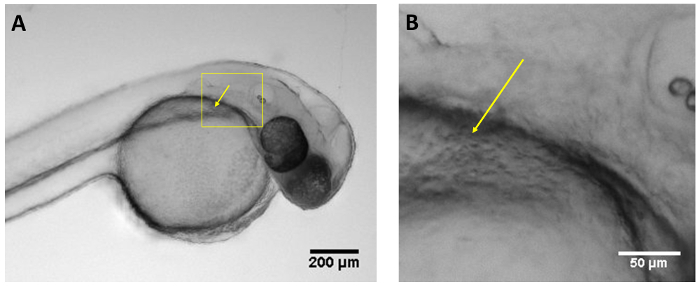
Figure 1 : Site d’injection optimale. (A) Image de larve 48 hpf montrant le site d’injection optimal dans le conduit de Cuvier (flèche jaune) à l’aide d’un stéréoscope ordinaire. (B) Magnified Découvre de boîte dans un affichage de la gaine de Cuvier (flèche jaune). Echelle = 200 µm (A), 50 µm (B). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Des images d’un parasite statique dans une larve de hpf 48 LSFM. Le parasite de T. cruzi (flèche jaune) reste collé aux parois du sac vitellin, tout au long de la séquence de Time-lapse (7,2 s, 17,2 s et 27,2 s), env. ~ 15 min après l’injection de parasite. Aucun changement dans la position du parasite n’est observé pendant une période d’acquisition d’au moins 30 s a, Atrium ; v, ventricule. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Trajectoire d’un parasite voyageant dans l’espace péricardique avec LSFM. Le parasite de T. cruzi peut être suivi tout en dérivant dans l’espace péricardique (PS), suivre la direction du flux sanguin (piste en rouge) environ ~ 15 min après l’injection de parasite. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Movie 1 : vallée de la circulation sanguine du jaune dans une larve 48 hpf. Film d’une larve 48 hpf montrant la vallée de la circulation sanguine ou la conduite de Cuvier à l’aide d’un stéréoscope ordinaire. Différentes régions sont concentrent au cours de la vidéo pour montrer les globules rouges circulant tout au long de la gaine. Flèche jaune indique le point d’injection optimale. Film a enregistré environ 10-15 min après l’injection de parasite. S’il vous plaît cliquez ici pour télécharger la vidéo.

Film 2 : T. cruzi parasites attachées aux parois du sac vitellin. Film LSFM d’un affichage de hpf larve 48 que T. cruzi parasites restent collés à la vésicule vitelline environ 10-15 min après l’injection de parasite. Aucun changement dans la position du parasite a été observé durant une période d’acquisition d’au moins 30 s a, Atrium ; v, ventricule. S’il vous plaît cliquez ici pour télécharger la vidéo.

Film 3 : T. cruzi parasites fixés aux murs du cœur. Film LSFM d’une larve 48 hpf montrant que T. cruzi parasites remain adhère à la paroi cardio-vasculaire, malgré les contractions du coeur fort environ 10-15 min après l’injection de parasite. Érythrocytes peuvent être observés comme des ombres arrondies noires. S’il vous plaît cliquez ici pour télécharger la vidéo.

Movie 4 : Parasites se déplaçant dans l’espace péricardique. Film LSFM un parasites de T. cruzi larve 48 hpf montrant dérivant dans l’espace péricardique. Deux parasites peuvent être attribués à des moments différents (ID 1, dans le cercle rouge et 2 ID dans cercle jaune), suivant une trajectoire similaire. Le film a été enregistré environ 10-15 min après l’injection de parasite. S’il vous plaît cliquez ici pour télécharger la vidéo.
Supplémentaire Figure 1 : signal fluorescent Accumulation de CFSE dans le jaune d’oeuf. Images de stéréoscope d’une larve de type sauvage, injecté à 48 hpf à la gaine de Cuvier. Signal fluorescent CFSE s’accumule progressivement dans le jaune d’oeuf, après que deux jours après l’injection (48 hpi). Echelle = 500 µm. s’il vous plaît cliquez ici pour télécharger le chiffre.
Supplémentaire 1 film : Parasites attachés aux murs et aux valves du système circulatoire. Stéréoscope temps série images de la larve de type sauvage, injecté à 48 hpf. Les images sont prises à intervalles de 0,2 s capture des parasites de T. cruzi se déplaçant en synchronie avec des contractions du muscle cardiaque à la valve auriculo-ventriculaire. Film a enregistré environ 30 min après l’injection de parasite. S’il vous plaît cliquez ici pour télécharger la vidéo.
2 film supplémentaire : parasites mobiles et collés dans l’espace de leucomalacie et le jaune d’oeuf. Film LSFM un parasites de T. cruzi larve 48 hpf montrant à la dérive ou adhéré à l’espace péricardique ou le jaune. Une vue de lumière transmise a été observée pour les 5 premiers s. La vue de fluorescence a été observée de 5.2-25,8 s. Le film a été enregistré environ 10-15 min après l’injection de parasite. S’il vous plaît cliquez ici pour télécharger la vidéo.
Discussion
Cette étude met en évidence les avantages du poisson-zèbre comme modèle animal pour étudier le comportement des agents in vivo. En particulier, cette étude propose une méthode pour visualiser le pathogène T. cruzi dans son environnement naturel : circulation hematic. L’environnement du microenvironnement circulatoire chez les poissons est comparable à celui des mammifères, et trypanosomatidés ont évolué des mécanismes voyageant, éludant le système immunitaire, et la fixation aux cellules pour infection dans cet environnement25. Ce protocole propose une description d’une méthode optimale pour la culture de T. cruzi dans une lignée cellulaire humaine et l’isolation ultérieure des formes flagellaires pour marquage fluorescent. Il montre ensuite les paramètres appropriés pour injection réussie des parasites dans le poisson-zèbre transparent pour montage plus tard et la visualisation à l’aide de LSFM. Enfin, ce protocole offre des suggestions pour efficace et efficiente le in vivo de l’imagerie du mouvement en circulation à l’aide de LSFM et emplacement du parasite.
Le flagelle des trypanosomes émerge de sa région postérieure, qui coule du corps cellulaire, et se bloque gratuits à la partie antérieure de l' organisme26. T. cruzi se propulse en agitant le flagelle devant le corps, qui ondule le corps tout entier du parasite. Mouvement flagellaire est non seulement indispensable pour la motilité parasite, comme dans le cas de T. brucei27 (l’agent causal de la trypanosomiase africaine), mais il est également utilisé pour l’infection cellulaire, comme l’a démontré en T. cruzi5 ,,28. Bien que le poisson-zèbre ne sont pas l’hôte naturel de T. cruzi, motilité du parasite peut être étudiée dans un système de circulation cardiovasculaire en développement utilisant les protocoles décrits ici. En outre, il y a des espèces de trypanosomes qui infectent les cyprinidés, la classe du poisson-zèbre, telle que carassii T. et T. borreli25. Ces espèces de parasites pourraient servir à étudier en temps réel les mouvements et les mécanismes de fixation de ces trypanosomatidés ; Ces études peuvent prêter aperçu du processus de l’infection de cellules de mammifères.
Dans cette étude, injecté motiles T. cruzi parasites ont été observées en parcourant la circulation cardio-vasculaire de poissons inoculées, se déplaçant avec des érythrocytes opaques et adhérant aux structures dans les parois de l’appareil cardiovasculaire. Nous avons utilisé un LSFM maison construite avec un 10 X achromatique longue distance de travail objectif de l’air (17,6 mm) pour le bras d’éclairage avec une ouverture numérique de 0,25. Un 40 X objectif à immersion d’eau apochromatique avec une ouverture numérique de 0,8 et une distance de travail de 3.5 mm a été utilisé pour le bras de détection. L’objectif de détection a été plongé dans le compartiment de mesure, tandis que l’objectif de l’illumination était à l’extérieur de la chambre. Un port dans la chambre scellée avec un lamelle couvre-objet et la colle optique autorisé pour le faisceau d’éclairage entrer dans la chambre, telle que décrite par Lorenzo et al. 18 pour l’éclairage, nous avons utilisé un laser DPSS 50 mW à 488 nm dont la puissance a été modulée par un filtre accordable optique Acousto. Le chemin d’accès détection utilisé des filtres compatibles avec la protéine fluorescente verte (GFP) ou FITC. Un microscope de nappe de lumière, équipé d’un porte-échantillon capillaire (idéalement avec rotation automatique) et le contrôle de la température de la chambre de mesure doit être adapté à cette application. Le microscope doit être aligné et étalonné selon les instructions du fabricant ou de protocoles standard de laboratoire de l’utilisateur avant l’acquisition, si nécessaire. Dans ce protocole, nous avons contrôlé le microscope à l’aide du logiciel SPIM19.
Il est important de noter que, dans la circulation du poisson-zèbre, attachement parasitaire des larves est efficace. Dans la veine Cardinale, les parasites restés attachés pour jusqu'à plusieurs minutes ; dans le coeur, ils ont tenu l’aux valves et murs, oscillant avec des contractions du cœur. D’autres études restent afin d’élucider si T. cruzi interagit avec les érythrocytes fluides qui dérivent dans le sens de la circulation sanguine. In vitro les études antérieures ont montré que la présence de structures solides (par exemple, les cellules du sang), ou une augmentation de viscosité du liquide pour imiter sang in vitro, a un effet significatif sur la motilité et la vitesse du parasite 9.
Il y a beaucoup de questions concernant le cours de l’infection par T. cruzi chez l’homme après que les amastigotes échapper des cellules phagocytaires, la cellule infectée initialement type29. Par exemple, comment ils arrivent à leurs organes cibles ? Quels sont les mécanismes de tropisme aux organes préférés, tels que cardiaque, digestif et du système nerveux central ? Fait intéressant, dans cette étude les parasites ont été initialement projetés au cœur de parce que c’était le site de la plus forte densité de parasites. Cependant, le signal CFSE accumulées par la suite dans l’intestin en développement par 7 jours post injection. Bien que l’anatomie des poissons et des mammifères est différent, les résultats de cette étude démontrent une forme de tropisme, comme il a été observé que les parasites montraient tropisme vers les organes cibles privilégiées connus malgré des différences. Une limite importante de cette étude concerne la température utilisée dans les expériences. Les larves de poisson zèbre doivent rester environ 28 °C pendant toute la procédure. Si cette température est similaire à l’hôte vecteur (insectes de la sous-famille des Triatominae), il est tout à fait différent de mammifères à sang chaud qui composent l’hôte final (environ 37 ° C). T. cruzi est connu pour avoir des formes vivantes flagellaire chez deux hôtes ; Toutefois, il est important de garder à l’esprit que ce facteur pourrait avoir des effets dans le comportement de l' animal in vivo.
Bien que le système immunitaire adaptatif de fish´s n’est pas mature jusqu'à 4 semaines après la fécondation, le système immunitaire inné est actif au début de développement10. Dès 48 ou 96 hpf, cellules phagocytaires ont été observés après avoir englouti étiqueté trypanosomes (données non présentées). Cela limite la fenêtre de temps pour la visualisation du parasite. Toutefois, si une étude a été de mettre l’accent sur l’évaluation de la réponse immunitaire de fish´s, injection à un stade ultérieur peut être recommandée. En outre, injection de parasites dans des lignes de poissons transgéniques avec des macrophages marqués ou d’autres cellules du système immunitaire peuvent être utiles dans l’étude de pièce jointe parasite et mécanismes possibles de l’endocytose. Il est important de noter que si les parasites sont étiquetés avec CFSE, étiquettes de cellules transgéniques ne devraient pas être GFP, et un marqueur à l’extrémité jaune ou rouge du spectre est requis.
Afin d’évaluer la direction détaillée du mouvement parasite, il peut être utile de suivre leur trajectoire en 3 dimensions (3D). Pour la visualisation 3D et de la reconstruction du processus, un système à haute vitesse est nécessaire. Avec le matériel utilisé dans le présent protocole, il n’est plus possible de visualiser les parasites dans un seul plan. Dans ce cas, nous avons priorisé stabilité plan focal pendant le mouvement parasite et qui enregistre sa trajectoire dans un seul plan.
La méthodologie proposée ici ouvre la voie à étudier plus de comportement parasite en circulation cardiovasculaire. En résumé, les étapes essentielles d’imagerie live parasites fluorescents à l’intérieur des larves de poisson zèbre sont :(i) utiliser de jeunes embryons éclos (24-48 hpf) ou des larves ou d’animaux entre hpf de 72-96 sans pigmentation afin qu’ils soient transparents et faciles à injecter ; (ii) larves d’image dès que possible après l’injection pour éviter le dégagement de parasite par les cellules phagocytaires ; et (iii) se concentrent le LSFM sur le site d’intérêt (p. ex., région péricardique) et maintenir l’attention. Cette nouvelle procédure permet la visualisation des trypomastigotes dans un environnement comparable à sa niche de l’infection naturelle, offrant pour la première fois la possibilité d’étudier T. cruzi dans un organisme vivant.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par Convocatoria Interfacultades de Vicerrectoría de Investigaciones de la Universidad de los Andeset le programme de l’USAID recherche et bourses de recherche de l’Innovation. Nous remercions Juan Rafael Buitrago et Yeferzon Ardila de poisson maintenance et assistance.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Micropipette | Fisherbrand | 21-377-815 | |
| Agarose RA | Amresco | N605 | Regular |
| Agarose SFR | Amresco | J234 | Low Melting point |
| Aquarium salt | Instant ocean | SS15-10 | |
| Cell Count chamber | Boeco | Neubauer | |
| Cell culture flasks | Corning | 430639 | |
| Centrifuge | Sorvall | Legend RT | |
| CFSE | ThermoFisher | C34554 | |
| Detection objective | Nikon 40x 0.8NA | 40x CFI APO NIR | |
| DMEM medium | Sigma-Aldrich | D5648 | |
| Dumont #5 fine forceps | World precision Instruments | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Fetal calf serum (FCS) | Eurobio | CVFSVF00-01 | |
| Filter | Chroma | ET-525/50M | |
| Glass capillaries for embryo mounting | Vitrez Medical | 160215 | |
| Glass capillaries for pulling needles | World precision instruments | TW100-4 | |
| Glucose | Gibco | A2494001 | |
| HEPES | Gibco | 156300-80 | |
| Incubator | Thermo Corporation | Revco | |
| Larval microinjection mold | Adaptive Science Tools | I-34 | |
| Laser | Crystalaser | DL488-050 | |
| L-glutamine | Gibco | 250300-81 | |
| Methylene blue | Albor Químicos | 12223 | |
| Micromanipulator | Narishige | MN-153 | |
| Micromanipulator system | Sutter Instrument | MP-200 | For LSFM |
| Micropipette puller device | Narishige | PC-10 | |
| Microscope | Olympus | CX31 | |
| Microscope (inverted) | Olympus | CKX41 | |
| Multipurpose microscope | Nikon | AZ100M | |
| Neubauer counting chamber | Boeco Germany | ||
| Penicillin-streptomycin | Gibco | 15140-163 | |
| Petri dish 94x16 | Greiner bio-one | 633181 | |
| Plastic pasteur pipette | Fisherbrand | 11577722 | |
| Rotation stage | Newport | CONEX-PR50CC | |
| RPMI-1640 medium | Sigma-Aldrich | R4130 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Stereoscope | Nikon | C-LEDS | |
| Tricaine (MS-222) | Sigma-Aldrich | 886-86-2 | |
| TRIS | Amresco | M151 | |
| Trypsin-EDTA (0.25%) | Gibco | R-001-100 | |
| Tubes 15 ml | Corning | 05-527-90 |
Références
- WHO. Chagas disease (American trypanosomiasis). , http://www.who.int/mediacentre/factsheets/fs340/en/ (2017).
- Bern, C. Chagas's Disease. New England Journal of Medicine. 373 (5), 456-466 (2015).
- Sosa Estani, S., Segura, E. L., Ruiz, A. M., Velazquez, E., Porcel, B. M., Yampotis, C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. The American Journal of Tropical Medicine and Hygiene. 59 (4), 526-529 (1998).
- Rosas, F., Roa, N., Cucunuba, Z. M., Cuellar, A., Gonzalez, J. M., Puerta, J. C. Chagasic Cardiomyopathy. Cardiomyopathies - From Basic Research to Clinical Management. , (2012).
- Finkelsztein, E. J., et al. Altering the motility of Trypanosoma cruzi with rabbit polyclonal anti-peptide antibodies reduces infection to susceptible mammalian cells. Experimental Parasitology. 150, 36-43 (2015).
- Martins, R. M., Covarrubias, C., Rojas, R. G., Silber, A. M., Yoshida, N. Use of L-Proline and ATP Production by Trypanosoma cruzi Metacyclic Forms as Requirements for Host Cell Invasion. Infection and Immunity. 77 (7), 3023-3032 (2009).
- Engstler, M., et al. Hydrodynamic Flow-Mediated Protein Sorting on the Cell Surface of Trypanosomes. Cell. 131 (3), 505-515 (2007).
- Uppaluri, S., et al. Impact of Microscopic Motility on the Swimming Behavior of Parasites: Straighter Trypanosomes are More Directional. PLoS Computational Biology. 7 (6), e1002058(2011).
- Heddergott, N., et al. Trypanosome Motion Represents an Adaptation to the Crowded Environment of the Vertebrate Bloodstream. PLoS Pathogens. 8 (11), e1003023(2012).
- Gratacap, R. L., Wheeler, R. T. Utilization of zebrafish for intravital study of eukaryotic pathogen–host interactions. Developmental & Comparative Immunology. 46 (1), 108-115 (2014).
- Meijer, A. H., Spaink, H. P. Host-Pathogen Interactions Made Transparent with the Zebrafish Model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Huisken, J. Slicing embryos gently with laser light sheets. BioEssays. 34 (5), 406-411 (2012).
- Westerfield, M. The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio). , University of Oregon Press. Eugene. http://zfin.org/zf_info/zfbook/zfbk.html (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Vargas-Zambrano, J. C., Lasso, P., Cuellar, A., Puerta, C. J., González, J. M. A human astrocytoma cell line is highly susceptible to infection with Trypanosoma cruzi. Memórias do Instituto Oswaldo Cruz. 108 (2), 212-219 (2013).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. JoVE (Journal of Visualized Experiments). (25), e1115-e1115 (2009).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6, 22(2011).
- Edelstein, A. D., Tsuchida, M. A., Amodaj, N., Pinkard, H., Vale, R. D., Stuurman, N. Advanced methods of microscope control using μManager software. Journal of Biological Methods. 1 (2), e10(2014).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer Mounting for Long-term Light Sheet Microscopy of Zebrafish. Journal of Visualized Experiments. (84), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ng, A. N. Y., et al. Formation of the digestive system in zebrafish: III. Intestinal epithelium morphogenesis. Developmental Biology. 286 (1), 114-135 (2005).
- Higuchi, M. D. L., et al. Correlation between Trypanosoma cruzi parasitism and myocardial inflammatory infiltrate in human chronic chagasic myocarditis: Light microscopy and immunohistochemical findings. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 2 (2), 101-106 (1993).
- Vago, A. R., Silva, D. M., Adad, S. J., Correa-Oliveira, R., d'Avila Reis, D. Chronic Chagas disease: presence of parasite DNA in the oesophagus of patients without megaoesophagus. Transactions of the Royal Society of Tropical Medicine and Hygiene. 97 (3), 308-309 (2003).
- Wiegertjes, G. F., Forlenza, M., Joerink, M., Scharsack, J. P. Parasite infections revisited. Developmental & Comparative Immunology. 29 (9), 749-758 (2005).
- De Souza, W. Basic cell biology of Trypanosoma cruzi. Current Pharmaceutical Design. 8 (4), 269-285 (2002).
- Langousis, G., Hill, K. L. Motility and more: the flagellum of Trypanosoma brucei. Nature Reviews. Microbiology. 12 (7), 505-518 (2014).
- Johnson, C. A., et al. Cellular response to Trypanosoma cruzi infection induces secretion of defensin α-1, which damages the flagellum, neutralizes trypanosome motility, and inhibits infection. Infection and Immunity. 81 (11), 4139-4148 (2013).
- Magalhães, L. M. D., Viana, A., Chiari, E., Galvão, L. M. C., Gollob, K. J., Dutra, W. O. Differential Activation of Human Monocytes and Lymphocytes by Distinct Strains of Trypanosoma cruzi. PLoS neglected tropical diseases. 9 (7), e0003816(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon