Method Article
Haute résolution de cartographie optique de la souris Noeud sino-auriculaire
Dans cet article
Résumé
Ici, nous présentons un protocole de cartographie optique de l'activité électrique de l'oreillette droite de la souris et en particulier le nœud sino-auriculaire, à une résolution spatiale et temporelle.
Résumé
Sino-atrial node (SAN) dysfunctions and associated complications constitute important causes of morbidity in patients with cardiac diseases. The development of novel pharmacological therapies to cure these patients relies on the thorough understanding of both normal physiology and pathophysiology of the SAN. Among the studies of cardiac pacemaking, the mouse SAN is widely used due to its feasibility for modifications in the expression of different genes that encode SAN ion channels or calcium handling proteins. Emerging evidence from electrophysiological and histological studies has also proved the representativeness and similarity of the mouse SAN structure and functions to larger mammals, including the presence of specialized conduction pathways from the SAN to the atrium and a complex pacemakers' hierarchy within the SAN. Recently, the technique of optical mapping has greatly facilitated the exploration and investigation of the origin of excitation and conduction within and from the mouse SAN, which in turn has extended the understanding of the SAN and benefited clinical treatments of SAN dysfunction associated diseases. In this manuscript, we have described in detail how to perform the optical mapping of the mouse SAN from the intact, Langendorff-perfused heart and from the isolated atrial preparation. This protocol is a useful tool to enhance the understanding of mouse SAN physiology and pathophysiology.
Introduction
Novel scientific breakthroughs that lead to leaps in the understanding of human physiology are often preceded by technological advances. Fluorescent optical mapping, for example, enables investigation of multiple physiological parameters in both cells and tissues.1,2 It significantly improved our understanding of how the anatomical structure is associated with electrophysiological functions and dysfunctions. In the heart, the natural pacemaker and conduction systems such as the sinoatrial node (SAN) and the atrioventricular junction consist of nodal myocytes that are insulated by the surrounding atrial myocytes.3-5 Such organization creates complex three-dimensional structures with specialized electrical properties. Both structural and functional remodeling of these pacemaker structures has been recognized to form significant electrophysiological heterogeneities.6,7 Understanding the mechanism underlying how such heterogeneities result in SAN dysfunctions and atrial arrhythmogenesis will dramatically benefit the clinical treatment of these diseases. It requires a technique to visualize the propagation of electrical signals at the tissue level, such as optical mapping.
Recently, accumulating evidence has proven the advance of optical mapping in studies of atrial electrophysiology and pathology.2 However, novel and rigorous studies are dependent on the accurate interpretation of experimental data, whose validity and stability rely on careful experiment protocols. Genetically modified mice are extensively used for research as animal models of human diseases including sick sinus syndrome, pacemaker abnormalities and atrial arrhythmias.6,8-11 Thus, a combination of fluorescent optical mapping with transgenic mouse models provides a powerful tool to study cardiac electrical abnormalities associated with various pathologies. In this paper, we present a protocol for high-resolution optical mapping of the mouse SAN and atrium. Specifically, we discuss and compare different dye loading approaches, time effects on dye bleaching and heart rate stability during the experiment.
Protocole
Toutes les expériences ont été menées en conformité avec les National Institutes of Health Guide pour le soin et l'utilisation des animaux de laboratoire (NIH Pub. N ° 80-23). Toutes les méthodes et les protocoles utilisés dans ces études ont été approuvées par l'Université du Wisconsin Animal Care et utilisation Comité du Protocole suivant les directives sur les soins et l'utilisation des animaux de laboratoire publiées par le NIH (publication n ° 85-23, révisée en 1996). Tous les animaux utilisés dans cette étude ont reçu des soins humains en conformité avec le Guide pour le soin et l'utilisation des animaux de laboratoire.
1. Heart Enlèvement et Langendorff Perfusion
- Avant l'isolement du coeur, une solution de Tyrode chaude à 37 ° C en utilisant un bain d'eau et d'une chemise d'eau.
- Anesthésier la souris avec 5% d' isoflurane / 95% de O 2.
- Veiller à ce niveau approprié de l'anesthésie en vérifiant la perte de réflexe de la douleur.
- Effectuer thoracotomie. Ouvrez le coffre à l'aide de courbes 5.5 "ciseaux Mayo et 5.5" hémostatique KellyCèpes pour faire 1 cm découpés sur le devant du thorax.
- extraire rapidement le cœur de la poitrine (à moins de 30 secondes). Utilisez 4 "courbes pince Iris pour saisir le tissu pulmonaire et découper le poumon, le thymus et le cœur en même temps que le péricarde en utilisant 4.3" ciseaux Iris. Ne pas saisir directement le cœur.
- Laver en oxygéné (95% O 2/5% CO 2), à température constante (36,8 ± 0,4 ° C) a modifié la solution de Tyrode. Utiliser la composition suivante en solution (en mM): NaCl 128,2, KCl 4,7, 1,19 NaH 2 PO 4, 1,05 MgCl2, 1,3 CaCl2, 20,0 NaHCO 3 et du glucose 11,1 (pH 7,35 ± 0,05).
- Tout en baignant dans une même solution, d'identifier les poumons, le thymus et les tissus adipeux. les disséquer avec soin du cœur. Utilisez courbe 3 "ciseaux Vannas-Tübingen et 4.3" # 5 forceps.
- Ensuite, identifier l'aorte et canuler il sur un 21 G canule sur-mesure. Utilisez deux 4.3 vigueur # 5B courbe "ps.
- Après canulation perfuser simultanément (par le biais de la canule à un débit d'environ 5 ml / min, ce qui devrait être ajustée en fonction de la pression aortique, voir ci-dessous) et superfuse (dans le bain à un débit d'environ 50 ml / min) le coeur avec la solution de Tyrode chauffée et filtrée à travers toute l'expérience. Passer la solution de perfusion à travers un filtre en nylon de 11 pm en ligne pour éviter le colmatage de la circulation coronaire.
- À l'aide d'un transducteur de pression (ou un manomètre) relié par l'intermédiaire d'un robinet à 3 voies Luer à la ligne de perfusion, de surveiller la pression aortique et la maintenir entre 60 et 80 mmHg. Ajustez la vitesse de perfusion si nécessaire pour maintenir la pression aortique dans cette plage.
2. Cartographie optique du SAN du Langendorff perfusé Coeur entier
- Instrumentation
- Placer horizontalement le coeur et la broche de la pointe du ventricule au fond siliconé de la chambre à l'aide de 0,1 mm de diamètre à goupilles prevent mouvement pendant l'expérience induite par flux. 12
- Insérer une petite (0,012 "ID x 0,005"), le tube de silicium dans le ventricule gauche (VG) par l'intermédiaire de la veine pulmonaire, l'oreillette gauche (LA) et la valve mitrale (MV). Fixer le tube par une suture de soie (4-0) pour le tissu conjonctif de sondage.
- Positionner le coeur avec son côté postérieur vers le haut (figure 1A, panneau de gauche).
- Broche le bord de l'appendice RA (RAA) au fond de la chambre de silicium en utilisant des broches de diamètre minuties 0,1 mm. Régler son niveau afin de rendre la surface postérieure de la RA plat et lui permettre d'être situé plan focal de la caméra. Cela va permettre des mesures optiques à partir de la surface maximale de l'atrium.
- Noose supérieure (SVC) et inférieure (VCI) de la veine cave par une suture de soie (4-0), étirer et épingler l'autre extrémité de la suture au fond d'une chambre de siliconé (voir la figure 3A). Assurez-vous que les sutures ne bloquent pas lachamp de vue optique.
- Placez l'électrode de stimulation sur mesure sur le bord de la RAA. Pour rendre les électrodes, l'utilisation du silicium revêtu de 0,25 mm de diamètre des fils en argent, avec 0,5 mm de distance inter-électrodes et dépourvue de silicium pour une longueur de 1 mm à l'extrémité de stimulation. Ensuite, placez deux aiguilles mm ECG 12 (29 gauge) électrodes monopolaires près de la base des ventricules droit et gauche. Placer le sol ECG électrode à proximité du sommet des ventricules.
- tachant
- Comme les deux colorants fluorescents et électro-mécanique découplant blebbistatin sont sensibles à la lumière, effectuer toutes les procédures décrites ci-dessous dans une pièce sombre. Préparer d'abord sensible à la tension de colorant RH-237 ou di-4-ANNEPS comme une solution mère, 1,25 mg / ml dans du diméthylsulfoxyde (2,5 mM), aliquote il (30 pi chacun) et stocker les aliquots à -20 ° C.
- Diluer 5-10 pi de solution de colorant disponible dans 1 ml de réchauffé (37 ° C) une solution de Tyrode, puis l'injecter dans la ligne de perfusion coronairesur une période de 5-7 minutes en utilisant un orifice d'injection en ligne Luer.
- Préparer blebbistatin comme une solution mère (2 mg / ml dans le diméthylsulfoxyde, 6,8 mM) à l'avance et le stocker à 4 ° C.
- Après 20 minutes de stabilisation, ajouter 0,5 ml de réchauffé (37 ° C) blebbistatin dans le perfusat et diluer 0,1 ml de blebbistatin dans 1 ml de réchauffé (37 ° C), la solution de Tyrode. Puis injecter dans la ligne de perfusion coronaire pendant une période de 5-7 minutes en utilisant un orifice d'injection en ligne Luer.
3. cartographie optique du SAN du Atrial Préparation isolé
- Instrumentation
- Pour la préparation auriculaire isolée, isoler et cathétériser le cœur comme décrit ci-dessus dans les étapes 1.1-1.5 pour la préparation entière cœur.
- Disséquer les ventricules loin de la face antérieure. Voir Figure 1A, panneau de droite, coupé # 1 pour plus de détails.
- Ouvrez le RA en coupant à travers le va tricuspideLVE (TV) le long de l'axe TV-SVC. Voir Figure 1A, panneau de droite, coupé # 2 pour plus de détails.
- Couper la branche médiane de la crête terminale pour ouvrir le RAA. Voir Figure 1A, panneau de droite, coupé # 3.
- Ouvrez la paroi libre auriculaire antérieure en effectuant une coupe de la ligne médiane de la coupe précédente n ° 3 sur le bord du coin inférieur droit du RAA, aplatir et épingler la paroi libre auriculaire au fond d'une chambre de silicium revêtu. Voir la direction indiquée par la flèche creuse dans la figure 1A, coupe n ° 4. Préserver un rebord du tissu ventriculaire pour épingler la préparation pour éviter d'endommager les oreillettes.
- De même, ouvert LA en coupant à travers le MV le long du coin MV supérieur de l'appendice LA (LAA).
- Pour ouvrir le LAA, coupé à partir du milieu de l'AAL ouvert, à travers la paroi libre auriculaire antérieure jusqu'à près d'un rebord milieu de la LAA.
- Ouvrez la partie antérieure auriculaire paroi alo libreng la même direction, puis aplatir et épingler au fond d'une chambre Sylgard revêtu.
- Déposer partiellement le tissu septal interauriculaire. Cela permettra de réduire la diffusion du signal optique à partir de tissus qui ne sont pas au point. Par conséquent, à la fois le LA et RA ainsi que le réseau SAN et auriculo-ventriculaire jonction (AVJ) , sont accessibles dans cette préparation (figure 1B).
- Soulever la préparation finale d'environ 0,5 mm à partir du fond de la chambre de silicium revêtu afin de permettre surfusion à partir des deux surfaces épicardique et endocardique.
- Superfuse la préparation avec réchauffé (37 ° C) une solution de Tyrode à une vitesse constante de ~ 12 ml / min pour un débit concentré situé près du SVC et ~ 30 ml / min pour une surfusion de bain.
- Placez le Ag / AgCl 2 électrodes de stimulation sur mesure (0,25 mm de diamètre) sur le bord de la RAA disséqués. Ensuite, placez deux aiguilles ECG 12 mm (29G) des électrodes (monopolaire) près de la RAA et LAA, respectivement. Placez le sol ECG élusmonté près du AVJ.
- tachant
- Effectuer une application directe du colorant sensible à la tension (RH-237 ou di-4-ANNEPS). Pour cela, diluer 1-2 ul de la solution de colorant de stock en 1 mm de réchauffé (37 ° C) une solution de Tyrode et relâchez lentement le colorant dilué sur la surface de la préparation à l'aide d'un 1 mm pipette.
- En variante, effectuer une coloration auriculaire avec le colorant sensible à la tension à travers une perfusion coronaire du coeur perfusé de Langendorff similaire à celle décrite ci-dessus pour la préparation entière cardiaque (étapes 2.2.1-2.2.2).
- Après la coloration de la perfusion coronaire, isoler la préparation auriculaire comme décrit. Effectuer supplémentaire coloration de la surface en cas de besoin pour atteindre un niveau de fluorescence satisfaisante. l'isolement auriculaire rapide ne pas l'eau de Javel du colorant et n'a aucune incidence sur la qualité de la coloration.
- Immobiliser la préparation avec l'électro-mécanique découplant, blebbistatin. Diluer 3-5 pi blebbistatin solution mère dans le réchauffé (37 ° C) une solution de Tyrode et lentement libérer le blebbistatin dilué sur la surface de la préparation et de la solution environnante. Depuis blebbistatin a été montré pour être sensible, 13,14 éviter une exposition prolongée à la lumière la lumière lors de la préparation et la coloration.
- Effectuer application blebbistatin supplémentaire autant que nécessaire pour supprimer la contraction. Normalement jusqu'à 3 applications supplémentaires (3-5 pi par chaque application) peut être utilisé pour supprimer l'artefact de mouvement suffisamment pour reconstituer avec précision SAN et activation auriculaire.
- Ajouter 0,5 ml supplémentaires de blebbistatin réchauffé dans le perfusat. Au cours de cette procédure, mettre en pause la surfusion pendant 30 secondes pour permettre au colorant / blebbistatin pour colorer le tissu auriculaire.
4. Cartographie optique Set Up
NOTE:. Une description détaillée du système de cartographie optique est prévue ailleurs 12
- Utilisez un appareil photo avec un systèmeporal résolution de 2000 images / s ou plus, et une série de lentilles de condenseur pour atteindre une résolution spatiale de 100 um / pixel ou plus. Cela est nécessaire pour reconstruire l'activation SAN et la propagation intranodale.
- Pour réduire l'artefact de mouvement de la solution vibrante, fixer un petit verre de couverture sur la surface de la solution sur le cœur / isolé préparation auriculaire.
- Utiliser la lumière d'excitation (520 ± 45 nm de longueur d'onde) fournie par une lampe à halogène à faible bruit de courant constant. Diriger le faisceau de lumière filtrée sur la préparation à l'aide d'un guide de lumière bifurquée flexible.
- Filtrer la fluorescence émise par un filtre passe-haut (> 715 nm). Collecter, numériser et enregistrer le signal fluorescent acquis sur un logiciel d'ordinateur à l'aide fournie par le fabricant de l'appareil.
5. Traitement des données
REMARQUE: Les données de cartographie optique est collectée et stockée sous forme d'une série de matrices d'intensité de fluorescence à différents moments. Chaque pixel represeNTS une mesure de l'intensité de fluorescence recueillie à partir d'un emplacement spécifique sur la préparation de tissu à un point de temps spécifique. la fluorescence d'arrière-plan est automatiquement retiré par pixel afin de permettre une meilleure visualisation des changements de fluorescence produites par les variations de tension de la membrane et vers le bas pour correspondre à des potentiels d'action (PA) mesurés par les systèmes de micro-électrodes. Les détails des différentes étapes du traitement des données d'imagerie optique, y compris la segmentation d' images, filtrage spatial, filtrage temporel, et la dérive retrait de la ligne de base, sont fournis dans la revue ciblée 15.
- Manuellement ou en utilisant l'algorithme spécial (par exemple, une détection de seuil ou le bord) 15 pour déterminer les limites de tissus, créer un masque binaire de 1 (pixels inclus) et 0 (pixels exclus) et appliquer le masque à chaque trame dans la séquence. Ce processus crée une image binaire qui met en lumière des domaines d'intérêt pour un traitement ultérieur.
- Pour améliorer le rapport signal-bruit de l'optdonnées iques, filtrer les signaux dans les zones d'intérêt sélectionnées. Pour cela, utilisez l' espace (ie la moyenne des pixels fluorescents voisins tels que définis par un bac de convolution désiré ou noyau, par exemple 3 x 3 ou, pour les données bruitées, 5 x 5) et / ou filtrage temporel (par exemple, Butterworth, le type Chebyshev 1, Chebyshev type 2, Elliptic etc.) (Figure 2). Gardez à l'esprit la possibilité d'artefacts filtrés induite par l'interprétation des données. Pour plus de détails, voir la revue 15.
- Retirer la dérive de la ligne de base dans les enregistrements optiques en cas de besoin (en utilisant le filtrage passe-haut ou d'un raccord polynôme du signal original), puis normaliser chaque signal de pixel de 0 (fluorescence minimum) à 1 (fluorescence maximale).
- Sélectionner une fenêtre temporelle qui englobe le temps d'activation de tous les pixels d'une seule propagation AP. Attribuez à chaque pixel de son temps d'activation comme le temps de dérivé upstroke maximale (dF / dt max, où F est fluorescenl'intensité de la CE). En utilisant tous les temps d'activation de pixel, reconstruire la carte d'activation isochrone. Chaque isochrone va donc montrer les pixels activés en même temps.
- Pour reconstituer la carte de répartition durée AP (TTA) pour chaque pixel , calculer la durée entre le temps d'activation et du temps à un niveau spécifique de la repolarisation (par exemple, à 80% de repolarisation, APD 80). En utilisant toutes les valeurs APD de pixels, reconstituer la carte de distribution isochrone APD. Chaque isochrone va donc montrer les pixels avec le même APD.
- Pour calculer la vitesse de conduction pour la propagation AP, adapter à une surface de la préparation des données de temps d'activation calculées en 5.4. Pour cela, utilisez polynôme surface de montage ou local lissage de surface du noyau, puis calculer des vecteurs de vitesse de conduction locale du gradient de la surface équipée.
- Pour créer la carte de repolarisation, attribuer à chaque pixel son temps de repolarisation, définie comme la dérivée seconde maximale (d 2 F / dt2) du signal optique à l'extrémité de la PAO, ou le temps de 90% de repolarisation.
Résultats
Cartographie optique du SAN Intact du Coeur de Langendorff perfusé
Un exemple typique d'une carte de contour d'activation de la RA reconstruit pour un rythme sinusal spontané est représenté sur la figure 3 pour un coeur de souris Langendorff perfusé. Le point d'activation précoce est situé dans la région intercaval près du SVC où le SAN est anatomiquement défini. 3,16 Deux RA cartes de contours d'activation acquis à 1,0 et 0,5 taux d'échantillonnage msec sont présentés dans la figure 3B.
Pour évaluer le fonctionnement SAN, nous avons mesuré le temps de récupération SAN (SANRT) 9 . Après ZRÉ stimulation pendant au moins 1 min à 10 à 12 Hz, la stimulation électrique a été arrêté et SANRT a été calculé comme l'intervalle de temps entre le dernier point d' accès saisi et AP premier spontanée (figure 3C). Le SANRT a été corrigée à la fréquence cardiaque (ie SANRT c) en calculant la différence entre la SANRT et la longueur du cycle de base. En outre, l'emplacement du premier stimulateur cardiaque après la stimulation a été identifié. Dans cet exemple, le SANRTc était d'environ 49 msec.
Activation Atria et SAN Isolated
L'activation de la préparation auriculaire isolée pendant le rythme sinusal spontané est représenté sur la figure 4A. Elle est née dans le anatomiquement défini SAN près du SVC avec un front d'onde de large qui se propagent anisotrope à travers le RA, avec deux directions de conduction préférentiels près des bords supérieurs et inférieurs SAN et bloc complet à la direction du septum (marqué dans les cartes d'activation de la figure 4A) . La carte d'activation acquis au 1er taux d'échantillonnage msec montre une vaste zone d'activation précoce. Une augmentation du taux d'échantillonnage de 0,5 ms et 0,3 msec nous permet d'identifier la zone précise de l'emplacement du premier stimulateur cardiaque. We observé un exemple typique, battu à battre la position monofocale stable du stimulateur leader qui correspond à la zone de pacemaker primaire précédemment caractérisé électrophysiologique par microélectrodes de verre 17 et cartographie optique 8-11,18,19 ainsi que par immunomarquage pour connexin45 et HCN4 . 6,16
Comme il est démontré précédemment, le potentiel d'action optique SAN consiste en un signal à deux phases qui comprend deux éléments distincts: la composante monte lentement SAN et la course ascendante augmentation rapide du myocarde auriculaire (composant auriculaire) (figure 4B) 20 En raison de la diffusion de la lumière. processus, PAO représente une activité électrique moyenne provenant de plusieurs couches de cellules à l'intérieur du tissu. La profondeur et la largeur de dispersion est régie par une constante de l'espace, qui est déterminée par les propriétés de diffusion et d'absorption de lumière et peut atteindre jusqu'à 1,5-2 mm. En raison de la Condu SANction retard, le SAN AP précède toujours l' activité auriculaire pendant l' activation physiologique (figure 4B). Pour calculer la transition du SAN à l'atrium (ie SAN temps de conduction, SANCT), nous avons utilisé soit le point de temps où le signal à double composante SAN atteint 50% de la composante amplitude SAN, ou le premier pic des deux-pic dérivée première senior (dF / dt). La SANCT de la zone d'activation premiers SAN à l'AR était d'environ 5 msec, semblable à celle mesurée par des microélectrodes en verre.
SAN Recovery Time
De même, le SANRT a été mesurée dans la préparation auriculaire isolée (figure 4D). Pour cela, les préparations auriculaires ont été stimulés à 12 Hz par une électrode de stimulation situé à l'angle de la RAA pendant au moins 1 min. 9 Pour cet exemple, le SANRTc était d' environ 34 msec, ce qui est comparable à celle mesurée dans le Langendorff perfusé coeur (figure 3C). En outre, l'emplacement du premier stimulateur cardiaque après la stimulation a été identifié.
Rythme cardiaque et Fluorescent Signal de stabilité au fil du temps
Si les procédures de chargement et de chirurgie colorants sont suivis de manière appropriée, il ne devrait pas y avoir de changement significatif dans les caractéristiques physiologiques de l'atrium. Sur la figure 5, nous présentons le rythme cardiaque mesuré avant et après la procédure d'isolement auriculaire et pendant la perfusion de 3 heures. Aucun changement significatif de la fréquence cardiaque ont été observés soit lors de l'isolement de l'atrium ou après charge de colorant.
Bien que la coloration artérielle peut nécessiter une plus grande quantité de colorant, la stabilité du signal fluorescent dans le tissu de la zone SAN semble être mieux en utilisant cette méthode de chargement. Dans la figure 6, nous présentons le signal d' intensité décroissance au fil du temps pour les colorations coronariennes et surface. en t il tissu SAN, IC 50 (qui indique la période où l' intensité du signal est décédé à 50%) est d' environ 107 min après coloration coronaire, presque deux fois plus longue que celle de la coloration de la surface.

Figure 1:. Isolement du Atrial Préparation souris (A) interventions chirurgicales effectuées pour isoler la souris préparation auriculaire. La vue postérieure du coeur est représentée. Toutes les coupes sont représentées par des lignes rouges en pointillés et étiquetés par des nombres dans l'ordre exécuté. Voir les détails dans le texte. (B) Le contour schématique de la souris isolé préparation auriculaire montrant les principales caractéristiques anatomiques, y compris la structure trabéculaire de gauche et droite appendices auriculaires ainsi que l'emplacement du nœud sino-auriculaire (SAN; marqué par un ovale gris). Toutes les abréviations sont expliquées dans la figure.tp_upload / 54773 / 54773fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2:. Signaux bruts et transformés enregistrés à 0,3, 0,5 et 1 msec / frame Raw signaux sont collectées à partir d' un seul pixel. Après 3 x 3 binning, les signaux sont filtrés en utilisant le passe-bas de l' algorithme Butterworth. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Whole-coeur cartographie optique du SAN (A) gauche, photo d'une préparation typique utilisée pour la cartographie du SAN du cœur intact.. Le carré bleu montre le champ optiquevue (6 mm par 6 mm). Droit, champ de vue optique capturé par la caméra et superposée avec des repères anatomiques. SVC et IVC: vena cava supérieure et inférieure; RAA: appendice auriculaire droit; RV et LV: ventricules droit et gauche; PVs: veines pulmonaires. Cartes (B) d'activation de contour couleur acquises avec 1,0 msec ( à gauche) et 0,5 msec ( à droite) de taux d'échantillonnage. Sur la droite de chaque carte, l'échelle de temps correspondant de couleur indiquant le temps d'activation auriculaire (à partir du point d'activation plus tôt en bleu, le dernier point indiqué en rouge d'activation) est affiché. Le site d'activation auriculaire plus tôt est marqué par un astérisque. (C) SAN temps de récupération (SANRT) mesurée dans la préparation entière cœur. Des exemples représentatifs des cartes de contours d'activation auriculaire reconstruit pour la dernière stimulation stimulus (S1) et pour le premier battement auriculaire post-stimulation (A1) sont indiqués pour les battements sélectionnés sur la trace senior représentant sur le dessus.Sites de l'activation auriculaire plus tôt sont marqués par un astérisque. BCL:. Longueur de base du cycle S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: haute résolution cartographie optique de la souris Noeud sino-auriculaire (SAN) à partir de la surface endocardique du Isolated Atria (A) Photographie d'un SAN de préparation de la souris typique (6 mm x 6 mm) et ses cartes de contours d'activation correspondant. obtenue à 1,0 msec, 0,5 msec, et 0,3 taux d'échantillonnage msec. SAN et une zone de bloc voisin sont représentés par des flèches. échelles de temps de couleur indiquent le temps d'activation auriculaire. L'astérisque indique l'emplacement du stimulateur de premier plan. RAA: appendice auriculaire droit, SVC et INC: supérieure et la veine cave inférieure, RV: ventricule droit, AVJ: atrio-ventricul ar jonction, CT: crista terminalis, IAS: septum inter-auriculaire. (B) Mécanisme de doubles éléments de l'enregistrement OAP de la zone SAN de la souris. Voir les détails dans le texte. . (C) OAPs enregistrées à partir du centre de la zone SAN (bleu), le plus ancien site d'excitation auriculaire (vert) et le dernier site d'activation de RA (rouge) Insets: transition de nodal à la forme d' onde auriculaire avec un temps de conduction totale égale à 5 msec. Le comparer avec le retard de temps pour l'activation du RA totale égale à 11 ms. (D) SAN temps de récupération (SANRT) mesurée dans la préparation auriculaire isolée. Des exemples représentatifs des cartes de contours d'activation auriculaire reconstruit pour la dernière stimulation stimulus (S1) et pour le premier battement auriculaire post-stimulation (A1) sont présentés. Un site de l'activation auriculaire plus tôt est marqué par un astérisque. BCL - longueur de base du cycle.k "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
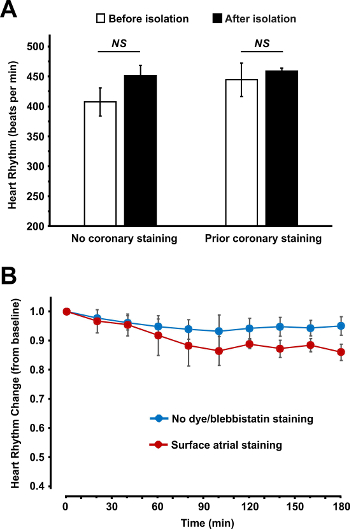
Figure 5: rythme cardiaque mesuré avant et après la procédure d'isolement atriale (A) et pendant la perfusion de 3 heures (B). (A) la fréquence cardiaque battant spontanée est montré avant et après l' isolement auriculaire pour deux types de coloration auriculaire: coloration de la surface après l' isolement (aucune coloration coronaire avant) et la coloration coronaire avant l' isolement auriculaire. (B) Spontaneous cœur battant la stabilité du rythme au cours de la perfusion de 3 heures est indiquée pour les préparations non colorées auriculaires et pour colorant fluorescent et blebbistatin préparations auriculaires colorés. Les données sont présentées comme moyenne ± SEM. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
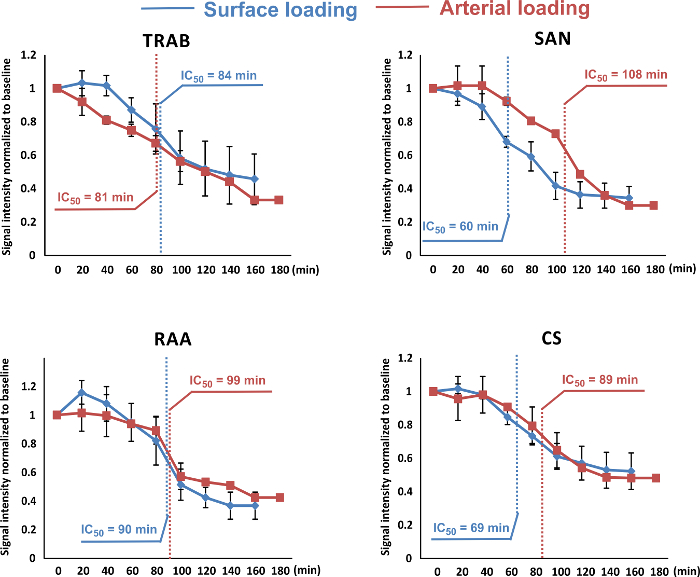
Figure 6:. Intensité du signal Decay au fil du temps Les intensités des signaux des deux méthodes de chargement (chargement coronaire indiquée en rouge, et le chargement de la surface indiquée en bleu) ont été mesurés et reportés dans le temps. Les intensités de signal ont été en moyenne d'une zone 7 de 7 pixels à quatre endroits typiques dans l'oreillette droite: trabéculum (Trab), noeud sinusal (SAN), appendices oreillette droite (RAA) et des sinus coronaire (CS). IC 50 valeurs ont ensuite été calculés et étiquetés dans toutes les courbes de décroissance. La décroissance de l'intensité du signal des deux méthodes de chargement était similaire dans TRAB et RAA. L'IC 50 de chargement artériel dans CS était d' environ 20 minutes de plus. Dans le SAN, cette valeur pour le chargement artérielle était près de deux fois plus grande par rapport à une charge de surface, ce qui indique que les méthodes de chargement artérielle ont abouti à une meilleure stabilité du colorant dans les tiss SANue au fil du temps. Les données sont présentées comme moyenne ± SEM. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Ici, nous avons présenté deux types de préparations souris SAN: 1) intact SAN dans le coeur entier Langendorff perfusé, et 2) SAN dans l'isolement, ouvert préparation auriculaire. Ces deux types de préparations servent différentes fins expérimentales. Dans la préparation du cœur entier Langendorff perfusé, la structure auriculaire intacte est préservée ce qui le rend possible l'étude des troubles du rythme auriculaire complexes , telles que la fibrillation auriculaire, ainsi que les interactions entre le réseau SAN et l' oreillette pendant une tachyarythmie rentrantes. 6 A l' inverse, dans la préparation auriculaire isolée , l'oreillette est ouvert et aplati en une structure pseudo deux dimensions où les faisceaux anatomiques tridimensionnels sont perturbés. Cela peut affecter l'anatomie des voies rentrantes qui rend la préparation auriculaire isolée pas idéal pour étudier arythmogenèse auriculaire. Cependant, en utilisant ce type de préparation, l'emplacement du premier stimulateur (s) de sites de conduction intra nodale, la propagation et l'AP pattern peut être visualisé avec précision et étudié en détail. En outre, les atriums intacts semblent être limités par une vue postérieure tandis que dans la préparation isolée, la totalité de la surface auriculaire est disponible pour la cartographie optique.
De plus, la préparation auriculaire isolée permet la cartographie structurale-fonctionnelle de l'atrium en résolvant la microstructure complexe du réseau trabéculaire comme on le voit sur la figure 4. Pour cela, spatiale élevée (100 um / pixel ou plus) et temporelle (2000 fps ou supérieur) résolutions doit être utilisé, car il est essentiel de particulariser les deux modèles d'activation auriculaire et SAN, qui pourrait encore être chevauchaient avec des structures correspondantes. Bien que la résolution temporelle de 1000 fps pourrait être un minimum pour reconstruire l'activation auriculaire (qui dure 10 - 20 msec), 2.000 fps devrait être considéré comme une résolution temporelle minimale pour la conduction intra nodale (qui dure ~ 5 ms et pourrait donc manquer en bas résolutions) et SAN acteLes mesures de Ivation comme on le voit sur la figure 4. Cela peut permettre à la localisation de arythmogènes «points chauds» (tels que les foyers ectopiques ou réentrée ancré) pendant la fibrillation auriculaire / flutter qui pourrait émerger de la superposition des régions de remodelage fonctionnel significatif avec ceux de la fibrose élevée et / ou réduite de cellule à cellule de couplage. 21,22 En outre, l'approche décrite pourrait être utilisée pour étudier les mécanismes électrophysiologiques des anomalies SAN, y compris SAN blocs de sortie, les pauses, les arythmies de tachycardie-bradycardie, maladie du sinus , etc.
En introduisant un deuxième (ou même une troisième) sonde fluorescente, il sera possible d'effectuer une cartographie optique multi-paramétrique de l'activité électrique en liaison avec la manipulation du calcium ainsi que du métabolisme et d'autres modifications. Différentes combinaisons de colorants peuvent être utilisés pour une utilisation simultanée de tension et de calcium, ratiométrique tension / calcium ou l'imagerie potentiel mitochondrial.
Pour une grande cartographie optique à résolution temporelle, en raison de la période de collecte des fluorophores plus courte, les signaux d'un plus faible rapport signal à bruit peuvent être appréciés. Par conséquent, une procédure de traitement d'étalement est appliqué aux signaux de rythme cardiaque sinusal ou les signaux de la série de stimulation selon le besoin. Le dF / dt max est détectée pour chaque signal dans un enregistrement de longue période. Ces points de temps d'activation sont ensuite alignés. Une période de réglage de l'enregistrement centré sur ces points de temps est coupé et la moyenne de l'ensemble ou Aps, au besoin.
Par l' utilisation précise de l' instrumentation et la procédure de coloration adéquate, les paramètres électrophysiologiques auriculaires , y compris la vitesse de conduction (comparer les figures 3C et 4D pour les cartes d'activation S1), rythme spontané SAN et la longévité de la préparation SAN (figure 5) ne sont pas affectés, qui restent stables 3 heures ou plus. Fait important, le monit continueoring de l'ECG doit être effectuée au cours de la procédure de coloration entière pour assurer un fonctionnement électrique normal du cœur. L'application de blebbistatin peut induire un transitoire ralentissement de la fréquence cardiaque, mais à part ça, il ne pas provoquer de tout changement dans les principaux sites de pacemaker ou des changements dans la morphologie AP comme l' a également décrit précédemment. 13
coloration de la surface de la préparation auriculaire isolée est une étape critique. A cet effet, une application rapide du colorant diluée sur la surface du tissu doit être évité; à la place, le colorant doit tomber sur la préparation librement en raison de la densité plus élevée de DMSO, qui sert à la fois colorant et dilutions blebbistatin. La quantité totale de chargement appropriée et la vitesse doivent être ajustés de façon à ne pas induire des changements spectaculaires de la fréquence cardiaque. La procédure de coloration peut être appliquée à plusieurs reprises jusqu'à ce que le signal atteigne un niveau raisonnable. Il convient de noter que l'application directe de colorant pourrait endommager le tissu SAN et affecter son pacemaking. Par conséquent, le colorant doit être dilué et la quantité appliquée doit être soigneusement contrôlée. Coloration de la surface appropriée ne doit pas endommager la préparation ou SAN 23 qui est évaluée par la fréquence cardiaque comparable et la vitesse de conduction.
protocoles de coloration alternatifs devraient également être pris en considération. Ceux - ci peuvent inclure soit 10-15 minutes surfusion du SAN / préparation auriculaire avec le colorant sensible à la tension (HR-237 ou di-4-ANEPPS) à 35 ± 1 ° C , 10,19 ou 30 minutes d' incubation de la préparation à la température ambiante (20-22 ° C) dans une solution Tyrode contenant l'indicateur sensible à la tension. 11
Pour la cartographie optique du SAN du coeur entier Langendorff perfusé, des étapes importantes d'instrumentation comprennent l'insertion du petit tube dans le LV et la fermeture de SVC et IVC. Le premier empêche une augmentation de la pression de la congestion de la solution au cours d'expériences à long terme, ainsi que i ultérieurele développement de schemia après la suppression des contractions ventriculaires par blebbistatin et l'acidification de la solution de perfusion. Ce dernier permet à la RA de maintenir un certain niveau de pression intra-auriculaire remplissant ainsi l'atrium avec une solution de perfusion et l'aplatissement de la région intercaval afin de découvrir toute la zone SAN pour la cartographie optique.
Enfin, la coloration coronaire, en plus de la surface charge de colorant, pourrait améliorer de manière significative l'intensité des SAN OAPs qui peut durer plus longtemps par rapport à la coloration de surface pur utilisé dans les études précédentes. 8,9
L'utilisation de blebbistatin présente de multiples avantages par rapport à d'autres découplants électromécaniques, y compris une faible toxicité, des effets moins prononcés secondaires, et la résistance au lavage quand il est utilisé avec prudence. Blebbistatin précipite quand il est dissous à des températures inférieures à 37 ° C. 14 cristaux blebbistatin peut interrompre le flux vasculaire normal et ainsi induire localeischémie et provoquer des événements arythmiques. 24 En outre, dans les études qui utilisent la GFP ou d' autres colorants verts / jaunes, les précipitations blebbistatin pourraient être confondus avec des cellules marquées qui devraient être prises en considération. Prévenir blebbistatin précipitations est simple, à savoir, il faut dissoudre dans un blebbistatin préchauffé (37 ° C et plus) et on agite vigoureusement médias.
D'analyser TTA, une concentration élevée de blebbistatin (jusqu'à 10 uM) peut être utilisée. 13,14,25. De même, si un médicament qui augmente la contraction est utilisée, l'application supplémentaire de blebbistatin est recommandée.
Comme une autre technique pour étudier la souris SAN activité électrique, basse résolution multi-réseau d' électrodes (64 électrodes séparées dans un carré de 8 x 8, la configuration avec une distance inter-électrode de 0,55 mm) 26 et les enregistrements de microélectrodes de verre consécutifs à brève distance entre impalements 17 sont utilisés. Bien que ceux-ci peuvent représenter relativement approches peu coûteuses, les deux ont de sérieuses limitations. Réseau d'électrodes multiples ont un environ 10 fois la résolution spatiale plus faible (ils sont limités par la taille physique des électrodes métalliques et la distance inter-électrode et une résolution de 550 um / pixel par rapport à 50 um / pixel pour optique cartographie) et ne peuvent être utilisés pour analyser la morphologie ou PA pour l'imagerie multi-paramétrique (telles que la tension simultanée et cartographie optique de calcium). Bien que les enregistrements de microélectrodes de verre fournissent plus d'informations sur AP morphologie, y compris les valeurs absolues pour AP amplitude et potentiel de repos, il est également limité par une faible résolution spatiale. Par conséquent, il ne peut être utilisé pour la localisation stable du stimulateur cardiaque avant et ne sont pas applicables à capturer battement à battement des modifications dans le premier emplacement du stimulateur cardiaque. Dans le même temps, comme l'a démontré précédemment 3,20 et mis en évidence dans la présente étude, le PAO co SANnsists d'un signal à deux phases à la fois whichincludes SAN et les composants du myocarde auriculaire AP (figure 4B). Il est donc difficile d'extraire un signal SAN pur et d'estimer avec précision la morphologie AP dans le SAN. A cet effet, des microélectrodes de verre 17 ou l'approche de serrage actuelle sur myocytes SAN isolés doivent être considérés.
Déclarations de divulgation
No conflicts of interest are declared.
Remerciements
We are supported by the University of Wisconsin-Madison Medical School start-up (A.V.G.).
matériels
| Name | Company | Catalog Number | Comments |
| water jacket | Radnoti | 1660 Series Tissue Bath for Large Organ or Single Cell Isolation Procedures | |
| water bath / circulator | Fisher Scientific | 1016S | |
| pressure amplifier | AD Instruments | MLT0670 | |
| EMD Millipore Nylon Net Filters | Fisher Scientific | NY1102500 | |
| Pressure transducer | AD Instruments | MLT0670 | |
| Stainless Steel Minutien Pins - 0.1 mm Diameter | Fine Science Tools | 26002-10 | |
| Perfusion pump | World Precision Instruments | PERIPRO-4LS | |
| Superfusion pump | World Precision Instruments | PERIPRO-4HS | |
| Vannas Tubingen scissors | World Precision Instruments | 503379 | |
| Dumont forceps | World Precision Instruments | 501201, 500085 | |
| Mayo scissors | World Precision Instruments | 501750 | |
| Kelly hemostatic forceps | World Precision Instruments | 501241 | |
| Iris forceps | World Precision Instruments | 15917 | |
| Iris scissors | World Precision Instruments | 501263 | |
| ECG 12 mm needle (29-gauge) electrodes (monopolar) | AD Instruments | MLA1203 | |
| in-line Luer injection port | Ibidi | 10820 | |
| Ultima-L CMOS camera | SciMedia | MiCAM-05 | |
| halogen lamp | Moritex USA Inc | MHAB-150W | |
| NaCl | Fisher Scientific | S271-1 | |
| CaCl2 (2H2O) | Fisher Scientific | C79-500 | |
| KCl | Fisher Scientific | S217-500 | |
| MgCl2 (6H2O) | Fisher Scientific | M33-500 | |
| NaH2PO4 (H2O) | Fisher Scientific | S369-500 | |
| NaHCO3 | Fisher Scientific | S233-3 | |
| D-Glucose | Fisher Scientific | D16-1 | |
| Blebbistatin | Tocris Bioscience | 1760 | |
| RH237 | ThermoFisher Scientific | S1109 | |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650 |
Références
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical imaging of the heart. Circ Res. 95 (1), 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circ Res. 110 (4), 609-623 (2012).
- Fedorov, V. V., Glukhov, A. V., Chang, R. Conduction barriers and pathways of the sino-atrial pacemaker complex: their role in normal rhythm and atrial arrhythmias. Am J Physiol Heart Circ Physiol. , (2012).
- Boyett, M. R., Honjo, H., Kodama, I. The sinoatrial node, a heterogeneous pacemaker structure. Cardiovasc Res. 47 (4), 658-687 (2000).
- Glukhov, A. V., et al. Sinoatrial Node Reentry in a Canine Chronic Left Ventricular Infarct Model: The Role of Intranodal Fibrosis and Heterogeneity of Refractoriness. Circ Arrhythm Electrophysiol. , (2013).
- Glukhov, A. V., et al. Calsequestrin 2 deletion causes sinoatrial node dysfunction and atrial arrhythmias associated with altered sarcoplasmic reticulum calcium cycling and degenerative fibrosis within the mouse atrial pacemaker complex. Eur Heart J. 36 (11), 686-697 (2015).
- John, R. M., Kumar, S. Sinus Node and Atrial Arrhythmias. Circulation. 133 (19), 1892-1900 (2016).
- Swaminathan, P. D., et al. Oxidized CaMKII causes cardiac sinus node dysfunction in mice. J Clin Invest. 121 (8), 3277-3288 (2011).
- Glukhov, A. V., Fedorov, V. V., Anderson, M. E., Mohler, P. J., Efimov, I. R. Functional anatomy of the murine sinus node: high-resolution optical mapping of ankyrin-B heterozygous mice. Am J Physiol Heart Circ Physiol. 299 (2), H482-H491 (2010).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. J Physiol. 593 (5), 1127-1146 (2015).
- Torrente, A. G., et al. Burst pacemaker activity of the sinoatrial node in sodium-calcium exchanger knockout mice. Proc Natl Acad Sci U S A. 112 (31), 9769-9774 (2015).
- Lang, D., Sulkin, M., Lou, Q., Efimov, I. R. Optical mapping of action potentials and calcium transients in the mouse heart. J Vis Exp. (55), e3275 (2011).
- Fedorov, V. V., et al. Application of blebbistatin as an excitation-contraction uncoupler for electrophysiologic study of rat and rabbit hearts. Heart Rhythm. 4 (5), 619-626 (2007).
- Swift, L. M., et al. Properties of blebbistatin for cardiac optical mapping and other imaging applications. Pflugers Arch. 464 (5), 503-512 (2012).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. Am J Physiol Heart Circ Physiol. 303 (7), H753-H765 (2012).
- Liu, J., Dobrzynski, H., Yanni, J., Boyett, M. R., Lei, M. Organisation of the mouse sinoatrial node: structure and expression of HCN channels. Cardiovasc Res. 73 (4), 729-738 (2007).
- Verheijck, E. E., et al. Electrophysiological features of the mouse sinoatrial node in relation to connexin distribution. Cardiovasc Res. 52 (1), 40-50 (2001).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. J Mol Cell Cardiol. 82, 125-135 (2015).
- Nygren, A., Lomax, A. E., Giles, W. R. Heterogeneity of action potential durations in isolated mouse left and right atria recorded using voltage-sensitive dye mapping. Am J Physiol Heart Circ Physiol. 287 (6), H2634-H2643 (2004).
- Efimov, I. R., Fedorov, V. V., Joung, B., Lin, S. F. Mapping cardiac pacemaker circuits: methodological puzzles of the sinoatrial node optical mapping. Circ Res. 106 (2), 255-271 (2010).
- Aschar-Sobbi, R., et al. Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFalpha. Nat Commun. 6, 6018 (2015).
- Hansen, B. J., et al. Atrial fibrillation driven by micro-anatomic intramural re-entry revealed by simultaneous sub-epicardial and sub-endocardial optical mapping in explanted human hearts. Eur Heart J. 36 (35), 2390-2401 (2015).
- Lang, D., Petrov, V., Lou, Q., Osipov, G., Efimov, I. R. Spatiotemporal control of heart rate in a rabbit heart. J Electrocardiol. 44 (6), 626-634 (2011).
- Kanlop, N., Sakai, T. Optical mapping study of blebbistatin-induced chaotic electrical activities in isolated rat atrium preparations. J Physiol Sci. 60 (2), 109-117 (2010).
- Glukhov, A. V., Flagg, T. P., Fedorov, V. V., Efimov, I. R., Nichols, C. G. Differential K(ATP) channel pharmacology in intact mouse heart. J Mol Cell Cardiol. 48 (1), 152-160 (2010).
- Wu, J., et al. Altered sinoatrial node function and intra-atrial conduction in murine gain-of-function Scn5a+/DeltaKPQ hearts suggest an overlap syndrome. Am J Physiol Heart Circ Physiol. 302 (7), H1510-H1523 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon