Method Article
La différenciation de la SH-SY5Y neuroblastome humain Cell Line
Dans cet article
Résumé
It is critical in neurobiology and neurovirology to have a reliable, replicable in vitro system that serves as a translational model for what occurs in vivo in human neurons. This protocol describes how to culture and differentiate SH-SY5Y human neuroblastoma cells into viable neurons for use in in vitro applications.
Résumé
Having appropriate in vivo and in vitro systems that provide translational models for human disease is an integral aspect of research in neurobiology and the neurosciences. Traditional in vitro experimental models used in neurobiology include primary neuronal cultures from rats and mice, neuroblastoma cell lines including rat B35 and mouse Neuro-2A cells, rat PC12 cells, and short-term slice cultures. While many researchers rely on these models, they lack a human component and observed experimental effects could be exclusive to the respective species and may not occur identically in humans. Additionally, although these cells are neurons, they may have unstable karyotypes, making their use problematic for studies of gene expression and reproducible studies of cell signaling. It is therefore important to develop more consistent models of human neurological disease.
The following procedure describes an easy-to-follow, reproducible method to obtain homogenous and viable human neuronal cultures, by differentiating the chromosomally stable human neuroblastoma cell line, SH-SY5Y. This method integrates several previously described methods1-4 and is based on sequential removal of serum from media. The timeline includes gradual serum-starvation, with introduction of extracellular matrix proteins and neurotrophic factors. This allows neurons to differentiate, while epithelial cells are selected against, resulting in a homogeneous neuronal culture. Representative results demonstrate the successful differentiation of SH-SY5Y neuroblastoma cells from an initial epithelial-like cell phenotype into a more expansive and branched neuronal phenotype. This protocol offers a reliable way to generate homogeneous populations of neuronal cultures that can be used for subsequent biochemical and molecular analyses, which provides researchers with a more accurate translational model of human infection and disease.
Introduction
La possibilité d'utiliser dans des systèmes modèles in vitro a grandement amélioré les domaines de la neurobiologie et les neurosciences. Cellules en culture constituent une plate-forme efficace pour caractériser la fonctionnalité des protéines et des mécanismes moléculaires spécifiques phénomènes sous-jacents, de comprendre la pathologie de la maladie et l'infection, et d'effectuer des évaluations préliminaires de dépistage de drogues. En neurobiologie, les principaux types de modèles de culture de cellules comprennent des cultures de neurones primaires dérivées de rat et la souris, et des lignées cellulaires de neuroblastome comme les cellules B35 de rat 5, des cellules de souris Neuro-2A 6, et les cellules PC12 de rat 7. Bien que l'utilisation de telles lignées cellulaires a progressé de façon significative le champ, il existe plusieurs facteurs de confusion liés à la manipulation des cellules non humaines et des tissus. Ceux-ci comprennent la compréhension spécifiques aux espèces différences dans les processus métaboliques, les phénotypes de la manifestation de la maladie, et la pathogenèse par rapport à l'homme. Il est également important de noter que lere des différences significatives entre la souris et l'expression de gènes humains et de la signalisation du facteur de transcription, en soulignant les limites des modèles de rongeurs et l'importance de comprendre quelles voies sont conservées entre les rongeurs et les humains 8-11. D'autres ont eu recours à l'utilisation de lignées de cellules neuronales humaines, y compris la N-Tera-2 (NT2) de lignée humaine de cellules de tératocarcinome et cellules souches pluripotentes inductibles (CSPi). Ces lignées cellulaires sont de bons modèles pour systèmes humains in vitro. Toutefois, la différenciation des cellules NT2 avec de l'acide rétinoïque (RA) a pour résultat la génération d'une population mixte de neurones, les astrocytes et les cellules gliales radiales 12, ce qui nécessite une étape de purification supplémentaire afin d'obtenir des populations pures de neurones. En outre, les cellules NT2 montrent un caryotype très variable 13, avec plus de 60% en 72 chromosomes des cellules. iPSCs montrent la variabilité dans la différenciation entre les différentes lignées cellulaires et de modification de l'efficacité de la différenciation 14. Il est donc souhaitable de disposer d'un modèle cellulaire neuronale humaine constante et reproductible pour compléter ces alternatives.
cellules neuroblastes comme SH-SY5Y sont un sous-clone de la lignée de cellules de neuroblastome parentale SK-N-SH. La lignée cellulaire parentale a été généré en 1970 à partir d'une biopsie de la moelle osseuse qui contient à la fois neuroblastes-like et les cellules épithéliales de type 15. SH-SY5Y ont un caryotype stable constitué de 47 chromosomes, et peuvent être différenciés d'un état dans les neurones humains matures neuroblastes comme à travers une variété de mécanismes, y compris l'utilisation de la PR, les esters de phorbol et neurotrophines spécifiques tels que les brain-derived facteur neurotrophique (BDNF). Avant preuve suggère que l'utilisation de différentes méthodes peut sélectionner des sous-types spécifiques de neurones adrénergiques tels que, cholinergiques et des neurones dopaminergiques 16,17. Ce dernier aspect fait SH-SY5Y utiles pour une multitude d'expériences de la neurobiologie.
ontenu "> Plusieurs études ont noté des différences importantes entre les cellules SH-SY5Y dans leurs états indifférenciées et différenciées. Lorsque les cellules SH-SY5Y sont indifférenciées, elles prolifèrent rapidement et semblent être non polarisée, avec très peu, des processus courts. Ils poussent souvent en touffes et d'exprimer des marqueurs indicatifs de neurones immatures 18,19. Lorsque différencié, ces cellules étendent longs processus ramifié, diminution de la prolifération et, dans certains cas polarisent 2,18. SH-SY5Y différenciées ont été entièrement précédemment démontré pour exprimer une variété de différents marqueurs de neurones matures, y compris des protéines de croissance associé (GAP-43), les noyaux neuronaux (NeuN), la synaptophysine (SYN), synaptique protéine vésiculaire II (SV2), neurone énolase spécifique (NSE) et la protéine associée aux microtubules (MAP) 2,16,17,20 et à l'absence d'expression de marqueurs gliales telles que protéine acide fibrillaire gliale (GFAP) 4. En outre soutien qui différencient SH-SY5Y represent une population neuronale homogène, l'enlèvement de BDNF se traduit par l'apoptose cellulaire 4. Ceci suggère que la survie des cellules SH-SY5Y différenciées dépend de facteurs trophiques, semblables à des neurones matures.L'utilisation de cellules SH-SY5Y a augmenté depuis le sous-clone a été créé en 1978 3. Quelques exemples de leur utilisation comprennent l'investigation de la maladie de Parkinson 17, la maladie d'Alzheimer 21, et la pathogenèse de l'infection virale dont poliovirus 22, l'entérovirus 71 (EV71) 23,24 , le virus varicelle-zona (VZV), 1, 25 cytomégalovirus humain et le virus de l'herpès simplex (HSV) 2,26. Il est important de noter que plusieurs études utilisant des cellules SH-SY5Y ont utilisé ces cellules dans leur forme indifférenciée, en particulier dans le domaine de la neurovirologie 27-36. La différence dans le phénotype observé des indifférenciée par rapport aux cellules SH-SY5Y différenciées soulève la question de whether la progression observée de l'infection serait différent dans les neurones différenciés matures. Par exemple, des cellules SH-SY5Y différenciées ont une plus grande efficacité de HSV-1 absorption en fonction, la prolifération des cellules SH-SY5Y indifférenciées, qui peuvent être dus à un manque de récepteurs de surface qui se lient HSV et modulent entrée sur les cellules SH-SY5Y indifférenciées 2. Il est donc essentiel que lors de la conception d'une expérience axé sur les essais neurones in vitro, les cellules SH-SY5Y devraient être différenciés afin d'obtenir les résultats les plus précis pour la traduction et la comparaison avec des modèles in vivo.
Le développement d'une méthode fiable pour générer des cultures de neurones humains est impératif de permettre aux chercheurs de réaliser des expériences traductionnelles modéliser avec précision le système nerveux humain. Le protocole présenté ici est une procédure qui définit les meilleures pratiques issues de méthodes précédentes 1-4 pour enrichir les neurones humains qui se différencientavec de l'acide rétinoïque.
Protocole
1. Considérations générales
- Voir la Table des Matières / Équipement pour la liste des réactifs nécessaires. Effectuez toutes les étapes dans des conditions aseptiques strictes.
- Utiliser du sérum de veau fœtal inactivé par la chaleur (hiFBS) pour toutes les préparations de médias qui incluent FBS. Pour chauffer inactiver, chauffer 50 ml aliquote de FBS à 56 ° C pendant 30 min, en inversant toutes les 10 min (voir également le tableau 1).
Remarque: Lors de FBS est utilisé sans inactivation par la chaleur, le phénotype de type epithelial progresse plus rapidement dans des cultures de cellules SH-SY5Y. - Avant utilisation, laisser le matériau chaleureux et équilibrent dans un incubateur à établir un bon équilibre du pH avant chaque étape. Par exemple, 50 ml de milieu prend environ une heure pour équilibrer complètement (pH 7, 37 ° C, 5% CO 2).
Remarque: Ce protocole utilise un mode opératoire de séparation en deux étapes qui nécessite SH-SY5Y différenciées partiellement être trypsinisées et re-plaquées. Ceci est un stressprocessus pour ces cellules exceptionnellement fragiles. Par conséquent, il est important de faire incuber les cellules à la trypsine pour un minimum de temps. Cela permettra à l'envol préférentiel de neurones, en laissant les cellules épithéliales comme encore attachés à l'antenne. - Effectuer une trituration de cellules différenciées lentement avec une pipette en matière plastique de 10 ml avec la pointe contre le fond du tube conique contenant les cellules. Effectuer trituration à une vitesse lente, de haut en bas pas plus de cinq fois.
2. Passage des cultures de maintenance SH-SY5Y
- cultures de maintenance cassés lorsque les cellules ont atteint 70-80% de confluence, et ne pas dépasser 10 à 15 passages. Cultures doivent généralement être passées tous les 3-5 jours (en supposant cultures ne sont pas dilués plus de 5 fois pendant le fendage).
- Pour les cellules de passage à partir d'un flacon T-75, aspirer hors médias, puis rincer avec environ 10 ml de PBS 1X.
Remarque: Nous ne recommandons pas diviser le SH-SY5Y cultures de maintenance fucomplémen taires de 1: 5 au cours des passages, car cela peut provoquer la mort des cellules en raison du faible confluence. - Aspirer PBS, puis ajouter 2,5 ml de 0,05% de trypsine-EDTA (1x).
- Incuber dans un incubateur 2-3 min et doucement basculer pour libérer les cellules de la surface du ballon.
- Ajouter 10 ml de croissance de base des médias (voir le tableau 2) et triturer 1-2 fois.
- Isoler pendant 2 min à 1000 xg, les médias aspirer, puis remettre le culot dans 5 ml de base de croissance des médias.
- Diluer les cellules de 1: 3 à 1: 5 dans un volume total de 20 ml pour le placage normal dans flacon T-75, ou de compter et de la plaque de différenciation (section 5).
3. congélation de cellules SH-SY5Y
- Congeler premiers passages des cellules de neuroblastome SH-SY5Y de croissance multimédia de base supplémenté avec 5% (v / v) de DMSO.
- Initialement, geler aliquotes à -80 ° C pendant 24 heures, puis transfert à l'azote liquide pour le stockage à long terme.
Remarque: Pour référence, une confluence (75-85%) flacon T-75 donnera cinqAliquotes de 1 ml de cellules SH-SY5Y de gel. Chacun de ces aliquotes devraient contenir de 2-5 millions de cellules totales.
4. Les cellules Décongeler et Culture indifférencié SH-SY5Y neuroblastome
- Préparer la croissance multimédia de base.
- Décongeler rapidement les cellules congelées dans un bain d'eau à 37 C ° à (environ 2 minutes).
- Resuspendre les cellules dans 9 ml de base de croissance des médias dans un tube conique de 15 ml et centrifuger ensuite pendant 2 min à 1000 x g.
- Aspirer le surnageant tout en faisant attention à ne pas perturber le culot cellulaire et les cellules doucement remettre en suspension dans 10 ml de base de croissance des médias.
- Cellules de plaque sur un flacon T-25 ou un plat de 60 mm 2.
- Le lendemain, remplacer médias pour éliminer les cellules mortes.
5. Jour 0: étalement des cellules de différenciation
- Voir Figure 1 pour le calendrier de la différenciation.
- Rincer cellules indifférenciées avec 1x PBS, aspirer, puis trypsiniser avec 1-2 ml réchauffé1x 0,05% de trypsine-EDTA.
- Lorsque les cellules sont la trypsine, incuber pendant environ 3 min dans un incubateur.
- Étancher la trypsine en ajoutant 10 ml de croissance avec les médias de base, rincer les parois du ballon ou un plat, et triturer doucement 1-3 fois. Transférer le contenu dans un tube conique de 15 ml.
- Centrifuger 2 min à 1000 x g, et aspirer les médias, tout en faisant attention de ne pas perturber le culot.
- Remettre le culot dans 5 ml de base de croissance des médias et triturer 1-3 fois.
- Compter les cellules à l'aide d'un hémocytomètre, puis diluer en utilisant croissance multimédia de base de 50.000 cellules / ml.
- Plate 2 ml de cellules par 35 mm 2 plat pour un total de 100.000 cellules par boîte et placer de nouveau dans l'incubateur.
6. Jour 1: Changer le média (différenciation des médias n ° 1)
- Aliquotes de 50 ml de différenciation média N ° 1 (voir le tableau 2) et incuber dans un bain-marie à 37 °.
- Lorsque le média est réchauffé, le laisser se stabiliser dans un incubateur (37° C, 5% CO 2) pendant au moins une heure d'établir un bon équilibre du pH avant de l'utiliser.
- Ajouter de l'acide rétinoïque (AR) (voir tableau 1) pour réchauffer et médiatique équilibrée immédiatement avant ajout de médias aux plats.
Remarque: L'acide rétinoïque est sensible à la lumière et doit être stocké dans des bouteilles foncées à 4 ° C - aspirer délicatement les anciens médias et le jeter.
- Ajouter 2 ml différenciation médias n ° 1 à la PR par 35 mm 2 plat et revenir à l'incubateur.
7. Jour 3: Changer le média (différenciation des médias n ° 1)
- Répétez la section 6 (étapes 1-5)
8. Jour 5: Changer le média (différenciation des médias n ° 1)
- Répétez la section 6 (étapes 1-5)
9. Jour 7: diviser les cellules 1: 1
- Ajouter à RA réchauffé et équilibré différenciation médias n ° 1 juste avant ajout de médias aux plats.
- aspirer délicatement les anciens médias et le jeter.
- Ajouter 200 ulréchauffé 0,05% 1x trypsine EDTA par 35 mm 2 plat et chaud dans l'incubateur d'environ 2-3 min ou jusqu'à ce que les cellules sont visiblement soulevé de la plaque, comme observé au microscope.
- Étancher la trypsine en ajoutant 2 ml différenciation médias n ° 1 à la PR par 35 mm 2 plat et utiliser les médias pour rincer restant cellules neuronales de la plaque. Puis transférer le contenu dans un tube conique de 50 ml.
Remarque: Au cours de trypsinisation étapes, ne trypsiniser trop de plats à la fois. Cela permet d'assurer des cultures de neurones ne sont pas mises en incubation dans de la trypsine pendant trop longtemps, ce qui peut être cytotoxique. - Mélanger le contenu d'un maximum de 10 petits plats dans les 50 ml tube conique et triturer doucement lentement de haut en bas pas plus de cinq fois avec une pipette de 10 ml en plastique.
- Aliquote de 2 ml de suspension cellulaire en frais 35 mm 2 plats et revenir à l'incubateur.
10. Jour 8: Changer le média (différenciation des médias n ° 2)
- Ajouter RA (voir Tableau 1) réchauffé et les médias équilibrée immédiatement avant ajout de médias aux plats.
- aspirer délicatement les anciens médias et le jeter.
- Lentement, ajouter 2 mL différenciation médias n ° 2 (voir le tableau 2) avec RA par 35 mm 2 plat et retour à l'incubateur. Ne laissez pas les neurones d'être exposés à l'air pendant une longue période de temps, car ils peuvent sécher rapidement.
11. Jour 9: Préparer la matrice extracellulaire (ECM) boîtes recouvertes
- Décongeler un flacon de solution ECM sur la glace et dilué 1: 100 dans DMEM froid.
- Distribuer 2 ml de mélange dans chaque 35 mm 2 plat et d'assurer la totalité de la base de la boîte est recouverte.
- Placer dans un incubateur (37 ° C, 5% CO 2) pendant 1 heure ou pendant une nuit.
- mélange Aspirer et laisser sécher à l'air pendant environ 1 h dans une hotte. Stocker à température ambiante pendant jusqu'à 2 mois.
12. Jour 10: Les cellules de transfert surECM plaques revêtues 1: 1
- Ajouter RA (voir le tableau 1) réchauffé et les médias équilibrée immédiatement avant ajout de médias aux plats.
- aspirer délicatement les médias et le jeter.
- Ajouter 200 pi de trypsine chauffées à chaque 35 mm 2 plat et laisser incuber à la température ambiante pendant environ 1-2 minutes, ou jusqu'à ce que les neurones sont visiblement levée de l'antenne comme on l'observe sous un microscope.
Remarque: Exécutez cette étape de traitement à la trypsine à la température ambiante de manière à ne pas trop incuber neurones avec de la trypsine et de causer des dommages. Neurones libèrent des plaques beaucoup plus rapidement que les cellules épithéliales de type à ce stade. - Étancher la trypsine en ajoutant 2 ml différenciation médias n ° 2 par 35 mm 2 plat et d'utiliser les médias pour rincer restant cellules neuronales de la plaque. Puis transférer le contenu dans un tube conique de 50 ml.
- Mélanger le contenu d'un maximum de 10 petits plats dans les 50 ml tube conique et triturer doucement lentement de haut en bas pas plus de cinq fois avecune pipette en matière plastique de 10 ml.
- Distribuer 2 ml de suspension cellulaire en 35 mm 2 plats ECM-enduit et revenir à l'incubateur.
13. Jour 11: Changer le média (différenciation des médias n ° 3)
- Ajouter RA (voir le tableau 1) réchauffé et les médias équilibrée immédiatement avant ajout de médias aux plats.
- aspirer délicatement les anciens médias et le jeter.
- Lentement, ajouter 2 ml différenciation médias n ° 3 (voir le tableau 2) avec RA par 35 mm 2 plat et revenir à l'incubateur. Ne pas permettre neurones d'être exposés à l'air pendant une période de temps prolongée.
14. Jour 14: Changer le média (différenciation des médias n ° 3)
- Répétez l'article 13 (étapes 1-3)
15. Jour 17: Dernier médias Change (différenciation des médias n ° 3)
- Répétez l'article 13 (étapes 1-3)
16. Jour 18: cultures de neurones prêt à l'emploi
- Changer de support pour frais Différentiation médias n ° 3 avec RA tous les 3 jours pour maintenir la santé des neurones.
Remarque: Les cellules doivent être différenciées en neurones et présentent un phénotype neuronal. Les cultures sont généralement stables pendant jusqu'à 14 jours après la différenciation terminale, mais la durée de la viabilité neuronale est fonction du nombre de passage de cellules indifférenciées au début de la différenciation. Un plus grand nombre de passage donnent neurones différenciés avec une durée de vie utile plus courte.
Résultats
À l'heure actuelle, il existe de nombreux cas dans le domaine de la neurobiologie et neurovirologie où SH-SY5Y indifférenciées sont utilisés comme un modèle fonctionnel pour les neurones humains 27-36, et surtout, des cellules indifférenciées peuvent manquer phénotypes tels que optimale absorption virale 2 qui sont nécessaire pour une interprétation précise. Il est essentiel que l'utilisation de cellules SH-SY5Y ou tout autre système neuronale in vitro, les cellules se différencient en neurones de façon appropriée, afin d'obtenir des données qui sont la meilleure représentation possible de ce qui peut se produire dans les neurones in vivo. Les rendements de protocole au-dessus hautement viables, homogènes, des cultures neuronales différenciées dans les 18 jours, que l'on peut utiliser pour la suite des analyses biochimiques et d'imagerie. Des cellules de neuroblastome SH-SY5Y indifférenciée démontrent un grand plat, phénotype, epithelial avec de nombreux processus courts étendant vers l'extérieur (figure 2A), tandis que la cellule différenciées possèdent plusieurs saillies séniles qui se connectent aux cellules environnantes (figure 2B). Il est important que, lorsque la différenciation des cellules SH-SY5Y, les cellules sont mises en incubation avec de la trypsine pendant une période minimale de temps pour garantir que seuls les neurones sont libérés de la capsule. Cela laisse derrière les cellules épithéliales indifférenciées qui seraient autrement contaminer la population cellulaire neuronale différenciée. Les caractéristiques neuronales de cellules SH-SY5Y différenciées sont mises en évidence entièrement par des techniques telles que la détection par immunofluorescence de marqueurs neuronaux classiques (figure 3).
SH-SY5Y montrent une variété de phénotypes différents au cours de la différenciation et il est important de pouvoir identifier les neurones sains de ceux qui sont stressés. Le jour de différenciation 1, avant l'introduction d'une différenciation des médias n ° 1, les cellules ont un appartement, phénotype rétractée à court, processus trapues (figure 4A).Suite à 5 jours de privation de sérum, SH-SY5Y commencent à se développer plus projections et de démontrer un phénotype plus neuronale (figure 4B). Le repiquage est un processus rigoureux pour SH-SY5Y, et les jours qui suivent immédiatement passages, les cellules semblent en mauvaise santé. Ceci est démontré par l'agglutination de corps de la cellule et la présence de moins, des processus plus courts. (Voir avant images: Figures 4C et 4E, et après des images: les figures 4D et 4F). Environ 48 heures suite à une scission, les cellules semblent se redresser, et à pleine maturité, les neurones différenciés sont obtenues au Jour 18 (figure 2B). Ceci est démontré par une réduction de l'agglutination de corps de la cellule, et l'extension de nombreuses fine, ramifiée processus séniles qui se connectent souvent à des cellules voisines.
Facteurs qui sont essentiels à l'obtention de cultures de neurones reproductibles et viables comprennent l'utilisation de FBS inactivé par la chaleur, ce qui minimise la trypsine incubationtemps, et trituration douce. Surtout, ce protocole en détail l'utilisation de quatre formulations de milieux différents avec différentes concentrations de hiFBS, créant ainsi une transition en douceur dans un état de sérum pendant les cellules. Lorsque SH-SY5Y matures sont en bonne santé, ils montrent de nombreuses saillies qui relient les neurones environnants (figure 5A). Il convient de noter que le phénotype épithélial distinctive va dépasser les cultures de neurones si elles sont mal utilisés au cours du processus de différenciation (figure 5B). En outre, si les neurones commencent à mourir, neurites se rétractent, les corps cellulaires commencent à se regrouper et arrondir, et les débris de la dégénérescence des neurites vont commencer à s'accumuler à et autour de processus cellulaires. Ce processus est semblable à ce qui est montré sur les figures 5C et 5D. Bien que la figure 5C représente une progression plus naturelle de la mort cellulaire après une carence en nutriments et de l'environnement,La figure 5D montre les neurones SH-SY5Y différenciées 4 h après l'infection avec une souche HSV-1 KOS, à une multiplicité d'infection (MOI) de 10 6 PFU. Ce protocole a été soigneusement optimisé dans le laboratoire et les rendements reproductibles, des populations homogènes de neurones, qui sont essentielles pour les analyses en aval et l'expérimentation.

Figure 1:. Horaires de la procédure de différenciation Le processus de différenciation se compose de 11 étapes réparties sur le cours d'une période de 18 jours. Le premier jour du protocole de différenciation (jour 0), entre 25.000 et 100.000 cellules sont étalées sur des boîtes de 35 non revêtues mm. Aux jours 1, 3 et 5, les anciens médias est enlevé et la différenciation des médias n ° 1 est appliquée. Au jour 7, les cellules sont divisées 1: 1 sur 35 mm plats non couchés dans la différenciation des médias n ° 1. Au jour 8, on remplace le milieu de différenciationLe support n ° 2, et le jour 10, les cellules sont à nouveau divisés 1: 1, mais cette fois sur des boîtes de 35 ECM revêtu mm dans la différenciation support n ° 2. Les jours 11, 14 et 17, les anciens médias est enlevé et la différenciation des médias n ° 3 est appliqué. Au jour 18, les neurones différenciés sont prêts à utiliser pour les applications en aval.
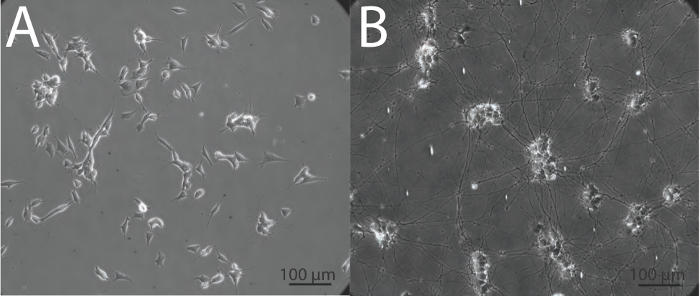
Figure 2:. Aspect morphologique des cellules SH-SY5Y indifférenciées et différenciées des cellules (A) indifférenciée SH-SY5Y ont un phénotype plat avec quelques projections tout en (B) différenciées neurones SH-SY5Y démontrent projections séniles vastes et allongées. Les images ont été obtenues en phase à un grossissement de 20x en utilisant un microscope à épifluorescence inversé.

Figure 3:Les marqueurs de différenciation neuronale. Immunofluorescence éclaire fonctions neuronales du SH-SY5Y différenciées entièrement. (A) Anti-SMI31 (vert) colore le neurofilament phosphorylée H dans le vaste réseau de neurites. (B) anti-MAP2 (rouge) étiquettes associée aux microtubules protéines 2, révélant le soma neuronal et la partie proximale de neurites. image de phase correspondant pour chaque panneau d'immunofluorescence est indiqué à droite. Les images ont été obtenues au grossissement 10X en utilisant un microscope à épifluorescence inversé. La barre d'échelle, 100 um.
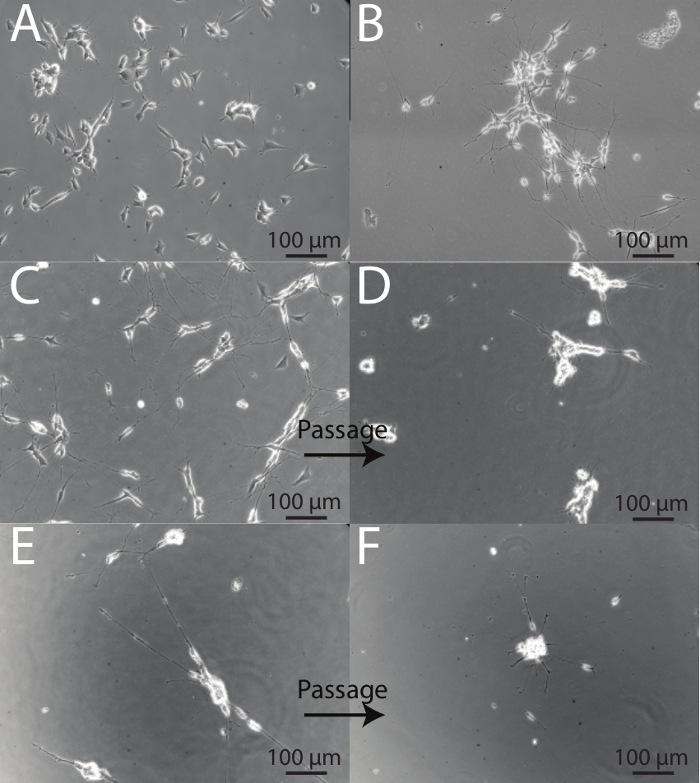
Figure 4: Les étapes intermédiaires du protocole de différenciation (A) 1 jour de différenciation.. Les cellules conservent un phénotype rétractée avec des saillies courtes. (B) Jour 5 de la différenciation. Les cellules ont été exposées à 5 jourss de la privation de sérum (différenciation des médias n ° 1). Les cellules survivantes commencent à se former plus allongé et procédés qui se connectent avec les cellules voisines. (C) Jour 7 de différenciation avant de diviser. Cellules montrent un grand nombre de processus longs, avec un nombre réduit de cellules montrant un phénotype de type epithelial. (D) Jour 8 de différenciation, un jour après le premier passage. Suivant le fractionnement, les corps cellulaires forment des grumeaux et des procédés apparaissent court à la suite de la procédure de passages. (E) Jour 10 de la différenciation, avant de diviser sur des plaques d'ECM revêtu. Cellules montrent plus processus qui établissent des connexions avec les cellules voisines. regroupement de corps cellulaire est également évident. (F) Jour 11 de la différenciation, un jour après la deuxième division. Les cellules sont stressés après la deuxième passage et de nombreux neurones sont finalement perdus. Cependant, la population restante est viable, homogène, et dans le phénotype neuronal. Les corps cellulaires produisent lclusters et processus Ärger commencent à émettre de la base des clusters.
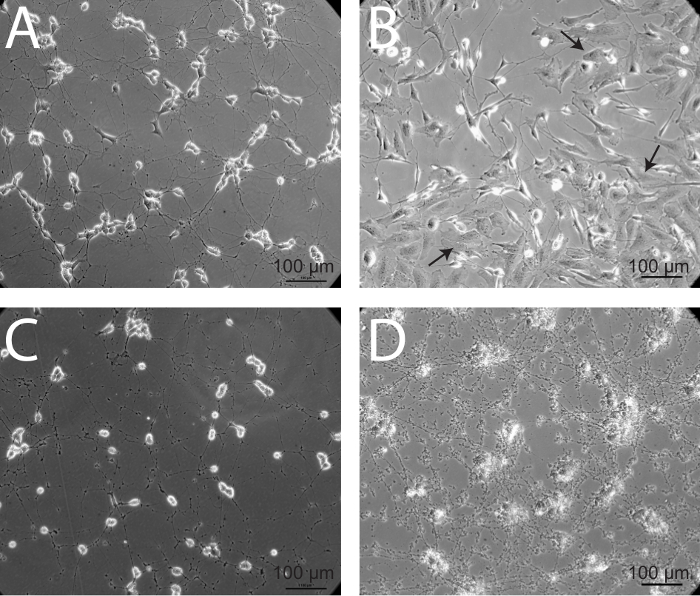
Figure 5:. Prolifération épithéliale et la mort neuronale - deux résultats possibles du processus de différenciation (A) en bonne santé, les neurones SH-SY5Y matures démontrer projections axonales diffuses liaison aux cellules voisines. (B) Dans certains cas, les cellules avec un plus phénotype de type epithelial dépasser cultures de maintenance. Cette sur-population de cellules épithéliales de type peut être dû à des passages fréquents des cultures de maintenance. Ces cultures doivent être jetés, comme les cellules épithéliales de type continueront d'être plus nombreux neurones. Les flèches indiquent les cellules épithéliales de type. Cellules (C) Lorsque SH-SY5Y sont insalubres et commencent à mourir, les corps cellulaires complètent et les processus se dégradent, générant une quantité importante de débris. (D ) une accumulation notable de débris cellulaires et la rétraction des processus neuronaux est évidente dans matures, les neurones différenciés, 4 heures après l'infection avec une souche de virus de l'herpès simplex de type 1 (HSV-1) KOS à une multiplicité d'infection (MOI) de 10 6 PFU.
| Composant | Détails | Stock | Instructions | ||||
| 10 uM de RA | l'acide tout-trans rétinoïque | 5 mM | Remettre en suspension 50 mg RA dans 33,3 ml EtOH à 95%. RA est sensible à la chaleur, la lumière et l'air. Conserver dans un flacon sombre et conserver à 4 ° C pendant jusqu'à 6 semaines. Utiliser à la dilution 1: 500 et dilué dans du milieu de différenciation immédiatement avant l'utilisation | ||||
| (300,44 g / mol) | |||||||
| 1x B-27 | B-27 Supplement | 50x | Décongeler 1-10 ml bouteille et aliquote reste en usage unique aliquots de 1 ml et conserver à -80 ° C. Magasin flacons de 10 ml à -20 ° C | ||||
| 20 mM KCl | Chlorure de potassium | 1 H | Ajouter 250 ml d'eau à 18,6 g KCl et filtre stérile. Ranger à température ambiante | ||||
| (74,55 g / mole) | |||||||
| 2 mM db-AMPc | dibutyryl AMP cyclique | 1 H | Remettre en suspension bouteille pleine en ajoutant 2,04 ml d'eau pour 1 g db-AMPc. Sensible à la lumière et de l'humidité. Magasin à des parties aliquotes de 100 ul ou 200 ul à une température de -20 ° C ou -80 ° C | ||||
| (491,37 g / mol) | |||||||
| 50 ng / ml de BDNF | facteur neurotrophique dérivé du cerveau (BDNF) | - | flacon centrifugeuse pour obtenir la poudre en bas.60; Remettre en suspension 10 ug flacon dans 1 ml Neurobasal + 1x B27 ou 5 ug dans 0,5 ml flacon Neurobasal 1x + B27 pour obtenir 10 ug / ml. Utilisez au 1: 200 dilution. Entreposer des portions de travail à -80 ° C (ex: 250 pi) | ||||
| hiFBS | Inactivé par la chaleur de sérum bovin fœtal | - | Aliquote décongelé FBS dans 50 ml tubes coniques. On chauffe à 56 ° C dans un bain-marie pendant 30 min. Retirer et congeler des aliquotes de travail à -20 ° C | ||||
Tableau 1: solutions et de composants d'actions.
| Croissance multimédia de base | ||
| Composant | Volume 500 ml | Dilution |
| EMEM | 415 ml EMEM | |
| 15% hiFBS | 75 ml hiFBS | |
| 1x Pen / Strep | 5 ml Pen / Strep | 1100 |
| 2 mM de glutamine | 5 ml Glutamine | 1100 |
| * Gardez pendant 6 semaines maximum | ||
| Différenciation des médias n ° 1 | ||
| Composant | Volume 50 ml | Dilution |
| EMEM | 48 ml EMEM | |
| 2,5% hiFBS | 1,3 ml hiFBS | |
| 1x Pen / Strep | 500 pi Pen / Strep | 1100 |
| 2 mM de glutamine | 500 pi glutamine | 1100 |
| 10 uM de RA | 100 pi RA (Stock 5 mM) | 1: 500 |
| * Gardez pendant 2 semaines maximum et ajouter RA immédiatement avantutiliser | ||
| * Ne pas tenir les médias supplémentaires une fois RA est ajouté - RA est instable | ||
| Différenciation des médias n ° 2 | ||
| Composant | Volume 50 ml | Dilution |
| EMEM | 49 ml de EMEM | |
| 1% hiFBS | 500 pi hiFBS | |
| 1x Pen / Strep | 500 pi Pen / Strep | 1100 |
| 2 mM de glutamine | 500 pi glutamine | 1100 |
| 10 uM de RA | 100 pi RA (Stock 5 mM) | 1: 500 |
| * Gardez pendant 2 semaines maximum et ajouter RA immédiatement avant l'utilisation | ||
| * Ne pas tenir les médias supplémentaire surCE RA est ajouté - RA est instable | ||
| Différenciation des médias n ° 3 | ||
| Composant | Volume 50 ml | Dilution |
| Neurobasal | 47 ml Neurobasal | |
| 1x B-27 | 1 ml B-27 (50X actions) | 1h50 |
| 20 mM KCl | 1 ml de KCl (1M stock) | 1h50 |
| 1x Pen / Strep | 500 pi Pen / Strep | 1100 |
| 2 mM GlutamaxI | 500 GlutamaxI pi (100x stock) | 1100 |
| 50 ng / ml de BDNF | 250 pi BDNF stock (10 ug / ml) | 1: 200 |
| 2 mM dibutyryl AMP cyclique (db-AMPc) | 100 pi db-AMPc (1M stock) | 1: 500 |
| 10 uM de RA | 100 pi RA (5 mM) | 1: 500 |
| * Gardez pendant 2 semaines maximum et ajouter RA immédiatement avant l'utilisation | ||
| * Ne pas tenir les médias supplémentaires une fois RA est ajouté - RA est instable | ||
Tableau 2: Médias recettes.
Discussion
Le protocole ci-dessus fournit une méthode simple et reproductible pour produire des cultures de neurones humains homogènes et viables. Ce protocole utilise des techniques et des pratiques qui intègrent plusieurs méthodes publiées antérieurement 1-4 et a pour objectif de définir les meilleures pratiques de chacun. La différenciation des cellules SH-SY5Y repose sur la privation de sérum progressive; l'addition de l'acide rétinoïque, les facteurs neurotrophiques et les protéines de la matrice extracellulaire; et le fractionnement de série pour sélectionner pour les neurones matures adhérentes différenciés. Cette lignée cellulaire commence comme une population hétérogène de cellules adhérentes et en suspension. Ce protocole vise à préserver les deux populations en retenant lavages PBS avant repiquage ou le support changement, mais une certaine perte de cellules en suspension est nécessaire pour permettre l'élimination des cellules épithéliales mortes. La méthode présentée produire une population homogène de neurones dissociés humain SH-SY5Y pour d'autres expérimentations.
Bien Other agents peuvent être utilisés pour orienter la différenciation des neurones cholinergiques dans un phénotype adrénergique ou 16,17, l'utilisation de RA pour différencier SH-SY5Y ont été utilisées précédemment pour produire des neurones à un phénotype dopaminergique 37,38. Addition de RA a été montré pour induire la différenciation cellulaire par l'intermédiaire d'un certain nombre de mécanismes, y compris arrêter la progression du cycle cellulaire de G0 / G1, ce qui augmente l'expression de la kinase dépendante de la cycline (CDK) des inhibiteurs p21 et p27 Kip1 et les protéines anti-apoptotiques Bcl -2 et Bcl-xL, et l'amélioration de l'activité PI3K / AKT qui joue un rôle dans le développement et la différenciation des neurites 39.
Il est impératif lors de l'exécution de ce protocole à utiliser les techniques de manutention douces et stériles, comme SH-SY5Y sont très sensibles au changement soudain. Il est à cause de cette sensibilité que le protocole de la privation de sérum progressive est préférable à des protocoles qui nécessitent des changements rapides dans medcomposition IA. Lors du fractionnement des cellules aux jours 7 et 10, il est important de minimiser la quantité de temps pendant laquelle les neurones dissociés passent partiellement à la trypsine. Cela réduit la probabilité de neurones nuisibles et favorise la libération préférentielle des neurones par rapport aux cellules épithéliales, qui prennent plus de temps à se détacher. Ceci aide à établir une population neuronale plus homogène de cellules et pour réduire au minimum la contamination par la prolifération des cellules épithéliales et indifférenciées. Il est également important de noter que les réactifs utilisés pour la culture et la différenciation des cellules SH-SY5Y doivent être remplacés régulièrement et ne pas être maintenu indéfiniment. Par exemple, la croissance des médias de base peut être maintenue jusqu'à 6 semaines alors que la différenciation des médias ne doit être conservé jusqu'à 2 semaines. Cela garantit des réactifs tels que dbcAMP et BDNF sont frais et stable. En outre, préparé RA ne doit être stocké pendant jusqu'à 6 semaines et dans l'obscurité avant un nouveau lot doit être faite. Nous avons observé une plus grande cohérence des résultats neuronales wvec ces précautions.
Une fois que les cellules ont été différenciées en neurones matures, ils peuvent être maintenus pendant jusqu'à 2 semaines différenciation post-terminal et utilisés pour l'expérimentation. À la suite de la différenciation terminale, les médias doivent être changés tous les 3-4 jours (différenciation des médias 3 #). Contrairement aux neurones différenciés, flacons de maintenance contenant des cultures de cellules SH-SY5Y indifférenciées peuvent être conservés pendant plusieurs semaines avec des passages réguliers. Il est important de cultures d'entretien de passage régulièrement, pour éviter une sur-population de cellules épithéliales analogue qui ne sont plus capables de se différencier en neurones. Lorsque ces cellules sont plus nombreux que ceux qui ont des neuro-potentiel, privation de sérum provoque une part disproportionnée de la mort cellulaire. cultures indifférenciées ne peuvent être maintenues jusqu'à environ 15 passages. Une fois que la culture a dépassé d'environ 15 passages, les cellules indifférenciées commencent à mourir et ont un aspect malsain rugueuse. En outre, différenciation des cellules SH-SY5Y haute passage est plus difficile que moins de cellules survivront chaque groupe, et ceux qui n'agréger souvent deux corps cellulaires et des axones, ce qui rend les analyses ultérieures plus difficile.
Il y a une nette diminution du nombre de cellules au cours du processus de différenciation des cellules autant de perte ou de ne pas survivre au processus de séparation. Par conséquent, au début d'une expérience impliquant des cellules SH-SY5Y différenciées, il faut tenir compte de la perte de neurones ~ 30-40%, et d'assurer un bon nombre de cellules est plaquée au début pour obtenir le rendement désiré. Pendant le dépôt de 100.000 cellules produit beaucoup de neurones, SH-SY5Y matures sains, moins ou de plus grands nombres peuvent être initialement étalées en fonction des besoins expérimentale.
Il est clair que les neurones SH-SY5Y complètement différenciées fournissent une approximation plus proche de neurones humains matures trouvés in vivo que leurs homologues de cellules souches indifférenciées (figure 2). Ces neurones fournissent un modèle avantageux pour caractérisations avenir de leur neurobiologie, pour l'étude des virus neurotropes, ou pour le dépistage de la toxicité de chimiothérapie dans les neurones.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We are grateful for the contributions of Yolanda Tafuri in optimizing conditions for SH-SY5Y differentiation, and for the support of Dr. Lynn Enquist, in whose lab this work was initiated. Y. Tafuri contributed the images shown in Figure 3. This work was supported by the NIH-NIAID Virus Pathogens Resource (ViPR) Bioinformatics Resource Center (MLS and L. Enquist) and K22 AI095384 (MLS).
matériels
| Name | Company | Catalog Number | Comments |
| B-27 | Invitrogen | 17504-044 | See Table 1 for preparation |
| Brain-Derived Neurotrophic Factor (BDNF) | Sigma | SRP3014 (10ug)/B3795 (5ug) | See Table 1 for preparation |
| dibutyryl cyclic AMP (db-cAMP) | Sigma | D0627 | See Table 1 for preparation |
| DMSO | ATCC | 4-X | - |
| Minimum Essential Medium Eagle (EMEM) | Sigma | M5650 | - |
| Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | See Table 1 for preparation |
| GlutamaxI | Life Technologies | 35050-061 | - |
| Glutamine | Hyclone | SH30034.01 | - |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-1 | See Table 1 for preparation |
| MaxGel Extracellular Matrix (ECM) solution | Sigma | E0282 | See step 11 of the protocol |
| Neurobasal | Life Technologies | 21103-049 | - |
| Penicillin/Streptomycin (Pen/Strep) | Life Technologies | 15140-122 | - |
| Retinoic acid (RA) | Sigma | R2625 | Should be stored in the dark at 4° C because this reagent is light sensitive |
| SH-SY5Y Cells | ATCC | CRL-2266 | - |
| 0.5% Trypsin + EDTA | Life Technologies | 15400-054 | - |
| Falcon 35mm TC dishes | Falcon (A Corning Brand) | 353001 | - |
Références
- Christensen, J., Steain, M., Slobedman, B., Abendroth, A. Differentiated Neuroblastoma Cells Provide a Highly Efficient Model for Studies of Productive Varicella-Zoster Virus Infection of Neuronal Cells. Journal of Virology. 85 (16), 8436-8442 (2011).
- Gimenez-Cassina, A., Lim, F., Diaz-Nido, J. Differentiation of a human neuroblastoma into neuron-like cells increases their susceptibility to transduction by herpesviral vectors. Journal of Neuroscience Research. 84 (4), 755-767 (2006).
- Biedler, J. L., Roffler-Tarlov, S., Schachner, M., Freedman, L. S. Multiple Neurotransmitter Synthesis by Human Neuroblastoma Cell Lines and Clones. Cancer Research. 38 (11 Pt 1), 3751-3757 (1978).
- Encinas, M., Iglesias, M., et al. Sequential Treatment of SH-SY5Y Cells with Retinoic Acid and Brain-Derived Neurotrophic Factor Gives Rise to Fully Differentiated, Neurotrophic Factor-Dependent, Human Neuron-Like Cells. Journal of Neurochemistry. 75 (3), 991-1003 (2000).
- Otey, C. A., Boukhelifa, M., Maness, P. B35 neuroblastoma cells: an easily transfected, cultured cell model of central nervous system neurons. Methods in Cell Biology. 71, 287-304 (2003).
- LePage, K. T., Dickey, R. W., Gerwick, W. H., Jester, E. L., Murray, T. F. On the use of neuro-2a neuroblastoma cells versus intact neurons in primary culture for neurotoxicity studies. Critical Reviews in Neurobiology. 17 (1), 27-50 (2005).
- Shafer, T. J., Atchison, W. D. Transmitter, ion channel and receptor properties of pheochromocytoma (PC12) cells: a model for neurotoxicological studies. Neurotoxicology. 12 (3), 473-492 (1991).
- Yue, F., Cheng, Y., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Cheng, Y., Ma, Z., et al. Principles of regulatory information conservation between mouse and conservation between mouse and human. Nature. 515 (7527), 371-375 (2014).
- Stergachis, A. B., Neph, S., et al. Conservation of trans-acting circuitry during mammalian regulatory evolution. Nature. 515 (7527), 365-370 (2014).
- Lin, S., Lin, Y., et al. Comparison of the transcriptional landscapes between human and mouse tissues. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 17224-17229 (2014).
- Coyle, D. E., Li, J., Baccei, M. Regional Differentiation of Retinoic Acid-Induced Human Pluripotent Embryonic Carcinoma Stem Cell Neurons. PLoS ONE. 6 (1), e16174 (2011).
- Mostert, M. M., van de Pol, M., et al. Fluorescence in situ hybridization-based approaches for detection of 12p overrepresentation, in particular i(12p), in cell lines of human testicular germ cell tumors of adults. Cancer Genetics and Cytogenetics. 87 (2), 95-102 (1996).
- Hu, B. -. Y., Weick, J. P., et al. Neural differentiation of human induced pluripotent stem cells follows developmental principles but with variable potency. Proceedings of the National Academy of Sciences of the United States of America. 107 (9), 4335-4340 (2010).
- Biedler, J. L., Helson, L., Spengler, B. A. Morphology and growth, tumorigenicity, and cytogenetics of human neuroblastoma cells in continuous culture. Cancer Research. 33 (11), 2643-2652 (1973).
- Påhlman, S., Ruusala, A. I., Abrahamsson, L., Mattsson, M. E., Esscher, T. Retinoic acid-induced differentiation of cultured human neuroblastoma cells: a comparison with phorbolester-induced differentiation. Cell Differentiation. 14 (2), 135-144 (1984).
- Xie, H., Hu, L., Li, G. SH-SY5Y human neuroblastoma cell line: in vitro cell model of dopaminergic neurons in Parkinson’s disease. Chinese Medical Journal. 123 (8), 1086-1092 (2010).
- Kovalevich, J., Langford, D. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology. Methods in Molecular Biology. 1078, 9-21 (2013).
- Påhlman, S., Hoehner, J. C., et al. Differentiation and survival influences of growth factors in human neuroblastoma. European Journal of Cancer. 31 (4), 453-458 (1995).
- Cheung, Y. -. T., Lau, W. K. -. W., et al. Effects of all-trans-retinoic acid on human SH-SY5Y neuroblastoma as in vitro model in neurotoxicity research. Neurotoxicology. 30 (1), 127-135 (2009).
- Agholme, L., Lindström, T., Kågedal, K., Marcusson, J., Hallbeck, M. An in vitro model for neuroscience: differentiation of SH-SY5Y cells into cells with morphological and biochemical characteristics of mature neurons. Journal of Alzheimer's disease: JAD. 20 (4), 1069-1082 (2010).
- La Monica, N., Racaniello, V. R. Differences in replication of attenuated and neurovirulent polioviruses in human neuroblastoma cell line SH-SY5Y. Journal of Virology. 63 (5), 2357-2360 (1989).
- Cordey, S., Petty, T. J., et al. Identification of Site-Specific Adaptations Conferring Increased Neural Cell Tropism during Human Enterovirus 71 Infection. PLoS Pathog. 8 (7), e1002826 (2012).
- Xu, L. -. J., Jiang, T., et al. Global Transcriptomic Analysis of Human Neuroblastoma Cells in Response to Enterovirus Type 71 Infection. PLoS ONE. 8 (7), e65948 (2013).
- Luo, M. H., Fortunato, E. A. Long-term infection and shedding of human cytomegalovirus in T98G glioblastoma cells. Journal of Virology. 81 (19), 10424-10436 (2007).
- Sun, Z., Yang, H., Shi, Y., Wei, M., Xian, J., Hu, W. Establishment of a cell model system of herpes simplex virus type II latent infection and reactivation in SH-SY5Y cells. Wei Sheng Wu Xue Bao = Acta Microbiologica Sinica. 50 (1), 98-106 (2010).
- Yun, S. -. I., Song, B. -. H., et al. A molecularly cloned, live-attenuated japanese encephalitis vaccine SA14-14-2 virus: a conserved single amino acid in the ij Hairpin of the Viral E glycoprotein determines neurovirulence in mice. PLoS pathogens. 10 (7), e1004290 (2014).
- Garrity-Moses, M. E., Teng, Q., Liu, J., Tanase, D., Boulis, N. M. Neuroprotective adeno-associated virus Bcl-xL gene transfer in models of motor neuron disease. Muscle & Nerve. 32 (6), 734-744 (2005).
- Kalia, M., Khasa, R., Sharma, M., Nain, M., Vrati, S. Japanese Encephalitis Virus Infects Neuronal Cells through a Clathrin-Independent Endocytic Mechanism. Journal of Virology. 87 (1), 148-162 (2013).
- Haedicke, J., Brown, C., Naghavi, M. H. The brain-specific factor FEZ1 is a determinant of neuronal susceptibility to HIV-1 infection. Proceedings of the National Academy of Sciences. 106 (33), 14040-14045 (2009).
- Xu, K., Liu, X. -. N., et al. Replication-defective HSV-1 effectively targets trigeminal ganglion and inhibits viral pathopoiesis by mediating interferon gamma expression in SH-SY5Y cells. Journal of molecular neuroscience: MN. 53 (1), 78-86 (2014).
- Oh, J., Fraser, N. W. Temporal association of the herpes simplex virus genome with histone proteins during a lytic infection. Journal of Virology. 82 (7), 3530-3537 (2008).
- Stiles, K. M., Milne, R. S. B., Cohen, G. H., Eisenberg, R. J., Krummenacher, C. The herpes simplex virus receptor nectin-1 is down-regulated after trans-interaction with glycoprotein D. Virology. 373 (1), 98-111 (2008).
- Thomas, D. L., Lock, M., Zabolotny, J. M., Mohan, B. R., Fraser, N. W. The 2-kilobase intron of the herpes simplex virus type 1 latency-associated transcript has a half-life of approximately 24 hours in SY5Y and COS-1 cells. Journal of Virology. 76 (2), 532-540 (2002).
- Handler, C. G., Cohen, G. H., Eisenberg, R. J. Cross-linking of glycoprotein oligomers during herpes simplex virus type 1 entry. Journal of Virology. 70 (9), 6076-6082 (1996).
- Nicola, A. V., Hou, J., Major, E. O., Straus, S. E. Herpes Simplex Virus Type 1 Enters Human Epidermal Keratinocytes, but Not Neurons, via a pH-Dependent Endocytic Pathway. Journal of Virology. 79 (12), 7609-7616 (2005).
- Korecka, J. A., van Kesteren, R. E., et al. Phenotypic characterization of retinoic acid differentiated SH-SY5Y cells by transcriptional profiling. PloS One. 8 (5), e63862 (2013).
- Presgraves, S. P., Ahmed, T., Borwege, S., Joyce, J. N. Terminally differentiated SH-SY5Y cells provide a model system for studying neuroprotective effects of dopamine agonists. Neurotoxicity Research. 5 (8), 579-598 (2004).
- Qiao, J., Paul, P., et al. PI3K/AKT and ERK regulate retinoic acid-induced neuroblastoma cellular differentiation. Biochemical and Biophysical Research Communications. 424 (3), 421-426 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon