Method Article
Utilisation de Click Chemistry pour mesurer l'effet de l'infection virale sur Host-Cell Synthèse des ARN
Dans cet article
Résumé
Cette méthode décrit l'utilisation de la chimie clic pour mesurer les changements dans la transcription de la cellule hôte après infection par le virus de la fièvre de la Vallée du Rift (FVR) souche MP-12. Les résultats peuvent être visualisés qualitativement par microscopie à fluorescence ou obtenus quantitativement par cytométrie de flux. Cette méthode est adaptable pour une utilisation avec d'autres virus.
Résumé
De nombreux virus à ARN ont développé la capacité à inhiber la transcription de la cellule hôte comme un moyen de contourner les défenses cellulaires. Pour l'étude de ces virus, il est donc important de disposer d'un moyen rapide et fiable de mesure de l'activité transcriptionnelle dans les cellules infectées. Traditionnellement, la transcription a été mesurée soit par incorporation de nucléosides radioactifs tels que 3H-uridine suivie d'une détection par autoradiographie ou comptage à scintillation, ou l'incorporation d'uridine halogénés analogues tels que le 5-bromouridine (BRU) suivie d'une détection par coloration immunologique. L'utilisation d'isotopes radioactifs, cependant, nécessite un équipement spécialisé et n'est pas réalisable dans un certain nombre de paramètres de laboratoire, tandis que la détection de BrU peut être lourde et peut souffrir d'une faible sensibilité.
La chimie de clic récemment mis au point, ce qui implique une formation de triazole cuivre catalysée par un azoture et un alcyne, offre maintenant une rapide et highly alternatif sensibles à ces deux méthodes. Cliquez chimie est un processus en deux étapes dans lequel ARN naissant est d'abord marquées par incorporation de l'uridine analogique 5 éthynyluridine (UE), suivie par la détection de l'étiquette avec un azoture fluorescent. Ces azides sont disponibles en plusieurs fluorophores différents, ce qui permet un large éventail d'options pour la visualisation.
Ce protocole décrit une méthode permettant de mesurer la répression de la transcription dans les cellules infectées par le virus de la fièvre de la Vallée du Rift (FVR) souche MP-12 à l'aide click chemistry. Parallèlement, l'expression de protéines virales dans ces cellules est déterminé par immunomarquage intracellulaire classique. Les étapes 1 à 4 en détail une méthode pour visualiser la répression de la transcription par microscopie à fluorescence, tandis que les étapes 5 à 8 détaillent une méthode pour quantifier la répression de la transcription par cytométrie de flux. Ce protocole est facilement adaptable pour une utilisation avec d'autres virus.
Introduction
Traditionnellement, l'activité transcriptionnelle a été mesurée par incorporation de deux radioactif (3 H-uridine) ou 1 (BRU) 2 nucléosides halogénés en ARN naissants. Ces analogues d'uridine sont prises par les cellules, convertis en uridine triphosphate (UTP) à travers la voie de récupération nucléosidique, et par la suite incorporés dans l'ARN nouvellement synthétisé. 3H-uridine peuvent être détectés par autoradiographie, ce qui peut prendre beaucoup de temps, ou scintillation comptage, qui nécessite un équipement spécialisé. En outre, l'utilisation d'isotopes radioactifs ne peut être pratique dans un certain nombre de paramètres de laboratoire, y compris les laboratoires de biosécurité Haut de confinement. BrU peut être détectée par immunomarquage avec des anticorps anti-Bru, qui peuvent nécessiter perméabilisation dur pour assurer l'accès de l'anticorps dans le noyau ou la dénaturation partielle de l'ARN, que la structure secondaire de l'ARN pourrait être un encombrement stérique de la liaison d'anticorps.
_content "> Le protocole décrit ici utilise le récemment développé click chemistry 3 pour mesurer l'activité transcriptionnelle dans les cellules infectées par la souche RVFV MP-12. click chemistry s'appuie sur un cuivre très sélective et efficace (I) catalysée par réaction de cycloaddition entre un alcyne et un groupement azoture de 4,5. Dans ce protocole, ARN naissant dans les cellules infectées est d'abord marqué par l'incorporation de l'uridine analogique de l'UE. Dans un deuxième temps, le incorporée UE est détectée par réaction avec un azoture fluorescent. Les principaux avantages de cette méthode sont (1) qu'il ne nécessite pas l'utilisation d'isotopes radioactifs et (2) qu'il ne nécessite pas de perméabilisation sévère ou dénaturation de l'ARN. avec un poids moléculaire de moins de 50 Da, l'accès de l'azoture fluorescent n'est pas entravée par l'insuffisance structure secondaire perméabilisation ou d'ARN. Par ailleurs, les chercheurs ne sont pas limités dans leur choix d'anticorps primaires en combinant la détection de l'ARN avec une classeimmunocoloration iCal pour les protéines virales.Deux méthodes différentes sont décrites dans ce protocole: l'un pour la visualisation de la transcription par microscopie à fluorescence (étapes 1-4), et l'autre pour quantifier la transcription par cytométrie de flux (étapes 5-8). Ces deux méthodes combinent l'étiquetage des ARN naissant avec un immunomarquage intracellulaire des protéines virales, ce qui permet d'établir une corrélation entre l'activité transcriptionnelle et l'infection virale sur une base par cellule à cellule.
Les auteurs ont utilisé avec succès le protocole décrit ici de déterminer l'activité de transcription dans les cellules infectées par la souche RVFV MP-12 6 cellules infectées par différents-12 MP mutants 7,8, 9, et les cellules infectées par le virus Toscana (TOSV) 10. Le protocole décrit ici peut être facilement adapté pour une utilisation avec différents virus et a le potentiel d'être modifié pour inclure immunofluorescence des protéines virales ou cellulaires spécifiques.
Protocole
Analyse de la transcription par microscopie à fluorescence
1. Infecter les cellules avec MP-12 et étiquettes ARN naissant avec l'UE
- Placer les lamelles rondes de 12 mm dans la plaque de culture tissulaire à 12 puits, une lamelle par puits.
Note: Si les cellules ont du mal à adhérer à lamelles, manteau avec de la poly-L-lysine (MW ≥ 70.000) avant de le placer dans les puits. Dans ce but, des lamelles de plonger dans une solution mg / ml stérile à 0,1 en H 2 O de poly-L-lysine pendant 5 min. Rincer lamelles avec H 2 O stérile et sécher à l'air pendant au moins 2 heures.
- Aux semences de 293 cellules sur des lamelles, ajouter 5 x 10 4 cellules dans un milieu de croissance 1 ml (DMEM contenant 10% de sérum de veau foetal, 100 U / ml de pénicilline et 100 mg / ml de streptomycine) par puits. Incuber dans un incubateur humidifié à 37 ° C et 5% de CO 2 O / N.
- Infecter les cellules avec MP-12 à une multiplicité d'infection (moi) de 3. Inclure au moins deux puits non infectés: l'un des deux puits serviront de témoins non infectés, l'autre sera traité avec actinomycine D (ACTD) à l'étape 1.5 en tant que témoin pour la répression de la transcription. Retirez le milieu de croissance et de diluer le stock de virus de sorte que le volume total ajouté à chaque puits est de 200 ml. Incuber pendant 1 h dans un incubateur humidifié à 37 ° C et 5% de CO 2.
Remarque: Au lieu d'infecter les cellules, les cellules peuvent également être transfectées avec l'ADN plasmidique ou synthétisés in vitro d'ARN codant pour une protéine virale spécifique. Dans ce but, la transfection de cellules avec un réactif de transfection chimique approprié conformément aux instructions du fabricant et passez à l'étape 1.5 à 16 h après la transfection. Il est conseillé d'optimiser les conditions de transfection et le temps d'incubation avant l'ARN étiquetage et la fixation.
- Retirer inoculum et ajouter 1 ml de milieu de croissance frais par puits. Incuber à 37 ° C pendant 15 heures.
- À 15 h après l'infection (HPI), remplacer le milieu de croissance avec un milieu contenant 1 mM UE. Pour l'un des puits infectés simulacres, ajouter également 5 ug / ml ACTD. Cela servira de contrôle pour la suppression de la transcription, comme ACTD inhibe la synthèse de l'ARN ADN-dépendante. Retour aux cellules de l'incubateur.
- A 16 HPI, éliminer le milieu et laver les lamelles une fois avec 1 ml de PBS (KCl 0,20 g / L, KH 2 PO 4 0,20 g / L, NaCl 8,00 g / L, Na 2 HPO 4 1,15 g / L, pH 7,4) par puits. Fixer les cellules en ajoutant 1 ml de paraformaldéhyde 4% (PFA) par puits et incuber pendant 30 min à température ambiante.
> NOTE: Pour préparer la solution de fixation de 4% PFA, dissoudre 10 g de paraformaldéhyde dans 150 ml H 2 O chauffée à 60 ° C sur un agitateur magnétique chauffant. Ajouter 500 ul de NaOH 1M et continuer à remuer jusqu'à ce que solution devient limpide. Filtrer la solution PFA travers un papier filtre pour éliminer les particules et ajouter un tampon phosphate 62,5 ml (77 mM NaH 2 PO 4, 287 mM Na 2 HPO 4, pH 7,4). Ajoutez H 2 O jusqu'à un volume total de 250 ml. Congeler à -20 ° C en aliquots à usage unique.
- Laver une fois avec 1 ml de PBS par puits. Pas le temps d'incubation est nécessaire pour cela et toutes les étapes de lavage ultérieures. Procéder immédiatement à l'étape 2.
Note: Il est important de procéder immédiatement à la réaction de clic, comme l'ARN dégénère si elles sont conservées à ce stade pour des périodes prolongées; une perte du signal de fluorescence ARN peut déjà être observée si les cellules sont conservées pendant 1 h à 4 ° C . De même, si parla formation d'une expérience de stage de temps, n'oubliez pas de l'étiquette, fixer, et aux taches tous les échantillons en même temps.
2. Cliquez réaction pour détecter les ARN marqué
- Perméabiliser les cellules par addition de 1 ml de 0,2% de Triton X-100 dans du PBS. Incuber pendant 10 min à température ambiante.
Note: Toutes les solutions utilisées dans les étapes 2.1 à 2.3 doivent être nucléase libre.
- Laver trois fois avec 1 ml de PBS par puits.
- Retirez les lamelles sur la plaque de 12 puits et le transfert dans la chambre humide. Couvrir chaque lamelle avec 50 - une solution de coloration de clic de 100 ul (Tris 100 mM, pH 8,5, 1 mM de CuSO 4, 20 uM d'azides fluorescente [excitation / émission maximale: 590/617 nm], l'acide ascorbique 100 mM) chacune. Incuber pendant 1 heure à température ambiante dans l'obscurité.
Note: Pour assembler la chambre humide, tapisser le fond d'une culture cellulaire ou boîte de Pétri avec un 10 cm de diamètre avec un film de paraffine plastique. Ligne à l'intérieur du bord de la dish avec du papier absorbant humide. Placer les lamelles sur la pellicule de paraffine plastique.
Remarque: Veillez à ne pas laisser les lamelles se dessèchent pas pendant cette ou toute autre étape dans le protocole. Il est préférable d'ajouter la solution de coloration à chaque lamelle directement après qu'il a été placé dans la chambre humide.
Note: Préparer la solution de coloration de clic frais immédiatement avant cette étape. Les solutions mères de Tris 1,5 M pH 8,5, 100 mM de CuSO 4, et de l'acide ascorbique 500 mM peuvent être conservés à 4 ° C. Toutefois, jeter toute solution mère d'acide ascorbique qui a jauni.
Remarque: Veillez à sélectionner un fluorophore qui correspond aux filtres sur votre microscope à fluorescence.
- Retirez les lamelles de la chambre humide et le placer dans une assiette fraîche de 12 puits et laver trois fois avec 1 ml de PBS par puits.
Remarque: Si aucun detection des protéines virales est souhaitée, des lamelles peut être monté et imagée après cette étape (passez à l'étape 3.3).
3. Immunofluorescence pour détecter l'expression de protéines virales
- Ajouter 1 ml de tampon de blocage (3% (p / v) de sérum albumine bovine (BSA) dans du PBS) à chaque puits et incuber pendant 30 min à température ambiante dans l'obscurité.
- Retirez les lamelles sur la plaque de 12 puits, le transfert dans la chambre humide et couvrir avec 50 - 100 pi d'anticorps primaire (anti-FVR, un cadeau aimable du Dr RB Tesh, UTMB) dilué dans du tampon de blocage (1:500). Incuber pendant 1 heure à température ambiante dans l'obscurité.
Remarque: Lors de l'adaptation de ce protocole à utiliser avec un autre virus, déterminer la dilution optimale pour votre premier anticorps primaire.
Note: Alternativement, cette étape peut être effectuée O / N à 4 ° C dans l'obscurité.
- Retirez les lamelles de la chambre humide et remettez-le dans la plaque de 12 puits et lavertrois fois avec 1 ml de PBS par puits.
- Retirez les lamelles de place de 12 puits, lieu dans la chambre humide et couvrir avec 50 - 100 pi d'anticorps secondaire (IgG anti-souris conjugué à un colorant fluorescent [excitation / émission maximale: 495/519 nm]) dilué dans du tampon de blocage (1: 500). Incuber pendant 1 heure à température ambiante dans l'obscurité.
Remarque: Veillez à sélectionner un anticorps secondaire qui peut reconnaître votre anticorps primaire et correspond aux filtres sur votre microscope à fluorescence.
Note: Si vous le souhaitez, à 200 ng / ml DAPI peut être ajouté à la dilution d'anticorps secondaire de visualiser les noyaux.
- Retirez les lamelles de la chambre humide et remettez-le dans la plaque de 12 puits et laver trois fois avec 1 ml de PBS par puits.
- Monter les lamelles en plaçant une goutte (ca. 15 pi) de Fluoromount-G sur une lame de microscope. Trempez la lamelle en H 2 O, enlever l'excès de H 2 O en touchant èmecôté de l'e sur une serviette en papier, et le lieu du côté de la cellule vers le bas dans la goutte de Fluoromount-G. Air sec pendant 5 min.
Remarque: Si l'imagerie sur un microscope inversé, permettre Fluoromount-G à se solidifier à 4 ° CO / N ou apposer les lamelles à la lame de microscope en scellant le bord avec du vernis à ongles transparent.
Note: Les diapositives peuvent être visualisés immédiatement ou conservés à 4 ° C dans l'obscurité pendant une semaine.
4. Acquisition de données
- L'image en utilisant un microscope à fluorescence.
Remarque: Veillez à sélectionner fluorophores appropriés qui peuvent être visualisés à l'aide de votre microscope. Pour référence, voici les fluorophores et des jeux de filtres utilisés pour acquérir des images présentées dans cette publication.
DAPI:
filtre d'excitation: BP 330-385
Dichromatique miroir: 400 DM
Filtre d'émission: LP 420
Fluorophore avec une excitation / émission maximale de 495/519:
filtre d'excitation: BP 460-490
Dichromatique miroir: DM 505
Filtre d'émission: LP 510
Fluorophore avec une excitation / émission maximale de 590/617:
filtre d'excitation: BP 545-580
Dichromatique miroir: 600 DM
Filtre d'émission: LP 610
L'analyse de la transcription par cytométrie de flux
5. Infecter les cellules avec MP-12 et étiquettes ARN naissant avec l'UE
- Graine de 293 cellules en plaque de culture tissulaire à 6 puits dans un milieu de croissance (DMEM contenant 10% de sérum de veau foetal, 100 U / ml de pénicilline, 100 pg / ml de streptomycine). Incuber dans un incubateur humidifié à 37 ° C et 5% de CO 2, jusqu'à ce que les cellules ont atteint 80 - 100% de confluence.
- Infecter les cellules avec MP-12 à une MOI de 3. Inclure au moins deux puits non infectés: l'un des deux puits servira de témoin non infecté, l'autre sera traité avec ACTD à l'étape5.4. Retirez le milieu de croissance et de diluer le stock de virus de sorte que le volume total ajouté à chaque puits est de 400 pi. Incuber pendant 1 h dans un incubateur humidifié à 37 ° C et 5% de CO 2.
- Retirer inoculum et ajouter 2 milieu de croissance frais ml par puits. Incuber à 37 ° C pendant 12 heures.
Remarque: Si l'adaptation de ce protocole pour l'utilisation avec un autre virus, il est conseillé d'effectuer une expérience de stage de temps pour déterminer le moment optimal pour l'étiquetage et la récolte. Mettre en place cette évolution dans le temps de sorte que les temps d'infection sont décalés et tous les échantillons peuvent être étiquetés, récolté, et colorées en même temps.
- A 12 HPI, remplacer le milieu de croissance avec un milieu contenant 0,5 mM UE. Pour l'un des puits infectés simulacres, ajouter également 5 ug / ml ACTD. Cela servira de contrôle pour la suppression de la transcription, comme ACTD inhibe la synthèse de l'ARN ADN-dépendante. Retour aux cellules de l'incubateur.
- À 13 HPI, laver les cellules une fois l'esprith PBS et la récolte par la trypsine des cellules. Laver les cellules récoltées trois fois avec du PBS contenant 1 mM EDTA (PBS-EDTA).
Remarque: Pendant ce sujet et les étapes ultérieures, ne pas centrifuger les cellules plus rapidement que 500 - 1000 xg pour éviter la rupture des cellules. Centrifuger les cellules pendant 1 - 2 min à sédiments.
Remarque: Si un immunomarquage de surface est prévu après la réaction clic, la récolte en utilisant une spatule en caoutchouc ou d'un grattoir cellulaire jetable à la place.
- Fixer les cellules en les remettant en suspension dans 1 ml de PFA 4% et incuber pendant 30 min à température ambiante. Reportez-vous à l'étape 1.6 pour obtenir des instructions sur la façon de préparer PFA 4%.
- Laver une fois avec 1 ml de PBS-EDTA par puits. Procéder immédiatement à l'étape 6.
Note: Il est important de procéder immédiatement à la réaction de clic, comme l'ARN dégénère si elles sont conservées à ce stade pour des périodes de temps prolongées. De même, si vous effectuez un moment cexpérience ourse, n'oubliez pas d'étiqueter, fixer et colorer tous les échantillons en même temps.
6. Cliquez réaction pour détecter les ARN marqué
- Perméabiliser les cellules en remettant en suspension dans 0,5 ml de 0,2% de Triton X-100 dans du PBS. Incuber pendant 10 min à température ambiante.
Note: Toutes les solutions utilisées dans les étapes 6.1 à 6.3 doivent être nucléase libre.
Note: Si les cellules ne sont pas correctement les sédiments au cours de cette étape, augmenter le temps de centrifugation de 5 min. comportement de sédimentation va s'améliorer une fois que les cellules sont mises en suspension dans un tampon FACS (étape 6.4).
- Laver une fois avec 1 ml de PBS.
Note: Ne pas utiliser EDTA dans cette étape car cela chélate le Cu 2 + ions nécessaires à la réaction de clic.
- Remettre les cellules dans 200 ul de solution de coloration de clic (Tris 100 mM pH 8,5, 1 mM CuSO 4, 200 nM azoture marqué par un colorant fluorescent [HTitation / émission maximale: 650/665 nm], acide ascorbique de 100 mm). Incuber pendant 1 heure à température ambiante dans l'obscurité.
Note: Préparer la solution de coloration de clic frais immédiatement avant cette étape. Les solutions mères de Tris 1,5 M pH 8,5, 100 mM de CuSO 4, et de l'acide ascorbique 500 mM peuvent être conservés à 4 ° C. Toutefois, jeter toute solution mère d'acide ascorbique qui a jauni.
Note: Si les cellules s'agrègent lors de cette étape, remettre en suspension par pipetage de haut en bas plusieurs fois.
Remarque: Veillez à sélectionner un fluorophore qui peut être détecté par votre cytomètre en flux.
Note: préparent également un échantillon des cellules infectées qui ne sont pas soumises à la procédure de coloration de clic; ceux-ci seront nécessaires pour l'étalonnage du cytomètre de flux. Soit utiliser la moitié des cellules infectées ou comportent un supplément de bien infecté à l'étape 5.2. Ces concellules contrôle seront immunocolorées à l'étape 7.1.
- Laver deux fois avec du tampon FACS (PBS contenant 1 mM d'EDTA et 0,5% (p / v) BSA).
Remarque: Si aucun immunomarquage des protéines virales est souhaitée, les cellules peuvent être analysés immédiatement (passez à l'étape 8).
7. Immunofluorescence pour détecter l'expression de protéines virales
- Remettre les cellules dans 200 ul d'anticorps primaire (anti-FVR) dilué dans tampon FACS (1:10,000) et incuber pendant 1 heure à température ambiante dans l'obscurité.
Note: Alternativement, cette étape peut être effectuée O / N à 4 ° C dans l'obscurité.
Note: préparent également un échantillon de cellules non infectées qui ont été soumises à la procédure de coloration de clic, mais ne sera pas immunocolorées, ceux-ci seront nécessaires pour l'étalonnage du cytomètre de flux. Soit utiliser la moitié des cellules infectées simulées ou comprennent un puits non infecté supplémentaire àl'étape 5.2.
Remarque: Lors de l'adaptation de ce protocole à utiliser avec un autre virus, déterminer la dilution optimale pour votre premier anticorps primaire.
- Laver les cellules deux fois dans le tampon FACS.
- Remettre les cellules dans 200 ul d'anticorps secondaire (IgG anti-souris conjugué à un colorant fluorescent [excitation / émission maximale: 495/519 nm]) dilué dans tampon FACS (1:1000) et incuber pendant 1 heure à température ambiante dans l'obscurité.
- Laver les cellules une fois dans un tampon FACS.
Remarque: À ce stade, les cellules peuvent être stockées O / N à 4 ° C dans l'obscurité.
8. Acquisition de données
- Resuspendre les cellules dans 500 pl de tampon FACS, le transfert dans des tubes de 5 ml de polystyrène et d'analyser en utilisant un cytomètre de flux. Utilisez-12 MP cellules infectées (aucune réaction clic, coloration anti-RVFV seulement) et les cellules infectées simulées (cliquez réaction uniquement) pour calibrer l'instrument.
None: Veillez à sélectionner fluorophores appropriés qui peuvent être détectés par votre instrument. Pour référence, voici les lignes laser et jeux de filtres utilisés pour acquérir les données présentées dans cette publication.
Fluorophore avec un spectre d'excitation / émission de 495/519:
Laser: 488 nm
Filtre: 530/30
Fluorophore avec un spectre d'excitation / émission de 650/665:
Laser: 640 nm
Filtre: 670/20
Résultats
La protéine NS du RVFV (famille des Bunyaviridae, genre Phlebovirus) 11 inhibe la cellule hôte transcription général à travers deux mécanismes distincts: (i) en séquestrant la sous-unité p44 du facteur de transcription basal TFIIH 11 et (ii) en favorisant la dégradation par le protéasome de la p62 sous-unité de TFIIH 6. La souche vaccinale RVFV MP-12 13 a été utilisé pour les expériences décrites dans ce protocole depuis souche MP-12 peut être manipulé dans un laboratoire de biosécurité de niveau 2 et est exclu de la règle de l'agent de sélection dans les Etats-Unis, qui s'applique aux autres sauvage typer les souches FVR. La protéine NS de la souche MP-12 est entièrement fonctionnel et conserve la capacité de supprimer la transcription d'hôte 6. Le virus RMP12-C13type, qui porte une délétion couvrant 69% du gène NSs 14, a été incluse comme un virus témoin dépourvu de toutes les fonctions NSS y compris la capacité de supprimer la transcription de la cellule hôte.
Figure 1 montre des images acquises par microscopie à fluorescence. Dans les cellules infectées simulées (figures 1a-1d), les noyaux apparaissent rouge vif en raison de transcription en cours. Comme les cellules n'ont été marquée par l'UE pendant 1 heure, suivie d'une fixation immédiate, la plupart des ARN restent dans le noyau. En revanche, lorsque les cellules ont été traitées avec ACTD pour inhiber pharmacologiquement transcription (figures 1e-1h), la fluorescence rouge de noyaux est nettement réduite. Cette fluorescence est de même réduit lorsque les cellules sont infectées par le MP-12 (Figures 1n-1Q), mais pas avec la suppression NSs mutants RMP12-C13type (figures 1 i-1m). Figure 2 montre également des images acquises par microscopie à fluorescence, mais ici les cellules ont été transfectées avec l'ARNm synthétisé in vitro, au lieu de l'infection par le virus vivant. Lorsque les cellules ont été transfectées avec l'ARNm codant pour la GFP (figures 2g-2i), aucun changement dans la transcriptional activité par rapport à des cellules non transfectées (figures 2a-2c), comme visualisé par fluorescence rouge dans le noyau, peut être détectée. Seulement transfection avec ARNm codant pour les RVFV virulence NSS facteur (figures 2k-2m) entraîne une diminution de fluorescence rouge.La figure 3A représente les données quantitatives obtenues par cytométrie de flux. Les données sont représentées sous forme de diagrammes de dispersion avec signal fluorescent pour l'incorporation de l'UE en ARN naissant tracée sur l'axe des ordonnées et que pour la coloration anti-RVFV tracée sur l'axe des abscisses. Le quadrant portes ont été mis en sorte que la majorité des cellules infectées simulées était situé dans le quadrant supérieur gauche, la majorité des cellules traitées ACTD était situé dans le quadrant inférieur gauche, et la majorité des cellules infectées était situé dans la moitié droite de l'intrigue . Lorsque les cellules ont été infectées par le MP-12, 81,5% des cellules totales, soit 93% de cellules positives anti-FVR, ont montré une activité transcriptionnelle réduite. En revanche, les EPMn cellules ont été infectées avec RMP12-C13type, 91,6% des cellules totales, soit 97% de cellules positives anti-FVR, ont montré une activité transcriptionnelle qui était comparable à celle des cellules infectées simulées. figure 3B représente les mêmes données que la figure 3A, sous la forme d'un histogramme pour l'ARN fluorescence étiquetage avec l'incorporation de l'UE.
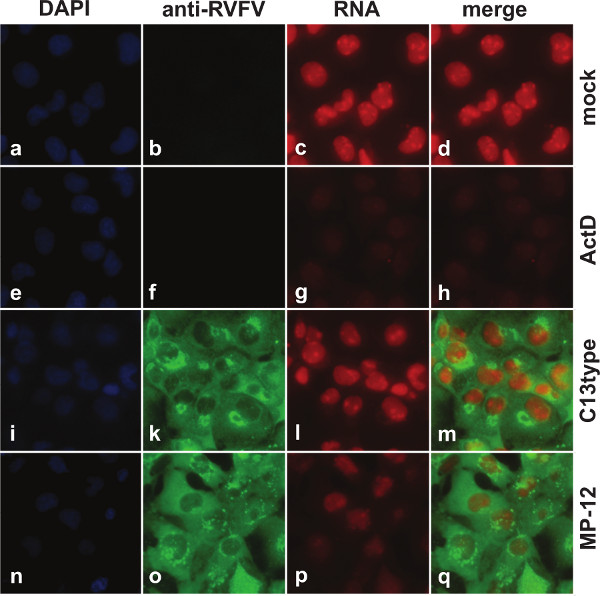
Figure 1. La microscopie à fluorescence de cellules infectées par le MP-12 et RMP12-C13type. 293 cellules étaient faux ou malades soit avec MP-12 ou la suppression NSs mutant RMP-12-C13type. Entre 15 et 16 HPI, les cellules ont été marquées avec 1 mM UE. En tant que témoin pour la suppression de la transcription, les cellules infectées simulées ont été traités avec 5 mg / ml ACTD concurremment avec le traitement de l'UE. Les noyaux sont visualisés par coloration DAPI (bleu), l'expression de protéines virales est visualisé par coloration avec des anticorps anti-FVR (vert), et l'ARN est visualiserd par détection de l'UE incorporé avec l'azoture marqué avec un colorant fluorescent (excitation / émission maximale: 590/617 nm) (rouge).

Figure 2. La microscopie à fluorescence de cellules transfectées avec l'ARN in vitro synthétisé soit pour la GFP ou MP NSS-12. 293 cellules transfectées étaient faux ou transfectées avec synthétisé in vitro d'ARN codant pour la GFP soit ou MP NSS-12. Entre 15 et 16 heures après transfection, les cellules ont été marquées avec 1 mM UE. En tant que témoin pour la suppression de la transcription, les cellules transfectées à blanc ont été traités avec 5 mg / ml ACTD concurremment avec le traitement de l'UE. L'expression de la GFP est visualisée par coloration avec un anticorps anti-GFP (GI), l'expression de NSS est visualisées par coloration avec des anticorps anti-RVFV (af, km), suivi par les anti-IgG de souris conjugué à un colorant fluorescent (excitation / émission maximum: 495/519 nm) (vert), et l'ARN est révélée par la détection de l'UE incorporé avec l'azoture marqué avec un colorant fluorescent (excitation / émission maximale: 590/617 nm) (rouge).

Figure 3. (A) L'analyse par cytométrie de cellules infectées par le MP-12 ou RMP12-C13type. Cellules ont été infectées maquette, ou infectées soit avec MP-12 ou RMP12-C13type. Entre 12 et 13 HPI, les cellules ont été marquées avec 0,5 mM UE. En tant que témoin pour la suppression de la transcription, les cellules transfectées à blanc ont été traités avec 5 mg / ml ACTD concurremment avec le traitement de l'UE. Expression des protéines virales est révélée par coloration avec des anticorps anti-RVFV suivie par un anticorps secondaire marqué avec un colorant fluorescent (excitation / émission maximale: 495/519 nm) (anti-VFVR) et l'ARN est visualisé par la détection de l'UE avec l'azoture incorporé marqué avec un colorant fluorescent (excitation / émission maximale: 650/665 nm) (RNA). Le datun est représenté par un nuage de points. (B) Représentation des mêmes données affichées dans une forme d'histogramme. L'intensité de fluorescence pour l'incorporation de l'UE est représentée sur l'axe des x, le nombre de cellules sont tracées sur l'axe des ordonnées. Cliquez ici pour agrandir la figure .
Discussion
Le protocole fourni décrit une méthode pour mesurer l'effet de l'infection virale sur la transcription de la cellule hôte via l'incorporation de l'uridine analogique UE en ARN naissants. Cette méthode présente plusieurs avantages par rapport aux méthodes précédentes: il est rapide, sensible et il ne repose pas sur l'utilisation des isotopes radioactifs. En outre, le procédé peut être adapté pour fournir des données qualitatives par microscopie à fluorescence ou des données quantitatives par cytométrie en flux utilisant essentiellement les mêmes réactifs. Lorsqu'il est combiné avec immunofluorescence des antigènes viraux, cette méthode permet également de différencier le chercheur infecté à partir de cellules non infectées.
Il est important de noter que cette méthode marque également l'ARN viral nouvellement synthétisées au même rythme qu'il qualifie transcriptions d'accueil, un inconvénient qui est partagé avec d'autres méthodes reposant sur 3 H-uridine ou BrU incorporation. Au moins dans le cas de RVFV MP-12 infection, cependant, nous avons constaté que l'amount de transcrits d'accueil et de loin, l'emporte sur la quantité de transcrits viraux, et donc l'influence de l'ARN viral de l'ARN total mesurée par ce test est négligeable. Lors de l'adaptation de ce protocole pour l'utilisation avec un autre virus, les chercheurs peuvent souhaiter identifier transcrits viraux, soit par leur localisation, par le traitement des cellules infectées avec ACTD, ou si hybridation in situ fluorescente (FISH) 15. Si le virus se réplique dans le cytoplasme, comme MP-12, puis l'ARN viral peuvent être facilement distingués de l'ARN cellulaire, qui est encore en grande partie contenu dans le noyau après 1 heure de l'étiquetage. Les cellules infectées peuvent aussi être traités avec ACTD pour réprimer la transcription de la cellule hôte, tout en laissant la synthèse d'ARN viral affectés. ACTD fonctions en se liant à l'ADN double brin 16 et donc seulement inhibe la transcription dépendant de l'ADN, mais n'a aucun effet sur viraux ARN polymérases ARN-dépendantes.
Lors de l'exécution de ce protocole, il est essentiel d'évitercontamination par des nucléases entre la perméabilisation et la réaction de marquage de clic, que l'UE ARN marqué reste sensible à la dégradation par les RNases 3. En outre, les chercheurs devraient procéder immédiatement à la réaction de marquage de clic, que les temps d'incubation prolongées entre la fixation et cliquez sur l'étiquetage réaction, même à 4 ° C, conduit à la dégradation de l'ARN et finalement entraîner une perte du signal de fluorescence ARN. Cela est particulièrement préoccupant lorsque la réalisation d'expériences évolution temporelle; chercheurs doivent concevoir leurs expériences afin que toutes les cellules peuvent être étiquetés, fixe, et colorées en même temps. Heureusement, le signal de fluorescence ARN reste stable après la réaction de marquage de clic, de sorte que le protocole peut facilement être arrêté après cette étape.
Enfin, les chercheurs doivent garder à l'esprit que l'effet cytopathique (CPE) provoquée par de nombreux virus affecte négativement la synthèse d'ARN cellulaire, même en l'absence de toute répression de la transcription spécifique. Celaest donc important de mesurer l'activité transcriptionnelle à une infection post-temps lorsque les cellules sont encore viables. Si un virus mutant est disponible qui n'a pas la capacité à réprimer la transcription, tels que RMP-12-C13type (figures 1 et 3), ce peut être un très bon outil pour déterminer le moment optimal pour la mesure de la transcription.
Lors de la planification d'un grand nombre d'expériences, les chercheurs pourraient vouloir envisager marquage direct de leur anticorps primaire avec un fluorochrome 17, éliminant ainsi la nécessité d'un anticorps secondaire et de réduire le temps nécessaire à la détection des antigènes viraux.
En résumé, ce protocole offre un moyen rapide et fiable de mesurer l'effet de l'infection virale sur la transcription de la cellule hôte. Il peut facilement être adapté pour être utilisé avec différents virus et a le potentiel d'être modifié pour inclure immunocolorations pour des protéines virales ou cellulaires spécifiques.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous remercions RB Tesh pour fournir la souris des anticorps polyclonaux anti-RVFV sérum et M. Griffin de l'UTMB cytométrie en flux Core Facility de l'aide avec la cytométrie de flux. Ce travail a été soutenu par 5 U54 AI057156 par le Centre régional de l'Ouest de l'excellence, NIH R01 AI08764301 et le financement du Centre Sealy pour le développement de vaccins à UTMB.BK a été soutenu par le Fonds James W. McLaughlin Fellowship à UTMB.OL a été soutenue par une bourse de chercheur Maurice R. Hilleman stade précoce carrière.
matériels
| Name | Company | Catalog Number | Comments |
| 5-ethynyl-uridine | Berry Associates | PY 7563 | dissolve in DMSO for 100 mM stock |
| 12-mm round coverslips | Fisherbrand | 12-545-82 | |
| 5 ml polystyrene tubes | BD Biosciences | 352058 | |
| Actinomycin D (ActD) | Sigma | 9415 | dissolve in DMSO for 10 mM stock |
| Alexa Fluor 488 goat anti-mouse IgG | Invitrogen | A-11029 | |
| Bovine Serum Albumin (BSA) | Santa Cruz | sc-2323 | |
| CuSO4 | Sigma | C-8027 | dissolve in H2O for 100 mM stock |
| DAPI | Sigma | D-9542 | dissolve in H2O for 5 mg/ml stock |
| DMEM | Invitrogen | 11965092 | |
| FBS | Invitrogen | 16000044 | |
| fluorescent azide (Alexa Fluor 594-coupled) | Invitrogen | A10270 | |
| fluorescent azide (Alexa Fluor 657-coupled) | Invitrogen | A10277 | |
| Fluoromount-G | Southern Biotech | 0100-01 | |
| L-ascorbic acid | Sigma | A-5960 | dissolve in H2O for 500 mM |
| paper filter | VWRbrand | 28333-087 | |
| paraformaldehyde | Sigma | 158127 | |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| poly-L-lysine (MW ≥ 70000) | Sigma | P1274 | |
| Triton X-100 | Sigma | T-8787 | |
| Trizma base | Sigma | T-1503 | dissolve in H2O for 1.5 M stock, pH 8.5 |
| Trypsin-EDTA | Invitrogen | 25200056 | |
| Fluorescence Microscope | e.g. Olympus IX71 | ||
| Flow Cytometer | e.g. BD Biosciences LSRII Fortessa |
Références
- Fakan, S. Structural support for RNA synthesis in the cell nucleus. Methods Achiev. Exp. Pathol. 12, 105-140 (1986).
- Jensen, P. O., Larsen, J., Christiansen, J., Larsen, J. K. Flow cytometric measurement of RNA synthesis using bromouridine labelling and bromodeoxyuridine antibodies. Cytometry. 14, 455-458 (1993).
- Jao, C. Y., Salic, A. Exploring RNA transcription and turnover in vivo by using click chemistry. Proc. Natl. Acad. Sci. U.S.A. 105, 15779-15784 (2008).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem. Int. Ed. Engl. 41, 2596-2599 (2002).
- Tornoe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(i)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalveram, B., Lihoradova, O., Ikegami, T. NSs protein of rift valley fever virus promotes posttranslational downregulation of the TFIIH subunit p62. J. Virol. 85, 6234-6243 (2011).
- Kalveram, B., et al. Rift Valley fever virus NSs inhibits host transcription independently of the degradation of dsRNA-dependent protein kinase PKR. Virology. , (2012).
- Head, J. A., Kalveram, B., Ikegami, T. Functional analysis of Rift Valley fever virus NSs encoding a partial truncation. PLoS One. 7, e45730 (2012).
- Lihoradova, O. A., et al. Characterization of Rift Valley Fever Virus MP-12 Strain Encoding NSs of Punta Toro Virus or Sandfly Fever Sicilian Virus. PLoS Negl Trop Dis. 7, e2181 (2013).
- Kalveram, B., Ikegami, T. Toscana Virus NSs Protein Promotes Degradation of Double-Stranded RNA-Dependent Protein Kinase. J. Virol. , (2013).
- Schmaljohn, C., Nichol, S., Knipe, D. M., et al. . In Fields Virology. , 1741-1789 (2007).
- Le May, N., et al. TFIIH transcription factor, a target for the Rift Valley hemorrhagic fever virus. Cell. 116, 541-550 (2004).
- Caplen, H., Peters, C. J., Bishop, D. H. Mutagen-directed attenuation of Rift Valley fever virus as a method for vaccine development. J. Gen. Virol. 66, 2271-2277 (1985).
- Ikegami, T., Won, S., Peters, C. J., Makino, S. Rescue of infectious Rift Valley fever virus entirely from cDNA, analysis of virus lacking the NSs gene, and expression of a foreign gene. J. Virol. 80, 2933-2940 (2006).
- Vyboh, K., Ajamian, L., Mouland, A. J. Detection of viral RNA by fluorescence in situ hybridization (FISH). J. Vis. Exp. , e4002 (2012).
- Reich, E., Goldberg, I. H. Actinomycin and nucleic acid function. Prog. Nucleic Acid Res. Mol. Biol. 3, 183-234 (1964).
- Holmes, K. L., Lantz, L. M., Russ, W. Conjugation of fluorochromes to monoclonal antibodies. Curr. Protoc. Cytom. Chapter 4 (Unit 4 2), (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon