Method Article
Micromanipulation de l'expression génique dans le cerveau de poisson zèbre adulte en utilisant microinjection Cerebroventricular d'oligonucléotides Morpholino
Dans cet article
Résumé
Dans cet article, nous démontrons une méthode pour la manipulation de l'expression des gènes dans les cellules ventriculaires du télencéphale de poisson zèbre adulte en utilisant des oligonucléotides antisens morpholino. Nous présentons aussi un protocole efficace et rapide qui peut être utilisé pour des études fonctionnelles dans le cerveau des vertébrés adultes cette méthode.
Résumé
Manipulation de l'expression des gènes dans les tissus est nécessaire de réaliser des études fonctionnelles. Dans cet article, nous démontrons la technique de micro-injection cerebroventricular (CVMI) comme un moyen de moduler l'expression des gènes dans le cerveau du poisson zèbre adulte. En utilisant CVMI, les substances peuvent être administrées dans le fluide cerebroventricular et être distribués à fond le long de l'axe rostrocaudal du cerveau. Nous nous concentrons particulièrement sur l'utilisation d'oligonucléotides antisens morpholino, qui sont des outils puissants pour abattre l'expression des gènes in vivo. Dans notre méthode, lorsqu'elle est appliquée, les molécules morpholino sont absorbés par les cellules qui tapissent la surface ventriculaire. Ces cellules comprennent des cellules gliales radiales, qui agissent en tant que progéniteurs neurogènes. Par conséquent, abattre l'expression des gènes dans les cellules gliales radiales est d'une importance capitale pour analyser la réponse de la neurogenèse répandue chez le poisson zèbre, et aussi permettrait de mieux comprendre comment les vertébrés pourraient soutenir NEUROGEN adulteréponse du SIAE. Une telle compréhension pourrait également contribuer aux efforts pour les applications cliniques dans les maladies neurodégénératives humaines et la régénération du système nerveux central. Ainsi, nous présentons la méthode de micro-injection cerebroventricular comme un moyen rapide et efficace pour modifier l'expression des gènes et la réponse de la neurogenèse dans le cerveau antérieur de poisson zèbre adulte. Nous fournissons également des conseils de dépannage et autres informations utiles sur la façon de mener à bien la procédure CVMI.
Introduction
neurogenèse adulte est un trait commun aux vertébrés, mais son degré de prévalence et de l'efficacité varie en fonction de la phylogénie 1,2,3,4,5,6. Par exemple, le cerveau des mammifères adultes contiennent des régions de cellules souches en grande partie limitées au cerveau antérieur 7,8, tandis que le poisson-zèbre teleost contient seize domaines des cellules souches différentes et des zones neurologiques associées à l'ensemble de son cerveau 4,5,9,10. Cette variation entre les mammifères et les poissons zèbres pourrait refléter une disparité dans les mécanismes de maintenance des cellules souches et de la capacité neurogène des cellules progénitrices. La compétence tout au long de poisson zèbre pour produire des neurones dans le cerveau pourrait également poser des ramifications cliniques comme les mécanismes moléculaires utilisés par le poisson-zèbre cerveau pourraient être exploitées pour des applications thérapeutiques pour lutter contre les maladies neurodégénératives chez l'homme.
Plusieurs cellules souches zones du cerveau de poisson zèbre adulte ont été analysées et il a été démontré que l'cellules qui tapissent la surface ventriculaire de ces régions servent de cellules progénitrices 9,11-20. Des analyses détaillées dans le télencéphale poisson zèbre, par exemple, ont identifié les cellules gliales radiales, qui délimitent la surface ventriculaire de cette région du cerveau à être progéniteurs neurogéniques 19, 20. Cela est vrai pour d'autres régions comme le cervelet et le toit optique, où ventricularly-situé cellules neuro fournissent l'entrée neurogène 16,21. À cette fin, la compréhension des mécanismes moléculaires régissant la compétence neurogène répandu dans le cerveau du poisson zèbre adulte nécessite la manipulation de l'expression des gènes dans les cellules progénitrices.
Diverses méthodes ont été décrites précédemment pour la fonction des gènes modulant chez le poisson zèbre. Il s'agit notamment de génération de lignées transgéniques exprimant conditionnelles variantes souhaitée d'une seule protéine, injections focales à base de plasmide couplés à des traitements d'électroporation ou chimiques. Nous avons déjà conçu unprocédé d'administration de diverses substances, notamment des oligonucléotides morpholino ou de protéines dans le cerveau de poisson zèbre adulte avec microinjection cerebroventricular comme un moyen rapide et efficace de la fonction des gènes modulant dans les cellules ventriculaires du poisson zèbre adulte forebrain 22. Dans nos études, morpholinos in vivo ont été utilisés en raison de leur composition chimique impliquant la molécule morpholino lié de façon covalente à l'arginine peptides de livraison riches, qui permettent la prestation efficace des cellules d'intérêt sans avoir besoin de perméabilisation supplémentaires telles que l'électroporation 23. Cela permettrait un ciblage minutieux du tissu désiré après l'injection, tout comme ce que nous avons observé chez les adultes poisson zèbre telencephalon 22. Utilisation des morpholinos in vivo sont donc supérieur aux méthodes existantes de tissu de ciblage telles que l'électroporation ou l'injection focal de molécules d'ADN.
Ici, nous démontrons visuellement la façon dont nous effectuons cette opération et de fournir unprotocole étape par étape. Nous commençons par expliquer la préparation du mélange d'injection et le poisson à injecter, et de procéder, en démontrant comment le dispositif d'injection est mis en place. Nous fournissons une description de la méthode d'injection cerebroventricular, qui consiste à générer une incision dans le crâne et l'injection des morpholinos utilisant microinjecteur. Nous élaborons également sur les points critiques il les faut être prudent durant toute la procédure en leur indiquant que l'optimisation ou des guides de dépannage.
Protocole
1. Préparation du mélange d'injection
- Utilisez morpholinos in vivo les cellules internalisent de façon plus efficace que les molécules morpholino normales. Voir les informations du fabricant pour plus de détails (Tableau 1: Réactifs et matériels).
- Utilisation d'un colorant fluorescent de poursuite (par exemple rouge CellTracker CMTPX, Invitrogen) pour visualiser l'exactitude de l'injection. Ce colorant est métabolisé dans la cellule et devient fluorescent seulement dans la cellule après l'absorption. Par conséquent, cette étape est cruciale pour déterminer les cellules qui sont efficacement ciblées par la microinjection cerebroventricular.
- Préparer un tampon phosphate salin (PBS) (NaCl 137 mM, 2,7 mM de KCl, 10 mM Na 2 HPO 4, 2 mM KH 2 PO 4, pH: 7,4) pour diluer solution morpholino. Si une dilution de la solution morpholino est nécessaire, utilisez toujours PBS.
- Préparer 10 pl du mélange d'injection en ajoutant 9 pl de la solution morpholino et 1 pl de the colorant traqueur de cellules (dilué ou non la concentration du stock de la solution morpholino est de 500 uM Nos résultats précédents 22 indiquent que plusieurs doses différentes du morpholino -.. allant de 50 et 500 microns - conduire à des niveaux de knockdown de manière efficace knockdown à des phénotypes hypomorphic). 1 pl de la solution est assez pour injection dans un cerveau de poisson zèbre.
- Bien mélanger et stocker à température ambiante jusqu'à ce que l'injection.
2. Préparation de l'appareil d'injection
- Préparer les capillaires injection vitre à l'aide d'un extracteur d'aiguilles. Utilisez les paramètres suivants: valeur du cycle de chauffage: 463, tirant valeur du cycle: 230, vitesse: 1,5 s, temps: 75 ms.
- Allumez la source de pression et ajuster les réglages de pression de 50 psi ou 3,5 bars.
- Réglez les paramètres microinjecteur comme suit: maintenir la pression de 20 psi, la pression d'éjection 10 psi, la valeur de période de 2,5 et 100 msec gamme de déclenchement.
- Tournersur la lampe annulaire et positionner l'anneau sur la platine du microscope.
- Placer le support de capillaire à une position appropriée à côté du microscope.
- Insérer le capillaire en verre dans le support. Ajustez l'angle d'injection à 45 degrés.
- Casser la pointe du capillaire en verre à l'aide d'une pince fine extrémité et calibrer la sortie de pression de l'orifice. Ce doit être testé en immergeant la pointe de l'aiguille dans l'eau du poisson et de donner une impulsion de pression en continu. Les bulles d'air découlant devraient être une seule ligne, ce qui est une indication de la pression optimale / taille de l'orifice. S'il vous plaît voir la vidéo de démonstration de ce calibrage.
- Chargez le capillaire en verre avec la solution injectable sans bulles d'air.
- Appliquer une pression pour enlever l'air entre l'extrémité du capillaire en verre et la solution injectable chargée.
3. Anesthésie
- Préparer la solution mère des anesthésiques (0,1% MESAB - éthyl-m-aminobenzoate de méthanesulfonate).
- Retirer nombre souhaité de poisson à partir de leurs réservoirs dans des cages de souris en plastique ou autre récipient de transport avec une quantité suffisante d'eau.
- Préparer la solution d'anesthésie dans une petite boîte en plastique en mélangeant 200 ml d'eau du poisson avec 5 ml de solution anesthésique boursier. La concentration finale de la anesthésiques: 0,0025% (v / v).
- Remplir à moitié un plat en plastique Petri avec des anesthésiques. Utilisez ce plat pour préparations injectables.
- Incuber les poissons dans les anesthésiques jusqu'à ce que les dompte de poissons.
4. Incision et microinjection Cerebroventricular
- Retirer le poisson de la boîte à l'aide d'un filet de poisson et le placer dans la boîte de Pétri.
- Maintenez le poisson avec la pince et d'orienter la tête d'une manière qu'il s'incline légèrement vers le bas. Cela facilitera l'incision.
- Générer une petite fente sur le crâne à l'aide d'une aiguille de calibre 30 barbelé-end. Utilisez seulement la pointe de l'aiguille et ne pénètrent pas plus deassez dans le cerveau car cela pourrait causer des dommages aux tissus du cerveau et se manifeste par l'hémorragie.
- Maintenez le poisson et insérez la pointe du capillaire en verre sur le site d'incision.
- Orienter la pointe du capillaire en verre vers le télencéphale. Évitez de toucher le tissu cérébral car cela crée des dommages aux tissus et empêche également la dispersion de la solution injectée.
- Injecter la solution. Le liquide se disperse immédiatement après l'injection.
5. Récupération et analyse de la précision d'injection
- Retirer le poisson de la configuration de l'injection et le placer dans une boîte en plastique avec de l'eau du poisson frais.
- Permettre la récupération.
- Re-anesthésier le poisson avec 0,0025% MESAB brièvement et vérifier le poisson sous le microscope à fluorescence. Une dispersion complète de la fluorescence rouge est une indication de la distribution à grande échelle du liquide injecté.
- Mettez le poisson dans la boîte en plastique.
- Branchez le boîtier en plastique de til le système de circulation pour oxygéner les poissons et les maintenir pendant de longues périodes de temps.
- Utilisez le poisson à des fins souhaitées telles que des analyses comportementales ou de sacrifier les animaux à des moments souhaités après l'injection pour préparer des échantillons de tissus pour des analyses plus poussées (colorations histologiques, immunohistochimie, etc.) Les références suivantes donnent des exemples de la façon d'analyser le cerveau de poisson zèbre adulte: 9,11,17-20,24-27. Le meilleur temps pour observer un effet de choc efficace (plus de 50% knockdown) était de 12 heures dans nos études 22.
6. Contrôles scientifiques proposées
- Utilisez une molécule morpholino de décalage qui n'est pas censé causer aucun phénotype comme contrôle négatif. Utilisez soit une molécule morpholino standard ou spécifiquement contrôles morpholino conception pour chaque gène d'intérêt. En outre, utiliser le solvant (dans ce cas PBS) comme un autre témoin négatif pour évaluer les effets ou la toxicité non spécifiques de la mismeatch / contrôle injections morpholino.
- Utilisez PCNA morpholinos décrit précédemment 22 comme contrôles positifs. Cette morpholino provoque knockdown efficace dans le cerveau du poisson zèbre adulte (75-95% d'efficacité de knockdown à 1 jour de l'injection) 22.
Résultats
Microinjection Cerebroventricular conduit à une large diffusion de la solution injectée
En utilisant le schéma de workflow et technique de la micro-injection cerebroventricular illustré à la figure 1, nous avons administré oligonucléotides morpholino dans le cerveau de poisson zèbre adulte. Un protocole précis de l'injection conduit à la dispersion du liquide injecté dans le cerveau et l'efficacité de ciblage des cellules proches de la surface du ventricule (Figure 2A). Injections où le capillaire en verre empale le tissu cérébral auront un signal fluorescent dense au niveau du point d'injection (figure 2B). Si la quantité injectée n'est pas suffisant, le signal fluorescent faible sera observée (figure 2C).
Microinjection Cerebroventricular peut être utilisé pour abattre l'expression du gène à la région ventriculaire du cerveau du poisson zèbre adulte
Nous avons montré èmeà morpholinos vivo peut pénétrer de quelques diamètres cellulaires à l'intérieur de la surface du ventricule et donc capable de cibler efficacement les cellules ventriculaires (figures 3A, 3B). Injection Morpholino pouvez l'expression des gènes knockdown car il permettra de réduire la production de la protéine correspondante (un exemple est PCNA comme le montrent les figures 3C, 3D). Nous avons déjà démontré que abattre gènes en utilisant cette technique entraîne des conséquences fonctionnelles au cours de la neurogenèse adulte (figures 3e, 3f) ou la réponse de régénération (figures 3G, 3H). Nous avons démontré que la gamme de knockdown efficace (plus de 50% knockdown) est atteinte environ 12 heures après l'injection du morpholinos 22. Nous avons également observé que la période de knockdown efficace est jusqu'à environ 5 jours après l'injection de la protéine PCNA 22. Plus de 70% knockdown a été vu jusqu'à 3 jours après l'injection 22. Les courbes de knockdown sont dépendants on le niveau d'expression des protéines endogènes et de l'efficacité des molécules morpholino, et doit être déterminée pour chaque gène par l'expérimentateur. Dans nos études, nous n'avons pas vu que la procédure CVMI compromet la survie de l'animal, sans doute parce que l'administration des molécules morpholino est locale et ne provoque pas de toxicité systémique.

Figure 1. Représentation schématique de la technique d'injection cerebroventricular. (A) L'injection est réalisée à partir de la dorsale du poisson zèbre adulte (1) au niveau du toit optique (OT, 2). Une incision est faite sur la plaque du crâne tectal optique avec une aiguille de calibre 30 (3). Utilisation de tubes capillaires en verre, les molécules morpholino sont injectés dans le liquide du ventricule (4). Une dispersion complète est unechieved instantanément (5). (B) La canule et son barbelés fin est montré dans un fort grossissement. (C) L'orientation de l'aiguille avant l'incision. (D) L'incision est encerclé et a souligné en pointillés. (E) L'injection capillaire est situé comme indiqué et l'injection est effectuée. Tous les panneaux ont été adaptés à partir ref. 22. Cliquez ici pour agrandir la figure .

Figure 2. Comparaison de l'efficacité de l'injection et de la précision. (A) une bonne injection conduit à cibler des cellules proches de la surface du ventricule. (B) si le capillaire en verre est insérée dans le tissu cérébral, il génère un signal de fluorescence central. (C ) Si le montant de l'injection est faible, cela conduira à une plus faible signal de fluorescence.
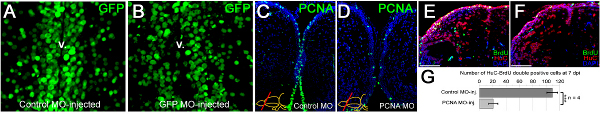
Figure 3. . Pénétration Morpholino, l'efficacité des passes rabattues de gènes et ses conséquences fonctionnelles (A) GFP immunologique sur les sections transversales télencéphaliques de contrôle morpholino-injectés Tg (H2A: GFP) lignée transgénique montrant noyaux GFP-positives. (B) la GFP immunomarquage sur les sections transversales de la GFP télencéphaliques antisens morpholino-injecté Tg (H2A: GFP) lignée transgénique affichant noyaux GFP-positives. Noter la différence dans le signal de la GFP à la région ventriculaire. v: ventricule. (C) PCNA immunologique sur le contrôle morpholino-injecté cerveau montrant la distribution généralisée des cellules PCNA-positifs. ( D) PCNA immunologique sur PCNA antisens morpholino cerveaux injectés montrant des quantités significativement réduit de cellules PCNA-positifs, montrant que CVMI pouvez gènes endogènes knockdown. (E) BrdU et HuC / D immunologique sur le contrôle morpholino-injectés cerveau afin de déterminer les nouveaux neurones après une expérience pulse-chase BrdU décrit précédemment 22. (F) BrdU et HuC / D immunologique sur PCNA antisens morpholino-cerveaux injectés afin de déterminer les nouveaux neurones après une expérience pulse-chase BrdU décrit précédemment 22. (G) Knocking-down PCNA conduit à une réduction significative de la génération de nouveaux neurones, ce qui indique que CVMI peut être utilisé à des gènes endogènes knockdown, qui donnent lieu à des conséquences fonctionnelles. Tous les panneaux ont été adaptés à partir ref. 22 Cliquez ici pour agrandir la figure .
Discussion
La méthode que nous décrivons ici permet une administration facile et rapide de morpholinos dans le cerveau de poisson zèbre adulte. Nous avons montré que notre méthode d'injection bloque efficacement l'expression des gènes dans les cellules ventriculaires et entraîne des conséquences fonctionnelles de la réponse de la neurogenèse.
Il ya des points important d'être prudent lors de l'exécution sur la microinjection cerebroventricular. Par exemple, l'effet des molécules morpholino dépend de la concentration utilisée. Cette concentration doit être déterminée par l'utilisateur final. Nous vous recommandons de commencer avec la solution de stock (500 M) et en effectuant des dilutions en série, et idéalement d'effectuer une pré-test par injection dans des embryons en utilisant un écart embryon injection protocoles 28-30. Auparavant, nous avons obtenu différents niveaux d'efficacité knockdown avec des concentrations de morpholinos allant de 50 et 500 microns 22. En second lieu, l'orifice de la vitre capillaire ne doit pas être large que cela conduira à une vaste afflux de liquide dans le cerveau après l'injection. De même, l'ouverture ne doit pas être trop étroit car cela empêchera injection adéquate. On peut déterminer la combinaison optimale orifice pression en pompant de l'air dans une boîte de Pétri avec de l'eau. Les bulles découlant devraient être sur une seule ligne, mais pas en plusieurs lignes. Nous démontrons dans la vidéo. Troisièmement, l'incubation du poisson dans les anesthésiques est critique. Le poisson ne doit pas être conservée plus de 2 min dans les anesthésiques. Cela va entraver le taux de récupération après l'injection. Quatrièmement, l'emplacement de l'incision est essentiel pour disperser complètement le liquide injecté. La région ventriculaire sur le toit optique est plus grande au-dessus de la ligne médiane et se rétrécit latéralement. Par conséquent, l'expérimentateur doit générer la fente dans le crâne à proximité de la ligne médiane et juste caudale à la plaque de crâne couvrant la région télencéphalique.
Un des avantages du produit à injecter cerebroventricularn méthode (CVMI) est son rapidness. CVMI est une méthode rapide pour le dosage de la fonction des gènes. Cette fonction est utile et important par rapport à la génération de lignées transgéniques pour des études fonctionnelles, qui prennent généralement plusieurs mois. En outre, CVMI conduit à une répartition uniforme du liquide injecté et fournit donc une manipulation relativement approfondie de l'activité des gènes, par rapport aux injections focales ou l'électroporation. Avec CVMI, plusieurs gènes peuvent être renversés simultanément en préparant injection mélange contenant de multiples morpholinos oligonucléotide. CVMI peut être utilisé pour injecter des concentrations différentes d'une donnée oligonucléotides morpholino, et peut donc être utilisé pour analyser les phénotypes hypomorphic. Enfin, ce paradigme d'injection n'entraîne pas de toxicité ou de compromettre la survie des animaux.
La technique CVMI pourrait être étendu à d'autres types d'études telles que l'injection de peptides modulateurs, des médicaments, ADN plasmidique ou modulateur ARN molecules ou d'autres substances qui pourraient influer sur la physiologie des cellules. Dosage combinaison de molécules et la réalisation d'analyses dose-réponse sont possibles en utilisant notre méthode, qui permet l'étude des phénotypes hypomorphic. Grâce à ces propriétés, CVMI s'avère être un test rapide et facile pour les études d'expression dans le cerveau du poisson zèbre adulte, et ouvre de dépistage rapide et des analyses fonctionnelles.
Le cerveau du poisson zèbre adulte peut produire constitutivement nouveaux neurones tout le long axe rostrocaudal et il peut également se régénérer après des lésions traumatiques. Ceci est en contraste frappant avec le cerveau des mammifères avec la neurogenèse limitée et pas du tout, plutôt faible capacité de régénération. Cette activité de cellules souches répandue et la capacité de récupération rend poisson-zèbre un organisme modèle utile pour comprendre les programmes moléculaires nécessaires à la régénération du système nerveux central, qui sont actuellement largement inconnue. Par conséquent, d'enquêter sur la base moléculaire de l'aptitude de régénération des zebrafish cerveau est un domaine de recherche intéressant qui pourrait expliquer la différence fondamentale la façon dont les poissons et les mammifères cerveau réagit après une blessure, et confèrent également des pistes pour les thérapies médicales régénératrices chez les humains. Afin de comprendre l'infrastructure moléculaires de la plasticité du cerveau des vertébrés et de régénération, les cellules gliales constituent un domaine de recherche important car ils sont les ancêtres neurogène 3,8,20. Ainsi, en utilisant la technique CVMI d'altérer la fonction des gènes dans les cellules gliales radiales du cerveau du poisson zèbre joue un rôle dans l'élucidation de la façon dont le cerveau de poisson peut activité progénitrices couple à la neurogenèse adulte et efficace réponse régénérative. Nous avons récemment montré l'implication et l'exigence de plusieurs facteurs et voies de signalisation dans la réponse de la neurogenèse de régénération du cerveau de poisson zèbre adulte 24,26,27, et ces études ont été rendues possibles par l'utilisation de la méthode CVMI. Dans l'ensemble, les connaissances que nous acquérons de poisson zèbre cerveau pourrait être exploitée pour imposer Regenecapacité figurative aux cellules gliales mammifères qui réagissent à des blessures et va donc aider à concevoir des thérapies cliniques pour les troubles neurologiques humaines et les blessures graves.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft (SFB 655) et l'Union européenne (ZF-Santé).
matériels
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| CellTracker Red CMTPX | Life Technologies, Invitrogen | C34552 | Use at 1:100 dilution for measuring the injection accuracy |
| MESAB (ethyl-m-aminobenzoate methanesulphonate) | Sigma-Aldrich | A5040 | For anesthetizing the fish |
| Petri dishes | Sarstedt | 821,472 | For handling the fish during injection and imaging |
| Phosphate-buffered saline | Life Technologies, GIBCO | 10010-056 | As sterile dilution medium |
| Vivo morpholinos | Gene Tools Inc. | Customized | More info on vivo morpholinos: www.gene-tools.com |
| Equipment | |||
| Barbed-end needle | Becton-Dickinson | 305178 | To generate the incision in the skull |
| Dissecting microscope | Olympus, Leica, Zeiss | Varies with the manufacturer | Part of the whole injection setup |
| Dumont Tweezers | World Precision Instruments | 501985 | To snap off the tip of the glass capillary |
| Fluorescence camera | Zeiss, Nikon, Leica | Varies with the manufacturer | To visualize the fluorescence after injection |
| Gillies Dissecting Forceps | World Precision Instruments | 501265 | To hold the fish in position |
| Glass injection capillaries | World Precision Instruments | TWF10 | For microinjection |
| PicoNozzle kit (microinjector holder) | World Precision Instruments | 5430-12 | For microinjection |
| Pneumatic PicoPump (microinjector) | World Precision Instruments | SYS-PV820 | For microinjection |
| Ring illuminator; Ring Light Guide | Parkland Scientific | ILL-RLG | For illuminating the specimen |
Références
- Stocum, D. . Regenerative Biology and Medicine. , (2006).
- Poss, K. D. Advances in understanding tissue regenerative capacity and mechanisms in animals. Nat. Rev. Genet. 11 (10), 710-722 (2010).
- Doetsch, F., Scharff, C. Challenges for brain repair: insights from adult neurogenesis in birds and mammals. Brain Behav. Evol. 58 (5), 306-322 (2001).
- Kaslin, J., et al. Proliferation, neurogenesis and regeneration in the non-mammalian vertebrate brain. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 363 (1489), 101-122 (2008).
- Kizil, C., et al. Adult neurogenesis and brain regeneration in zebrafish. Dev. Neurobiol. 72 (3), 429-461 (2012).
- Grandel, H., Brand, M. Comparative aspects of adult neural stem cell activity in vertebrates. Dev. Genes Evol. , (2013).
- Kempermann, G. . Adult Neurogenesis 2: Stem Cells and Neuronal Development in the Adult Brain. , (2010).
- Ihrie, R. A., Alvarez-Buylla, A. Cells in the astroglial lineage are neural stem cells. Cell Tissue Res. 331 (1), 179-191 (2008).
- Grandel, H., et al. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell. 295 (1), 263-277 (2006).
- Chapouton, P., et al. Adult neurogenesis in non-mammalian vertebrates. Bioessays. 29 (8), 745-757 (2007).
- Adolf, B., et al. Conserved and acquired features of adult neurogenesis in the zebrafish telencephalon. Dev Biol. 295 (1), 278-293 (2006).
- Byrd, C. A., Brunjes, P. C. Neurogenesis in the olfactory bulb of adult zebrafish. Neuroscience. 105 (4), 793-801 (2001).
- Pellegrini, E., et al. Identification of aromatase-positive radial glial cells as progenitor cells in the ventricular layer of the forebrain in zebrafish. J. Comp. Neurol. 501 (1), 150-167 (2007).
- Lam, C. S., et al. gfap and nestin reporter lines reveal characteristics of neural progenitors in the adult zebrafish. 238 (2), 475-486 (2009).
- Wang, X., et al. Identification of Wnt-responsive cells in the zebrafish hypothalamus. Zebrafish. 6 (1), 49-58 (2009).
- Kaslin, J., et al. Stem cells in the adult zebrafish cerebellum: initiation and maintenance of a novel stem cell niche. J. Neurosci. 29 (19), 6142-6153 (2009).
- Ganz, J., et al. Heterogeneity and Fgf dependence of adult neural progenitors in the zebrafish telencephalon. Glia. 58 (11), 1345-1363 (2010).
- März, M., et al. Heterogeneity in progenitor cell subtypes in the ventricular zone of the zebrafish adult telencephalon. Glia. 58 (7), 870-888 (2010).
- Rothenaigner, I., et al. Clonal analysis by distinct viral vectors identifies bona fide neural stem cells in the adult zebrafish telencephalon and characterizes their division properties and fate. Development. 138 (8), 1459-1469 (2011).
- Kroehne, V., et al. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Ito, Y., et al. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Dev. Biol. 342 (1), 26-38 (2010).
- Kizil, C., Brand, M. Cerebroventricular microinjection (CVMI) into adult zebrafish brain is an efficient misexpression method for forebrain ventricular cells. PLoS One. 6 (11), e27395 (2011).
- Morcos, P. A., et al. Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues. Biotechniques. 45 (6), 613-614 (2008).
- Kizil, C., et al. The chemokine receptor cxcr5 regulates the regenerative neurogenesis response in the adult zebrafish brain. Neural Dev. 7, 27 (2012).
- Chapouton, P., et al. her5 expression reveals a pool of neural stem cells in the adult zebrafish midbrain. Development. 133 (21), 4293-4303 (2006).
- Kizil, C., et al. Regenerative neurogenesis from neural progenitor cells requires injury-induced expression of Gata3. Developmental Cell. 23 (6), 1230-1237 (2012).
- Kyritsis, N., et al. Acute inflammation initiates the regenerative response in the adult zebrafish brain. Science. 338 (6112), 1353-1356 (2012).
- Rosen, J. N., et al. Microinjection of zebrafish embryos to analyze gene function. J. Vis. Exp. (25), e1115 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. J. Vis. Exp. (27), e1113 (2009).
- Rikin, A., et al. A reverse genetic approach to test functional redundancy during embryogenesis. J. Vis. Exp. (42), e2020 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon