Method Article
Évitement osmotique Caenorhabditis elegans: La fonction synaptique de deux gènes, orthologues de l'homme NRXN1 Et NLGN1, Comme candidats pour l'autisme
Dans cet article
Résumé
Neurexines et neuroligines sont des protéines d'adhésion à la membrane des neurones, qui jouent des rôles essentiels dans la différenciation synaptique et la transmission. Mutants déficients neuroligines des C. elegans Sont défectueux dans la détection de la force osmotique, mais quand ils contiennent également une mutation dans le gène codant la neurexine, ils récupèrent le phénotype de type sauvage.
Résumé
Neurexines et neuroligines sont des molécules d'adhésion cellulaires présents dans les synapses excitateurs et inhibiteurs, et ils sont requis pour la fonction réseau correct neurone 1. Ces protéines se trouvent dans les membranes présynaptique et postsynaptique 2. Les études chez la souris indiquent que neurexines et neurologins ont un rôle essentiel dans la transmission synaptique 1. Des rapports récents ont montré que modifié connexions neuronales durant le développement du système nerveux humain pourrait constituer la base de l'étiologie de nombreux cas de troubles du spectre autistique 3.
Caenorhabditis elegans pourrait être utilisé comme un outil expérimental pour faciliter l'étude du fonctionnement des composants synaptiques, en raison de sa simplicité pour l'expérimentation en laboratoire, et étant donné que son système nerveux et le câblage synaptique a été complètement caractérisés. En C. Elegans NRX-1-1 et NLG gènes sont orthologues pour la santé humaine et de NRXN1 NLGN1 gènes qui codent l'alpha-neurexine-1 et une neuroligine-protéines, respectivement. Chez les humains et les nématodes, l'organisation de neurexines et neuroligines est similaire en ce qui concerne les domaines fonctionnels.
La tête du nématode contient les amphid, un organe sensoriel du nématode, qui médiatise des réponses à des stimuli différents, y compris la force osmotique. Le amphid est constitué de 12 neurones sensoriels bipolaires avec des dendrites ciliées et un axone terminaison présynaptique 4. Deux de ces neurones, nommé ASHR et ASHL sont particulièrement importants dans la fonction sensorielle osmotique, la détection soluble dans l'eau répulsifs avec force osmotique élevée 5. Les dendrites de ces deux neurones allonger à l'extrémité de la bouche et les axones s'étendent à l'anneau nerveux, où ils font les connexions synaptiques avec d'autres neurones déterminant la réponse comportementale 6.
Pour évaluer les implications de la neurexine et neuroligines de l'évitement à haute résistance osmotique, nous montrons la réponse différente des mutants de C. elegans défectueux dans NRX-1-1 et NLG gènes, en utilisant une méthode basée sur un anneau de fructose 4M 7. Les phénotypes comportementaux ont été confirmés en utilisant des clones spécifiques ARNi 8. Dans C. elegans, l'ARNdb requis pour déclencher l'ARNi peut être administré par une alimentation 9. La livraison des ARNdb induit par l'alimentation de l'interférence ARN interférence du gène d'intérêt permettant ainsi l'identification des composants génétiques et des voies du réseau.
Protocole
1: test d'évitement osmotique.
- A propos de 16-24 heures avant le dosage, ramasser les animaux stade larvaire L4 de chaque génotype à une plaque de NGM frais contenant OP50 E. coli qu'il andincubate à 20 ° C. Le lendemain, commencer l'expérience avec de jeunes adultes.
- Il est recommandé d'effectuer le dosage "aveuglément". Les plaques avec chaque souche à doser doivent être réétiquetés par un second expérimentateur, réaliser le dosage en utilisant les plaques réétiquetés qui serait démasqué lorsque l'expérience est terminée.
- Le jour du dosage, préparer une solution stock de 4M de fructose avec 1% rouge Congo solution et dissoudre complètement à température ambiante. Nous vous recommandons de vérifier la solution avant chaque essai, depuis le colorant pourrait précipiter avec le temps.
- Anneau (1 cm de diamètre) sur la plaque NGM est décrit sur le centre du milieu solide, avec 15 ul de la solution de fructose 4M rouge. Laissez tremper la solution de fructose dans la gélose, ce qui prend généralement entre 2 et 5 minutes.
- Place individuelle des animaux adultes jeunes de chaque souche dans le ring et suivre au cours des 10 prochaines minutes pour déterminer la réponse à la barrière osmotique. Animaux en évitant l'anneau plus de six fois dans une rangée sont classés comme normaux, ceux de quitter le ring en moins de six tentatives sont considérés comme défectueux dans la sensibilité osmotique.
Note: La souche de contrôle doit être utilisé dans chaque essai. Animaux N2 jeunes adultes sont utilisés comme contrôles positifs car ils décisive éviter la barrière anneau. Les animaux qui ont été préalablement affamés, traversé Dauer larves ou viennent de plaques qui sont trop secs ne doivent pas être utilisés. Au début, les animaux de contrôle devraient être évalués en double exemplaire, pour confirmer que les plaques de dosage et la solution sont corrects.
2: Génération des vers knockdown en alimentant l'ARNi.
- ARNi plaques: les plaques d'alimentation NGM RNAi contient par litre: 17 g d'agar, 2,5 g de peptone, 3,0 g de NaCl, 1 ml de 5 mg de cholestérol ml -1; remplir le flacon à 1 litre avec H 2 O et autoclave. Après agar refroidit à environ 65 ° C, ajouter 25 ml de 1 M KPO 4, pH 6,0, 1 ml de 1 M CaCl 2, 1 ml de 1M MgSO 4, 0,5 ml de carbénicilline (50 mg ml -1) et 1 ml 1M IPTG. Si vous commencez avec le NGM solide préparé, faire fondre le milieu solide en micro-ondes et par la suite lieu NGM liquide sur le banc pour refroidir et ajouter ensuite KPO 4, pH 6,0, CaCl 2, MgSO 4, carbénicilline et IPTG comme indiqué précédemment.
Ajouter 10 ml de NGM dans chaque boîte de Pétri de 60 mm. Laisser refroidir et inverser les plaques en les maintenant au jour au lendemain avant d'utiliser RT. Les plaques peuvent être stockées dans un sac en plastique à 4 ° C pendant environ 4-5 jours. - Préparation bactérienne et de l'induction: Isoler les colonies de E. coli HT115 (DE3) souche, transformé avec L4440 vecteur contenant un fragment correspondant au gène cible, sur Luria-Bertani (LB) gélose (17 g d'agar, 10 g de tryptone, 5 g extrait de levure et 10 g de NaCl par litre) contenant de l'ampicilline (50 ug / ml) et la tétracycline (15 pg / ml).
Choisissez une colonie de bactéries et inoculer dans LB avec 50 pg / ml d'ampicilline et cultivé pour 6 8 h avec agitation à 37 ° C; semences une goutte de cette culture sur les plaques préparées NGM et sécher les plaques à fond avant d'être en incubation pendant la nuit ( 12 24 h) à température ambiante pour permettre aux bactéries de croître et de commencer à induction. L'incubation a été dans l'obscurité, car la tétracycline est sensible à la lumière et il peut affecter la variabilité des dosages ARNi dans les assiettes.
Il est nécessaire d'utiliser un positif et un contrôle négatif pour des expériences d'alimentation ARNi. Le contrôle positif est E.coli HT115 cellule transformée avec le vecteur contenant la séquence L4440-22 du gène unc. Le knockdown de l'UNC-22 gène produit un «phénotype tics». Le contrôle négatif est E.coli HT115 cellule transformée avec le vecteur L4440 vide. - La manipulation et la notation Worm: Le premier jour, place L4 vers l'étape d'une plaque de NGM ensemencé avec OP50 sur des plaques NGM sans bactéries et incuber à 20 ° C pendant 12 heures (à jeun).
Le lendemain, le transfert des jeunes adultes hermaphrodites jeûné sur une plaque seedded avec les bactéries exprimant l'ARNi spécifiques des gènes cibles. Laisser 40-48 heures à 20 ° C pour générer descendance F1.
Ensuite, placez quelques vers pour adultes F1 sur une autre plaque ensemencée avec la même bactérie. Après 24-48 heures, sélectionner et isoler de la descendance F2, les jeunes adultes (entièrement formée vulve saillante avec quelques œufs) et le score pour les phénotypes.
Remarque: l'induction d'ARNi dans les neurones ont quelques limitations en raison des propriétés réfractaires de la C elegans système nerveux de l'ARNi.. Pour surmonter les problèmes de cette inefficacité dans le neurone, il est recommandé d'utiliser la souche far-3, un fond d'hypersensibilité aux effets de l'ARNi dans les neurones 10. Dans nos expériences ne differences ont été trouvés entre Bristol N2 et far-3 souches pour les gènes et le phénotype analysé.
3: Les souches utilisées.
Le C. elegans souches utilisées dans ce travail sont présentés au tableau 1. Des souches mutantes ont été hors traversé l'encontre N2 sauvages - type au moins quatre fois pour enlever les mutations aléatoires qui auraient pu être générés au cours du protocole de mutagenèse.
. OP50 E coli souche a été suppliied par Caenorhabditis génétique Center, University of Minnesota, USA E.coli HT115 (DE3) avec le plasmide portant pL4440 NRX-1 (JA: C29A12.5). Et NLG-1 (JA: C40C9.5 fragments de gènes) ont été fournies par le Dr Peter Askjaer, Centro Andaluz de Biología del Desarrollo (CABD), CSIC Universidad Pablo Olavide, Séville, Espagne.
4: Les résultats représentatifs.
Résultats indicatifs sont représentés dans les figures 1 et 2. Dix animaux de chaque souche et un minimum de trois expériences répliques ont été réalisées.

Figure 1. Des expériences de comportement d'évitement osmotique.
Souches de contrôle et NRX-1 (ok1649 et tm1961) mutantworms V déficiente face en renversant en arrière quand ils rencontrent une barrière osmotique (4M fructose). NLG-1 (ok259 et tm474) X mutants ne parviennent pas à détecter cette barrière. Doubles mutants déficients en NLG-1 et NRX-1, les souches CRR21 (ok1649; ok259) VX et CRR23 (tm1961; ok259) VX récupéré le phénotype de type sauvage. Le * indique des différences significatives (P ≤ 0,001) par le t-test de d'étudiants, dans la réponse de chaque souche de la N2 Bristol type sauvage par le t-test de d'étudiants
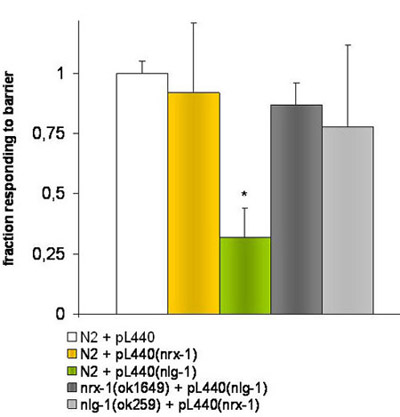
Figure 2. Les expériences avec les vers knockdown en alimentant l'ARNi.
E.coli HT115 (DE3) transformées avec le vecteur vide ou contenant pL4440 un fragment correspondant aux gènes cibles NRX-1 ou NLG-1 ont été utilisés pour nourrir le ver souches différentes. Le * indique des différences significatives (P ≤ 0,001) par le t-test de d'étudiants, dans la réponse de la souche N2 nourris avec des bactéries portant le vecteur pL4440 avec un fragment de ciblage des NLG-1 du gène en comparaison avec la souche N2 nourris avec des vides pL4440 vectoriel .
Discussion
Neurexines et effectuer des neuroligines rôle essentiel dans la transmission synaptique et la différenciation des 11 connexions synaptiques 12. Les deux molécules ont été identifiées comme des gènes candidats pour l'autisme 13,14.
Dans cette vidéo on montre une méthode simple qui nous permet d'étudier l'effet des gènes affectant la réponse d'évitement osmotique dans C. elegans. Mutants déficients neuroligines sont défectueux dans la détection de la force osmotique, mais mutants déficients en neurexine montrent une réponse similaire à la souche de type sauvage, en évitant une solution de fructose 4M. Toutefois, lorsque les mutants neuroligines, qui sont incapables de détecter la solution de fructose, sont également déficientes pour le gène neurexine, ils récupèrent le phénotype de type sauvage répondant à la force osmotique.
Cette observation a été confirmée en utilisant une approche RNAi knockdown alimentation. Ainsi, la souche de type sauvage a été altérée dans la reconnaissance de la barrière osmotique quand il a été nourri avec des bactéries exprimant une séquence codante du gène de la NLG-1. Mais NLG-1 mutants, qui ne parviennent pas à détecter la barrière osmotique, récupéré cette capacité quand ils ont été nourris avec des bactéries exprimant une séquence codante du NRX-1. Ces résultats indiquent que la neurexine et neuroligines pourrait être impliqué au niveau des synapses des neurones sensoriels de nématodes et qu'ils interagissent les uns avec les autres dans une manière qui affecte la fonction synaptique.
Remerciements
Nous tenons à remercier le Dr Antonio Miranda-VIZUETE pour son aide précieuse. Nous aimons aussi à exprimer notre gratitude à Salma Boulayoune et Isabel Caballero pour l'assistance technique précieuse. Ce travail a été financé par une subvention de la Junta de Andalucía (BIO-272). Cette recherche a été effectuée en accord avec les lois actuelles régissant l'expérimentation génétique en Europe.
matériels
Tableau 1. C. souches elegans.
| Name | Company | Catalog Number | Comments |
| Souche | Gene | Allèle | Source |
| Bristol N2 | - | - | CACG |
| VC228 | NLG-1 | ok259 | CCG |
| FX00474 | NLG-1 | tm474 | bNBP-JAPON |
| VC1416 | NRX-1 | ok1649 | CCG |
| FX1961 | NRX-1 | tm1961 | NBP-JAPON |
| NL2099 | far-3 | pk1436 | CCG |
| CRR21 | NRX-1; NLG-1 | ok1649; ok259 | Ce travail |
| CRR22 | NRX-1; NLG-1 | tm1961; ok259 | Ce travail |
a. Caenorhabditis génétique Center, University of Minnesota, USA.
b. Projet bioressources nationale pour l'expérimentation animale "nématode C. elegans". Femmes de Tokyo Medical University, Japon.
Références
- Sudhof, T. C. . Nature. 455 (7215), 903-903 (2008).
- Fabrichny, I. P., Leone, P., Sulzenbacher, G. . Neuron. 56 (6), 979-979 (2007).
- Garber, K. . Science. 317 (5835), 190-190 (2007).
- Wang, K., Zhang, H., Ma, D. . Nature. 459 (7246), 528-528 (2009).
- Ward, S., Thomson, N., White, J. G. . The Journal of comparative neurology. 160 (3), 313-313 (1975).
- Bargmann, C. I., Thomas, J. H., Horvitz, H. R. Cold Spring Harbor symposia on quantitative biology. 55, 529-529 (1990).
- White, J. G., Southgate, E., Thomsom, J. N., Brenner, S. . Philos. Trans. R. Soc. Lond. B Biol. Sci. 314, 1-1 (1986).
- Culotti, J. G., Russell, R. L. . Genetics. 90 (2), 243-243 (1978).
- Fire, A., Xu, S., Montgomery, M. K. . Nature. 391 (6669), 806-806 (1998).
- Timmons, L., Fire, A. . Nature. 395 (6705), 854-854 (1998).
- Simmer, F., Tijsterman, M., Parrish, S., Koushika, S. P., Nonet, M. L., Fire, A., Ahringer, J., Plasterk, R. H. . Curr Biol. 12, 1317-1317 (2002).
- Missler, M., Zhang, W., Rohlmann, A. . Nature. 423 (6943), 939-939 (2003).
- Varoqueaux, F., Aramuni, G., Rawson, R. L. . Neuron. 51 (6), 741-741 (2006).
- Graf, E. R., Zhang, X., Jin, S. X., Scheiffele, P., Fan, J., Choih, J. . Cell. 119 (7), 1013-1013 (2004).
- Scheiffele, P., Fan, J., Choih, J. . Cell. 101 (6), 657-657 (2000).
- Jamain, S., Quach, H., Betancur, C. . Nature genetics. 34 (1), 27-27 (2003).
- Szatmari, P., Paterson, A. D., Zwaigenbaum , L. . Nature genetics. 39 (3), 319-319 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon