Técnicas basadas en inmunoprecipitación: purificación de proteínas endógenas mediante perlas de agarosa
Visión general
Fuente: Susannah C. Shissler1, Tonya J. Webb1
1 Departamento de Microbiología e Inmunología, Universidad de Maryland, Baltimore, MD 21201
La inmunoprecipitación (IP, también conocida como ensayo "pull-down") es una técnica ampliamente utilizada que tiene aplicaciones en una variedad de campos. Concebido por primera vez en 1984, fue refinado en 1988 (1, 2). El objetivo fundamental de la P.I. es la purificación y el aislamiento de una proteína específica utilizando un anticuerpo contra esa proteína. La palabra "inmuno" se refiere al uso de un anticuerpo, mientras que la palabra "precipitación" se refiere a extraer una sustancia específica de una solución. La proteína diana puede ser endógena o recombinante. La mayoría de las proteínas recombinantes tienen una etiqueta de epítopo (es decir, mico o bandera) unida a ellas para simplificar la purificación posterior. Típicamente, es más fácil optimizar la proteína recombinante IP porque los anticuerpos contra las etiquetas de epítopos recombinantes son muy fuertes y eficaces. Los anticuerpos contra las proteínas endógenas tienen una eficacia extremadamente variable, lo que hace mucho más difícil optimizar estas IP. Un paso necesario después de la inmunoprecipitación es la verificación de la purificación. La proteína aislada se resuelve utilizando SDS-PAGE y posteriormente sondeada para la pureza por manchas occidentales (Figura 1). Un control importante es el uso de un anticuerpo diferente durante la mancha occidental para verificar el tirón de la proteína correcta. La combinación de IP con técnicas posteriores es una poderosa herramienta de análisis. El objetivo después de la purificación puede ser la caracterización de la proteína en sí por RMN, espectrometría de masas y ensayos in vitro, o el análisis de los socios que interactúan con la proteína (es decir, proteína, ADN, ARN) (3, 4, 5).
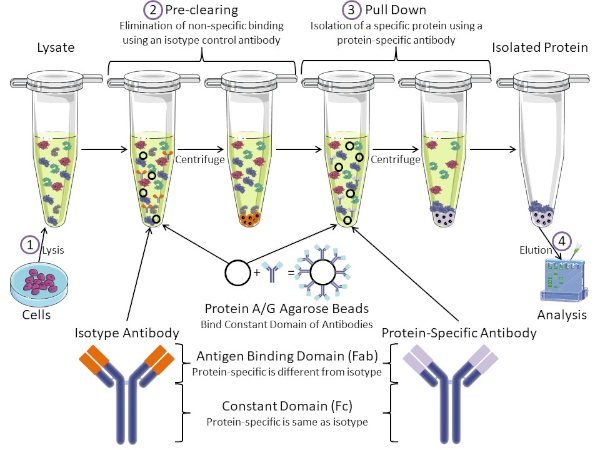
Figura 1: Visión general del procedimiento de inmunoprecipitación. La inmunoprecipitación es el aislamiento de una proteína específica utilizando un anticuerpo. Después de la producción de lisado a partir de células, hay dos pasos principales: pre-clearing y pull down. Durante el paso de pre-limpieza, los lisados celulares se eliminan previamente de proteínas que se unen a los anticuerpos no específicamente utilizando un anticuerpo de control de isotipo. En el paso de tracción hacia abajo, la proteína diana se tira hacia abajo usando un anticuerpo específico de la proteína. La proteína aislada es entonces analizada por western blot. Los anticuerpos isotipo y los anticuerpos específicos de proteínas tienen el mismo dominio constante, pero diferentes dominios de unión de antígenos. Un componente clave de este protocolo son las perlas de agarosa de proteína A/G que unen el dominio constante de los anticuerpos, lo que permite la inmunoprecipitación de la proteína diana. Haga clic aquí para ver una versión más grande de esta figura.
Los anticuerpos son el componente clave de una inmunoprecipitación que la diferencia de otras formas de purificación de proteínas (es decir, purificación de columnas de afinidad de níquel). Los anticuerpos son moléculas producidas por células B que pueden reconocer epítopos proteicos específicos. Los anticuerpos tienen dos dominios: constante (Fc) y enlace de antígeno (Fab) (Figura 1). El dominio constante identifica el tipo de anticuerpo y dicta la función in vivo. Por lo general, los dominios constantes de los anticuerpos utilizados para IP son IgG de ratón, rata o conejo. La porción de unión al antígeno del anticuerpo reconoce un epítopo específico de una proteína específica. Los anticuerpos pueden reconocer epítopos en proteínas plegadas que pueden no existir cuando la proteína está desnaturalizada y viceversa. Por lo tanto, la disponibilidad del epítopo depende del plegado de proteínas, identificando un factor importante a tener en cuenta a la hora de elegir anticuerpos y condiciones para la P.I.
Tanto los sistemas procaario como el eucariota tienen proteínas de unión a anticuerpos. En los sistemas eucariotas, el propósito es la protección inmune contra las bacterias mientras que en los sistemas procariotas, el propósito es la protección del sistema inmunológico. Las proteínas de unión a anticuerpos afectan a la metodología IP de dos maneras. En primer lugar, hay un paso necesario de pre-limpieza (Figura 1) para eliminar el lisado de proteínas que unen anticuerpos - reduciendo así la unión no específica en el producto final. Este paso utiliza un anticuerpo isotipo que tiene el mismo dominio constante que un dominio de unión de anticuerpos diferente al de su anticuerpo específico de proteína. Las proteínas bacterianas de unión a anticuerpos son el segundo componente clave de este método. Después de que el anticuerpo específico de la proteína une la proteína diana, el anticuerpo: complejo proteico debe ser arrastrado hacia abajo (Figura 1). Las proteínas A, G y L son proteínas bacterianas que unen el dominio constante de los anticuerpos. Mientras que las bacterias utilizan esto para subvertir el sistema inmunológico, los investigadores han cooptado este sistema para una fácil purificación de anticuerpos, y se utiliza durante los pasos previos a la limpieza y el tirón. Estas proteínas tienen diferentes afinidades de unión para diferentes especies y diferentes subtipos de dominio constante - otro factor a tener en cuenta a la hora de elegir condiciones para la P.I. Muchas empresas venden cuentas de agarosa etiquetadas con proteína A/G (Figura 1), columnas de espín prefabricadas o resinas para hacer columnas. En general, las perlas y las columnas de espín se utilizan para tamaños de muestra más pequeños, mientras que las resinas se utilizan para la purificación a granel.
En este ejercicio de laboratorio, demostramos cómo purificar la proteína endógena c-myc, a partir de timocitos murinoprimarios primarios, utilizando la técnica básica de inmunoprecipitación basada en la proteína A/G Plus. El protocolo comienza a partir de la preparación del lisado celular y termina con la verificación de la extracción exitosa de proteína hacia abajo usando el análisis de la mancha occidental.
Procedimiento
1. Inmunoprecipitación con abalorios de agarosa de proteína A/G PLUS
Preparación de lisato celular
- Centrifugar 108 timiocitos en una microcentrífuga a 13.000 rpm durante 3 min y retirar el sobrenadante.
Nota: El número de células variará dependiendo de los niveles de expresión de la proteína deseada y el tipo de célula elegido. - Vuelva a suspender las celdas en el búfer de lisis de 500 l RIPA con PMSF.
- Interrumpe las células usando unos pulsos rápidos con un vórtice y luego aspira el lisado unas cuantas veces con una aguja de 25 G unida a una jeringa.
Nota: Evite crear burbujas. Utilice una aguja más grande, como una aguja 21G para tipos de células más grandes. - Incubar el lisado celular sobre hielo durante 10 minutos.
- Centrifugar el lisado a 13.000 rpm durante 15 min a 4oC.
- Transfiera el sobrenadante a un tubo de microcentrífuga fresco y etiquetado.
Pre-clearing
- Añadir cuentas de agarosa de 20 l de proteína A/G PLUS y 1 g de un anticuerpo de control de isotipo (aquí, se utiliza el anticuerpo de control de isotipo IgG1 de ratón), al lisado.
Nota: La elección del anticuerpo isotipo utilizado dependerá del anticuerpo específico de proteína utilizado más adelante en el paso desplegable. - Incubar la mezcla de lisado en un rotador centrífugo en la cámara fría (4oC) durante 30 min.
- Centrifugar la muestra a 3200 rpm durante 30 s a 4oC.
- Transfiera el sobrenadante pre-claro a un tubo de microcentrífuga fresco, etiquetado, de 1,5 ml. Deseche el pellet.
Determinación de la concentración de proteínas
- Determinar la concentración de proteína del lisado celular mediante la realización de un ensayo de Bradford.
- Reactivo Bradford Aliquot 1000 l en 7 tubos de microcentrífuga.
- Añadir las siguientes cantidades de proteína BSA estándar (2 mg/ml) en 6 de los tubos (Tabla 1).
| Número de tubo | Volumen de la AB (L) (2 mg/ml) | Concentración de proteínas (g/L) |
| 1 | 0 | 0 |
| 2 | 1 | 2 |
| 3 | 2 | 4 |
| 4 | 3 | 6 |
| 5 | 4 | 8 |
| 6 | 5 | 10 |
Tabla 1: Cantidades estándar de proteína BSA
- En eltubo 7, añadir 1 l del lisado pre-claro.
Nota: Para asegurarse de que la concentración de la muestra se encuentra dentro del rango de detección de ensayo, prepare y analice también una dilución de lisado 1:2 o 1:5. - Coloque 200 ml de cada uno de los 7 tubos en pozos individuales de una placa de fondo plano de 96 pocillos repitiendo cada muestra en triplicado.
- Lea la placa en un lector de placas a 595 nm.
- Genere la curva estándar en Excel y calcule la concentración de proteínas del lisado pre-borrado.
Tire hacia abajo
- Etiquete dos tubos de microcentrífuga nuevos de 1,5 ml, uno como "control" y otro como "prueba", que en este ejemplo es c-myc.
- Coloque 500 g de lisado pre-claro en cada uno de estos tubos.
Nota: La cantidad de proteína utilizada aquí dependerá de la cantidad de la proteína deseada para ser purificada. - Traiga el volumen total para cada tubo hasta 500 l utilizando el tampón de lisis.
- Añadir 2 g de anticuerpo anti-c-mico al tubo del grupo de ensayo y 2 g de anticuerpo de control de isotipo IgG1 del ratón al grupo de control.
Nota: La cantidad de anticuerpos dependeráde la eficacia de los anticuerpos y de la cantidad de la proteína diana. - Incubar los tubos de un rotador en la cámara frigorífica (4oC) durante 2 h.
- Añadir 20 éL de proteína A/G PLUS perlas de agarosa a cada tubo.
Nota: Es aconsejable utilizar puntas de pipeta con el extremo cortado para evitar daños en las perlas. - Incubar sobre un rotador en cámara frigorífica (4oC) durante la noche.
Nota: Dependiendo de la proteína diana y la eficacia de los anticuerpos, este paso puede variar de 1 h a la noche. - Centrifugar los tubos a 3200 rpm a 30 s 4oC para tirar hacia abajo de las perlas.
- Aspirar el sobrenadante de cada tubo.
Nota: La proteína diana ahora está unida a las cuentas. - Lave las perlas dos veces con PBS de 500 L 1X Dulbecco.
- Centrifugar los tubos a 3200 rpm durante 30 s 4oC.
Nota: Para un lavado más estricto, utilice búferes más estrictos, como RIPA. - Aspirar el tampón de cada tubo. Usando puntas de carga de gel, elimina cualquier tampón sobrante de las cuentas y mantén las cuentas en hielo para eluir la proteína.
Nota: En este ejemplo, la proteína se eluye en el búfer de ejecución SDS-PAGE hirviendo las perlas, para el análisis de manchas occidentales. Este enfoque es adecuado para verificar los resultados de la P.I. o para examinar las interacciones proteínas y proteínas. Para otras aplicaciones posteriores, como la purificación de proteínas para análisis estructurales o enzimáticos, se utilizan sistemas más sofisticados, como etiquetas de epítopos (etiqueta de bandera o etiqueta micálica) para evitar la elución del anticuerpo con la proteína de interés.
2. Verificación de la P.I. a través del análisis de Western Blot
Electroforesis SDS-PAGE:
- Vuelva a suspender las perlas en un tinte de carga SDS-PAGE de 20 l que contenga el mercapto-etonol.
- Hervir las muestras a 95 oC durante 5 min.
- Centrifugar las perlas a 13.000 rpm durante 10 s a temperatura ambiente.
- Usando puntas de carga de gel, entube cuidadosamente las muestras obtenidas de las cuentas y cárguelas en pozos de 4-15% de gradiente SDS-PAGE gel.
- Además de las muestras, cargue un carril con una escalera de proteínas, así como un carril con el islapreo pre-despejado para servir como control de carga.
- Corre a 100 V hasta que el frente del tinte alcance la parte inferior del gel (1h).
Análisis de Western Blot:
- Haga un sándwich western blot, asegurándose de que la membrana PVDF esté entre el gel y el cátodo rojo.
- Traslado por 1 h a 100 V.
- Coloque la membrana en tampón de bloqueo de 5 ml a temperatura ambiente durante 1 h en un balancín en un ajuste bajo, para bloquear los sitios de unión a proteínas no específicos.
Nota: Es posible que sea necesario aumentar los volúmenes de tampón de bloqueo, anticuerpoprimario, anticuerpo secundario y lavados para manchas de mayor tamaño. - Incubar la mancha con un anticuerpo anti-c-mico de 5 ml en el tampón de bloqueo durante la noche a 4oC en balancín en un ajuste bajo.
Nota: El anticuerpo utilizado aquí debe ser diferente del utilizado en el paso desplegable. - Lave la mancha 3-6 veces usando 5 ml de TBST con cada lavado siendo 5 min a temperatura ambiente en un balancín en un ajuste bajo.
- Incubar la mancha con anticuerpo secundario de cadena ligera anticonejo con etiqueta HRP en tampón de bloqueo, durante 1 h a temperatura ambiente en balancín a un ajuste bajo.
Nota: La elección del anticuerpo secundario dependerá del anticuerpo primario utilizado para la mancha occidental. Además, una cadena ligera específica secundaria se utiliza en el protocolo porque la proteína diana está cerca en peso molecular de la cadena pesada del anticuerpo. Si la proteína diana está cerca de 50kDa, utilice una cadena ligera específica secundaria. Si la proteína diana está cerca de 25kDa, utilice y una cadena pesada específica secundaria. - Lave la mancha 3-6 veces usando 5 ml de TBST con cada lavado siendo 5 min a temperatura ambiente en un balancín en un ajuste bajo.
- Retire el líquido de la mancha y el borde de la mancha en las toallitas de laboratorio para eliminar el exceso de líquido.
- Cubra la mancha con 1 x reactivo de detección quimioluminiscente' e incubar durante 1 min.
Nota: Los siguientes pasos deben realizarse en rápida sucesión, ya que el reactivo de detección es sensible a la luz y al tiempo. - Dab borde de mancha en toallitas de laboratorio para eliminar el exceso de reactivo de detección.
- Coloque la mancha en la superficie de imagen de la bandeja Imager.
Nota: Las manchas quimioluminiscentes también se pueden visualizar utilizando película. - Imagen usando el 'Programa Chemiluminescent' para capturar múltiples puntos de tiempo de 10 s a 5 min.
Nota: El tiempo óptimo puede cambiar en función de la cantidad de proteínas y la calidad de los anticuerpos. - Elija una imagen con una visibilidad óptima de la banda y, a continuación, exporte esa imagen.
- Antes de mover la mancha, tome una foto de la mancha usando el imager, para capturar la ubicación de la escalera. Luego, exporta esa imagen también.
- Con un software de preparación de diapositivas (como PowerPoint), alinee las bandas y las imágenes de escalera para formar una sola imagen.
Resultados
Los resultados del procedimiento detallado anteriormente se muestran en la Figura 2. De izquierda a derecha, los carriles contienen el grupo de control (isotipo), el grupo de prueba (c-mic), el islapredado pre-claro (lisado) y la escalera de peso molecular (escalera). Las bandas de escalera de 25 y 75 kDa están marcadas. Las dos bandas prominentes a 25 kDa y 50 kDa son la cadena ligera y pesada del anticuerpo de unión, respectivamente, y no son específicas de la IP o de las muestras. proteína c-myc que dura alrededor de 67kDa en manchas occidentales y generalmente es visible justo debajo de la banda de escalera de 75 kDa. En esta mancha, la banda c-myc es visible en el segundo carril, pero ausente en el primer carril, lo que indica que el anticuerpo IP tiró con éxito por c-myc. No hay banda visible en el carril de lisado pre-claro, lo que sugiere que esta proteína tiene bajos niveles de expresión endógena.
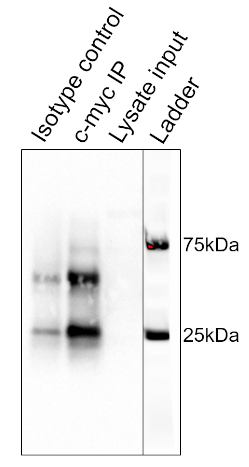
Figura 2: Resultados de un análisis de Western Blot, utilizado para evaluar la purificación de c-myc por inmunoprecipitación. Una banda de 67 kDa, correspondiente a c-myc, es visible en el carril anti-c-mico, pero no en el carril de control de isotipo. Tenga en cuenta que los niveles de c-myc no eran lo suficientemente altos como para ser visualizados en el carril de lisado. Haga clic aquí para ver una versión más grande de esta figura.
Aplicación y resumen
En resumen, la inmunoprecipitación es el aislamiento de una proteína específica utilizando un anticuerpo. En este ejemplo, los resultados de la inmunoprecipitación fueron analizados por Western blot para evaluar la pureza. La proteína aislada podría utilizarse en una serie de aplicaciones posteriores, incluyendo: RMN para la estructura proteica, Espectrometría de masas para secuencia de aminoácidos, o ensayos in vitro para la caracterización enzimática. Las IPs también pueden caracterizar a los socios que interactúan con las proteínas. Por ejemplo, después del aislamiento, el ADN o el ARN podrían aislarse para la secuenciación. Las inmunoprecipitaciones evalúan las interacciones proteína-proteína. Cuando la proteína diana se tira hacia abajo durante una IP, las proteínas que interactúan también se pueden tirar hacia abajo. Estos socios que interactúan pueden ser evaluados por espectrometría de masas y mancha occidental. La inmunoprecipitación es una técnica poderosa para estudiar la biología proteica.
Referencias
- Olliver, C. L. and Boyd, C. D. (1984). Immunoprecipitation of In Vitro Translation Products with Protein A Bound to Sepharose. In J. M. Walker (eds), Nucleic Acids. Methods in Molecular Biology (pp. 157-160). New Jersey: Humana Press.
- Thurston, C. F. and Henley, L. F. (1988). Direct Immunoprecipitation of Protein. In J. M. Walker (eds), New Protein Techniques. Methods in Molecular Biology (pp. 149-158). New Jersey: Humana Press.
- Anderson, N. G. (1998). Co-immunoprecipitation: Identification of Interacting Proteins. In R. A. Clegg (eds), Protein Targeting Protocols.Methods in Molecular Biology (pp. 35-45). New Jersey: Humana Press.
- Jackson, D. I. and Dickson, C. (1999). Protein Techniques: Immunoprecipitation, In Vitro Kinase Assays, and Western Blotting. In P.T. Sharpe and I. Mason (eds), Molecular Embryology. Methods in Molecular Biology (pp. 699-708). New Jersey: Humana Press.
- Trieu, E. P. and Targoff, I. N. (2015). Immunoprecipitation: Western Blot for Proteins of Low Abundance. In B. Kurien and R. Scofield (eds), Western Blotting. Methods in Molecular Biology (pp. 327-342). New York, NY: Humana Press.
Saltar a...
Vídeos de esta colección:

Now Playing
Técnicas basadas en inmunoprecipitación: purificación de proteínas endógenas mediante perlas de agarosa
Immunology
87.8K Vistas

Citometría de flujo y clasificación de células activadas por fluorescencia (FACS): Aislamiento de linfocitos B esplénicos
Immunology
93.1K Vistas

Clasificación celular activada magnéticamente (MACS): Aislamiento de linfocitos T del timo
Immunology
22.9K Vistas

Ensayos ELISA: Indirecto, Sándwich y Competitivo
Immunology
238.9K Vistas

Ensayo ELISPOT: Detección de esplenocitos secretores de IFN-γ
Immunology
28.5K Vistas

Inmunohistoquímica e Inmunocitoquímica: Imágenes de tejidos a través de microscopía óptica
Immunology
79.1K Vistas

Generación de anticuerpos: Producción de anticuerpos monoclonales mediante hibridomas
Immunology
43.6K Vistas

Microscopía de Inmunofluorescencia: Tinción de inmunofluorescencia de secciones de tejido incrustado en parafina
Immunology
53.9K Vistas

Microscopía de Fluorescencia Confocal: Una Técnica para Determinar la Localización de Proteínas en Fibroblastos de Ratón
Immunology
43.3K Vistas

Análisis del ciclo celular: Evaluación de la proliferación de células T CD4 y CD8 después de su estimulación mediante tinción CFSE y citometría de flujo
Immunology
24.3K Vistas

Transferencia celular adoptiva: Introducción de cenocitos de un ratón donante a un ratón huésped y evaluación del éxito a través de FACS
Immunology
22.5K Vistas

Ensayo sobre la muerte celular: Ensayo de liberación de cromo de la capacidad citotóxica
Immunology
151.4K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados