Method Article
In vitro Modelado de la neurogénesis del síndrome de Down utilizando células madre pluripotentes inducidas por humanos
En este artículo
Resumen
Este protocolo describe una metodología para recapitular la neurogénesis alterada del síndrome de Down (SD) utilizando iPSC humanas con SD. El protocolo identificó el defecto del ciclo celular bifásico como la causa de la neurogénesis alterada en el síndrome de Down. Proporciona una plataforma sólida para comprender los mecanismos celulares y moleculares que subyacen a la neurogénesis anormal asociada con el SD.
Resumen
El síndrome de Down (SD), causado por una copia adicional del cromosoma 21, es una de las principales causas de discapacidad intelectual. Uno de los factores clave que contribuyen a esta discapacidad intelectual es el deterioro de la neurogénesis que se observa desde las etapas fetales en adelante. Para estudiar estas anomalías del desarrollo neurológico, las células madre pluripotentes inducidas por el ser humano (hiPSC) generadas a partir de células obtenidas de pacientes con SD proporcionan un modelo valioso y relevante. Aquí, se describe un protocolo integral para recapitular la neurogénesis alterada del SD observada durante las etapas fetales del SD. Este protocolo utiliza un par de DS-hiPSCs que tienen tres copias del cromosoma 21 y sus hiPSCs euploides isogénicas que tienen dos copias del cromosoma 21. Es importante destacar que el protocolo descrito aquí recapitula la neurogénesis alterada por el SD y encontró que el defecto del ciclo celular bifásico, es decir, la proliferación reducida de las células progenitoras neurales (NPC) del SD durante la fase temprana de la etapa neurogénica seguida de una mayor proliferación de NPC del SD durante la fase tardía de la etapa neurogénica es la causa de la neurogénesis deteriorada del SD. El aumento de la proliferación de NPC DS durante la fase tardía de la etapa neurogénica conduce a una salida retrasada del ciclo celular, lo que provoca una reducción de la generación de neuronas postmitóticas a partir de las NPC DS. Este protocolo incluye pasos detallados para el mantenimiento de las hiPSCs, su diferenciación en linajes neuronales que muestran un defecto del ciclo celular bifásico durante la etapa neurogénica y la posterior validación de la diferenciación neuronal reducida en las células DS. Siguiendo esta metodología, los investigadores pueden crear un sistema experimental robusto que imite las condiciones de neurodesarrollo del SD, lo que les permite explorar las alteraciones específicas en el desarrollo cerebral causadas por la trisomía 21.
Introducción
El síndrome de Down (SD), o trisomía 21, es la anomalía cromosómica más común y la principal causa de discapacidad intelectual (DI)1. El deterioro de la neurogénesis durante el desarrollo fetal del SD es una de las causas de discapacidad intelectual en el SD2. Los estudios fetales con SD humano muestran una reducción en el peso y volumen del cerebro, neuronas reducidas, aumento de astrocitos 3,4 y distribución anormal de neuronas en las capas II y IV 5,6. Además, la segunda fase del desarrollo cortical, es decir, la aparición de la laminación, se retrasa y se desorganiza en el DS7.
Los defectos del neurodesarrollo en el SD se han estudiado principalmente utilizando modelos de ratones de SD como Ts65Dn, Ts1Rhr y Ts1cje8. Sin embargo, estos modelos de ratones no fueron capaces de recapitular completamente varios fenotipos observados en los estudios de SD debido a las diferencias fisiológicas y de desarrollo entre ratones y humanos9, lo que llevó a ensayos clínicos fallidos10. La invención de las células madre pluripotentes inducidas11,12 proporcionó una oportunidad para modelar el deterioro neurológico del síndrome de Down utilizando células derivadas directamente de individuos con SD. Sin embargo, los intentos anteriores de modelar los defectos del neurodesarrollo del SD utilizando iPSCs humanas encontraron resultados inconsistentes y no pudieron explicar completamente los defectos del neurodesarrollo observados en las secciones del cerebro fetal del SD 13,14,15,16. Por ejemplo, un informe publicado por Shi et al. encontró fenotipos de Alzheimer relacionados con el SD, pero no informó ninguna diferencia en la neurogénesis del SD en comparación con los controles euploides15. De manera similar, Weick et al. informaron una actividad sináptica reducida pero una neurogénesis normal en el SD en comparación con los controles euploides16. Sin embargo, la neurogénesis normal en el SD reportada en estas publicaciones no fue consistente con la observación de las secciones del cerebro fetal del SD. Más tarde, un informe de Hibaoui et al. informó de una reducción de la neurogénesis en el SD, lo que fue consistente con la observación de la sección14 del cerebro fetal del SD. Sin embargo, este informe y otro informe reciente describieron la reducción de la proliferación de NPCs del SD como la causa de la reducción de la neurogénesis en el SD14,17. Sin embargo, solo la reducción de la proliferación de NPCs con SD no pudo explicar el aumento de las células astrogliales y el retraso en la aparición de la laminación durante el desarrollo del cerebro fetal con SD.
En un trabajo publicado recientemente, se desarrolló un modelo de neurogénesis alterada del SD basado en iPSC humano que muestra una neurogénesis reducida. Este modelo encontró que la neurogénesis alterada en el SD se debe a defectos del ciclo celular bifásico durante la etapa neurogénica (la etapa durante la cual se generan células progenitoras neurales a partir de células madre pluripotentes). Durante la primera fase en la etapa neurogénica, las NPC DS exhiben una proliferación reducida en comparación con las células neuronales euploides isogénicas, seguidas de una mayor proliferación de las NPC DS en comparación con las células euploides isogénicas en la fase tardía de la etapa neurogénica18.
En este manuscrito, se ha descrito un protocolo detallado paso a paso para la diferenciación de las hiPSCs del síndrome de Down y sus hiPSCs euploides isogénicas en neuronas corticales. El objetivo general de este método es proporcionar un protocolo detallado, paso a paso, para diferenciar un par de hiPSC DS y sus hiPSC euploides isogénicas en neuronas corticales con un enfoque en el modelado de los defectos de neurogénesis asociados con el SD. Este protocolo está diseñado para ofrecer un sistema robusto y reproducible para investigar los mecanismos celulares y moleculares que subyacen a las anomalías que causan la neurogénesis alterada por el SD.
La razón detrás del desarrollo de este protocolo es permitir la diferenciación de células madre pluripotentes en neuronas corticales mediante la utilización de principios de la neurobiología del desarrollo, permitiendo así la identificación de fenotipos que surgen debido a una enfermedad / trastorno. Su objetivo era adoptar un enfoque minimalista para la diferenciación neuronal de las iPSC evitando compuestos como el AMPc o el DAPT, que pueden enmascarar los fenotipos de enfermedades que surgen debido a defectos en el canal Ca++ o en la vía NOTCH, respectivamente. Del mismo modo, también se evitó el uso de ácido ascórbico, BDNF y GDNF, que pueden enmascarar otros fenotipos relacionados con enfermedades neurológicas al potenciar la neurogénesis.
Las ventajas de esta técnica sobre los métodos alternativos radican en que proporcionan una recapitulación robusta de los fenotipos neurológicos observados en las secciones cerebrales fetales del SD. Cabe destacar que, en comparación con los modelos de ratón, el sistema basado en iPSC humano elimina las diferencias entre especies, proporcionando un modelo más relevante para estudiar los procesos de neurodesarrollo específicos de loshumanos.9 pero hasta ahora no ha logrado recapitular la neurogénesis alterada del SD observada en las etapas fetales del SD en adelante. Además, el uso de pares isogénicos de hiPSCs reduce la variabilidad y mejora la fiabilidad de las diferencias fenotípicas observadas. Este protocolo será de particular interés para los investigadores que estudian los trastornos del neurodesarrollo y la neurogénesis humana. Es especialmente relevante para aquellos que buscan modelar aspectos específicos del SD humano o aquellos interesados en desarrollar intervenciones terapéuticas dirigidas a los defectos de neurogénesis asociados con la trisomía 21.
Protocolo
Se siguió el siguiente protocolo con dos pares de iPSCs humanas con síndrome de Down y sus iPSCs euploides. Un par se generó utilizando el método de administración de reprogramación mediado por retrovirales19, y un segundo par (NSi003-A y NSi003-B) se generó utilizando el método de administración del virus Sendai no integrador20. A grandes rasgos, el protocolo consta de dos etapas: la etapa neurogénica (Etapa 1) y la etapa de diferenciación neuronal (Etapa 2). Además, se observan dos fases basadas en las diferencias en la proliferación del síndrome de Down y las líneas celulares euploides isogénicas, es decir, las fases temprana y tardía, en la etapa neurogénica. Los detalles de los reactivos, medios y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Cultivo y mantenimiento de hiPSCs con síndrome de Down y hiPSCs euploides isogénicas
- Placas de alimentación para hiPSC
NOTA: La calidad y la densidad del alimentador son extremadamente importantes para la buena calidad del cultivo de iPSCs humanas.- Agregue 2 ml de gelatina al 0,1% para cubrir una placa de 6 pocillos durante al menos 1-2 h a 37 °C antes de sembrar con celdas alimentadoras.
- Mantenga la placa recubierta de gelatina a temperatura ambiente en la campana de cultivo celular durante al menos 30 minutos antes de colocar las células.
- Medios calientes de fibroblastos embrionarios de ratón (MEF) para ser utilizados para la reactivación en baño de perlas/baño de agua.
- Alícuota 5 mL de medio MEF en un tubo de centrífuga de 15 mL.
- Saque un vial de celdas alimentadoras del tanque de nitrógeno líquido (tanque LN2).
NOTA: Las células alimentadoras se derivaron mediante el tratamiento de fibroblastos embrionarios de ratón E13.5 con 10 μg/mL de mitomicina C durante 3 h seguido de 2-3 lavados con DPBS18. Las celdas de alimentación se pueden usar directamente o congelar en un tanque de LN2 para uso futuro. Todos los ratones fueron utilizados después de la aprobación del Comité Institucional de Ética Animal. - Mantenga el vial a 37 °C en el baño de agua utilizando una rejilla flotante hasta que quede un pequeño trozo de hielo.
- Lleve el vial dentro de la cabina de bioseguridad y esterilícelo con alcohol antes de ponerlo dentro de la cabina de bioseguridad.
- Agregue 1 mL de medio MEF tibio (consulte la Tabla de materiales) gota a gota.
- Extraiga suavemente el medio del vial y viértalo gota a gota en un tubo de centrífuga de 15 ml que contenga medios MEF.
- Centrifugar a temperatura ambiente durante 5 min a 200 x g.
- Aspire el sobrenadante utilizando un sistema de aspiración al vacío (VAS).
- Agregue 1 ml de medio MEF y pipetee suavemente hacia arriba y hacia abajo 3-4 veces.
- Tome el recuento de células con un hemocitómetro. Las células muertas se excluyeron con Trypan Blue.
- Placa 3.1-3.3 x 105 celdas alimentadoras vivas por pocillo de una placa de 6 pocillos o 2 x 106 celdas por placa de 6 pocillos en medio MEF.
- Mantenga la placa dentro de la incubadora de CO2 a 37 °C con 85% de humedad durante la noche. Agite la placa dentro de la incubadora de CO2 de adelante hacia atrás y hacia los lados 2-3 veces para lograr una distribución homogénea de las células de alimentación.
- Resurgimiento de las hiPSCs del síndrome de Down y las hiPSCs euploides isogénicas
NOTA: Caliente el volumen requerido de medios hiPSC en un baño de perlas a 37 °C.
Medio de reactivación de células madre pluripotentes inducidas humanas (hiPSC): Agregue recientemente 25 ng/mL de factor de crecimiento básico de fibroblastos (bFGF) y 10 μM de inhibidor de rocas (RI) (Y-27632 2HCl) en medio hiPSC.- Retire el medio MEF de los pocillos de los alimentadores y lave los comederos agregando suavemente 1 mL/pocillo de DMEM/F12 tibio desde los lados del pocillo. Aspire el medio y agregue 2 mL/medio hiPSC hiPSC bien tibio. Deje la placa dentro de la incubadora durante al menos 2 h antes de sembrar las hiPSC.
- Saque un vial de hiPSC.
- Mantenga el vial en una rejilla flotante en un baño de agua a 37 °C hasta que quede un pequeño trozo de hielo.
- Antes de llevar el vial dentro de la cabina de bioseguridad, esterilícelo con alcohol al 70%.
- Agregue 1 mL de medio de reactivación hiPSC tibio.
- Extraiga suavemente el medio del vial y viértalo gota a gota en un tubo de centrífuga de 15 mL que contenga 5 mL de medio de reactivación de hiPSCs.
- Centrifugar a temperatura ambiente durante 2 min a 100 x g.
- Aspire el sobrenadante con VAS y desaloje el pellet golpeando suavemente el tubo.
- Vierta 500 μL de medio hiPSC con 10 μM de RI y vierta sobre la placa de alimentación que contiene el medio de reactivación hiPSC. Etiquete la placa con el nombre de la célula, el número de pasaje, el nombre del investigador y la fecha.
- Observe las colonias de hiPSC bajo un microscopio invertido con un aumento de 4x; Debe haber grupos de células.
- Mientras mantiene la placa dentro de la incubadora de CO2 , agite la placa de adelante hacia atrás y hacia los lados 2-3 veces para lograr una distribución homogénea de las células. No moleste la placa durante 24 h.
- Al día siguiente, algunas colonias pueden parecer adheridas a los comederos y otras estarían flotando. Sin aspirar ningún medio, añadir medio hiPSCs fresco suplementado con 25 ng/mL de bFGF y 10 μM de IR.
- Al segundo día después de la reactivación, la mayoría de las colonias estarían adheridas a la superficie. Cambie el medio completo por medio hiPSC con 25 ng/mL de bFGF. En los próximos días, las colonias de hiPSC serán visibles.
NOTA: Las hiPSC tardan al menos una semana en revivir y formar colonias con bordes lisos y bien definidos, morfología celular uniforme y un centro de colonia denso.
- Síndrome de Down de paso: hiPSCs y hiPSCs euploides isogénicas en los comederos
NOTA: Todos los reactivos deben estar tibios antes de comenzar. Evite el pipeteo excesivo de las células. Manipule las células con mucho cuidado.- Paso: hiPSCs cuando la mayoría de las colonias comienzan a fusionarse entre sí o cuando hay la aparición de demasiadas colonias diferenciadas. Generalmente, la división debe realizarse dentro de los 5-7 días posteriores al primer paso.
- Reviva un vial de comederos un día antes de partir.
- Dé un lavado a los comederos con 1 mL/pocillo de DMEM/F12 tibio y agregue 2 mL/pocillo de medio hiPSC tibio suplementado con 25 ng/mL de bFGF. Deje la placa dentro de la incubadora de CO2 a 37 °C durante al menos 2 h antes de sembrar las hiPSC.
- Observe la placa con hiPSC para colonias diferenciadas y elimine la colonia diferenciada mediante raspado con una pipeta de 200 μL bajo un microscopio estereoscópico.
- Dé un lavado a las hiPSC con 1 mL/DMEM/F12 bien tibio.
- Vierta 1 mL/pocillo de 1 mg/ml de solución de colagenasa. Mantenga la placa dentro de la incubadora durante 8-10 minutos y luego observe bajo un microscopio invertido los bordes sueltos de las colonias.
- Aspirar la colagenasa y dar 2 lavados de DMEM/F12. A continuación, añada 1 mL/pocillo hiPSC Medium.
- Corte suavemente las colonias horizontal y verticalmente de 8 a 10 veces en un pocillo con la punta de una jeringa de 2 ml. Observe las colonias bajo un microscopio invertido para verificar si la mayoría de las colonias se han cortado al tamaño adecuado.
- Si las colonias se cortan lo suficiente, levante suavemente las colonias con un elevador de celdas.
- Pipetear suavemente las colonias en el pocillo con una punta de 1 mL, 5-8 veces, dependiendo del tamaño de las colonias.
- Recoja todas las células en un tubo de centrífuga de 15 ml y centrifuga a temperatura ambiente durante 2 minutos a 100 x g.
- Aspirar suavemente el sobrenadante con una pipeta, desalojar el pellet de la célula golpeando suavemente el tubo y añadir 200 μL de medio hiPSC con 25 ng/mL de bFGF y 10 μM de IR. Pipetear 2-3 veces con la pipeta de 200 μL y añadir 300 μL más de medio hiPSC con 25 ng/mL de bFGF y 10 μM de RI.
- Ahora coloque suavemente estas células sobre los alimentadores que contienen medio hiPSC + 25 ng/mL de bFGF. Un pozo se puede dividir en 1:2 o 1:3, dependiendo del número de colonias presentes después de eliminar las colonias diferenciadas. Etiquete la placa con el nombre de la célula, el número de pasaje, el nombre del investigador y la fecha.
- Mientras mantiene la placa dentro de la incubadora de CO2 , agite la placa de adelante hacia atrás y hacia los lados 2-3 veces para lograr una distribución homogénea de las células.
- Al día siguiente, lavar suavemente con DMEM/F12 tibio y añadir 2,5 mL de medio hiPSC con 25 ng/mL de bFGF.
- HiPSCs del síndrome de Freezing Down y hiPSCs euploides isogénicas de los comederos
NOTA: Se debe evitar el pipeteo excesivo de iPSC humanas durante el procedimiento de congelación.- Divida las hiPSC cuando todavía estén en su fase logarítmica, es decir, 4-5 días después del paso.
- Observe la placa con hiPSC para las colonias diferenciadas y retire las colonias diferenciadas utilizando una pipeta de 200 μL bajo un microscopio estereoscópico.
- Dé un lavado a las hiPSC con 1 mL/DMEM/F12 bien tibio.
- Agregue 1 mL/pocillo de 1 mg/mL de solución de colagenasa. Mantenga la placa dentro de la incubadora durante 8-10 minutos, y luego observe bajo un microscopio invertido para levantar los bordes de las colonias.
- Aspirar la colagenasa y dar 2 lavados de DMEM/F12. A continuación, añada 1 mL/pocillo hiPSC Medium.
- Levanta suavemente las colonias con un elevador de células.
- Pipetear suavemente las colonias en el pocillo con una punta de 1 mL de 5 a 8 veces, dependiendo del tamaño de las colonias.
- Recoja todas las células en un tubo de centrífuga de 15 ml y centrifuga a temperatura ambiente durante 2 minutos a 100 x g.
- Aspire el sobrenadante suavemente con una pipeta, desaloje la pastilla celular golpeando suavemente el tubo y agregue 1 mL de medio hiPSC sin antibiótico suplementado con 25 ng/mL de bFGF según el número de pocillos. Dispense las células en crioviales.
- Añadir medio hiPSC sin antibiótico suplementado con 25 ng/mL de bFGF y 20% de DMSO en los crioviales para lograr una concentración final del 10% de DMSO.
- Coloque los crioviales en un baño helado con isopropanol para proporcionar una congelación lenta.
- Mantenga la escarcha a -80 °C durante la noche. Transfiera los viales al día siguiente al tanque de LN2.
2. Diferenciación neuronal
NOTA: Preparación del medio acondicionado para el alimentador (FCM): Utilice un matraz T-75 y una placa de 4 x 106 celdas de alimentación por matraz. Al día siguiente, agregue 40 mL de medio hiPSC con 4 ng/mL de bFGF. Recogida durante 7 días. Almacene cada tubo diario a -20 °C durante un máximo de 1 mes. Cubrir un plato de 15 cm con 10 ml de gelatina al 0,1% a 37 °C durante al menos 2 h antes de disociar las células. Cubra una placa de 6 pocillos con matriz de membrana basal calificada para hESC (en lo sucesivo denominada "matriz calificada") 1 día antes de disociar las células. Al disociar células en todo el protocolo, agregue 10 μM de RI a la solución de desprendimiento de células (consulte la Tabla de materiales), DPBS y medios de recubrimiento (FCM suplementado con 25 ng/mL de bFGF). Prepare un medio acondicionado para alimentadores frescos (FCM) para cada diferenciación. Evite el pipeteo excesivo de las hiPSC.
- Día In vitro (DIV) 2: Fabricación de células individuales y siembra de hiPSCs para la neurodiferenciación
- Agregue 10 μM de IR en el medio hiPSC suplementado con 25 ng/mL de bFGF, DPBS, solución de desprendimiento de celdas, y medio acondicionado del alimentador suplementado con 25 ng/mL de bFGF. Calentar todos estos reactivos a 37 °C.
- Tome una placa de 6 pocillos de iPSC en los comederos, retire las colonias diferenciadas y agregue medios frescos de hiPSC suplementados con 25 ng/mL de bFGF y 10 μM de RI. Mantenga la placa durante 2 h en la incubadora.
- Saque la placa de iPSCs después de 2 h y haga un lavado con DPBS sin Ca++ y Mg++.
- Añada 1 mL/solución de desprendimiento de células de pocillo (+ 10 μM de IR) y mantenga la placa dentro de la incubadora de CO2 durante 12-14 min.
- Después de 12-14 minutos, observe las células bajo un microscopio invertido; La mayoría de las células comienzan a desprenderse de la placa. Si algunas células aún se adhieren, golpee suavemente la placa desde los lados.
- Diluir la solución de desprendimiento celular añadiendo 3 mL/pocillo DPBS con Ca++ y Mg++ (+ 10 μM de IR). Con una pipeta de 5 ml, pipetee 2-3 veces suavemente, evitando que las burbujas rompan los grumos.
- Pase las células a través de un colador de 40 μM.
- Recoja las células en un tubo de centrífuga de 50 ml.
- Centrifugar a temperatura ambiente durante 5 min a 200 x g y aspirar el medio suavemente con VAS.
- Resuspender las células en 10 mL de medio hiPSC (+ 25 ng/mL de bFGF + 10 μM de IR). Agregue las células en un plato de 15 cm recubierto de gelatina al 0,1% durante 1,5 h para eliminar los comederos, ya que los comederos tienen una adhesión preferencial a la superficie recubierta de gelatina en comparación con las hiPSC.
- Después de 1,5 h, recoja suavemente el medio con células y centrifugue a temperatura ambiente durante 5 minutos a 200 x g. Aspire medios mediante VAS.
- Vuelva a suspender las células en 1 mL de FCM (+ 25 ng/mL de bFGF + 10 μM de IR) y realice el recuento de células.
- Usando FCM (+ 25 ng/mL bFGF + 10 μM de RI), haga una suspensión celular de 30,000-50,000 celdas/mL y siembre una suspensión celular de 5 mL/placa de 60 mm o 2 mL/pocillo de una placa de 6 pocillos o 500 μL/pocillo de una placa de 24 pocillos. Las placas deben estar recubiertas con una matriz calificada (ver Tabla de Materiales).
- DIV 0: (~48 h más tarde): Cambie el medio acondicionado del alimentador por un medio NPC (DDM + B27 sin vitamina A + N2) (consulte la tabla de materiales).
- DIV 2: Añadir medio NPC con 0,125 μM de Dorsomorfina cada día alterno hasta DIV 18.
- DIV 18: Agregue medios NPC sin Dorsomorfina y reponga cada día alterno hasta DIV 28.
- DIV 28-30: Fabricación de células individuales y siembra de NPC para la Etapa 2
- En DIV 28, saque la placa (que contiene NPCs) y reemplace el medio con medio NPC (+ 10 μM de RI). Coloque la placa en la incubadora de CO2 durante 2 h.
- Después de 2 h, aspire el medio y realice un lavado con DPBS (sin Ca++ y Mg++).
- Añada 1 mL/solución de desprendimiento de células de pocillo (+ 10 μM de IR) y mantenga la placa dentro de la incubadora durante 14 min.
- Después de 14 minutos, observe las células bajo un microscopio invertido a 4x. La mayoría de las células comienzan a desprenderse de la placa. Si algunas células aún se adhieren, golpee suavemente la placa desde los lados.
- Diluir la solución de desprendimiento de células añadiendo 3 mL/pocillo DPBS con Ca++ y Mg++ (+ 10 μM de IR). Con una pipeta de 5 ml, pipetee 2-3 veces suavemente, evitando que las burbujas rompan los grumos.
- Pase a través de un colador de 40 μM colocado en un tubo de centrífuga de 50 mL.
- Centrifugar a temperatura ambiente durante 5 min a 200 x g. Aspire los medios suavemente con VAS.
- Resuspender las células en DDM + B27 con vitamina A (+ 10 μM de IR).
- Cuente las células vivas usando azul de tripán con un hemocitómetro.
- Siembre 50.000 células/pocillo en una placa recubierta de matriz calificada (1x) de la placa de 48 pocillos.
- DIV 33: Cambiar medio a medio de diferenciación neuronal (ver la Tabla de Materiales). Cambie el medio cada 5 días. Siga reponiendo los medios hasta DIV 85/90.
3. Inmunocitoquímica (ICC)
NOTA: Agregue suficiente tampón en todas las etapas para cubrir las celdas y evitar el secado del pocillo mientras aspira durante la etapa de lavado.
- Saque la placa celular diferenciada fuera del área de cultivo celular.
- Aspire el medio y lave con DPBS.
- Para la fijación, agregue 1 mL de paraformaldehído (PFA) al 4% a las células. Cubra la placa con papel de aluminio y colóquela en un agitador basculante a 37 °C durante 30 min.
- Aspire PFA y dé tres lavados de 15 min cada uno con DPBS (sin Ca++ y Mg++).
- Añadir tampón de bloqueo (3% BSA + 5% Burro Serum (o sueros del animal huésped del anticuerpo secundario) + 0,2% Triton-X en DPBS) durante 1 h a temperatura ambiente.
- Añadir 250 μL/pocillo de anticuerpos primarios [Ki67 (dilución 1:100), TUBB3 (dilución 1:500), PAX6 (1:100)] e incubar durante la noche a 4 °C en un agitador balancín. La dilución se realizó en una solución de bloqueo.
- Lavar tres veces con DPBS después de la incubación primaria de anticuerpos.
- Añadir 250 μL/pocillo de anticuerpo secundario (diluido 1:250 en BSA al 3% + Triton-X al 0,2% en DPBS) durante 1 h a temperatura ambiente.
- Lavar 3 veces con DPBS después de la incubación secundaria de anticuerpos.
- Añadir DAPI (dilución 1:1000 de 5 mg/mL de caldo en DPBS) durante 15 min a temperatura ambiente. Lavar tres veces con DPBS. Deje el último lavado en la placa de cultivo y observe bajo el microscopio.
4. Adquisición y análisis de imágenes
- Capture imágenes con el microscopio de fluorescencia con una resolución de 20x.
- Capture imágenes de Ki67, así como imágenes de tinción TUBB3 con un filtro de excitación de 540 nm, PAX6 con un filtro de excitación de 488 nm e imágenes DAPI con un filtro de excitación de 358 nm.
- Capture imágenes de diez campos aleatorios diferentes para su análisis.
- Analice imágenes ICC con el software ImageJ.
- Para el análisis TUBB3 y PAX6, realice el umbral de todas las imágenes para las señales roja y verde, respectivamente, y la intensidad de la señal azul para DAPI. La intensidad media de los píxeles rojos de TUBB3 y los píxeles verdes de PAX6 se normalizaron con la intensidad media de los píxeles azules de DAPI.
- Para el análisis Ki67, cuente las celdas utilizando la función de contador de celdas automatizado en el software ImageJ. Normalice el número de células Ki67 positivas con el número de células DAPI positivas.
- Realice análisis estadísticos utilizando estadísticas y software de gráficos comparando los dos grupos utilizando pruebas t no apareadas. Los datos deben expresarse como media ± SEM de tres experimentos independientes. Un valor p inferior a 0,05 se considera estadísticamente significativo.
Resultados
Las iPSCs humanas singularizadas se sembraron en placas recubiertas de matriz calificadas como suspensiones unicelulares, y la diferenciación se inició mediante la eliminación de bFGF. Para inhibir la diferenciación no ectodérmica, se añadió dorsomorfina, un inhibidor de la señalización de BMP, de DIV 2-1821. Para una mayor diferenciación de las células progenitoras de la etapa neurogénica, las suspensiones de células individuales se replantaron a baja densidad en la matriz calificada (Figura 1) durante 6-10 semanas adicionales para observar la diferenciación neuronal temprana. Después de la etapa de diferenciación neuronal (Etapa 2), el análisis del día 85 reveló una reducción significativa de las neuronas TUBB3+ en los cultivos de DS en comparación con aquellos con células euploides isogénicas (Figura 2A). La cuantificación mostró una disminución de aproximadamente el doble en las neuronas TUBB3+ en los cultivos de DS (Figura 2B). Esto indica que las células del SD exhiben una diferenciación neuronal reducida, lo que es consistente con las observaciones de las secciones del cerebro fetal del SD, lo que demuestra la fiabilidad del modelo de neurogénesis del SD in vitro utilizado en este estudio.
Para investigar la causa subyacente de la reducción del número de neuronas en el SD, se utilizó la inmunotinción Ki67 para analizar el ciclo celular durante la etapa neurogénica de la neurogénesis. Durante la fase inicial de esta etapa, la mayoría de las células euploides isogénicas eran Ki67+, lo que indica una proliferación celular activa. Por el contrario, una proporción significativamente menor de células DS eran Ki67+ (Figura 2C). El análisis cuantitativo reveló una reducción de aproximadamente cuatro veces en las células Ki67+ en el SD (Figura 2D), lo que sugiere que las células del SD permanecieron predominantemente en la fase G0 durante la etapa neurogénica temprana. Un análisis más detallado durante la fase tardía de la etapa neurogénica reveló que la mayoría de las células euploides isogénicas habían salido del ciclo celular, como lo demuestra la ausencia de tinción con Ki67 (Figura 2E). Por el contrario, la mayoría de las células DS permanecieron Ki67+ (Figura 2F), lo que indica la persistencia de células progenitoras cíclicas. Los datos cuantitativos demostraron un aumento de aproximadamente cinco veces en las células Ki67+ en el SD en comparación con las células euploides isogénicas. Estos hallazgos del primer par de DS y hiPSCs euploides isogénicas se validaron utilizando un segundo par de DS y hiPSCs euploides isogénicas. El segundo par también mostró una neurogénesis reducida en el día 85 en las células DS en comparación con las células euploides isogénicas (Figura 2G). El análisis cuantitativo mostró una reducción del doble en las neuronas TUBB3+ (Figura 2H) al final de la diferenciación neuronal. Además, hubo un aumento de más del doble en las células progenitoras neurales PAX6+ en el SD en comparación con las células euploides isogénicas en la misma etapa (Figura 2G y Figura 2I). Estos hallazgos confirmaron que las células progenitoras neurales del DS no lograron salir del ciclo celular y diferenciarse en neuronas postmitóticas, lo que es consistente con un defecto bifásico del ciclo celular.
Este estudio, realizado utilizando dos pares de hiPSCs del SD y sus homólogos euploides isogénicos, demuestra que la neurogénesis alterada observada en el SD se deriva de la desregulación del ciclo celular bifásico en la etapa neurogénica del desarrollo de los progenitores neuronales. Durante la inducción neuronal, las células SD mostraron una proliferación reducida en la fase temprana, seguida de una mayor proliferación durante la fase tardía en comparación con las células de control. La disminución de la proliferación durante la fase temprana restringe el tamaño del grupo de progenitores neuronales, mientras que el aumento de la proliferación durante la fase tardía retrasa la formación de neuronas postmitóticas en el SD.
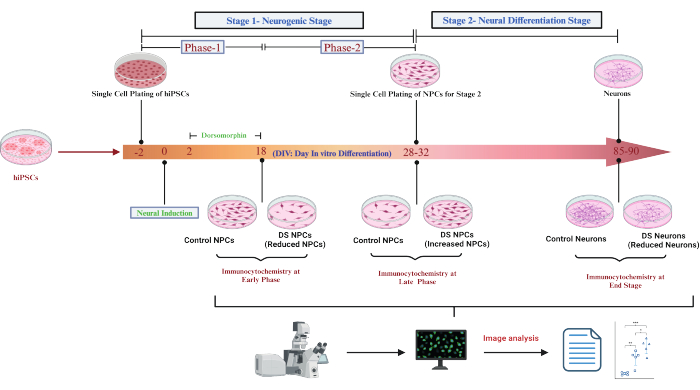
Figura 1: Ilustración de la neurogénesis de las iPSC humanas con síndrome de Down (SD). Las ilustraciones muestran que la neurogénesis se divide en dos etapas: la etapa neurogénica y la etapa de diferenciación neuronal. La diferenciación de las células madre pluripotentes hacia la etapa progenitora neural se denomina etapa neurogénica, mientras que la diferenciación de los progenitores neurales hacia las células del linaje neural se denomina etapa de diferenciación neuronal. La ilustración muestra las escalas de tiempo de cada etapa, como se observa en este protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El defecto del ciclo celular bifásico contribuye a la neurogénesis del síndrome de Down (SD) deteriorada. (A) Imágenes representativas de TUBB3 (rojo), imágenes DAPI y la superposición correspondiente del primer par de DS y hiPSC euploides isogénicas en el día 85. (B) Cuantificación de la expresión de TUBB3 normalizada a la tinción de DAPI mediante inmunocitoquímica (ICC). (C) Imágenes representativas de Ki67 (rojo) durante la fase temprana (DIV 18) de la Etapa 1, con las correspondientes imágenes DAPI y su superposición del primer par de DS y hiPSC euploides isogénicas. (D) Cuantificación de la expresión de Ki67 durante la fase temprana. (E) Imágenes representativas de Ki67 durante la fase tardía (DIV 28) de la Etapa 1, con las correspondientes imágenes DAPI y su superposición del primer par de DS y hiPSC euploides isogénicas. (F) Cuantificación de la expresión de Ki67 durante la fase tardía. (G) Imágenes representativas de TUBB3 (rojo), PAX6 (verde) y DAPI del segundo par de DS y hiPSC euploides isogénicas. (H) Cuantificación de la expresión de TUBB3 en el día 85. (I) Cuantificación de la expresión de PAX6 en el día 85. Las comparaciones entre los grupos se realizaron mediante pruebas t no pareadas. Los datos se presentan como media ± SEM de tres experimentos independientes, con significación estadística definida como p < 0,05. Las barras de escala representan 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este trabajo, se describe un protocolo eficiente de neurodiferenciación cortical monocapa no dirigida para un par isogénico de hiPSCs euploides, y hiPSCs DS. Al crecer las células como monocapas, están más expuestas a las condiciones de cultivo, lo que no es posible en la misma medida que el uso de cuerpos embrioides para la diferenciación de iPSCs, que generalmente se utilizan en otros protocolos14,16. Si bien la utilidad de los sistemas de organoides está creciendo, el sistema de diferenciación neuronal basado en una sola capa tiene sus ventajas para proporcionar a las células un entorno de diferenciación homogéneo. En los sistemas basados en organoides, debido a su naturaleza tridimensional, se puede formar una actividad similar a un centro de modelado local. Además, no todas las células de los organoides tienen el mismo acceso a los factores de crecimiento añadidos exógenamente, lo que conduce a un gradiente de morfógenos incontrolado, como lo demuestra la muerte celular en el centro de los organoides. Aunque se han propuesto varias mejoras en los métodos de organoides, existe la necesidad de validar los métodos de organoides por su capacidad para recapitular los fenotipos observados en muestras humanas. Como se ha mencionado, varios protocolos anteriores no lograron recapitular la neurogénesis alterada por el SD. Por lo tanto, se prefirió el método basado en una sola capa, lo que permitió condiciones de cultivo más controladas durante la neurodiferenciación. Los métodos de neurodiferenciación están en constante evolución. Mientras que algunos métodos proporcionan una neurodiferenciación más rápida22, otros proporcionan un tiempo de diferenciación fisiológicamente más relevante23. Además, los usuarios deben evaluar el uso de compuestos no fisiológicos, por ejemplo, DAPT, AMPc o ácido ascórbico, o la concentración no fisiológica de factores de crecimiento como GDNF y BDNF antes de utilizarlos para la neurodiferenciación. Los compuestos o factores de crecimiento añadidos exógenamente pueden enmascarar las propiedades intrínsecas de las células enfermas y evitar que se imiten las condiciones in vivo de una placa.
La tasa de éxito de la neurodiferenciación depende de la calidad de las iPSC antes de sembrar la diferenciación. Debe haber menos del 10% de colonias diferenciadas. Un paso crítico del procedimiento experimental es que las iPSC deben sembrarse a una densidad baja que oscile entre 5000 y 10.000 células/cm2, y para lograr la dorsalización de las células, se debe agregar dorsomorfina durante unos 16 días a una concentración baja de 0,125 μM. Se observa una muerte celular extensa a concentraciones más altas de dorsomorfina cuando se usa con células plateadas de baja densidad. Noggin también puede agregarse en lugar de Dorsomorphin para reducir la muerte celular, pero Dorsomorphin se usó para reducir el alto costo asociado con Noggin. La siembra de células a alta densidad reduce la diferenciación neuronal y también puede promover poblaciones neuronales de mesencéfalo y cerebro posterior24. Dado que las diferentes iPSC pueden variar en su tasa de proliferación, la densidad de recubrimiento inicial debe probarse para cada nueva línea de hiPSC. Además, si las células madre pluripotentes muestran una proliferación extensa, las células pueden dividirse alrededor del día 20. Este protocolo será útil para estudiar el efecto de los genes del cromosoma 21 en la neurogénesis del SD y se puede utilizar para el cribado de fármacos.
La principal limitación de este protocolo es una larga duración de hasta 85-90 días para diferenciarse en neuronas. Además, se observó que las líneas de tiempo para la fase temprana, la fase tardía y la etapa final pueden diferir durante la neurodiferenciación de líneas adicionales de hiPSCs, pero aún se pueden observar defectos del ciclo celular bifásico durante la neurodiferenciación del SD. Las diferencias observadas en diferentes iPSCs podrían deberse a diferencias inherentes en las hiPSCs debido a la naturaleza estocástica del proceso de reprogramación o debido a diferencias en los números de paso.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que revelar.
Agradecimientos
Los autores agradecen al Prof. Stuart H. Orkin por proporcionarnos un par de hiPSC con síndrome de Down y euploides isogénicas. Los autores también están agradecidos al Centro Nacional de Ciencia Celular (BRIC-NCCS), Pune, por proporcionar los fondos para llevar a cabo este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| MEF medium: | |||
| DMEM High Glucose | Gibco | 11965-092 | |
| FBS | VWR | 97068-085 | 10% final concentration |
| Non-Essential Amino Acids | Hyclone | SH30238.01 | 1X final concentration |
| Penicillin/Streptomycin | Hyclone | SV30010 | 1X final concentration |
| β-Mercaptoethanol | Gibco | 21985-023 | 1X final concentration |
| hiPSC medium: | |||
| Knockout DMEM/F12 | Gibco | 12660-012 | |
| Knockout Serum Replacement (KOSR) | Gibco | 10828-028 | 20% final concentration |
| Non-Essential Amino Acids | Hyclone | SH30238.01 | 1X final concentration |
| Glutamax | Gibco | 35050061 | 1X final concentration |
| Penicillin/Streptomycin | Hyclone | SV30010 | 1X final concentration |
| β-Mercaptoethanol (1000X) | Gibco | 21985-023 | 1X final concentration |
| DDM medium: | |||
| Knockout DMEM/F12 | Gibco | 12660-012 | |
| Non-Essential Amino Acids | Hyclone | SH30238.01 | 1X final concentration |
| Glutamax | Gibco | 35050061 | 1X final concentration |
| Penicillin/Streptomycin | Hyclone | SV30010 | 1X final concentration |
| Albumax (10%) | Invitrogen | 11020-021 | 0.5 X of 10% Albumax is final concentration |
| NPC medium: | |||
| DDM medium | |||
| N2 Supplement | Gibco | 17502048 | 1X final concentration |
| B-27 Supplement (50X), minus vitamin A | Gibco | 12587010 | 1X final concentration |
| Neural Differentiation medium (ND): | |||
| DDM medium | 1/2 of volume | ||
| Neurobasal Medium | Gibco | 21103-049 | 1/2 of volume |
| N2 Supplement | Gibco | 17502048 | 0.5 X final concentration |
| B-27 Supplement (50X) | Gibco | 17504044 | 0.5 X final concentration |
| Glutamax | Gibco | 35050061 | 1X of Neurobasal medium |
| Penicillin/Streptomycin | Hyclone | SV30010 | 1X of Neurobasal medium |
| Antibodies and reagents for immunostaining: | |||
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | 4% |
| DPBS, no calcium, no magnesium | Sigma-Aldrich | D5652 | |
| Triton-X-100 Solution | Sigma-Aldrich | X100-500ML | 0.20% |
| BSA | Hyclone | A7979-50ML | 1.00% |
| Purified anti-tubulin β-3 (TUBB3) (TUJ1) | BioLegend | 801202 | 1:500 dilution |
| Donkey anti-Mouse IgG (H+L) Secondary Antibody, Alexa fluor 594 conjugate | Life Tech Invitrogen | A21203 | 1:250 dilution |
| Purified Mouse-Anti-Human Ki67 | BD Pharmingen | 550609 | 1:100 dilution |
| Purified anti-PAX6 | BioLegends | 901302 | 1:100 dilution |
| Alexa fluor 488 Donkey (anti-rabbit) | Life Tech Invitrogen | A21206 | 1:250 dilution |
| DAPI Solution (5 mg/mL) | Sigma | D9542 | 1:1000 dilution |
| Others | |||
| Cell detachment solution (Accutase) | Gibco | A11105-01 | Ready to use working solution |
| Rock inhibitor (RI) | Sellechckem | Y27632 | 10 mM/ml final concentration |
| Dorsomorphin | Sellechckem | S7306 | 0.125 nM/ml final concentration |
| DPBS with calcium and magnisium (DPBS+ Ca, Mg) | Gibco | 14040133 | Ready to use working solution |
| DPBS without calcium and magnisium | Gibco | 14190136 | Ready to use working solution |
| Gelatin Type A | Sigma | G2500-100G | 0.10% |
| hESC-qualified basement membrane matrix (Matrigel GFR) | Corning | 356230 | 1 mg stock vial diluted 1:240 |
| Trypsin 0.05% | Gibco | 25300054 | |
| Trypan Blue | Gibco | 15250-061 | 0.40% |
| Basic Fibrablast Growth Factor (bFGF) | Peprotech | 100-18B | 25 ng/ml final concentration |
| Collagenase | Gibco | 17104-019 | 1mg/ml final concentration |
Referencias
- Chapman, R. S., Hesketh, L. J. Behavioral phenotype of individuals with Down syndrome. Ment Retard Dev Disabil Res Rev. 6 (2), 84-95 (2000).
- Haydar, T. F., Reeves, R. H. Trisomy 21 and early brain development. Trends Neurosci. 35 (2), 81-91 (2012).
- Wisniewski, K. E. Down syndrome children often have brain with maturation delay, retardation of growth, and cortical dysgenesis. Am J Med Genet Suppl. 7, 274-281 (1990).
- Guidi, S., et al. Neurogenesis impairment and increased cell death reduce total neuron number in the hippocampal region of fetuses with Down syndrome. Brain Pathol. 18 (2), 180-197 (2008).
- Lott, I. T. Neurological phenotypes for Down syndrome across the life span. Prog Brain Res. 197, 101-121 (2012).
- Stagni, F., Giacomini, A., Emili, M., Guidi, S., Bartesaghi, R. Neurogenesis impairment: An early developmental defect in Down syndrome. Free Radic Biol Med. 114, 15-32 (2018).
- Golden, J. A., Hyman, B. T. Development of the superior temporal neocortex is anomalous in trisomy 21. J Neuropathol Exp Neurol. 53 (5), 513-520 (1994).
- Gupta, M., Dhanasekaran, A. R., Gardiner, K. J. Mouse models of Down syndrome: Gene content and consequences. Mamm Genome. 27 (11-12), 538-555 (2016).
- Wu, Y., West, N. R., Bhattacharyya, A., Wiseman, F. K. Cell models for Down syndrome-Alzheimer's disease research. Neuronal Signal. 6 (1), NS20210054 (2022).
- Zhao, X., Bhattacharyya, A. Human models are needed for studying human neurodevelopmental disorders. Am J Hum Genet. 103 (6), 829-857 (2018).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Briggs, J. A., et al. Integration-free induced pluripotent stem cells model genetic and neural developmental features of Down syndrome etiology. Stem Cells. 31 (3), 467-478 (2013).
- Hibaoui, Y., et al. Modeling and rescuing neurodevelopmental defect of Down syndrome using induced pluripotent stem cells from monozygotic twins discordant for trisomy 21. EMBO Mol Med. 6 (2), 259-277 (2014).
- Shi, Y., et al. A human stem cell model of early Alzheimer's disease pathology in Down syndrome. Sci Transl Med. 4 (124), 124ra29 (2012).
- Weick, J. P., et al. Deficits in human trisomy 21 iPSCs and neurons. Proc Natl Acad Sci U S A. 110 (24), 9962-9967 (2013).
- Meharena, H. S., et al. Down syndrome-induced senescence disrupts the nuclear architecture of neural progenitors. Cell Stem Cell. 29 (1), 116-130.e7 (2022).
- Sharma, V., et al. Biphasic cell cycle defect causes impaired neurogenesis in Down syndrome. Front Genet. 13, 1007519 (2022).
- Maclean, G. A., et al. Altered hematopoiesis in trisomy 21 as revealed through in vitro differentiation of isogenic human pluripotent cells. Proc Natl Acad Sci USA. 109 (43), 17567-17572 (2012).
- Nehra, S., Sharma, V., Umrani, M., Singhal, N. Generation of integration-free Down syndrome and isogenic euploid human induced pluripotent stem cells. Stem Cell Res. 67, 103041 (2023).
- Yu, P. B., et al. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4 (1), 33-41 (2008).
- Shi, Y., Kirwan, P., Smith, J., Robinson, H. P., Livesey, F. J. Human cerebral cortex development from pluripotent stem cells to functional excitatory synapses. Nat Neurosci. 15 (3), 477-486 (2012).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Gaspard, N., et al. Generation of cortical neurons from mouse embryonic stem cells. Nat Protoc. 4 (10), 1454-1463 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados