Method Article
Cuantificación de leucocitos adherentes inducidos por diabetes en la vasculatura de la retina
En este artículo
Resumen
Demostramos un método para etiquetar las paredes de la vasculatura de la retina y los leucocitos adherentes. Estos leucocitos adherentes se pueden contar bajo un microscopio de fluorescencia como un parámetro de inflamación o la respuesta de esa inflamación a las terapias.
Resumen
La leucostasis se refiere a la unión de los leucocitos a la pared luminal de la vasculatura. Esta interacción de los leucocitos con la pared de los vasos sanguíneos es característica de la inflamación y se ha relacionado causalmente con la oclusión capilar en una variedad de tejidos y enfermedades, incluida la retinopatía diabética.
La leucotasia se ha reportado durante años como una complicación potencialmente mortal de la hiperleucocitosis y solo se puede diagnosticar clínicamente. Dada la importancia del fenómeno, se han realizado investigaciones intensivas para comprender los posibles mecanismos que conducen a su manifestación; Sin embargo, no existe una técnica estándar de oro en entornos de laboratorio para visualizar y cuantificar la gravedad del evento.
En el método que se resume a continuación, la vasculatura se perfunde inicialmente con un tampón para extraer sangre y, a continuación, la concanavalina A se perfunde en la vasculatura, donde se une a todas las paredes celulares expuestas y provoca una tinción especialmente brillante de los leucocitos. Si la perfusión para eliminar todas las células sanguíneas no unidas fue exitosa, los leucocitos marcados con fluorescencia restantes se unen a la vasculatura y se pueden cuantificar manualmente utilizando cualquier microscopio de fluorescencia disponible.
Introducción
Los leucocitos (glóbulos blancos, leucocitos) desempeñan un papel importante en la función óptima de la vasculatura, como el mantenimiento de la fluidez sanguínea y la regulación de la resolución del trombo1. También juegan un papel clave en algunas condiciones patológicas, como la adherencia a la pared luminal de la vasculatura durante períodos prolongados de tiempo que conducen a la obstrucción de los vasos, al menos temporalmente, un fenómeno conocido como leucotasia 2,3.
La retinopatía diabética es una de las complicaciones más comunes de la diabetes a largo plazo y una de las principales causas de discapacidad visual y ceguera en los Estados Unidos y en todo el mundo para las personas de 20 a 75años de edad. La degeneración lenta y progresiva de la vasculatura retiniana es un componente clínicamente significativo de las etapas tempranas de la enfermedad, que en algunos pacientes conduce a isquemia retiniana con la consiguiente neovascularización retiniana 5,6. La evidencia acumulada indica que la inflamación juega un papel importante en el desarrollo de la retinopatía7, y la leucotasia se considera una respuesta inflamatoria intravascular subclínica. La leucotasia ocurre en las primeras etapas de la diabetes, mucho antes de que se desarrollen las manifestaciones clínicas detectables 8,9,10. El taponamiento repetido de los vasos retinianos por parte de los leucocitos adheridos durante meses o años (leucotasia crónica) en la diabetes podría contribuir a la oclusión vascular y a la degeneración de los capilares 11,12,13. La gravedad de esta leucotasia es de importancia patológica y puede utilizarse para controlar la gravedad del proceso de la enfermedad o para evaluar la eficacia de una terapia en entornos de investigación.
Para profundizar en el estudio de los efectos específicos del microambiente hiperglucémico sobre la leucotasia, se han diseñado modelos in vitro. Las células endoteliales microvasculares aisladas de la retina pueden cultivarse y organizarse en modelos de cultivo 2 o 3D (microvasculatura en un chip14) para replicar el endotelio vascular (la monocapa celular que pavimenta la luz de los vasos). Sin embargo, la variación interexperimental de estos modelos limita su uso. El estudio de la leucotasia en la vasculatura de la retina humana in vivo es aún limitado y, por lo tanto, la mayor parte del conocimiento actual sobre la leuchatasia de la retina se deriva de modelos animales de retinopatía diabética13,15.
El objetivo de este reporte es describir un protocolo estándar basado en los métodos descritos en otros16 para la cuantificación de los leucocitos adheridos a la vasculatura retiniana como parámetro de la leucostasis. Este ensayo puede ser utilizado para estudiar otras enfermedades vasculares que también presentan leucostasis, como neoplasias malignas 3,17,18,19 y algunas afecciones infecciosas y alérgicas 20. Este protocolo puede ser implementado en cualquier laboratorio de investigación básica sin necesidad de equipos especializados. En el método resumido a continuación, la vasculatura se perfunde inicialmente con tampón para extraer la sangre y, a continuación, la concanavalina A se perfunde en la vasculatura, donde se une a todas las paredes celulares expuestas y provoca una tinción especialmente brillante de los leucocitos 21,22,23. Si la perfusión para eliminar todas las células sanguíneas no unidas tiene éxito, los leucocitos marcados con fluorescencia restantes que están unidos a la vasculatura se pueden cuantificar manualmente utilizando cualquier microscopio de fluorescencia que tenga a mano.
Protocolo
El protocolo ha sido revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de California en Irvine, y cumple con las regulaciones gubernamentales sobre el cuidado y uso de animales de laboratorio. No hay puntos de parada en este protocolo. El tiempo medio por ratón es de 30 min.
1. Preparación de la etapa de perfusión
- Calentar la bolsa de solución salina al 0,9% y la solución de concanavalina A en un baño de agua a 37 oC durante 20-30 min antes de usar.
NOTA: Proteja la concanavalina A de la exposición a la luz (cúbrala con papel de aluminio). - Coloque una bandeja para contener la sangre y los líquidos que gotean en la superficie donde se llevará a cabo el procedimiento. En la parte superior de la bandeja, coloque una almohadilla térmica cubierta con una almohadilla absorbente o cualquier material absorbente.
NOTA: El objetivo es evitar que el cuerpo del ratón pierda calor durante el procedimiento, ya que el enfriamiento dificulta la extracción de sangre durante la perfusión.
2. Configuración del infusor de presión
- Conecte en serie la bolsa de solución salina al 0,9%, el juego de catéteres intravenosos, una llave de paso de válvula de 4 vías y la aguja de sonda nasogástrica.
- Inserte la bolsa de solución salina al 0,9% entre la red y la cámara de aire del infusor de presión. Cuelgue la bolsa de solución salina en el gancho ubicado en la parte posterior de la cámara de aire. Utilice el lazo del polo intravenoso para colgar el infusor de presión en el polo intravenoso.
- Purgue las líneas y los puertos de todas las burbujas de aire dejando que el sistema se abra (funcione) durante un par de minutos y ajuste el caudal a 18-20 mL/min24. Para inflar la cámara de aire del infusor de presión, gire la manija de la llave de paso para que apunte hacia la ventilación de la llave de paso abierta, luego bombee la bombilla de inflado hasta que el manómetro indique la presión deseada. Vuelva a ajustar la presión antes de fusionar cada mouse. Para desinflar, gire la manija de la llave de paso hacia abajo, hacia la bombilla de inflado.
NOTA: Si la bolsa de solución salina al 0,9% es nueva, generalmente una presión de 150 mmHg proporciona el caudal deseado; Sin embargo, la presión debe ajustarse empíricamente debido a las variaciones en las marcas de infusores de presión y durante el período de uso de la bolsa de solución salina al 0,9%. - Conecte una jeringa de 10 ml llena de solución de concanavalina A calentada a la válvula de 4 vías.
NOTA: Proteja la jeringa de la exposición a la luz (cúbrala con papel de aluminio).
3. Anestesia
- Administrar anestesia mediante inyección intraperitoneal (I.P.) de ketamina:xilacina; La dosis más utilizada para la cirugía/procedimiento con ratones es de 100:10 mg/kg de peso corporal25. Evalúe la anestesia mediante el reflejo del pedal (pellizco firme del dedo del pie).
NOTA: Esta dosis proporciona un inicio de 4-6 min con una duración de 45-60 min de anestesia quirúrgica. El cóctel anestésico se puede almacenar a temperatura ambiente durante un máximo de 2 semanas.
4. Perfusión transcárdica y tinción con concanavalina A
- Coloque el ratón en la etapa de perfusión en posición supina para permitir la exposición de la cavidad torácica y abdominal.
- Identifique visualmente la apófisis xifoides y, con el hemostático en la mano dominante, sujete la piel con alfileres y fíjela. Una vez que el hemostático esté asegurado, transfiéralo a la mano no dominante y levante la piel.
- Utilice unas tijeras en la mano dominante y corte, en un ángulo de 90° con respecto a la columna vertebral, un parche de piel para revelar la pared abdominal externa.
- Con la apófisis xifoides y la caja torácica ahora visibles, diseccione a través de la pared abdominal bilateralmente, teniendo cuidado de evitar cortar cualquier órgano o vaso principal.
- Con el diafragma ahora visible, visualice el corazón, los ventrículos y los pulmones a través del diafragma. Con la punta de las tijeras, corte el diafragma en uno de los flancos, cerca de la columna vertebral, teniendo cuidado de evitar cortar cualquier órgano o vaso principal.
NOTA: Este "orificio" en el diafragma equilibrará la presión intratorácica negativa con la presión atmosférica, y se producirá un neumotórax colapsando los pulmones y retrayendo el corazón, facilitando la disección del diafragma sin dañar los pulmones ni el corazón. - Continúa diseccionando a través de las costillas y en paralelo a los pulmones para crear un "colgajo" en el pecho. Libera el hemostático y corta la apófisis xifoides en el plano sagital. Abra suavemente el proceso de xifoides manualmente. Observa las cuatro cámaras del corazón.
- Con la mano no dominante y usando fórceps, agarre el corazón cerca de su ápice. Con la mano dominante, sostenga la aguja de sonda nasogástrica (conectada al catéter intravenoso) y perfore el vértice del corazón. Para evitar la perforación completa del ventrículo izquierdo o el alcance de la vasculatura pulmonar y luego una mala perfusión de la vasculatura sistémica, verifique la colocación del extremo de la punta esférica de la aguja de sonda nasogástrica, que debe estar en el borde del sitio de punción que sobresalga ligeramente del corazón. Sujete la aguja de sonda nasogástrica en su lugar con pinzas antimosquitos curvas o simplemente sujétela con la mano mientras manipula la llave de paso intravenosa.
- Abra la llave de paso a la solución salina al 0,9% y casi simultáneamente, abra el ventrículo derecho con unas tijeras; perfundir durante 2-3 min. Durante el tiempo de perfusión, mueva suavemente la aguja de un lado a otro y de arriba a abajo para reducir la torcedura de la vasculatura y aumentar la salida de sangre del corazón.
- Después de perfundir con solución salina, gire la manija de la llave de paso para cortar el flujo de la solución salina y permitir el flujo de la jeringa a la aguja de sonda nasogástrica. Perfundir a mano con la solución de concanavalina A a una velocidad de estado estacionario. Asegúrese de que los 10 ml de solución de concanavalina A se dispensen en 30-35 s.
- Después de la perfusión con concanavalina A, gire la válvula para cerrar el flujo de la jeringa y permitir el flujo desde la solución salina al 0,9% hasta la aguja de sonda nasogástrica nuevamente. Perfundir con la solución salina al 0,9% durante 2-3 minutos más. Retire la aguja de sonda nasogástrica del corazón.
NOTA: La concanavalina A sugerida en este protocolo se conjuga con fluoresceína (verde); sin embargo, también está disponible la concanavalina A unida a otros fluorocromos.
5. Enucleación y aislamiento de retina fresca
- Gire el ratón de lado y, con la mano no dominante, coloque el dedo índice y el pulgar en los párpados superior e inferior, respectivamente. Retraiga suavemente los párpados y la piel con los dedos y sostenga el ojo, haciendo que sobresalga parcialmente de la cuenca.
- Mientras el ojo está apoyado, use tijeras curvas en la mano dominante y coloque debajo del ojo en un ángulo de 45°. Corta la inserción muscular y el nervio óptico. Usando las mismas tijeras que una espátula, transfiera el ojo a un recipiente pequeño o directamente a la etapa del microscopio de disección.
NOTA: Tenga cuidado de no cortar la parte posterior del ojo y evite jalar el ojo durante este paso. - Coloque el ojo sobre una cera dental para abrir el globo. Bajo el microscopio de disección y con la mano no dominante, sostenga el pliegue escleral o los restos musculares aún unidos externamente al ojo posterior con micropinzas, y oriente el ojo de modo que la córnea mire hacia un lado.
NOTA: Para evitar que el ojo se mueva o deslice al abrir el globo, se puede colocar un trozo de pañuelo húmedo sin pelusa encima de la cera dental. - Con una de las esquinas afiladas de una hoja de afeitar recubierta de teflón, haga una incisión de 1 a 2 mm detrás y paralela al limbo (unión córnea-esclerótica). Sostenga el pliegue escleral o el músculo con las micropinzas y pase la hoja por el limbo con una fuerza mínima hacia abajo. Continúe cortando con la navaja para separar totalmente el segmento anterior (córnea, iris, cristalino y vítreo) del segmento posterior (copa del ojo).
NOTA: No corte de un lado a otro. - Transfiera el ocular dividido en dos a una placa de Petri pequeña con PBS.
NOTA: Evite el contacto de la retina con el papel de seda (nota en el paso 5.3) ya que se adherirá firmemente al papel y será prácticamente imposible de recuperar. - Agarre un pliegue escleral o el músculo restante en la parte exterior de la esclerótica con micropinzas. Separe completamente la retina de la esclerótica rompiendo todas las conexiones en el limbo alrededor del perímetro de la copa del ojo con una microespátula. Saque la retina de la esclerótica con la microespátula. Si la retina todavía está unida a la esclerótica por el nervio óptico, deslice las microtijeras entre la retina y la esclerótica para cortar el nervio óptico.
- Eliminar cualquier resto de músculo vítreo y ciliar en la periferia de la retina. Transfiera inmediatamente la retina aislada a un portaobjetos con algo de PBS.
NOTA: Se puede utilizar cualquier otra técnica de aislamiento de retina dependiendo de la preferencia del investigador.
6. Montaje plano de la retina
- Coloque la retina no fijada en un portaobjetos con una pequeña cantidad de PBS. Con la microespátula, oriente suavemente la retina con el lado vítreo hacia arriba. Si la retina está doblada hacia adentro, use micropinzas para sostener los bordes de la retina mientras la retina se despliega con la microespátula.
- Haga 4-5 cortes radiales en la retina para que quede plana (patrón de trébol).
- Con un pañuelo sin pelusa, seque el exceso de PBS lejos de la retina.
NOTA: No toque la retina con el tejido; de lo contrario, la muestra se perderá. El deslizamiento es deseable para mantener la retina plana.
7. Microscopía
NOTA: Para este paso se puede utilizar cualquier microscopio de fluorescencia con un canal GFP/FITC (480/530 nm). Para este trabajo se utilizó el microscopio referenciado de 488 canales y el software asociado para la adquisición de imágenes.
- Observe la retina recientemente montada plana bajo el microscopio con un aumento de 100x (objetivo de 10x) y cuente los leucocitos marcados con fluorescencia (manualmente) escaneando metódicamente todo el tejido (de derecha a izquierda o de arriba a abajo).
NOTA: Los leucocitos son puntos fluorescentes individuales que pueden mostrar una forma redonda u ovalada. Tienen un diámetro de 12-15 μm y no sobresalen de los capilares de la retina (la estructura está completamente constreñida por la luz del vaso). - Adquiera imágenes representativas con la ampliación deseada y realice el posprocesamiento de las imágenes con el software de su elección (por ejemplo, ImageJ [Fiji]).
- Expresa el recuento como leucocitos por retina. Grafica los datos por media ± desviación estándar.
Resultados
Un protocolo de perfusión y tinción bien ejecutado mostrará la vasculatura retiniana completa delineada con concanavalina A (Figura 1). Una mala perfusión del ratón impide el marcaje de todo el árbol vascular y el posterior análisis de los leucocitos adheridos a la luz (Figura 2), mientras que la presión excesiva de un apretón rápido de una jeringa (menos de 30-35 s) puede provocar permeabilidad vascular y rotura de los vasos sanguíneos (Figura 3). La concanavalina A extravasada puede causar un etiquetado incorrecto de las estructuras externas, lo que lleva a una cuantificación confusa de los leucocitos adherentes.
La evaluación de la vasculatura retiniana y la cuantificación de los leucocitos adheridos mediante microscopía de fluorescencia deben realizarse inmediatamente después del montaje de la retina (Figura 4). Hay que tener cuidado al ver la retina con un gran aumento porque las curvas de los capilares pueden parecer leucocitos marcados adheridos a la vasculatura (Figura 4B, círculo discontinuo). Enfocar el microscopio hacia arriba y hacia abajo mientras se observa el área en cuestión generalmente permitirá diferenciar la leucostasis de un vaso que se sumerge en la retina. El usuario puede cambiar/elegir el fluoróforo conjugado con concanavalina A que coincida con el cubo de fluorescencia disponible en el microscopio que se va a utilizar. La leucastasis en la retinopatía diabética no es un evento dramático y el investigador debe evaluar todo el árbol vascular escaneando toda la retina en busca de leucocitos adherentes. Por lo general, hay de 1 a 3 leucocitos por retina de animales no diabéticos y de 3 a 12 leucocitos por retina de animales diabéticos, por lo que el tamaño mínimo de la muestra para alcanzar una diferencia estadísticamente significativa es de 10 a 12 animales por grupo (Figura 4A, B y Figura 5). Dado este fenotipo, es poco común encontrar 2 o más leucocitos en las proximidades (Figura 4B,C). No ocurre lo mismo con los modelos agudos de inflamación, como en el desafío con lipopolisacáridos (LPS), donde se observa un fenómeno de leucastasis robusto (Figura 4C y Figura 5). Para obtener un protocolo detallado del modelo de desafío LPS, consulte 26.

Figura 1: Imagen representativa de una vasculatura retiniana bien perfundida y teñida. Imagen de campo amplio de la vasculatura de la retina de un ratón C57Bl/6J sano (4 meses de edad) después de la infusión de concanavalina A-FITC. La concanavalina A-FITC tiñe la red vascular total de la retina de manera uniforme si se logra una perfusión óptima. Después de ajustar el brillo y el contraste, la imagen se convirtió a RGB. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imagen representativa de mala perfusión y tinción de la vasculatura retiniana. Una mala perfusión del animal puede conducir a un acceso limitado de la concanavalina A a los vasos de la retina, lo que resulta en una tinción deficiente de la red vascular de la retina. Áreas extensas de la retina mostrarán falta de tinción (rectángulo discontinuo), lo que limita la visualización de los leucocitos adheridos a esa vasculatura. Los vasos que recibieron concanavalina A pueden mostrar leucocitos adheridos (flechas), pero no representan el recuento total de la retina. Cuando esto ocurre, la muestra debe desecharse. Una declaración deficiente también puede conducir a una puntuación artificiosa (círculos discontinuos) debido a la microscopía de baja calidad (canal forzado para detectar alguna señal fluorescente). Después de ajustar el brillo y el contraste, la imagen se convirtió a RGB. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imagen representativa que muestra el estallido de los capilares retinianos. La presión excesiva de un apretón rápido de una jeringa de carga A de concanavalina (menos de 30-35 s) puede causar permeabilidad vascular inducida experimentalmente y estallido de los vasos sanguíneos (círculos discontinuos), lo que lleva al marcaje de estructuras externas u otros artefactos (cuadrados discontinuos). Después de ajustar el brillo y el contraste, la imagen se convirtió a RGB. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
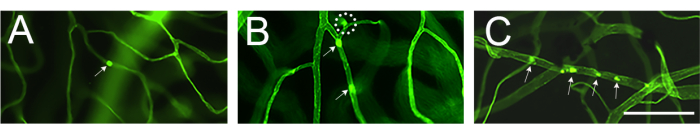
Figura 4: Ejemplos de flexión capilar y leucotasia en ratones no diabéticos, diabéticos y desafiados con LPS. Ejemplos de leucasis retiniana en ratón C57Bl/6J (4 meses de edad) después de la infusión de concanavalina A-FITC. (A) Los ratones no diabéticos no muestran leucostasis, pero no es raro encontrar de 1 a 3 leucocitos adheridos a la vasculatura de la retina después de escanear toda la retina (flecha). (B) Los leucocitos adheridos a la vasculatura de la retina en ratones diabéticos (modelo de inflamación subclínica) pueden oscilar entre 3 y 12 y es poco común encontrar leucocitos adheridos muy cerca (flechas). La estructura encerrada con el círculo discontinuo es un ejemplo de un capilar doblado que se sumerge en la retina. (C) Se puede desafiar a ratones con LPS (modelo de inflamación aguda) con cada experimento como control positivo de la leucostasis. En este modelo, es común encontrar varios leucocitos adheridos a la vasculatura muy cerca (flechas). Después de ajustar el brillo y el contraste, la imagen se convirtió a RGB. Barra de escala = 100 μm. Abreviatura: LPS = lipopolisacárido. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Gráfico representativo para reportar resultados. El recuento de leucocitos se expresa por retina y los datos se grafican mediante la media y la desviación estándar. Abreviaturas: N = no diabético; D = diabético; LPS = lipopolisacárido. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La leucotasia en humanos se refiere a los síntomas y hallazgos clínicos asociados con la hiperleucocitosis (recuento total de leucocitos (leucocitos) >100.000/μL) y es una emergencia médica20. Los mecanismos que conducen a la leucotasia están bajo una investigación intensiva. Hasta la fecha, el estudio de la leucotasia en humanos in vivo aún no es posible y los investigadores deben basarse en modelos animales para comprender este proceso. Diferentes enfermedades presentan leucastasis y tener un protocolo detallado para visualizar el fenómeno ex vivo puede ser útil para los investigadores en el laboratorio. El protocolo presentado en este informe ha sido optimizado para el estudio de la vasculatura retiniana; Sin embargo, puede ser optimizado empíricamente para el estudio de otros lechos vasculares adecuados como la vasculatura en el músculo Cremaster27.
Cuando se realiza correctamente, esta técnica permite la perfusión y el marcaje de todo el árbol vascular de la retina y el marcaje y cuantificación de los leucocitos adheridos a la pared vascular. La retina es particularmente adecuada para este método porque su vasculatura está restringida a planos definidos en el tejido (a diferencia de la mayoría de los tejidos donde la vasculatura es menos ordenada). Este método proporciona un buen contraste con el tejido no teñido cuando se utiliza tejido transparente (retina) o muy fino (como el músculo cremaster27). Los tejidos gruesos o los tejidos con abundantes nervios mielinizados u otras células opacas y pigmentadas son sitios deficientes para la evaluación con este método.
Un requisito crítico en el procedimiento es una buena perfusión de la vasculatura. La perfusión mientras el corazón aún está bombeando facilita una buena perfusión y marcaje de la microvasculatura. La mala perfusión vascular a menudo se debe al uso de líquidos fríos que conducen a la vasoconstricción o torcedura de la vasculatura debido al peso y la ubicación de la aguja de perfusión o las pinzas. Al perfundir, es importante prestar mucha atención a los diferentes órganos durante el procedimiento, ya que pueden proporcionar algunas pistas sobre la eficiencia de la perfusión. Por ejemplo, si la aguja se inserta en la vena pulmonar, los pulmones se llenarán y cambiarán de color (blanqueamiento) inmediatamente cuando se inicie el flujo, lo que sugiere que la perfusión no será óptima debido al secuestro de todos los líquidos en el árbol pulmonar. Se observa blanqueamiento en la lengua, los riñones y el hígado durante la perfusión, lo que podría sugerir un procedimiento óptimo; Sin embargo, estos órganos se encuentran aguas abajo de los vasos sanguíneos que irrigan los ojos y, por lo tanto, el blanqueamiento de los órganos garantiza una buena perfusión al cuerpo pero no siempre a la retina.
Otros problemas potenciales que se han identificado que impactan en la perfusión son: i) burbujas de aire atrapadas en la línea de perfusión que ingresan a los microvasos e impiden la perfusión con el tinte fluorescente; ii) si la aguja sonda nasogástrica insertada en el corazón se extiende demasiado en el arco aórtico, es posible bloquear la arteria carótida derecha, evitando así el flujo de tinte hacia la retina derecha; y iii) si la perfusión es demasiado fuerte, el aumento resultante de la presión intravascular puede conducir a una permeabilidad vascular inducida experimentalmente y puede hacer que algunos leucocitos queden atrapados artefactosamente en la microvasculatura. La permeabilidad vascular inducida experimentalmente se visualiza bajo el microscopio como un estallido localizado de concanavalina A extravasada en el tejido circundante del vaso, mientras que la permeabilidad vascular patológica presenta un patrón difuso sutil. En el primer escenario, el marcaje de estructuras externas u otros artefactos podría resultar confuso en la cuantificación de los leucocitos adherentes. En esta circunstancia, el observador debe basarse en los indicadores objetivos que definen histológicamente a un leucocito: forma, tamaño y localización (dentro de la luz de un vaso).
Las condiciones patológicas que presentan capilares acelulares (degenerados) como la retinopatía diabética no excluyen el uso de esta técnica. Los capilares en etapas tempranas de degeneración, aquellos que han perdido el endotelio pero las células murales están intactas, siguen siendo permeables, mientras que los capilares en etapa tardía de degeneración, aunque ya no son permeables, permanecen en su sitio original (degeneración focalizada) y se observan cambios no apreciables en los vasos vecinos 28. Ambas circunstancias permiten el marcaje de la vasculatura circundante y la evaluación de la leucostasis.
Un paso crucial en el aislamiento de la retina es la enucleación del ojo sin cortar la parte posterior del ojo. Como el nervio óptico contiene los vasos sanguíneos entrantes y salientes que vascularizan las capas de la retina y las neuronas, cortar el nervio óptico demasiado cerca de su entrada al globo ocular casi garantiza que el árbol vascular de la retina colapsará, lo que lleva a una visión subóptima de la vasculatura y al posterior análisis del fenómeno de la leucostasis. Se debe prestar especial atención a las hojas de afeitar utilizadas para la extirpación del segmento anterior del ojo; Deben cambiarse con frecuencia (idealmente una hoja de afeitar por 1-2 ojos) porque las hojas desafiladas cortan mal y pueden provocar tirones y tirones del ojo y la retina, lo que a su vez dañará la vasculatura. Al extirpar el segmento anterior del ojo, se sugiere rotar el ojo mientras se corta el limbo y se retira el cristalino. La extirpación inicial del segmento anterior del ojo es más fácil cuando se realiza sobre papel húmedo sin pelusa; Sin embargo, el papel debe retirarse inmediatamente después de la extracción del segmento anterior, o la retina recién aislada podría adherirse al papel y no se puede recuperar.
Reconocemos que este protocolo tiene varias limitaciones. En primer lugar, la perfusión inicial puede eliminar los leucocitos que están débilmente adheridos a la vasculatura, lo que lleva al investigador a informar de una ausencia de leucastasis cuando en realidad puede no ser el caso. La inclusión de un control positivo de la leucostasis, como un modelo agudo de inflamación26, podría ayudar a determinar que la perfusión no fue demasiado dura, al demostrar la presencia de leucastas. Y en segundo lugar, será difícil para un observador no entrenado determinar si la estructura fuertemente fluorescente es de hecho la célula de interés y no un artefacto. Para superar este problema, el investigador debe familiarizarse con la forma (generalmente redonda u ovalada en la unión inicial a la vasculatura) y el tamaño (12-15 μm) de los leucocitos29. En caso de duda de que la estructura observada sea o no un leucocito, es recomendable no incluirla en la cuantificación, pero el investigador debe tomar la decisión final una vez que se familiarice con el ensayo. Idealmente, la cuantificación automática utilizando un software específico podría facilitar la cuantificación manual de los leucocitos adheridos a la vasculatura, sin embargo, hasta ahora, la distinción entre leucocitos y artefactos solo se puede hacer con el conocimiento y la experiencia del investigador. El desarrollo u optimización de las plataformas actuales para cuantificar la leucocitosis de forma automática o semiautomática es una opción que debe explorarse.
En conclusión, este protocolo validado para la evaluación de la leucotasia podría ser una herramienta útil para los investigadores que realizan estudios sobre la retinopatía diabética y otras enfermedades vasculares oculares y no oculares y para probar nuevas intervenciones terapéuticas.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo contó con el apoyo de las subvenciones de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) R01EY022938, R01EY022938-S1 y K99EY034928. Los autores reconocen los servicios de los núcleos del Centro de Investigación de Ciencias Visuales de CWRU (P30EY11373) y UCI (P30EY034070), así como el apoyo departamental de una subvención sin restricciones de Investigación para Prevenir la Ceguera del Instituto Oftalmológico Gavin Herbert de la Universidad de California en Irvine.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 4-way stopcock Luer lock I.V. line valve | Baxter | 2C6204 | |
| Concanavalin A solution | Vector | FL-1001 | Prepare in PBS 1 mg/mL |
| Dissecting tools set | Includes hemostats, scissors and forceps | ||
| FIJI | Software for image processing | ||
| Fluorescence microscope | Nikon | Eclipse Ni | |
| Forceps, Dumont #5, Biological grade tip | Electron Microscopy Sciences (EMS) | 72700-D | |
| Gavage Needle 1.25 mm OD barrel tip x 30 mm | Fine Science | 18060-20 | |
| Halstead Mosquito Forceps | Fisher Scientific | 13-812-10 | |
| I.V. Catheter set with regulating clamp 70 inches | Baxter | 2C5417s | |
| I.V. Pole | |||
| Lint free tissue | Kimpwipes is an option | ||
| Micro dissecting spring scissors, Vannas, 3 mm straight | ROBOZ | RS-5620 | |
| Micro spatula | Fine Science Tools (FST) | 10091-12 | |
| Nikon | NIS-Elements (AR 5.30.03 64-bit) | Software for image acquisition | |
| Petri dish (100 mmx15 mm) | Corning | 351029 | |
| Phosphate buffered saline (PBS) | |||
| Pink dental wax | Electron Microscopy Sciences (EMS) | 72670 | |
| Pressure infuser | Infusurge | 4010 | |
| Razor blades, GEM single edge stainless steel, Teflon coated | Electron Microscopy Sciences (EMS) | 71970 | |
| Saline 0.9%, veterinary grade, 1000 mL | Baxter | 04925-04-10 | |
| Small dissecting scissors, curved blunt end 22 mm | ROBOZ | RS 5983 |
Referencias
- Swystun, L. L., Liaw, P. C. The role of leukocytes in thrombosis. Blood. 128 (6), 753-762 (2016).
- Barouch, F. C., et al. Integrin-mediated neutrophil adhesion and retinal leukostasis in diabetes. Invest Ophthalmol Vis Sci. 41 (5), 1153-1158 (2000).
- Macaron, W., Sargsyan, Z., Short, N. J. Hyperleukocytosis and leukostasis in acute and chronic leukemias. Leuk Lymphoma. 63 (8), 1780-1791 (2022).
- Kempen, J. H., et al. The prevalence of diabetic retinopathy among adults in the United States. Arch Ophthalmol. 122 (4), 552-563 (2004).
- Kohner, E. M. Diabetic retinopathy. Br Med Bull. 45 (1), 148-173 (1989).
- Aouiss, A., Anka Idrissi, D., Kabine, M., Zaid, Y. Update of inflammatory proliferative retinopathy: Ischemia, hypoxia and angiogenesis. Curr Res Transl Med. 67 (2), 62-71 (2019).
- Tsalamandris, S., et al. The role of inflammation in diabetes: Current concepts and future perspectives. Eur Cardiol. 14 (1), 50-59 (2019).
- Adamis, A. P. Is diabetic retinopathy an inflammatory disease. Br J Ophthalmol. 86 (4), 363-365 (2002).
- Joussen, A. M., et al. A central role for inflammation in the pathogenesis of diabetic retinopathy. FASEB J. 18 (12), 1450-1452 (2004).
- Serra, A. M., et al. CD11b+ bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation. Am J Pathol. 181 (2), 719-727 (2012).
- Kinukawa, Y., Shimura, M., Tamai, M. Quantifying leukocyte dynamics and plugging in retinal microcirculation of streptozotosin-induced diabetic rats. Curr Eye Res. 18 (1), 49-55 (1999).
- Linsenmeier, R. A., et al. Retinal hypoxia in long-term diabetic cats. Invest Ophthalmol Vis Sci. 39 (9), 1647-1657 (1998).
- Herdade, A. S., et al. Effects of diabetes on microcirculation and leukostasis in retinal and non-ocular tissues: Implications for diabetic retinopathy. Biomolecules. 10 (11), 1583 (2020).
- Oakley, J., et al. Incorporating hemoglobin levels to map leukostasis risk in acute leukemia using microvasculature-on-chip technologies. Blood. 136 (Suppl 1), 9-10 (2020).
- Miyamoto, K., et al. Prevention of leukostasis and vascular leakage in streptozotocin-induced diabetic retinopathy via intercellular adhesion molecule-1 inhibition. Proc Natl Acad Sci U S A. 96 (19), 10836-10841 (1999).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Lester, T. J., Johnson, J. W., Cuttner, J. Pulmonary leukostasis as the single worst prognostic factor in patients with acute myelocytic leukemia and hyperleukocytosis. Am J Med. 79 (1), 43-48 (1985).
- Porcu, P., et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma. 39 (1-2), 1-18 (2000).
- Giammarco, S., et al. Hyperleukocytosis and leukostasis: management of a medical emergency. Expert Rev Hematol. 10 (2), 147-154 (2017).
- Mank, V., Azhar, W., Brown, K. Leukocytosis. StatPearls. , (2024).
- Bernhard, W., Avrameas, S. Ultrastructural visualization of cellular carbohydrate components by means of concanavalin A. Exp Cell Res. 64 (1), 232-236 (1971).
- Oliver, J. M., Zurier, R. B., Berlin, R. D. Concanavalin a cap formation on polymorphonuclear leukocytes of normal and beige (chediak-higashi) mice. Nature. 253 (5491), 471-473 (1975).
- Pink, J. R., Hoessli, D., Tartakoff, A., Hooghe, R. Characterisation of Concanavalin A-binding glycoproteins from mouse splenic leukocytes by two-dimensional electrophoresis: preferential binding of incompletely glycosylated forms of H-2 antigen to the lectin. Mol Immunol. 20 (4), 491-497 (1983).
- Janssen, B., Debets, J., Leenders, P., Smits, J. Chronic measurement of cardiac output in conscious mice. Am J Physiol Regul Integr Comp Physiol. 282 (3), R928-R935 (2002).
- Flecknell, P. A., Flecknell, P. A. Anaesthesia of common laboratory species: Special considerations. Laboratory Animal Anaesthesia. , 181-241 (2009).
- Seemann, S., Zohles, F., Lupp, A. Comprehensive comparison of three different animal models for systemic inflammation. J Biomed Sci. 24 (1), 60 (2017).
- Lessieur, E. M., et al. ICAM-1 on the luminal surface of endothelial cells is induced to a greater extent in mouse retina than in other tissues in diabetes. Diabetologia. 65 (10), 1734-1744 (2022).
- Kuwabara, T., Cogan, D. G. Studies of retinal vascular patterns: I. Normal architecture. Arch Ophthalmol. 64, 904-911 (1960).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls. , (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados