Method Article
Técnica para el aislamiento y cultivo de células madre mesenquimales de médula ósea de mandíbula de rata
En este artículo
Resumen
Las células madre mesenquimales de la médula ósea de la mandíbula tienen funciones significativas en la diferenciación diversa, la autorrenovación y la modulación inmunitaria. Se han convertido en un reservorio crucial de células precursoras en terapia génica, ingeniería de tejidos y medicina regenerativa. Aquí, presentamos un método único para aislar células madre mesenquimales de médula ósea de la mandíbula en ratas.
Resumen
Las células madre mesenquimales de la médula ósea (BMMSC) son un tipo de célula madre con potencial de diferenciación multidireccional. En comparación con las BMMSC derivadas de los huesos apendiculares, las BMMSC derivadas de la mandíbula tienen una mayor capacidad de diferenciación proliferativa y osteogénica, convirtiéndose gradualmente en células semilla importantes para la reparación de defectos de la mandíbula. Sin embargo, la mandíbula tiene una estructura ósea compleja y menos esponjoso que los huesos apendiculares. Es difícil adquirir un gran número de células madre mesenquimales de médula ósea derivadas de la mandíbula de alta calidad utilizando métodos tradicionales. Este estudio presenta un "enfoque basado en nichos sobre la madre" para aislar y cultivar células madre mesenquimales de médula ósea (JBMMSC) de mandíbula de rata. Las JBMMSC primarias de rata se aislaron y cultivaron utilizando el método de adherencia de médula ósea completa combinado con el método de digestión de cortes de hueso. Las células aisladas se identificaron como JBMMSC mediante la observación de la morfología celular, la detección de marcadores de superficie celular y la inducción de diferenciación multidireccional. Las células extraídas por este método exhiben una forma de huso "similar a un fibroblasto". Las células son largas, fusiformes y parecidas a fibroblastos. El análisis de citometría de flujo muestra que estas células son positivas para CD29, CD44 y CD90, pero negativas para CD11b/c, CD34 y CD45, lo cual es congruente con las características de las BMMSC. Las células muestran una fuerte capacidad de proliferación y pueden experimentar diferenciación osteogénica, adipogénica y condrogénica. Este estudio proporciona un método eficaz y estable para obtener suficientes JBMMSC de alta calidad con una fuerte capacidad de diferenciación en poco tiempo, lo que podría facilitar estudios adicionales de la exploración de la función biológica, la medicina regenerativa y las aplicaciones clínicas relacionadas.
Introducción
Las células madre mesenquimales (MSC) se descubrieron por primera vez en la médula ósea, que mostraron la capacidad de formar colonias adhesivas en cultivo y un fuerte potencial osteogénico1. Pittinger et al.2 descubrieron además su potencial de diferenciación multidireccional hacia el hueso, la grasa y el cartílago. Aunque todas las células madre mesenquimales de diferentes fuentes tienen el potencial de diferenciación multidireccional, las células madre mesenquimales de la médula ósea tienen el mayor potencial de diferenciación condrogénica en comparación con las células madre mesenquimales derivadas de otros tejidos, lo que las convierte en las mejores células candidatas parala ingeniería de tejidos óseos.. Sin embargo, muchos estudios han demostrado que las BMMSCs de diferentes orígenes presentan características y propiedades específicas del sitio, como la capacidad de diferenciación osteogénica y la actividad proliferativa celular 4,5. Esto puede deberse a diferentes capas germinales entre la mandíbula y los huesos apendiculares o la cresta ilíaca6.
Las células madre mesenquimales de la médula ósea de la mandíbula (JBMMSC) surgen de las células de la cresta neural del neuroectodermo, mientras que las BMMSC derivadas del fémur se originan en elmesodermo 7. En comparación con las BMMSC derivadas de los huesos largos y la cresta ilíaca, las JBMMSC tienen una mayor tasa de proliferación, actividad ALP y potencial osteogénico8. Además, el efecto de la aplicación de las BMMSCs en tejidos y órganos puede variar dependiendo de los diferentes tipos de células y entornos9. La reparación de los defectos de la mandíbula depende principalmente del reclutamiento de células madre mesenquimales derivadas de la mandíbula. Por lo tanto, el estudio de las JBMMSC puede proporcionar una base experimental para su aplicación clínica en la ingeniería de tejidos óseos mandibulares10. Sin embargo, la investigación básica y las aplicaciones clínicas se centran principalmente en las BMMSC derivadas de huesos apendiculares y axiales11. La investigación sobre las JBMMSCs es limitada, y esto puede deberse al bajo contenido de hueso esponjoso en la mandíbula y al hecho de que las mandíbulas de las ratas tienen aún menos contenido de hueso esponjoso12. Por lo tanto, es difícil separar las células madre mesenquimales de la médula ósea de la mandíbula utilizando el método ordinario de lavado de la médula ósea, que se usa comúnmente para aislar las BMMSC de los huesos apendicular o de la cresta ilíaca13. Basándonos en los métodos de Hong et al.14 y Cheng et al.15, planteamos la hipótesis de que la combinación de la digestión ósea densa y el método de lavado de la médula ósea podría aislar eficientemente las JBMMSC de rata.
Este estudio tiene como objetivo establecer un método eficiente para aislar las JBMMSC de rata y proporcionar suficientes fuentes de células semilla para la ingeniería de tejidos óseos de la mandíbula.
Protocolo
El protocolo fue aprobado por el Comité Institucional de Ética Animal del Hospital General del PLA de China. Para el experimento se utilizaron ratas Wistar macho de trece semanas de edad. Los detalles sobre los animales, los reactivos y el equipo se enumeran en la Tabla de Materiales.
1. Preparación experimental
- Esterilice todos los instrumentos quirúrgicos, incluidas las tijeras oftálmicas, las pinzas y los espigones óseos, a alta temperatura y presión.
- Prepare los medios de cultivo con anticipación.
- Prepare α medio completo de MEM que contenga 10% de suero fetal bovino (FBS) y 1% de penicilina-estreptomicina.
- Prepare colagenasa tipo II al 0,1% en solución salina tamponada con fosfato (PBS).
- Prepare 50 mL de PBS con penicilina-estreptomicina al 1% en un tubo centrífugo estéril desechable de 50 mL.
2. Aislamiento y cultivo de JBMMSC de ratas
- Aísla la mandíbula de la rata siguiendo los siguientes pasos:
NOTA: Para mantener la esterilidad de la muestra, todos los instrumentos quirúrgicos metálicos deben desinfectarse a alta temperatura sobre la llama de una lámpara de alcohol durante al menos tres segundos antes de su uso.- Anestesiar a la rata con pentobarbital sódico al 2% (2 mL/kg) mediante inyección intraperitoneal.
- Sacrificar la rata anestesiada por dislocación de vértebras cervicales (siguiendo protocolos aprobados institucionalmente) después de que su frecuencia respiratoria disminuya y los músculos se relajen por completo.
- Sumerja la rata en etanol al 75% durante 30 minutos para desinfectarla y luego transfiérala a la mesa ultra limpia.
- Coloque la rata sobre un paño estéril desechable o en un recipiente estéril y manténgala en posición supina.
- Cortar y separar la piel y el músculo del ángulo de oris a la articulación a lo largo de la rama, y luego separar el cóndilo de la fosa glenoidea cortando el disco de la articulación temporomandibular y los ligamentos periféricos bilaterales horizontalmente con tijeras oftálmicas.
NOTA: Determine la posición de la articulación temporomandibular moviendo la mandíbula y observando la posición del cóndilo externamente. - Cortar y separar los músculos y los tejidos conectivos de la mandíbula lateral con unas tijeras desde el surco vestibular en el lado bucal de los incisivos inferiores hacia los lados izquierdo y derecho.
- Incisión en los músculos linguales de la mandíbula desde el frenillo lingual hasta la región posterior de la mandíbula.
- Retire la mandíbula del cráneo.
- Divida la mandíbula en mitades cortando la sínfisis entre los incisivos inferiores con unas tijeras oftálmicas.
- Retire los músculos adheridos, la fascia y otros tejidos blandos restantes de la mandíbula con cuidado con tijeras y pinzas oftálmicas.
- Aísle los JBMMSC.
- Coloque el pico del rongeur en la unión de los incisivos y la parte mesial del primer molar, corte la conexión entre los incisivos inferiores y la mandíbula con el rongeur, y extraiga los incisivos inferiores por completo.
- Retire todos los molares con un rongeur de hueso.
- Extraer la rama mandibular con un rongeur óseo y exponer la cavidad medular separando la parte central de la mandíbula a lo largo del borde distal del último molar16.
- Aspire el medio completo α-MEM con una jeringa estéril desechable de 1 mL. Inserte la aguja en la cavidad de la médula ósea y enjuague la médula ósea repetidamente en la placa de cultivo con medio completo α-MEM hasta que el hueso se vuelva blanco.
- Recoja la solución de lavado de médula ósea en un tubo de centrífuga de 15 ml y centrifugue a 800 x g durante 3 minutos a temperatura ambiente.
- Deseche el sobrenadante con una pipeta, vuelva a suspender las células con 10 mL de medio completo α-MEM y colóquelas en una nueva placa de cultivo de 10 cm.
- Divida la mandíbula enjuagada en rodajas de hueso de 1-3 mm³ con un rongeur y digieralas con 3 mL de colagenasa tipo II al 0,1% durante 90 min en un agitador de 200 rpm/min a 37 °C.
- Centrifugar la mandíbula digerida a 800 x g durante 3 min a temperatura ambiente y desechar el sobrenadante.
- Cultive las células recolectadas y los trozos de hueso digeridos con medio completo α-MEM a 37 °C en una incubadora humidificada con 5% de CO2 .
- Cambie la mitad del medio de cultivo por medio fresco después de 72 h y luego cámbielo completamente cada 2 días.
NOTA: No mueva la placa de cultivo durante los primeros tres días. - Pase las células adherentes en una proporción de 1:2 cuando alcancen el 80%-90% de confluencia. Retire las rodajas de hueso durante el segundo subcultivo. Utilice las celdas de las generaciones P2 o P3 para los experimentos.
3. Citometría de flujo para la identificación de marcadores de superficie celular
- Vuelva a suspender las JBMMSC de la generación P2 en el tampón de citometría de flujo. Cuente las células utilizando un contador de células automatizado y ajuste la concentración a 3 × 106 células/mL.
- Agregue 100 μL de suspensión celular y 2 μL de anticuerpos monoclonales (CD11b/c, CD29, CD34, CD44, CD45 y CD90) a cada tubo de microcentrífuga. Incubar durante 30 min a 4 °C17,18.
- Lavar la muestra dos veces con 200 μL de tampón de citometría de flujo y centrifugarla durante 5 min a 250 x g a temperatura ambiente. Retire el sobrenadante.
- Agregue 100 μL de tampón de citometría de flujo y 2 μL de anticuerpo secundario fluorescente marcado con PE a cada tubo. Incubar a 4 °C durante 30 min.
- Repita el paso 3.3.
- Resuspenda las JBMMSC en 300-500 μL de tampón de citometría de flujo por tubo.
- Realice el análisis de citometría de flujo utilizando un citómetro de flujo.
NOTA: Utilice anticuerpos homólogos como controles negativos para eliminar la tinción de fondo causada por la combinación inespecífica de anticuerpos.
4. Determinación de la proliferación celular
- Siembre las JBMMSC de la generación P3 en una placa de 96 pocillos con una densidad de 5 × 103 celdas por pocillo.
- Agregue 10 μL de solución CCK-8 a cada pocillo.
- Coloque la placa de 96 pocillos en la incubadora durante 2 h y mida la absorbancia (valor OD a 450 nm) con un lector de microplacas.
NOTA: Realice la prueba a la misma hora todos los días durante siete días consecutivos.
5. Capacidad de formación de colonias
- Siembre 1000 JBMMSCs del pasaje 3 en placas de cultivo de 10 cm y cultivo a 37 °C con 5% de CO2.
- Cambie el medio de cultivo cada 3 días.
- Realizar la tinción con cristal violeta después de un cultivo continuo durante 15 días.
- A continuación, fije las células con metanol durante 5 min y tiña con un 2% de cristal violeta durante 5 min.
6. Diferenciación multilinaje de las JBMMSC
NOTA: Utilice JBMMSC de generación P3 para la diferenciación de varios linajes. El grupo control se cultivó con medio completo α-MEM.
- Realizar la diferenciación osteogénica.
- Inocular 1 × 105 JBMMSC por pocillo en una placa de seis pocillos.
- Cuando la confluencia celular alcance el 70%, cambie el medio a medio de inducción osteogénico.
NOTA: Cambie el medio de inducción osteogénico cada 3 días. - Realizar la tinción con fosfatasa alcalina (ALP) después de 7 días de inducción osteogénica.
- Retire el medio de la placa de seis pocillos, fije las celdas con paraformaldehído al 4% a temperatura ambiente durante 30 minutos y luego lávelas con PBS tres veces.
- Tiñir las células con solución de tinción de ALP a temperatura ambiente durante 30 min y protegerlas de la luz.
- Enjuague las células hasta que no quede ninguna solución de tinción y observe las muestras bajo un microscopio.
- Realizar la tinción con rojo de alizarina después de 21 días de inducción osteogénica.
- Tiñir las células con una solución de tinción de rojo de alizarina durante 5 minutos después de fijar las células con paraformaldehído al 4% durante 30 minutos.
- Lave las células con PBS hasta que no quede una solución de tinción de rojo de alizarina.
- Observe el número de nódulos de calcio bajo un microscopio.
- Realizar la diferenciación adipogénica.
- Inocular 1 × 105 JBMMSC por pocillo en una placa de seis pocillos.
- Cuando la confluencia celular alcanza el 70%, cambie el medio a medio de inducción adipogénico.
NOTA: Cambie el medio de inducción adipogénico cada tres días. - Realice la tinción de aceite rojo O después de 14 días de inducción adipogénica.
- Retire el medio de la placa de seis pocillos, fije las celdas con una solución de fijación Oil Red O durante 20-30 minutos y luego lávelas con PBS tres veces.
- Retire la solución de fijación y lave las celdas con agua destilada dos veces.
- Sumerja las células en isopropanol al 60% durante 20-30 s.
- Retirar el 60% de isopropanol y teñir las células con aceite rojo O tinción durante 20-30 min.
- Retire la solución de tinción, enjuague las células con isopropanol al 60% durante 20-30 s y luego lávelas con agua destilada.
- Tiñir el núcleo con una solución de hematoxilina durante 1-2 min.
- Retire la solución de hematoxilina y lave las células 2-3 veces con agua destilada. Agregue el tampón O rojo aceite durante 1 min y retírelo.
- Observe el número de gotas de lípidos bajo un microscopio.
- Realizar diferenciación condrogénica.
- Inocular 1 × 105 JBMMSC por pocillo en una placa de seis pocillos.
- Cuando la confluencia celular alcanza el 70%, cambie el medio a medio de inducción condrogénico.
NOTA: Cambie el medio de inducción condrogénico cada 3 días. - Realizar la tinción con azul alcián después de 21 días de inducción condrogénica.
- Retire el medio de la placa de seis pocillos, fije las celdas con paraformaldehído al 4% a temperatura ambiente durante 30 minutos y luego lávelas con PBS tres veces.
- Teñir las células con azul alcián a 37 °C durante 1 h.
- Enjuague las células hasta que no quede ninguna solución de tinción y obsérvelas bajo un microscopio.
7. PCR en tiempo real
- Extraiga el ARN total con el kit de extracción de ARN y mida la concentración de ARN con un marcador enzimático (siguiendo las instrucciones del fabricante).
- Sintetizar ADNc utilizando 500 ng de ARN19.
- Realice qRT-PCR en un sistema en tiempo real con 10 μL de mezcla de qRT-PCR que contiene 1 μL de ADNc, 3,5 μL de agua bidestilada, 5 μL de SYBR y 0,5 μL de mezcla de cebador (0,1 μM).
NOTA: Las secuencias de cebadores se enumeran en la Tabla 1. Las condiciones de ciclo térmico son las siguientes: 50 °C durante 2 min, 95 °C durante 2 min, seguidos de 40 ciclos de 95 °C durante 15 s, 60 °C durante 2 min, y luego incrementos de 0,5 °C durante 5 s de 60 °C a 95 °C para la curva de fusión. - Utilizar el GAPDH como control interno16.
Resultados
Después de 72 h de inoculación celular, la mayoría de las células estaban suspendidas y de forma redonda, con muy pocas adheridas a la pared (Figura 1B). Al quinto día, aparecieron colonias de células adherentes, que exhibían husos o formas similares a fibroblastos (Figura 1C). Al séptimo día, las células adherentes alcanzaron el 90% de confluencia, formando una forma de "banco de peces" con un pequeño número de células suspendidas intermitentes (Figura 1D). Las células pasadas crecieron rápidamente y fueron expulsadas cada 3 días. La morfología de la célula era relativamente homogénea, predominantemente en forma de huso, y dispuesta en un patrón similar a un vórtice después de la confluencia (Figura 1E-G).
El análisis de citometría de flujo reveló altos niveles de expresión de los marcadores de superficie de células madre mesenquimales CD90, CD29 y CD44, con tasas positivas de 97,2%, 97,7% y 95,7%, respectivamente. Por el contrario, los marcadores de superficie de células madre hematopoyéticas CD45, CD34 y CD11b/c mostraron una expresión baja, con tasas positivas de 1,37%, 0,66% y 1,49%, respectivamente (Figura 2A). Después de 2 semanas de cultivo, las JBMMSC demostraron colonización, como lo demuestra la tinción con violeta cristalino (Figura 2B). Mostraron una capacidad de expansión estable in vitro, con la curva de crecimiento celular siguiendo un patrón típico "tipo S" (Figura 2C). El proceso de proliferación celular incluyó un período de latencia, una fase de crecimiento logarítmico y una fase de meseta. El crecimiento rápido comenzó después de dos días, seguido de una desaceleración después de seis días. Las células individuales mostraron características de autorreplicación y proliferación.
Las células exhibieron partículas de tinción de ALP de color azul-púrpura en el7º día y nódulos mineralizados rojos en el21º día. Además, después de 14 días de inducción adipogénica, las células mostraron gotas lipídicas con perlas rojas, mientras que la inducción de la diferenciación condrogénica dio como resultado la formación de tejido similar al cartílago azul (Figura 3A). Además, después de 7 días de inducción osteogénica, los niveles de expresión de ARNm de ALP, OCN y Runx2 en las JBMMSC se elevaron15 (Figura 3B).
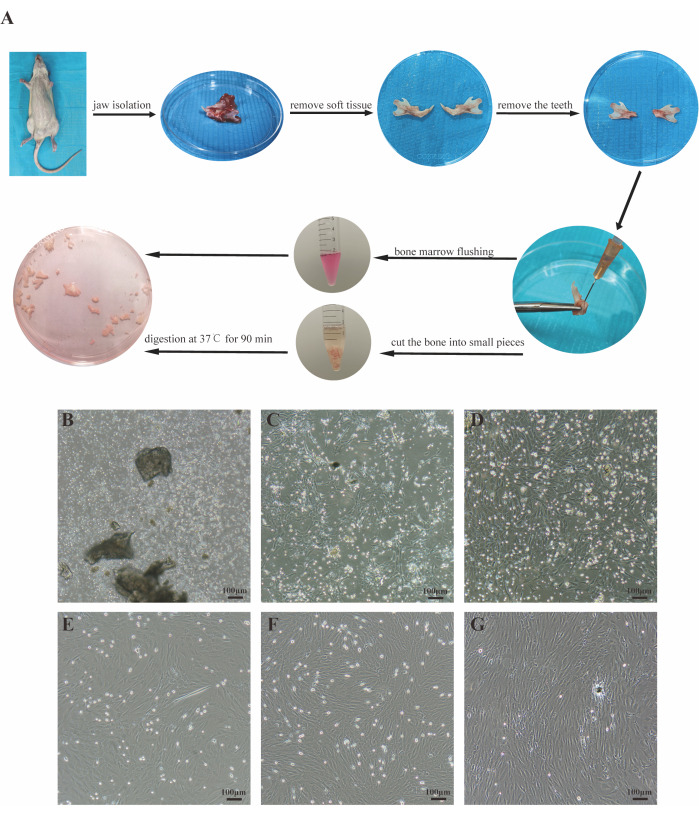
Figura 1: Aislamiento y cultivo de los JBMMSC. (A) Una visión general del protocolo. (B-D) Imágenes de células cultivadas durante 3 días, 5 días y 7 días en cultivo primario, respectivamente. (E-G) Imágenes de las células P1, P2 y P3, respectivamente. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
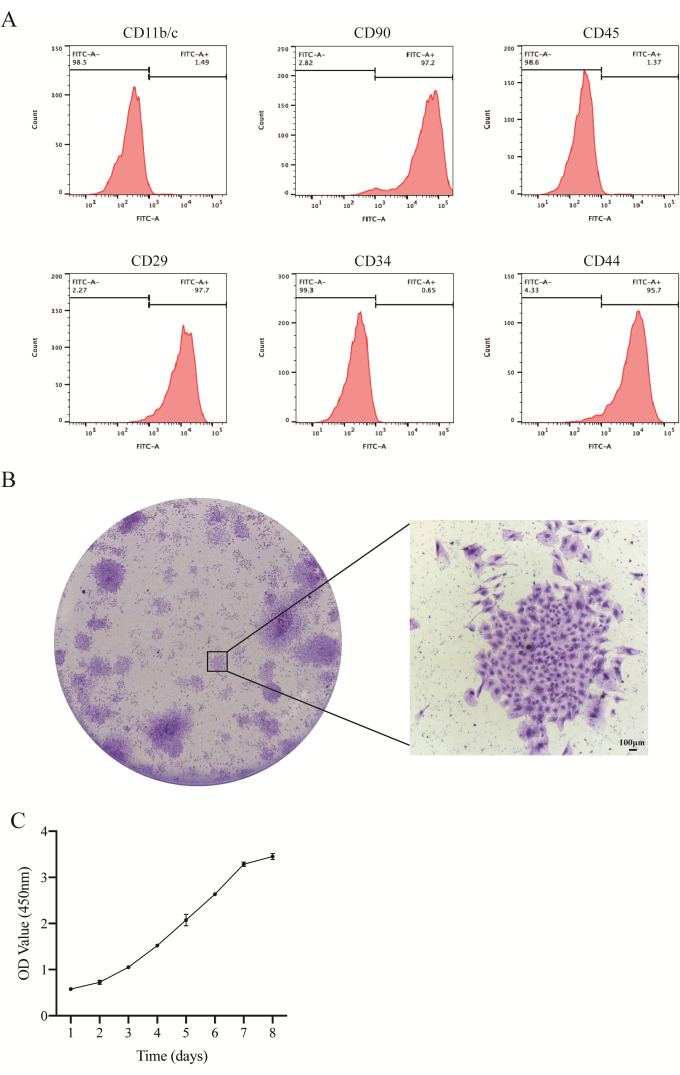
Figura 2: Identificación de las JBMMSC. (A) Resultados del análisis de citometría de flujo de las JBMMSC de rata. El análisis de citometría de flujo reveló que estas células eran positivas para CD29, CD44 y CD90, lo que concuerda con las características de las BMMSC. Por el contrario, fueron negativos para CD11b/c, CD34 y CD45. (B) Imágenes representativas de las colonias de JBMMSCs teñidas con violeta cristalino (barras de escala: 100 μm). (C) La curva de crecimiento celular mostró la tasa de proliferación celular. Los datos y las barras de error denotan la media ± la desviación estándar, n = 3. Haga clic aquí para ver una versión más grande de esta figura.
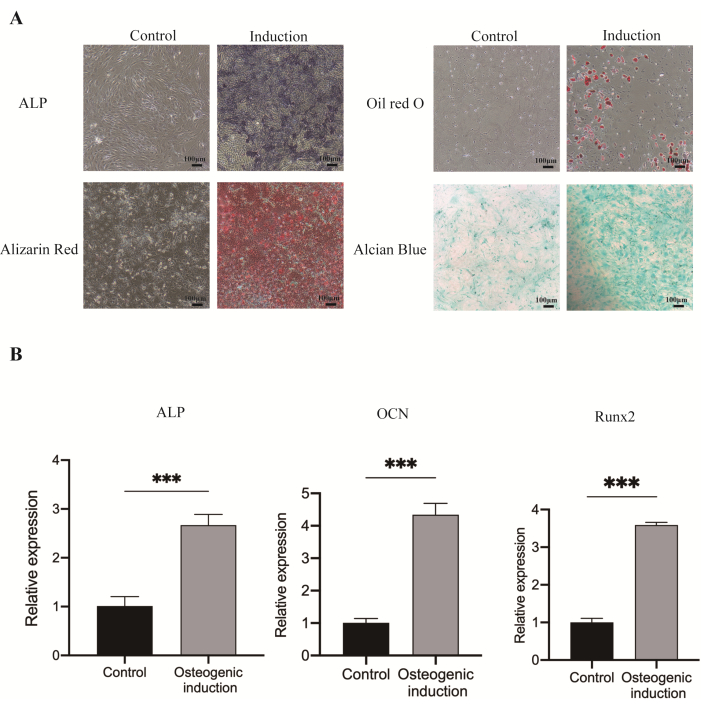
Figura 3: Diferenciación multilinaje (osteogénica, adipogénica y condrogénica) de las JBMMSC. (A) Después de 7 días de inducción osteogénica, se observó un aumento de la actividad de la ALP. A los 21 días después de la inducción osteogénica, numerosos nódulos mineralizados se tiñeron de rojo con tinción roja de alizarina. La tinción de aceite rojo O reveló un número significativo de gotas de lípido. La tinción con azul alcián puso de manifiesto las células inducidas en condrocitos tras la inducción condrogénica. (B) Expresión de ARNm de los genes osteogénicos relacionados ALP, OCN y Runx2 de JBMMSC después de la inducción osteogénica durante 7 días. (***P < 0,001, vs. el grupo de control). Los datos y las barras de error denotan la media ± la desviación estándar, n = 3. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Gen | Secuencias de cebadores (5'-3') |
| GADPH | F: ACCCAGAAGACTGTGGATGG |
| R: CACATTGGGGGTAGGAACAC | |
| ALP | F: CACGTTGACTGTGGTTACTGCTGA |
| R: CCTTGTAACCAGGCCCGTTG | |
| OCN | F: GGTGGTGAATAGACTCCGGC |
| R: GCAACACATGCCCTAAACGG | |
| Runx2 | F: GCACCCAGCCCATAATAGA |
| R: TTGGAGCAAGGAGAACCC |
Tabla 1: Primers utilizados en PCR en tiempo real.
Discusión
Las células madre mesenquimales de la médula ósea (BMMSC) representan un subconjunto de células madre no hematopoyéticas que residen en la médula ósea, caracterizadas por su capacidad de autorrenovación, su potencial de diferenciación multidireccional y sus funciones de apoyo para la hematopoyesis. Estas células desempeñan un papel fundamental en diversos procesos fisiológicos, como la regeneración de tejidos, la angiogénesis y la regulación de las actividades celulares20. En consecuencia, las BMMSC se utilizan con frecuencia en la reparación de tejidos y la ingeniería regenerativa como una fuente óptima de células semilla21.
Las células madre mesenquimales de la médula ósea de la mandíbula (JBMMSC), inicialmente aisladas de aspirados de médula ósea de la mandíbula humana en 2005 por Matsubara et al.22, exhiben características de diferenciación distintivas atribuibles a los orígenes únicos y las vías de desarrollo de la mandíbula en comparación con otros sitios esqueléticos 4,23. Dados los distintos mecanismos patológicos y de desarrollo que gobiernan el hueso craneofacial, parece imperativo priorizar las JBMMSC en la reparación de defectos óseos craneofaciales, debido a sus rasgos homólogos del desarrollo23. Además, las JBMMSCs exhiben una mayor histocompatibilidad con el microambiente oral debido a sus orígenes compartidos en el tejido embrionario24,25. A pesar de estas ventajas, un protocolo de aislamiento estandarizado y seguro para las JBMMSC sigue siendo difícil de alcanzar, y la investigación sobre las JBMMSC sigue siendo relativamente limitada.
En la actualidad, el aislamiento y el cultivo de BMMSCs carecen de estandarización, con métodos comúnmente empleados que incluyen la clasificación inmunomagnética de perlas, la clasificación por citometría de flujo, la centrifugación en gradiente de densidad y el cultivo de adherencia a la médula ósea completa26. Entre estos, el método de perlas inmunomagnéticas y el método de clasificación por citometría de flujo aíslan las células mediante el reconocimiento de antígenos específicos en la superficie celular. Sin embargo, estos métodos implican operaciones engorrosas, requieren instrumentos especializados y pueden afectar la actividad celular a pesar de producir células de alta pureza27. El método de centrifugación en gradiente de densidad separa las células a través de la centrifugación y la estratificación, lo que puede alterar el microambiente celular, lo que conduce a un crecimiento celular más lento y un mayor envejecimiento celular28. Por el contrario, el método de cultivo de adherencia a la médula ósea completa separa y purifica las BMMSC mediante la sustitución intermitente del medio y el paso en función de las diferentes capacidades de adherencia entre los diferentes tipos de células de la médula ósea. Este método inflige un daño mínimo a las células y es sencillo de ejecutar16.
En comparación con el fémur, la mandíbula es de menor tamaño y tiene una cavidad de médula ósea más estrecha, con interferencia de las células del diente o del ligamento periodontal. El método de lavado y adhesión de la médula ósea requiere una cantidad relativamente mayor de médula ósea y es adecuado para animales grandes y humanos29. Las CMJMs en ratas extraídas mediante la aplicación del método tradicional de lavado de médula ósea son raras en número, de proliferación lenta y de mala calidad30,31. El contenido de JBMMSC en la médula ósea es muy bajo y se encuentran principalmente en el hueso compacto y el endostio. Bu-Kyu Lee et al.32 utilizaron los aspirados mandibulares para aislar las JBMMSC, mientras que el tiempo total de aspiración de 10 mL de sangre medular para la mandíbula fue cinco veces mayor que el de la cresta ilíaca, y el rendimiento inicial de MSCs de la mandíbula fue tres veces menor que el de la cresta ilíaca. El lavado de la médula ósea por sí solo no puede aislar eficazmente las células del hueso compacto y el endostio.
En los últimos años, los estudios han encontrado que el hueso compacto es una fuente nueva y confiable de BMMSC, y se ha derivado un método relativamente simple de aislamiento de BMMSC, el método de cultivo de digestión de corte de hueso33. Las BMMSC aisladas por este método tienen una alta pureza34. Guo et al.35han aislado con éxito células madre mesenquimales óseas de fémures de ratón utilizando el método de cultivo de digestión de cortes de hueso. Yamazaza et al.12 y Cheng et al.15 aplicaron el método de cultivo de digestión de cortes de hueso al aislamiento de células madre mesenquimales de médula ósea mandibular de ratón y verificaron las propiedades de las MSC mediante proliferación celular, inmunofenotipo y diferenciación multilinaje. En este experimento se utilizó una combinación de adhesión de médula ósea entera lavada y digestión de cortes de hueso para aislar y cultivar JBMMSC primarias de rata. La médula ósea se lavó completamente de la cavidad sin filtración para mantener la composición celular original y los factores de crecimiento en la médula ósea. Luego, las rodajas de hueso se cortaron en trozos pequeños y se digierieron usando colagenasa tipo II para facilitar que las células salieran de los fragmentos de hueso. Finalmente, las rodajas de hueso se inocularon en una placa de cultivo y se cultivaron para permitir que las células salieran de las rodajas de hueso. El método de combinación hace que el sistema de cultivo de la célula primaria contenga simultáneamente componentes de células madre hematopoyéticas, hueso esponjoso y hueso cortical, lo que puede simular mejor el microambiente de las células madre mesenquimales de la médula ósea en el cuerpo y es más propicio para mantener las características biológicas originales de las células. Por lo tanto, este método se denomina "un enfoque basado en nichos sobre la derivación"36. Luet al.37 también enfatizó la importancia de los nichos de células madre en el aislamiento de las BMMSCs, pero solo involucraron el microambiente en la médula ósea sin hueso cortical. Este método se ha aplicado con éxito en el aislamiento de células madre mesenquimales de médula ósea de mandíbulade ratón 38.
También aislamos y cultivamos con éxito JBMMSC de ratas con este enfoque basado en nichos. En primer lugar, las células aisladas exhibieron una forma similar a la de un fibroblasto y se adhirieron a placas de cultivo de plástico in vitro. En segundo lugar, las células expresaron positivamente los marcadores de superficie CD90, CD29 y CD44 y expresaron negativamente CD45, CD34 y CD11b/c. En tercer lugar, las células podían diferenciarse en osteocitos, adipocitos y condrocitos. Las células obtenidas tenían una buena morfología, una tasa de proliferación rápida y capacidad de diferenciación, lo que cumplía con los criterios mínimos para identificar células madre mesenquimales de origen humano propuestos por la Sociedad Internacional de Terapia Celular17.
El aislamiento de JBMMSCs se ha desarrollado y utilizado para aislar células en humanos. Matsubara et al.22 fueron los primeros en aislar JBMMSCs de muestras de médula ósea alveolar humana durante cirugía oral. Durante el proceso de aspiración de la mandíbula pueden producirse posibles complicaciones, como daños en el tejido adyacente, infección por contaminación bacteriana oral, etc. Zong et al.39 lavaron la cavidad de la médula ósea de las piezas de muestras óseas esponjosas para obtener JBMMSCs humanas. Park et al.40 aislaron JBMMSCs humanas a partir de chips de hueso alveolar obtenidos durante el fresado de implantes utilizando un método de digestión secuencial. Mason et al.41 aislaron directamente las JBMMSC humanas de los núcleos de médula ósea de la mandíbula y el aspirado de pacientes sometidos a la colocación rutinaria de implantes dentales. Hubo una alta tasa de éxito en el aislamiento de células de aspirados o núcleos y una mayor tasa de éxito de la combinación. Sin embargo, aunque los métodos anteriores han aislado con éxito las JBMMSC de los seres humanos, es necesario comparar las diferencias en la eficacia entre los métodos. Actualmente, este método presentado solo se ha utilizado en ratones y ratas, y no hay investigaciones sobre la aplicación de este método al aislamiento de JBMMSC humanas. Este método tiene sus limitaciones, especialmente cuando se aplica a los seres humanos. En primer lugar, este método de combinar el lavado de la médula ósea y la digestión de los cortes de hueso es relativamente complicado y requiere más pasos. En segundo lugar, los procesos complejos imponen mayores exigencias a la esterilidad de las operaciones, que es fundamental para el protocolo. En tercer lugar, es imposible lavar toda la cavidad de la médula ósea de la mandíbula humana, por lo que es necesario explorar algunos métodos equivalentes, como el lavado de fragmentos de hueso esponjoso.
En resumen, este estudio aisló y cultivó con éxito JBMMSC de rata utilizando una combinación de lavado de médula ósea y digestión de cortes de hueso basada en el principio de "nicho de células madre". Los resultados de la identificación celular confirmaron que este método puede aislar JBMMSC suficientes y de alta pureza, proporcionando amplias fuentes celulares para la ingeniería de tejidos maxilares, particularmente en la reparación de defectos óseos, que es de gran importancia.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio contó con el apoyo de los proyectos de atención médica del Departamento de Logística de la Comisión Militar (19BJZ22), la Fundación de Ciencias Naturales de Beijing (7232154) y los proyectos de investigación clínica Fourth Mil Med Univ. (2021XB025).
Materiales
| Name | Company | Catalog Number | Comments |
| Alizarin Red S Solution 0.2% | Solarbio | G1450 | |
| BCIP/NBT Alkaline Phosphatase Color Development Kit | Beyotime | C3206 | |
| Bio-Rad CFX96 Real-Time System | Bio-Rad | ||
| CCK8 Kit | Dujindo | CK04 | |
| Cell culture dish 10 cm | Corning | 353003 | |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge Tube 15 mL | Corning | 430790 | |
| Centrifuge Tube 50 mL | Corning | 430828 | |
| CO2 incubator | Thermo Fisher | 3111 | |
| Constant-temperature oscillator | Shanghai Zhicheng Analysis Instrument Manufacturing Co., Ltd. | ZWY-100H | |
| Fetal bovine serum | BI | 04-001-1ACS | |
| Flow cytometer | BD | FACS C6 | |
| Inverted phase-contrast microscope | Olympus | CKX41 | |
| Mesenchymal Stem Cell (Rat) Surface marker Detection Kit | Oricell | RAXMX-09011 | |
| Multifunctional microplate reader | BioTek | Synergy LX Multi-Mode | |
| Oil Red O Stain Kit | Solarbio | G1262 | |
| Paraformaldehyde 4% | Solarbio | P1110 | |
| PBS | MACGENE | CC008 | |
| penicillin-streptomycin 0.25% | MACGENE | CC004 | |
| PowerUp SYBR Green Master Mix | Thermo Fisher | A25742 | |
| PrimeScript RT Master Mix | Takara | RR036A | |
| Rat Bone Marrow Mesenchymal Stem Cells Adipogenic Differentiation kit | Oricell | RAXMX-90031 | |
| Rat Bone Marrow Mesenchymal Stem Cells Chondrogenic Differentiation kit | Oricell | RAXMX-90041 | |
| Rat Bone Marrow Mesenchymal Stem Cells Osteogenic Differentiation kit | Oricell | RAXMD-90021 | |
| RNA extraction kit | TIANGEN | DP419 | |
| Super-clean bench | Beijing Yataikelong Instrument Technology Co. Ltd. | KLCZ-1220A | |
| Trypsin-EDTA 0.25% | MACGENE | CC012 | |
| Type II collagenase | Solarbio | C8150 | |
| Wistar rat | Beijing Yataikelong Instrument Technology Co. Ltd. | ||
| α-MEM culture medium | Gibco | C12571500BT |
Referencias
- Friedenstein, A. J., Petrakova, K. V., Kurolesova, A. I., Frolova, G. P. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation. 6 (2), 230-247 (1968).
- Pittenger, M. F., et al. Multilineage potential of adult human mesenchymal stem cells. Science. 284 (5411), 143-147 (1999).
- Shao, J., Zhang, W., Yang, T. Using mesenchymal stem cells as a therapy for bone regeneration and repairing. Biol Res. 48, 62 (2015).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. Long-bone marrow stromal cells. J Dent Res. 89 (11), 1293-1298 (2010).
- Mendi, A., Ulutürk, H., Ataç, M. S., Yılmaz, D. Stem cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Adv Exp Med Biol. 1144, 101-121 (2019).
- Couly, G. F., Coltey, P. M., Le Douarin, N. M. The triple origin of skull in higher vertebrates: A study in quail-chick chimeras. Development. 117 (2), 409-429 (1993).
- Leucht, P., et al. Embryonic origin and hox status determine progenitor cell fate during adult bone regeneration. Development. 135 (17), 2845-2854 (2008).
- Jeyaraman, M., et al. Is mandible derived mesenchymal stromal cells superior in proliferation and regeneration to long bone-derived mesenchymal stromal cells. World J Methodol. 13 (2), 10-17 (2023).
- Mouraret, S., et al. The potential for vertical bone regeneration via maxillary periosteal elevation. J Clin Peri.odontol. 41 (12), 1170-1177 (2014).
- Li, T. Q., Meng, X. B., Shi, Q., Zhang, T. Research progress in biological characteristics and influencing factors of jaw bone marrow mesenchymal stem cell. Zhonghua Kou Qiang Yi Xue Za Zhi. 57 (1), 107-112 (2022).
- Arthur, A., Gronthos, S. Clinical application of bone marrow mesenchymal stem/stromal cells to repair skeletal tissue. Int J Mol Sci. 21 (24), 9759 (2020).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. J Dent Res. 90 (3), 317-324 (2011).
- Chen, L., et al. Directional homing of glycosylation-modified bone marrow mesenchymal stem cells for bone defect repair. J Nanobiotechnology. 19 (1), 228 (2021).
- Hong, Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. J Vis Exp. (162), e61532 (2020).
- Cheng, B., et al. Isolation, culture and biological characteristics of high-purity orofacial-bone-derived mesenchymal stem cells of the rats. Zhongguo Zuzhi Gongcheng Yanjiu. 25 (1), 67-72 (2021).
- Lee, D. J., et al. Osteogenic potential of mesenchymal stem cells from rat mandible to regenerate critical sized calvarial defect. J Tissue Eng. 10, 2041731419830427 (2019).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The international society for cellular therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Fathi, E., Mesbah-Namin, S. A., Vietor, I., Farahzadi, R. Mesenchymal stem cells cause induction of granulocyte differentiation of rat bone marrow c-kit(+) hematopoietic stem cells through jak3/stat3, erk, and pi3k signaling pathways. Iran J Basic Med Sci. 25 (10), 1222-1227 (2022).
- Xu, W., et al. Exosomes from microglia attenuate photoreceptor injury and neovascularization in an animal model of retinopathy of prematurity. Mol Ther Nucleic Acids. 16, 778-790 (2019).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. Int J Mol Sci. 21 (3), 708 (2020).
- Liu, Y., et al. Systemic infusion of mesenchymal stem cells improves cell-based bone regeneration via upregulation of regulatory T cells. Tissue Eng Part A. 21 (3-4), 498-509 (2015).
- Matsubara, T., et al. Alveolar bone marrow as a cell source for regenerative medicine: Differences between alveolar and iliac bone marrow stromal cells. J Bone Miner Res. 20 (3), 399-409 (2005).
- Zhang, G., Li, Q., Yuan, Q., Zhang, S. Spatial distributions, characteristics, and applications of craniofacial stem cells. Stem Cells Int. 2020, 8868593 (2020).
- Akintoye, S. O. The distinctive jaw and alveolar bone regeneration. Oral Dis. 24 (1-2), 49-51 (2018).
- Park, J. B., Kim, I., Lee, W., Kim, H. Evaluation of the regenerative capacity of stem cells combined with bone graft material and collagen matrix using a rabbit calvarial defect model. J Periodontal Implant Sci. 53 (6), 467-477 (2023).
- Ni, X., et al. Isolation, culture and identification of SD rat bone marrow mesenchymal stem cells in tissue engineering. Materials Exp. 12, 817-822 (2022).
- Abdallah, B. M., Khattab, H. M. Recent approaches to isolating and culturing mouse bone marrowderived mesenchymal stromal stem cells. Curr Stem Cell Res Ther. 16 (5), 599-607 (2021).
- Tan, S. L., Ahmad, T. S., Selvaratnam, L., Kamarul, T. Isolation, characterization and the multilineage differentiation potential of rabbit bone marrow-derived mesenchymal stem cells. J Anat. 222 (4), 437-450 (2013).
- Mason, S., Tarle, S. A., Osibin, W., Kinfu, Y., Kaigler, D. Standardization and safety of alveolar bone-derived stem cell isolation. J Dent Res. 93 (1), 55-61 (2014).
- Kagami, H., Agata, H., Tojo, A. Bone marrow stromal cells (bone marrow-derived multipotent mesenchymal stromal cells) for bone tissue engineering: Basic science to clinical translation. Int J Biochem Cell Biol. 43 (3), 286-289 (2011).
- Liu, J., Watanabe, K., Dabdoub, S. M., Lee, B. S., Kim, D. G. Site-specific characteristics of bone and progenitor cells in control and ovariectomized rats. Bone. 163, 116501 (2022).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 112 (6), e86-e93 (2011).
- Zhu, H., et al. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone. Nat Protoc. 5 (3), 550-560 (2010).
- Short, B. J., Brouard, N., Simmons, P. J. Prospective isolation of mesenchymal stem cells from mouse compact bone. Methods Mol Biol. 482, 259-268 (2009).
- Guo, Z., et al. In vitro characteristics and in vivo immunosuppressive activity of compact bone-derived murine mesenchymal progenitor cells. Stem Cells. 24 (4), 992-1000 (2006).
- Pal, B., Das, B. In vitro culture of naïve human bone marrow mesenchymal stem cells: A stemness based approach. Front Cell Dev Biol. 5, 69 (2017).
- Lu, L. L., et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials. Haematologica. 91 (8), 1017-1026 (2006).
- Cao, W., et al. Mir-344d-3p regulates osteogenic and adipogenic differentiation of mouse mandibular bone marrow mesenchymal stem cells. PeerJ. 11, e14838 (2023).
- Zong, C., Zhao, L., Huang, C., Chen, Y., Tian, L. Isolation and culture of bone marrow mesenchymal stem cells from the human mandible. J Vis Exp. (182), e63811 (2022).
- Park, J. C., et al. Acquisition of human alveolar bone-derived stromal cells using minimally irrigated implant osteotomy: In vitro and in vivo evaluations. J Clin Periodontol. 39 (5), 495-505 (2012).
- Mason, S., Tarle, S. A., Osibin, W., Kinfu, Y., Kaigler, D. Standardization and safety of alveolar bone-derived stem cell isolation. J Dent Res. 93 (1), 55-61 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados