Method Article
Caracterización de las propiedades mecánicas de la pared celular primaria en órganos vegetales vivos mediante microscopía de fuerza atómica
En este artículo
Resumen
Los estudios de biomecánica de la pared celular son esenciales para comprender el crecimiento y la morfogénesis de las plantas. Se propone el siguiente protocolo para investigar las paredes celulares primarias delgadas en los tejidos internos de órganos de plantas jóvenes utilizando microscopía de fuerza atómica.
Resumen
Las propiedades mecánicas de las paredes celulares primarias determinan la dirección y la tasa de crecimiento de las células vegetales y, por lo tanto, el tamaño y la forma futuros de la planta. Se han desarrollado muchas técnicas sofisticadas para medir estas propiedades; sin embargo, la microscopía de fuerza atómica (AFM) sigue siendo la más conveniente para estudiar la elasticidad de la pared celular a nivel celular. Una de las limitaciones más importantes de esta técnica ha sido que solo se pueden estudiar células vivas superficiales o aisladas. Aquí se presenta el uso de la microscopía de fuerza atómica para investigar las propiedades mecánicas de las paredes celulares primarias pertenecientes a los tejidos internos del cuerpo vegetal. Este protocolo describe las mediciones del módulo aparente de Young de las paredes celulares en las raíces, pero el método también se puede aplicar a otros órganos de la planta. Las mediciones se realizan en secciones de material vegetal derivadas de vibratomas en una celda líquida, lo que permite (i) evitar el uso de soluciones plasmolizantes o impregnación de muestras con cera o resina, (ii) hacer que los experimentos sean rápidos y (iii) prevenir la deshidratación de la muestra. Se pueden estudiar tanto las paredes celulares anticlinales como las periclinas, dependiendo de cómo se seccionó la muestra. Las diferencias en las propiedades mecánicas de diferentes tejidos se pueden investigar en una sola sección. El protocolo describe los principios de planificación del estudio, los problemas con la preparación y las mediciones de la muestra, así como el método de selección de curvas de fuerza-deformación para evitar la influencia de la topografía en los valores obtenidos del módulo elástico. El método no está limitado por el tamaño de la muestra, pero es sensible al tamaño de la célula (es decir, las células con una gran luz son difíciles de examinar).
Introducción
Las propiedades mecánicas de la pared celular de la planta determinan la forma de la célula y su capacidad para crecer. Por ejemplo, la punta en crecimiento del tubo polínico es más suave que las partes que no crecen del mismo tubo1. La formación de primordios en el meristemo de Arabidopsis está precedida por una disminución local de la rigidez de la pared celular en el sitio del futuro primordio 2,3. Las paredes celulares de Arabidopsis hypocotyl, que son paralelas al eje de crecimiento principal y crecen más rápido, son más suaves que las que son perpendiculares a este eje y crecen más lentamente 4,5. En la raíz de maíz, la transición de las células de la división al alargamiento se acompañó de una disminución de los módulos elásticos en todos los tejidos de la raíz. Los módulos se mantuvieron bajos en la zona de elongación y aumentaron en la zona de elongación tardía6.
A pesar de la disponibilidad de varios métodos, las grandes cantidades de información bioquímica y genética sobre la biología de la pared celular obtenida anualmente rara vez se comparan con las propiedades mecánicas de las paredes celulares. Por ejemplo, los mutantes en genes relacionados con la pared celular a menudo tienen un crecimiento y desarrollo alterados 4,7,8, pero rara vez se describen en términos de biomecánica. Una de las razones de esto es la dificultad de realizar mediciones a nivel celular y subcelular. La microscopía de fuerza atómica (AFM) es actualmente el enfoque principal para tales análisis9.
En los últimos años, se han llevado a cabo numerosos estudios basados en AFM sobre biomecánica de la pared celular vegetal. Se han investigado las propiedades mecánicas de las paredes celulares de los tejidos externos de Arabidopsis 2,3,4,5,10,11 y cebolla 12, así como de células cultivadas 13,14,15. Sin embargo, las células superficiales de una planta pueden tener paredes celulares cuyas propiedades mecánicas difieren de las de los tejidos internos6. Además, las células vegetales son presurizadas por turgencia, lo que las hace más rígidas. Para deshacerse de la influencia de la presión de turgencia, los investigadores tienen que utilizar soluciones plasmolizantes 2,3,4,5,10,11 o descomponer los valores obtenidos en turgencia y aportes de pared celular 12. El primer enfoque conduce a la deshidratación de la muestra y cambia el grosor y las propiedades de la pared celular16, mientras que el segundo enfoque requiere mediciones adicionales y matemáticas complicadas, y se aplica solo a células de forma relativamente simple12. Las propiedades de la pared celular de los tejidos internos pueden evaluarse en criosecciones17 o secciones de material vegetal impregnado con resina8. Sin embargo, ambos métodos implican deshidratación y/o impregnación de muestras, lo que inevitablemente conduce a cambios en las propiedades. Las propiedades de las células aisladas o cultivadas son difíciles de relacionar con la fisiología de toda la planta. Tanto el cultivo como el aislamiento de las células vegetales pueden afectar las propiedades mecánicas de sus paredes celulares.
El método presentado aquí complementa los enfoques antes mencionados. Usándolo, se pueden examinar las paredes celulares primarias de cualquier tejido y en cualquier etapa del desarrollo de la planta. Las observaciones de seccionamiento y AFM se realizaron en líquido, lo que evita la deshidratación de la muestra. El problema de la turgencia se resolvió a medida que se cortan las células. El protocolo describe el trabajo con raíces de maíz y centeno, pero cualquier otra muestra puede ser examinada si es adecuada para la sección de vibratomo.
Los estudios de MFA descritos aquí se realizaron utilizando la técnica de fuerza-volumen. Diferentes instrumentos usan diferentes nombres para este método. Sin embargo, el principio básico es el mismo; Un mapa fuerza-volumen de la muestra se obtiene mediante un movimiento sinusoidal o triangular del voladizo (o muestra) para lograr una cierta fuerza de carga en cada punto analizado, mientras se registra la deflexión del voladizo18. El resultado combina una imagen topográfica de la superficie y la matriz de curvas fuerza-distancia. Cada curva se utiliza para calcular la deformación, rigidez, módulo de Young, adhesión y disipación de energía en un punto específico. Se pueden obtener datos similares por espectroscopia de fuerza punto por punto después de escanear en el modode contacto 19, aunque lleva más tiempo.
Protocolo
1. Preparación de la muestra para mediciones de AFM
- Material vegetal: Esterilizar las semillas de maíz (Zea mays L.) y centeno (Secale cereale L.) con una solución de NaOCl al 0,35% durante 10 min, lavar 3 veces con agua destilada y luego cultivar hidropónicamente en la oscuridad a 27 °C durante 4 días y 2 días, respectivamente. Se utilizaron raíces primarias para el experimento.
- Preparación de soluciones y muestra para la sección de vibratomo
- Prepare la solución de agarosa para incrustar la raíz disolviendo la agarosa de bajo punto de fusión al 3% (p/p) en agua usando un horno de microondas.
NOTA: Todos los experimentos se realizaron en agua. Si se requiere tampón o cualquier otro tipo de medio para el estudio, es mejor usar el mismo medio para la preparación de agarosa, durante la sección y en la celda líquida del AFM para evitar dañar la muestra. - Vierta una capa de 4 mm de agarosa derretida al 3% en el fondo de la placa de Petri (diámetro = 35 mm) y deje que se enfríe ligeramente para evitar daños térmicos en la muestra.
- Coloque tres o cuatro piezas pequeñas (de unos 5 mm de largo) del órgano vegetal estudiado horizontalmente sobre la agarosa.
NOTA: Las muestras deben estar semisumergidas pero no sumergidas en la capa de agarosa. Si la muestra no se sumerge, puede desprenderse de la agarosa durante la sección del vibratomo. Si la muestra se hunde hasta el fondo, estará demasiado cerca del borde de la sección y se volverá inconveniente para pasos posteriores. - Cuando aparezca una película delgada y semisólida en la parte superior de la primera capa de agarosa (30-60 s), vierta con cuidado una segunda capa en la parte superior.
NOTA: La capa inferior de agarosa no debe solidificarse completamente. De lo contrario, las dos capas pueden separarse entre sí durante el trabajo posterior. - Después de que la agarosa esté completamente solidificada, corte el bloque que contiene la muestra. Dar forma al bloque en una pirámide truncada hexagonal para garantizar su estabilidad durante la sección posterior (Figura 1A).
NOTA: La muestra puede orientarse vertical u horizontalmente dentro de este bloque dependiendo del tipo de sección requerida. Al preparar el bloque, deje 2-3 mm de agarosa alrededor de la muestra. En este caso, la sección de muestra será retenida por la capa de agarosa al 3%, lo que facilitará su posterior inmovilización (Figura 1B).
- Prepare la solución de agarosa para incrustar la raíz disolviendo la agarosa de bajo punto de fusión al 3% (p/p) en agua usando un horno de microondas.
- Seccionando la muestra con el vibratomo
- Pegue el bloque a la etapa de vibratomo con adhesivo de cianoacrilato. Coloque el escenario en el vibrátomo de modo que una de las esquinas de la pirámide se enfrente a la hoja del vibratomo. Vierta agua en el baño de vibratomo.
- Establezca los parámetros de seccionamiento (grosor de sección, velocidad de la cuchilla y frecuencia de vibración) y corte la muestra.
NOTA: Utilice espesores de sección entre 200 y 400 μm. Una sección demasiado delgada puede introducir errores en la evaluación de las propiedades mecánicas, mientras que una sección demasiado gruesa es propensa a romperse. Se utilizó una velocidad de hoja de 1,3 mm·s-1 y una frecuencia de oscilación de 90 Hz para las raíces de centeno y maíz. - Con un cepillo fino, mueva la sección del baño de agua a un tobogán de vidrio y coloque una gota de agua en la sección para evitar que se seque. Compruebe la calidad de la sección bajo un microscopio óptico.
NOTA: Las secciones oblicuas no se pueden utilizar para medir el módulo de elasticidad. Las paredes celulares deben ser perpendiculares al plano de sección, de lo contrario pueden doblarse o doblarse debajo de la punta AFM.
- Inmovilización de la sección para mediciones de AFM (Figura 1B)
- Vierta una capa de agarosa fundida al 1% (p/p) (~1 ml) en el fondo de la tapa de la placa de Petri con una pipeta.
NOTA: Asegúrese de que los lados de la tapa de la placa de Petri no impidan que la punta se acerque a la muestra. La capa de agarosa debe tener un grosor de 1 mm y debe cubrir toda la parte inferior de la tapa. - Después de que la agarosa al 1% se haya solidificado, elimine el exceso de agua de la sección llevando el papel de filtro a su borde.
NOTA: No toque la sección de la planta con el papel para evitar daños y secado completo de la muestra. - Transfiera con cuidado la sección de la diapositiva al centro de la tapa de la placa de Petri con un cepillo. Con una pipeta de 20 μL, agregue cuidadosamente agarosa al 1% alrededor de la sección (Figura 1B).
NOTA: La agarosa al 1% no debe entrar en el espécimen en sí. Solo debe cubrir los bordes de la capa de agarosa al 3% que retiene el espécimen de la planta. La agarosa al 1% debe formar pequeños montículos en los bordes de esta capa de agarosa al 3%. Los montículos grandes pueden evitar que el voladizo se acerque a la muestra. - Vierta el agua u otra solución que se utilizará para el AFM en la tapa de la placa de Petri con la sección inmovilizada.
- Vierta una capa de agarosa fundida al 1% (p/p) (~1 ml) en el fondo de la tapa de la placa de Petri con una pipeta.
2. Preparación y calibración de AFM
NOTA: El método fuerza-volumen de AFM genera una matriz espacialmente resuelta de curvas fuerza-distancia obtenidas en cada punto del área estudiada. Obtenga todos los parámetros para el modo fuerza-volumen (rigidez en voladizo, IOS, etc.) en modo de contacto. Procedimientos similares para instrumentos de otros fabricantes se han descrito anteriormente10,20.
- Seleccione el tipo adecuado de voladizo.
NOTA: La rigidez en voladizo debe ser comparable a la rigidez de la muestra21. Un voladizo que es mucho más rígido que la muestra no se desviará mucho, mientras que un voladizo que es demasiado blando no deformará la muestra lo suficiente. Una frecuencia de resonancia típica debe ser suficiente para balancear el voladizo en el líquido (es decir, ser al menos unas pocas decenas de kHz). El área de contacto debe ser pequeña en comparación con el tamaño de la pared celular, ya que se supone que la muestra en estudio en los cálculos del módulo de Young es un semiespacio infinito. Para las raíces de centeno y maíz se utilizaron los siguientes voladizos: voladizos afilados con una frecuencia de resonancia típica de 60 kHz, una constante de resorte promedio de 1.5 N·m-1 y un radio de ápice de 10 nm, o voladizos esféricos con una frecuencia de resonancia típica de 75 kHz, una constante de resorte promedio de 2.8 N·m-1, y un radio de vértice de 150 nm. - Encienda el dispositivo AFM y el software asociado (Tabla de materiales). Monte el voladizo en el soporte de la punta para la celda líquida. Coloque una gota de líquido en la punta para evitar que se formen burbujas de aire en la punta mientras la sumerge en el líquido.
NOTA: En caso de formación de burbujas, el líquido se puede eliminar con una toallita de precisión, y luego se puede colocar una nueva gota. - Monte el soporte de la punta en el cabezal de escaneo.
- Coloque una muestra dura (portaobjetos de vidrio fresco) en una tapa de placa de Petri. Vierta el líquido en él, asegurándose de que cubra el portaobjetos. Coloque el cabezal de escaneo en el escenario y levante la muestra para que el líquido cubra el voladizo.
- Elija la pestaña Cabezas en el menú desplegable Herramientas . Asegúrese de que el cabezal de escaneo para la celda líquida esté seleccionado.
- Haga clic en el botón Apuntar para abrir la ventana Apuntar láser . Haga clic en el botón Cámara para abrir la ventana Microscopio óptico . Coloque el láser en la punta del voladizo, utilizando los tornillos en el cabezal AFM y la ventana del microscopio óptico para orientarse.
- Elija el modo Semicontacto en el menú desplegable en la ventana principal del programa.
- Abra la pestaña Resonancia y elija el tipo de voladizo que se está utilizando en el menú Sondas . Haga clic en el botón Auto para determinar la frecuencia de resonancia.
NOTA: Si el voladizo que se está utilizando no aparece en la lista, abra Herramientas > Pasaporte de sondeo. Cree un nuevo archivo, introduzca los parámetros en voladizo y guárdelo. Luego elíjalo en el menú desplegable Sondas . - Elija el modo Contacto en el menú desplegable en la ventana principal del programa.
- Haga clic en el botón N_Force Cal para abrir la ventana de calibración en voladizo. Elija el voladizo que se está utilizando y haga clic en el botón Barrer y, a continuación, en el botón Spect Meas para determinar la constante del resorte en voladizo mediante el procedimiento de ajuste térmico. Cierre la ventana.
- Establezca el SetPoint en 1 nA. Abra la pestaña Aproximación y haga clic en el botón Aterrizaje para acercarse a la muestra.
- Abra la pestaña Escaneo . Establezca la velocidad de escaneo en 0.5 Hz. Haga clic en el botón Área y establezca el Tamaño de escaneo en 10 μm x 10 μm y el Punto de escaneo en 256 x 256. Haga clic en el botón Ejecutar y escanee unas 20 líneas para comprobar que no hay contaminación en el vidrio. Haga clic en el botón Detener para finalizar el escaneo sin perder datos.
- Abra la pestaña Curvas . Establezca los parámetros de retracción y aproximación a 500 nm y -100 nm, respectivamente.
- Elija el último escaneo en el menú desplegable Seleccione Marco para observar la superficie.
- Encuentre un área limpia en el vidrio e indique el punto donde se debe tomar la curva de fuerza-deformación, y haga clic en el botón Ejecutar para obtener la curva. Registre de tres a cinco curvas de fuerza en diferentes lugares del escaneo.
- Haga clic en el botón Datos para abrir la ventana de análisis y seleccione el marco con la curva fuerza-deformación.
- Haga clic en el botón Emparejar marcadores e indique la parte lineal de la curva de retracción para calcular la relación entre la señal DFL y el desplazamiento, que es la sensibilidad óptica inversa (IOS, nA nm-1) o la sensibilidad de deflexión.
- Repita el paso 2.17 para todas las curvas registradas y anote todos los valores calculados de la relación señal/desplazamiento DFL. Deberían ser los mismos.
- Cierre la ventana de análisis, haga clic en la ficha Enfoque y, a continuación, en el botón Eliminar para retirar la sonda de la muestra.
3. Adquisición de datos
- Guiar la muestra debajo del voladizo AFM usando el microscopio óptico. Haga clic en la ficha Aproximación y, a continuación, en el botón Aterrizaje para acercarse a la muestra en modo de contacto con un SetPoint de 1 nA.
- Haga clic en la pestaña Escaneo y, a continuación, en el botón Área . Seleccione el Tamaño de área de 70 μm x 70 μm para escanear.
- Haga clic en el botón Mover sonda y compruebe toda el área de escaneo moviendo el escáner sobre ella. Según el grado de protuberancia del escáner, encuentre el punto más alto.
- Abra la pestaña Enfoque , luego haga clic en el botón Eliminar para retractarse de la muestra. Usando el punto más alto como objetivo, haga clic en el botón Aterrizaje para acercarse nuevamente a la muestra. A continuación, compruebe de nuevo la superficie haciendo clic en el botón Mover sonda y moviendo el escáner sobre ella. Ninguno de los puntos de la zona debe requerir que el escáner esté completamente elevado.
NOTA: Idealmente, el rango z del escáner debe exceder la diferencia de altura de la muestra. Sin embargo, es aceptable si algunos puntos en el área de escaneo están por debajo de la capacidad del escáner. Al mismo tiempo, no debería haber muchos puntos de este tipo. Las áreas grandes que no pueden ser alcanzadas por el escáner pueden causar el aborto de escaneo. - Ajuste la velocidad de escaneo a 0,5 Hz. Establezca el tamaño de escaneo en 70 μm x 70 μm y el punto de escaneo en 64 x 64. Haga clic en el botón Ejecutar y escanee para verificar la superficie de la muestra y su posible contaminación con agarosa.
NOTA: Si la muestra tiene celdas con un lumen grande, se puede reducir el tamaño del área de exploración o se debe mover para que haya más paredes celulares en la exploración. - Haga clic en el botón Activado en la parte superior de la ventana principal para desactivar el bucle de retroalimentación.
- Elija el modo HDPlus (método de fuerza de volumen) en el menú desplegable en la ventana principal del programa. Aparecerá una ventana adicional (ventana HD).
- Establezca el SetPoint en 0.1 nA en la ventana principal del programa.
- En la pestaña Principal de la ventana HD, establezca los parámetros de escaneo (amplitud y frecuencia del movimiento del voladizo sinusoidal) apropiados para la muestra estudiada.
NOTA: Cada tipo de muestra y voladizo requiere la selección de parámetros de escaneo. Algunos experimentos preliminares son necesarios. Para las raíces de maíz o centeno, se utilizaron voladizos afilados y esféricos a una amplitud de 400 nm y una frecuencia de 300 Hz. - Abra la pestaña Ruidos en la ventana HD e ingrese la frecuencia de resonancia del voladizo.
- Abra la pestaña Quant de la ventana HD e ingrese el IOS, la rigidez en voladizo y el radio y ángulo de la punta. Seleccione el modelo de contacto que se utilizará para los cálculos en función de la geometría de la punta.
NOTA: El modelo DMT tiene en cuenta la fuerza de adhesión existente entre la sonda y la muestra, y se utiliza más comúnmente en mecanobiología21. - Abra la pestaña Escanear de la ventana HD y seleccione las señales que desea grabar. Seleccione la dirección en la que se graba la señal. Marque la casilla Forzar volumen para obtener un registro de todas las curvas de fuerza.
NOTA: Registre la señal del módulo de elasticidad tanto en dirección hacia adelante como hacia atrás. Proporcionará más puntos para calcular. - Haga clic en el botón Desactivado en la parte superior de la ventana principal del programa para activar el bucle de retroalimentación.
- Haga clic en el botón PhaseCorr en la ventana principal de HD para corregir la sensibilidad del sistema óptico.
- La pestaña vs Time de la ventana principal de HD presenta la función de la señal DFL vs . time en tiempo real; Seleccione las partes de esta función que se utilizarán para la determinación del nivel de referencia y para ajustar el modelo de contacto para cálculos posteriores.
- Establezca el valor del punto de escaneo en 256 x 256 en la ventana principal del programa. Establezca la velocidad de escaneo en 0.2 Hz y haga clic en el botón Ejecutar para escanear la muestra.
- Después de que se detenga el escaneo, haga clic en el botón Activado en la parte superior de la ventana principal para desactivar el bucle de retroalimentación.
- Elija el modo Contacto en el menú desplegable, abra la pestaña Enfoque y haga clic en el botón Eliminar para retirarse de la muestra.
- Haga clic en el botón Datos para abrir el software de análisis y guardar la salida.
- Al final del día de medición, retire el soporte de la punta en voladizo del cabezal y enjuáguelo cuidadosamente con agua ultrapura varias veces. Cada vez, retire el agua con una toallita de precisión.
4. Evaluación de datos y post-procesamiento
NOTA: No confíe en los valores del módulo elástico calculados automáticamente. Dado que la superficie varía mucho en altura, muchas curvas de artefactos deben ser expulsadas.
- Abra el archivo guardado en el software de análisis.
- Seleccione el fotograma HDForceVolume .
- Mantenga presionada la tecla Ctrl y seleccione un fotograma visual obtenido en la misma dirección de escaneo. Haga clic en el botón Cargar mapa externo para ver dónde se encuentran las paredes celulares.
NOTA: Cualquier mapa de señal se puede utilizar como un marco visual, pero el uso del mapa de señal DFL (diferentes instrumentos pueden referirse a él como una señal de desviación o señal de error) puede ser la forma más fácil. - Compruebe InvOptSens (IOS) y los valores de rigidez en voladizo en la pestaña Principal .
- Abra la pestaña Adicional y verifique los parámetros de la punta y el modelo de contacto.
- Haga clic en varios puntos de las paredes celulares en el marco visual y seleccione solo aquellas curvas que están bien descritas por el modelo. Consulte los resultados representativos para obtener más información.
- Anote los valores obtenidos.
Resultados
En la Figura 2 se presentan mapas típicos de módulo elástico y DFL, así como curvas de fuerza obtenidas en raíces de centeno y maíz por el método descrito. La Figura 2A muestra el módulo elástico y los mapas DFL obtenidos en la sección transversal de la raíz primaria de centeno. Las áreas blancas en el mapa de módulos (Figura 2A, izquierda) corresponden a una sobreestimación errónea del módulo de Young debido a que el escáner alcanzó su límite en la dirección z. Esta imagen no es conveniente para ser utilizada como un mapa externo para una selección adicional de curvas de fuerza satisfactorias. El mapa de señal DFL (mapa de deflexión/error) que se presenta a la derecha (Figura 2A) es más adecuado para este propósito.
Los mapas de módulos de las secciones transversales y longitudinales de la raíz de maíz se muestran en la Figura 2B,C. El escáner que se ha extendido completamente al intentar llegar a la parte inferior de la muestra puede dar lugar a mediciones erróneas e incluso escaneos interrumpidos (parte superior de la Figura 2C). A veces, después de obtener un buen escaneo en modo de contacto, el instrumento contrae repentinamente el escáner por completo, lo que alarma de que ha alcanzado el límite máximo de dirección z cuando cambia al modo de fuerza-volumen. Significa que la muestra no se inmovilizó adecuadamente y flotó. Se debe preparar una nueva muestra.
La contaminación por agarosa también puede ser una razón para preparar una nueva muestra (Figura 2D, E). La presencia de agarosa se puede comprobar al obtener la primera exploración en el modo de contacto (paso 3.5). Idealmente, las paredes celulares y algunos fondos celulares deberían ser visibles en tales exploraciones (Figura 2D); sin embargo, en caso de inmovilización inexacta, la superficie puede cubrirse con agarosa (Figura 2E), que enmascara la topografía de la muestra.
La Figura 2F muestra cuatro curvas de fuerza diferentes registradas en diferentes puntos de la misma pared celular. La curva registrada en el punto 1 no muestra ninguna línea de base. Significa que no hubo separación de la punta en voladizo de la pared celular. El módulo calculado a partir de esta curva fue sobreestimado. La curva registrada en el punto 3 muestra un hombro en la parte que se aproxima. Este artefacto puede indicar que la pared celular estaba doblada. Ambas curvas registradas en los puntos 1 y 3 deben ser expulsadas. Los puntos 2 y 4 muestran curvas de fuerza satisfactorias con valores similares de módulos. Se pueden utilizar los siguientes criterios para distinguir las curvas adecuadas: i) el nivel de referencia debe ser evidente tanto en las partes de la curva que se aproximan como en las que se retraen; ii) no debe haber irregularidades tales como arcenes o fallas (aparecen como valores de fuerza constantes y una disminución repentina de los valores de fuerza en medio de la pendiente, respectivamente); iii) el modelo seleccionado debe ajustarse bien a la curva. Para todas las curvas seleccionadas, los valores máximos de fuerza aplicados deben ser similares. Una fuerza máxima aplicada que sea significativamente mayor o menor que el valor esperado también se puede utilizar como criterio para la expulsión de la curva. El uso de redes neuronales para descartar curvas de baja calidad19 puede acelerar el procesamiento de los resultados.

Figura 1: Pasos críticos en la preparación de la muestra. (A) Fragmento de raíz incrustado en un bloque de agarosa y montado en la etapa de vibratomo. (B) Sección de muestra colocada encima de una capa de agarosa al 1% e inmovilizada con agarosa adicional en una tapa de placa de Petri. Haga clic aquí para ver una versión más grande de esta figura.
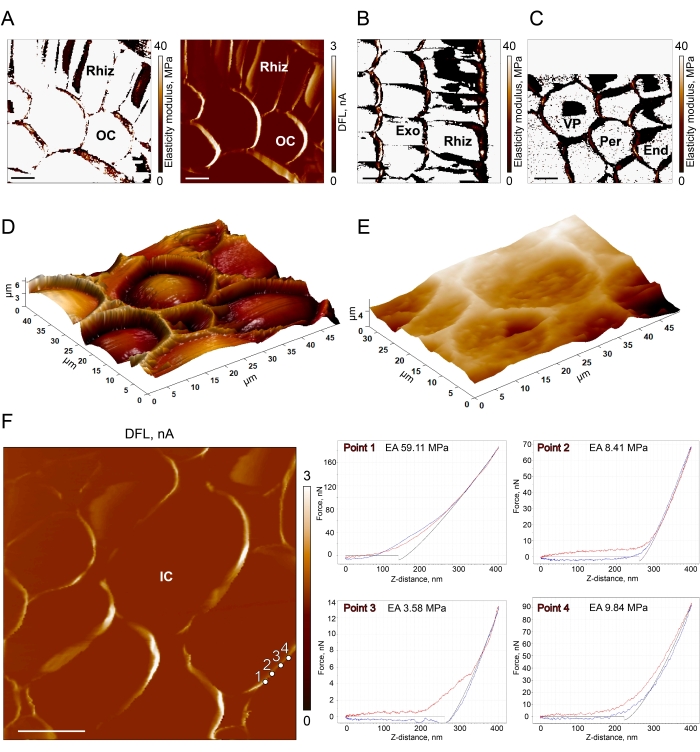
Figura 2: Imágenes AFM típicas y mediciones en raíces primarias . (A) Módulo de elasticidad y mapas DFL de una sección transversal de la raíz de centeno. Mapas completamente registrados (B) e interrumpidos (C) del módulo de elasticidad obtenidos en secciones longitudinales y transversales de la raíz de maíz. Vista 3D de secciones limpias (D) y cubiertas de agarosa (E) de raíces de maíz. (F) Un mapa DFL de una sección transversal de la raíz de maíz. Los puntos 1-4 en la pared celular muestran las posiciones donde se registraron las curvas de fuerza presentadas en el lado derecho de la imagen. La línea roja es para acercarse, la línea azul es para la retracción y la línea negra muestra el ajuste del modelo de mecánica de contacto. Las curvas registradas en los puntos 1 y 3 tienen artefactos y no se pueden utilizar para los cálculos. Las raíces de centeno se examinaron con puntas afiladas, y las raíces de maíz se examinaron con puntas esféricas. Abreviaturas: Rhiz = rizodérmis, Exo = exodermis, OC = corteza externa, IC = corteza interna, End = endodermis, Per = periciclo y VP = parénquima vascular. Barras de escala = 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las propiedades mecánicas de las paredes celulares primarias determinan la dirección y la tasa de crecimiento de las células vegetales y, por lo tanto, el tamaño y la forma futuros de la planta. El método basado en AFM presentado aquí complementa las técnicas existentes que se utilizan para estudiar las propiedades de las paredes celulares de las plantas. Permite investigar la elasticidad de las paredes celulares, que pertenecen a los tejidos internos de la planta. Utilizando el método presentado, se mapearon las propiedades mecánicas de las paredes celulares en diferentes tejidos de la raíz de maíz en crecimiento, y se construyó un modelo matemático basado en estas propiedades6. La raíz simulada respondió a la aplicación de presión imitando la turgencia por cambios en el tamaño lineal. Estos cambios fueron en el mismo rango y en la dirección opuesta a los exhibidos por una raíz recién extirpada en medio plasmolizante6.
La preparación de la muestra es crítica para este protocolo. El secado de la muestra debe evitarse durante toda la preparación. La colocación correcta del material vegetal a seccionar es una cuestión importante; Las paredes celulares deben estar orientadas estrictamente perpendiculares al futuro plano de escaneo. De lo contrario, se obtendrán curvas de fuerza-deformación insatisfactorias porque la pared celular se ha doblado o doblado. La sección incrustada en agarosa debe fijarse firmemente con agarosa adicional (Figura 2B). Este último no debe entrar en la muestra, de lo contrario, se medirán las propiedades de la agarosa. La parte más importante de este protocolo es filtrar las curvas de fuerza resultantes. Incluso el estudio de objetos modelo, como las rejillas de calibración AFM, puede resultar en una proporción significativa de curvas erróneas de fuerza-deformación22. El uso directo de los valores de módulo calculados sin analizar las curvas de fuerza-deformación subyacentes puede llevar a conclusiones incorrectas (Figura 2F).
La técnica no está limitada por la localización de la célula o el tamaño de los órganos de la planta. Sin embargo, los objetos que son demasiado pequeños son difíciles de cortar, orientar e inmovilizar. Las células con un lumen grande son difíciles de trabajar ya que existe una alta probabilidad de interrupción del escaneo (Figura 2C).
Con todos los beneficios de usar secciones de plantas no fijas preparadas con un vibratomo, hay al menos dos cuestiones cruciales: la posibilidad de desarrollar una reacción de estrés después de cortar material vegetal y la posibilidad de solubilización parcial del material de las paredes celulares cortadas. Ambos pueden conducir a cambios en la composición y propiedades de las paredes celulares. La presencia de respuesta inmediata al estrés en el corte se probó en Arabidopsis apices10. No se informó ningún efecto significativo sobre las propiedades observadas. Se realizaron experimentos para probar cambios en las propiedades de las paredes celulares cortadas durante su incubación en agua19. No hubo una tendencia estable en los valores aparentes del módulo de Young medidos en la misma pared de la raíz de maíz durante al menos un período de media hora19. Sin embargo, es mejor mantener el tiempo de los experimentos lo más corto posible y verificar cada espécimen para detectar tales cambios durante la incubación de la muestra en agua.
AFM es una técnica poderosa para estudiar las paredes celulares de las plantas. Sin embargo, es obvio que los cálculos del módulo de elasticidad, rigidez y adhesión se basan en varios supuestos que no se cumplen con las paredes celulares de las plantas. Todos los modelos de mecánica de contacto utilizados por AFM consideran el espécimen investigado como un semiespacio infinito de material isotrópico, lo que no es cierto para las paredes celulares de las plantas. Simultáneamente, se supone que la geometría y las propiedades del penetrador se miden con precisión y son constantes durante la vida útil del voladizo, lo que también puede ser erróneo. Además, las paredes celulares de las plantas exhiben un comportamiento mecánico complejo que involucra componentes elásticos, viscoelásticos y plásticos, y generalmente solo uno de estos se puede medir en un solo experimento. Sin embargo, los datos obtenidos utilizando métodos basados en AFM se correlacionan de manera confiable con el crecimiento celular de la planta y el rendimiento mecánico en varios órganos y especies 3,4,5,6. Todo ello hace que tanto la propia técnica como la comprensión de los datos obtenidos con ella puedan mejorarse.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Nos gustaría agradecer al Dr. Dmitry Suslov (Universidad Estatal de San Petersburgo, San Petersburgo, Rusia) y a la Prof. Mira Ponomareva (Instituto de Investigación Científica Tártara de Agricultura, FRC KazSC RAS, Kazán, Rusia) por proporcionar semillas de maíz y centeno, respectivamente. El método presentado fue desarrollado en el marco del Proyecto de la Fundación Rusa de Ciencias No. 18-14-00168 otorgado a LK. La parte del trabajo (obtención de los resultados presentados) fue realizada por AP con el apoyo financiero de la asignación gubernamental para el Centro Científico FRC Kazan de RAS.
Materiales
| Name | Company | Catalog Number | Comments |
| Agarose, low melting point | Helicon | B-5000-0.1 | for sample fixation |
| Brush | - | - | for section moving |
| Cantilevers | NanoTools, Germany | NT_B150_v0020-5 | Model: Biosphere B150-FM |
| Cantilevers | NT-MDT, Russia | FMG01/50 | Model: FMG01 |
| Cyanoacrylate adhesive | - | - | for vibratomy |
| Glass slides | Heinz Herenz | 1042000 | for vibratomy and AFM calibration |
| ImageAnalysis P9 Software | NT-MDT, Russia | - | for data analysis |
| Leica DM1000 epifluorescence microscope | Leica Biosystems, Germany | 11591301 | for section check |
| NaOCl | - | - | for seed sterilization |
| Nova PX 3.4.1 Software | NT-MDT, Russia | - | for experiments conducting |
| NTEGRA Prima microscope with HD controller | NT-MDT, Russia | - | for AFM and data acquisition |
| Petri dish 35 mm | Thermo Fisher Scientific | 153066 | for sample fixation |
| Tip pipette 1000 µL | Thermo Fisher Scientific | 4642092 | - |
| Tip pipette 2-20 µL | Thermo Fisher Scientific | 4642062 | - |
| Ultrapure water | - | - | - |
| Vibratome Leica VT 1000S | Leica Biosystems, Germany | 1404723512 | for sample sectioning |
Referencias
- Zerzour, R., Kroeger, J., Geitmann, A. Polar growth in pollen tubes is associated with spatially confined dynamic changes in cell mechanical properties. Developmental Biology. 334 (2), 437-446 (2009).
- Braybrook, S. A., Peaucelle, A. Mechano-chemical aspects of organ formation in Arabidopsis thaliana: the relationship between auxin and pectin. Plos One. 8 (3), 57813 (2013).
- Milani, P., et al. In vivo analysis of local wall stiffness at the shoot apical meristem in Arabidopsis using atomic force microscopy. Plant Journal. 67 (6), 1116-1123 (2011).
- Daher, F. B., et al. Anisotropic growth is achieved through the additive mechanical effect of material anisotropy and elastic asymmetry. Elife. 7, 38161 (2018).
- Peaucelle, A., Wightman, R., Hofte, H. The control of growth symmetry breaking in the Arabidopsis hypocotyl. Current Biology. 25 (13), 1746-1752 (2015).
- Petrova, A., Gorshkova, T., Kozlova, L. Gradients of cell wall nano-mechanical properties along and across elongating primary roots of maize. Journal of Experimental Botany. 72 (5), 1764-1781 (2021).
- Chiniquy, D., et al. Three novel rice genes closely related to the Arabidopsis IRX9, IRX9L, and IRX14 genes and their roles in xylan biosynthesis. Frontiers in Plant Science. 4, 83 (2013).
- Majda, M., et al. Mechanochemical polarization of contiguous cell walls shapes plant pavement cells. Developmental Cell. 43 (3), 290-304 (2017).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Peaucelle, A. AFM-based Mapping of the elastic properties of cell walls: at tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Beauzamy, L., Derr, J., Boudaoud, A. Quantifying hydrostatic pressure in plant cells by using indentation with an atomic force microscope. Biophysical Journal. 108 (10), 2448-2456 (2015).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysical Journal. 103 (3), 386-394 (2012).
- Yakubov, G. E., et al. Mapping nano-scale mechanical heterogeneity of primary plant cell walls. Journal of Experimental Botany. 67 (9), 2799-2816 (2016).
- Zdunek, A., Kurenda, A. Determination of the elastic properties of tomato fruit cells with an atomic force microscope. Sensors. 13 (9), 12175-12191 (2013).
- Evered, C., Majevadia, B., Thompson, D. S. Cell wall water content has a direct effect on extensibility in growing hypocotyls of sunflower (Helianthus annuus L). Journal of Experimental Botany. 58 (12), 3361-3371 (2007).
- Torode, T. A., et al. Branched pectic galactan in phloem-sieve-element cell walls: implications for cell mechanics. Plant Physiology. 176 (2), 1547-1558 (2018).
- Garcia, R. Nanomechanical mapping of soft materials with the atomic force microscope: methods, theory and applications. Chemical Society Reviews. 49 (16), 5850-5884 (2020).
- Kozlova, L., Petrova, A., Ananchenko, B., Gorshkova, T. Assessment of primary cell wall nanomechanical properties in internal cells of non-fixed maize roots. Plants-Basel. 8 (6), 172 (2019).
- Bovio, S., Long, Y. C., Moneger, F. Use of atomic force microscopy to measure mechanical properties and turgor pressure of plant cells and plant tissues. Journal of Visualized Experiments. (149), e59674 (2019).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. 1 (1), 41-57 (2019).
- Braunsmann, C., Schaffer, T. E. Note: Artificial neural networks for the automated analysis of force map data in atomic force microscopy. Review of Scientific Instruments. 85 (5), 056104 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados