Method Article
Aislamiento de F1-ATPasa de los Protista parásito Trypanosoma brucei
En este artículo
Resumen
Este protocolo describe la purificación de F1-ATPasa de la etapa de insectos cultivada de Trypanosoma brucei. El procedimiento produce un complejo altamente puro, homogéneo y activo adecuado para estudios estructurales y enzimáticos.
Resumen
F1-ATPasa es un subcomplex catalítico membranas extrínsecas de tipo F ATP sintasa, una enzima que utiliza la fuerza motriz de protones a través de membranas biológicas para producir trifosfato de adenosina (ATP). El aislamiento de la intacta F1-ATPasa de la fuente nativa es un requisito previo esencial para caracterizar la composición proteica, parámetros cinéticos y sensibilidad a los inhibidores de la enzima. Un altamente pura y homogénea F1-ATPasa puede ser utilizada para estudios estructurales, que proporcionan la penetración en mecanismos moleculares de la síntesis de ATP y a la hidrólisis. Este artículo describe un procedimiento para la purificación de la F1-ATPasa de Trypanosoma brucei, el agente causal de la tripanosomiasis africanas. F1-ATPasa está aislada de las vesículas mitocondriales, que son obtenidas por lisis hipotónica de tripanosomas en vitro cultivados. Las vesículas son fragmentadas mecánicamente por sonicación y F1-ATPasa se libera de la membrana interna mitocondrial por la extracción de cloroformo. El complejo enzimático es más purificado por intercambio del anión consecutivos y cromatografía por exclusión de tamaño. Técnicas de espectrometría de masas sensibles demostraron que el complejo purificado está desprovisto de cualquier contaminantes de la proteína y, por lo tanto, representa el material adecuado para la determinación de la estructura por cristalografía de rayos x o microscopia del cryo-electrón. Los aislados de F1-ATPasa exhibe actividad hidrolítica de la ATP, que puede ser inhibida totalmente por la azida sódica, un inhibidor potente del tipo F ATP sintasas. El complejo purificado permanece estable y activo por lo menos tres días a temperatura ambiente. Precipitación por sulfato de amonio se utiliza para almacenamiento a largo plazo. Procedimientos similares se han utilizado para la purificación de F1- ATPasas de los tejidos de mamíferos y plantas, levaduras y bacterias. Así, el protocolo presentado puede servir como una guía para la F1-aislamiento de ATPasa de otros organismos.
Introducción
El tipo F ATP sintasas son membrana-limite rotación complejos de multiproteínas translocación de protón de pareja a través de membranas transductoras de energía de las bacterias, mitocondrias y cloroplastos con la formación de ATP. Detalles moleculares del mecanismo rotacional de la síntesis de ATP son conocidos principalmente por los estudios estructurales de purificada bacterianas y mitocondriales ATP sintasas y sus Subcomplejos de mando1. Tipo F ATP sintasa se organiza en moléculas de membrana-intrínsecas y extrínsecas de la membrana. La parte extrínseca de la membrana, conocida como F1-ATPasa, contiene tres sitios catalíticos, donde se produce la fosforilación del Adenosín difosfato (ADP) a ATP o la reacción reversa. F1-ATPasa puede liberarse experimentalmente la parte intrínseca de la membrana mientras que conserva su capacidad de hidrolizar pero no sintetizar, ATP. El sector unida a la membrana, llamado Fo, media la translocación de la proteína, que impulsa la rotación de la parte central de la enzima. La F1 y Fo sectores están conectados por los tallos centrales y periféricos.
Los primeros intentos purificar la F1-ATPasa de la levadura de florecimiento y la fecha de las mitocondrias de corazón bovino hacia la década de 1960. Estos protocolos utilizados extraen las mitocondrias, que fueron interrumpidas por sonicación, fraccionado por la precipitación de sulfato amónico o protamina, seguido de cromatografía opcional pasos y tratamiento térmico2,3,4 ,5,6. La purificación fue grandemente mejorada y simplificada por el uso de cloroformo, que libera fácilmente la F1-ATPasa de la membrana mitocondrial fragmentos7. La extracción de cloroformo entonces fue utilizada para extraer F1- ATPasas de varios animales, plantas y fuentes bacterianas (p. ej., hígado de rata8, maíz9, Arum maculatum10y de Escherichia coli 11). Más purificación de liberado cloroformo F1-ATPasa por cromatografía de afinidad o de exclusión de tamaño (SEC) produjo una proteína altamente pura compleja, que era conveniente para la determinación de la estructura de alta resolución por cristalografía de rayos x, como documentado por las estructuras de F1-ATPasa de corazón bovino12,13 y14de la Saccharomyces cerevisiae. F1-estructuras de ATPasa también se determinaron de organismos que son difíciles de cultivar y, por lo tanto, la cantidad de la materia biológica inicial fue limitada. En este caso, F1-ATPase subunidades fueron artificialmente expresados y montados en el complejo de e. coli, y la enzima entera heteróloga se purificó por cromatografía de afinidad a través de una subunidad etiquetada. Tal planteamiento condujo a la determinación de F1-estructuras de la ATPasa de dos especies bacterianas termófilas, Geobacillus stearothermophilus15 y thermarum Caldalkalibacillus16, 17. sin embargo, esta metodología es algo inadecuada para eucariotas F1- ATPasas puesto que se basa en el aparato protheosynthetic procariotas procesamiento postraduccional y montaje complejo.
La extracción de cloroformo-basado fue utilizada previamente para aislar F1- ATPasas de trematodos unicelulares parásitos Trypanosoma cruzi18 y T. brucei19importantes patógenos mamíferos causando americano y Tripanosomiasis africanas, respectivamente y de parásito de insectos monogénica Crithidia fasciculata20. Estas purificaciones condujeron sólo a una simple Descripción de la F1- ATPasas, puesto que no hay aplicaciones posteriores fueron utilizadas para caracterizar completamente la composición, estructura y características enzimáticas del complejo. Este artículo describe un método optimizado para la F1-purificación de la ATPasa de la etapa del ciclo de vida de insectos cultivados de T. brucei. El método se desarrolla en base a los protocolos establecidos para el aislamiento de bovinos y levadura F1- ATPasas21,22. El procedimiento produce enzima altamente pura y homogénea adecuada para en vitro enzimática inhibitoria ensayos y, proteómicos detallada caracterización por espectrometría de masas23y estructura determinación24. El protocolo de purificación y el conocimiento de la F1-estructura de la ATPasa a nivel atómico abre una posibilidad para el diseño de pantallas para identificar inhibidores de molécula pequeña y ayudar en el desarrollo de nuevos fármacos contra la tripanosomiasis africanas. Por otra parte, el protocolo puede ser adaptado para purificar F1-ATPasa de otros organismos.
Protocolo
1. tampones y soluciones
- Preparar las soluciones a continuación. Degas todos los búferes para cromatografía de líquidos. Añadir inhibidores de proteasa, ADP y benzamidine justo antes del uso.
- Preparar tampón de Tris buffer A: 50 mM con ácido clorhídrico (Tris-HCl) pH 8.0, sacarosa de 0,25 M, 5 mM benzamidine, 5 mM aminocaproico ácido (ACA) y la proteasa inhibidores (10 amastatin μm, 50 μm bestatina, 50 μm pepstatin, leupeptin μm 50 y 50 μm diprotin A).
- Preparación de tampón B: 50 mM Tris-HCl pH 8.0, sacarosa de 0,25 M, ácido de 4 mM etilendiaminotetracético (EDTA), 5 mM benzamidine, 5 mM ACA, 1 mM de ADP e inhibidores de la proteasa (10 amastatin μm, 50 μm bestatina, 50 μm pepstatin, leupeptin μm 50 y diprotin 50 μm A).
- Preparar memoria intermedia de la columna Q: 20 mM Tris-HCl pH 8.0, 4 mM EDTA, 10 mM MgSO4, 5 mM benzamidine, 5 mM ACA y 1 mM de ADP.
- Preparar el tampón de elución de la columna Q: almacenador intermediario de la columna Q con 1 M de NaCl.
- Preparar buffer de seg: 20 mM Tris-HCl de pH 8.0, 10 mM MgSO4, 100 mM NaCl, 1 mM de ADP.
- Preparar el cloroformo impregnado 2 M Tris-HCl, pH 8.5. Mezcla de cloroformo con 2 M Tris-HCl pH 8.5 en proporción de aproximadamente 1:1 en una botella de tapón de rosca, agitar, dejar que las fases orgánicas y acuosas separadas y medir el pH en la capa acuosa superior con una tira de papel indicador de pH. Almacenar a temperatura ambiente. Justo antes del uso agitar otra vez y dejar que las fases separadas. Utilizar la capa inferior de cloroformo.
PRECAUCIÓN: El cloroformo es volátil e irritante para los ojos y la piel. Trabajar en una campana de humos. Utilice gafas de seguridad cuando se sacude.
2. preparación de las partículas sub-mitocondrial
- Resuspender las vesículas mitocondriales (mitoplasts) aisladas por lisis hipotónica25 de 1 x 1011 2 x 1011 células de T. brucei procíclicas en 5 mL de tampón de helada A. Mantenga la muestra refrigerada hasta el paso 3.2.
- Determinar la concentración de proteína en la suspensión por el bicinchoninic ácido (BCA) proteína ensayo26 según las instrucciones del fabricante.
- Utilizar una serie de diluciones de albúmina de suero bovino (BSA) en agua ultrapura para construir la curva estándar. Diluir una pequeña cantidad de muestra de 20 - 100 veces con agua ultrapura para encajar en los estándares de la gama de BSA.
- Calcular la cantidad de proteína total en la muestra y llevar a la concentración de proteína a 16 mg/mL por dilución con tampón adicional A.
- Fragmento mitoplasts en piezas de membrana y vesículas invertidas por sonicación de la suspensión de 7 x 15 s con un total de energía de 70 a 100 J por impulso con una micropunta de 3.9 mm de diámetro. Si el homogenizador ultrasónico no muestra la salida de energía, empezar la optimización en el 50% de la potencia máxima. Incubar la muestra en hielo por 30 s entre impulsos. Después de la sonicación, la suspensión se convierte en un poco más oscura.
- Fragmentos de sedimentos la membrana por ultracentrifugación a 54.000 x g durante 16 horas o a 98.000 x g durante 5 h a 4 ° C. Decantar el sobrenadante y proceder a la extracción de cloroformo, o flash-freeze el sedimento en nitrógeno líquido y almacenarlo a-80 ° C.
3. liberación de F1-ATPasa de membrana por cloroformo
- Resuspender el precipitado de las membranas mitocondriales en tampón B con la ayuda de un pequeño homogeneizadores Dounce. Calcular el volumen de tampón B basado en la cantidad total de buffer usado en fórmula los pasos 2.1 y 2.2 siguiente: volumen (tampón B) = volumen (tampón A) x 12/21. Transferir la suspensión a un tubo cónico de 15 o 50 mL.
- Retire la muestra de hielo y de ahora en adelante, mantener la muestra y todas las soluciones para ser utilizado a temperatura ambiente.
- Añadir cloroformo impregnado 2 M Tris-HCl pH 8,5; el volumen de cloroformo para ser añadido es igual a la mitad el volumen de la suspensión. Cierre la tapa firmemente. Agitar vigorosamente durante exactamente 20 s. lo Centrifugue inmediatamente a 8.400 x g durante 5 min a temperatura ambiente.
- Transferir la fase acuosa nublada superior a 1,6 mL microtubos. Añadir inhibidores de la proteasa (10 amastatin μm, 50 μm bestatina, 50 μm pepstatin, 50 μm leupeptin y diprotin μm 50 A) para reemplazar a los inhibidores de eliminar mediante el tratamiento con cloroformo. Centrifugar las muestras a 13.000 x g durante 30 min a temperatura ambiente. Transferir el sobrenadante a microtubos fresca y repita la centrifugación para eliminar cualquier material insoluble.
4. intercambio cromatografía
- Equilibrar la columna de intercambio (Q) del anión de 5 mL unida a un sistema de cromatografía líquida rápida de proteínas con el buffer Q columna a un flujo de 5 mL/min hasta que la absorbancia a 280 nm y la conductividad estabilizan (aproximadamente 50 mL de tampón).
- Cargar el sobrenadante del paso 3.3 en la columna de equilibrado en un caudal de 1 mL/min de espera hasta que la absorbancia a 280 nm se estabiliza en el fondo. Aplicar un degradado lineal de 25 mL del buffer de elución Q columna de 0% al 100% con un caudal de 0,5 mL/min., recoger fracciones de 1 mL.
- Análisis de las fracciones individuales correspondientes al pico de elución más importantes para la actividad hidrolítica de la ATP por la ATPasa de Pullman ensayo2 a pH 8.0. Utilice 10 μl de cada fracción por 1 mL de mezcla de reacción. Las fracciones que exhiben actividad ATPasa de la piscina. Opcionalmente, separado 10 μl de cada fracción en electroforesis de poliacrilamida gel de fosfato de sodio dodecyl (SDS-PAGE) y manchar el gel por azul de Coomassie visualizar individual F1-ATPase subunidades y las proteínas contaminantes.
- Concentrado de la muestra combinada por ultrafiltración de la membrana utilizando una columna de vuelta con un filtro 100.000 de MWCO PES a 200-500 μl. proceder a SEC o a tienda la muestra durante la noche a temperatura ambiente.
5. tamaño-exclusión cromatografía
- Equilibrar la columna seg conectada a un sistema de cromatografía de líquidos con por lo menos 48 mL (dos volúmenes de columna) del búfer seg con un caudal de 0,5 mL/min.
- Aplicar la muestra en la columna y ejecute cromatografía a un caudal de 0.25 mL/min recogemos fracciones de 0,25 mL.
- Correr 10 μl de las fracciones que corresponden a los picos de la traza de absorbancia UV280nm en SDS-PAGE y tinción por azul de Coomassie. El primer pico importante contiene la F1-ATPasa. Análisis de las fracciones correspondientes a este pico para el ATP hidrolítica actividad y azida de sensibilidad por el análisis de la ATPasa de Pullman. Determinar la concentración de proteína por el ensayo BCA.
- Mantener la purificada F1-ATPasa a temperatura ambiente y utilizarlo en 3 d después de la purificación para aplicaciones posteriores. Por otra parte, concentrar la muestra mediante una columna de vuelta con filtro 100.000 MWCO PSA > 1,5 mg / ml, precipitado por mezcla con sulfato de amonio saturado ajustado a pH 8.0 (1.2 x el volumen) y almacenar a 4 ° C.
Resultados
Una purificación típico (figura 1) inicia con vesículas mitocondriales (mitoplasts) aisladas en el gradiente de Percoll de hypotonically sometidas a lisis 1 x 1011 a 2 x 1011 procíclicas T. brucei células25 cultivadas en estándar glucosa media27de SDM-79. Los mitoplasts están fragmentadas por sonicación, hilada, y se descarta el sobrenadante que contiene la matriz. Las membranas mitocondriales son tratadas con cloroformo para liberar la F1-ATPasa. Después de la centrifugación, la fase orgánica y la interfase precipitado se descartan. La fase acuosa se fracciona por cromatografía de intercambio iónico en amonio cuaternario, un intercambiador de aniones fuertes (figura 2A). Las fracciones que corresponden a la elución de gran pico y contener la F1-ATPasa son agrupados y concentrados. Este material sirve como entrada para la SEC, que elimina las impurezas residuales. El contaminante principal es dihydrolipoyl dehydrogenase, que elutes de la columna de la SEC como un pico discreto, marcado por la barra verde oscurezca en la figura 2B. F1-ATPasa elutes en el primer pico dominante, en gran medida simétrico (figura 2B).
El progreso de la purificación es seguido por el ensayo de proteína BCA (o un ensayo de proteína común), SDS-PAGE y el monitoreo de la actividad de la ATPasa. Se mide la tasa de hidrólisis de ATP la ATP Pullman ensayo2, basado en la disminución de absorbancia del NADH en la reacción acoplada de la regeneración. Azida sódica, un inhibidor establecido de F1-ATPasa, se utiliza en una concentración de 2 mM para determinar la proporción de la F1-ATPasa-específico hidrólisis de ATP. Normalmente, el material de entrada contiene aproximadamente 150-300 mg de proteínas mitocondriales, dependiendo del número de células utilizadas como la fuente de las vesículas mitocondriales. La proporción sensible a azida de la total actividad de la ATPasa es alrededor 30-40% en esta etapa. Después de la extracción de cloroformo, más del 90% de la actividad de la ATPasa en la muestra se contribuyó a la F1-ATPasa. La purificada F1- ATPasa es casi totalmente sensible al tratamiento azida (la ATPasa residual mínima actividad puede atribuirse a la autólisis de fondo ATP) y representa alrededor del 1% de la masa de entrada de la proteína, con un rendimiento aproximado de 1 - 1,5 mg de F1-ATPasa por las células 1 x 1011 (tabla 1). Un patrón de bandas típico después de la separación de la purificada F1-ATPasa en gel de SDS-PAGE seguido por el azul de Coomassie tinción se muestra en la figura 2. Las proteínas fueron identificadas por la masa del péptido toma de huellas dactilares y caracteriza detalladamente por varios enfoques de espectrometría de masas en23. Esporádicos bandas débiles visibles por encima de la banda de la β-subunidad representan Subcomplejos mando del α3β3 casco (dímeros y oligómeros de subunidades α y β) y están desprovistos de cualquier contaminación detectable por técnicas de espectrometría de masas sensibles. La purificada F1-ATPasa puede almacenarse por hasta varios días en el búfer de seg a temperatura ambiente. Por otra parte, la F1-ATPasa concentrada a ≥ 2 mg/mL se puede precipitar por un volumen igual de sulfato de amonio saturado en el búfer de la SEC, con pH ajustado a 8.0 y almacenado a 4 ° C. Durante al menos seis meses después de la precipitación, la enzima activa con ninguna degradación evidente de cualquier subunidad puede obtenerse redissolving el material precipitado en el segundo buffer o solución similar. Sin embargo, más de un mes de almacenamiento no es adecuado para la cristalización, determinado empíricamente.

Figura 1 : Esquema del procedimiento de purificación de. Haga clic aquí para ver una versión más grande de esta figura.
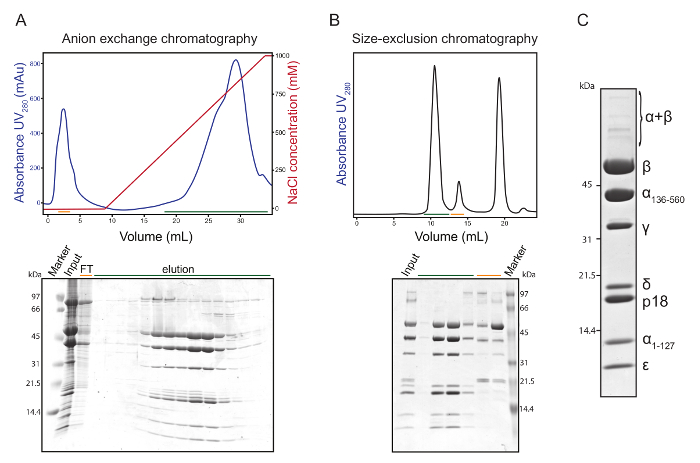
Figura 2 : Purificación de dos pasos de la libertad de cloroformo F1-ATPasa por cromatografía líquida de. (A) Perfil de elución de la cromatografía de intercambio aniónico (panel superior) y las fracciones separadas en el gel de SDS-PAGE de Tris glicina 10% - 20% teñido con colorante azul de Coomassie (panel inferior). Azul trace: absorbancia de UV a 280 nm; huella roja: concentración de NaCl en el tampón de elución; Entrada: F1-ATPasa por cloroformo; FT: flujo a través. (B) Perfil de elución del SEC (panel superior) y las fracciones separadas en el gel SDS-PAGE teñido con colorante azul de Coomassie (panel inferior). Entrada: combinaron fracciones de cromatografía de intercambio aniónico que contiene F1-ATPasa. Las barras de colores en los paneles A y B marcan las fracciones en los perfiles de elución que fueron analizadas por SDS-PAGE y los correspondientes carriles en el gel respectivo. (C) identidad de proteínas individuales de la F aislado1-ATPasa identificados por espectrometría de masas. Haga clic aquí para ver una versión más grande de esta figura.
| Concentración de proteínas (mg/mL) | Proteínas totales (mg) | Proporción de material de entrada (%) | Actividad (ΜmolATP x mg-1 x min-1) | Sensibilidad de la azida (%) | |
| Vesículas mitocondriales en tampón A | 16.2 | 170 | 100 | 1.3 | 25-35 |
| Membranas mitocondriales en tampón B | 18.6 | 97 | 57 | 2.4 | 35-45 |
| Fracciones extraídas de cloroformo | 2.5 | 7.9 | 4.7 | 12 | 91-95 |
| F1-ATPasa después de columna Q | - | 2.2 | 1.3 | 23 | 92-96 |
| F1-ATPasa después de la filtración de gel | - | 1.6 | 0,93 | 48 | 93-98 |
Tabla 1: Ejemplo del desarrollo típico y de rendimiento de la F1-purificación de la ATPasa de las mitocondrias aisladas de células de T. brucei de 1 x 1011 procíclicas.
Discusión
El protocolo para F1-purificación de ATPasa de T. brucei se desarrolló en base a métodos previamente publicados para el aislamiento de F1-complejos de ATPasa de otras especies13,14. El método no requiere ninguna modificación genética (p. ej., etiquetado) y produce un complejo activo con todas las subunidades presentes. El paso crucial es la liberación facilitada de cloroformo de la F1-ATPasa de la membrana unida parte de la enzima. En purificaciones de todas las especies eucariotas descritas hasta ahora, el liberado subcomplex contiene subunidades α, β, γ, δ y ε en una estequiometría de 3:3:1:1:1. En T. brucei, F1-ATPasa contiene un adicional tres copias de la subunidad p18, un novedoso componente restringido a euglenozoan protistas23. Además, la α-subunidad del euglenozoan proteolytically se divide en dos fragmentos, tanto estable asociada con el complejo24,28,29. La subunidad OSCP (oligomycin-sensibilidad-confiriendo proteína), que une a la F1-moiety al tallo periféricas30, está ausente del complejo liberado, que está de acuerdo con F1-purificaciones de la ATPasa por cloroformo extracción de otras especies13,14.
Publicado por cloroformo F1-ATPasa está más purificada por cromatografía líquida. En el caso de la especie bovina F1-ATPasa, paso de sólo una cromatografía, cromatografía por exclusión de tamaño, es suficiente para obtener un complejo altamente puro y activo31. Sin embargo, la sola configuración de SEC era insuficiente para la purificación de la T. brucei F1-ATPasa, como las fracciones enriquecidas de F1-ATPasa contiene contaminantes adicionales de la proteína, principalmente delta-1-pyrroline-5-carboxylate deshidrogenasa. Por lo tanto, cromatografía de intercambio aniónico fue presentada ante la SEC como el primer y principal paso purificador, y la SEC sirve como el posterior procedimiento de pulido. Para los experimentos de cristalización, el uso de la columna aumento de Superdex 200 demostró para ser esencial, desde esta columna siempre material que permitió el crecimiento de cristales de buena calidad. Es probable que la resolución de la columna habilitada la separación de una pequeña proporción de complejos incompletas que interfieren con la cristalización. Sin embargo, para aplicaciones que no sean de cristalización, la separación mediante la columna de Superdex 200 fue igualmente satisfactoria.
Para proteger a la F1-ATPasa compleja de proteólisis parcial por protease(s) desconocido presente en el mitocondrial lisada, las reservas iniciales A y B contienen una amplia gama de inhibidores de la proteasa. El impacto de los inhibidores en la proteolisis de F1-subunidades de ATPasa no ha sido probado y, probablemente, la presencia de algunos de los inhibidores es redundante. Para el paso de la SEC, los inhibidores no se agregan, como las proteasas contaminantes se quitan de la F1-muestra de la ATPasa por la extracción con cloroformo o el primer paso de la cromatografía.
El protocolo de pasos conduce inevitablemente a pérdidas parciales de las F1-ATPasa. La pérdida más significativa (25% - 45% del total) se produce durante la etapa de concentración por ultrafiltración de la membrana en una columna de vuelta después de la cromatografía de intercambio aniónico. F1-ATPasa probablemente se adhiere a la membrana de la columna de vuelta. Así, para algunas aplicaciones posteriores que no exigen una alta pureza y concentración muestra (e.g., ensayos enzimáticos y pantallas inhibitorios), F1-ATPasa puede ser utilizada inmediatamente después de la cromatografía de intercambio aniónico (véase figura 2B, carril de entrada).
Aunque la purificación de F1-ATPasa de diferentes organismos varía en detalle, el flujo de trabajo general sigue siendo el mismo. Por lo tanto, este protocolo puede servir como una guía para el desarrollo de la F1-protocolo de aislamiento de ATPasa de otras fuentes abundantes, como los tejidos o células cultivable en gran escala.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Ministerio de educación ERC CZ conceder LL1205, la concesión de la beca Agencia de República Checa 18-17529S y por FEDER/FSE del proyecto centro de investigación de patogenicidad y virulencia de los parásitos (no. CZ.02.1.01/0.0/0.0/16_019/0000759).
Materiales
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Adenosin Diphosphate Disodium Salt (ADP) | Applichem | A0948 | |
| Amastatin Hydrochloride | Glantham Life Sciences | GA1330 | |
| Aminocaproic Acid | Applichem | A2266 | |
| BCA Protein Assay Kit | ThermoFischer Scientific/Pierce | 23225 | |
| Benzamidine Hydrochloride | Calbiochem | 199001 | |
| Bestatin Hydrochloride | Sigma Aldrich/Merck | B8385 | |
| Chloroform | Any supplier | ||
| cOmplete Tablets, Mini EDTA-free | Roche | 4693159001 | Protease inhibitor cocktail tablets |
| Ethylenediaminetetraacetic Acid (EDTA) | Any supplier | ||
| Hydrochloric Acid | Any supplier | For pH adjustment | |
| Ile-Pro-Ile | Sigma Aldrich/Merck | I9759 | Alias Diprotin A |
| Leupeptin | Sigma Aldrich/Merck | L2884 | |
| Magnesium Sulfate Heptahydrate | Any supplier | ||
| Pepstatin A | Sigma Aldrich/Merck | P5318 | |
| Protein Electrophoresis System | Any supplier | ||
| Sodium Chloride | Any supplier | ||
| Sucrose | Any supplier | ||
| Tris | Any supplier | ||
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Centrifuge Tubes for SW60Ti, Polyallomer | Beckman Coulture | 328874 | |
| DounceTissues Homogenizer 2 mL | Any supplier | ||
| Glass Vacuum Filtration Device | Sartorius | 516-7017 | Degasing solutions for liquid chromatography |
| HiTrap Q HP, 5 mL | GE Healthcare Life Sciences | 17115401 | Anion exchange chromatography column |
| Regenaretad Cellulose Membrane Filters, pore size 0.45 μm, diameter 47 mm | Sartorius | 18406--47------N | Degasing solutions for liquid chromatography |
| Superdex 200 Increase 10/300 GL | GE Healthcare Life Sciences | 29091596 | Size-exclusion chromatography column |
| Vivaspin 6 MWCO 100 kDa PES | Sartorius | VS0641 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AKTA Pure 25 | GE Healthcare Life Sciences | 29018224 | Or similar FPLC system |
| Spectrophotometer Shimadzu UV-1601 | Shimadzu | Or similar spectrophotometer with kinetic assay mode | |
| Ultracentrifuge Beckman Optima with SW60Ti Rotor | Beckman Coulture | Or similar ultracentrifuge and rotor | |
| Ultrasonic Homogenizer with Thin Probe, Model 3000 | BioLogics | 0-127-0001 | Or similar ultrasonic homogenizer |
Referencias
- Walker, J. E., Wikström, M. Structure, mechanism and regulation of ATP synthases. Mechanisms of Primary Energy Transduction in Biology. , 338-373 (2017).
- Pullman, M. E., Penefsky, H. S., Datta, A., Racker, E. Partial resolution of the enzymes catalyzing oxidative phosphorylation. I. Purification and properties of soluble dinitrophenol-stimulated adenosine triphosphatase. The Journal of Biological Chemistry. 235, 3322-3329 (1960).
- Schatz, G., Penefsky, H. S., Racker, E. Partial resolution of the enzymes catalyzing oxidative phosphorylation. XIV. The Journal of Biological Chemistry. 242 (10), 2552-2560 (1967).
- Racker, E., Horstman, L. L. Partial resolution of the enzymes catalyzing oxidative phosphorylation. 13. Structure and function of submitochondrial particles completely resolved with respect to coupling factor. The Journal of Biological Chemistry. 242 (10), 2547-2551 (1967).
- Senior, A. E., Brooks, J. C. Studies on the mitochondrial oligomycin-insensitive ATPase. I. An improved method of purification and the behavior of the enzyme in solutions of various depolymerizing agents. Archives of Biochemistry and Biophysics. 140 (1), 257-266 (1970).
- Tzagoloff, A., Meagher, P. Assembly of the mitochondrial membrane system. V. Properties of a dispersed preparation of the rutamycin-sensitive adenosine triphosphatase of yeast mitochondria. The Journal of Biological Chemistry. 246 (23), 7328-7336 (1971).
- Beechey, R. B., Hubbard, S. A., Linnett, P. E., Mitchell, A. D., Munn, E. A. A simple and rapid method for the preparation of adenosine triphosphatase from submitochondrial particles. Biochemical Journal. 148 (3), 533-537 (1975).
- Tyler, D. D., Webb, P. R. Purification and properties of the adenosine triphosphatase released from the liver mitochondrial membrane by chloroform. Biochemical Journal. 178 (2), 289-297 (1979).
- Hack, E., Leaver, C. J. The alpha-subunit of the maize F1-ATPase is synthesised in the mitochondrion. The EMBO Journal. 2 (10), 1783-1789 (1983).
- Dunn, P. P., Slabas, A. R., Moore, A. L. Purification of F1-ATPase from cuckoo-pint (Arum maculatum) mitochondria. A comparison of subunit composition with that of rat liver F1-ATPase. Biochemical Journal. 225 (3), 821-824 (1985).
- Satre, M., Bof, M., Vignais, P. V. Interaction of Escherichia coli adenosine triphosphatase with aurovertin and citreoviridin: inhibition and fluorescence studies. Journal of Bacteriology. 142 (3), 768-776 (1980).
- Abrahams, J. P., Leslie, A. G., Lutter, R., Walker, J. E. Structure at 2.8 Å resolution of F1ATPase from bovine heart mitochondria. Nature. 370 (6491), 621-628 (1994).
- Lutter, R., et al. Crystallization of F1-ATPase from bovine heart mitochondria. Journal of Molecular Biology. 229 (3), 787-790 (1993).
- Kabaleeswaran, V., Puri, N., Walker, J. E., Leslie, A. G., Mueller, D. M. Novel features of the rotary catalytic mechanism revealed in the structure of yeast F1-ATPase. The EMBO Journal. 25 (22), 5433-5442 (2006).
- Shirakihara, Y., et al. Structure of a thermophilic F1-ATPase inhibited by an epsilon-subunit: deeper insight into the epsilon-inhibition mechanism. The FEBS Journal. 282 (15), 2895-2913 (2015).
- Stocker, A., Keis, S., Cook, G. M., Dimroth, P. Purification, crystallization, and properties of F1-ATPase complexes from the thermoalkaliphilic Bacillus sp. strain TA2.A1. Journal of Structural Biology. 152 (2), 140-145 (2005).
- Ferguson, S. A., Cook, G. M., Montgomery, M. G., Leslie, A. G., Walker, J. E. Regulation of the thermoalkaliphilic F1-ATPase from Caldalkalibacillus thermarum. Proceedings of the National Academy of Sciences of the United States of America. 113 (39), 10860-10865 (2016).
- Cataldi de Flombaum, M. A., Frasch, A. C. C., Stoppani, A. O. M. Adenosine triphosphatase from Trypanosoma cruzi: purification and properties. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. 65 (1), 103-109 (1980).
- Williams, N., Frank, P. H. The mitochondrial ATP synthase of Trypanosoma brucei: isolation and characterization of the intact F1 moiety. Molecular and Biochemical Parasitology. 43 (1), 125-132 (1990).
- Higa, A. I., Cazzulo, J. J. Mg2+-activated adenosine triphosphatase from Crithidia fasciculata: purification and inhibition by suramin and efrapeptin. Molecular and Biochemical Parasitology. 3 (6), 357-367 (1981).
- Walker, J. E., et al. Primary structure and subunit stoichiometry of F1-ATPase from bovine mitochondria. Journal of Molecular Biology. 184 (4), 677-701 (1985).
- Mueller, D. M., et al. Ni-chelate-affinity purification and crystallization of the yeast mitochondrial F1-ATPase. Protein Expression and Purification. 37 (2), 479-485 (2004).
- Gahura, O., et al. The F1-ATPase from Trypanosoma brucei is elaborated by three copies of an additional p18-subunit. The FEBS Journal. 285 (3), 614-628 (2018).
- Montgomery, M. G., Gahura, O., Leslie, A. G. W., Zikova, A., Walker, J. E. ATP synthase from Trypanosoma brucei has an elaborated canonical F1-domain and conventional catalytic sites. Proceedings of the National Academy of Sciences of the United States of America. 115 (9), 2102-2107 (2018).
- Schneider, A., Charriere, F., Pusnik, M., Horn, E. K. Isolation of mitochondria from procyclic Trypanosoma brucei. Methods in Molecular Biology. 372, 67-80 (2007).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Wirtz, E., Leal, S., Ochatt, C., Cross, G. A. A tightly regulated inducible expression system for conditional gene knock-outs and dominant-negative genetics in Trypanosoma brucei. Molecular and Biochemical Parasitology. 99 (1), 89-101 (1999).
- Speijer, D., et al. Characterization of the respiratory chain from cultured Crithidia fasciculata. Molecular and Biochemical Parasitology. 85 (2), 171-186 (1997).
- Nelson, R. E., Aphasizheva, I., Falick, A. M., Nebohacova, M., Simpson, L. The I-complex in Leishmania tarentolae is an uniquely-structured F1-ATPase. Molecular and Biochemical Parasitology. 135 (2), 221-224 (2004).
- Carbajo, R. J., et al. How the N-terminal domain of the OSCP subunit of bovine F1Fo-ATP synthase interacts with the N-terminal region of an alpha subunit. Journal of Molecular Biology. 368 (2), 310-318 (2007).
- Bowler, M. W., Montgomery, M. G., Leslie, A. G., Walker, J. E. Ground state structure of F1-ATPase from bovine heart mitochondria at 1.9 Å resolution. The Journal of Biological Chemistry. 282 (19), 14238-14242 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados