Method Article
La medición de nitritos y nitratos, los metabolitos en el Oxido Nítrico, en Materiales Biológicos utilizando el método de quimioluminiscencia
En este artículo
Resumen
Nitric oxide (NO) is an important signaling molecule in vascular homeostasis. NO production in vivo is too low for direct measurement. Chemiluminescence provides useful insight into NO cycle via measuring its precursors and oxidation products, nitrite and nitrate. Nitrite / nitrate determination in body tissues and fluids is explained.
Resumen
El óxido nítrico (NO) es una de las principales moléculas de regulador en la homeostasis vascular y también un neurotransmisor. producido enzimáticamente NO se oxida en nitrito y nitrato por interacciones con diversas proteínas oxi-hemo y otras vías todavía no bien conocidas. El proceso inverso, la reducción de nitrito y nitrato en NO había sido descubierto en mamíferos en la última década y que se destaca por ser una de las posibles vías para prevenir o aliviar una amplia gama de enfermedades cardiovasculares, metabólicas y trastornos musculares que se cree estar asociado con niveles disminuidos de NO. Por tanto, es importante para estimar la cantidad de NO y sus metabolitos en diferentes compartimentos del cuerpo - la sangre, fluidos corporales y los diversos tejidos. La sangre, debido a su fácil accesibilidad, es el compartimiento preferido utilizado para la estimación de metabolitos de NO. Debido a su corta vida (pocos milisegundos) y baja concentración sub-nanomolar, mediciones fiables directas de sangre NO <em> in vivo presentan grandes dificultades técnicas. Por lo tanto la disponibilidad de NO se estima por lo general basado en la cantidad de sus productos de oxidación, nitrito y nitrato. Estos dos metabolitos siempre se miden por separado. Hay varios métodos bien establecidos para determinar sus concentraciones en los fluidos y tejidos biológicos. Aquí se presenta un protocolo para el método de quimioluminiscencia (CL), basado en la detección espectrofotométrico de NO después de nitrito o nitrato de reducción por (III) soluciones de cloruro de tri-yoduro o vanadio, respectivamente. La sensibilidad para la detección de nitrito y nitrato está en la gama baja nanomolar, que establece CL como el método más sensible disponible actualmente para determinar los cambios en las rutas metabólicas NO. Explicamos en detalle cómo preparar muestras de fluidos y tejidos biológicos con el fin de preservar el valor de origen de nitritos y nitratos presentes en el momento de la recogida y la forma de determinar sus respectivas cantidades en las muestras. Las limitaciones de la técnica CL también son explained.
Introducción
Nitrito y nitrato a un menos extender, los niveles en la sangre refleja el estado general del cuerpo NO metabolismo. las concentraciones de nitrito en la sangre y la mayoría de los órganos y tejidos son sólo en alta nanomolar o rango micromolar bajo, el nitrato es por lo general presentes en cantidades mucho más elevadas - en el rango micromolar. Los cambios en los niveles de nitritos debido a la progresión de la enfermedad o los cambios en los hábitos alimenticios son bastante pequeñas y sólo pueden ser medidos usando un método muy sensible. Debido a sus muy diferentes niveles y diferentes procesos metabólicos, determinación separada de los niveles de nitrito y nitrato es esencial. El llamado "NO determinación x", donde nitritos y nitratos se mide en conjunto tiene muy poco valor.
Se han desarrollado varios métodos para la cuantificación de nitrito en diversas muestras biológicas - siendo el más común el más antiguo, en base a la reacción de Griess que había sido descrito originalmente en 1879. Incluso con modificatio modernons, el límite de sensibilidad para el nitrito alcanzable por el método de Griess 'está en el rango bajo micromolar. Quimioluminiscencia (CL), combinado con tri-yoduro de solución reductora, se considera actualmente el método más sensible, lo que permite la cuantificación en el intervalo nanomolar bajo de concentraciones de nitrito 1-8,10,11. El mismo método CL, en combinación con vanadio (III) cloruro solución reductora, se puede utilizar para mediciones sensibles de nitrato, con precisión en el rango nanomolar 9.
CL detecta gas libre NO. Por lo tanto, nitrito, nitrato, R-nitrosotioles (R-SNO), R-nitrosaminas (R-NNO), o compuestos de metal-NO (más adelante en el manuscrito que se refiere como "R- (X) -NO"), deben ser convertidos en liberar el gas NO con el fin de cuantificar su valor de origen a través de CL. La conversión a NO se consigue utilizando varias soluciones de reducción diferentes, dependiendo de la naturaleza de la NO metabolito. Después de la conversión, libre de gas NO se purga del recipiente de reacción por un gas portador (He, N2 o Ar) en la cámara de reacción del analizador CL donde el ozono (O 3) se combina con el NO para formar dióxido de nitrógeno (NO 2) en su estado activado. Con el retorno al estado fundamental, NO2 * emite en la región del infrarrojo y fotón emitido es detectado por fotomultiplicador (PMT) del instrumento CL. La intensidad de la luz emitida es directamente proporcional a la concentración de NO en la cámara de reacción, que permite el cálculo de la concentración de la especie original utilizando curvas de calibración adecuados.
En nuestro protocolo, que la determinación basada en CL primer regalo de nitrito y nitrato en los entornos clínicos más utilizados - en la sangre y el plasma, y luego se discute cómo determinar estos iones en muestras de tejido. También explicamos en detalle cómo conservar la concentración de nitrito fisiológico original en entornos de nitrito-reactivos, tales como la sangre y sus compartimentos, plasma y células rojas de la sangre.
Protocolo
Todos los protocolos que incluyen el uso de animales fueron aprobados para su uso por NIDDK Cuidado de Animales y el empleo y se obtuvo sangre humana a partir de bancos de sangre de donantes sanos NIH.
1. Preparación de muestras
- Preparación de solución de nitrito de preservar
- Preparar una solución que contiene 890 mM de ferricianuro de potasio (K 3 Fe (CN) 6) y NEM mM 118 (N-etilmaleimida) en agua destilada. Disolver bien hasta que quede claro de color amarillo sin cristales presentes. Añadir NP-40 (octil phenoxylpolyethoxylethanol) en una relación 1: 9 (v / v, NP-40 / solución). Mezclar suavemente para evitar la formación de espuma y se almacena a 4 ° C durante aproximadamente una semana).
- Recogida y preparación de muestras de sangre
- Recoger la sangre usando al menos una aguja de 20 G para evitar la hemólisis con heparina para evitar la coagulación (5 U / ml). Para la muestra de sangre, se mezcla la sangre con nitrito de solución de conservación inmediatamente en una proporción de 1: 4 (v/ V / solución de sangre).
- Para las muestras de plasma y células rojas de la sangre, se centrifuga la sangre recogida durante 5 minutos a 4000 xga 4 ° C para separar las células rojas de la sangre (RBC) y plasma. Tome el sobrenadante (plasma) y se mezcla con nitrito de solución de conservación como se describe anteriormente para la determinación de los niveles de nitrito en plasma.
- Retire cuidadosamente el plasma y la capa leucocitaria de la muestra y la pipeta de muestra RBC desde la parte inferior del tubo restante para evitar la contaminación por otros tipos de células de la sangre utilizando una punta de pipeta de corte, y la transfiere en un tubo que contiene solución de conservación de nitrito en el mismo relación que anteriormente.
- Mezclar cada muestra (plasma y RBC) con metanol frío con una relación de 1: 1 o 1: 2 (v / v de la muestra / metanol) y se centrifuga a 13.000 xg ellos a 4 ° C durante 15 min para precipitar las proteínas. Tomar el sobrenadante y utilizarlo para la medición de nitritos o congelar muestras preparadas, si es necesario, en hielo seco y almacenar a -80 ° C.
Nota: El nitrito rea rápidamentects con la oxihemoglobina (oxiHb) de nitrato de formación de sangre. Desde oxiHb siempre está presente en gran exceso sobre el nitrito, esta reacción conduce a la aniquilación casi completa de nitrito de sangre nativa con un marco de tiempo de ~ 10 min. Con el fin de preservar la mayor parte de nitrito de sangre endógena, se añadió una solución de nitrito de preservación de las muestras de sangre inmediatamente después de la extracción de sangre. La solución lisar rápidamente glóbulos rojos y oxidar oxiHb en metahemoglobina (metahemoglobina), una forma inactiva de la hemoglobina que no reacciona químicamente con nitrito.
- Preparación de las muestras de otros tipos de fluido corporal
- Después de la recogida de la muestra en un recipiente adecuado, mezclar bien con nitrito de preservar la solución, y medir deproteinate inmediatamente o congelar y almacenar a -80 ° C.
- Recogida y preparación de muestras de tejido
- Recoger tejidos de animales perfundidos con solución salina heparinizada (10 U HEPArin / ml). Impuestos Especiales sobre 1 g de tejido deseado y homogeneizar, ya sea usando un homogeneizador manual o un homogeneizador automatizado.
- Añadir cantidad conocida de nitrito de solución de conservación según sea necesario para lograr homogeneizado suave.
- Una vez que el tejido se homogeneiza, precipitar proteínas utilizando metanol frío (1: 1 o 1: 2 relación v / v de la muestra / metanol) como se describió anteriormente, las muestras de centrifugar a 13.000 xg a 4 ° C durante 15 min.
- Recoge los niveles de nitrito sobrenadante y medida. Si es necesario, congelar las muestras en cualquier etapa de la preparación en hielo seco y almacenar a -80 ° C.
2. Preparación de soluciones reductoras
- Tri-yoduro (I 3) la reducción de solución de nitrito y R- (X) -NO especies determinación 1,3,4
- Preparar una solución de KI 301 mM junto con una solución de 138 mM I 2 en agua. Mezclar con ácido glacial acético en proporción de 2: 7 (v / v / solución de ácido) en un agitador magnético durante ~ 30 min hasta que todocristales se disuelven. Preferiblemente tener en botella oscura, como yoduro es sensible a la luz, y el uso dentro de una semana desde su preparación.
Nota: Esta solución reducirá el nitrito en NO y que también dará a conocer NO a partir de R-SNO, R-NNO y NO-Fe grupos funcionales (R- (X) -NO), pero el nitrato no se verá afectada. La señal de los grupos funcionales basados en NO anteriores se puede separar de la verdadera señal de nitrito por tratamiento de la media de la muestra con sulfanilamida acidificada (AS) y comparar AS tratada y la señal no tratada. AS irreversiblemente forma catión diazonio con nitrito y este complejo no puede ser reducida por I 3 solución. Porque así como el tratamiento, preparar una solución 290 mM de sulfanilamida en HCl 1 M y añadirlo a una parte alícuota de la muestra en relación 1: 9 (v / v AS / muestra). Medir la señal CL en piezas tratadas y sin tratar AS-de la muestra. Se calcula la verdadera señal de nitrito como una diferencia de parte tratada y no tratada AS-de la muestra. El nitrito puede ser también midió mediante el uso de una liendre selectivaRite-reducción solución de mezcla de ácido ascórbico / ácido acético como se describe en la parte 2.2. Sin embargo, debido a la generalmente pequeña cantidad de R- (X) -NO especies presentes, las mediciones usando muestras AS-no tratados son en la mayoría de los casos una muy buena aproximación del contenido total de nitrito.
- Preparar una solución de KI 301 mM junto con una solución de 138 mM I 2 en agua. Mezclar con ácido glacial acético en proporción de 2: 7 (v / v / solución de ácido) en un agitador magnético durante ~ 30 min hasta que todocristales se disuelven. Preferiblemente tener en botella oscura, como yoduro es sensible a la luz, y el uso dentro de una semana desde su preparación.
- / Solución de ácido acético (4A) de ácido ascórbico para la determinación selectiva de nitrito de 2
- Preparar ácido ascórbico 500 mM en agua. Mezclar esta solución con ácido acético glacial en una relación 1: 7 (v / v, ácido ascórbico / ácido acético) para preparar la mezcla de reacción.
Nota: Esta solución es específico para el nitrito, no va a liberar NO desde cualquier R- (X) -NO especies o nitrato. Sin embargo, la solución de ácido ascórbico y ácido acético debe prepararse poco antes de cada día de las mediciones, como el ácido ascórbico se oxida fácilmente en solución.
La finalización de la reducción de nitrito depende de la concentración de ácido ascórbico; y ácido ascórbico al menos 50 mm se recomienda para r completaeducción de nitrito de plasma. Sin embargo, se recomienda llevar a cabo unos experimentos piloto con diferentes concentraciones de ácido ascórbico y normas de nitritos en el rango de concentración de nitrito esperado antes de las mediciones de muestras finales. Tenga en cuenta que el ácido ascórbico reduce ligeramente durante las mediciones, se recomiendan cambios tan frecuentes de mezcla de reacción en la cámara de reacción de vidrio.
- Preparar ácido ascórbico 500 mM en agua. Mezclar esta solución con ácido acético glacial en una relación 1: 7 (v / v, ácido ascórbico / ácido acético) para preparar la mezcla de reacción.
- El vanadio (III) cloruro de solución reductora para la determinación de nitrato de 9
- Preparar la solución de 51 mM de VCl3 en HCl 1. Filtrar la solución a través de filtro de 200 micras y guardar en un frasco oscuro, utilice el plazo de dos semanas.
Nota: Esta solución reducirá nitrato, nitrito y todo R- (X) -NO especies, por lo que si cantidades comparables de nitrito u otro R- (X) -NO especies están presentes junto con el nitrato, el contenido final de nitrato tienen que ser calculados como la diferencia entre las señales CL obtenidos con VCl 3 y I3 la reducción de las soluciones.
- Preparar la solución de 51 mM de VCl3 en HCl 1. Filtrar la solución a través de filtro de 200 micras y guardar en un frasco oscuro, utilice el plazo de dos semanas.
3. La quimioluminiscencia (CL) de configuración del analizador y Medidas
- Solucion estandar
- Preparar 1 M solución de nitrito sódico (NaNO2). La misma solución se puede utilizar para las determinaciones de nitrito y nitrato.
- El uso de analizador de NO
Nota: En la actualidad hay dos disponibles comercialmente NO analizadores que son lo suficientemente sensibles como para fines de investigación biológica - Sievers NOA y 88Y Ecophysics EPC. Ambos operan en el mismo principio; la principal diferencia es que la EPC 88Y utiliza el oxígeno del aire de la habitación para que el ozono (O 3), mientras que NOA requiere un tanque de oxígeno externo para este propósito. El procedimiento siguiente describe la puesta en marcha de la Sievers NOA.- configuración del instrumento
- Realizar una configuración inicial de la analizador de NO de acuerdo con las recomendaciones del fabricanteSegún lo visto en la Figura 1.
- Abrir O2 depósito conectado al instrumento. Elija "análisis" y "entrar" en el menú principal en el panel frontal. En la siguiente pantalla seleccione "Iniciar" y pulse "enter". Conectar la trampa ácido (que contiene NaOH 1 M) en el instrumento como se ve en la Figura 1.
- Esperar hasta fotomultiplicador se enfría a temperatura por debajo de -12 ° C y la cámara de reacción se evacua a 6 Torr. Se tarda unos 30 minutos para llegar a una línea de base plana y estable. La línea de base necesita para estabilizar dentro de 1 - 2 mV, su valor nominal es menos importante que su estabilidad.
Nota: Si se mide el nitrato, encender el baño de enfriamiento de agua (establecido a 4 ° C, la cual sirve como trampa fría para ácidos y vapores de agua) y el baño de agua de calentamiento (la cámara de reacción principal, 95 ° C). La velocidad de la reducción de nitrato en NO en solución VCl 3 es dependiente de la temperatura, y es muy lento a tempe habitacióntura, por lo que se necesita aumento sustancial de la temperatura para observar la reacción. - Se abrirá el tanque y conecte la cámara de reacción de vidrio para atrapar el ácido como se ve en la Figura 1. Llenar la cámara de reacción con una solución de reductor apropiado, reducir la formación de burbujas al mínimo y conecte la cámara de reacción a la trampa de ácido. El uso de ensayo y error, ajustar la velocidad de burbujeo Él para que coincida con la velocidad de aspiración instrumento (normalmente ~ 200 ml / min para el NOA de Siever).
- Encienda el ordenador que controla el instrumento e inicie el software líquido basado en Labview. Para activar la comunicación entre el instrumento y el software de adquisición, pulse "enter" cuando en "menú de datos de" hasta que la pantalla se lee "activar la salida", a continuación, presione "claro" para volver de nuevo a la pantalla de datos.
- Esperar a que una traza de línea de base estable en la pantalla y comenzar la inyección de las muestras y patrones de nitrito en la reducción de solución a través del septum. Siempre esperar a llegar a una línea de base estable popaer el pico. Esto puede tardar hasta 2 minutos. El software de líquido tiene una opción para "marcar" los tiempos de inyección y anotar la inyección y se exportará estos comentarios en un archivo separado (filename.info) como un complemento útil para el archivo de datos (filename.data).
- Una vez que se miden las muestras y patrones, elegir la opción "parada" opción en el menú del software Liquid - esto va a escribir los datos de un archivo temporal en un archivo permanente conocida como "filename.data". Al pulsar la opción de "abortar" terminará la medición sin necesidad de escribir los datos adquiridos en un archivo permanente.
- Para terminar el experimento, desconectar la máquina de la vasija de reacción apagando la llave de paso en la parte superior del recipiente de reacción y desconectar el tubo entre la trampa y ácido recipiente de reacción (véase la Figura 1). Ahora deja de analizador de NOA - presione "claro", vaya a "análisis", máquina de poner en "espera" y espera "confirmar". Si se usa con regularidad, lainstrumento puede dejarse en modo de espera durante varias semanas. Cierre el suministro de oxígeno. A continuación, enjuagar la solución reductora de la cámara de reacción, de desconexión y cierre del depósito de Él del recipiente de reacción de vidrio y termine de limpiar recipiente de reacción.
- Normas y inyecciones de muestra
- Inyectar 50 l de solución de nitrito de 1 mM en la mezcla de reacción usando una jeringa Hamilton bien lavada. Espere por lo menos 1 - 2 minutos entre cada inyección para lograr una buena separación de los picos. repetición de la inyección de 50 l para obtener duplicados a cada punto de datos. Lavar la jeringa con agua desionizada después de cada inyección.
- Para adquirir un conjunto completo de datos para la curva estándar, continuar con las inyecciones duplicadas de 100, 150 l (200 l adicionales podrían ser necesarias si se espera que las altas concentraciones de nitrito o nitrato) de solución de nitrito de 1 mM. En cada caso, tenga cuidado que esperar hasta que la señal pasa de nuevo a la línea de base y luego adquirir 1 - 2 millasn de la línea de base para lograr una buena separación de los picos.
Nota: las normas de nitrito se pueden medir en cualquier momento durante los experimentos. Sin embargo, es preferible adquirir la curva estándar antes de la medición de datos, ya que también sirve como un control independiente de la funcionalidad de instrumento.
Cuando se recogen los datos, cantidad de muestra inyectada debería conducir a picos bien pronunciadas. Sin embargo se debe tener en cuenta que el fotomultiplicador es lineal sólo hasta ~ 800 mV, por lo que ninguno del pico debe ser superior a ~ 700 mV. Esto se puede lograr ya sea por la disminución de la cantidad inyectada de la muestra o la dilución de la muestra con agua desionizada. Cada punto se debe medir al menos por duplicado.
- configuración del instrumento
Resultados
Figura 2 muestra resultados representativos obtenidos de normas y cinco muestras diferentes. Como se muestra en esta figura, los aumentos de tensión fotomultiplicador inmediatamente después de que se inyecta la solución (estándares o muestras) que contiene nitrito en la reducción de la solución (inyecciones veces se indican mediante flechas rojas debajo de la curva) y vuelve al valor de referencia una vez que todo el nitrito presente en el inyectado solución se redujo. También está claro a partir de esta figura que las mediciones de volumen precisas son necesarias para obtener datos altamente reproducibles. Recomendamos el uso de jeringas de precisión Hamilton para medir volúmenes de inyección. La pérdida de la reducción de la capacidad de I 3 (o ácido ascórbico o VCl 3) solución es otra fuente común de error. Como regla general, cuando el ancho de línea de base de los picos comienza a ensancharse considerablemente, reduciendo solución en la cámara de reacción tiene que ser cambiado. La anchura de pico depende del flujo de gas en el NOUna cámara de reacción (marcado como RC en la Figura 1), y es ligeramente varía de un montaje experimental a otro. Consideramos que la anchura normal para ser alrededor 1 min para las mediciones de nitrito y hasta 2 min para las mediciones de nitrato.
Con el fin de relacionar la señal del fotomultiplicador con la cantidad de NO detectado, una curva estándar se construye como un gráfico de la área bajo el pico y la cantidad de nitrito (en pmol) inyecta como se ve en la Figura 3A. Para medir el área bajo el pico de cualquier software adecuado se puede utilizar, como el origen, Excel o como. La pendiente de esta curva, K (marcado en rojo en la figura 3B), da la cantidad de pmol de NO causando aumento de 1 mV de la señal fotomultiplicador (PM). La ventaja de utilizar la pendiente de la curva, en lugar de área bajo el pico que se relaciona con cantidad fija de NO, se aumenta la precisión. La curva estándar es construida a partir de al menos 3 diferentespuntos, cada una de ellas se midieron por duplicado y, si hay algo de nitrito o nitrato residual en el agua utilizada para preparar la solución estándar, utilizando K elimina la necesidad de correcciones a la presente cantidades residuales. También, siguiendo nuestras pruebas iniciales del instrumento NOA por su linealidad PM, se determinó que se produce una respuesta lineal hasta 700 - 800mV. Por lo tanto, nuestra curva estándar es válida para todas las señales de las muestras hasta este rango de PM. El rango de medida depende de PM y puede cambiar con el tiempo. Se necesita ser determinado antes de que el instrumento se utilizó por primera vez y se ensayó como PM edades cada par de años.
Los datos recogidos a partir de muestras se procesan en forma similar a como los datos recogidos para curva estándar: En primer lugar, se determina el área bajo el pico. A continuación, esta zona se divide por el K pendiente de la curva estándar, que da el número de pmol de NO originó a partir de la cantidad de muestra inyectada.
Los ajustes necesarios para la dilución de la muestra original de solución de nitrito de preservar, desproteinización, o cualquier otro diluciones se hacen necesarias. El resultado se expresa por lo general como nitrito o nitrato de concentración (nM o M) para los fluidos biológicos (sangre, orina) o como picomoles / gramo de tejido en el caso de muestras sólidas, como se muestra en la Figura 3B. Los datos se representa gráficamente a continuación, de manera similar al ejemplo de la Figura 3B. En el ejemplo dado en la figura 3B que trazan los resultados de 5 muestras individuales que se muestran en el panel A. Aquí se trazan los valores promedio de 2 inyecciones y dan la SD para demostrar la reproducibilidad de las mediciones de puntos individuales.
Para las muestras en la figura 3, S1, S2 y S4 son de sangre de rata y S3 y S5 de hígado de rata. La Figura 3C muestra los resultados finales parcela junto con SD y se expresaron en nM (para sangre, n = 3) o pmol / mg de tejido (por hígado, n = 2).

Figura 1: Configuración de Sievers NOA quimioluminiscencia del instrumento. El recipiente de reacción se llena con I 3 (ácido ascórbico / ácido acético o VCl 3) solución con gas portador Él suavemente burbujeante a través. Muestra se inyecta usando una jeringa Hamilton a través del septo en I 3-NO solución en la que los componentes relacionados se reducen a gas NO y se les traslada analizador de NO. La trampa de frío, trampa llena de NaOH, y el filtro analizador protegen contra la humedad y los vapores ácidos. En la cámara de reacción (RC) gas NO se combina con O 3 (generado en el generador de O 3) a partir de oxígeno de O 2 tanque. Señal de quimioluminiscencia de NO 2 * es detectada por el tubo fotomultiplicador (PMT) y aún más amplificada y procesada. adquisición y análisis de datos se llevan a cabo en el PC. Bomba aspiradoracreado baja presión en la cámara de reacción (RC) y evacua gas tóxico NO 2 después de la medición de quimioluminiscencia a través de filtro de carbón vegetal (CF). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: gráfico representativo de la ausencia de picos generados por CL. Este gráfico muestra la señal fotomultiplicador (PMT) como una función del tiempo. Los picos son el resultado de las inyecciones de diversas cantidades de una solución 1 M de nitrito (estándares) y 100 l de muestras (S1 - S5) inyectada por duplicado y triplicado (50 l de solución patrón de nitritos). Las flechas rojas indican bajo la curva tiempos de inyecciones. Haga clic aquí para ver a larger versión de esta figura.
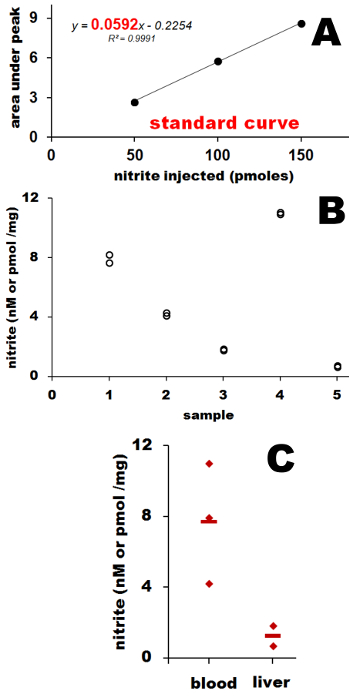
Figura 3: Curva estándar (A) y resultados representativos de rata sangre y el hígado (B), los resultados finales de la parcela (C). Se obtuvo la curva estándar (panel A) mediante la inyección de 50, 100 y 150 l de solución de nitrito de 1 M en agua, midiendo el área bajo los picos. La pendiente, K (número rojo) da nmol de NO requerida para un incremento de 1 mV en el voltaje del fotomultiplicador. Picos original utilizado para la curva estándar se encuentran en la figura 2 y están marcados como 50, 100 y 150 l. La Figura 2 muestra también las inyecciones originales para nuestras muestras - S1, S2 y S4 (gris oscuro) a partir de sangre de rata, S3 y S5 a partir de tejido de hígado de rata, todos inyectados por duplicado. Área bajo estos picos se midió y, después se hicieron todas las correcciones para las diluciones tal como se describe, en parte, 3.2.1., ResULTS que se muestran en el panel B de muestras individuales se calcularon como la cantidad de nitrito en pmol / g de hígado o en nM para la sangre. Para apreciar la reproducibilidad del método de quimioluminiscencia, que trazan los promedios y las desviaciones estándar para cada muestra individual. Panel C muestra los productos de nitrito y nitrato final en sangre de rata y el hígado representan como promedio de tres muestras individuales de sangre y dos para el hígado junto con la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los pasos críticos dentro del Protocolo
Las alícuotas de todas las soluciones (incluyendo el agua) que se usan para preparar, diluir o tratar de otro modo las muestras originales tienen que ser guardados y revisados para su posible nitrito o (más a menudo) la contaminación por nitratos. Encontramos que la mayoría contaminación proviene del agua y muchos productos químicos utiliza para tratar la muestra (ferricianuro en particular) también contiene cantidad significativa de contaminación con nitrato en algunos lotes que interfiere con la determinación de nitrato endógeno. Por lo tanto, comprobamos todos nuestros productos químicos para los nitritos y nitratos contaminantes antes de que los usamos en el experimento regular.
Dado que las muestras podrían ser sometidos a diluciones sustanciales en varias ocasiones durante los tratamientos, todas las manipulaciones de muestras necesitan ser documentados para los cálculos de concentración final. La mayoría de los errores se hacen en esta parte del protocolo.
Al manipular muestras para mediciones de nitrito, transferencia rápida ennitrito de solución de conservación es crucial, especialmente cuando las proteínas que contienen hemo, tales como la hemoglobina, que reacciona con el nitrito y se oxida en nitrato, están presentes. Una vez estabilizado, las muestras se pueden congelar para su almacenamiento prolongado antes de los ensayos.
Las cantidades de varios metabolitos de NO en muestras biológicas (especialmente RX-NO) son muy bajas, a veces los niveles de NO generados están en el nivel de ruido de fondo del analizador NOA. Siempre es preferible preparar muestras con tan poco como sea posible dilución si tales compuestos se van a medir.
Limitaciones de la Técnica
Con una cuidadosa preparación de la muestra y las inyecciones, el límite inferior de sensibilidad es cerca de 20 nM de aducto de NO presente en la muestra totalmente preparado. Las concentraciones biológicos habituales de nitrito y nitrato hacen superar estas concentraciones, sin embargo, el R- (X) -NO cantidades podría caer cerca de esta gama.
sen alta de CLsibilidad exige una cuidadosa preparación de muestras y mediciones precisas de volumen.
Importancia de la CL con respecto a los métodos alternativos de Medidas ningún metabolito
Quimioluminiscencia (CL) es un método muy sensible para detectar NO, nitrito, nitrato y RX-NO. Actualmente, CL se considera el estándar de oro en la determinación de NO y sus metabolitos.
Otra alternativa común para determinar el nitrito es la reacción de Griess (GR). GR es un método colorimétrico conveniente y de bajo costo basado en la reacción de diazotación descrito por Peter Griess en 1879. Análisis de nitrato requiere químico antes o reducción enzimática de nitrato a nitrito. Mejores actuales kits disponibles en el mercado tienen una sensibilidad de alrededor de 100 nM para el nitrito, la sensibilidad de la mayoría de los kits que permiten determinar el nitrato y nitrato está en la gama baja M. Cuando se utiliza GR para determinar nitrito y nitrato en la muestra, se requieren dos pasos; en primer lugar, determinar el nitrito amporte en la primera parte alícuota de la muestra, a continuación, utilizar segunda alícuota de reducir el nitrato en nitrito y medir en total de nitrito y nitrato (a veces conocido como NOx) contenidos en la muestra. El verdadero valor de nitrato es la diferencia de ambas mediciones. Una mejor alternativa a este protocolo de dos pasos es la separación previa de nitritos y nitratos por cromatografía. Sin embargo, esto disminuye considerablemente la sensibilidad y aumenta el tiempo de análisis.
Las aplicaciones futuras
Con la creciente evidencia acerca de la importancia de vía del NO en el sistema biológico, prevemos el uso más frecuente de nitrito o nitrato u otros metabolitos de NO como biomarcadores de la salud cardiovascular. El aumento de la evidencia también sugiere que estas moléculas podrían ser importantes en la medicina ejercicio y sus niveles pueden ser cambiado en las personas con diabetes, la obesidad y el síndrome metabólico.
Divulgaciones
El Dr. Alan Schechter aparece como co-inventor de varias patentes concedidas a los Institutos Nacionales de la Salud para el uso de sales de nitrito para el tratamiento de enfermedades cardiovasculares. Él recibe las regalías sobre la base de los NIH concesión de licencias de estas patentes para el desarrollo clínico, pero sin otra compensación.
Agradecimientos
Los autores quieren reconocer las contribuciones importantes de Dr. A. Dejam y MM Pelletier en el desarrollo del uso de la solución de nitrito de preservar para las mediciones de nitritos en la sangre.
Materiales
| Name | Company | Catalog Number | Comments |
| potassium ferricyanide; K3Fe(CN)6 | Sigma | 702587 | |
| NEM; N-ethylmaleimide | Sigma | 4260 | |
| NP-40; 4-Nonylphenyl-polyethylene glycol | Sigma | 74385 | |
| sulfanilamide; AS | Sigma | S9251 | |
| HCl | Sigma | H1758 | |
| acetic acid, glacial | Sigma | A9967 | |
| ascorbic acid | Sigma | A7506 | |
| potassium iodide; KI | Sigma | 60399 | |
| iodine; I2 | Sigma | 207772 | light sensitive, toxic |
| sodium nitrite; NaNO2 | Sigma | 563218 | |
| vanadium(III) chloride; VCl3 | Sigma | 208272 | ligt sensitive, toxic |
| GentleMac | Miltenyi | ||
| Sievers NOA 280i | GE | ||
| CLD 88Y | Ecophysics |
Referencias
- Piknova, B., Schechter, A. N. Measurement of Nitrite in Blood Samples Using the Ferricyanide-Based Hemoglobin Oxidation Assay. Methods Mol Biol. 704, 39-56 (2011).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radic Biol Med. 42, 1146-1154 (2007).
- Pinder, A. G., Rogers, S. C., Khalatbari, A., Ingram, T. E., James, P. E. The measurement of nitric oxide and its metabolites in biological samples by ozone-based chemiluminescence. Methods in Molecular Biology, Redox-Mediated Signal Transduction. Hancock, J. T. 476, Humana press. Totowa, NJ. 11-28 (2008).
- Pelletier, M. M., Kleinbongard, P., Ring-wood, L., Hito, R., Hunter, C. J., Schechter, A. N., et al. The measurement of blood and plasma nitrite by chemiluminescence: pitfalls and solutions. Free Radic Biol Med. 41, 541-548 (2006).
- Mac Arthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. J Chromatogr B. 851, 93-105 (2007).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radic Biol Med. 43, 645-657 (2007).
- Hendgen-Cotta, U., Grau, M., Rasaaf, T., Gharinin, P., Kelm, M., Kleinbongard, P. Reductive gas-phase chemiluminescence and flow injection analysis for measurement of nitric oxide pool in biological matrices. Method Enzymol. 441, 295-315 (2008).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of S-nitrosothiols, iron-nitrosyls and Nitrite in biological samples. Free Radic Res. 37, 1-10 (2003).
- Smárason, A. K. 1, Allman, K. G., Young, D., Redman, C. W. Elevated levels of serum nitrate, a stable end product of nitric oxide, in women with pre-eclampsia. Br J Obstet Gynaecol. 104 (5), 538-543 (1997).
- Beckman, J. S., Congert, K. A. Direct Measurement of Dilute Nitric Oxide in Solution with an Ozone Chemiluminescent Detector. Methods: A companion to Methods in Enzymology. 7, 35-39 (1995).
- Bates, J. N. Nitric oxide measurements by chemiluminescence detection. Neuroprotocols: A companion to Methods in Neuroscience. 1, 141-149 (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados