Method Article
El uso de la cromatografía de gases para analizar los cambios de composición de ácidos grasos en el tejido de hígado de rata durante el embarazo
En este artículo
Resumen
El embarazo provoca cambios significativos en la composición de ácidos grasos de los tejidos maternos. Los perfiles lipídicos se pueden obtener por medio de la cromatografía de gases para permitir la identificación y cuantificación de los ácidos grasos en las clases de lípidos individuales entre las ratas alimentadas con diferentes dietas de alta y baja en grasa durante el embarazo.
Resumen
La cromatografía de gases (GC) es un método altamente sensible para identificar y cuantificar el contenido de ácidos grasos de los lípidos de los tejidos, las células y el plasma / suero, obteniéndose resultados con alta precisión y alta reproducibilidad. En estudios metabólicos y de la nutrición GC permite la evaluación de cambios en las concentraciones de ácidos grasos siguientes intervenciones o durante cambios en el estado fisiológico tal como el embarazo. Extracción en fase sólida (SPE) usando cartuchos de sílice aminopropilo permite la separación de las principales clases de lípidos incluyendo triglicéridos, fosfolípidos diferentes, y ésteres de colesterol (CE). GC combinado con SPE se utilizó para analizar los cambios en la composición de ácidos grasos de la fracción de CE en los hígados de ratas vírgenes y embarazadas que habían sido alimentados con diferentes dietas altas y bajas en grasa. Hay importantes efectos de la interacción dieta / el embarazo sobre el contenido de ácidos grasos omega-3 y omega-6 ácidos grasos de la CE de hígado, lo que indica que las mujeres embarazadas tienen una respuesta diferente a la dieta manipulatión que se observa entre las hembras vírgenes.
Introducción
La cromatografía de gases (GC) es una técnica bien establecida se utiliza para identificar y cuantificar la incorporación de ácidos grasos al interior de las acumulaciones de lípidos y membranas celulares de 1,2 durante la suplementación o fisiológicas condiciones tales como la obesidad y enfermedades relacionadas (como la diabetes) o un embarazo 3 - 5. También es adecuado para el análisis de los tipos y cantidades de grasas en los alimentos. Esto es útil cuando la caracterización de las dietas experimentales, así como garantizar que la industria alimentaria cumple con la normativa. Por ejemplo, GC se puede utilizar para confirmar la identidad y la cantidad de ácidos grasos dentro de un producto, tales como un suplemento dietético para asegurar que el etiquetado es correcto y reglamentos se adhiere a 6,7. Análisis de ácidos grasos puede proporcionar información valiosa sobre el metabolismo de lípidos en la salud y la enfermedad, el impacto del cambio en la dieta, y el efecto de los cambios en el estado fisiológico 8. Uso de GC para estudiar muestras durante el embarazo ha proporcionado importanteinformación sobre los cambios en los ácidos grasos y la homeostasis de los lípidos complejos 3.
Antes de la separación cromatográfica, los lípidos son típicamente extrae de la muestra usando la solubilidad de los lípidos en mezclas de disolventes de cloroformo y metanol. Se añade cloruro de sodio para facilitar la separación de la mezcla en lípidos acuosa y orgánica que contiene fases 9,10. Clases de lípidos complejo de interés se pueden separar a partir del extracto total de lípidos por extracción en fase sólida (SPE). Esta técnica de separación eluye clases de lípidos basados en su polaridad o afinidad de unión. Triacilgliceroles (TAG) y los ésteres de colesterol (CE) se eluyen primero como una fracción combinada, otras clases, fosfatidilcolina (PC), fosfatidiletanolamina (PE), y ácidos grasos no esterificados (NEFA) se eluyen mediante el aumento de la polaridad del disolvente de elución . La separación de los TAG de CE explota la unión de TAG sólo a un cartuc SPE frescadge, lo que permite a la CE ser eluido. TAG puede entonces ser eluido mediante el aumento de la polaridad del disolvente de elución 9,10. Este método permite múltiples muestras para ser separadas simultáneamente con un mayor rendimiento que se consigue con cromatografía en capa fina, lo que significa que muestras relativamente pequeñas de tamaño (por ejemplo, <100 l de plasma o suero, <100 mg de tejido) pueden ser analizados 11,12.
GC es una técnica bien establecida descrita por primera vez en la década de 1950; se sugirió que la fase móvil en los sistemas a continuación, líquido-líquido podría ser sustituido con de vapor. Fue utilizado inicialmente para el análisis de petróleo, pero rápidamente se expandió a otras áreas como el análisis de aminoácidos y la bioquímica de los lípidos, que sigue siendo de gran interés. Los avances en equipos de GC y la tecnología, como el desarrollo de las columnas capilares de las columnas de relleno utilizados anteriormente han llevado a nuestras técnicas actuales en los que los ácidos grasos son capaces de serseparados de manera más eficiente a temperaturas más bajas que resultan en GC se utiliza rutinariamente para identificar y cuantificar los ácidos grasos en una amplia gama de investigaciones 13.
GC requiere ácidos grasos para ser derivatizados con el fin de que puedan llegar a ser suficientemente volátil para ser eluida a temperaturas razonables sin descomposición térmica. Esto normalmente implica la sustitución de un grupo funcional que contiene hidrógeno para formar ésteres, tioésteres o amidas para el análisis. Los ésteres metílicos se estudian comúnmente derivados, que son producidos por metilación. En este método los enlaces éster en los lípidos complejos se hidrolizan para liberar ácidos grasos libres, que se transmethylated para formar ésteres metílicos de ácidos grasos (FAME). El perfil resultante de FAME, determinado por GC, se conoce como la composición de ácidos grasos y puede ser fácilmente comparado entre los diferentes grupos experimentales 9,10. La técnica permite tanto a las proporciones de indiviácidos grasos UAL y sus concentraciones a medir.
Además de la utilización de GC para el análisis de ácidos grasos en los estudios de nutrición y en la industria alimentaria, la técnica se puede utilizar en una amplia gama de campos analíticos. Por ejemplo, los análisis ambientales utilizando GC incluyen la medición de la contaminación del agua por los insecticidas y los análisis de suelos medir el contenido de clorobenceno. En toxicología, GC también se ha utilizado para identificar las sustancias ilegales en la orina y muestras de sangre de los individuos; unos potenciadores tales rendimiento deportivo 12 y la capacidad de separar mezclas complejas de hidrocarburos hace que esta técnica popular en la industria petrolera para el análisis petroquímica 12.
El embarazo se asocia con cambios significativos en la composición de ácidos grasos de los tejidos maternos, específicamente en el contenido de ácidos grasos omega-3 (n-3) y omega-6 (n-6) aci grasos poliinsaturadosds (PUFA) 3. En el estudio actual, ejemplificamos el uso de GC en la medición de los ácidos grasos mediante la descripción de su uso en el análisis de la composición de ácidos grasos del tejido del hígado tomado de ratas vírgenes y gestantes alimentadas con dietas altas y bajas en grasa con diferentes fuentes de petróleo. Las dietas experimentales que aquí eran una base de aceite de soja dieta baja en grasas, una dieta alta en grasas a base de aceite de soja (130,9 g de grasa total / kg de grasa total) o (130,9 g de grasa total / kg con una dieta alta en grasas a base de aceite de linaza dieta), proporcionado por 20 días. La composición de ácido graso total de nutrientes y de estas dietas se han descrito previamente 14. Las dietas de aceite de soja son ricos en ácido linoleico (18:2 n-6) y contienen algo de ácido α-linolénico (18:3 n-3), mientras que la dieta de aceite de linaza es rica en ácido α-linolénico. Estas dietas altas en grasas representan diferentes raciones de ácidos linoleicos a α-linolénico (raciones de 08:01 y 01:01, respectivamente). El método para el aislamiento de clases de lípidos individuales y el análisis por GC es quell establecido y validado, y que ha sido previamente publicado 10 pero sin la descripción técnica detallada contenida aquí.
Protocolo
1. Procedimientos animales
- Todo animal de trabajo debe llevarse a cabo de acuerdo con el Ministerio del Interior Animales (Procedimientos Científicos) de la Ley (1986).
- Mate de ratas Wistar a partir de 10 semanas de edad mediante la cría monógama, y confirmar el embarazo por la aparición de un tapón vaginal. Anote este como el día 1 de la gestación, y comenzar la dieta experimental. Para las hembras vírgenes, albergar cada rata individual, y comenzar la dieta experimental.
- Después de alimentar a las dietas experimentales durante 20 días la eutanasia a las ratas por asfixia de CO 2 seguido por dislocación cervical.
- El uso de fórceps y tijeras de disección para exponer la cavidad abdominal y extirpar el hígado mediante la reducción de los ligamentos, que conectan el hígado al diafragma, la pared anterior del abdomen, el estómago y el duodeno. Lavar el hígado en PBS y congelar en nitrógeno líquido antes de guardarlo a -80 ° C.
2. Preparación de un extracto lipídico total 9
- Añadir molecultamices ar (para llenar 1/10 del recipiente de disolvente) a todos los disolventes para crear disolventes "secos". Llevar a cabo todos los trabajos de disolvente dentro de una campana de humos.
- Cortar aproximadamente 100 mg de hígado congelado y pesar. Coloque el tejido en un tubo en un cubo de hielo y se añade 0,8 ml de hielo frío 0,9% de NaCl. Homogeneizar el tejido.
- Añadir estándares internos disueltos en 1 ml / mg de cloroformo seco: metanol (02:01, v / v) que contiene hidroxitolueno butilado (BHT; 50 mg / l) como anti-oxidante. Durante 100 mg de hígado de rata añaden 100 g de la norma CE (Cholesteryl heptadecanoato 17:00) Precaución:. Cloroformo y BHT son peligrosos.
- Añadir 5,0 ml de cloroformo seco: metanol (02:01, v / v) que contenía BHT (50 mg / L).
- Añadir 1,0 ml de 1 M NaCl, mezclar bien por agitación hasta que la mezcla se ve uniforme. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
- Centrifugar a 1000 xg durante 10 minutos, bajo el freno a temperatura ambiente.
- Recoger menorfase con una pipeta Pasteur de vidrio, traslado al nuevo tubo de vidrio de tapón de rosca y seco bajo nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
3. La separación de clases de lípidos por extracción en fase sólida (SPE) 10
- Conectar el depósito de la SPE a una bomba de vacío y colocar aminopropil cartucho SPE de sílice en el tanque.
- Coloque el nuevo tubo de vidrio con tapón de rosca TAG marcado CE y en el bastidor del tanque en la columna para recoger primera fracción.
- Disolver el extracto de lípidos totales en 1,0 ml de cloroformo seco y vórtice.
- Aplicar la muestra a la columna usando una pipeta Pasteur de vidrio y dejar a gotear a través de en el tubo con tapón de rosca por gravedad. Cuando no hay más gotas caen, eliminar el líquido restante por medio de vacío.
- Se eluye la fracción TAG y CE al vacío, se lava la columna con 2 x 1,0 ml lavados de cloroformo seco.
- Cuando se elimina todo el líquido, se seca el TAG y CE fraction bajo nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
- Coloque el nuevo tapón de rosca tubo de vidrio PC marcado en la bandeja del tanque, en la columna.
- Eluir la fracción de PC bajo vacío con la adición de 2 x 1,0 ml de cloroformo seco: metanol (60:40, v / v) hasta que se retira todo el líquido de la columna.
- Retire y fracción PC seco bajo nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
- Colocar un nuevo tapón de rosca de tubo de vidrio de PE marcado en la bandeja de depósito y eluir la fracción de PE con la adición de 1,0 ml de metanol seco bajo vacío.
- Retire y fracción PE seco bajo nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
- Coloque el nuevo tubo de vidrio con tapón de rosca marcado NEFA en la bandeja de depósito y eluir la fracción de NEFA bajo vacío por la adición de 2 x 1,0 ml de lavados de cloroformo seco: metanol: ácido acético glacial. (100:2:2, v / v / v) Precaución: El ácido acético glacial es peligroso.
- Eliminar fracción recogida de NEFA y seco bajo nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
- Coloque un nuevo cartucho de SPE de sílice aminopropilo en el tanque de SPE y colocar un tubo de vidrio con tapón de rosca en la bandeja del tanque debajo del cartucho de recogida de residuos.
- Lavar la columna con 3 lavados de hexano seco bajo vacío y luego un lavado de 1,0 ml final bajo la gravedad. No permita que el cartucho se seque (a su vez los canales de columna de cartucho a una posición cerrada cuando el nivel de hexano se encuentra cerca de la matriz de cartucho) Precaución:. Hexano es peligroso.
- Vuelva a colocar el tubo de residuos con tubo de vidrio nuevo tapón de rosca marcado CE.
- Disolver la fracción TAG y CE se secó (preparado en la etapa 3.6) en 1,0 ml de hexano seco y vórtice. Aplicar esto a la columna usando una pipeta Pasteur de vidrio y dejar a gotear a través de bajo gRavity.
- Cuando no hay más gotas caen, eliminar el líquido restante al vacío.
- En el vacío, se lava la columna con 2 x 1,0 ml lavados de hexano seco para eluir CE y fracción recogida seco bajo nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
- Coloque el nuevo tubo de vidrio con tapón de rosca de TAG marcado en la bandeja del tanque y TAG eluir con la adición de 2 x 1,0 ml de lavados de hexano seco: metanol: acetato de etilo (100:5:5) bajo vacío.
- Fracción seco recogido en nitrógeno a 40 ° C. Las muestras pueden ser tapados y almacenados a -20 ° C en esta etapa hasta por una semana Precaución:. Acetato de etilo es peligroso.
4. Preparación de FAME de CE 10
- Añadir 0,5 ml de tolueno seco a la fracción CE separados (recogido en el paso 3.19) y agitar Precaución:. Tolueno es peligroso.
- Prepare el reactivo de metilación (metanol seco con 2% (v/ V) de H 2 SO 4), de los cuales 1,0 ml se requiere por muestra. Dispensar el volumen de metanol seco en un vaso o recipiente de plástico con tapa apto y agregue la cantidad necesaria de H 2 SO 4, gota a gota y mezcle por inversión Precaución:. El ácido sulfúrico es peligroso.
- Añadir 1,0 ml de reactivo de metilación de las muestras disueltas en tolueno seco, tapar los tubos de forma segura, y mezclar suavemente.
- Calentar las muestras durante 2 horas a 50 ° C.
- Después de 2 horas retirar los tubos de calor. Una vez fría añadir 1,0 ml solución neutralizante (0,25 M KHCO3 0.5MK 2 CO 3) Precaución:. Bicarbonato de potasio y carbonato de potasio son peligrosos.
- Añadir 1,0 ml de hexano seco y vórtice.
- Se centrifuga a 250 g durante 2 min, bajo el freno a temperatura ambiente.
- Recoger la fase superior, que contiene la FAME, y transferir a un nuevo tubo de vidrio desechable sin tapa roscada.
- Seque el FAMA recogido bajode nitrógeno a 40 ° C. Las muestras se pueden taparon y se almacenaron a -20 ° C en esta etapa hasta una semana.
5. Eliminación de la contaminación colesterol libre de FAME CE 14
(Colesterol libre puede contaminar la muestra; vea la Figura 1 en busca de rastros ejemplo cromatógrafo con y sin eliminación de colesterol).
- Coloque un tubo de residuos en el tanque de SPE y colocar un cartucho de SPE de gel de sílice en el tanque.
- Lavar la columna con 3 x 1 ml de lavados de hexano seco bajo vacío y 1 x 1 ml bajo la gravedad.
- Retire los residuos lavados y agregar nuevo tubo de residuos en el tanque.
- Disolver FAME CE en 1 ml de hexano seco, vórtice.
- Aplicar a la columna usando una pipeta Pasteur de vidrio y dejar que gotee a través bajo gravedad.
- Lavar la columna con 3 x 1 ml lavados de hexano al vacío.
- Retire los residuos lavados y colocar nuevo tubo sin tapón de rosca en el tanque de la etiqueta FAME CE.
- Eluir laFAME CE con 2 x 1 ml de hexano seco: éter dietílico (95:5 v / v) lavados.
- Seco bajo nitrógeno a 40 ° C. Las muestras pueden ser tapados y almacenados a -20 ° C en esta etapa hasta por una semana Precaución:. Éter dietílico es peligroso.
6. Transferencia de FAME en GC Auto Sampler Vial
- Añadir 75 l de hexano seco para probar, vórtice, y la transferencia a un GC muestra auto vial.
- Añadir un 75 hexano l seca aún más a la muestra, vórtice y traslado a la misma GC muestra auto vial. Las muestras pueden ser tapados y almacenados a -20 ° C en esta etapa hasta por un mes.
7. Análisis utilizando el cromatógrafo de gases 14
- Analizar FAME en un cromatógrafo de gases. Ejemplo creado: 30 mx 0,25 m x 0,25 mm BPX-70 columna capilar de sílice fundida con el protocolo de la temperatura:
Temperatura inicial de 115 ° C, mantenga 2 min, rampa de 10 ° C / min hasta 200 ° C, mantenga 18,5 min, rampa de 60 ° C / min hasta 245 ° C, hedad 4 min.
Columna: de gas helio, velocidad de flujo 1.0, 14.6 presión y la velocidad 29.
Inyector: Temperatura = 300 ° C.
Detector: El flujo de hidrógeno 40.0, aire fluya 184.0, conforman Helio gas, flujo 45.0, temperatura = 300 º C. - Establecer relación de división en su caso (por ejemplo, 25:1 para el análisis FAME CE).
- Determinar el área bajo cada pico usando el software apropiado y FAME identificar por comparación con patrones. Consulte la Figura 2, por ejemplo cromatogramas.
- Utilice el área bajo los picos de los datos para calcular la contribución de los ácidos grasos individuales como porcentaje de los ácidos grasos totales.
- Cálculo de las concentraciones absolutas de los ácidos grasos dividiendo el área del patrón interno por la cantidad añadida. Divida el área de cada ácido graso por este resultado a obtener concentraciones absolutas de cada ácido graso dentro de la cantidad de tejido usado.
Resultados
El éxito de este método depende de la siguiente protocolo con precisión y en el uso de disolventes y reactivos limpio con el fin de reducir el "ruido" y la contaminación que puede aparecer en un cromatograma. Las muestras contaminadas son más difíciles de analizar, la reducción de la exactitud de la zona bajo los cálculos de la curva. Si el protocolo es seguido con éxito un cromatograma con picos simétricos claros y bien definidos y con un mínimo de ruido de fondo debe ser obtenido como se ilustra en la Figura 3. Si se ha producido la contaminación del cromatograma mostrará picos adicionales y exhibir picos no simétricas (asimétricos) como se ilustra en la Figura 4. La contaminación de colesterol libre se producirá cuando se ejecuta FAME derivado de CE (ver Figura 1, a menos que se retira el colesterol (como se describe en el Protocolo 5).
El uso de una mezcla de calibración preparada permite la identificación de la FAME en the muestra. La mezcla de calibración se ejecuta utilizando los mismos ajustes del instrumento que las muestras de modo que el cromatograma se puede comparar con la muestra y picos correctamente identificados en base a sus tiempos de retención, como se ilustra en la Figura 2.
Área del pico se utiliza para calcular el porcentaje de ácidos grasos específicos dentro del total. Una vez que se han recogido los datos, es útil para inspeccionar ellos para los valores atípicos, como se muestra en la Figura 5. Muestras Outlier se pueden investigarse más a fondo y la extracción y / o análisis de repetirse si es necesario.
La adición de un patrón interno a las muestras (como se describe en el paso de protocolo 2.3) permite la cuantificación de ácidos grasos dentro de la muestra por cálculos utilizando el área de cantidad conocida de pico del patrón interno en relación con el área del pico de interés, y se ajusta para la volumen de la muestra original o de peso. En la Tabla 1, la fama dentro de hígado de rata CE se describen como unpor ciento de ácidos grasos totales (total de ácidos grasos g g/100) dentro de la CE hígado. Estos datos describen los ácidos grasos CE en el hígado de ratas vírgenes o embarazadas alimentados durante 20 días en una de las tres dietas diferentes. El análisis estadístico usando ANOVA de dos factores (factores: dieta, embarazada vs virgen) revela efectos significativos de la dieta y el embarazo sobre la proporción de varios ácidos grasos, así como la dieta x interacción embarazo significativas (Tabla 1). Como una ilustración, la Figura 6 muestra que el ácido araquidónico (AA; 20:4 n-6) el contenido de la CE de hígado en ratas embarazadas está más influenciada por la dieta que el de hembras vírgenes.
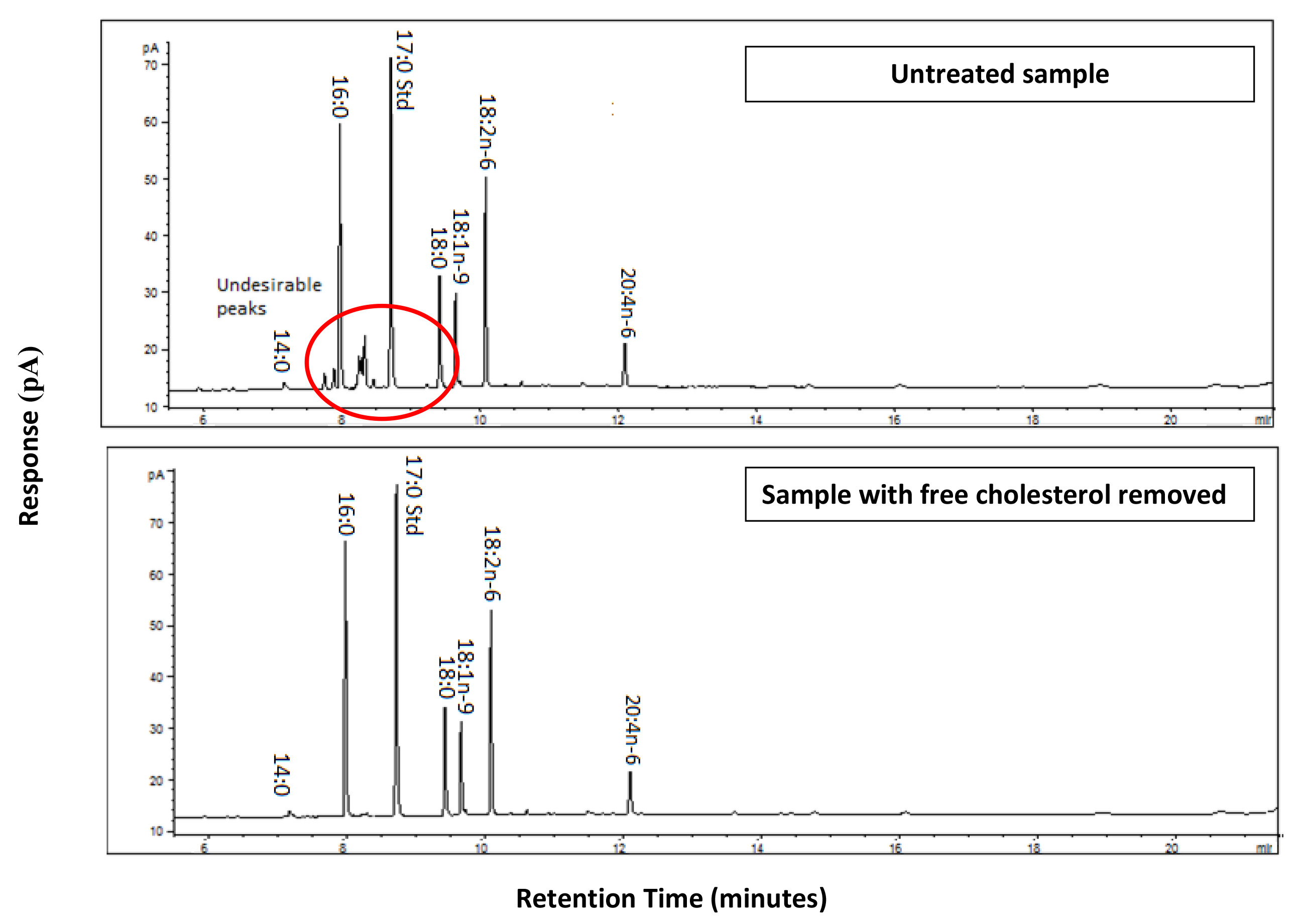
Figura 1. Cromatogramas de gas comparativos de muestras idénticas que ilustran la importancia de la eliminación de colesterol libre en el tejido de hígado de rata. La muestra no tratada muestra evidencia de contaminación colesterol libre por los picos indeseables de adición como un círculo. Estos pueden ocurrir en cualquier parte a lo largo de la muestra que puedan perturbar los picos de interés y que afectan a la exactitud de los cálculos de área bajo la curva y la cuantificación resultante de estos ácidos grasos. El cromatograma producido a partir de la muestra en la que el colesterol libre se eliminó programas bien definidos, picos distinguibles sin interferencia de fondo, lo que produciría resultados con alta precisión. Haga clic aquí para ver la imagen más grande.
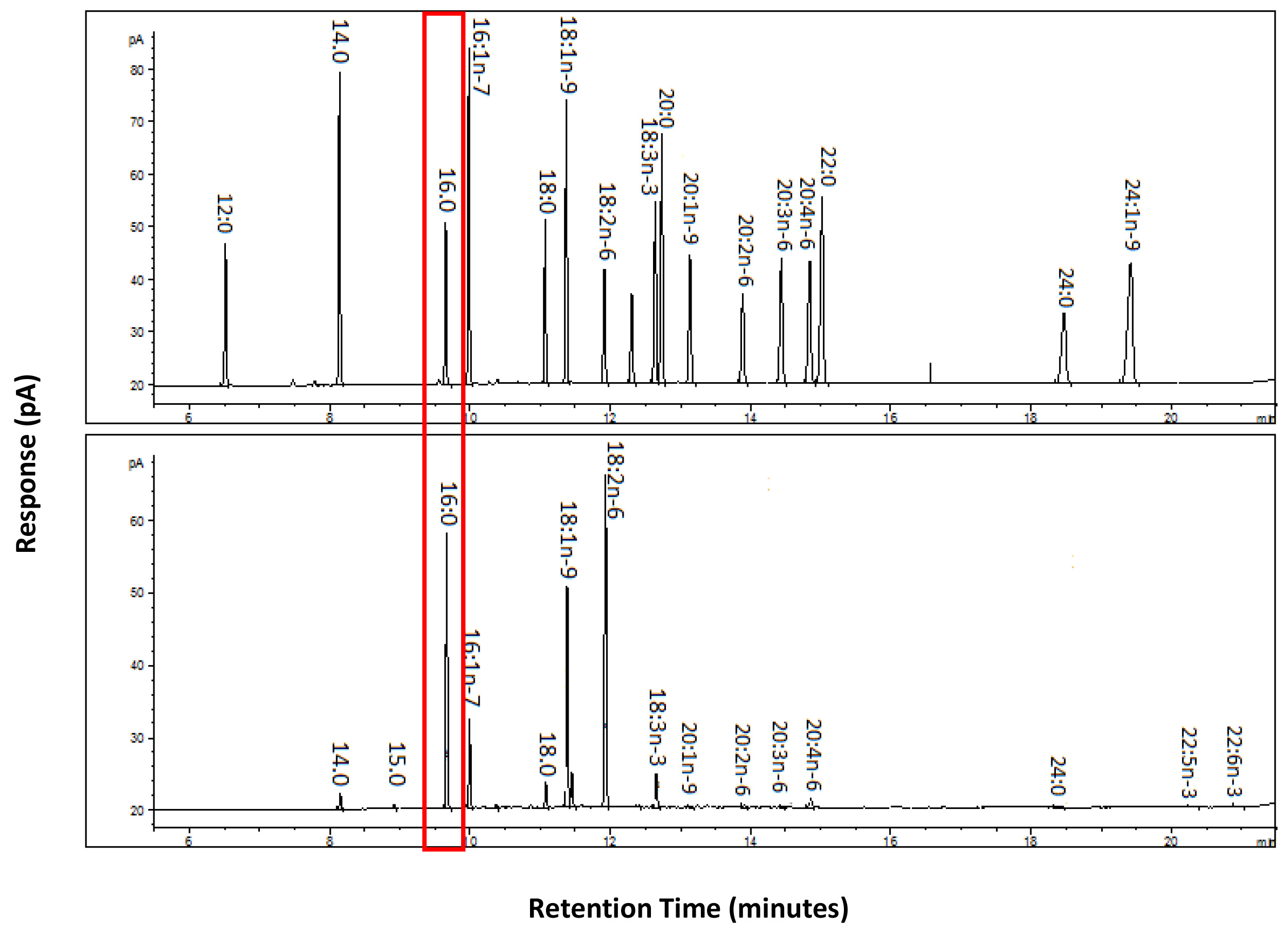
Figura 2. Ejemplo del método utilizado para identificar la muestra de CE FAME a partir de tejido de hígado de rata usando una mezcla de calibración preparada. Un PRmezcla de calibración epared se ejecuta utilizando los mismos ajustes del instrumento que las muestras de manera que los cromatogramas se pueden comparar para identificar los ácidos grasos dentro de la muestra. El cromatograma de acompañamiento para la mezcla de calibración permite que el FAME en la mezcla para ser etiquetado. Esta traza marcado puede entonces ser comparado con el cromatograma de la muestra donde grandes picos fácilmente identificables pueden ser comparados por sus tiempos de retención con los de la mezcla de calibración a continuación, debidamente etiquetados. Por ejemplo destacado en la traza. es 16:00 para ilustrar la comparación de los tiempos de retención de la mezcla de calibración por encima de los ácidos grasos en la traza de ejemplo siguiente permite el correcto etiquetado de los ácidos grasos. Haga clic aquí para ver la imagen más grande.

Figura 3. Buen ejemplo de cromatograma de gas que representa los ácidos grasos de ésteres de colesterol (como ésteres metílicos) a partir de tejido de hígado de rata. Picos de interés son fáciles de distinguir ya que son simétricas, bien definido y hay muy poco ruido de fondo. Todos los picos son ininterrumpida y no hay picos inclinados que permiten una integración fácil y precisa área bajo la curva de cálculo. Haga clic aquí para ver la imagen más grande.
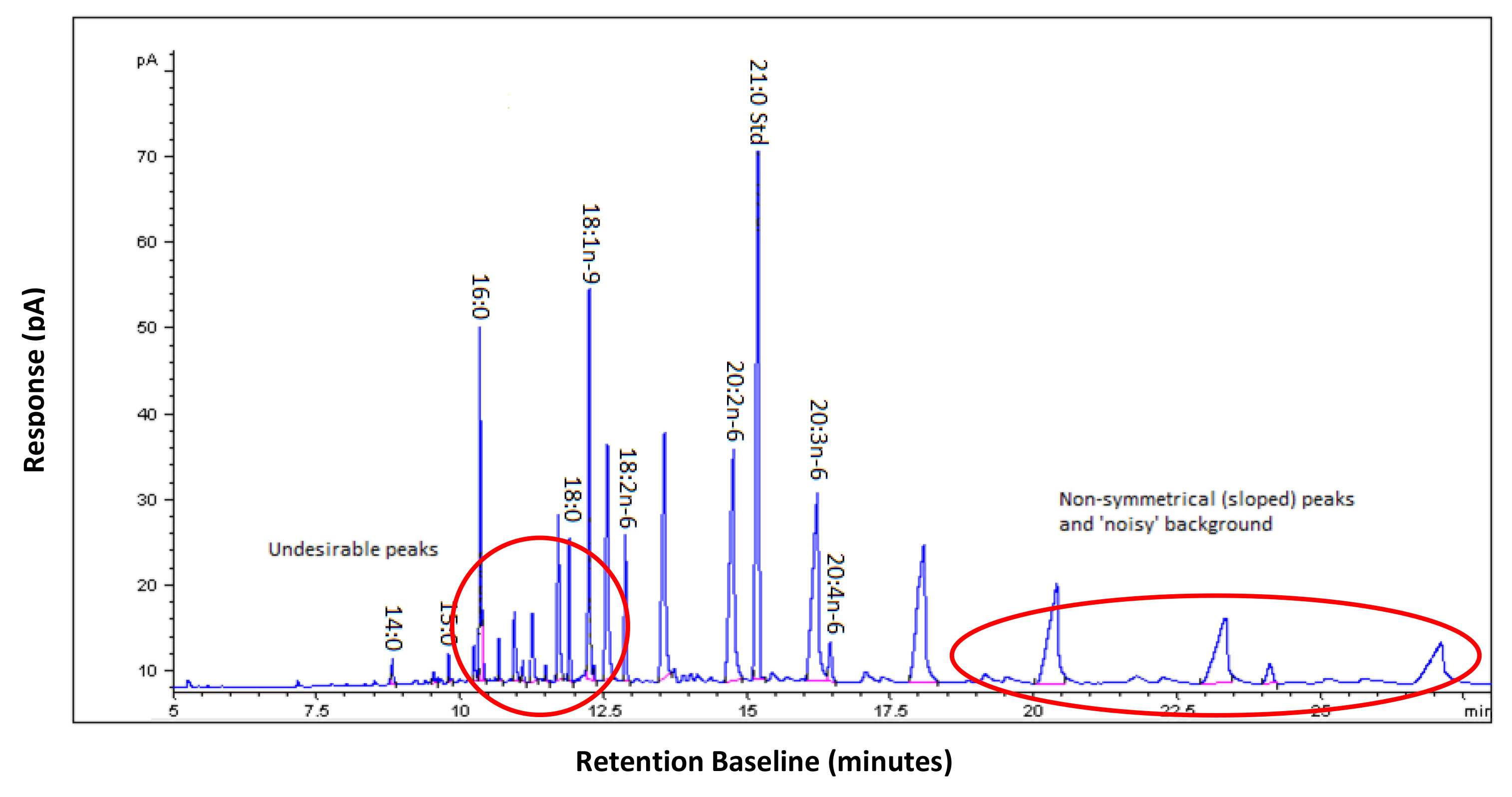
Figura 4. Ejemplo de un cromatograma de gases contaminados NEFA obtenido a partir de plasma humano. Hay muchos picos inesperados, rodeados con un círculo en el inicio de la muestra, que pueden afectar a la integración de los picos auténticos. Los picos son interrumpidos e indefinido como se ve towar DS El extremo de la muestra y se han convertido en pendiente como un círculo. Esto afectará a la exactitud de la zona bajo los cálculos de la curva y la cuantificación de estos ácidos grasos. Haz clic aquí para ver la imagen más grande.
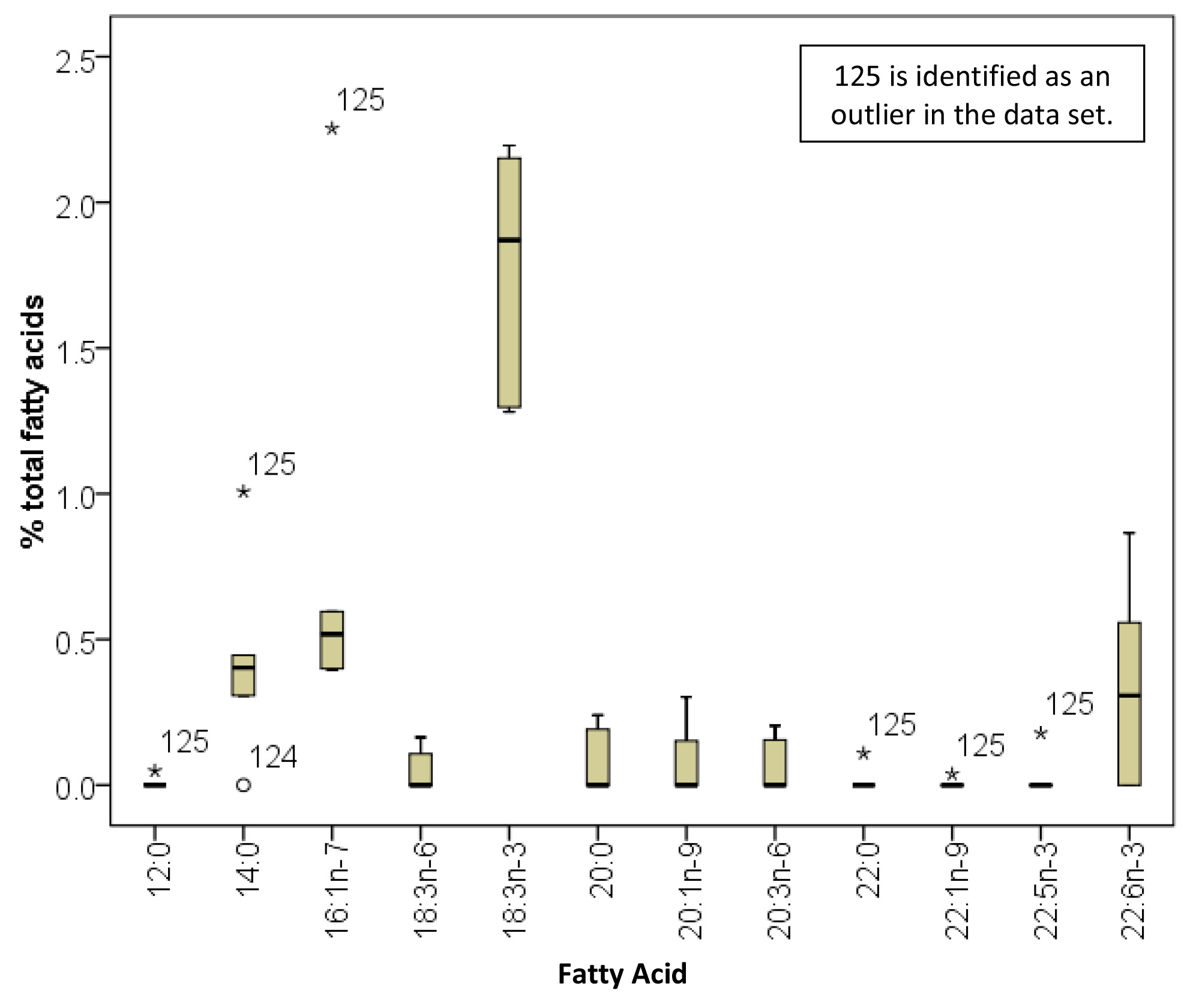
Figura 5. Identificación de los datos atípicos entre la composición de ácidos grasos de la CE de hígado en ratas vírgenes alimentados con una dieta de aceite de soja de alto contenido de grasa (n = 6). Esto ilustra cómo se pueden usar los datos de porcentaje de ácidos grasos analizados para determinar los resultados ambiguos. Estos datos indican que la muestra 125 puede ser una de las demás, y requiere mayor investigación. Los cinco principales ácidos grasos dentro de la CE (16:00, 18:00, 18:01 n-9, 18:2 n-6, 20:4 n-6) no se muestran.. "Target =" _blank jpg "> Haga clic aquí para ver la imagen más grande.
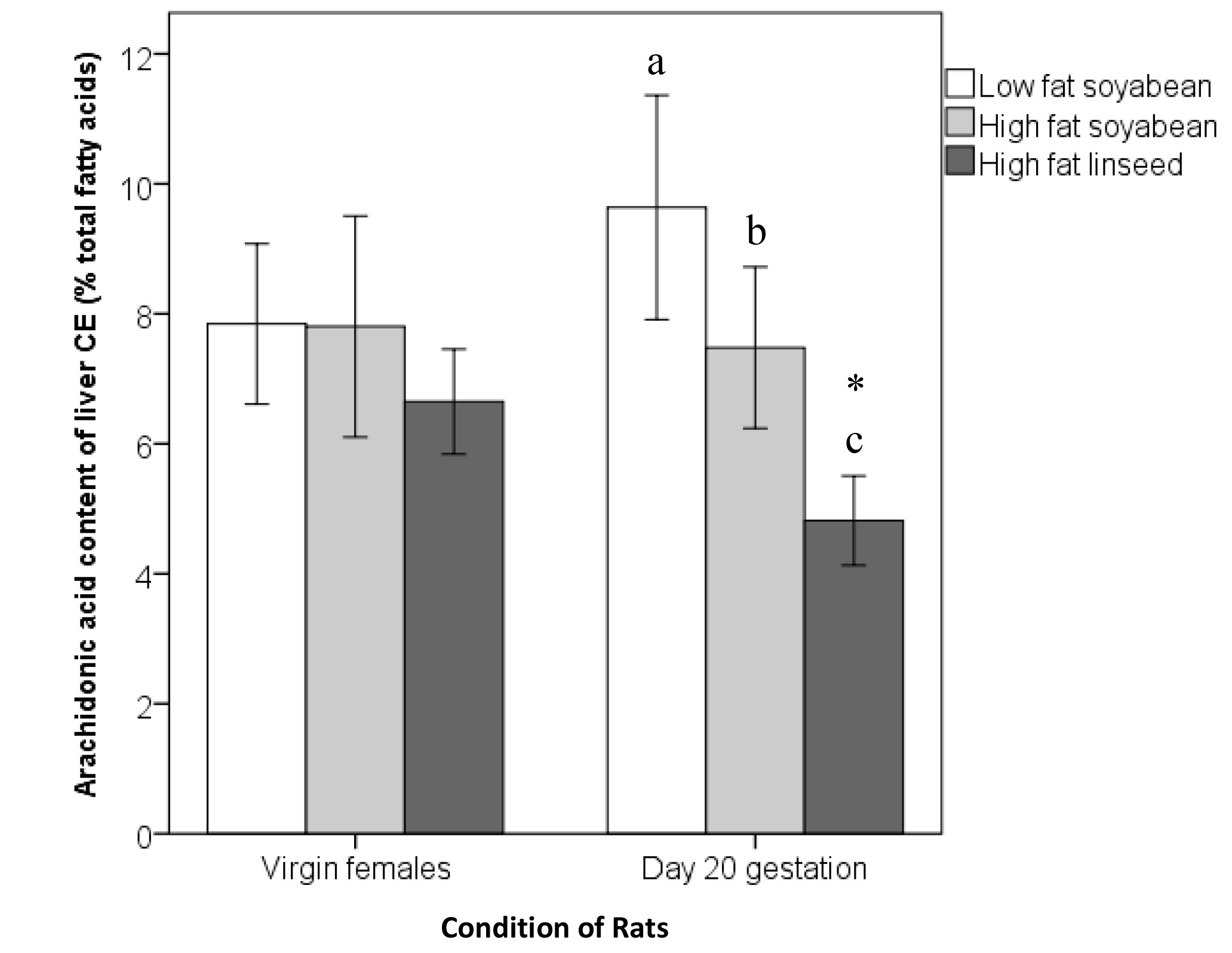
Figura 6. Contenido de ácido araquidónico de las CE de hígado entre las ratas vírgenes y embarazadas alimentados con dietas experimentales. Los valores son medias ± SD, n = 6. Medios sin una carta común difieren, P <0,05. * Diferente de hembras vírgenes dentro grupo dietético emparejado, P <0,05. Esta es una representación visual de los resultados de la Tabla 1 muestran las diferencias en el contenido de CE hígado de ratas vírgenes alimentados varias dietas comparación con las ratas embarazadas alimentado esas mismas dietas. Las diferencias se pueden ver en cada grupo de la dieta entre las ratas vírgenes y embarazadas. Haz clic aquí para ver la imagen más grande.

Tabla 1. Composición de ácidos grasos de los ésteres de colesterol del hígado de rata de ratas vírgenes y embarazadas alimentados con dietas experimentales. Los valores son medias (SD), n = 6. ND indica no detectado (media <0,1%). Medios sin una carta común en hembras vírgenes embarazadas o difieren, P <0,05. * Diferente de hembras vírgenes dentro grupo dietético emparejado, P <0,05. Esta tabla muestra los valores medios de los ácidos grasos n-3 y n-6 presentes en el tejido hepático de ratas vírgenes y embarazadas cuando se alimentan con dietas bajas y variables de alto contenido graso. Los resultados fueron analizados estadísticamente mediante análisis de la varianza (ANOVA) con un nivel de significación de p <0,05 para las diferencias entre ratas vírgenes y embarazadas, el tipo de dieta y la dieta x interacción embarazo. Resultados del ANOVA indican que existen diferencias significativas en los niveles de ácido araquidónico (20:4 n-6) entre virgen y ratas gestantes en los mgrupos dietéticos atched.
Discusión
La cromatografía de gases es una técnica precisa a utilizar para el análisis de ácido graso, y su alta reproducibilidad considere esta técnica adecuada para análisis clínicos. Columnas de CG apropiados deben ser utilizados para permitir la identificación de ácidos grasos de interés, con columnas disponibles que tiene variaciones en la polaridad de la fase estacionaria, longitud de la columna y el diámetro interno. El uso de una columna capilar de sílice fundida en este método de análisis proporciona una buena estabilidad térmica y una alta reproducibilidad de los tiempos de retención debido a su alta inercia de la superficie y buena resolución 8.
Los pasos críticos dentro de este protocolo incluyen medidas de recolección de fase superior (protocolo de los pasos 2.7 y 4.8) y menor. Es importante que, como gran parte de la fase correcta se recoge como sea posible sin contaminación con cualquiera de la fase no deseada. La presencia de contaminantes en una muestra dará lugar a una salida indeseable cromatográfica, Como se ilustra en la Figura 2. Cuando la recogida de CE durante SPE es imperativo que las columnas de cartucho se mantienen saturada con disolvente (paso 3,15) después de los lavados con hexano para asegurar que la muestra penetra en la columna para permitir la separación exitosa de la CE de la etiqueta. La separación adicional de CE para eliminar el colesterol libre es importante para evitar la contaminación que aparece en trazas cromatógrafo como se ilustra en la Figura 1. También es importante asegurarse de pasos que requieren la eliminación de líquido con vacío se siguen con precisión de manera que todo el líquido se elimina por completo de la columna para asegurar un buen rendimiento.
La principal limitación de GC es que los lípidos complejos tales como fosfolípidos y triacilgliceroles necesitan ser saponificado antes de la derivatización para formar FAME antes del análisis, lo que la información en las estructuras específicas de estos lípidos y combinaciones típicas de ácidos grasos está perdido 10. Todos los pasos enEste protocolo debe ser llevada a cabo en una campana de humos debido al uso de disolventes, lo que limita la idoneidad de entorno este método se puede realizar in Este método también puede llevar mucho tiempo para el análisis de un pequeño número de muestras, tomando típicamente dos días de trabajo para llegar de la muestra de interés para la salida de datos, a menos que se utilicen procedimientos totalmente automatizados. Sin embargo, cuando se procesan grandes números de muestras, cada etapa se puede realizar en lotes para maximizar la eficacia de esta técnica el tiempo y la disponibilidad de equipos a otros usuarios. Ciertas técnicas dentro del protocolo requieren práctica y destreza manual, como las extracciones de la fase superior e inferior (pasos 2.7 y 4.8), lo que podría ser un problema para las personas con articulaciones problemáticas o que son propensos a los efectos negativos de los movimientos repetitivos.
Pasos dentro de este método se pueden agregar o quitar fácilmente para facilitar la recogida de las diferentes fracciones para una amplia gama de muestrass, por ejemplo, de recogida de PE puede no ser necesaria en el análisis de plasma, pero es de interés en muestras de células y tejidos 10. Este método también se puede modificar para el análisis de células de extractos de lípidos totales, donde los pasos de la SPE se puede omitir si se desea. Una tal variación es que se describe para las células rojas de la sangre, que omite el paso total de la extracción de lípidos, así como los pasos 15 de la SPE. En contraste con el protocolo actual, el método utilizado en este estudio utiliza 250 l de un reactivo de metilación (14% de trifluoruro de boro), que se añade directamente a las células rojas junto con 250 l de hexano y se calentó durante 10 minutos a 100 ˚ C. La etapa de neutralización se omite y se añaden en lugar de agua y hexano; la muestra se centrifuga a continuación y la fase superior de hexano recoge y se transfiere directamente a un GC muestreador automático vial sin secado en atmósfera de nitrógeno y volver a disolver en hexano.
GC es un método versátil y proporciona reliable resultados con una serie de modificaciones disponibles 15 y se pueden utilizar para analizar una amplia variedad de muestras. Tiene ventajas más de la espectrometría de masas (MS) en el análisis de metabolismo de los ácidos n-6 y n-3 grasos, ya que es capaz de distinguir entre ácidos grasos estructuralmente similares, ya que utiliza el tiempo de retención para el etiquetado en lugar de masa atómica. La EM es capaz de identificar los ácidos grasos dentro de una muestra, pero incapaz de distinguir las posiciones de dobles enlaces en estereoisómeros y por lo tanto incapaz de decir ciertos ácidos grasos aparte. Si es necesario, ambos métodos se pueden utilizar en tándem por GC-MS 16. Esta técnica se emplea durante la investigación sobre el metabolismo y la función en el campo de la lipidomics de lípidos. El uso de GC en conjunto con MS ha llevado a grandes avances, ya que permite la manipulación de la identificación de ácidos grasos por el uso de las diferentes fases estacionarias en GC para discriminar entre ácidos grasos que solo MS no puede. GC también se puede utilizar en combinación con espectrometría de masas de impacto de electrones(EI-MS), que permite la identificación de ácidos grasos cuando se combinan con derivados químicos alternativos, tales como ésteres de picolinilo. Esto amplía el uso de la técnica y continúa mejorando el perfil lipídico como método de investigación en una serie de áreas como la fisiología, la detección de biomarcadores clínicos y patología, así como la bioquímica de lípidos 17.
Divulgaciones
Los autores declaran no tener intereses financieros en competencia.
Agradecimientos
Los autores desean agradecer la contribución de Meritxell Romeu-Nadal al estudio de la rata.
Materiales
| Name | Company | Catalog Number | Comments |
| Methanol | Fisher Scientific | M/4056/17 | 'CAUTION' Fumes - HPLC Grade |
| Chloroform | Fisher Scientific | C/4966/17 | 'CAUTION' Fumes - HPLC Grade |
| BHT | Sigma- Aldrich | W218405 | 'CAUTION' Dust fumes - Anhydrous |
| NaCl | Sigma- Aldrich | S9888 | Anhydrous |
| Hexane | Fisher Scientific | H/0406/17 | 'CAUTION' Fumes - HPLC Grade |
| Glacial acetic acid | Sigma- Aldrich | 695084 | 'CAUTION' Burns - 99.85% |
| Sulfuric acid | Sigma- Aldrich | 339741 | 'CAUTION' Burns - 99.999% |
| Potassium carbonate | Sigma- Aldrich | 209619 | 99% ACS Reagent grade |
| Potassium bicarbonate | Sigma- Aldrich | 237205 | 99.7% ACS Reasgent grade |
| Ethyl acetate | Fisher Scientific | 10204340 | 'CAUTION' Fumes - 99+% GLC SpeciFied |
| Toluene | Fisher Scientific | T/2300/15 | 'CAUTION' Fumes |
| Diethyl ether | Sigma- Aldrich | 309966 | 'CAUTION' Fumes |
| Nitrogen (oxygen free) cylinder | BOC | 44-w | 'CAUTION' Compressed gas - explosion risk |
| Aminopropyl silica SPE cartridges | Agilent | 12102014 | Cartridge - Bead mass 100 mg |
| Silica gel SPE cartidges | Agilent | 14102010 | Cartridge - Bead mass 100 mg |
| Molecular seives | Sigma- Aldrich | 334324 | Pellets, AW-300, 1.6 mm |
| Glass Pasteur pipettes | Fisher Scientific | FB50251 |
Referencias
- Browning, L. M., et al. Incorporation of eicosapentaenoic and docosahexaenoic acids into lipid pools when given as supplements providing doses equivalent to typical intakes of oily fish. Am. J. Clin. Nutr. 96 (4), 748-758 (2012).
- Cao, J., Schwichtenberg, K. A., Hanson, N. Q., Tsai, M. Y. Incorporation and clearance of omega-3 fattyacids in erythrocyte membranes and plasma phospholipids. Clin. Chem. 52 (12), 2265-2272 (2006).
- Lauritzen, L., Carlson, S. E. Maternal fatty acid status during pregnancy andlactation and relation to newborn and infant status. Matern. Child Health. 7 (2), 41-58 (2011).
- Kelsall, C. J., et al. Vascular dysfunction induced in offspring by maternal dietary fat involves altered arterial polyunsaturated fatty acid biosynthesis. PLoS One. 7 (4), (2012).
- Karpe, F., Dickmann, J. R., Frayn, K. N. Fatty acids, obesity, and insulin resistance: time for a re-evaluation. Diabetes. 60 (10), 2441-2449 (2011).
- Mossoba, M. M., Moss, J., Kramer, J. K. Trans fat labelling and levels in U.S. foods: assessment of gas chromatographic and infrared spectroscopic techniques for regulatory compliance. J. AOAC Int. 92 (5), 1284-1300 (2009).
- Chee, K. M., et al. Fatty acid content of marine oil capsules. Lipids. 25 (9), 523-528 (1990).
- American oil chemists society. Gas chromatographic analysis of molecular species of lipids. , The Oily Press, Inc. Available from: http://lipidlibrary.aocs.org (2013).
- Folch, J., Lees, M., Sloane-Stanley, G. H. A simple method for the isolation and purification of total lipids from animal tissues. J. Biol. Chem. 226 (1), 497-509 (1957).
- Burdge, G. C., Wright, P., Jones, E. A., Wootton, S. A. A method for separation of phosphatidylcholine, triacylglycerol, non-esterified fatty acids and cholesterol esters from plasma by solid-phase extraction. Br. J. Nutr. 84 (5), 781-787 (2000).
- Seppänen-Laakso, T., Laakso, I., Hiltunen, R. Analysis of fatty acids by gas chromatography, and its relevance to research on health and nutrition. Anal. Chim. Acta. 465 (1), 39-62 (2002).
- Beesley, T. E., Buglio, B., Scott, R. P. W. Quantitative chromatographic analysis. , Marcel Dekker. New York, NY. Part. (2000).
- Bartle, K. D., Myers, P. History of gas chromatography. Trends Anal. Chem. 21 (9), 9-10 (2002).
- Childs, C. E. The effect of gender, pregnancy and diet upon rat tissue fatty acid composition and immune function. , University of Southampton, School of Medicine. Available from eprints.soton.ac.uk 378 (2008).
- Harris, S. W., Pottala, J. V., Ramachandran, S. V., Larson, M. G., Robins, S. J. Changes in erythrocyte membrane Trans and marine fatty acids between 1999 and 2006 in older Americans. J. Nutr. 142 (7), 1297-1303 (2012).
- Rohwedder, W. K. Mass spectrometry of lipids (USDA). Northern Regional Research Laboratory ARS. , Available from: ddr.nal.usda.gov/bitstream/10113/29457/1/CAIN769045540.pdf (2013).
- Roberts, L. D., McCombie, G., Titman, C. M., Griffin, J. L. A matter of fat: An introduction to lipidomic profiling method. J. Chromatogr. B. 871 (2), 174-181 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados