Method Article
Imágenes in vivo de Óptica de Fibras Nerviosas Integridad de la RM con contraste en ratones
* Estos autores han contribuido por igual
En este artículo
Resumen
Este video muestra un método, utilizando una clínica 3 T escáner, por contraste mejorado la RM del ratón proyección visual ingenuo y para estudios repetitivos y longitudinales en vivo de la degeneración del nervio óptico asociadas con lesión por aplastamiento del nervio óptico aguda y degeneración del nervio óptico crónica en ratones knock-out (KO p50).
Resumen
El sistema visual roedor abarca las células ganglionares de la retina y sus axones que forman el nervio óptico para entrar en los centros talámicos y del cerebro medio, y proyecciones postsinápticos a la corteza visual. Sobre la base de su estructura anatómica distinta y la accesibilidad conveniente, se ha convertido en la estructura favorecida para los estudios sobre la supervivencia neuronal, la regeneración axonal, y la plasticidad sináptica. Los recientes avances en la RM han permitido la visualización in vivo de la parte retino tectal de esta proyección utilizando manganeso mediada aumento del contraste (MEMRI). A continuación, presentamos un protocolo MEMRI para ilustración de la proyección visual en ratones, mediante el cual las resoluciones de (200 m) 3 se puede lograr utilizando escáneres comunes 3 Tesla. Demostramos cómo la inyección intravítrea de una sola dosis de 15 nmol MnCl2 conduce a una mejora de la proyección saturada intacta dentro de 24 horas. Con excepción de la retina, se indepen cambios en la intensidad de la señaldente de la estimulación visual coincidió o envejecimiento fisiológico. Aplicamos aún más esta técnica para supervisar longitudinalmente degeneración axonal en respuesta a la lesión aguda del nervio óptico, un paradigma por el que Mn 2 + transporte completamente detenciones en el sitio de la lesión. Por el contrario, el transporte activo de Mn + 2 es cuantitativamente proporcional a la viabilidad, el número y la actividad eléctrica de las fibras de axones. Para un análisis de este tipo, ejemplificamos Mn 2 + cinética de transporte a lo largo del camino visual en un modelo de ratón transgénico (p50 NF-kB KO) mostrando atrofia espontánea de los sentidos, incluyendo visuales, proyecciones. En estos ratones, MEMRI indica reducida pero no retardada Mn 2 + de transporte en comparación con ratones de tipo salvaje, lo que revela signos de alteraciones estructurales y / o funcionales por mutaciones NF-kB.
En resumen, MEMRI puentes convenientemente en ensayos in vivo y post mortem para la histología characterizatisobre la integridad y la actividad de las fibras nerviosas. Es muy útil para los estudios longitudinales sobre la degeneración axonal y la regeneración, y las investigaciones de los ratones mutantes para fenotipos genuinos o inducibles.
Introducción
Sobre la base de su estructura neuro-anatómico favorable el sistema visual del roedor ofrece posibilidades únicas para evaluar compuestos farmacológicos y su capacidad para mediar en la neuroprotección 1 o efectos pro-regenerativas 2,3. Por otra parte, permite que los estudios sobre las características funcionales y neuro-anatómico de ratones mutantes, en fecha tan reciente ejemplifica para los ratones que carecen de la proteína de andamiaje presináptico Fagot 4. Además, un amplio espectro de herramientas complementarias ofrece que ofrece adicional de células de la retina ganglio (RGC) y los números de los axones de CGR así como la actividad de RGC, por ejemplo, por el electrorretinograma y pruebas de comportamiento, y la determinación de los reordenamientos corticales por imagen óptica de señales intrínsecas. Las últimas novedades técnicas en microscopía láser permiten una visualización in situ de regeneración RGC por imágenes de fluorescencia de tejido profundo en el conjunto de montaje de especímenes del nervio óptico (NO) y el cerebro. En este histopatología,enfoque ical, tetrahidrofurano basado claro tejido en combinación con hoja de luz de microscopía de fluorescencia permite la resolución de las fibras individuales que se vuelva a introducir en el SOBRE deafferented y el tracto 5 óptica. Si bien tales técnicas pueden ser superiores en la resolución y la determinación de los patrones de crecimiento, que no permiten análisis repetitivos y longitudinales de los eventos individuales de crecimiento, que son particularmente deseables para evaluar el proceso de regeneración a largo plazo.
Mejorada de contraste de RM ha sido empleado para la visualización mínima invasiva de la proyección retino-tectal en ratones y ratas 6,7. Esto puede lograrse mediante la entrega intraocular directa de iones paramagnéticos (por ejemplo, Mn 2 +) a células de la retina. Como un análogo de calcio, Mn 2 + se incorpora en RGC somata a través de canales de calcio dependientes de voltaje y transportados activamente a lo largo del citoesqueleto axonal del EN intacto y tracto óptico. Mientras se acumula en núcleos cerebralesde la proyección visual, es decir, el núcleo geniculado lateral (LGN) y colículo superior (SC), la propagación transsynaptic en la corteza visual primaria parece insignificante 8,9, aunque puede ocurrir 10,11. Bajo secuenciación MR, paramagnético Mn 2 + aumenta el contraste MR principalmente por el acortamiento T1 spin-red tiempo de relajación 12. Tal Mn 2 + mejorado MRI (MEMRI) ha sido aplicado con éxito en varios estudios de neuro-anatómicas y funcionales de las ratas, incluida la evaluación de la regeneración axonal y degeneración después de la lesión SOBRE 13,14, el mapeo anatómico preciso de la proyección de 15 retino tectal , así como la determinación de las características de transporte axonal después del tratamiento farmacológico 16. Mejoras recientes en la dosis, la toxicidad, y la cinética de los protocolos de RM neuronales Mn 2 + captación y el transporte, así como la mejora han extendido su aplicación a los estudios sobre transgénicos9 ratones utilizando escáneres de 3 Tesla de uso común en la práctica clínica 17.
Aquí, se presenta un protocolo adecuado para MEMRI longitudinal de imágenes in vivo del ratón proyección retino tectal y ejemplificar su aplicación mediante la evaluación de mejora de la señal de Mn 2 + dependientes en condiciones de neurodegeneración ingenuos y varios. Nuestro protocolo pone especial énfasis en la adquisición de datos de RM en un campo magnético moderado 3 T, que generalmente es más accesible que los escáneres de los animales dedicados. En los ratones no tratados previamente, se expone cómo la intensidad de señal del tracto específico puede ser sustancialmente y reproducible convertirse aumentado después intravítrea (ivit) Mn 2 + aplicación. Cuantitativamente, Mn 2 + de propagación a lo largo de la proyección visual se produce independientemente del proceso de envejecimiento normal (medida entre los ratones 3 y 26 meses de edad) y el aumento es refractario a la estimulación visual y la adaptación a la oscuridad. En contraste, Mn 2 + enriquecimiento en los centros talámicos y cerebro medio se reduce siguientes efectos agudos EN lesión por aplastamiento 18, así como en NFKB1 ratones knock-out (KO p50) que sufren de la muerte de las CGR apoptosis espontánea y la degeneración de 19. Por lo tanto, en la expansión a análisis histológico convencional, el análisis de MEMRI longitudinal de animales individuales permite perfiles de la cinética únicas de procesos neurodegenerativos. Esto puede ser muy útil para los estudios sobre la neuroprotección y la regeneración axonal asociada con las intervenciones farmacológicas o genéticas.
Protocolo
Todas las intervenciones de los animales se realizaron de acuerdo con el Convenio Europeo para la Atención Animal y Uso de Animales de Laboratorio y la Declaración de ARVO para el uso de animales en Oftálmica y Vision Research. Todos los experimentos son aprobados por el comité de ética local. El procedimiento de la lesión en ON en los ratones se describe en otro 9.
1. Intravítreas de manganeso Inyección
- Realice el Mn 2 + de la inyección de 24 horas antes de la MR scan con la ayuda de un asistente. Se anestesia a los animales mediante inyección intraperitoneal de una solución de hidrato de cloral 5% (420-450 mg / kg de peso corporal en PBS estéril). Para la anestesia tópica adicional, aplique una gota de conjuncain líquido (0,4% de clorhidrato de oxibuprocaína) a la córnea antes de la punción de los ojos. Para inyectar 15 nmol Mn 2 + por ojo preparar una mM de MnCl solución de 7,5 2, por ejemplo, mediante la dilución de 1 L de solución 2 M de MnCl de stock 1 en 132 LH 2 </ Sub> O. Carga 5 l de la solución final en una jeringa de 5 l Hamilton conectado a una aguja extraíble pequeño cubo 34 G (la aguja RN).
- Al comenzar con el ojo derecho, coloque el ratón del lado izquierdo con un microscopio binocular y suavemente abierta y fijar el ojo derecho entre el pulgar y el dedo índice de su mano izquierda. Tome la jeringa con la mano derecha y sujete la aguja cerca de la punta. Para la punción atraumática del bulbo ocular, insertar cuidadosamente la aguja en el cuerpo vítreo en la circunferencia inferotemporal aproximadamente 1 mm distal al limbo, evitando de ese modo los vasos esclerales.
- A continuación, el asistente se aplica lentamente el volumen total de 2 l, mientras que el control de la escala de la jeringa Hamilton. Durante este procedimiento, el seguimiento óptimo de colocación de la aguja en el microscopio y evitar la punción de la lente o el derrame del líquido. Mantenga la aguja insertada de forma estática para un 30 sec adicional, a continuación, retirar lentamente para minimizar el líquidopérdidas en el lugar de la inyección.
- Durante todo el procedimiento, la atención especial se debe tomar para evitar la presión en el ojo. Del mismo modo, evitar tentativas fuertes o numerosas para perforar la bombilla de ojo. Desde Mn 2 + absorción en la CGR y el transporte a lo largo del EN ya está saturado a 15 nmol MnCl2, esto minimiza las variaciones de la señal por los volúmenes de inyección ligeramente imprecisos. Para mejorar la señal bilateral de la proyección visual, repita el procedimiento de inyección para el ojo izquierdo.
- Aplicar ofloxacina que contienen (3 mg / ml) colirios y ungüentos que contengan pantenol-una vez después del procedimiento para prevenir las infecciones oculares y secado del ojo. Volver a los ratones a sus jaulas en condiciones normales de alojamiento hasta el inicio de la exploración de RM.
2. Preparación de los animales para la RM
- Se anestesia el ratón por administración de una mezcla de gas isoflurano / oxígeno 2% / 98%. Monte el ratón sobre un soporte de ratón en una posición casi horizontal, sin torsión. InsERT en la bobina de RM, que se ajusta entonces en el interior del escáner de RM. Monitorear la respiración y la frecuencia cardíaca mediante sistemas adecuados. Para más detalles técnicos, véase Herrmann et al 20.
- Durante la RM, la anestesia de suministro por insuflación continua de un inicialmente 1.5% / 98.5% mezcla de gas isoflurano / oxígeno a través de un evaporador conectado a la titular de la cabeza del ratón por un tubo integrado. Durante la exploración, ajustar la profundidad de la anestesia según los parámetros vitales registrados (es decir, aspirar a una tasa de respiración estable de alrededor de 40 respiraciones por minuto). El uso de un dispositivo de calentamiento a mantener la temperatura de la superficie corporal estable entre 35 y 37 ° C, medida por un sensor térmico colocado en el sitio abdominal del ratón. Para más detalles técnicos, véase Herrmann et al 17.
- Después de la exploración, liberar el ratón del soporte y suministrándole oxígeno puro para acelerar la recuperación de la anestesia. Además, mantener la temperatura corporal estable mediante el uso deuna fuente de calor la luz roja.
3. Protocolo de resonancia magnética
- El protocolo es validado por un Tesla escáner 3 equipado con una, bobina dedicada SNR-eficiente de pequeños animales (polarizada linealmente bobina Litz) con un campo de visión efectivo de 35 mm × 38 mm de diámetro. Haga funcionar la bobina en modo de transmisión-recepción.
- Con el animal en su posición definitiva, ajuste la melodía y el partido de la bobina con la ayuda de un analizador de frecuencias. Ajuste manualmente el voltaje de referencia del transmisor y las corrientes de la calza para optimizar la homogeneidad y calidad de imagen.
- Adquirir en T1 imágenes de EET en 2D con una resolución de 0,5 mm × 0,5 mm × 2 mm en vista sagital y transversal para la planificación. El uso de la planificación de resonancia magnética, adquirir las imágenes MEMR en la dirección de medición coronal, girado para ser paralelo a la cabeza del animal con la codificación de fase a lo largo de la dirección izquierda-derecha. Para reducir al mínimo el tiempo de adquisición, utilizar un campo rectangular de vista ajustada a laDimensiones del cabezal de reales. Emplear una secuencia FLASH 3D mimada (VIBE 3D) con los siguientes parámetros: la matriz de base 256, el campo de visión de 54 mm × 50,65 mm x 14,08 mm, con un 93,8% campo rectangular de vista en la dirección de codificación de fase, y 128 láminas de 0,11 mm grosor de corte con la resolución rebanada establece en un 61%.
- Activar la interpolación en el plano para crear imágenes finales con 512 × 480 × 128, proporcionando una resolución efectiva de 0,21 mm x 0,21 mm x 0,18 mm (0,1 mm × 0,1 mm × 0,09 mm interpolan), tiempo de eco T E = 6,51 mseg, tiempo de repetición TR = 16 ms, ancho de banda = 160 Hz / px, flip = ángulo 22 °. Aplicar dos medias y tres repeticiones para lograr un tiempo de adquisición total de (T a) de aproximadamente 30 min.
4. Análisis de los datos de resonancia magnética
- Analizar los datos utilizando el fastView syngo software. Para mejorar la señal cuantitativa, seleccione las regiones definidas of interés en grabaciones de resonancia magnética planares 2D y determinar las intensidades de señal (SI) de la estructura reforzada (SI MEMRI), fondo del tejido (SI backgr), y la desviación estándar del ruido (DS N). Cuando sea necesario, utilice un atlas del cerebro del ratón para facilitar la orientación neuro-anatómico para LGN y estructuras SC. Calcular la relación de contraste a ruido (CNR) usando la fórmula:
- CNR = (SI MEMRI - SI backgr) / SD N
- Cuantificar tres imágenes consecutivas para cálculo de la media CNR para cada muestra. En los animales inyectados bilateralmente, analizar cada hemisferio de forma independiente.
- Para la representación de imágenes horizontales, coronal y sagital, reconstrucciones multiplanares cálculo del conjunto de datos 3D MRI inicial. Estas imágenes procesadas no son recomendables para el análisis cuantitativo. Para crear reconstrucciones 3D animados (proyecciones de máxima intensidad, MIP) de la retinopatía-Tectal proyección, utilice un módulo de software de post-procesamiento de la angiografía.
5. Mn 2 + autometalografía (TIMM tinción)
- Para la tinción de TIMM de Mn 2 + estructuras cerebrales trazadas siguiendo MEMRI, inyecte una dosis de 15 a 150 nmol Mn 2 + ivit 24 horas antes de la proyección de imagen.
- Después de escanear el MR, perfundir los animales con 30 ml enfriado con hielo 0,325% de Na 2 S en PBS (pH 7,4). Diseccionar retinas y congelar las muestras en la sección congelada.
- Cortar secciones secuenciales, ecuatoriales de 15 micras de espesor sobre una cryotome.
- Realizar tinción TIMM 21 en ausencia de fijador y crioprotección de acuerdo con Angenstein et al 22.
6. Análisis estadístico
Realizar análisis estadísticos utilizando la prueba t de Student para las comparaciones individuales, seguido de correo ANOVA hoc. Los datos se presentan como media ± error estándar. Números individuales de N sondado por separado para cada experimento. Resultados alcanzando P ≤ 0,05 se consideraron estadísticamente significativas (P ≤ 0,05, *, P ≤ 0,01, **, P ≤ 0,001, ***).
Resultados
La capacidad de esta técnica de imagen para evaluar con precisión la vitalidad y funcionalidad de la proyección visual se basa en la aplicación precisa de un no tóxico Mn 2 + dosificación al cuerpo vítreo y su absorción por las CGR. Esta suposición principal se prueba en la Figura 1, donde la capa específica de Mn 2 + captación se demuestra por autometalografía (tinción TIMM) 21. Retina secciones se analizaron a las 24 horas después de la aplicación de cualquiera de ivit 15 nmol o 150 nmol Mn 2 +, o PBS como control. En este punto del tiempo, los Mn 2 + retinas inyectadas muestran mejora máxima de la señal en T1 ponderado MRI (N = 3; líneas de puntos), mientras que el PBS inyectado retina no se mejora en la señal (N = 3; línea de puntos) (Figura 1 , panel izquierdo). Tenga en cuenta la mejora de la señal hiperintensas en el ojo inyectado 150 nmol. Por el contrario, las áreas del cerebro sin contraste (asteriscos) muestran la intensidad de señal de fondo similar para todos los conditions (color verde). Ivit Mn aumenta 2 + tinción de aplicación general TIMM particularmente en la capa de CGR y la capa de fibras nerviosas (NFL) (Figura 1, inserciones magnificados en panel central), que se confirma por la investigación de somata individuo RGC siguiente H & E co-etiquetado (panel derecho).
Para formación de imágenes in vivo de la proyección del ratón retino-tectal, es crítico para seleccionar un protocolo de MEMRI ratón especial donde los parámetros operativos, así como el equipo, como se ilustra en la Figura 2, están adaptados para analizar los ratones en un campo de 3 T. La aplicación de tal configuración del escáner, nuestro trabajo anterior reveló que para los sistemas CNS resolución de imagen de una bobina de la cabeza de la rata es superior a un ratón de bobina de cuerpo entero dedicado 17. Para fijar la cabeza murino y para ajustar correctamente su posición dentro de la bobina de rata, se utiliza un soporte y un tubo cónico con barra de mordedura de plástico, ambos de los cuales están a escala reducida para satisfacer las dimensiones de la carroceríade los ratones (figuras 2A, B). Cuando las imágenes se adquieren en una transversal T 1 matriz ponderada implementar secuencias de eco de gradiente 3D, la generación de imágenes de alta resolución de (200 m) 3 dentro de 35 minutos de tiempo de adquisición se puede esperar. Recomendamos encarecidamente la supervisión constante de las funciones vitales durante la exploración. Ajuste de la anestesia junto con oxigenación postimaging y control de la temperatura del cuerpo acelera significativamente el tiempo de recuperación y garantiza tasas de supervivencia de aproximadamente el 100%. Tales precauciones técnicas son esenciales para asegurar que toda la cohorte sostendrá MRI longitudinal y repetitiva.
En cualquier estudio, sólo un Mn 2 + de dosificación no tóxico de 15 nmol se debe utilizar para la aplicación ivit 9, que es suficiente para mejorar prominente CNRS de la retina, EN, y tracto óptico hasta el LGN intracerebral presináptica y SC. Valores CNR se calculan mejor de 200 micras de espesor transversalrebanadas obtenidas a partir de conjuntos de datos de resonancia magnética originales por reslicing el volumen original 3D isotrópico. Figura 3A muestra un ejemplo de determinación CNR preciso para la mejora de LGN, donde se seleccionan tres regiones de interés en cada imagen para (1) área de señal mejorada (SI MEMRI ), (2) el tejido no afín cerebro (SI backgr), y (3) el ruido de fondo (SD N). La mejora de la señal espacial esperable cuantificado a lo largo de la totalidad de una sola proyección visual se presenta en la Figura 3B. Tenga en cuenta el fuerte aumento gradual de mejora de la señal en las secciones de la retina a lo largo del plano dorsoventral, que culmina a la cabeza del nervio óptico. Además, tenga en cuenta la falta de un relevante transsynaptic Mn 2 + de propagación en las capas corticales en las condiciones experimentales aplicadas (caída de la señal en la corteza visual). MIPs son muy ilustrativo para visualizar el posicionamiento 3D de la proyección-retino tectal in toto (Película 1). Laccumulation de Mn 2 + a lo largo de la proyección visual se determina por la cinética de la captación intracelular en CGR a través de la tensión dependiente de Ca 2 + canales y su transporte axonal rápido, así como por el relativamente bajo aclaramiento desde el tejido diana 13. De acuerdo con nuestros estudios cinéticos anteriores, mejora de la señal de Mn 2 + dependiente puede ser detectado tan pronto como 6 horas después de la inyección. Es más picos a 24 h, y se reduce de nuevo a los niveles de referencia dentro de 120 horas después de la inyección 9. Por lo tanto, para lograr resultados óptimos, MEMRI debe realizarse 24 horas después de la inyección, lo que representa la mitad del tiempo requerido para la mejora de las ratas 13.
Después de haber esbozado el principio de mejora del contraste de la proyección visual por MEMRI, nos comunicamos más las influencias de dos parámetros - la condición de luz y de los animales de edad - que pueden afectar las mediciones cuantitativas:
(1) Para probar fo la acumulación de estímulo-dependiente de Mn 2 + en los centros del cerebro medio, los ratones se mantuvieron bien en condiciones de luz-estimulado alcanzados por la exposición de la linterna de una frecuencia definida (5 Hz) y la intensidad de la luz (3 W LED) o en la oscuridad completa antes de la exploración y durante las 24 horas de Mn 2 + exposición. El análisis cuantitativo de la CNR 24 horas después de ivit Mn 2 + aplicación revela un aumento significativo en la intensidad de la señal de retina adaptada a la oscuridad en comparación con condiciones de luz estimulada (66,29 ± 3,07 vs 54,56 ± 3,08, P ≤ 0,05, N = 7 / 8; Figura 3C). Dado el gradiente en aumento de la señal entre la retina periférica y la cabeza del nervio óptico (véase la Figura 3B), aseguramos para analizar siempre correspondiente secciones de la retina dentro de todos los grupos experimentales. Análisis de la imagen a lo largo del plano ventrodorsal reveló, como se esperaba, que los valores absolutos de CNR están disminuyendo en ambas condiciones. Es importante destacar que, el reldiferencia de señal entre ativa retinas adaptada a la oscuridad y la luz sigue siendo persistente (datos no presentados). Sin embargo, mejora de la señal en las áreas de proyección de LGN (26,97 ± 1,78 vs 26,58 ± 1,05, P = 0,9, N = 7-2) y SC (25,09 ± 1,24 vs 26,81 ± 1,55, P = 0,4, N = 7 / 8) no se puede distinguir entre los entornos de acondicionamiento de luz y oscuridad (Figura 3C). Este ensayo demuestra que la absorción de Mn 2 + en capas de la retina es sensible a la exposición a la luz, mientras que su propagación a lo largo de la proyección retino-tectal y la acumulación en las zonas de destino no está influenciada por la estimulación visual coincidente. Alternativamente, la sensibilidad de la señal del escáner 3 T podría ser por debajo del umbral de detección de variación de la señal en el LGN o SC.
(2) Para explorar las implicaciones de la edad del animal en la mejora de la señal MEMRI relacionados de la proyección visual, se analizaron los ratones entre los 3 y 26 meses oedad f. Valores de CNR en el LGN de los ratones 3 meses de edad (23,49 ± 1,36, N = 12) no difieren de la intensidad de la señal medida en ratones de edad de 7 meses (23,90 ± 0,81, p = 0,79, N = 16), 13 meses (23,35 ± 1,29, P = 0,94, N = 10) o 26 meses (25,10 ± 2,29, P = 0,53, N = 6; Figura 3D). Del mismo modo, la intensidad de la señal en la SC es sin cambios entre 3 meses (19,01 ± 1,20) y 26 meses de edad (16,92 ± 2,18, p = 0,37; Figura 3D). Aunque un ligero aumento es evidente en los valores de la CNR de retinas de 26 meses (38,49 ± 3,25), este aumento no alcanzó significación en comparación a lo largo de todos los grupos (P> 0,05). Estos experimentos indican que la mejora de la señal en las zonas objetivo cerebrales de la proyección visual no se ve afectada por la estimulación visual y envejecimiento fisiológico.
A continuación, se demuestra la sensibilidad de MEMRI para detectar alteraciones estructurales of la proyección visual causado por axonopatía aguda y crónica. Para explorar esto, un modelo de degeneración walleriana inducida por la lesión traumática EN 18, así como un modelo animal que muestra la degeneración precoz y espontánea de las proyecciones sensoriales incluyendo la vía visual 19 estaban empleados:
(1) axonopatía traumática inducida por la lesión por aplastamiento EN provoca la rotura de Axona fascículos. En consecuencia, el transporte retino-tectal de Mn 2 + a lo largo del citoesqueleto axonal será completamente y de forma sostenible bloqueada, como se visualiza por la pérdida completa de la señal de Mn 2 + mejorado en el LGN y SC analizó un día (que no se muestra), una semana (Figura 4A , líneas de puntos) y 4 semanas (no se muestra) después de la lesión. Para demostrar claramente las características de RM neuroanatómicas y consecutivas de una lesión en ON y la disección del estado ingenuo, la lesión fue infligida sólo de manera unilateral. Esto da como resultado inalterado Mn 2 + transporte en tél control lateral en contraste a la interrupción del trazador en el lado de la intervención. Análisis de los valores de CNR en las áreas deafferented confirma la ausencia completa de mejora de la señal (no mostrado). Este experimento demuestra, además, que MEMRI es altamente sensible en la detección de la localización y la gravedad de un sitio de la lesión por la evaluación longitudinal de la intensidad de la señal a lo largo de la proyección antes y después de la lesión (Figura 4B). Mientras que la intensidad de la señal a lo largo de la EN antes de la lesión se mantiene constantemente por encima de la señal de fondo, hay una caída temporo-espacial en intensidad de la señal al nivel de fondo un día después de la lesión en ON.
(2) Nuestro trabajo previo demostró que Mn 2 + dependientes de mejora de la señal en el LGN se reduce en 10 meses de edad ratones que carecen de la subunidad p50 de NF-kB, medida 24 horas después de la inyección 9. La detección de este con una alta fiabilidad, se asumió un deterioro general de la retinopatía tectal Mn 2 + transpuerto, posiblemente causada por un número reducido de CGR y relacionados sobre la neuropatía en el envejecimiento p50 KO ratones 19. Alternativamente, la mejora de la señal reducida podría estar asociado con una captación neuronal retardada y la propagación de Mn 2 + desde el cuerpo vítreo y a lo largo de la proyección patológica. Esta última posibilidad puede explorarse mediante la realización de exámenes de IRM repetitivas después de una sola aplicación de 15 nmol Mn 2 + y el estudio de la cinética de la mejora de la señal en la retina y LGN en temprano (8 y 24 horas) y tarde (48 y 72 horas) el tiempo puntos. En tipo salvaje y p50 ratones KO, picos de mejora de señales de la retina a las 8 horas a las tasas casi idénticas de mejora (43,52 ± 3,24 y 40,72 ± 2,79, p = 0.6, N = 3-6; Figura 4C, izquierda). Mientras mejora de la señal sigue siendo alta en los tipos silvestres en 24 horas después de la inyección, se declina en p50 ratones KO (43,38 ± 2,18 vs 32,89 ± 1,54, P ≤ 0,01, N = 5-8). Durante las fases posteriores (48 y 72 h), mejora de la señal disminuye en ambos grupos (con valores CNR consistentemente más bajos en los ratones knock-out), lo que excluye un Mn retina retrasado 2 + captación y propagación en p50 ratones KO. Los correspondientes resultados en el LGN de p50 KO ratones confirman esta idea. Aunque la CNR es significativamente más baja entre 8 y 48 horas después de la inyección (P ≤ 0,05, N = 5-9), la cinética de la atenuación de la señal en p50 KO ratones corresponde a la de los ratones de tipo salvaje (Figura 4C, derecha). Por lo tanto, la reducción de mejora de la señal-temporo espacial de la proyección-retino tectal se debe a la reducción de los números de los axones procedentes de una población RGC limitada en lugar de cinética de transporte deteriorados. Proponemos MEMRI ser una herramienta valiosa para detectar mutantes genéticos de ratón para los deterioros projectional en el SNC.
contenido "fo: keep-together.within-page =" always ">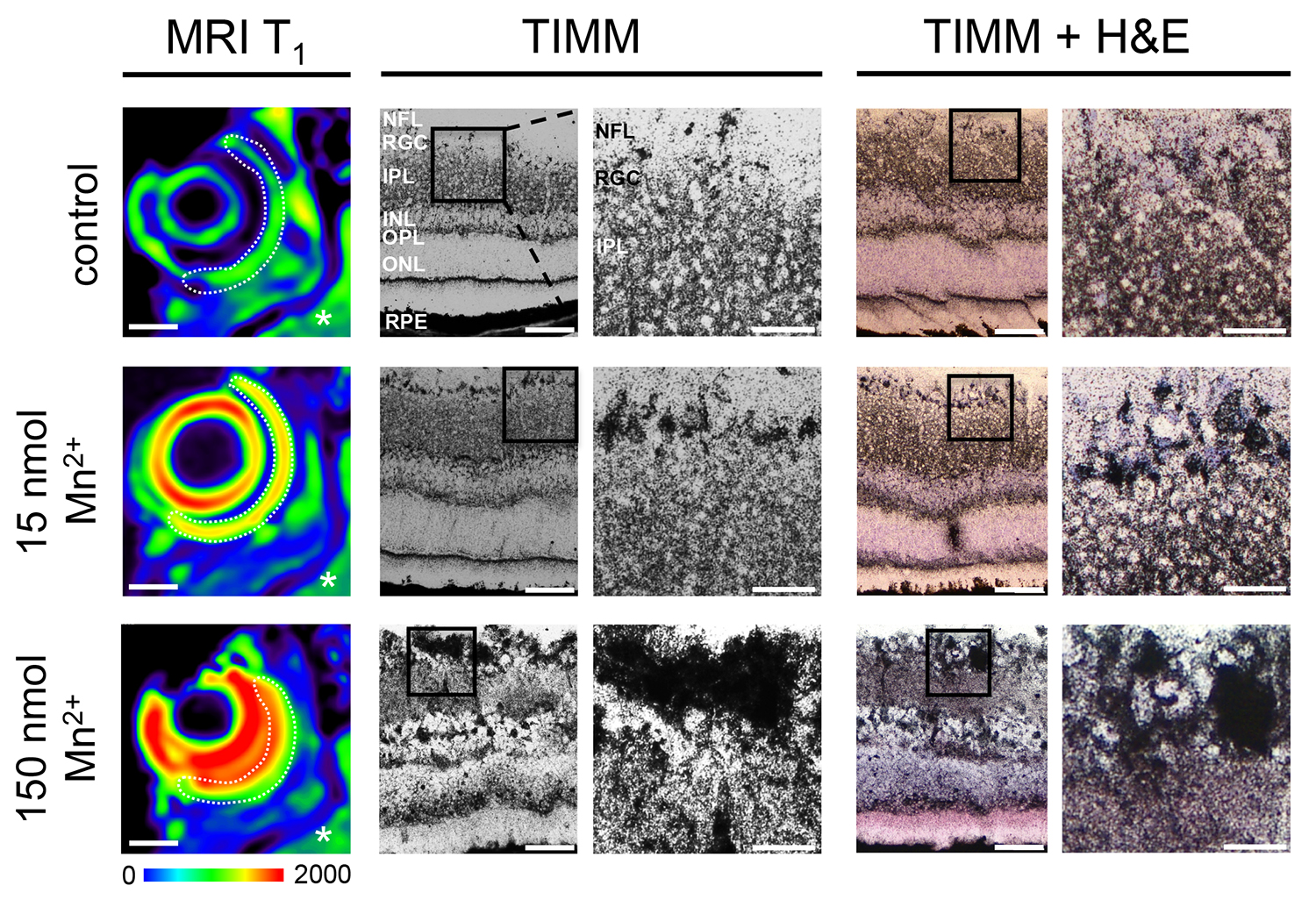
Figura 1. Tinción TIMM de Mn 2 + captación en CGR. Representativas imágenes del mapa de calor en T1 MRI (resonancia magnética T 1) muestran aumento de la señal de la lente y de toda la circunferencia de la retina (línea punteada) 24 horas después de la aplicación ivit de 15 nmol, y mejora de la señal muy intensiva, después de la aplicación de 150 nmol Mn 2 + (izquierda). Los colores cálidos representan valores de señal más altos que los colores fríos. Barra de escala: 1 mm. Medio / derecha: Mn 2 + captación por CGR tras la inyección ivit de MnCl2 detectada por precipitación de plata mediante la tinción de TIMM (color negro). Secciones de retina de control tratados con PBS demuestran tinción más bien débil y la diferenciación difusa de la capa de CGR (RGC) (parte superior, N = 3). Gran aumento no permite d. a discriminación de las células individuales (inserciones amplificadas) Ivit de MnCl aplicación 2 aumenta diferencialmente tinción general de plata a través capas de la retina, con una precipitación de plata destacado especialmente en la capa de fibras nerviosas (NFL), la capa de CGR, y la capa nuclear interna (INL, media e inferior , inserciones amplificadas, N = 3). Colabeling de TIMM con H & E tinción confirma aún más dicha capa específica Mn 2 + acumulación (panel derecho). La barra de escala, descripción: 50 micras, la ampliación: 25 m. IPL, la capa plexiforme interna; OPL, capa plexiforme externa; ONL, capa nuclear externa; RPE, el epitelio pigmentario de la retina.

Figura 2. Fotografías que muestran equipos de resonancia magnética específicamente para la adquisición de imágenes MEMR ratón en un escáner 3T clínica. A) muestra la cuna del ratón a medida con bite fijación cabeza de la barra y el sensor de monitorización respiratoria (almohadilla blanca, tubo de color azul). B) muestra el ratón posicionado y fijado en la cuna. Los tubos a la izquierda de suministro del gas anestésico. C) ejemplifica el posicionamiento de la cabeza del ratón y el soporte dentro de la bobina de Litz polarizada linealmente que opera en el modo de transmisión y de recepción. D) muestra la plataforma de la bobina en frente del tubo de protección y el clínico 3 T escáner. El tubo recubierto de cobre brinda protección adicional contra el ruido y bloquea la señal de resonancia magnética de la rejilla de calefacción a base de agua caliente (envoltorio negro alrededor de la sonda). E) visualiza la completa puesta a punto de la bobina de los animales en el poro del escáner 3 T sólo antes de colocar la cabeza del animal, precisamente, en el isocentro dentro del escáner.
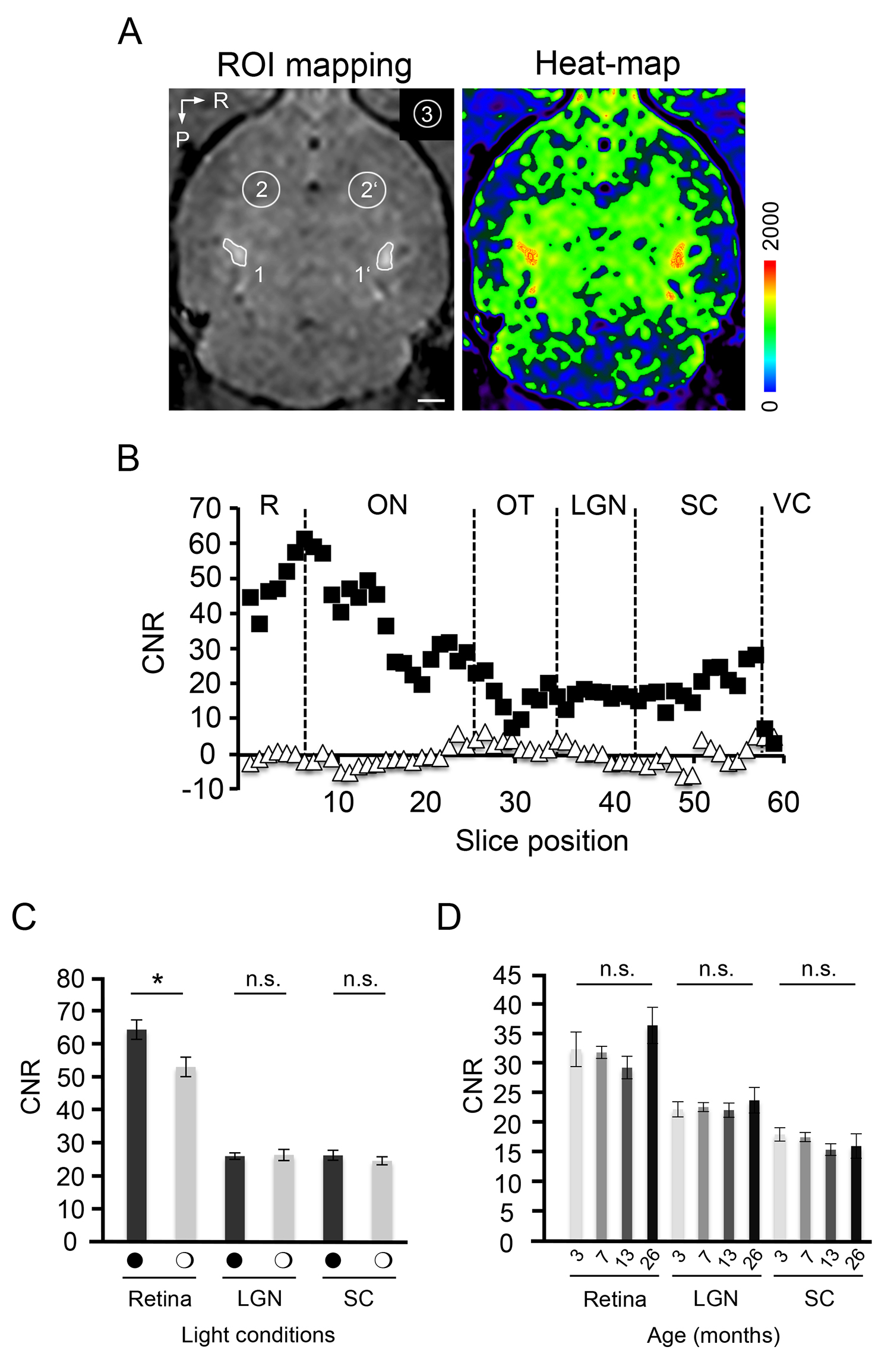
Figura 3. MEMRI de la proyección-retino tectal ingenuo en diversas condiciones de luz y de edad. A) Ilustración de la región de interés (ROI) de mapeo en una mayor LGN y el tejido de fondo en una resonancia magnética transversal grabación (izquierda). Mejora de la señal específica LGN se ilustra con un mapa de calor de presentación (a la derecha). 1 y 1 ', a la izquierda ya la derecha LGN; 2 y 2 ', el tejido de fondo; 3, el ruido; P, posterior; R, a la derecha. Barra de escala:. 100 m B) la cartografía espacial de la mejora de la señal a lo largo de una sola proyección retino tectal determinado a partir de imágenes de RM rebanadas transversales adquiridas originalmente por MEMRI. Los cuadrados rellenos, mejora de la señal de Mn 2 + dependientes; triángulos en blanco, señal de fondo. R, la retina; ON, el nervio óptico; OT, tracto óptico; LGN, núcleo geniculado lateral; SC, colículo superior; VC, corteza visual. Grosor de corte, 200 m. C) la estimulación de luz reduce significativamente mejora de la señal de la retina. Enhancement en el LGN y SC es independiente de la estimulación visual. Los símbolos en negro, oscuro-la adaptación; círculos abiertos, adaptación a la luz. D) mejora de la señal es independiente del aumento de la edad entre los 3 y 26 meses.

Figura 4. MEMRI de la proyección retino-tectal en condiciones neurodegenerativas. A) MEMRI de los ratones inyectados bilateralmente ivit realizó una semana después de la lesión por aplastamiento unilateral de la derecha. Reconstrucciones multiplanares de puntos de vista horizontal, coronal, y lateral muestran ausencia total de aumento de la señal en el LGN y SC para el hemisferio lesionado (líneas punteadas). c, hemisferio contralateral; i, hemisferio ipsilateral. Barra de escala:. 1 mm B) Imágenes MIP y el análisis de resonancia magnética longitudinal de la mejora de la señal espacial a lo largo del ON antes yun día después de la lesión. R, la retina; ON, el nervio óptico; flecha, lugar de la lesión. Barra de escala:.. 0,5 mm C) Cinética de la mejora de la señal en virtud de la neurodegeneración crónica de la proyección visual en p50 ratones KO temprano (8 h) la absorción de Mn 2 + en las células de la retina no se ve afectada, pero ya se reduce en el LGN de p50 ratones KO. De formación de imágenes MR repetitiva en 24, 48, y (sólo para la retina) a las 72 horas muestra la reducción sostenida de la señal, pero cinética similar de Mn 2 + de transporte y la acumulación en la retina y LGN de p50 ratones KO.
Película 1: Animated, presentación de calor-mapa en 3D de la in situ proyección retino tectal contraste mejorado la RM se realizó 24 horas después de la inyección ivit bilateral de 15 nmol MnCl2.. Los datos se presentan en el modo de MIP. Grosor de corte, 200 m. Haga clic aquí para ver el vídeo.
Discusión
MEMRI del sistema visual se extiende técnicas neurobiológicos convencionales para evaluar la funcionalidad en condiciones no tratados previamente y patológicos. Además de proporcionar una visión única de la integridad de un hecho aislado CNS tracto de fibras, MEMRI puede ser fácilmente complementado con pruebas de comportamiento, por ejemplo, optometría y tareas a base de agua visualmente, para investigar las consecuencias inmediatas de un determinado paradigma de la percepción visual. También vincula electrofisiológico y las investigaciones histológicas con la caracterización visual funcional in vivo. La técnica es muy fiable y reproducible con variaciones interindividuales menores dentro de grupos idénticos (ver barras de error en las Figuras 3, 4). Curiosamente, a una dosis de 15 nmol, Mn 2 + absorción y el transporte axonal son procesos saturado, de modo que mejora de la señal alcanza una meseta que no puede ser elevado por adicional Mn 2 + de suministro 9. Desde una perspectiva prácticaopinión, una respuesta a la dosis minimiza tales características, al menos hasta cierto punto, de inyección de variaciones asociadas en la mejora de la señal. En particular, los datos presentados sobre la dosificación y la cinética de la mejora de Mn 2 + señal son específicos para los ratones y distinta de las de las ratas, que requieren una 10-20x mayor Mn 2 + de dosificación, aproximadamente, y aumento de la latencia (36 hr) para lograr la mejora del contraste óptima 13,23. Además, mejora a lo largo de la proyección visual sigue siendo consistente entre una edad de los animales, de 3 y 26 meses. Este resultado está en línea con las pruebas visuales realizadas en ratones de envejecimiento y el hecho de que los ratones C57/B6 mantener la actividad visual normal hasta los 2 años de edad de 24 años. Aunque no analizamos los ratones individuales longitudinalmente en el estudio de envejecimiento, los resultados anteriores demuestran claramente la seguridad de Mn 2 + dosificaciones administradas de forma repetitiva de 15 nmol para el mantenimiento visual 9, lo que podría ser deseable en estudios de envejecimiento longitudinales.
De acuerdo con la noción de que Mn 2 + se incorpora en CGR, mostramos Mn 2 + captación en su somas por tinción TIMM que se basa en la precipitación de plata de iones metálicos libres, tal como se aplica por Angenstein et al. Para intracerebral Mn 2 + detección siguiente su aplicación sistémica 22. Anteriormente, intracerebral Mn 2 + Distribución se detectó por autorradiografía de 54 Mn 2 + isótopo para delinear los circuitos neuronales del SNC de la rata 25, pero no en el nivel celular. Aquí, la tinción de TIMM permite la atribución de Mn 2 + captación de poblaciones de células distintas dentro de la retina expuesta, donde encontramos la precipitación de plata prominente en la RGC y capas de fibras nerviosas. Cabe señalar que el protocolo de espectáculos aplica la detección mejorada por tinción TIMM después de la aplicación de una dosis de 150 nmol en comparación con 15 nmol de Mn 2 +. Aunque Mn 2 + captación y su axonal transpuerto ya está saturado a 15 nmol, por tanto, confiere ningún aumento adicional CNR lo largo de la proyección-retino tectal con dosis más altas, la suplementación excesiva puede aumentar la disponibilidad de conexión, la proteína no unida Mn 2 + y así render accesible para la precipitación de plata. Mejoras futuras en la sensibilidad tinción permitirán a la correlación de los valores de CNR de proyecciones específicas del sistema nervioso central con la localización celular de Mn 2 + de enriquecimiento dentro de una región histológico definido basados en MEMRI. Tal capacidad también podría ser útil para la caracterización y cuantificación de Mn 2 + Distribución en otras regiones del SNC fuera de la proyección visual. Del mismo modo, Mn 2 + se ha empleado en un modelo de toxicidad kainato para visualizar la degeneración y la regeneración de las fibras musgosas del hipocampo 26.
Mn 2 + es tomado por los canales de calcio voltaje dependientes y se distribuye de forma intracelular en transporte axonal activa, que can ser bloqueado por el tratamiento con colchicina 25,27. Experimentos de estimulación visual en ratas que recibieron una dosis intraperitoneal de MnCl2 han puesto de manifiesto un aumento de la mejora de la señal en la retina interna y, en particular, exterior 28. De este modo, adaptación a la oscuridad aumenta aún más la intensidad de señal en las capas externas de la retina en comparación con las ratas expuestas a sólo condiciones de luz ambiente, lo que indica la sensibilidad de la retina Mn 2 + captación a la estimulación visual 28. Del mismo modo, nos encontramos con la intensidad de señal mejorada en la retina de los ratones adaptados a la oscuridad en comparación con los ratones expuestos a la estimulación visual después de ivit Mn 2 + aplicación. Esto podría estar relacionado con las propiedades electrofisiológicas específicos de la retina y la generación de una corriente de oscuridad continua en las células fotorreceptoras. Desde Ca 2 + afluencia en los segmentos externos de los fotorreceptores contribuye significativamente a la constitución de la corriente oscura, su generación podría estar acompañadopor una mayor co-absorción de Mn 2 + en la capa de células fotorreceptoras bajo oscuridad. En contraste, la estimulación de la luz reduce la corriente de oscuridad y provoca la hiperpolarización de las células fotorreceptoras 29. De este modo, en general Mn 2 + captación podría verse disminuida en condiciones de luz.
Para un uso confiable de MEMRI, es importante aclarar si el Mn más pronunciada 2 + captación en la retina adaptada a la oscuridad altera mejora de la señal a lo largo de otras partes de la proyección visual o incluso la totalidad de su extensión. Cambios de estimulación dependiente de la intensidad de la señal de las redes cerebrales MEMRI se han demostrado para el sistema acústico después intraperitoneal Mn 2 + aplicación 30. En este estudio por Yu et al., Las ratas fueron expuestas a las frecuencias de ruido de variables antes de los exámenes de IRM y T 1 mejora de la señal ponderada del colículo inferior se investigó posteriormente. Estimulación acústica se encontró que significantemente aumentar la intensidad de señal de MEMRI en una representación tonotópica, ejemplificando así el carácter fMRI-como de Mn 2 + acumulación dependiente de la actividad 30. En contraste, en nuestro juego experimental Mn 2 + acumulación en el LGN y SC parece independiente de la estimulación visual. Sin embargo, tales diferencias en sensoriales intentos de mapeo cerebral podrían surgir del campo magnético inferior y el umbral limitado de detección de nuestro 3 T escáner en comparación con el alto campo de 7 T escáner utilizado por Yu et al 30.
Hasta la fecha, no se sabe hasta qué punto los parámetros biofísicos afectan el transporte axonal anterógrado de Mn 2 + y cómo MEMRI podría servir como un indicador de la actividad eléctrica. Sin embargo, parece que el Mn 2 + transmisión por CGR se produce, al menos en parte, independientemente de la luz estimulación específica y la entrada eléctrica recibida a partir de células bipolares. Alternativamente, el efecto neto de un eléctricactividad dentro de la proyección-retino tectal podría ser el resultado de la estimulación eléctrica de la oscuridad de respuesta 'OFF-CGR-y la luz-sensible' ON-CGR. Esta interpretación se ve apoyada por el hallazgo de que Mn 2 + de transporte a lo largo de la proyección-retino tectal no se altera en las cepas de ratón con mala visión, tales como ratones CBA portadoras de la mutación del gen rd1 PDE6B causan degeneración de la retina 11. En un estudio cinético de tipo salvaje ratones con deficiencia visual y la CBA, se observaron tasas de transporte comparables durante la fase inicial de afluencia (a 2,5 horas después de la inyección) y para la mejora de la señal final (a las 24 h) en el LGN y SC 11.
Tomados en conjunto, estas observaciones apoyan la idea de que MEMRI, por ejemplo, del sistema visual como se ejemplifica aquí, representa una medida valiosa para la integridad estructural y la estabilidad metabólica en lugar de para la actividad eléctrica. Prácticamente, el aparentemente smesa de independencia de mejora de la señal en LGN cerebral y SC de exposición a la luz permite un manejo robusto y alojamiento de los animales sin el cuidado especial sobre la iluminación. Por otro lado, para los estudios de MEMRI que se centran en la mejora de la señal de la retina, es necesario mantener a los animales en condiciones de luz muy controladas antes del examen.
Entre los parámetros fisiológicos que afectan Mn 2 + tasas de transporte axonal y mejora de la señal MEMRI posterior, la estabilidad de la temperatura corporal puede ser de particular importancia. Esto se indica por los estudios sobre intranasal Mn 2 + para la mejora de los objetivos de proyección olfativos primarios en el cerebro, donde se encontró el enriquecimiento que se disminuyó significativamente a una reducción temporal de la temperatura corporal a 30 ° C en comparación con la señal de mejora en condiciones de temperatura normal del cuerpo 27. Por lo tanto, la temperatura del cuerpo debe controlarse y ajustarse antes de y durante el MR escanea no sólo a Proteger salud de los animales, sino también para normalizar los parámetros fisiológicos de Mn 2 + de propagación.
Dado que las alteraciones fisiopatológicas y alteraciones metabólicas afectan a la eficacia del transporte axonal de Mn 2 +, mejora de la señal en los centros de proyección, por ejemplo, LGN y SC, pueden servir como una medida de la integridad estructural y la actividad funcional de esta vía. A continuación, presentamos dos condiciones diferentes de EN degeneración e ilustramos que Mn 2 + de propagación y el enriquecimiento de los centros talámicos y cerebro medio varía en función de la integridad axonal. La lesión aguda ON en una pérdida total de la señal inmediatamente después de la lesión, que no se recupere en un plazo de 4 semanas debido a la falta de regeneración axonal relevante, mientras que la degeneración axonal lento en el p50 KO mutante se refleja en valores reducidos de CNR en el LGN. Dada la posibilidad de formación de imágenes longitudinal, esta aplicación de MEMRI podría ser valiosa fo seguimiento de las respuestas de crecimiento post lesión de la ON y permitir la investigación de las intervenciones genéticas o farmacológicas proregenerative a la CGR.
Además, presentamos MEMRI como un método altamente sensible para detectar alteraciones graduales en mejora de la señal que están asociados con los procesos de degeneración axonal crónicas. El factor de transcripción NF-kappa B está implicado en el mantenimiento neuronal y ratones con deleción de la subunidad p50 de NF-kB pantalla pérdida de células neuronales dependiente de la edad y degeneración axonal en el sistema visual 19. Además de histológico y microscópico de electrones analiza, MEMRI de la proyección retino-tectal es capaz de identificar alteraciones fenotípicas en estos ratones. Por adquisición de T de serie 1 imágenes de RM ponderadas siguientes ivit Mn 2 + aplicación, distinguimos un conjunto reducido de un Mn 2 + transporte simplemente retrasado a lo largo de la vía visual en estos p50Ratones KO. De este modo, la adquisición de datos repetitivos por MEMRI después de una sola Mn 2 + aplicación permite la definición de la cinética de transporte axonal y alteraciones neurofisiológicas en la piscina inestimable de ratones modificados genéticamente disponibles. Actualmente, varias modificaciones de MEMRI están bajo investigación con el objetivo de hacer que esta técnica segura para aplicaciones de diagnóstico en seres humanos. Un enfoque prometedor de alta relevancia clínica, que constituye una alternativa a ivit inyección, es la entrega de Mn 2 + como gotas para los ojos. De este modo, la administración tópica de 1 M MnCl2 produjo una mejora significativa de la señal en un 20% en el SC cuando las imágenes se adquirieron en un 4,7 T escáner animales 31. El método fue capaz de detectar extensa sobre la degeneración después de la isquemia de la retina 31, y la concentración aplicada demostró seguro cuando se aplica repetidamente en intervalos mensuales 32. Dada la relativamente elevada neurotoxicidad del Mn 2 + 9 se necesitan futuros estudios para definir si esta estrategia es lo suficientemente sensible para detectar SOBRE patologías ya en estados tempranos cuando se aplica en concentraciones tolerables. Dicha investigación será útil para soportar aplicaciones clínicamente relevantes MEMRI, por ejemplo, para el diagnóstico de la esclerosis múltiple y otras neuropatías.
En resumen, nuestro estudio demuestra que MEMRI es un enfoque experimental poderosa para estudiar trazados de circuito retinopatía tectales en ratones, que se extiende por lo tanto las tareas de optometría para evaluar la funcionalidad del sistema visual.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
AK es apoyado por la Fundación Oppenheim y RH con el apoyo de la Fundación Velux. Agradecemos I. Krumbein de técnica y K. Buder apoyo histológico, y J. Goldschmidt (Instituto Leibniz de Neurobiología, Magdeburg, Alemania) para el asesoramiento técnico en la tinción de TIMM.
Materiales
| Name | Company | Catalog Number | Comments |
| Manganese (II) chloride solution 1 M | Sigma Aldrich, Taufkirchen, Germany | M1787 | MEMRI contrast reagent |
| Conjuncain | Dr. Mann Pharma, Berlin, Germany | PZN 7617666 | 0.4% oxybuprocaine hydrochloride |
| Floxal eye drops | Dr. Mann Pharma, Berlin, Germany | PZN 3820927 | 3 mg/ml ofloxacin |
| Ointment panthenol | Jenapharm, Jena, Germany | PZN 3524531 | |
| Chloral hydrate | Sigma Aldrich, Taufkirchen, Germany | C8383 | 420-450 mg/kg body weight |
| Hamilton syringe | Hamilton Company, Reno, NV, USA | 7634-01 | SYR 5 µl, 75 RN, no NDL |
| 34 G needle (34/35/pst4/tapN) | Hamilton Company, Reno, NV, USA | 207434/00 | removable needle RN, 34 G, length 38.1 mm, point style 4 |
| Binocular Stemi-2000 | Zeiss, Oberkochen, Germany | ||
| 3 T MRI scanner Magnetom TIM Trio | Siemens Medical Solutions, Erlangen, Germany | ||
| Rat head coil | Doty Scientific Inc., Columbia, SC, USA | ||
| Mouse holder | custom made | ||
| Red light lamp | |||
| Frozen section medium NEG-50 | Thermo Fisher Scientific, Schwerte, Germany | 6502 | tissue embedding for cryo-sections |
| Sodium dihydrogen phosphate monohydrate (NaH2PO4·H2O) | Merck, Darmstadt, Germany | 106346 | for sulfide perfusion |
| Sodium sulfide nonahydrate (Na2S·9H2O) | Sigma Aldrich, Taufkirchen, Germany | 208043 | |
| Gum arabic | Roth, Arlesheim, Switzerland | 4159 | for TIMM staining |
| Hydroquinone (C6H6O2) | Roth, Arlesheim, Switzerland | 3586 | |
| Citric acid (C6H8O7) | Roth, Arlesheim, Switzerland | 6490 | |
| Tri-sodium citrate dihydrate (C6H5Na3O7·2H2O) | Merck, Darmstadt, Germany | 106448 | |
| Silver nitrate (AgNO3) | Roth, Arlesheim, Switzerland | 7908 |
Referencias
- Kretz, A., et al. Simvastatin promotes heat shock protein 27 expression and Akt activation in the rat retina and protects axotomized retinal ganglion cells in vivo. Neurobiol Dis. 21, 421-430 (2006).
- Lima, S., et al. Combinatorial therapy stimulates long-distance regeneration, target reinnervation, and partial recovery of vision after optic nerve injury in mice. Int Rev Neurobiol. 106, 153-172 (2012).
- Lima, S., et al. Full-length axon regeneration in the adult mouse optic nerve and partial recovery of simple visual behaviors. Proc Natl Acad Sci U S A. 109, 9149-9154 (2012).
- Goetze, B., et al. Vision and visual cortical maps in mice with a photoreceptor synaptopathy: reduced but robust visual capabilities in the absence of synaptic ribbons. Neuroimage. 49, 1622-1631 (2010).
- Luo, X., et al. Three-dimensional evaluation of retinal ganglion cell axon regeneration and pathfinding in whole mouse tissue after injury. Exp Neurol. 247, 653-662 (2013).
- Pautler, R. G., et al. In vivo neuronal tract tracing using manganese-enhanced magnetic resonance imaging. Magn Reson Med. 40, 740-748 (1998).
- Watanabe, T., et al. Mapping of retinal projections in the living rat using high-resolution 3D gradient-echo MRI with Mn2+-induced contrast. Magn Reson Med. 46, 424-429 (2001).
- Pautler, R. G. In vivo, trans-synaptic tract-tracing utilizing manganese-enhanced magnetic resonance imaging (MEMRI). NMR biomed. 17, 595-601 (2004).
- Haenold, R., et al. Magnetic resonance imaging of the mouse visual pathway for in vivo studies of degeneration and regeneration in the CNS. Neuroimage. 59, 363-376 (2012).
- Lindsey, J. D., et al. Magnetic resonance imaging of the visual system in vivo: transsynaptic illumination of V1 and V2 visual cortex. Neuroimage. 34, 1619-1626 (2007).
- Bearer, E. L., et al. Role of neuronal activity and kinesin on tract tracing by manganese-enhanced MRI (MEMRI). Neuroimage. 37, S37-S46 (2007).
- Mendonca-Dias, M. H., et al. Paramagnetic contrast agents in nuclear magnetic resonance medical imaging. Semin Nucl Med. 13, 364-376 (1983).
- Thuen, M., et al. Manganese-enhanced MRI of the optic visual pathway and optic nerve injury in adult rats. J Magn Reson Imaging. 22, 492-500 (2005).
- Sandvig, I., et al. In vivo MRI of olfactory ensheathing cell grafts and regenerating axons in transplant mediated repair of the adult rat optic nerve. NMR biomed. 25, 620-631 (2012).
- Chan, K. C., et al. In vivo retinotopic mapping of superior colliculus using manganese-enhanced magnetic resonance imaging. Neuroimage. 54, 389-395 (2011).
- Chan, K. C., et al. In vivo chromium-enhanced MRI of the retina. Magn Reson Med. 68, 1202-1210 (2012).
- Herrmann, K. H., et al. Possibilities and limitations for high resolution small animal MRI on a clinical whole-body 3T scanner. Magma. 25, 233-244 (2012).
- Villegas-Perez, M. P., et al. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Takahashi, Y., et al. Development of spontaneous optic neuropathy in NF-κΒ50-deficient mice: requirement for NF-κΒp50 in ganglion cell survival. Neuropathol Appl Neurobiol. 33, 692-705 (2007).
- Herrmann, K. H. P., et al. MRI compatible small animal monitoring and triggering system for whole body scanners. Z Med Phys. 24, 55-64 (2013).
- Danscher, G., Zimmer, J. An improved Timm sulphide silver method for light and electron microscopic localization of heavy metals in biological tissues. Histochemistry. 55, 27-40 (1978).
- Angenstein, F., et al. Manganese-enhanced MRI reveals structural and functional changes in the cortex of Bassoon mutant mice. Cereb cortex. 17, 28-36 (2007).
- Thuen, M., et al. Manganese-enhanced MRI of the rat visual pathway: acute neural toxicity, contrast enhancement, axon resolution, axonal transport, and clearance of Mn(2). J Magn Reson Imaging. 28, 855-865 (2008).
- Lehmann, K., et al. Vision and visual plasticity in ageing mice. Restor Neurol Neurosci. 30, 161-178 (2012).
- Takeda, A., et al. Manganese transport in the neural circuit of rat CNS. Brain Res Bull. 45, 149-152 (1998).
- Nairismagi, J., et al. Manganese-enhanced magnetic resonance imaging of mossy fiber plasticity in vivo. Neuroimage. 30, 130-135 (2006).
- Smith, K. D., et al. In vivo axonal transport rates decrease in a mouse model of Alzheimer's disease. Neuroimage. 35, 1401-1408 (2007).
- Berkowitz, B. A., et al. Noninvasive and simultaneous imaging of layer-specific retinal functional adaptation by manganese-enhanced MRI. Invest Ophthalmol Vis Sci. 47, 2668-2674 (2006).
- Schnapf, J. L. B. D. A. How photoreceptor cells respond to light. Sci. Am. 256 (8), (1987).
- Yu, X., et al. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat Neurosci. 8, 961-968 (2005).
- Sun, S. W., et al. Noninvasive topical loading for manganese-enhanced MRI of the mouse visual system. Invest Ophthalmol Vis Sci. 52, 3914-3920 (2011).
- Sun, S. W., et al. Impact of repeated topical-loaded manganese-enhanced MRI on the mouse visual system. Invest Ophthalmol Vis Sci. 53, 4699-4709 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados