Method Article
Cerca de la tomografía de proyección óptica por infrarrojos para las Evaluaciones de distribución de la masa de células β en Investigación de la Diabetes
* Estos autores han contribuido por igual
En este artículo
Resumen
Se describe la adaptación de la tomografía óptica de proyección (OPT) 1 Para formación de imágenes en el espectro del infrarrojo cercano, y la aplicación de una serie de herramientas computacionales. Estos protocolos permiten la evaluación de páncreas β masa de células (BCM) en los especímenes más grandes, aumentar la capacidad de múltiples canales de la técnica y aumentar la calidad de los datos opt.
Resumen
Mediante la adaptación de OPT para incluir la capacidad de formación de imágenes en el infrarrojo cercano (NIR) del espectro, que aquí ilustran la posibilidad de cuerpos imagen más grande de tejido pancreático, tales como el páncreas de rata, y para aumentar el número de canales (tipos de células) que puede ser estudiado en una sola muestra. Nos describen adicionalmente la aplicación de una serie de herramientas computacionales que proporcionan: posicionamiento 1 / exacto de (en nuestro caso el páncreas) centro de una muestra de masa (COM) en el eje de rotación (AR) 2; 2 algoritmos / mejoradas para la post -alineación de sintonización que evita las distorsiones geométricas durante la reconstrucción tomográfica 2 y 3 / un protocolo para la ecualización de intensidad para aumentar la relación señal-ruido en las determinaciones de BCM OPT basadas 3. Además, se describe un soporte de muestras que minimiza el riesgo de los movimientos involuntarios de la muestra durante la adquisición de la imagen. En conjunto, estos protocolos permiten la evaluación de la distribución de BCM y other características, que se realiza en todo el volumen de páncreas intacto o otros órganos (por ejemplo, en estudios de trasplante de islotes), con una resolución hasta el nivel de los islotes de Langerhans individuales.
Introducción
La β productoras de insulina de las células son la clave para la capacidad del cuerpo para controlar la homeostasis de la glucosa en sangre. Por lo tanto, la evaluación de la distribución de páncreas BCM son imprescindibles para muchas áreas de la investigación de la diabetes preclínica. En las evaluaciones de los regímenes terapéuticos, por ejemplo, el impacto de la ablación gen diana en la diferenciación de células endocrinas o estudios de etiología diabetes en modelos de roedores para la enfermedad a menudo dependen de tales análisis. Tradicionalmente, estos tipos de evaluaciones se han basado en enfoques que consumen tiempo estereológicos que son difíciles de realizar debido al tamaño y constitución compleja anatómica del páncreas. Enfoques de resolución más altos de imágenes en la actualidad (normalmente óptico), no proporcionan profundidad de penetración suficiente para permitir la formación de imágenes páncreas completo en roedores. Por el contrario, los métodos de imagen que no están limitadas por su profundidad de penetración (normalmente nuclear) proporcionar a baja resolución para resolver la distribución BCM completo y se ve obstaculizadapor la falta de agentes de contraste de 4,5 adecuadas.
Tomografía por proyección óptica es una técnica de imagen en 3D que permite a las evaluaciones de alta resolución de muestras biomédicas en la escala mm a 6 cm. Por la presente, la información sobre la posición espacial y el volumen de la insulina individuo que expresa islotes de Langerhans se pueden extraer a través del volumen del páncreas en ratones normales y diabéticos 3,7-10. El objetivo del presente estudio es mejorar aún más la capacidad de esta técnica para la evaluación de páncreas β-células; su distribución endógena, cuando se injertan en otros tejidos, su relación con otros constituyentes pancreáticas (tales como la infiltración tipos de células) y en mayor preparaciones pancreáticas que antes.
El cerca de infrarrojo tomografía óptica de proyección (NIR-OPT) de configuración
En la siguiente protocolos, un escáner OPT basa en la configuración original descrito por Sharpe et al 1, adaptado para formación de imágenes en el rango del infrarrojo cercano se describe y utiliza. Para la evaluación de un solo canal del páncreas de ratón (por ejemplo, de BCM), la SkyScan 3001 (Bioptonics) del escáner puede ser utilizado.
Una lámpara de halogenuro metálico que proporciona una mayor energía de excitación de una lámpara de arco de mercurio en longitudes de onda por encima de 650 nm, proporciona la luz de excitación. La luz se transmite a través de una guía de luz líquida. Una combinación útil de fluorocromos y filtros de paso de banda de fluorescencia de imágenes NIR y la separación de canales se muestran en la Figura 3. La luz emitida se detecta con un sistema de iluminación posterior cámara CCD, con una alta eficiencia cuántica en el espectro NIR. La exploración OPT está automatizado utilizando una plataforma LabView que controla la cámara y el motor paso a paso. Para apoyar las muestras en el tamaño de los páncreas de rata intacta, un espejo de plata recubierto protegido y una cubeta grande se utiliza. Por último, un soporte de muestras que elimina no deseados movemen verticalests de la muestra durante el análisis fue diseñado.
Protocolo
1. Preparación de muestras y exploración
1.1 Preparación de la muestra
El siguiente procedimiento se realiza esencialmente como se describe anteriormente 7.
- Se recoge el páncreas. Use PBS enfriado en hielo para evitar la degradación proteolítica.
- Fijar el tejido en el 4% PFA en PBS en hielo durante 2-3 horas. Asegúrese de que los lóbulos se "extiende" durante la fijación. Esto facilitará la identificación de los puntos de referencia anatómicos después de la reconstrucción.
- Lavar en exceso de PBS durante 30 min.
- Deshidratar el páncreas paso a paso en metanol (33, 66%, 100%), 15 min / paso. Esto minimiza la formación de burbujas durante el blanqueo (ver paso 5) y evita la destrucción celular durante la congelación-descongelación (ver paso 7).
- Incubar el tejido en recién preparada MeOH: H 2 O 2: DMSO blanqueo tampón en una proporción de 02:01:03 a TA durante 24 h para apagar la fluorescencia tejido endógeno. Para muestras grandes, el intercambio de nuevo bleaching tampón y se incuba durante otras 24 horas.
- Lavar en exceso de MeOH, ON.
- Congelación-descongelación durante al menos 5 ciclos de -80 ° C - RT para facilitar la penetración de anticuerpos.
- Rehidratar gradual de nuevo a TBST (33, 66%, 100%), 15 min / paso.
- Bloquear en TBST con 10% de suero (preferiblemente de la misma especie en la que se generó el anticuerpo secundario), 5% de DMSO y 0,01% Naaz para 12-24 horas a RT
- Se incuba con anticuerpos primarios en tampón de bloqueo durante 48 h, a TA, se extienden a 72 hr para muestras más grandes (anticuerpos utilizados aquí se enumeran en la tabla de los reactivos).
- Lavar en exceso TBST, ON.
- Se incuba con anticuerpos secundarios conjugados con fluorescencia durante 48 horas, a temperatura ambiente, se extienden a 72 hr para muestras más grandes.
- Lavar en exceso TBST, ON.
1,2
El siguiente procedimiento describe cómo montar la muestra en agarosa y adjuntarlo a la titular de la muestra por encargo (ver Figura 7) Antes de OPT de exploración.
- Separar los lóbulos esplénicos, duodenal y gástrica de acuerdo a la figura 3A en Hornblad et al 3. La relación entre los lóbulos se clarifica más en Hornblad et al 11.
- Preparar 1,5% (w / v) de baja temperatura de fusión de agarosa en dH 2 O, se filtra, se deja enfriar a 37 ° C y enjuagar el tejido en dH 2 O para enjuagar el detergente y eliminar las burbujas antes de agarosa-incrustación en hielo.
- Cortar un bloque de agarosa que encierra la muestra y dejar un espaciador ~ 1 cm entre la muestra y la base de la agarosa. Recortar los bordes afilados (≤ 90 °) del bloque de agarosa para reducir la dispersión de la luz.
- Deshidratar la muestra paso a paso en MeOH (33, 66%, 100%), lo que permite que se equilibre el tiempo entre cada paso. Cuando el espécimen se hunde se considera para ser equilibrada.
- Desactive la muestra en una solución 1:2 de alcohol bencílico: Benzyl Benzoato (BABB) hasta que se vuelve transparente. Cambio BABB solución e incubar durante 12 h.
- Coloque la muestra se aclaró en el soporte de muestra y fijarlo mediante la inserción de agujas 2 a través del espaciador de agarosa a través de los agujeros perforados en las bridas de la titular.
- Colocar la muestra en el escáner y sumergirlo en una cubeta llena con solución BABB claro. Cuando se compara una serie de pancreata la misma ampliación debe ser utilizado para todos los análisis. El aumento se debe optimizar para la muestra más grande de la serie.
1.3 Posicionamiento de la muestra en la AR
El siguiente protocolo describe el procedimiento para colocar con precisión una muestra usando el algoritmo COM-AR. Este procedimiento sólo es aplicable cuando el retorno de la inversión incluye la muestra completa. Para una descripción detallada de los algoritmos, consulte Cheddad et al 2.
- Adquirir imágenes de la muestra en dos posiciones para both la anatomía y canales de señal. Posición 1 a 0 ° (asociado con el eje X), presentando la mayor área de proyección, y la posición 2 a 90 ° (asociadas con el eje Z). Estamos utilizando el canal de GFP para visualizar la anatomía.
- Aplicar la expectativa de maximización (EM) algoritmo en las imágenes de la anatomía con el umbral del retorno de la inversión.
- Cálculo de los puntos de COM (coordenadas x) de las imágenes binarias obtenidas en la etapa 2, tanto para el 0 ° y 90 ° proyecciones.
- Superponer una línea vertical que pasa por el punto de COM identificado calculado en el paso 3 en la de 0 ° y 90 ° de imágenes de la señal del canal.
- Utilizar las imágenes adquiridas en el paso 4, como referencia para mover la muestra hasta que la línea central del campo de visión pasa a través de los puntos que han encontrado COM de la muestra.
1.4 Exploración
- Ajustar los tiempos de exposición para conseguir la más alta relación de señal a ruido posible sin saturaciónting cualquier área de la imagen de proyección. Repita el procedimiento para todos los canales que desee escanear.
- Seleccione el conjunto de filtro para el primer canal de fluorescencia que va a escanear. Emisión de fluoróforos λ más cortas pueden excitar los fluoróforos con más tiempo y por lo tanto causar λ foto de blanqueo. Para reducir al mínimo esta posibilidad, escanear el fluoróforo con λ excitación más largo primero.
- Abra el obturador para iluminar la muestra y recoger la señal de fluorescencia a lo largo de 360 °, la rotación de la muestra a lo largo del eje vertical para cada canal. El ángulo de paso utilizado para la configuración NIR-OPT es de 0,9 ° y para el 3001 Bioptonics escáner 0,45 °.
- Seleccione el filtro adecuado para el siguiente canal y seguir las indicaciones anteriores.
2. Procesamiento Computacional y Reconstrucción
2.1 Post-adquisición desalineación detección y corrección (valor de ajuste)
En la tomografía de proyección, es en general necesariopara asignar un valor posterior a la alineación con las proyecciones para afinar la posición de las imágenes a lo largo del eje de rotación antes de la reconstrucción. Sin embargo, una aberración pequeña en el ángulo de la cámara hacia el eje óptico puede causar no uniformes valores a lo largo de la longitud de la muestra, y así inducir distorsiones geométricas. Para evitar tales distorsiones, un método de cálculo para encontrar la exacta y unificado post-valor de alineación (A-valor) a lo largo de todo el espécimen se puede aplicar 2.
- Utilice una transformada discreta de Fourier para dividir una proyección de la señal específica a 0 ° y 180 ° en 8 bloques de píxeles de altura y calcular el desplazamiento a lo largo del eje x (el valor A) entre cada bloque.
- Aplicar un lineal de mínimos cuadrados de regresión para ayudar a calcular el ángulo θ ', que describe la pendiente de la eje x de desplazamiento a lo largo de la longitud de la muestra, y para buscar un punto central de rotación.
- Corrija los errores de alineación durante la exploración girando todo proyecciones θ '/ 2 alrededor del punto central de rotación.
2,2 contraste limitado ecualización de histograma adaptativo (CLAHE)
Para facilitar la detección y segmentación de objetos (islotes) que muestran señales muy débiles, que están en riesgo de ser "thresholded out" durante la reconstrucción y / o segmentación para las evaluaciones cuantitativas, un algoritmo de CLAHE se puede aplicar a las imágenes de proyección. La operación CLAHE se realiza con dos transformaciones de intensidad principales:
- El contraste local se estima y empató en que no se superponen bloques de la imagen de proyección.
- Las intensidades se normalizan en las regiones fronterizas entre los bloques a través de interpolación bilineal.
El nombre de contraste limitado refiere al límite de clip, que se establece para evitar saturar pixeles en la imagen. En este protocolo, el MATLAB función incorporada "adapthisteq" fue utilizado y aplicado con la c omisión labio límite de 0,01 y un tamaño de mosaico de 256. Nota, el tamaño de mosaico óptimo tiene que ser probado empíricamente y pueden variar dependiendo de la muestra analizada. Más detalles sobre el algoritmo y se pueden encontrar ejemplos en Hornblad et al 3.
Nota: Los pasos enumerados arriba computacionales de procesamiento (incluyendo COM-AR, el ajuste al valor y CLAHE, véase 1.3 a 2.2) se basan en algoritmos estándar y se ejecutan en MATLAB (The Mathworks).
2.3 Reconstrucción tomográfica y la representación iso-superficie
- Uso de una retroproyección filtrada algoritmo, las imágenes corregidas y normalizadas ahora se puede reconstruir con compensación de desalineación unificado y requisito mínimo para la optimización de rango dinámico. En este protocolo, todas las reconstrucciones se llevaron a cabo utilizando el método de retroproyección filtrada disponible en el software NRecon (Skyscan), versión 1.6.8 (= "_blank"> Http://www.skyscan.be/products/downloads.htm). Nota, la ampliación de un objeto formado la imagen depende de su distancia desde el punto focal de la lente a menos que la geometría del haz paralelo se aplica en la configuración de imagen. Por lo tanto, al importar un conjunto de datos de proyección para el software NRecon es importante incluir el objeto correcto a distancia de la fuente (mm) y la dirección de rotación del escáner (para el contador de entrada de las agujas del reloj "cc" y para la entrada de las agujas del reloj "cw") en el acompañamiento el archivo de registro, para evitar artefactos de haz cónico inducidos durante la reconstrucción.
- Para visualizar y cuantificar la pila de secciones virtuales obtenidos, generar 3D iso-superficies utilizando software adecuado procesamiento de imágenes tales como Imaris o Volocity.
Aislamiento de islotes murino y los procedimientos de trasplante se realizaron en Procesamiento de células preclínicos sobre la Diabetes del Instituto de Investigación Traslacional y Core Modelo bajo protocolos revisados y aprobados por la Universidad de Miami Cuidado de Animales institucional y el empleo. El comité de ética de la investigación con animales, el norte de Suecia, aprobó todos los demás experimentos con animales.
Resultados
En el presente informe se describe un protocolo para la extracción y procesamiento computacional de los datos de BCM en páncreas de roedor (y otros tejidos) utilizando NIR-OPT (Figura 1). Como se ilustra en la Figura 2, autofluorescense tejido a partir de muestras de páncreas es como se esperaba reduce marcadamente en el espectro NIR. Esto conduce a un aumento significativo en la media de la señal a ruido (S: N) para la evaluación de los islotes de Langerhans insulina marcada. Por las adaptaciones de OPT para formación de imágenes en la parte NIR del espectro, tal como se describe en este documento, al menos tres canales específicos pueden ser visualizados con el suficiente S: relación de N para permitir la evaluación de los tipos de anticuerpos de células marcadas en todo el volumen del páncreas murino con distinta separación de canales (véase la Figura 3 y 4). Aplicada a la formación de imágenes de procesos diabetogénicos y / o evaluaciones BCM en general, la técnica por tanto permite la visualización y cuantificación deinsulina áreas positivas en relación con el entorno y / o interactuar tipos de células (véase Figura 4). Tales evaluaciones son gracias a la profundidad del tejido obtenido una mayor penetración en el rango NIR posible realizar en muestras mucho más grandes que previamente, incluyendo el páncreas de rata, que es 3-5 veces mayor que su contraparte de ratón (ver Figura 5). Independientemente de si las longitudes de onda visibles o NIR se utilizan, la aplicación de CLAHE significativamente puede facilitar las evaluaciones basadas OPT de BCM durante diferentes condiciones genéticas y fisiológicas mediante el aumento de la sensibilidad de detección de la técnica (véase la Figura 6). Un modelo para el soporte de muestra desarrollado se muestra en la Figura 7.

Figura 1. Diagrama de flujo que representa los pasos críticos para OPT basado en los análisis de BCM en el MURpáncreas ine. El tiempo necesario para evaluar un páncreas de un ratón típico es de 13-14 días. La mayoría de las veces se consume durante el procesamiento del tejido y la tinción inmunohistoquímica (10 días), compensación tejido requiere de aproximadamente 2 días, mientras que la longitud de la exploración depende del tiempo de exposición requerido (normalmente alrededor de 1 hora). El procesamiento computacional posterior se realiza típicamente dentro de un día. Nota, el protocolo de tinción relativamente largo es ideal para el procesamiento por lotes de grandes cantidades de muestras.
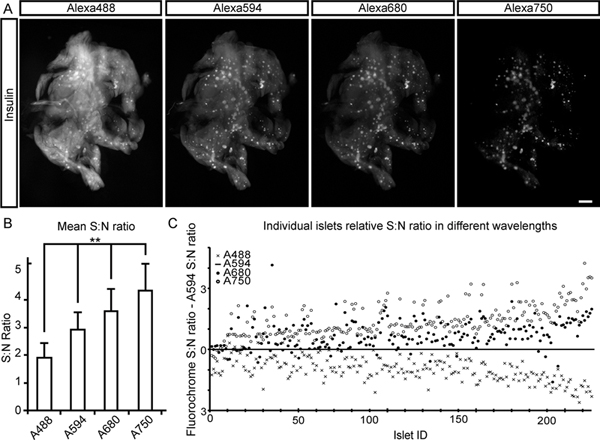
Figura 2. De señal a ruido para las evaluaciones de BCM en longitudes de onda diferentes. Un lóbulo duodenal del páncreas del ratón, se tiñeron para la insulina y con un cóctel de fluorocromo conjugado con anticuerpos secundarios (Alexa 488, 594, 680 y750), se utilizó para determinar S: ratios N a diferentes longitudes de onda. A Images, muestran el marco primera proyección para cada canal de señal. B, gráfico que ilustra la media S: N para cada canal de señal. Las proporciones se determinaron como la intensidad media de islote (basado en 215 islotes) dividido por la intensidad de fondo (la fluorescencia tejido endógeno del tejido exocrino). C, Gráfico que muestra S: ratios de N para los islotes individuales en cada canal normalizado a la S: N obtenidos para el Alexa 594 canales. Una forma ANOVA fue utilizado para los análisis estadísticos. Los niveles de significancia indicados corresponden a ** p <0,01. Barra de escala en (A) corresponde a 1 mm. Haga clic aquí para ampliar la cifra .

Figura3. Separación de canales. A, anticuerpos secundarios conjugados con colorantes AlexaFluor enumerados en la tabla se inmovilizaron por separado en proteinG-Sefarosa. B, Las perlas fluorescentes fueron incorporados a diferentes niveles en un fantasma de agarosa y se formó una imagen usando filtros indicados.
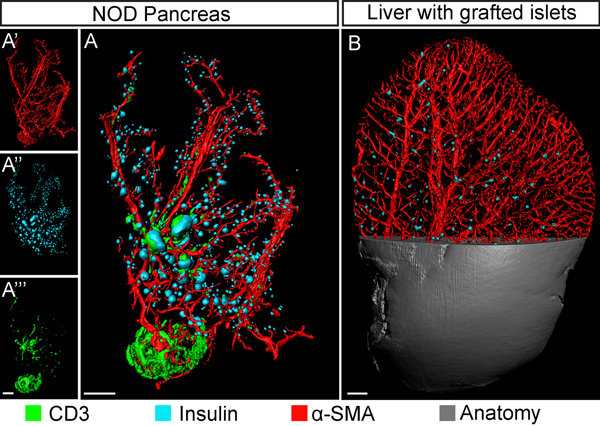
Figura 4. OPT imagen multicanal basada en la investigación de la diabetes. A, OPT basado iso-superficie de reconstrucción de un páncreas (12 semanas, lóbulo duodenal) desde el diabético no obeso (NOD) modelo para la diabetes tipo 1. La muestra se tiñeron para la insulina (islotes β-células, pseudo color azul); músculo liso α-actina (vasos sanguíneos, de color rojo) y CD3 (linfocitos T infiltrantes, verde). Los correspondientes anticuerpos secundarios utilizados eran; Cy3, IRDye-680 y DyeLight-750 respectivamente. Lainserciones (A'-A'' ') muestran los canales de señal individuales. B, imagen OPT (golpe encima de la vista) de un lóbulo del hígado del ratón (lateralis lobus siniestros) injertado con islotes singénicos y con imágenes de NIR-OPT dos semanas después del trasplante. Los islotes de insulina se expresan pseuodocolored en azul y el músculo liso α-actina positivos los buques están en rojo. El método permite la evaluación de la distribución del injerto de islotes dentro de la red vascular. Las barras de escala corresponden a 1 mm.

Figura 5. NIR-OPT facilita la formación de imágenes de especímenes mayores. A, Iso-superficie de representación de la distribución de BCM en un páncreas de rata a partir del modelo Zucker Fatty para la diabetes tipo 2 (lóbulo esplénica menos 9 meses), ejemplificando la posibilidad de espécimen imagen de la rata páncreas escala por NIR-OPT. Como se determinópor esta técnica, el lóbulo se muestra es ~ 6 veces mayor (v / v) que su homólogo de ratón y alberga 10139 expresar insulina de islotes de Langerhans cuya β-volumen celular constituye 1,32% del volumen total de lobular. B, sección tomográfica correspondiente a la línea de trazos en (A) ilustra que los islotes de todas las profundidades del tejido se detectan. C, Iso-superficie de representación de la distribución de BCM en un páncreas de ratón (lóbulo esplénica a las 8 semanas) se muestra como una referencia de tamaño. El lóbulo muestra alberga 2490 islotes de insulina que expresan β-cuyo volumen celular representa 0,89% del volumen total de lobular. El páncreas se tiñen con GP anti-insulina seguido por Alexa594 conjugado de cabra anti-GP (ratón) y IRDye 680 burro conjugado anti-GP (rata) anticuerpos, respectivamente. Los especímenes en (AC) están representados a escala, y la barra de escala en (C) corresponde a 2 mm.
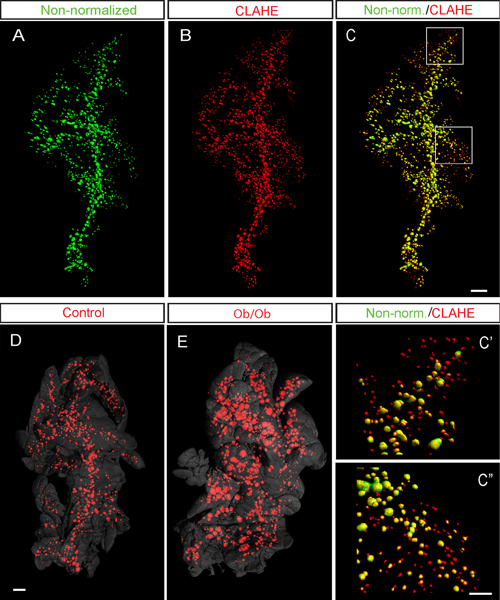
Figura 6. CLAHE facilita la detección de islotes en el páncreas murino mediante formación de imágenes OPT. AC, representativos iso-superficie prestados imágenes OPT de un C57Bl / páncreas de ratón 6 (lóbulo esplénica a las 8 semanas) con la etiqueta de la insulina. Iso-superficie reconstrucciones de imágenes OPT se realizaron antes (A, de color verde pseudo) y después el protocolo CLAHE fue aplicado (B, pseudo color rojo). C, la superposición de los datos no normalizados en (A) y los datos procesados CLAHE en (B). C'-C ", superposición Representante de gran aumento de los no normalizado (A) y procesados CLAHE (B) imágenes. Tal como se muestra por la presencia de" rojo de sólo "islotes, la secuencia de comandos CLAHE facilita la detección de la señal pequeña y baja islotes de intensidad. En el ejemplo actual el espécimen representa (después de CLAHE procesamiento) albergado 2419 islotes con un volumen de 1,74 mm 3 (números basados en los datos no procesados de proyección correspondiente fue de 1057 islotes with un volumen de 1,77 mm 3). D y E, Ejemplo de datos de control (D) y el modelo de ratón ob / ob para la diabetes tipo 2 12 (E) a los 6 meses que implementan el protocolo CLAHE. Tenga en cuenta el enorme aumento general en el tamaño de los islotes del páncreas ob / ob (E). En (D) y (E) el contorno páncreas (gris) se basa en la señal de autofluorescencia del tejido. Barra de escala en C es de 500 micras de CA. La barra de escala en C "corresponde 200 micras en C 'y C'' bar. Escala en E corresponde a 1 mm en (D) y (E). Imágenes en (AC) están adaptados de Hornblad et al 3 y se generaron utilizando el Bioptonics 3001 escáner.

Figura 7. Soporte de la muestra para la fijación de las muestras OPT. La muestra está asegurada mediante la inserción de agujas a través del separador de agarosa a través de los agujeros pre-perforados en las bridas. El soporte está articulado con el motor paso a paso a través de unfuerte imán situado en su base. Esta configuración se omite el uso de colas inestables y evita los movimientos no deseados de la muestra durante el análisis.
Discusión
Las técnicas descritas para la formación de imágenes OPT permite la extracción de parámetros espaciales y cuantitativos en todo el volumen del páncreas murino. Debido a las limitaciones en la resolución alcanzable para este tipo de formación de imágenes que mesoscópica Hay que señalar que, como para la mayoría de modalidades de formación de imágenes, mayor será el espécimen menor será la resolución (Aunque el uso de una mayor resolución CCD debe aumentar la resolución de la exploración OPT) . Por lo tanto, para la evaluación de los lóbulos del páncreas de ratón intactas, la técnica en la actualidad no proporcionan una resolución única célula, aunque está cerca (aprox. 15-20 micras) 7. Sin embargo, para la extracción de distribución BCM en el páncreas de ratón de los protocolos han proporcionado datos que más bien coinciden con los de punto por ejemplo contando morfometría 3,13 Cabe señalar que, aunque la aplicación del protocolo CLAHE permite la detección de islotes significativamente más , estos islotes son generalmente más pequeños y no contribute sustancial a las células β-generales volúmenes.
Los protocolos de inmunohistoquímica implicados son relativamente largos (hasta dos semanas), pero las manos reales en tiempo de preparación de la muestra es corta y por lo tanto, la técnica es muy adecuado para el estudio de grandes cohortes de animales 9. Si el potencial de los patrones de distribución heterogénicas es un foco para la investigación, cabe destacar que se debe tener cuidado en los pasos sobre la fijación de montaje y para evitar que el tejido pancreático se hace fija de manera desfavorable y un plano ("hacia fuera" ) de montaje del tejido debe ser esforzado por facilitar tales evaluaciones.
Un problema importante cuando se realizan OPT es que COM de la muestra se fija en el eje de rotación y que no se mueve, ya sea vertical u horizontalmente, durante el procedimiento de exploración. Por lo tanto, es esencial contar con una configuración mecánica estable y un sistema que funciona bien para attaching de la muestra. Hemos resuelto este problema mediante la construcción de un nuevo montaje (Figura 7).
Geometría paralela no era cierto para nuestro NIR-OPT o Bioptonics 3001 escáner, que se detectó como un desplazamiento vertical entre la parte posterior y las posiciones frontales de los objetos periféricos en las imágenes de proyección grabados. Mediante el ajuste de la distancia de la fuente al objeto en el archivo de registro del escáner correspondiente (véase 2.3.1) se podría mejorar significativamente la calidad de los datos y corregir las distorsiones geométricas en los bordes lejanos de las imágenes de proyección, lo cual es de particular importancia cuando la evaluación de los especímenes más grandes.
En el protocolo actual, ofrecemos una sugerencia de conjuntos de filtros que permiten la visualización de tres diferentes canales específicos y una "anatomía" de canal en las evaluaciones de las preparaciones de páncreas intacto. Obviamente esta configuración podría ser modulada para ajustarse mejor a los fluorocromos utilizados para un estudio dado aunque, como con todas las formas de fluorescenciamicroscopía ciento, el riesgo potencial de sangrado a través de la señal debe ser cuidadosamente evaluado. El estudio de islotes de insulina marcadas con fluorocromos que son excitados por encima de 750 nm no ha sido posible por nosotros usando la lámpara de haluro metálico que nuestro conjunto hasta utiliza. Es posible que una cámara con incluso mayor eficiencia cuántica en las longitudes de onda pertinentes en combinación con otras fuentes de luz (por ejemplo, los láseres de diodo) podría aumentar el potencial del NIR-OPT adicional y permitir la formación de imágenes en longitudes de onda más altas.
OPT formación de imágenes es una técnica altamente versátil para las evaluaciones espaciales y cuantitativos de muestras biomédicas en la escala de mm-cm. Aunque los protocolos presentados aquí han sido desarrollados con el propósito principal de la investigación de páncreas / diabetes que debe ser posible traducir a la investigación de otras especies, tipos de especímenes y marcadores. Por la posibilidad de visualizar varios canales distintos en las preparaciones de páncreas intacto, NIR-OPT imagen fás tiene el potencial como una herramienta para evaluar la especificidad de la captación de agentes de contraste destinados a no invasivos evaluaciones por otras modalidades de imagen, siempre que estos agentes de contraste pueden ser diseñados para llevar también un fluoróforo detectable por OPT.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Dr. P. Lindström es reconocido por brindar ratones ob / ob. J. Lehtonen es reconocido por la ayuda a la producción de vídeo y Gilbert J. ayuda con la edición. Este estudio fue apoyado por becas de la Fundación Instituto de Investigación de Diabetes (AP), la Juvenile Diabetes Research Foundation (AP y UA), la Comisión Europea (FP-7, el acuerdo de subvención n º:. IP CP-228933-2) (JS y UA), la Fundación Kempe, Universidad de Umeå y el Consejo Sueco de Investigación de la AU
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / material | Empresa | Número de Catálogo | Comentarios |
| Metanol | Scharlau | ME03162500 | |
| 30% de H 2 O 2 | Scharlau | HI01362500 | |
| Alcohol bencílico | Scharlau | AL01611000 | |
| Benzoato de bencilo | Scharlau | BE01851000 | |
| Low-meltingpoint agarosa | LONZA | 50100 | |
| Paraformaldehído (PFA) | Sigma-Aldrich | 158127 | |
| DMSO | Sigma-Aldrich | D5879 | |
| Triton-X100 | Sigma-Aldrich | T8787 | |
| Mouse anti-asma-Cy3 | Sigma-Aldrich | C6198 | Anticuerpo primario |
| De conejo anti-CD3 | Sigma-Aldrich | C7930 | Anticuerpo primario |
| Guinea Pig anti-Ins | DAKO | A0564 | Anticuerpo primario |
| Burro anti GP-IRDye680 | LI-COR Biosciences | 926-32421 | Anticuerpo secundario |
| Cabra anti-Rb DyeLight750 | Thermo Scientific | 35570 | Anticuerpo secundario |
| Cabra anti-GP Alexa594 | Molecular Probes | A-11076 | Anticuerpo secundario |
| Cabra anti-GP Alexa488 | Molecular Probes | A-11008 | Anticuerpo secundario |
| Cabra antiGP-Alexa594 | Molecular Probes | A-11012 | Anticuerpo secundario |
| Cabra anti-GP Alexa680 | Molecular Probes | A-21076 | Anticuerpo secundario |
| Cabra anti-GP Alexa750 | Molecular Probes | A-21039 | Anticuerpo secundario |
| OPT Skyscan 3001 | Bioptonics | OPT-Scanner | |
| Leica MZ FLIII | Leica Microsystems | Estereomicroscopio | |
| Objetivo Leica 0.5x | Leica Microsystems | 10446157 | |
| Leica Camera adaptador 1.0x | Leica Microsystems | 10445930 | |
| EL6000 halogenuros metálicos | 11504115 | LIGHTSOURCE | |
| Guía de luz líquida | 11504116 | ||
| Cuvette | Hellma Analytics | 6030-OG | 55 x 55 x 52,5 mm |
| Espejo | Edmund Optics | F68-334 | 50 x 50 mm |
| Andor Ikon-M | Andor Tecnología | DU934N-BV | Back-iluminado CCD |
| Filterset | Tecnología Chroma | 41021-MZFLIII | TXR, Alexa-594, Cy3 |
| Filterset | Tecnología Chroma | 41022-MZFLIII | IRDye680, Alexa-680 |
| Filterset | Tecnología Chroma | 49037-MZFLIII | Dylight750, Alexa-750 |
| Sepharose bolas ProteinG- | GE Healthcare | 17-0618-01 | Proteína G Sepharose 4 Fast Flow |
| Sodio azida | Sigma-Aldrich | 08591 | Azida de sodio 0,1 M de solución |
Referencias
- Sharpe, J., et al. Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Cheddad, A., Svensson, C., Sharpe, J., Georgsson, F., Ahlgren, U. Image Processing Assisted Algorithms for Optical Projection Tomography. IEEE Trans. Med. Imaging. , (2012).
- Hornblad, A., Cheddad, A., Ahlgren, U. An improved protocol for optical projection tomography imaging reveals lobular heterogeneities in pancreatic islet and beta-cell mass distribution. Islets. 3, 204-208 (2011).
- Holmberg, D., Ahlgren, U. Imaging the pancreas: from ex vivo to non-invasive technology. Diabetologia. 51, 2148-2154 (2008).
- Ahlgren, U., Gotthardt, M. Approaches for imaging islets: recent advances and future prospects. Adv. Exp. Med. Biol. 654, 39-57 (2010).
- Sharpe, J. Optical projection tomography. Annu. Rev. Biomed. Eng. 6, 209-228 (2004).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Methods. 4, 31-33 (2007).
- Alanentalo, T., et al. High-resolution three-dimensional imaging of islet-infiltrate interactions based on optical projection tomography assessments of the intact adult mouse pancreas. J. Biomed. Opt. 13, 054070 (2008).
- Alanentalo, T., et al. Quantification and Three-Dimensional Imaging of the Insulitis-Induced Destruction of beta-Cells in Murine Type 1 Diabetes. Diabetes. 59, 1756-1764 (2010).
- Sun, G., et al. Ablation of AMP-activated protein kinase alpha1 and alpha2 from mouse pancreatic beta cells and RIP2.Cre neurons suppresses insulin release in vivo. Diabetologia. 53, 924-936 (2010).
- Hornblad, A., Eriksson, A. U., Sock, E., Hill, R. E., Ahlgren, U. Impaired spleen formation perturbs morphogenesis of the gastric lobe of the pancreas. PLoS One. 6, e21753 (2011).
- Lindström, P. The physiology of the Obese-Hyperglycemic Mice (ob/ob Mice). The Scientific World JOURNAL. 7, 665-685 (2007).
- Bock, T., Pakkenberg, B., Buschard, K. Genetic background determines the size and structure of the endocrine pancreas. Diabetes. 54, 133-137 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados