Method Article
El examen de selección tímica positivo y negativo por citometría de flujo
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta una citometría de flujo basado en el método para examinar el desarrollo de las células T In vivo Utilizando ratones genéticamente manipulados en un fondo de tipo salvaje o receptor de células T transgénicos.
Resumen
Un sistema inmunológico saludable requiere que las células T responden a antígenos extraños sin dejar de ser tolerante a antígenos propios. Reordenamiento aleatorio del receptor de células T (TCR) α y β loci genera un repertorio de células T con una gran diversidad en la especificidad de antígeno, tanto para uno mismo y extranjeros. Selección del repertorio durante el desarrollo en el timo es crítico para la generación de células T segura y útil. Los defectos en la selección tímica contribuir al desarrollo de trastornos autoinmunes e inmunodeficiencia 1-4.
Progenitores de células T entrar en el timo como dobles negativas (DN) timocitos que no expresan CD4 o CD8 co-receptores. Expresión de la αβTCR y ambos receptores co-ocurre en el doble positiva (DP) etapa. Interacción de la αβTCR con el auto-péptido-MHC (pMHC) presentados por células tímicas determina el destino de la timocitos DP. Interacciones de alta afinidad conducir a la selección negativa y la eliminaciónción de las materias autorreactivas timocitos. Interacciones de baja afinidad resultado en la selección positiva y el desarrollo de las células CD4 o CD8 individuales positivos (SP) células T capaces de reconocer antígenos extraños presentados por auto-MHC 5.
La selección positiva puede ser estudiada en ratones con un anticuerpo policlonal (tipo salvaje) repertorio TCR mediante la observación de la generación de células T maduras. Sin embargo, no son ideales para el estudio de selección negativa, que implica la supresión de pequeñas poblaciones específicas de antígeno. Muchos sistemas modelo se han utilizado para estudiar la selección negativa, pero varían en su capacidad para recapitular los eventos fisiológicos 6. Por ejemplo, la estimulación in vitro de timocitos carece del entorno del timo que está íntimamente involucrada en la selección, mientras que la administración de antígeno exógeno puede conducir a la supresión no específica de los timocitos 7-9. En la actualidad, las mejores herramientas para estudiar en la selección negativa vivo son ratones que expresan una transgenic TCR específico para el auto-antígeno endógeno. Sin embargo, muchos clásicos modelos transgénicos TCR se caracterizan por prematura expresión de la cadena TCRα transgénica en la etapa de DN, lo que resulta en la eyaculación de selección negativa. Nuestro laboratorio ha desarrollado el modelo HY CD4, en el que el transgénico HY TCRα está condicionalmente expresó en la fase DP, permitiendo la selección negativa que se producen durante la transición a DP SP como ocurre en ratones de tipo salvaje 10.
Aquí se describe un flujo de citometría de protocolos para examinar la selección tímica positivo y negativo en el modelo de ratón HY CD4. Mientras que la selección negativa en las células CD4 HY ratones es muy fisiológico, estos métodos también se pueden aplicar a otros modelos transgénicos TCR. También se presentarán las estrategias generales para el análisis de la selección positiva en un repertorio policlonal aplicable a cualquier ratones genéticamente manipulados.
Protocolo
Consulte la Figura 1 para un esquema general del protocolo experimental.
1. Disección
- Place acero estéril pantalla de malla en 60 x 15 mm plato Petri. Una unidad se necesita por muestra de tejido.
- Añadir 5 ml de solución salina equilibrada de Hank (HBSS) a cada placa. Mantenga los platos en hielo.
- Eutanasiar ratones con CO 2.
- Ratón segura a la superficie de la disección, la parte ventral hacia arriba. Spray de ratón con 70% de etanol para la esterilización y para asegurar que la piel es enredado abajo.
- Usando tijeras quirúrgicas, comenzar la disección haciendo una incisión ventral en la piel abdominal justo por encima de los genitales. Extienda la incisión hacia arriba a la barbilla.
- Desde la línea media, extender la incisión hacia abajo a lo largo de todas las extremidades. Tire hacia atrás la piel suelta y el pin a la superficie disección.
- Coseche el timo:
- Levante la punta inferior del esternón para hacer una incisión.
- Evitar el hígado, cortar el diafragma para separar las costillas y luego se corta la caja torácica a cada lado. Cortar hacia arriba costillas en cada lado, teniendo cuidado de evitar los pulmones y el corazón.
- Tire suavemente de la caja torácica espalda con pinzas. El timo es un órgano blanco, bilobulado situado por encima del corazón. Con el borde plano de la pinza para agarrar la parte inferior de los lóbulos, tire suavemente el timo y lo coloca en la pantalla de malla.
- Se recoge el bazo:
- El bazo es un rojo, en forma de tabla de surf órgano situado en el lado izquierdo de la cavidad abdominal del ratón, por debajo del hígado.
- Hacer una incisión en la cavidad abdominal. Retire con cuidado el bazo con un par de pinzas, utilizando el par de segundos para provocar el tejido conectivo. Coloque el bazo en una pantalla de malla separada.
2. Preparación de células
- El uso de un émbolo de una jeringa de 3 ml, molerórganos en la malla hasta que el tejido conectivo y sólo restos de grasa. Enjuague con HBSS malla de la cápsula tres veces. Utilice un émbolo nuevo para cada muestra de tejido.
- Otras opciones para la homogeneización de tejido se puede utilizar en lugar de este método.
- Contar las células usando un hemocitómetro.
- Precipitar las células por centrifugación a 335 xg durante 5 min a 4 ° C.
- Esplenocitos Resuspender en 500 l de tampón de lisis ACK (0,15 M NH 4 Cl, 10 mM KHC0 3, 0,1 mM Na 2 EDTA, pH 7,2) durante 10 min a temperatura ambiente. Timocitos Resuspender a 20 x 10 6 células / ml en tampón FACS (PBS, 1% FCS, 0,02% de azida de sodio) y dejar de lado en el hielo.
- Volver a la isotonicidad esplenocitos mediante la adición de 5 ml de HBSS. Pellet esplenocitos por centrifugación y se resuspende en 20 x 10 6 células / ml en tampón FACS. Si las células deben permanecer estériles, puede utilizar estéril RPMI + 10% de FCS.
3.Las células de tinción para citometría de flujo
El objetivo de este protocolo es delinear estrategias para el análisis de selección positiva y negativa usando tipo salvaje (WT) y ratones HY CD4. Por consideraciones generales relacionadas con la citometría de flujo de diseño experimental, adquisición y análisis, nos referimos a los lectores una excelente revisión de Tung et al. 11
- Alícuota de 4 x 10 6 timocitos por muestra de citometría de flujo a cada pocillo de una placa de 96-pocillos, así como 1 x 10 6 esplenocitos WT por control de compensación. Si el uso de ratones transgénicos, se debe incluir un ratón WT como un control en un experimento.
- Bloquear los receptores Fc mediante la incubación de las células con anti-CD16/32 (clon 2.4G2) durante 10 min en hielo.
- Girar la placa a 335 xg, a 4 ° C durante 5 min. Retire la tapa y disipar líquido de los pozos colocando el plato una vez, boca abajo en el fregadero. Resuspender cada pocillo en 200 l de tampón FACS. Repita el lavado.
- Preparar cócteles de anticuerpos como se indica a continuación, utilizando la concentración óptima de cada anticuerpo sobre la base de la dilución en 200 l de tampón FACS por pocillo. La concentración óptima de cada anticuerpo se define como la concentración más baja necesaria para proporcionar la mayor separación de las poblaciones positivas y negativas. Si no existe una población negativa para un determinado anticuerpo, un anticuerpo isotipo deben ser incluidos. El volumen total por pocillo se puede reducir (por ejemplo a 100 l por pocillo) si se desea.
- PESO timo: anti-TCRβ, anti-CD4 y anti-CD8, anti-CD69 o anti-CD5 y anti-CD24
- HY timo CD4: anti-TCR HY (T3.70), anti-CD4, anti-CD8, anti-CD69 o anti-CD5, anti-CD24
Para obtener una mejor separación de CD69 y CD69 Mín poblaciones HI de los timocitos, se recomienda que un anticuerpo biotinilado anti-CD69 primaria ser utilizado, seguido de una tinción secundaria que contiene un fluorocromo conjugado estreptavidina. Nos üsí la misma estrategia para CD5 tinción.
- Se incuban las células con 200 l de cóctel de anticuerpos en tampón FACS durante 30 min en hielo en la oscuridad.
- Coincidiendo con la tinción de anticuerpos cóctel, mancha cada control de compensación con un solo fluorocromo y conjugado de anticuerpos. Idealmente, la tinción de compensación implica los mismos anticuerpos tal como se utiliza en el cóctel de anticuerpos. Sin embargo, la tinción para cada antígeno individual puede no ser factible para grandes experimentos cuando muchos antígenos se está ensayando. Por lo tanto, la tinción de los anticuerpos anti-CD4 o anti-CD8 es recomendable debido a la alta expresión de estos antígenos, o el uso de perlas de compensación. Teñir en tampón FACS durante 30 min en hielo en la oscuridad. Agregar un control de compensación sin mancha.
- Lavar las células dos veces con tampón FACS.
- Resuspender las células en tampón FACS y la transferencia a tubos de FACS.
- Adquirir muestras en citómetro de flujo. Incluye la adquisición de FSC y FSC-A-W para unllow de discriminación doblete.
4. Análisis de citometría de flujo de datos - Non-TCR ratones transgénicos
Usamos FlowJo por citometría de flujo de análisis de datos. Refiérase a la Figura 2A para la estrategia de activación periódica para no TCR ratones transgénicos.
- Usando FSC-A por SSC, puerta electrónica en el "linfocitos" de la población.
- Dentro de la "linfocitos" de la población, el uso FSC-A por el FSC-W electrónicamente a la puerta de la FSC-W población lo excluir dobletes celulares y aggregrates. Esta es la "camiseta" de la puerta.
- Con los acontecimientos de la "camiseta" puerta, parcela CD8 por CD4. Dibuja puertas para DN, aburrido DP, DP brillante, CD4 + CD8 poblaciones lo, CD4SP CD8SP y como se muestra en la Figura 2B.
- En las puertas CD4SP y CD8SP, crear TCRβ por CD24 parcelas. Utilice la herramienta de gating cuadrante para dibujar puertas como se muestra en la Figura 2C.
- Crear una new argumento de la "camiseta" puerta: TCRβ de CD69. Dibujar puertas A, B, C, D tal como se representa en la Figura 2D.
- Crear otra parcela de la "camiseta" puerta: TCRβ por CD5. Dibujar puertas i, ii, iii, iv como se representa en la figura 2E. Esta es otra estrategia para el examen de selección positiva.
- Aplicar DN, aburrido DP, DP brillante, int CD4, CD4SP y puertas CD8SP de debajo de "singlete" a puertas i, ii, iii, iv, A, B, C, D (Figura 2 D, E).
- Calcular el número de células en un determinado subconjunto de multiplicar celularidad de órganos por la frecuencia de cada puerta posterior hasta llegar a la población objetivo. Por ejemplo, el número de TCRβ hi-CD69 CD8SP timocitos sería determinado por el timo celularidad x% bhi TCR CD69-(fracción D) x CD8SP%.
- Contando ya tiene en cuenta que las células vivas y muertas por lo que no se incluye el lymphoc "YTE "puerta en sus cálculos.
5. Análisis de citometría de flujo de datos - TCR ratones transgénicos
Consulte la Figura 3A para la estrategia de puerta para TCR ratones transgénicos.
- Siga los pasos 4,1 y 4,2 como en la sección anterior.
- Bajo el "singlete" puerta, crear un T3.70 por parcela SSC y la puerta en la T3.70 + población celular a analizar antígenos específicos de células T (Figura 3B). En algunas circunstancias, puede ser de interés para comparar esta población a la no específica de antígeno (T3.70-) población de células T.
- Dentro de la población T3.70 +, dibujar DN, DP, CD4SP y CD8SP puertas (Figura 3C).
- Para las muestras de control WT, dibujar estas puertas bajo la "camiseta" puerta o crear una T3.70-gate, ya que habrá muy pocos T3.70 + células.
- Bajo la puerta CD8SP, crear unaT3.70 por CD24 trama. Utilice la herramienta de gating cuadrante para dividir las células en cuatro poblaciones (Figura 3F).
- Crear un histograma que representa superpuesto expresión de CD69 en el compartimiento de DP de ratones WT y T3.70 + compartimiento DP de CD4 HY ratones (Figura 4A). Repetir para examinar la expresión de CD5 (Figura 4B).
- Calcular el número absoluto de células en cada subconjunto de interés como en 4,8.
Resultados
En fisiológicos TCR modelos transgénicos y ratones WT, la selección positiva se inicia en la etapa DP brillante antes de pasar a la etapa de DP aburrido después del encuentro de antígeno. Timocitos DP aburridos a continuación, introduzca un CD4 + CD8 etapa de transición antes de convertirse en lo CD4SP o timocitos CD8SP (Figura 2B). Timocitos maduros SP se caracteriza por la alta expresión de TCR y la pérdida de CD24 (Figura 2C). Mientras que el CD4 CD8 de perfil puede revelar defectos en la selección positiva, examinando TCRβ por CD69 o CD5 puede proporcionar más información sobre dónde se encuentra el defecto. Tanto CD69 y CD5 están regulados por incremento después de la estimulación de TCR, con fuertes interacciones de conducción más alta expresión de estos marcadores.
Por TCRβ por CD69 parcela, puerta A (TCRβ lo CD69-) representa una población de timocitos DP preselección, puerta B (CD69 TCRβ int +) representa un trpoblación ansitional directamente después de TCR compromiso, puerta C (TCRβ hi CD69 +) representa la población de células directamente después de la selección positiva, y la puerta D (TCRβ hi CD69 -) representa una población más madura de células (Figura 2D). En un ratón WT, puerta A está formado por células DP brillantes, mientras que la puerta B se compone fundamentalmente de DP brillante con un poco aburrida DP y CD4 + CD8 lo. Puerta C se compone fundamentalmente de DP aburrido, CD4 + CD8 y las células lo CD4SP, mientras que la puerta D se compone fundamentalmente de CD4SP y CD8SP. Ausencia de poblaciones B y C puede ser indicativa de deterioro de la selección positiva. Los cambios en la relación de CD4SP a CD8SP D dentro de la población puede sugerir alteraciones en el compromiso del linaje. La pérdida de poblaciones C y D puede reflejar problemas de supervivencia después de la selección positiva.
Examinando TCRβ por CD5 es otra t estrategiao identificar poblaciones de selección pre-y post-positivas. Población i (TCRβ lo CD5 lo) representa pre-selección de timocitos DP y ii población (TCRβ lo CD5 int) son células que inician la selección positiva (2E Figura). Estas consisten principalmente en poblaciones de timocitos DPbright. Población iii (TCRβ int CD5 hi) representa timocitos en el proceso de experimentar selección positiva y consisten principalmente de DP opaco y CD4 + CD8 timocitos lo. Población iv (TCRβ hi hi CD5) se compone principalmente de post-positivos de selección timocitos SP. Deterioro de la generación de las poblaciones ii y iii sugiere defectuoso selección positiva. Los cambios en la relación de CD4SP a CD8SP dentro de la población iv normales a pesar de poblaciones anteriores puede sugerir alteraciones en el compromiso del linaje. La ausencia de población iv puede indicar una menor supervivencia después de selección positivación. Por ejemplo, en TOX - / - ratones, diferenciación defectuosa CD4SP conduce a una reducción drástica en las poblaciones iv, C y D, mientras que la selección positiva se mantiene intacta 12. Verdaderos defectos en la selección positiva se puede ver con la inactivación Bcl11b durante la etapa de DP, que conduce a la pérdida de poblaciones B, C y D 13,14. RasGRP1 los ratones deficientes tienen un defecto más temprano en la selección positiva, lo que resulta en la presencia de sólo una población. (Datos no publicados)
Como la selección negativa implica la eliminación de pequeñas poblaciones específicas de antígeno, los defectos en este proceso se observan mejor usando ratones transgénicos TCR. En las células CD4 HY ratones, los timocitos que expresan el TCR transgénico HY puede ser detectado con el anticuerpo monoclonal T3.70 (Figura 3B). El TCR reconoce el antígeno HY HY hombres concretos presentados en MHC clase b de identificación. Por lo tanto, CD4 HY macho (M) ratones someterse a la selección negativa de HY TCR + timocitos, como se indica por una reducción en T3.70 + D números P timocitos (Figura 3D) y una disminución más dramática en T3.70 + números CD8SP timocitos (Figura 3C, E). Por el contrario, CD4 HY hembra (F) ratones someterse a la selección positiva para generar T3.70 + CD8SP células T. Por su definición más estricta, la selección negativa impide la generación de mayores autorreactivas timocitos. Así, mientras que una reducción en los números de timocitos D P es indicativa de la selección negativa, la ausencia de antígenos específicos de timocitos SP es la medida más precisa. Un examen más detallado de las pocas T3.70 + timocitos CD4 CD8SP ratones ÍA M revela que la mayoría son inmaduras (CD24 hi), mientras que la mayoría T3.70 + timocitos CD8SP en el CD4 HY F han alcanzado la madurez (CD24 lo) (Figura 3F) . Esto proporciona un soporte adicional de que la selección negativa se produce in HY cd4 M ratones.
Una advertencia de modelos transgénicos TCR es que el TCR transgénico se expresa altamente en todo el desarrollo de timocitos. Como resultado, es difícil de caracterizar mejor selección positiva mediante la identificación de poblaciones basadas en la expresión de TCR y CD69/CD5. Sin embargo, CD69 y CD5 expresión se correlacionan con la fuerza de TCR de señalización. En ratones WT, la mayoría de los timocitos DP no se someten a selección positiva o negativa, lo que requiere TCR compromiso de pMHC, y por lo tanto no upregulate CD69 o CD5. Cd4 HY ratones F tienen una gran población de T3.70 + timocitos DP que se someten a selección positiva, como se indica por un aumento en la población CD69 + en comparación con el WT (Figura 4A). La selección negativa implica una mayor afinidad TCR estímulo de selección positiva; esto se indica por el aumento de expresión de CD69 en T3.70 + timocitos DP en las células CD4 HY M ratones, resultando en un cambio of el pico del histograma a la derecha. Tendencias similares se observan con CD5 expresión (Figura 4B). Cuando se analiza la selección tímica en ratones genéticamente manipulados, o examinar CD69 CD5 expresión puede determinar si el defecto se encuentra con el TCR de señalización o un resultado corriente abajo de la estimulación de TCR.

Figura 1. Esquema general del protocolo experimental.

Figura 2. Análisis de selección tímica en no-TCR ratones transgénicos. (A) Gating estrategia para el análisis de la selección tímica no en ratones transgénicos TCR. (B) por el perfil de CD4 CD8 de un timo WT. (C) El examen de la madurez de los timocitos SP por TCRβ y la expresión de CD24. (D) Las etapas de selección positiva se pueden distinguir porCD69 mediante la expresión TCRβ, junto con CD8 y CD4 de perfiles en cada subgrupo. (E) TCRβ por CD5 es otra estrategia que se puede utilizar para separar las etapas de desarrollo. Haga clic aquí para ampliar la cifra .

Figura 3. Analizar selección tímica en cd4 HY ratones. (A) Gating estrategia para el análisis de la selección tímica en ratones transgénicos TCR. (B) La frecuencia de los timocitos que expresan el TCR HY (T3.70 +) en WT, HY CD4 F y HY CD4 M ratones. (C) CD8 por los perfiles de la población CD4 + T3.70 en ratones indican. Además de las frecuencias, el número absoluto de T3.70 + DP (D) y, especialmente, T3.70 + timocitos CD8SP (E) son indicadores importantes de la selección negativa. (F) El examen de lamadurez de los timocitos CD8SP en ratones indican. Haga clic aquí para ampliar la cifra .
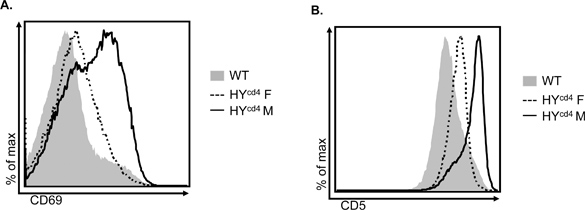
Figura 4. Expresión de marcadores de activación CD69 (A) y CD5 (B) sobre el total de timocitos DP de WT y T3.70 + timocitos DP de HY F CD4 y CD4 HY M ratones.
Discusión
El protocolo presentado aquí puede ser utilizado para examinar la selección positiva y negativa en no-TCR transgénicos y ratones transgénicos TCR. Este protocolo describe la tinción de antígenos de superficie. Para un análisis más detallado de los mecanismos moleculares, a menudo es necesario para realizar la tinción intracelular. Usamos la BD Biosciences Cytofix / Cytoperm Kit para la mayoría de las proteínas intracelulares y el Kit de BD Biosciences Foxp3 de tinción para los factores de transcripción. Por lo general, adquirir nuestras muestras inmediatamente después de la tinción. Sin embargo, las muestras pueden ser almacenadas durante la noche en tampón FACS con formaldehído al 1% a 4 ° C en la oscuridad. Tenga en cuenta que algunos fluorocromos y los anticuerpos pueden no ser compatibles con la fijación.
Para el análisis de selección positiva, se recomienda utilizar biotinilado anti-CD69 o anti-CD5 para proporcionar una mejor separación de las poblaciones negativas, intermedio, y que expresa altamente (Figura 2). Como se describe en los resultados representativos,esta estrategia gating ayudarán a distinguir los defectos de la selección positiva del compromiso de linaje, ya que los dos pueden requerir diferentes seguimiento. Además de la generación de los timocitos maduros SP, la selección positiva se puede confirmar mediante la regulación positiva de IL-7Rα y CCR7. Sin embargo, estos marcadores se expresan a nivel bajo en los timocitos de selección posterior a la DP en comparación con los timocitos SP 15,16. Para un análisis detallado de las etapas de maduración dentro del compartimiento de DP, Zap70 expresión intracelular puede ser medida 17. Esto puede ser particularmente útil para demostrar que las poblaciones con similar expresión de marcadores de maduración, tales como I y II en la TCRβ x CD5 parcela (Figura 2E), representan diferentes etapas de desarrollo.
El modelo HY CD4 tiene las ventajas de que representa tanto positiva y selección negativa, así como la expresión fisiológica del TCR transgénico. Sin embargo, estos métodos se pueden aplicar aotros modelos TCR transgénicos con ciertas consideraciones. Siempre incluye un anticuerpo contra el TCR transgénico de elección para permitir el estudio de las células T específicas de antígeno. Para algunos análisis, puede ser de interés para comparar la población específica de antígeno a la población no específico como un control interno. El estudio de la selección negativa en otros modelos transgénicos TCR requiere consideraciones adicionales. La etapa de desarrollo de los timocitos durante el cual tiene lugar la selección negativa varía entre los diferentes modelos TCR transgénicos. Cd4 HY timocitos pMHC participar en la fase DP, con lo que el análisis de la población CD8SP HY-específico progenie es la lectura correcta para la selección negativa 10,18 (Figura 3). Si la selección negativa se produce durante la transición a DN DP como en ratones HY clásicos 19, el análisis de interés sería la presencia o ausencia de antígenos específicos de timocitos DP. La selección contra el antígeno HY ubicuo se produce en el timocorteza 20. En contraste, la selección negativa contra antígenos restringidos de tejido se produce en la médula tímica 21,22. OT-I RIP-MOVA ratones recapitular este tipo de selección como el antígeno de Ova se expresa bajo el control del promotor de insulina de rata, que sólo está activo en la médula del timo y páncreas 23. Dado que la selección positiva de timocitos DP en la corteza tímica es primero necesario para la migración en el bulbo raquídeo, la ausencia de maduro (CD24 LO) OT-I TCR + timocitos CD8SP indica exitosa selección negativa en OT-I Rip-MOVA ratones 24.
Durante el uso de ratones transgénicos TCR tiene la ventaja de ser capaz de estudiar una población grande de antígenos específicos de células, una advertencia potencial se altera el desarrollo de células T debido a ligandos limitados que pueden mediar la selección positiva y negativa de la TCR transgénico. En RAG-suficientes cd4 HY ratones, otra advertencia es que la co-expresión de endógenonous cadenas TCRα tiene el potencial de modular la selección positiva y negativa en una minoría de HY TCR + timocitos. Esta advertencia no es única para el modelo HY CD4, sino más bien modelos TCR transgénicos en general. Los cd4 HY representativos presentados se derivan de cd4 HY ratones sobre un fondo Rag-suficiente. Aunque es un poco más complejo en la naturaleza, hay muchas maneras de estudiar la selección de timocitos en un ambiente más precursor fisiológico de frecuencia limitada. Por ejemplo, TCR transgénico y WT mixtos quimeras de médula ósea puede ser generado para reducir la frecuencia específica de antígeno precursor de timocitos. Adicionalmente, se pueden utilizar ratones que expresan sólo una cadena TCRβ transgénico, tal como la cadena VB8 del TCR HY 25 o la cadena de VB5 del TCR OT-I 26 para limitar la frecuencia de precursores. Debido a que la cadena TCRβ transgénico está emparejado con varias cadenas endógenas TCRα, el seguimiento de antígeno específico de re timocitoscuadernillos el uso de tetrámeros de pMHC. Una limitación de este método es que la expresión de TCR es demasiado baja en los timocitos DP para permitir la detección con tetrámeros. Esto limita un mayor estudio de los mecanismos moleculares en los timocitos DP que conducen a la selección positiva y negativa. Más recientemente, una combinación de tetrámeros de pMHC y el enriquecimiento de esferas magnéticas se ha utilizado para enumerar pequeñas, antígenos específicos de poblaciones de células T CD4 + en ratones no manipulados 27.
La selección negativa es principalmente mediada por la deleción clonal de autorreactivas timocitos través de la vía intrínseca de apoptosis. Timocitos apoptóticos puede ser detectado por citometría de flujo utilizando tinción intracelular para exfoliados caspasa-3. El BH3-sólo Bcl-2 Bim miembro de la familia es esencial para la activación de la caspasa-3 en timocitos, en respuesta a la estimulación de TCR 18,28. Al cruzar Bim-ratones deficientes para diferentes modelos transgénicos TCR, nuestro laboratorio ha descubierto que Bim se requiere para selección negativación contra ubicuos antígenos propios, pero no tejido con restricción de antígenos, lo que indica la existencia de múltiples mecanismos de selección negativos 18,29. Métodos similares han implicado la Nur77 huérfano receptor de esteroides como otro mediador clave de la selección tímica negativa 30,31. Transcripcional análisis de los timocitos DP de cd4 HY ratones ha generado una lista de genes específicamente inducidos durante la selección positiva y negativa 32. La aplicación de los métodos presentados aquí para ratones manipulados en estos genes pueden proporcionar información sobre los mecanismos moleculares de la selección tímica.
Es ideal para el seguimiento de examen de selección tímica con un análisis del compartimiento inmune periférica. Sin embargo, a menudo es difícil separar deleción central y periférico. La selección negativa se refleja finalmente por la ausencia de la autoinmunidad. Aunque tienen limitaciones, TCR ratones transgénicos son una forma eficaz y práctica paraestudiar la selección negativa fisiológica. Crossing TCR ratones transgénicos a los ratones deficientes en genes particulares es una manera eficaz para investigar los mecanismos moleculares de selección negativa. Es importante tener en cuenta, sin embargo, que la inflamación periférica debido a un defecto genético puede causar no específica mediada por deleción de timocitos corticosteroides y citoquinas 7-9. En tales casos, la estrategia que se presenta aquí se puede aplicar al análisis de timos de ratones recién nacidos antes de la aparición de la inflamación. La selección positiva, por otro lado, se puede estudiar en cualquiera de TCR-o no-TCR modelos transgénicos, el ahorro de los investigadores los problemas de mestizaje. Una mejor comprensión de las moléculas implicadas en la selección positiva y negativa conducirá a nuevas estrategias para el diagnóstico y tratamiento de trastornos autoinmunes e inmunodeficiencia.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean dar las gracias a Bing Zhang por su asistencia técnica. Este trabajo fue financiado por los Institutos Canadienses de Investigación en Salud (RP-86595). TAB es un Investigador CIHR Nueva y Académico AHFMR. QH es apoyado por una beca de CIHR Canadá Posgrado - Doctorado y una beca de AIHS tiempo completo. SAN es apoyado por una beca de la reina Elizabeth II de Posgrado. AYWS con el apoyo de una beca NSERC Postgrado - Doctorado.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Solución salina equilibrada de Hank HyClone | Thermo Scientific | SH30030.02 | |
| Pantallas metálicas de malla | Cedarlane | CX-0080-E-01 | |
| Placas de Petri (60 x 15 mm) | Fisher Scientific | 877221 | |
| Jeringuillas (3 ml) | BD Biosciences | 309657 | |
| Tubos cónicos (15 ml) | Sarstedt | 62.554.205 | |
| Microscopio | Zeiss - Primo Star | 415500-000-00XX | |
| Hemocitómetro | HausserCientífico | 3110 | |
| Placa de 96 pocillos | Sarstedt | 82.1582.001 | |
| Pipeta multicanal | Fisherbrand | 21-377-829 | |
| Suero de ternero fetal | PAA | A15-701 | |
| Salina tamponada con fosfato | Fisher Scientific | SH3025802 | |
| Sodio azida | IT Baker Chemical Co. | V015-05 | |
| FcR reactivo de bloqueo | Clone 2.4G2 | ||
| Anti-ratón HY TCR | eBioscience | XX-9930-YY * | Clone T3.70 |
| Mouse anti-CD4 | eBioscience | XX-0042-YY * | Clone RM4-5 |
| Lanti-ratón CD8 | eBioscience | XX-0081-YY * | Clone 53-6.7 |
| Anti-CD24 de ratón | eBioscience | XX-0242-YY * | Clone M1/69 |
| Anti-ratón TCRβ | eBioscience | XX-5961-YY * | Clon H57-597 |
| Anti-CD69 de ratón biotinilado | eBioscience | 13-0691-AA * | Clone H1.2F3 |
| Anti-ratón biotinilado CD5 | eBioscience | 13-0051-YY * | Clone 53-7.3 |
| Estreptavidina | eBioscience | XX-4217-YY * | |
| Citómetro de flujo | BD Biosciences - FACS Canto | 338962 | |
| FACS tubos | BD Biosciences | 352052 | |
| La citometría de flujo de software de análisis | TreeStar - FlowJo | FlowJo v7 / 9 | |
| HyClone medio RPMI - 1640 | Thermo Scientific | SH30027.01 | |
* XX varía según el fluorocromo y YY varía según el tamaño del vial. |
Referencias
- Liston, A., Lesage, S., Wilson, J., Peltonen, L., Goodnow, C. C. Aire regulates negative selection of organ-specific T cells. Nat. Immunol. 4, 350-354 (2003).
- Liston, A. Gene dosage--limiting role of Aire in thymic expression, clonal deletion, and organ-specific autoimmunity. J. Exp. Med. 200, 1015-1026 (2004).
- Hogquist, K. A., Baldwin, T. A., Jameson, S. C. Central tolerance: learning self-control in the thymus. Nat. Rev. Immunol. 5, 772-782 (2005).
- Liston, A., Enders, A., Siggs, O. M. Unravelling the association of partial T-cell immunodeficiency and immune dysregulation. Nat. Rev. Immunol. 8, 545-558 (2008).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu. Rev. Immunol. 21, 139-176 (2003).
- McCaughtry, T. M., Hogquist, K. A. Central tolerance: what have we learned from mice. Seminars in immunopathology. 30, 399-409 (2008).
- Zhan, Y. Without peripheral interference, thymic deletion is mediated in a cohort of double-positive cells without classical activation. Proceedings of the National Academy of Sciences of the United States of America. 100, 1197-1202 (2003).
- Brewer, J. A., Kanagawa, O., Sleckman, B. P., Muglia, L. J. Thymocyte apoptosis induced by T cell activation is mediated by glucocorticoids in vivo. J. Immunol. 169, 1837-1843 (2002).
- Martin, S., Bevan, M. J. Antigen-specific and nonspecific deletion of immature cortical thymocytes caused by antigen injection. European journal of immunology. 27, 2726-2736 (1997).
- Baldwin, T. A., Sandau, M. M., Jameson, S. C., Hogquist, K. A. The timing of TCR alpha expression critically influences T cell development and selection. J. Exp. Med. 202, 111-121 (2005).
- Tung, J. W. Modern flow cytometry: a practical approach. Clinics in laboratory medicine. 27, 453-468 (2007).
- Aliahmad, P., Kaye, J. Development of all CD4 T lineages requires nuclear factor TOX. J. Exp. Med. 205, 245-256 (2008).
- Kastner, P. Bcl11b represses a mature T-cell gene expression program in immature CD4(+)CD8(+) thymocytes. Eur. J. Immunol. 40, 2143-2154 (2010).
- Albu, D. I. BCL11B is required for positive selection and survival of double-positive thymocytes. J. Exp. Med. 204, 3003-3015 (2007).
- Van De Wiele, C. J. Thymocytes between the beta-selection and positive selection checkpoints are nonresponsive to IL-7 as assessed by STAT-5 phosphorylation. J. Immunol. 172, 4235-4244 (2004).
- Ueno, T. CCR7 signals are essential for cortex-medulla migration of developing thymocytes. J. Exp. Med. 200, 493-505 (2004).
- Saini, M. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science signaling. 3, ra23(2010).
- Hu, Q., Sader, A., Parkman, J. C., Baldwin, T. A. Bim-mediated apoptosis is not necessary for thymic negative selection to ubiquitous self-antigens. J. Immunol. 183, 7761-7767 (2009).
- Kisielow, P., Bluthmann, H., Staerz, U. D., Steinmetz, M., von Boehmer, H. Tolerance in T-cell-receptor transgenic mice involves deletion of nonmature CD4+8+ thymocytes. Nature. 333, 742-746 (1988).
- McCaughtry, T. M., Baldwin, T. A., Wilken, M. S., Hogquist, K. A. Clonal deletion of thymocytes can occur in the cortex with no involvement of the medulla. J. Exp. Med. 205, 2575-2584 (2008).
- Derbinski, J., Schulte, A., Kyewski, B., Klein, L. Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self. Nat. Immunol. 2, 1032-1039 (2001).
- Anderson, M. S. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298, 1395-1401 (2002).
- Kurts, C. Constitutive class I-restricted exogenous presentation of self antigens in vivo. J. Exp. Med. 184, 923-930 (1996).
- Nitta, T., Nitta, S., Lei, Y., Lipp, M., Takahama, Y. CCR7-mediated migration of developing thymocytes to the medulla is essential for negative selection to tissue-restricted antigens. Proceedings of the National Academy of Sciences of the United States of America. 106, 17129-17133 (2009).
- Bouneaud, C., Kourilsky, P., Bousso, P. Impact of negative selection on the T cell repertoire reactive to a self-peptide: a large fraction of T cell clones escapes clonal deletion. Immunity. 13, 829-840 (2000).
- Gallegos, A. M., Bevan, M. J. Central tolerance to tissue-specific antigens mediated by direct and indirect antigen presentation. J. Exp. Med. 200, 1039-1049 (2004).
- Moon, J. J. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27, 203-213 (2007).
- Bouillet, P. BH3-only Bcl-2 family member Bim is required for apoptosis of autoreactive thymocytes. Nature. 415, 922-926 (2002).
- Suen, A. Y., Baldwin, T. A. Proapoptotic protein Bim is differentially required during thymic clonal deletion to ubiquitous versus tissue-restricted antigens. Proceedings of the National Academy of Sciences of the United States of America. , (2012).
- Calnan, B. J., Szychowski, S., Chan, F. K., Cado, D., Winoto, A. A role for the orphan steroid receptor Nur77 in apoptosis accompanying antigen-induced negative selection. Immunity. 3, 273-282 (1995).
- Zhou, T. Inhibition of Nur77/Nurr1 leads to inefficient clonal deletion of self-reactive T cells. J. Exp. Med. 183, 1879-1892 (1996).
- Baldwin, T. A., Hogquist, K. A. Transcriptional analysis of clonal deletion in vivo. J. Immunol. 179, 837-844 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados