Method Article
Sensibles al voltaje Dye grabación de axones, dendritas y espinas dendríticas de las neuronas individuales en rodajas de cerebro
En este artículo
Resumen
Una técnica de imagen para el monitoreo de los cambios de potencial de membrana con una resolución temporal sub-micrométrico espacial y sub-milisegundos es descrito. La técnica, basado en una excitación láser de colorantes sensibles a voltaje, permite realizar mediciones de señales en los axones y colaterales axónicas, ramas terminales individuales dendríticas, y las espinas dendríticas.
Resumen
Entender las propiedades biofísicas y la organización funcional de las neuronas individuales y la forma en que procesan la información es fundamental para la comprensión de cómo funciona el cerebro. La función principal de cualquier célula nerviosa es para procesar señales eléctricas, por lo general de múltiples fuentes. Propiedades eléctricas de los procesos neuronales son extraordinariamente complejos, dinámicos y, en el caso general, imposible de predecir en ausencia de mediciones detalladas. Para obtener una medición de uno lo haría, idealmente, como para ser capaz de controlar, en múltiples sitios, eventos subumbral medida que viajan desde los sitios de origen de los procesos neuronales y summate en determinados lugares para la iniciación del potencial de acción. Este objetivo no se ha alcanzado en cualquier neurona debido a las limitaciones técnicas de mediciones que emplean electrodos. Para superar este inconveniente, es altamente deseable para complementar el enfoque parche de electrodo con técnicas de imagen que permiten recordin paralelo extensags de todas partes de una neurona. A continuación, describimos una técnica - grabación óptica de los transitorios de potencial de membrana con orgánicos tintes sensibles al voltaje (V m-imaging) - caracterizadas por sub-milisegundos y resolución sub-micrométrico. Nuestro método se basa en el trabajo pionero sobre sensibles al voltaje sondas moleculares 2. Muchos aspectos de la tecnología inicial han sido continuamente mejorado a lo largo de varias décadas 3, 5, 11. Además, el trabajo previo documentado dos características esenciales de la V m-imágenes. En primer lugar, las señales de fluorescencia son linealmente proporcional al potencial de membrana en todo el rango fisiológico (-100 mV a +100 mV; 10, 14, 16). En segundo lugar, las neuronas de carga con el colorante sensible al voltaje utilizado aquí (JPW 3028) no tiene efectos farmacológicos detectables. La ampliación grabado de la espiga durante la carga de colorante es completamente reversible 4, 7. Además, la evidencia experimental muestra que es posible obtenerun número significativo (hasta cientos) de grabaciones antes de cualquier efecto detectables fototóxicas 4, 6, 12, 13. En la actualidad, se toma ventaja de la excelente brillo y la estabilidad de una fuente de luz láser a la longitud de onda casi óptimo para maximizar la sensibilidad de la V m técnica de imagen. La sensibilidad actual permite realizar varias grabaciones sitio ópticas de V m transitorios de todas partes de una neurona, incluyendo los axones y colaterales del axón, ramas terminales dendríticas, y las espinas dendríticas individuales. La información adquirida en las interacciones de la señal puede ser analizada cuantitativamente, así como visualizar directamente en la forma de una película.
Protocolo
1. Configuración del equipo
Paso 1.1. Imágenes de instalación
La clave de registro de señales de tensión tintes sensibles es el diseño de la configuración apropiada. Nosotros usamos un microscopio vertical (BX51WI Olympus o AxioExaminer Zeiss) equipado con tres cámaras. La configuración se ha diseñado para la iluminación de las neuronas individuales en rodajas de cerebro de la luz de excitación en epi-fluorescencia de campo amplio modo de microscopía usando ya sea Nikon 60X/1.0 NA o Zeiss 63X/1.0 agua NA objetivos de inmersión. Nuestros microscopios están atornillados a una tabla de aislamiento de vibraciones y están equipadas con muebles motorizados etapas. Cada microscopio está equipado con tres puertos de cámara. Un puerto de la cámara tiene un alto nivel de resolución espacial cámara CCD para DIC video-microscopía infrarroja (IR-1000, Dage MTI, EE.UU.). El puerto de segunda cámara tiene una cámara de adquisición de datos rápida (hasta 20 kHz frecuencia de imagen) con una resolución espacial relativamente bajo (80 x 80 píxeles), pero el rango dinámico excepcional (14 bits) y excepcionalmente baja leerruido (NeuroCCD-SM, RedShirtImaging LLC, Decatur, GA). El puerto de la cámara tercera tiene una cámara CCD con una alta resolución espacial (PixelFly, 1392x1024 pixeles; PCO AG, Alemania) montado en un escáner confocal de hilar disco (CSU-10, Yokogawa, Japón) que se utiliza para recoger z-pilas de imágenes confocales para reconstrucción detallada morfológica de la célula teñida. Un diodo-bombeado de doble frecuencia Nd: YVO4 láser de onda continua (400 mW) que emite a 532 nm (MLL-III/400 mW; CNI, Changchun, China) es la fuente de luz de excitación. El 2 mm de diámetro del haz láser cerrada por un obturador (LS6; Asociados Vincent) está dirigida a una guía de luz acoplada a un microscopio de epifluorescencia a través de un condensador de un solo puerto (TILL Photonics GmbH, Gräfelfing, Alemania) diseñado para sobrellenar la abertura posterior de la objetiva, y cerca de iluminación uniforme del plano del objeto. La luz láser se utiliza en lugar de una convencional de xenón de arco de la lámpara para maximizar la sensibilidad de V m-formación de imágenes por: (1) utilizando un ex monocromáticacitación luz en el ala roja del espectro de absorción para maximizar la sensibilidad V m del colorante 9, 10 y (2) el aumento de la intensidad de la luz de excitación más allá del nivel que se puede lograr por un arco de lámpara. La luz de excitación se refleja a la preparación por un espejo dicroico con una longitud de onda central de 560 nm y la luz de fluorescencia registrada se pasó a través de un filtro de barrera de 610 nm (a Schott RG610). El efecto combinado de un aumento de la intensidad de la luz y el uso de longitudes de onda óptimas cerca de excitación monocromática era una mejora dramática en la sensibilidad de formación de imágenes tensión por un factor de aproximadamente 50 en comparación con las mediciones anteriores 6.
Paso 1,2. Ajustar para obtener una iluminación uniforme
Utilice un estándar diapositiva de fluorescencia (excitación verde / rojo emisión). Insertar apropiados filtros de densidad neutra en la trayectoria del rayo láser de manera que el CCD no está saturado. Enfoque el objetivo en la superficie dela diapositiva. Ajustar la posición del extremo de recepción de la guía de luz de cuarzo en frente del objetivo lanzador láser, y ajustar la posición del extremo de salida de la guía de luz acoplado al microscopio utilizando actuadores apropiados en el condensador de epi-fluorescencia para lograr y centrado uniforme iluminación del campo de visión.
Paso 1.3. Determinar ruido vibracional
Colocar una pequeña marca de tinta negro en la superficie de la corredera de fluorescencia. Registro de la intensidad de luz con NeuroCCD en el modo de grabación continua. Enfoque el objetivo en un borde oscuro de la marca de tinta negro. Anote la intensidad de la luz durante unos 100 ms a 2 kHz frecuencia de imagen. Muestra el promedio espacial de las trazas de intensidad de luz (fraccionarios Df / F) de ~ 20 pixeles que reciben la luz de la zona iluminada de manera uniforme y de ~ 20 píxeles a lo largo del borde de la marca de tinta. El exceso de ruido en grabaciones de píxeles con bordes de alto contraste refleja el ruido de vibración enel sistema.
Paso 1.4. Vibración aislamiento
Es obligatorio para reducir las vibraciones mediante el uso de una mesa de vibración-el aislamiento hasta un nivel por debajo del ruido de disparo a intensidades de luz comparables a las condiciones de grabación experimentales. Ajuste la tabla de aislamiento de vibración hasta que el ruido de las vibraciones en la intensidad de la luz de los píxeles que cubren el borde afilado de la imagen es insignificante. Ninguno de los equipos con partes móviles (obturadores mecánicos, ventiladores) se puede montar sobre la mesa. Los cables del equipo en la tabla adjunta a otros componentes que no son aislados de las vibraciones deben estar sueltos para que no transmitan vibraciones mecánicas para el microscopio.
2. La selección de una neurona Adecuado para V m-Imaging
Paso 2.1. Selección de las neuronas
Hacer rodajas de cerebro de acuerdo con procedimientos estándar. Utilice una línea de ratones que expresan EGFP en las células nerviosas individuales de il interés. Con un sistema de disco giratorio confocal, visualizar las neuronas EGFP etiquetados en la rebanada. Seleccione neuronas para V m-formación de imágenes con intactas dendríticas / axonal árboles, y con procesos que se ejecutan en paralelo y cerca de la superficie de la rebanada. Esto no puede llevarse a cabo en ratones de tipo salvaje porque los axones y dendritas finas, en su mayor parte, no son visibles en el modo de microscopía DIC.
3. Las neuronas de carga con voltaje-sensible Dye
Paso 3.1. El llenado de la pipeta de parche
Llenar pipetas de vidrio de parches desde la punta con medio de contraste solución libre intracelular mediante la aplicación de presión negativa durante aproximadamente 15 s hasta 2/3 de la conicidad electrodo. La solución de tinte libre en la punta es necesaria para prevenir el derrame de colorante sobre la rebanada que aumenta la fluorescencia de fondo y reduce drásticamente relación señal a ruido. Volver a llenar el electrodo con la solución que contiene la membrana impermeabilizante colorante sensible al voltaje JPW3028 disueltoen solución intracelular (0,8 mM).
JPW3028, la sonda de tensión más exitoso para la aplicación intracelular, es un análogo doblemente cargado positivamente de la serie de ANEP lipófilos colorantes de estirilo que todavía es suficientemente soluble en agua para ser utilizado para la microinyección. El análogo de di-etílico de este colorante tiene prácticamente idénticas características (incluyendo voltaje-sensibilidad) y está disponible comercialmente como JPW1114 (ver Tabla 1). Preparamos solución madre 20 mM en agua destilada H 2 O. 50 ml de alícuotas de la solución madre se mantuvo congelado a -20 ° C. Para la concentración de colorante final de 0,8 mM, 2 l de la solución stock se disuelve en 50 l de solución intracelular en el día del experimento. La solución de tinte stock es estable y puede guardarse a temperatura ambiente durante varios meses. Por lo tanto, mantener una alícuota de 50 l a temperatura ambiente hasta que se agote.
Paso 3.2. Establecer un giga-seal rápidamente
Patch una neurona previamente seleccionados y permitir la libre difusión del colorante a partir de una pipeta de patch somático al soma en la configuración de célula entera para 20-45 min. Es esencial para obtener un sellado tan rápido como sea posible para que la cantidad de colorante en una solución libre de la punta puede ser pequeña. Iniciar mediante la práctica de parches rápido sin el tinte en el electrodo. Siguiente neuronas, la práctica de parches y la carga con el colorante con el objetivo de utilizar una cantidad mínima de colorante en una solución libre de la punta sin contaminar el tejido circundante. Con la práctica, es posible establecer un sello dentro de 1-2 min.
Paso 3.3. Controlar el nivel de tinción
Durante la difusión del colorante en la configuración de célula completa, monitorizar el estado fisiológico de la neurona mediante el registro de los potenciales evocados de acción en el modo de corriente-clamp. Además, controlar la cantidad de tinción mediante el registro de la intensidad de la luz en reposo (RLI) desde el soma celular a una velocidad de 2 k Hz y en una fracción de la intensidad de luz total se ajusta con filtros de densidad neutra (usamos 0,04% de la intensidad de la luz láser de un láser de 400 mW). Continuar el proceso de carga de colorante hasta que el potencial de acción comienza a ampliar, por lo general después de 20-40 minutos, dependiendo del tamaño del electrodo y la resistencia.
La ampliación de la punta es completamente reversible y muy probablemente debido al efecto de la carga capacitiva de la concentración de saturación del colorante en la membrana somática. La forma de onda de la espiga está completamente restaurada después de la concentración de colorante se equilibra a lo largo de la neurona.
Paso 3.4. Retire el electrodo de tinte
Al final del periodo de tinción, extraer cuidadosamente el parche pipeta lejos del soma en la configuración de fijación de voltaje asegurar que la transición de la célula entera a la configuración del parche exterior hacia fuera se consigue en el proceso.
Paso 3,5. Esperar a que la difusión del colorante
ent "> Incubar la rebanada por un adicional de 1.5-2 horas a temperatura ambiente para permitir que el colorante sensible al voltaje que se extienda en los procesos neuronales. Después de una cantidad significativa de colorante se difunde lejos del soma en procesos dendríticos y axonales, la forma de onda de el punto de acceso está completamente restaurado.4. Óptico de grabación
Paso 4.1. Seleccionar un compartimiento celular para formación de imágenes
Localice el soma de la neurona teñido mediante fluorescencia bajo nivel de luz y re patch-la neurona con un electrodo de parche estándar (sin tinte) con DIC. Visualice los procesos neuronales bajo nivel de luz baja a una velocidad de 10-40 Hz en el modo de grabación continua de la Convención para la tensión de imágenes. Reducir el nivel de luz con filtros de densidad neutra a lo estrictamente necesario para visualizar el objeto de interés. Usamos 0,01% de la intensidad del láser 400 mW durante el posicionamiento de la neurona manchado. Usando una etapa XY, coloque el proceso neuronal de interés en tél centro de la superficie de imágenes. Proteja el soma de la luz de excitación mediante el iris campo parada parcialmente cerrada del microscopio. Proteger a la soma de luz de alta intensidad de excitación reducirá significativamente el daño fotodinámico durante la grabación.
Paso 4,2 señales de grabación ópticos relacionados a los transitorios de potencial de membrana
Graba señales ópticas relacionadas con APs individuales backpropagated en ramas dendríticas. Graba señales ópticas relacionadas con APs en el axón. Graba señales ópticas relacionadas con backpropagating APs en las espinas dendríticas. Utilice velocidades de fotogramas apropiadas para la reconstrucción precisa de la forma de onda de la señal y mantener los períodos de grabación y la exposición a luz de alta intensidad de excitación tan cortos como sea posible para minimizar la decoloración y tinte daño fotodinámico. Por ejemplo, el examen de la secuencia de inicio y la propagación de los potenciales de acción en el axón individuales requiere períodos de grabación de 5-10 mseg. La luz de excitación intensificaTy durante la grabación es un compromiso entre la relación de señal a ruido por un lado y el grado de blanqueo y tinte daño fotodinámico en el otro lado. Usamos 100% de la intensidad del láser de 400 mW en la grabación de secciones largas de axones cuando un área de 300 m de diámetro está iluminada. Cuando la luz de excitación está enfocada a un área de diámetro 30 micras para obtener imágenes de la espina dendrítica, utilizamos un 10-25% de la intensidad de la luz láser. El plazo de vigencia de la grabación es un importante factor determinante de la intensidad de luz de excitación óptima, cortos períodos de grabación permiten mayores intensidades de luz. La intensidad de la iluminación óptima se determina mejor empíricamente para cada preparación y la configuración de medición.
5. Análisis de Datos
Paso 5.1. Corrija los datos en bruto para los errores conocidos
El análisis y la visualización de los datos se realizó mediante el programa NeuroPlex (RedShirtImaging) escrito en IDL (ITT Visual Information Solutiones, Boulder, Colorado) y rutinas personalizadas de Visual Basic. Bajo las condiciones de bajos niveles de luz, la fluorescencia de fondo se convierte en un determinante significativo de la señal de tamaño Df / F. Los datos en bruto se corrigieron primero para este efecto restando la intensidad media de fluorescencia de fondo determina a partir de un área sin teñir en el segmento. Posteriormente, el software de alineación de la señal se usa para corregir la fluctuación temporal en AP iniciación, así como para posibles pequeños movimientos de la preparación durante un promedio. En el dominio temporal, las señales de AP fueron alineados por correlación cruzada de los puntos de acceso eléctricamente registrada en cada ensayo para la señal de referencia adquirido en el inicio de promediado (Figura 1B). En el dominio espacial, las imágenes fueron alineados en dos dimensiones desconectado por imagen de correlación cruzada para compensar posibles pequeños movimientos laterales de la preparación. El enfoque correcto de la imagen en la dimensión z se verificó antes de cada ensayo individual; smal l ajustes eran a menudo necesarias. Las señales espacial y temporalmente alineados se promediaron como se muestra en la Figura 1B. Los cambios lentos en la intensidad de la luz debido a la decoloración del colorante fueron corregidos por la división de los datos por una función doble exponencial apropiada derivada de los ensayos de grabación sin estimulación (Figura 1B). La forma de onda de la señal de AP fue reconstruido a partir de un conjunto de puntos de datos mediante interpolación spline cúbica, una curva continua por tramos pasando a través de cada punto de datos. Para confirmar que la señal de tinte sensible al voltaje rastrea potencial de membrana sin distorsión significativa en la escala de tiempo de un milisegundo, la señal eléctrica de AP desde el soma se comparó con la señal óptica AP de la loma axón adyacente como se muestra en la Figura 3B. Las dos señales de superponer muy de cerca, lo que permite el ruido de disparo en la grabación óptica.
les/ftp_upload/4261/4261fig1.jpg "/>
Figura 1. Análisis de los datos (Animación). (A) Panel superior: Imagen de alta resolución confocal de una neurona se tiñeron con axón en posición de grabación. Electrodo de registro conectado al soma y electrodo extracelular estimulante al lado de dendrita basal se muestra esquemáticamente. Los potenciales de acción evocados por estimulación extracelular, sináptica. Panel inferior: imagen de baja resolución espacial de la fluorescencia del axón conseguir por CCD utilizado para V m de imagen (B) grabaciones de electrodos del soma (trazos negros), grabaciones ópticas de AIS (trazos rojos), y desde el nodo de Ranvier (trazas verdes). . Trazas principales: datos brutos de 9 ensayos que muestran inestabilidad temporal en la PA iniciación. Segunda fila de huellas: alineado temporalmente señales. Tercera fila de huellas: señal promediada. Cuarta fila de huellas: Corrección de lejía. Trazas inferiores: interpolación spline cúbica con una sola pasada de alisado temporal.
Resultados
Microscopía confocal de éxito debe permitir la identificación clara de los procesos neuronales intactas que están cerca de la superficie de la rebanada y situado en un plano de enfoque. La selección de las células nerviosas que son apropiados para la formación de imágenes de tensión antes de la carga del colorante sensible al voltaje es crítica. Un ejemplo de imágenes confocales de la L5 neuronas piramidales que expresan EGFP en una rebanada cortical (Crym transgénico línea de ratón) se muestra en la Figura 2. Los axones de las neuronas individuales son claramente visibles. Las células con largos axones intactos (flechas blancas) en un plano de enfoque de cerca a la superficie de la rodaja se seleccionaron.
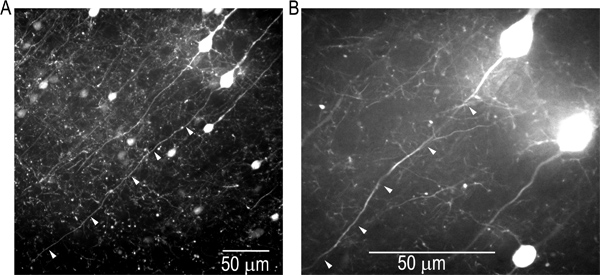
Figura 2. Selección de L5 neuronas corticales para V m-proyección de imagen de las señales de AP de los axones. Bajo (izquierda) y alta (derecha) ampliación de la región misma división, excitación 488 nm utilizando Yokogawahilado escáner de discos.
El patrón espacial de Na-canal de la agrupación en el segmento inicial del axón (AIS) desempeña un papel crítico en la sintonización cálculos neuronales y los cambios en Na-canal de distribución han demostrado mediar nuevas formas de plasticidad neuronal en el axón. Sin embargo, los datos sobre la distribución de inmuno canal no puede directamente predecir las características espacio-temporales de la iniciación del potencial de acción y las medidas electrofisiológicas anteriores son o indirecta (extracelular) o carecen de la suficiente resolución espacial (intracelular) para caracterizar directamente la zona gatillo espiga (TZ). Una mejora metodológica crítico en la sensibilidad de la técnica de imagen potencial de membrana aquí descrito permite la determinación directa de la ubicación y la longitud de la espiga TZ tal como se define en términos funcionales. Un ejemplo de grabación de señales de AP en alta resolución espacial y temporal se muestra en la Figura 3. Figura 3B ilustra quela sensibilidad disponible de V m-imagen fue suficiente para el control preciso de la despolarización subumbral que precede a la regeneración de la señal AP. Además, la comparación de las señales ópticas de AP de la loma soma / axón y desde un nodo más distal de Ranvier confirmó que los puntos de acceso tienen una dinámica marcadamente diferentes en estas dos ubicaciones de 8, 15; tanto la carrera ascendente y la carrera descendente del AP fue más rápida en el nodo de Ranvier. Para obtener más información sobre los límites de resolución espacio-temporal en las mediciones del tamaño y la posición de la espiga TZ véanse las figuras 3 y 5 en Popovic et al. (2011).

Figura 3. Acción posibles señales del axón. (A) Panel superior: imagen confocal de alta resolución de una neurona cortical L5 cargadas con el colorante sensible al voltaje con axón en posición de grabación, proyección from un z-stack de imágenes confocal. Grabación / electrodo estimulante parche unido a soma. Panel inferior: bajo la imagen de fluorescencia resolución espacial del axón obtenida por la CCD utilizado para V m-imágenes. (B) Las señales de AP relacionadas con grabado a una velocidad de 10 kHz. Las huellas de la derecha: AP transitorios procedentes de tres lugares: 1-electrodo de registro de soma, 2-óptico de grabación de axón loma; 3-óptico de grabación desde el primer nodo de Ranvier. Trazas de fondo: Superpuesta señal de los mismos tres ubicaciones.
La interacción no lineal entre los potenciales excitatorios postsinápticos (EPSPS) y PABs en las dendritas, que es responsable de la inducción de LTP no se entiende completamente. Esta interacción depende críticamente de la amplitud de ambas señales y deben, por lo tanto, ser espacialmente no uniforme. La prueba experimental de esta predicción requiere mediciones espacialmente bien resueltos que no se han llevado a cabo porque las ramas dendríticas de pequeño diámetro no son unaccessible a las mediciones de los electrodos. La técnica de formación de imágenes potencial de membrana se describe aquí permite el seguimiento de señales eléctricas desde múltiples ubicaciones en el árbol dendrítico completo como se muestra en la Figura 4. El patrón de actividad BAP en el cenador dendrítico se caracteriza por picos de corriente de sodio dominaron en las regiones proximales que cambió gradualmente a la corriente de calcio despolarización prolongada dominado los acontecimientos en las dendritas distales.

Figura 4. Señales de potencial de acción desde varias ubicaciones en el árbol dendrítico de una neurona cortical L5. Panel de la izquierda: imagen de alta resolución de una neurona cortical L5 cargado con un colorante sensible al voltaje; proyección de un Z-pila de imágenes confocales. Panel derecho: una ráfaga de 4 AP iniciadas a 100 Hz por cortos pulsos de corriente de despolarización (traza inferior) entregados al soma. Backpropagating unction posibles señales procedentes de seis localidades seleccionadas (1-6) a lo largo de las dendritas apicales y oblicua. Las huellas 1 a 3 se obtuvieron a partir de una grabación de prueba única. Traza 4 es una media de prueba de cuatro, mientras trazas 5 y 6 son dieciséis promedios de prueba.
La hipótesis de que las espinas tienen una función eléctrica de modificar la eficacia sináptica que subyace plasticidad y aprendizaje y la memoria, posiblemente, mecanismos ha recibido recientemente considerable atención debido a sus implicaciones críticas para la función cerebral (Yuste, 2010). Hay, sin embargo, muy poca evidencia experimental directa a favor o en contra de esta hipótesis. Las incertidumbres en la interpretación de los resultados indirectos y la falta de pruebas directas sobre el comportamiento eléctrico de las espinas dendríticas se deben principalmente a una limitación metodológica - espinas son pequeñas y no se puede acceder a los métodos convencionales de electrofisiología. Por lo tanto, los intentos para investigar esta cuestión en la ausencia de datos experimentales invocadossimulaciones por ordenador con las estimaciones de los parámetros eléctricos basados en la morfología y las propiedades difusionales columna vertebral de la espina dorsal del cuello. El enfoque de voltaje de formación de imágenes se describe aquí hace posible controlar las señales de potencial de acción y potenciales sinápticos señales en la escala espacial de las espinas dendríticas individuales con alta sensibilidad. Los experimentos ahora pueden ser diseñados para probar directamente las predicciones teóricas fundamentales sobre el comportamiento eléctrico de las espinas dendríticas. Un ejemplo de las señales ópticas relacionados con puntos de acceso backpropagating en una espina dendrítica individual y su padre dendrita se muestra en la Figura 5.

Figura 5. Señales del potencial de acción de una espina dendrítica individual. Paneles de la izquierda: micrografías superiores - reconstrucciones anatómicas obtenidas a partir de una pila de hilado de disco confocal de imágenes. Menores - FL micrografíasuorescencia imágenes de la misma región obtenida con la cámara CCD para V m-formación de imágenes. Panel derecho: La intensidad de fluorescencia traza correspondiente a bAP desde ubicaciones 1-3 descritos en imágenes CCD. Promedios temporales de 9 ensayos. Traza de fondo: Las grabaciones de electrodos del soma. Tenga en cuenta que la traza 3 desde una zona sin una columna vertebral no tiene señal detectable que indica el nivel bajo de dispersión de la luz en la capa superficial de la rebanada.
Discusión
En este artículo se describe un método de tintura sensible al voltaje de grabación para monitorear la actividad eléctrica de las neuronas individuales con sub-micrométrico y sub-milisegundos resolución espacio-temporal. Excitación con láser en casi óptimo de longitud de onda (en cuanto al tamaño de la señal) mejoró la sensibilidad de grabación en un factor de ~ 50 sobre los enfoques anteriores. La sensibilidad actual permite monitorizar señales eléctricas de todas las partes de las neuronas individuales, incluyendo las dendritas, axones, colaterales y terminales de axón axón, así como las espinas dendríticas individuales. Con sensibilidad presente, las grabaciones de los transitorios potenciales de membrana se puede llevar a cabo a velocidades de cuadro de hasta 20 kHz. Promedio de la señal modesta (4-25 ensayos) fácilmente puede mejorar la sensibilidad de grabación expresa como la relación de señal a ruido en un factor de 2-5. La limitación principal de formación de imágenes de voltaje es la falta de calibración simple de señales ópticas de varias ubicaciones en una escala de tensión absoluta. En algunos preparacións esto puede ser resuelto mediante la búsqueda de una señal de potencial de membrana que tiene una amplitud conocida en todos los lugares. Señales de AP en el axón y las dendritas en algunas completamente excitables 6 proporcionan un excelente estándar de calibración.
Pasos críticos en la aplicación de esta metodología son:
- Minimización de los efectos de dispersión de luz mediante la restricción de las grabaciones de las neuronas localizadas cerca de la superficie de las secciones de cerebro agudo (<30 micras). Esto requiere la optimización del procedimiento de corte para obtener un alto porcentaje de las neuronas sanas en la capa superior de la rebanada 1.
- Optimización de la cantidad de solución clara en la punta del electrodo para suministrar el medio de contraste para asegurar carga rápida de las neuronas.
- La eliminación de las vibraciones mecánicas de la preparación que puede ser una fuente de exceso de ruido en la grabación óptica.
- El empleo de bajo nivel de ruido de onda continua (CW) láser con el ruido RMS de amplitud <0,5% como fuente de excitación luz.
- Control de los daños fotodinámica mediante la selección de la intensidad de luz de excitación apropiada con respecto a la duración del período de registro y mediante la separación de grabaciones sucesivas por períodos de oscuridad. Los períodos más largos de grabación requieren bajas intensidades de luz para evitar daños fotodinámica.
Los ejemplos de grabación mostrado arriba indica un punto de inflexión en la columna vertebral y la fisiología del axón. Estas grabaciones revelan el extraordinario poder de ser capaz de grabar directamente los eventos eléctricos que sólo podían ser analizados en el campo teórico en el pasado.
Divulgaciones
Dejan Zecevic declara que él es co-propietario de RedShirtImaging LLC., Una empresa especializada en alta velocidad, bajo ruido cámaras CCD utilizados en la grabación de tinte sensible a la tensión. Todos los demás autores no reportan intereses financieros o los posibles conflictos de interés relacionados con el estudio actual.
Agradecimientos
Estamos muy agradecidos a nuestros colaboradores Knut Holthoff, Konnerth Arthur y Canepari Marco, que participó en el desarrollo inicial de esta técnica, así como a Leslie M. Loew para proporcionar la amabilidad de los tintes. Con el apoyo de NSF subvención IOS-0817969, el NIH subvenciones NS068407 y M136043 y por Instituto Kavli de Neurociencia en la Universidad de Yale.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del componente | Empresa | Número de catálogo | Comentarios (opcional) |
| Componentes de la instalación | |||
| Microscopio vertical | Olympus Inc. | BX51WI | Con tres puertos de cámara |
| Fase móvil motorizado | Siskiyou | MXOPi.2 | |
| Epi-fluorescencia Olympus BX51 condensador para | TILL Photonics | 0000-560-11659 | |
| Microscopio vertical | Carl Zeiss, LLC | AxioExaminer D1 | Con tres puertos de cámara |
| Plato Motorizado Top | Scientifica Limited | MMBP | |
| Epi-fluorescencia Zeiss condensador para AxioExaminer | TILL Photonics | ||
| Datos de la Cámara de Adquisición | RedShirtImaging LLC | NeuroCCD-SM | Alta velocidad, bajo ruido de lectura |
| CCD IR-DIC | Dage-MTI | IR-1000 | |
| Spinning-Disc escáner confocal | Yokogawa | CSU-10 | |
| CCD de alta resolución espacial en el escáner confocal | PCO AG | PixelFly | 1392x1024 píxeles |
| CW DPSS láser (532 Nm) | CNI Tech Optoelectronics. Co., Ltd | MLL-III-532 400mW | Excitación fuente de luz |
| Multi-Mode Fiber Launcher | Siskiyou | SM-CFT | |
| Guía de luz | TILL Fotonics | 0000-515-11524 | |
| Obturador | Vincent Asociados | LS6 | |
| Vibración Tabla Aislamiento | Minus k Tecnología | MK26 | |
| Reactivos específicos | |||
| Di-2-ANEPEQ (JPW 1114) | Life Technologies | D-6923 | Tinte sensible a la tensión |
| Crym-EGFP ratón Line | GENSAT (MMRRC) | ARCHIVO Tg (Crym-EGFP) GF82Gsat/Mmcd | Escasamente expresando EGFP en la capa 5 neuronas corticales |
Referencias
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1, 2075-2081 (2006).
- Cohen, L. B., Salzberg, B. M. Optical measurement of membrane potential. Ann. Rev. Neurosci. 1, 171-182 (1978).
- Cohen, L. B. Historical overview and general methods of membrane potential imaging. Membrane Potential Imaging in the Nervous System. Canepari, M., Zecevic, D. , Springer Neuroscience. New York. (2010).
- Canepari, M., Djurisic, M., Zecevic, D. Dendritic signals from rat hippocampal CA1 pyramidal neurons during coincident pre- and post-synaptic activity: a combined voltage- and calcium imaging study. J. Physiol. 580, 463-484 (2007).
- Canepari, M., Popovic, M., Vogt, K., Holthoff, K., Konnerth, A., Salzberg, B. M., Grinvald, A., Antic, S. D., Zecevic, D. Imaging submillisecond membrane potential changes from individual regions of single axons, dendrites and spines. Membrane Potential Imaging in the Nervous System. Canepari, M., Zecevic, D. , Springer Neuroscience. New York. (2010).
- Djurisic, M., Antic, S., Chen, W. R., Zecevic, D. Voltage imaging from dendrites of mitral cells: EPSP attenuation and spike trigger zones. J. Neurosci. 24, 6703-6714 (2004).
- Holthoff, K., Zecevic, D., Konnerth, A. Rapid time-course of action potentials in spines and remote dendrites of mouse visual cortical neurons. J. Physiol. 588, 1085-1096 (2010).
- Kole, M. H. P., Letzkus, J. J., Stuart, G. J. Axon initial segment Kv1 channels control axonal action potential waveform and synaptic efficacy. Neuron. 55, 633-647 (2007).
- Kuhn, B., Fromherz, P., Denk, W. High sensitivity of Stark-shift voltage-sensing dyes by one- or two-photon excitation near the red spectral edge. Biophysical J. 87, 631-639 (2004).
- Loew, L. M. Design and characterization of electrochromic membrane probes. J. Biochem. Biophys. Method. 6, 243-260 (1982).
- Loew, L. Design and use of organic voltage sensitive dyes. Membrane Potential Imaging in the Nervous System. Canepari, M., Zecevic, D. , Springer Neuroscience. New York. (2010).
- Palmer, L. M., Stuart, G. J. Site of action potential initiation in layer 5 pyramidal neurons. J. Neurosci. 26, 1854-1863 (2006).
- Popovic, M. A., Foust, A. J., McCormick, D. A., Zecevic, D. The spatio-temporal characteristics of action potential initiation in layer 5 pyramidal neurons: a voltage imaging study. J. Physiol. 589, 4167-4187 (2011).
- Ross, W. N., Salzberg, B. M., Cohen, L. B., Grinvald, A., Davila, H. V., Waggoner, A. S., Wang, C. H. Changes in absorption, fluorescence, dichroism, and birefringence in stained giant axons: optical measurement of membrane potential. J. Membr. Biol. 33, 141-183 (1977).
- Shu, Y., Duque, A., Yu, Y., Haider, B., McCormick, D. A. Properties of action potential initiation in neocortical pyramidal cells: evidence from whole cell axon recordings. J Neurophysiol. 97, 746-760 (2007).
- Wu, J. -Y., Cohen, L. B. Fast multisite optical measurement of membrane potential. A practical guide to technology for quantitative real-time analysis. Mason, W. T. , Academic. New York. 389-404 (1993).
- Yuste, R. Dendritic Spines. , MIT Press. (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados