Method Article
La implantación intracraneal con posterioridad 3D En Vivo Bioluminiscentes imagen de gliomas murino
En este artículo
Resumen
Implantación intracraneal de GL261 células en ratones C57BL / 6 produce los gliomas malignos que recapitular muchas de las características del glioblastoma multiforme humano. Hemos utilizado GL261 células que expresan establemente la luciferasa que nos permita utilizar En vivo Imágenes para seguir la progresión del tumor. La cirugía y 3D En vivo Imágenes se muestran.
Resumen
El ratón glioma 261 (GL261) es reconocido como un sistema en el modelo in vivo que resume muchas de las características del glioblastoma multiforme humano (GBM). La línea celular fue inducida inicialmente por inyección intracraneal de 3-metil-cholantrene en un C57BL / 6 cepa de ratón singénico 1, por lo tanto, inmunocompetentes ratones C57BL / 6 se puede utilizar. Mientras que utilizamos el GL261, el siguiente protocolo se puede utilizar para la implantación y seguimiento de cualquier modelo de ratón de tumores intracraneales. GL261 células fueron diseñados para expresar de forma estable la luciferasa de luciérnaga (GL261-luc). También hemos creado el más brillante GL261-luc2 de líneas celulares mediante transfección estable del gen luc2 expresa del promotor de CMV. Ratones C57BL/6-cBrd/cBrd/Cr (variante albina de C57BL / 6) del Instituto Nacional del Cáncer, Frederick, MD se utiliza para eliminar la atenuación de la luz causada por la piel y el pelo negro. Con el uso de C57BL albino / 6 ratones; imágenes in vivo utilizando el espectro IVIS en vivo imel envejecimiento del sistema es posible a partir del día de la implantación (Caliper Life Sciences, Hopkinton, MA). El GL261-luc y GL261-luc2 líneas celulares mostraron el mismo comportamiento in vivo como la de sus padres GL261 células. Algunas de las características compartidas histológicos presentes en GBMs humanos y este modelo de ratón son: necrosis tumoral, pseudopalisades, la neovascularización, la invasión, hipercelularidad, y la inflamación 1.
Antes de la implantación de los animales fueron anestesiados con una inyección intraperitoneal de ketamina (50 mg / kg), xilacina (5 mg / kg) y buprenorfina (0,05 mg / kg), colocado en un aparato estereotáctico y una incisión se realizó con un bisturí sobre la la línea media del cráneo. A burrhole se hizo posterior a la de 0,1 mm y 2,3 mm bregma a la derecha de la línea media. Una aguja se inserta a una profundidad de 0,4 mm y 3 mm de retirarse a una profundidad de 2,6 mm. Dos l de GL261-luc o GL261-luc2 células (10 7 células / ml) fueron infundidos en el transcurso de 3 minutos. El burrhole se cerrócon bonewax y la incisión fue suturada.
Tras el implante estereotáctico de las células bioluminiscentes son detectables a partir del día de la implantación y el tumor puede ser analizada utilizando la función de reconstrucción de imágenes 3D de los instrumentos de espectro IVIS. Los animales reciben una inyección subcutánea de 150μg luciferina / kg de peso corporal de 20 minutos antes de la imagen. La carga tumoral se cuantifica utilizando bioluminiscencia tumor significa que el paso del tiempo. Los ratones portadores del tumor fueron observados diariamente para evaluar la morbilidad y fueron sacrificados cuando uno o más de los siguientes síntomas están presentes: letargo, falta de deambular, postura encorvada, falta de novio, anorexia resulta en la pérdida> 10% del peso. Los tumores fueron evidentes en todos los animales en la necropsia.
Protocolo
1. Cultivo de células
- La línea celular GL26 se obtuvo de la División de Tratamiento y Diagnóstico del Cáncer (DCTD) Instituto Nacional del Cáncer (NCI), Frederick, MD. Para facilitar una medición cuantitativa de la tasa de crecimiento del tumor GL261 células se hicieron con el bioluminiscentes Lentiphos HT System (Clontech Laboratories, Inc., de Mountain View, CA) con el Lenti-X Mix HT Embalaje (Clontech Laboratories, Inc.) y la FUW GL plásmido (un generoso regalo del laboratorio de JB Rubin, MD, PhD). Las células se mantuvieron en la Dulbecco modificado de Eagle (DMEM) con tetraciclina libre de 10% de suero de ternera fetal (FCS; Clontech Laboratories, Inc.). GL261 células también fueron transfectadas establemente con el gen que codifica luc2 con el pGL4.51 [luc2 / CMV / Neo] las condiciones de vector (Promega Corp, Madison, WI) y FuGENE 6 Transfection Reagent (Roche Ciencias Aplicadas, Indianapolis, IN), tras especificado por el fabricante. El gen luc2 es una versión optimizada del codón luciérnaga Luciferase lo que proporciona una salida de luz mucho mayor que el estándar gen luc. Transfectantes estables fueron seleccionados y mantenidos en los medios de comunicación DMEM con 10% FCS y 100 mg / ml geneticina (G418, Invitrogen Corp, Carlsbad, CA).
- Antes de la implantación de las células cultivadas se cosechan trypsinzation, una vez lavadas en DMEM sin suero y se resuspendieron en DMEM sin suero a una concentración de 1 x 10 7 células / ml.
2. Cirugía de configuración 2
- Un ambiente estéril se mantiene durante toda la cirugía, incluyendo todos los instrumentos quirúrgicos, insumos, guantes, cortinas, etc.
- Diez semanas de edad C57BL/6-cBrd/cBrd/Cr (albino C57BL / 6) los ratones son comprados por el Instituto Nacional del Cáncer en Frederick Programa de Producción Animal y se utiliza en un peso promedio de 20 gramos (NCI, Frederick, MD).
- Los animales son anestesiados por inyección intraperitoneal de xilazina (5 mg / kg), ketamina (50 mg / kg) y buprenorfina (0,05 mg / kg). Auna pizca de correo se hace para asegurar que el animal esté anestesiado antes de la cirugía ha comenzado. Movimiento (aunque leve) de cualquier parte del animal es una indicación de una reducción en el nivel de anestesia. Animal es inmediatamente dado un adicional de 3,3 mg / kg de xilazina y ketamina 26,6 mg / kg. La temperatura corporal se mantiene con una lámpara y una gasa estéril que cubre el cuerpo.
- Una vez que el animal está bien anestesiado, se colocan en la cama acolchada del castillete estereotáctica (Modelo 900 de Pequeños Animales estereotáxica, David Kopf Instruments) [Figura 1].
- Una pequeña cantidad (1 / 4 de pulgada) de ungüento lubricante AKWA lágrimas oftálmica se aplica sobre la córnea.
- El animal se fija en el marco de estereotaxia mediante la apertura de la boca del animal (colocando el dedo índice y el pulgar alrededor de la mandíbula del animal) y el deslizamiento de los dientes frontales superiores en la muesca en el marco estereotáctico. La pinza se aprieta para asegurar la cabeza del animal en el auricular de asegurarse de que thcabeza e está alineada y los ojos se centran, por lo que sin embargo no ejercer una fuerza excesiva sobre la cabeza del animal.
- La manguera de O 2 se pega abajo, cerca de las fosas nasales del animal. Tasa de flujo de oxígeno es de 0,5 l / min.
- La espalda baja y la cola se pega abajo de la cama estereotáctica con cuidado de no comprometer las respiraciones.
- El sitio de la incisión quirúrgica se afeita. Yodo povidona palillos de hisopo se usan para lavar el área entre los ojos que se remonta a la zona comprendida entre las orejas con el yodo, por lo que el yodo no gotea en los ojos del animal.
- Las células están preparadas para la implantación justo antes de la cirugía y se mezclan periódicamente para asegurarse de que no se conforman.
- A l 10, 50 mm Mundial de instrumentos de precisión (IPM), Sarasota, FL, una jeringa con aguja de calibre 26 biselados se carga con el inóculo celular. Si las células parecen estar agrupadas, puede ser necesario volver a cargar la jeringa.
- La jeringa de 10 l se coloca en el Ultram UMP3-1icroPump micro inyección (WPI, Sarasota, FL).
3. La implantación intracraneal 2
- La incisión de la piel se realiza con un tamaño de 15 hoja de bisturí y pinzas dentadas. Se hace una incisión de 10-15 mm se hace longitudinalmente desde entre los ojos del animal, moviéndose hacia las orejas del animal exponiendo el bregma (unión de las suturas coronal y sagital en la parte superior del cráneo). Asegúrese de identificar correctamente el bregma ya que puede confundirse fácilmente con el área del seno que es distal a la bregma [Figura 2].
- Después de que el animal está sedado recibe una inyección intra-incisión de 0,25% (2,5 mg / ml) de bupivacaína.
- A burrhole se hace 0,1 mm posterior al bregma y 2,3 mm a la derecha de la línea media, poco a poco girando una de calibre 16 de 1 ½ pulgadas de la aguja con la mano, aplicando muy poca presión a la aguja mientras gira hasta que el cráneo es penetrado y el cerebro está expuesto.
- La aguja de la jeringa se desplaza hacia abajo en su posición utilizando el ste microdrivetitular reotactic jeringa hasta que toque la superficie del cerebro. Desde esta posición, la aguja se introduce en el cerebro a una profundidad de 3 mm y se mantienen en su lugar durante 3 minutos.
- Se retira la aguja 0,4 mm a una profundidad total de 2,6 mm por debajo de la superficie del cerebro, creando una pequeña bolsa donde las células se infunde. Es opcional en este punto para tomar una imagen de rayos X de la aguja en el animal para asegurar la colocación adecuada y en profundidad.
- La suspensión de células se infunde más de 3 minutos con el inyector de micro conjunto a un volumen de 2.000 NL (2 l), con una tasa de infusión de 667 nL / min.
- La aguja se deja en su lugar durante 2 minutos para evitar la fuga del lugar de la perfusión.
- La aguja se retira lentamente por completo.
- El burrhole está lleno de cera de hueso utilizando un disector Penfield.
- La incisión se sutura con un 4-0 (1,5 métrico) vicryl sutura asegurándose de que no se dejan grandes lagunas en la piel. Vicryl es un material de sutura que se disuelvens, y por lo tanto, las suturas no necesitan ser retirados cuando la incisión se cure.
- Después de la cirugía los animales se colocan en una jaula en una lámpara de calentamiento que se encuentra a la altura requerida para calentar la superficie inferior de la jaula a 30 ° C. Cuando los animales están completamente despierto (a juzgar por el movimiento normal en la jaula) que se devuelven a la vivienda del grupo. Ibuprofeno oral se añade al agua de bebida durante 5 días después de la operación. 100 mg de ibuprofeno para niños (100mg/5ml) se añade a un estándar de 473 ml botella de agua de roedores. Los animales se observan diariamente y con imágenes y pesaba cada 3 días. Dos semanas después de la implantación de observación se incrementa hasta dos veces por día. Los animales son sacrificados cuando muestran signos de deterioro de la salud que incluye la postura encorvada, pérdida de movilidad reducida y visible el peso corporal (≥ 20%). Estos síntomas son una respuesta publicada en el tumor y reproducible aparecen aproximadamente 1 día antes de la muerte por el tumor.
4. En vivo La bioluminiscencia de imágenes 3
- Inicie el [imagen viva] software.
- El sistema IVIS imágenes se inicializa haciendo clic en el [Inicializar sistema IVIS] situado en la parte inferior derecha del panel de control.
- Seleccione el botón [luminiscentes] Modo de Imagen en la parte superior izquierda del panel de control.
- Para determinar el momento óptimo de la imagen después de la inyección luciferina un estudio cinético es necesario [Figura 3]. Esta descripción es para luciferasa de luciérnaga;
- Inyectan 10μl / g de peso corporal de D-luciferina de luciérnaga (15mg/ml en PBS; Caliper Life Sciences catálogo XR-1001 o un producto similar de otro fabricante) en el animal, tal como se describe a continuación.
- Esperar 3 minutos, y luego anestesiar el ratón, colocándolo en la cámara de gas anestésico (2% del gas isoflurano en O 2).
- Apague la anestesia de gas a la cámara y abra la válvula de la anestesia y el vacío del colector de IVIS. Colocar inmediatamente el animal sedadoen la plataforma de temperatura controlada de imágenes, asegurándose de que las fosas nasales del ratón está colocado correctamente en el colector de gas anestésico. La primera imagen que se debe tomar aproximadamente 5 minutos después de la inyección luciferina. Hasta 5 animales se pueden obtener imágenes de una sola vez en el instrumento del espectro IVIS. Si es menos de 5 animales se van a imágenes, es posible conectar el colector utilizado (s) para conservar el gas isoflurano.
- Siga tomando imágenes cada 3 minutos, creando una secuencia de hasta una hora para generar una curva de cinética de expresión luciferina.
- Haga clic en [Configuración de secuencia] botón en el panel de control.
- El editor de secuencia.
- En el panel de control, especifique la configuración de la primera imagen bioluminiscente en la secuencia.
- Le recomendamos empezar con Binning Medio.
- También se recomienda la exposición automática para determinar el tiempo de exposición óptimo.
- Seleccione el botón [Delay] en el editor de secuencia de unaª especificar un tiempo de retardo de 3 minutos entre cada adquisición.
- Haga clic en [Agregar] en el editor de secuencias. Los parámetros de adquisición se añade a la mesa.
- Repita el paso 4 para cada imagen de la secuencia.
- Una vez que la curva se ha establecido, la imagen en tiempo óptimo se puede determinar mediante el trazado de la fuerza de la señal (intensidad) en función del tiempo. Los animales de la imagen en el momento de mayor número de fotones en vivo para obtener la señal más fuerte y más precisa.
- Los primeros experimentos utilizados por vía intraperitoneal (ip) de la luciferina, sin embargo, las inyecciones ip de vez en cuando como resultado de los resultados intermitente muestra poco o nada de bioluminiscencia en el tumor. La hipótesis de que la falta ocasional de azar de la señal se debió a la entrega de la luciferina de los intestinos u otros órganos internos. Por lo tanto, comenzó a utilizar la vía subcutánea (sc) luciferina inyecciones y vio a una mayor reproducibilidad de imágenes [Figura 3].
- Veinteminutos después de la inyección sc, los animales son anestesiados colocándolos en una cámara con 2% de gas isoflurano en O 2 hasta que no responden.
- El animal anestesiado (s) se trasladó a la cámara de imágenes. Ungüento oftálmico se debe utilizar para el estudio de la cinética debido a la longitud de la imagen. No es necesario para los procedimientos de diagnóstico por imágenes, ya que son de corta duración.
- La imagen se adquiere a hurgar en la basura medio con un tiempo de exposición de 5 minutos. La opción de adquisición de automóviles también se puede utilizar.
- Si la señal está saturada y / o se desmaya en medio de hurgar en la basura, el tiempo de hurgar en la basura o la exposición se puede ajustar.
- Los archivos de programa y los comentarios posteriores de la imagen se guardan en el directorio de la computadora del usuario.
5. Imágenes 3D 3
- Haga clic en la ficha [Imagen Asistente] en [Ajustes de secuencia] ventana del panel de control.
- Seleccione el botón [bioluminiscencia] el modo de imagen en la pantalla de imagen Asistente de inicio y click [Siguiente].
- En el "bioluminiscencia - DLIT" ventana del asistente de imagen, seleccione la opción [Firefly] sonda reportero. La emisión / excitación del espectro de la fuente seleccionada aparecerá luciérnaga con las seis selecciones de filtro correspondiente a adquirir.
- La última pantalla que mostrará las opciones por defecto que incluyen los parámetros de adquisición automático de exposición y de campo de la configuración de vista predeterminada C. funcionan muy bien, sin embargo, estos ajustes se pueden modificar si es necesario.
- Haga clic en [Siguiente] y la ventana del editor de secuencias se rellenará con la secuencia de las seis regiones espectrales en 20 nm filtros de ancho (560 nm, 580 nm, 600 nm, 620 nm, 640 nm y 660 nm). Pulse [Adquirir secuencia]. El primer filtro (560 nm) se incluyen un patrón de luz estructurada mediante un galvanómetro láser para establecer la topografía de la superficie.
- Seleccione el botón [topografía de la superficie] en la paleta de herramientas. Alisando la superficie se puede aplicar para dar cuenta de los ángulos agudos creado durante el proceso de reconstrucción. Lasuavizado por defecto baja es recomendable.
- Haga clic en [Crear] y el cuadro de análisis de tomografía aparecerá. Dibuja un cuadro de recorte que incluye todo el animal y luego haga clic en [Siguiente].
- La herramienta umbral aparece como una máscara de color púrpura sobre la región seleccionada. La máscara de forma automática se debe establecer para que coincida con la fotografía del animal. Si es necesario, ajustar el umbral de la máscara para ajustar más adecuadamente el contorno del animal.
- Haga clic en [Finalizar] y la malla reconstruido parecerá. La reconstrucción puede ser guardado en la pestaña de resultados.
- Tras la creación de topografía de la superficie del animal, proceder a la [DLIT Reconstrucción 3D] desplegable de la paleta de herramientas.
- En el marco del [Analizar] ficha seleccione las seis longitudes de onda para llevar a cabo la reconstrucción. Anular la selección de imágenes que produjo píxeles saturados o por abajo de 600. Dejar los ajustes en el [Parámetros] pestaña por defecto.
- Bajo la ficha [Propiedades], "Muscle" debe aparecer como la opción predeterminada paraPropiedades r tejido, y "Firefly" debe aparecer como el espectro de la fuente.
- Haga clic en [Reconstruir] en la ficha Analizar, y la reconstrucción 3D de la superficie del animal y la reconstrucción correspondiente de la fuente de la señal debe aparecer [Figura 4].
- Para determinar la ubicación y la intensidad de la señal, seleccione el botón Voxels en la ficha Herramientas en 3D de la paleta de herramientas.
- Dibujar un cuadrado alrededor de los voxels en pantalla y el total de las mediciones de flujo se muestra en la parte inferior de la pestaña de volumen.
- Haga clic en [Centro de masa] para identificar la ubicación de la señal de los voxels seleccionados. Cortes coronal, sagital y transaxial del animal aparecerá y el uso de la [Pantalla de medición del cursor] la distancia desde la superficie del animal al centro de voxel se puede medir.
- Por favor, consulte el manual de la imagen viva del usuario del software para obtener más información sobre el registro conjunto de atlas de órganos y otras características avanzadas.
6. Los datos de unanálisis 3
- Después de que la imagen se adquiere y se guarda, el acceso al archivo del programa haciendo clic en el botón [Examinar] y seleccione el archivo.
- La información de la imagen se puede encontrar en [Ver] → [Información de la imagen].
- La intensidad de la señal puede ser cuantificada mediante la selección de la región de interés (ROI) [ROI Herramientas] botón. Asegúrese de que se analiza la imagen en el modo [Photon] seleccionando "Photon" en la lista desplegable en la esquina superior izquierda del panel de control de imagen.
- Seleccione el botón [Medición de ROI] en el "Tipo" en la lista desplegable. Seleccione la forma ROI de interés, las opciones incluyen círculo, cuadrado, y, o de cuadrícula. Cubrir todas las áreas de la intensidad de la imagen adquirida.
- La posición de retorno de la inversión se ajusta arrastrando la selección de la forma de ROI para la región que contiene la señal bioluminiscente.
- La intensidad de la señal del retorno de la inversión se calcula haciendo clic en [la medida] botón. La etiqueta de retorno de la inversión muestra la intensidad. ROI se puede administrar y guardar using el software de imagen viva.
7. Los resultados representativos:
El éxito de la implantación de células se hace evidente cuando las células implantadas se pueden detectar utilizando el espectro IVIS en el día de la cirugía. Ambos GL261-luc y células GL261-luc2 son detectables, sin embargo, el gen luc2 proporcionará un mayor nivel de bioluminiscencia [Figura 5]. Las imágenes tomadas poco después de la implantación puede tener no específicos de señalización en las patas del animal y la nariz, que deben tenerse en cuenta como telón de fondo. Señal situada en el sitio de implantación es real y la señal se incrementará con el tiempo [Figura 6]. La disminución de la intensidad de la señal en el día 6 es reproducible y muy probablemente debido a la pérdida de tumor tomar por algunas de las células implantadas. Las mediciones cuantitativas de la carga tumoral son reproducibles en que debe aumentar constantemente hasta que el animal finalmente sucumbe a la enfermedad. Sin embargo, las curvas de crecimiento dependerá en gran medida el estado de las células implantadas, y var o menor inevitable ESPONSABILIDAD en el procedimiento de implantación. Nuestro laboratorio ha elegido a los animales implantados imagen cada tres días.

Figura 1. Después de que el ratón está bien anestesiado, se coloca en el marco estereotáctico. La cabeza del ratón se asegura utilizando la pinza la boca.

Figura 2. Después de la piel se abre los puntos anatómicos principales se identifican como son el bregma, las suturas coronal y sagital. El burrhole se 2.3mm a la derecha de la bregma lentamente torsión calibre 16 de 1 ½ pulgadas con una aguja pequeña cantidad de presión hasta que el cráneo es penetrado y el cerebro está expuesto.
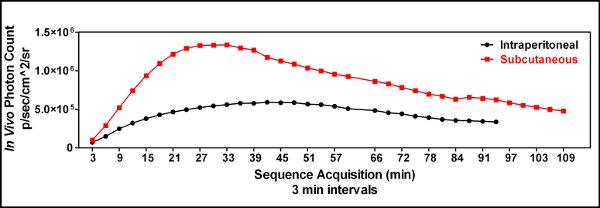
Figura 3. Una comparación cinética del subcutánea (iles/ftp_upload/3403/3403fig3_1.jpg "alt =" Figure3.1 "/>) versus intraperitoneal (  ) La inyección luciferina se realizó para demostrar la utilidad de una inyección subcutánea luciferina y para identificar el momento óptimo para la administración siguiente imagen luciferina. Tres minutos después de la luciferina se inyectó el ratón estaba sedado, colocado en el instrumento del espectro IVIS y la imagen cada 3 minutos hasta una hora y cada 6 minutos después de que para generar una curva de cinética de la bioluminiscencia. Esto demostró que una ruta subcutánea de administración luciferina era superior a la de una inyección intraperitoneal en nuestras manos, y que el momento óptimo para la imagen de los animales era de unos 25 minutos después de la inyección luciferina cuando GL261-luc células se utilizaron.
) La inyección luciferina se realizó para demostrar la utilidad de una inyección subcutánea luciferina y para identificar el momento óptimo para la administración siguiente imagen luciferina. Tres minutos después de la luciferina se inyectó el ratón estaba sedado, colocado en el instrumento del espectro IVIS y la imagen cada 3 minutos hasta una hora y cada 6 minutos después de que para generar una curva de cinética de la bioluminiscencia. Esto demostró que una ruta subcutánea de administración luciferina era superior a la de una inyección intraperitoneal en nuestras manos, y que el momento óptimo para la imagen de los animales era de unos 25 minutos después de la inyección luciferina cuando GL261-luc células se utilizaron.
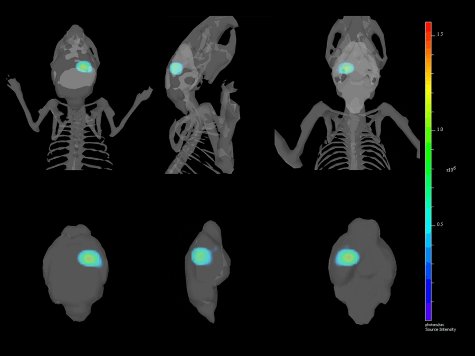
Figura 4. Múltiples puntos de vista de una reconstitución de 3 dimensionesbronca de la implantación intracraneal de GL261-luc2 células co-registradas con el esqueleto y el cerebro del ratón.
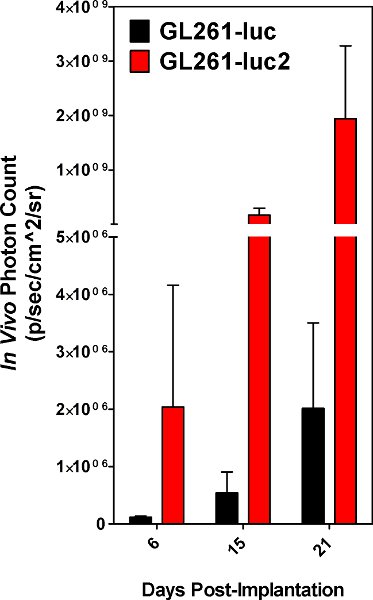
Figura 5. Recuento de fotones obtenidas de tumores derivados de células GL261-luc vs GL261-luc2 células. Los resultados son un promedio de 5 animales.
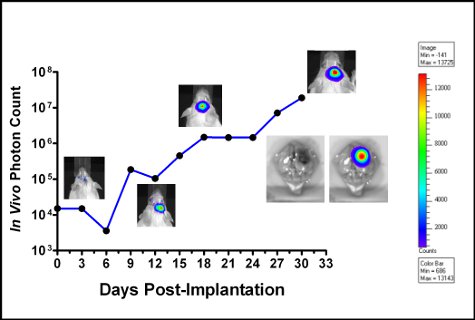
Figura 6. Gráfica de GL261-luc crecimiento de células tumorales en un C57BL albino / 6 del ratón. La bioluminiscencia se midió cada 3 días y se representa como in vivo recuento de fotones en vez de días después de la implantación. Las fotografías muestran la bioluminiscencia en diversos puntos temporales. La coloración es una indicación de la bioluminiscencia (intensidad de los píxeles), que es relativo al número de células tumorales (barra de color se muestra a la derecha). Después de que el animal sucumbió a la enfermedad del cerebro fue disecada y luciferina se añadió por vía tópica para obtener la imag ex vivoe muestra en la figura insertada.
Discusión
El inóculo de células se infunde a una profundidad de 2,6 mm de la superficie del cerebro después de la creación de una bolsa de 0,4 mm. Para asegurar la colocación adecuada y la profundidad de la aguja de una radiografía se puede tomar con un brazo-C o similar de rayos X de dispositivos de imagen intensificando, sin embargo, esto es opcional. Las complicaciones de la cirugía pueden surgir si el animal no está adecuadamente sedado, momento en el que el animal puede moverse durante la infusión de células. Esto puede causar fugas de la mezcla de células o sangrado de trayecto de la aguja. La fuga de las células causa el crecimiento ectópica de las células tumorales. También es importante no perforar el ventrículo que se puede hacer si el burrhole se hace por dentro de la de 2,3 mm se describe en el protocolo 4. La colocación correcta de la aguja y propagación de células se puso a prueba mediante la infusión de un ratón con dos l colorante azul de metileno y la disección de los tejidos cerebrales para verificar la ubicación del colorante infundido.
En este protocolo se ha utilizado el espectro IVIS de imágenes in vivo del sistema y tque estar de software de imagen (v 4.0), diseñado para su uso con este instrumento. (Caliper Life Sciences). Cualquier sistema de imagen comparable en vivo y herramientas de análisis de imagen se puede utilizar para obtener resultados similares. Estos sistemas ofrecen algunas ventajas sobre las tradicionales imágenes por resonancia magnética (MRI) para seguir el crecimiento de un tumor intracraneal experimental. El más obvio es el costo relativo de los dos instrumentos - máquinas de resonancia magnética de los animales son mucho más caros y suelen requerir los servicios de un técnico de MRI especializada. Imágenes in vivo, como lo que se describe aquí se puede hacer por el usuario final. Los datos de la bioluminiscencia es cuantitativo, mientras que la cuantificación de los datos de la RM es mucho tiempo y un poco inexacta. Además, imágenes de resonancia magnética muestran edema y la inflamación, además de las células tumorales y puede ser difícil separar el efecto del tratamiento de tumores. Por estas razones, la obtención de precisas mediciones volumétricas del crecimiento del tumor puede ser un desafío. Bioluminiscencia requiere ATP, Por lo tanto, sólo las células tumorales de vida contribuyen a los datos del tamaño del tumor. A pesar de esto, hay algunas ventajas de la RM, si una máquina está disponible. Las células no tienen que estar etiquetados con un marcador bioluminiscente a visualizar por resonancia magnética. La capacidad de visualizar el edema peri-tumoral puede ser una ventaja para algunos protocolos experimentales. Una de las ventajas de ambas tecnologías es que el uso de uno no excluye el uso de la otra, por lo que se pueden obtener datos sobre el crecimiento del tumor, así como la presencia de peri-tumoral edema y la inflamación del mismo animal, cuando ambas tecnologías están disponibles para el investigador.
Divulgaciones
Acceso libre a este artículo es patrocinado por Caliper Life Sciences.
Agradecimientos
Nos gustaría agradecer al Dr. Joshua B. Rubin por el generoso regalo de los plásmidos para el sistema de lentivirus, así como Rao Mahil por sugerencia útil en la preparación de las células GL261-luc.
Agradecemos a los estudiantes Apoyo a la investigación del tumor cerebral (SSBTR), la Fundación Neurológica Barrow y la Fundación Wallace por su generoso apoyo.
Los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por el Cuidado de Animales institucional y el empleo de Hospital St. Joseph y el Centro Médico.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo o el suministro | Empresa | Número de catálogo | Comentarios |
| GL261-luc2 Bioware ultra | Caliper Life Sciences | GL261-luc2 | |
| Dulbecco Eagle modificado (DMEM) | Invitrogen | 10313039 | |
| Geneticina (G418) | Gibco (Invitrogen) | 11811-023 | |
| Suero fetal bovino (FCS) | Invitrogen | 26140079 | |
| Fosfato (PBS) | Invitrogen | 70011044 | |
| C57BL/6-cBrd/cBrd/Cr Ratones | NCI-Frederick | ||
| AKWA lágrimas lubricantes oftálmicos pomada | Akorn Inc | 17478-062-35 | |
| Ketaset (clorhidrato de ketamina) | Wyeth | 11570775 | |
| Sedazine (clorhidrato de xilazina) | Wyeth | 10031894 | |
| Pequeños Animales de instrumentos estereotáxica | Kopf Instruments | 900 | |
| UltraMicroPump con SYS-Micro4 Controller | Mundial de Instrumentos de Precisión | UMP3-1 | Si no está disponible, es posible inyectar manualmente |
| 10μl jeringa con aguja de calibre 26 biselados | Mundial de Instrumentos de Precisión | SGE010RNS | |
| Adison Pinzas | Mundial de Instrumentos de Precisión | 500092 | |
| Penfield disector | Codman | 65-1015 | |
| 16 g 1 ½ precisión Glide aguja | Beckton Dickinson and Company (BD) | 305198 | |
| Manejar la hoja quirúrgica | BD | 371030 | |
| Tamaño de la hoja 15 | BD | 371315 | |
| Sutura Vicryl 4-0 | Ethicon | VCP496G | |
| La cera de hueso | Medline | DYNJBW25 | |
| Yodo povidona palillos de hisopo | Medline | MD93901 | |
| D-luciferina de sal de potasio | Caliper Life Sciences | 122796 | |
| Foráneo (isoflurano) | Baxter | 1001936060 | |
| OPMI Pentero Microscopio | Carl Zeiss, Inc. | Cualquier microscopio quirúrgico es suficiente | |
| Xenogen IVIS del espectro con el sistema opcional de la anestesia | Caliper Life Sciences |
Referencias
- Candolfi, M. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. J Neurooncol. 85, 133-148 (2007).
- Stafford, P., Abdelwahab, M. G., do, K. i. m., Preul, Y., Rho, M. C., M, J., Scheck, A. C. The ketogenic diet reverses gene expression patterns and redudes reactive oxygen species levels when used as an adjuvant therapy for glioma. Nutr Metab. 7, (2010).
- Caliper Life Sciences, Inc. . Living Image Software Version 4.0. VivoVision Systems. , (2010).
- Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Jouanneau, E., Poujol, D., Gulia, S., Le, M. I., Blay, J. Y., Belin, M. F. Dendritic cells are essential for priming but inefficient for boosting antitumour immune response in an orthotopic murine glioma model. Cancer Immunol Immunother. 55, 254-267 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados