Method Article
Culturas organotípicos rebanada de mesencéfalo ventral embrionario: Un sistema para estudiar el desarrollo neuronal dopaminérgica In vitro
En este artículo
Resumen
Un método para generar cortes organotípicos del cerebro medio E12.5 embrionarias murinas se describe. Las culturas rebanada organotípicos se puede utilizar para observar el comportamiento de las neuronas dopaminérgicas o neuronas del cerebro medio ventral.
Resumen
El ratón es un organismo modelo excelente para estudiar el desarrollo del cerebro de mamíferos debido a la abundancia de datos moleculares y genéticos. Sin embargo, el cerebro del ratón en desarrollo no es adecuado para una fácil manipulación y de imágenes en vivo desde el embrión de ratón es inaccesible y opaco. Cultivos organotípicos trozo de cerebro embrionario, por lo tanto ampliamente utilizado para estudiar el desarrollo del cerebro murino in vitro. Ex-vivo la manipulación o el uso de ratones transgénicos que permite la modificación de la expresión génica a fin de que las subpoblaciones de células neuronales o gliales pueden ser etiquetados con proteínas fluorescentes. El comportamiento de las células marcadas se puede observar mediante time-lapse de imágenes. Time-lapse de imágenes ha sido particularmente exitoso para el estudio de los comportamientos celulares que subyacen en el desarrollo de la corteza cerebral en las últimas etapas embrionarias 1-2. Embrionarias sistemas organotípicos cultura de división en regiones del cerebro fuera del cerebro anterior se estableci menoshed. Por lo tanto, la riqueza de los datos de time-lapse de imágenes que describen la migración de las células neuronales se limita al cerebro anterior 3,4. Todavía no se conoce, si los principios descubiertos por el cerebro dorsal son válidas para las áreas del cerebro ventral. En el cerebro ventral, las neuronas se organizan en grupos neuronales en lugar de capas y muchas veces tienen que someterse a complicadas trayectorias migratorias para alcanzar su posición final. El cerebro medio ventral no sólo es un buen modelo de sistema para el desarrollo cerebral ventral, pero también contiene poblaciones neuronales, tales como las neuronas dopaminérgicas que son relevantes en los procesos de enfermedad. Mientras que la función y la degeneración de las neuronas dopaminérgicas se ha investigado en gran detalle en el adulto y el envejecimiento del cerebro, se sabe poco sobre el comportamiento de estas neuronas durante su diferenciación y la fase de migración 5. Se describe aquí la generación de culturas de corte a partir del día embrionario (E) 12,5 mesencéfalo ventral del ratón. Estos culto rebanadadas son potencialmente adecuados para vigilar el desarrollo de neuronas dopaminérgicas en varios días in vitro. Se destacan los pasos críticos en la generación de cortes de cerebro en las primeras etapas del desarrollo embrionario y discutir las condiciones necesarias para mantener el desarrollo normal de las neuronas dopaminérgicas in vitro. También se presentan los resultados de los experimentos de imagen en tiempo transcurrido. En estos experimentos, los precursores del mesencéfalo ventral (incluidos los precursores dopaminérgicos) y sus descendientes fueron etiquetados en forma de mosaico con un Cre / loxP destino basado inducible sistema de mapeo 6.
Protocolo
Partes de este protocolo se modifican de Daza et al., 2007 7.
1. Preparativos
- Se puede preparar con un día de antelación
- Preparar 1X buffer Krebs (1,5 L): 126 mM NaCl, 2,5 mM de KCl, 1,2 mM NaH 2 PO 4: H 2 O, 1,2 mM MgCl 2, 2,5 mM CaCl 2, 11 mM de glucosa, 25 mM NaHCO 3; ajustar el pH a 7.4. Filtro de esterilización (0,22 micras de tamaño de poro) y almacenar a 4 ° C.
- Preparar el medio de cultivo (20 ml): 5 ml de HBSS, 9 ml de glucosa en DMEM alto, 850 l de glucosa al 30%, 5 ml de suero de caballo (25%). Añadir 200 l 100X penicilina / estreptomicina. Almacenar a 4 ° C.
- Preparar antes de comenzar la disección
- Preparar 100 ml de 4% de agarosa de baja fusión (LMP agarosa) en 1X buffer Krebs: la solución de microondas hasta que la agarosa se disuelva por completo y luego coloque la agarosa en un baño de agua a 45 ° C.
- Llene la vibraciónTomé la bandeja de búfer con helado de buffer 1X Krebs y de apertura del elemento de refrigeración (mantener a 4 ° C). Fijar una hoja de afeitar en el portador de la cuchilla y la puesta en marcha de la zona vibratome con un bisturí, un pincel fino y con una cuchara perforada pequeño para recoger los trozos. Preparar placas de Petri estériles (35 x 10 mm) con 1x buffer Krebs para recoger los trozos. Mantener en hielo.
- Puesta en marcha del área de disección con placas de Petri estériles (100 x 15 mm) para la disección y pequeñas placas de Petri estériles (35 x 10 mm) para incrustar, tijeras pequeñas, dos pinzas finas (Dumont 5), una cuchara perforada mini, un vaso Pasteur fuego pipeta pulida con una ronda cerró la punta y 1 l de 1x tampón de Krebs en el hielo. Limpie todas las herramientas de disección con etanol al 70%.
- Añadir medio de cultivo a los pocillos de una placa de seis pocillos (1,5 ml / pocillo) y colocarlo en una incubadora a 37 ° C.
- Preparar una placa de seis pocillos con 1,5 ml / pocillo estéril 1X buffer Krebs y 15 l penicilina / estreptomicina (100X) y /. En condiciones estériles, lugar Millicell insertos de cultivo celular en los pocillos. Colocar la placa de seis pozos al lado de la vibratome para que las rodajas de cerebro pueden ser transferidos a las membranas de filtro inmediatamente después de la sección.
2. La disección y la incorporación de los cerebros de embriones
- Anestesiar a un ratón hembra embarazada con el isoflurano y el sacrificio del ratón por dislocación cervical (embriones debe estar en fase E12.5). Diseccionar el útero del ratón tirando hacia arriba del útero con una pinza. Use unas pinzas para separar el otro mesometrio fuera del útero. Coloque el útero en helado 1X tampón de Krebs. Use unas pinzas finas para separar la pared muscular del útero, la membrana de Reichert y el visceral saco vitelino del embrión. La toma de embriones del útero. Colocar los embriones disecados en un aparte con placa de Petri estéril 1X buffer Krebs.
- Diseccionar el cerebro bajo un microscopio estereoscópico. Para diseccionar el cerebro, el primero le cortó la cabeza del embrión. Fijar la cabezapor la perforación de unas pinzas finas a través de la cabeza (altura de los ojos). Utilice otro par de pinzas para retirar con cuidado la piel y el cráneo. Use unas pinzas para levantar cuidadosamente el cerebro a cabo y la transfiere en una placa de Petri estéril con buffer 1X Krebs. Es muy importante que la integridad de todo el cerebro se mantiene durante la disección, ya que los daños en el tejido cerebral va a crear problemas (por ejemplo, romper papeles) durante el corte en el vibratome.
- Lavar el cerebro de vez en bajo punto de fusión del 4% (LMP) de agarosa. Insertar 2-3 cerebro en un momento dulce en el 4% de agarosa LMP. Coloque los platos incrustación en el hielo lo más uniforme posible. Utilice una pipeta Pasteur con una punta redonda pulida al fuego para levantar el cerebro hasta la parte inferior de la agarosa se solidifica. El cerebro debe instalarse en una posición plana horizontal en la parte inferior del bloque de agarosa.
- Después de la agarosa ha solidificado completamente (después de aproximadamente 3 min), recorte la agarosa que rodea el cerebro y la cola del bloque de agarosa al escenario muestrade la vibratome. Al pegar los bloques, asegúrese de que la parte ventral del cerebro es paralelo a la plataforma, ya que el cerebro debe ser cortado en un plano de sección horizontal.
3. Vibratome corte
- Use una hoja de afeitar para cortar. Para obtener rebanadas intactas es muy importante para mantener la temperatura a 4 º C durante el corte.
- Sección 300 micras de espesor cortes horizontales a una frecuencia de 50 Hz, la amplitud de la hoja de 1,1 mm y una velocidad de 25 mm / seg.
- Utilice el pincel fino para empujar el corte en una cuchara perforada pequeño para recoger los cortes de cerebro y transferirlos en un plato con agua estéril buffer helada 1X Krebs. Elija el segmento que contiene tejido del cerebro medio ventral (ver Figura 1). En un cerebro de ratón E12.5 no es sólo una rebanada 300 m horizontal que contiene tejido del cerebro medio ventral incluyendo las neuronas dopaminérgicas.
4. Cortar la cultura
Pasos 4.2-4.5 debe llevarse a cabo en condiciones estériles.
- La transferencia de las rodajas de cerebro en una inserción de células Millicell membrana cultura en una placa de seis pocillos con 1x buffer Krebs (véase el punto 1.2.5). Para transferir la porción con la cuchara perforada pequeño (Herramientas Artes Ciencias) y un pincel fino. Hasta 3 rebanadas se pueden colocar en una membrana.
- Transferencia de la membrana con el sector a la placa de seis pocillos con medio de cultivo (véase el punto 1.2.5). La parte superior de la membrana no debe ser cubierto por medio. Los cortes de cerebro recibe soporte desde abajo y el aire desde arriba.
- Colocar la placa de seis pozos en una incubadora con 5% de CO 2 a 37 ° C. Es muy importante que las rodajas se colocan en la incubadora a las 2 horas después de la etapa inicial de la disección. A más tiempo de preparación prolongado puede resultar en la supervivencia de los pobres de las rebanadas.
- Rebanadas se pueden mantener in vitro hasta 3 días. 50% de cambio del medio de cultivo en el 2 º día.
5. Time-lapse de imágenes
- Vamos a recuperar las rebanadas en la incubadora por 4-5 horas antes de la hora de inicio de imágenes a intervalos.
- Para time-lapse, mantener los cortes en la inserción de membrana y la transferencia de la inserción en un 35 mm ibidi μ-plato (la parte inferior del plato se compone de un material con una alta calidad óptica).
- Añadir 1 ml de medio de cultivo, más 1,5 l de ácido ascórbico (200 mM) al plato. El ácido ascórbico protege contra las rodajas de fototoxicidad.
- Incubar las rebanadas en una cámara climática a 37 º C con CO2 al 5% durante el time-lapse.
6. Resultados representante
La Figura 1 ilustra la preparación de cultivos rebanada organotípicos de cerebro de ratón E12.5. La figura 2 muestra horizontal rodajas organotípicos (aguda y después de varios días en la cultura) obtiene a partir de E12.5 cerebro del ratón. Por comparación, las secciones del cerebro congelado en las etapas de desarrollo equivalentese muestran. Las neuronas dopaminérgicas del mesencéfalo se visualizan con la inmunohistoquímica para la tirosina hidroxilasa (TH). Mesencéfalo neuronas dopaminérgicas a los objetivos del proyecto en el cerebro anterior. Estas proyecciones comienzan a formarse en E12.5 y se extienden hacia el cerebro anterior durante los días posteriores. Consideramos que el desarrollo de las proyecciones del cerebro anterior como una buena indicación para el desarrollo normal de las neuronas dopaminérgicas en la cultura. En el mesencéfalo cortes horizontales a las neuronas dopaminérgicas se extienden proyecciones hacia su área adecuada objetivo del prosencéfalo. Después de 3 DIV (días in vitro) o cuando las zonas de intervención del cerebro anterior están dañados, las proyecciones aberrantes se extienden hacia el cerebro medio dorsal. Ejemplos de cortes coronales del cerebro medio E12.5 se muestran en la Figura 3. Las neuronas dopaminérgicas visualiza con inmunotinción para TH extender proyecciones aberrantes hacia el cerebro medio dorsal. La figura 4 muestra un análisis de la proliferación, las células necróticas y apoptosis en los cultivos de corte organotípicos. BrdU immunostaining para visualizar las células que proliferan demuestra que las células proliferan en condiciones de cultivo después de un DIV. Proliferación se reduce después de 4 DIV. Después de 3 DIV, muchas células en el cerebro medio ventral sufrir necrosis (tinción con yoduro de propidio) y apotosis (inmunotinción para exfoliados caspasa-3). Figura 5 muestra las rutas migratorias de YFP-etiquetados neuronas control en un experimento de time-lapse en un corte agudo .

Figura 1. Esquema que ilustra la preparación de cultivos rebanada organotípicos. 300 micras rodajas de cerebro horizontal son preparados por el corte de un cerebro con una vibratome E12.5. (A) Esquema sagital de un cerebro de ratón E12.5. Los niveles de las secciones se indican. El área que contiene las neuronas dopaminérgicas se representa en color rosa, las proyecciones se indican en azul. (B) Esquema de los tres sectores que se pueden obtener de dorsal a ventral y that contienen cerebro anterior (Fb) y el cerebro medio (Mb). Tenga en cuenta que sólo una porción contiene neuronas dopaminérgicas (b rebanada). El corte adecuado se pueden identificar sobre la base de la posición de los ventrículos y la continuidad de los tejidos del cerebro medio y el prosencéfalo (flechas, comparar la sección B de la sección A y C). El área que contiene las neuronas dopaminérgicas se indica en color rosa, el área que contiene precursores dopaminérgicos se muestra en las flechas verdes, azules indican las proyecciones de desarrollo. (C) El segmento que contiene las neuronas dopaminérgicas se cultiva en las inserciones de la membrana. Abreviaturas: mesencéfalo VMB, ventral, DMB, mesencéfalo dorsal; Hyp, el hipotálamo, Hb, rombencéfalo.

Figura 2. Las proyecciones de las neuronas dopaminérgicas del mesencéfalo en cultivos de corte organotípicos dependen de la integridad del cerebro anterior. Inmunohistoquímica para la tirosina hidroxilasa (TH) para marcar las neuronas dopaminérgicas. (A) corte aguda (0 DIV)que muestra la ubicación normal de las neuronas dopaminérgicas en el mesencéfalo ventral. La punta de flecha blanca indica el área que se muestra en un aumento mayor en el recuadro. Las proyecciones para el cerebro anterior aún no han desarrollado. Después de un DIV, las proyecciones en el cerebro anterior se empiezan a formar. Las proyecciones se extienden hacia el cerebro anterior de 2-3 DIV. Puntas de flechas blancas indican la ubicación de los cuerpos celulares se muestra en un aumento mayor en las inserciones (recuadro blanco). Las flechas amarillas destacan las proyecciones normales en rodajas intacta se muestra en un aumento mayor en las inserciones (cuadro amarillo). Proyecciones aberrantes se desarrollan en rodajas de cerebro anterior con daños. Las flechas rojas indican las proyecciones aberrantes hacia el cerebro medio dorsal se muestra en un aumento mayor en las inserciones (recuadro rojo). Los daños se indica con un asterisco rojo. Después de 3 DIV, la mayoría de los cortes (n = 5 / 7) tenía proyecciones aberrantes hacia el cerebro medio dorsal. (B) inmunotinción TH en secciones horizontales cerebro congelado en las distintas fases para mostrar el desarrollode las proyecciones dopaminérgicas en vivo. Puntas de flechas blancas indican la ubicación de los cuerpos celulares se muestra en un aumento mayor en las inserciones (recuadro blanco). Las flechas amarillas resaltar la posición de las proyecciones que figuran en un aumento mayor en las inserciones (cuadro amarillo). El nivel de las secciones de congelados fue elegido para corresponder con el nivel de las culturas rebanada organotípicos. Tenga en cuenta que una sola secciones congeladas (12 micras) no representa la rebanada completa organotípicos (300 micras). Por lo tanto, las proyecciones muestran en E13.5 E14.5 y se observaron en los artículos 120 micras más ventral de la sección que contiene los cuerpos celulares (asterisco amarillo).
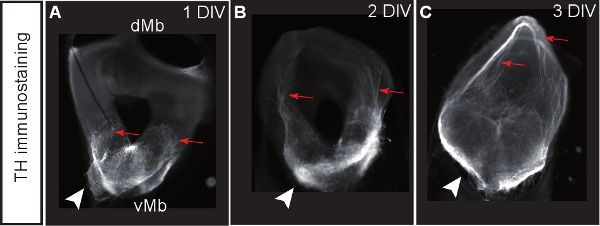
Figura 3. Mesencéfalo culturas coronal parte manchada de la tirosina hidroxilasa (TH) como marcador de las neuronas dopaminérgicas. (AC) Rebanadas después de DIV 1, 2 o 3. Las neuronas dopaminérgicas desarrollar proyecciones aberrantes hacia el cerebro medio dorsal (rflechas ed). Puntas de flecha indican la situación de los cuerpos celulares dopaminérgicos.

Figura 4. Proliferación celular y la viabilidad celular en cultivos de mesencéfalo rebanada organotípicos. (A) Las células en crecimiento fueron etiquetados por la adición de BrdU (50 ng / ml, Sigma) al medio de cultivo durante 18 h. Los cortes se immunostained posteriormente para BrdU. Después de un DIV, las células BrdU marcado se encuentran en las zonas del ventrículo izquierdo (flechas rojas). Después de 4 DIV, la proliferación de células son más dispersos y una zona ventricular distintas se mantiene por más tiempo. (B) Las células necróticas fueron etiquetados por la adición de yoduro de propidio (1μg/μL, Sigma) al medio de cultivo durante 2 horas y se visualizan por microscopía de fluorescencia. Después de un DIV, el mesencéfalo ventral (BV) no es necrótico, pero muchas células con yoduro de propidio etiqueta se puede ver en el mesencéfalo y el prosencéfalo dorsal. Después de 3 DIV disminuye la viabilidad celular en el midbra ventralin Barra de escala: 500 mm (c) Immunostaing para exfoliados caspasa-3 para visualizar las células apoptóticas. En 1 o 2 DIV, las neuronas dopaminérgicas sólo unos pocos (TH) son apoptóticas. Después de 3 DIV, las neuronas dopaminérgicas comenzar a someterse a la apoptosis. Paneles en el centro y la derecha son mayores aumentos de la zona de caja en los paneles de la izquierda. Las imágenes mayores aumentos son proyecciones de máxima intensidad de la z-pilas de 14-16 frames. Las imágenes fueron tomadas cada 0,5 m con una apótoma Zeiss set-up.

Figura 5. Ruta migratoria de YFP marcado con las neuronas en una parte aguda. (A) Corte horizontal utilizada para la imagen de lapso de tiempo de YFP-etiquetados neuronas. El corte se incubó durante 5 horas antes de la imagen. Las células fueron marcadas con una inducible Cre / loxP del sistema 6. Shh ratones CREER 8 y ROSA loxP-STOP-loxP-EYFP 9 ratones reportero quevolver a utilizar. La recombinación de los alelos periodista ROSA (y la expresión EYFP) se induce en las células que expresan CREER (Shh-que expresan las células), pero sólo después de la administración de tamoxifeno (Sigma). En este ejemplo, el tamoxifeno (3 mg/40 g de peso corporal) se administró a ratones gestantes a E8.5. Este montaje experimental los resultados sobre todo en el etiquetado de los precursores de las neuronas dopaminérgicas y sus descendientes en el mesencéfalo ventral 10,11. Barra de escala: 500 micras. (B) Seguimiento de la ruta migratoria de YFP marcado con las neuronas en una parte aguda. Time-lapse imágenes de YFP-etiquetados neuronas destino asignado se adquirieron cada 30 minutos durante un tiempo total de 5 horas y 30 minutos en un Zeiss Axio-observador microscopio (objetivo de la CE PlnN 10x / 0,3). Los cortes se incuban en una cámara ambiental (incubadora XLS1 Pecon) a 37 ° C y se suministra con 5% CO 2 durante el estudio. La posición inicial de las células está marcada con flechas rojas, las posiciones de migración están marcados con un asterisco rojo.
Discusión
El método slice cultura organotípicos presentada aquí, proporciona un sistema para el corto plazo en el desarrollo de análisis in vitro de neuronas dopaminérgicas y sus rutas migratorias y la proyección en el mesencéfalo ventral embrionario. Hemos encontrado que hay una serie de pasos críticos en el protocolo que debe ser cuidadosamente atendidos para obtener cortes que permiten el desarrollo normal de las neuronas dopaminérgicas del mesencéfalo ventral. El paso más crítico es la disección del cerebro embrionario, que tiene que ser rápido y preciso. En contraste con la generación de rodajas de cerebro de un adulto, es fundamental a la sección del cerebro en un vibratome equipado con un sistema de refrigeración y usar una baja frecuencia en combinación con una alta velocidad para obtener rebanadas intactas de E12.5 cerebro. Por último, se observó que las rebanadas tienen que ser seccionado en el plano horizontal de forma que, además del mesencéfalo ventral del cerebro anterior las áreas objetivo de las proyecciones dopaminérgicas están incluidos en la división.También hay que destacar que el cerebro anterior tiene que estar intacto en estos segmentos con el fin de lo normal para desarrollar proyecciones dopaminérgicas. En cortes coronales, las zonas de intervención del prosencéfalo de las neuronas dopaminérgicas están ausentes y las neuronas de forma aberrante las proyecciones hacia el cerebro medio dorsal.
Se demuestra que las rebanadas obtenidas tras el protocolo se puede mantener in vitro para un máximo de 3 días y que las neuronas dopaminérgicas mantener su posición normal y las proyecciones del cerebro anterior. Por otra parte, la capacidad proliferativa de los precursores de la zona ventricular se mantiene durante toda la división. Sin embargo, después de más de 3 días en la cultura, la viabilidad de los sectores disminuye drásticamente. En consecuencia, las culturas corte obtenidos a partir de E12.5 cerebros pueden ser utilizados para evaluar los primeros pasos en la migración neuronal y la diferenciación dopaminérgica, pero no pueden ser utilizados para experimentos a largo plazo. Para evaluar las etapas posteriores del desarrollo del cerebro medio, la generación de rodajas de un poco older embriones podría ser una alternativa.
Además, muestran que los cultivos de corte organotípicos se puede utilizar para time-lapse de los precursores del mesencéfalo ventral y sus descendientes, que fueron etiquetados en vivo utilizando un enfoque de destino mapeo genético. Dado que el método de etiquetado que aquí se presenta sólo marca los cuerpos celulares, hemos utilizado los cortes para seguir la migración neuronal. Sin embargo, las diferentes líneas periodista que también marca las proyecciones axonal puede ser útil para controlar la diseminación axonal de las neuronas del cerebro medio ventral in vitro 12.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Damos las gracias a Martine Emond y Brachmann Isabel por su ayuda en el establecimiento del sistema de corte y la cultura organotípicos Wolfgang Hübner y Liviu Gabriel Bodea para la lectura crítica del manuscrito. Nos gustaría dar las gracias a Frank Costantini para el R26 ratones reportero y Tabin Acantilado de los ratones CREER Shh. Este estudio fue financiado por un Premio de Investigación del Ministerio de Ciencia e Investigación del Norte-Westfalia (Programm zur Förderung der Rückkehr des wissenschaftlichen Spitzennachwuchses aus dem Ausland).
Materiales
Tabla de reactivos y equipos específicos
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| DMEM | Sigma-Aldrich | D6429 | |
| Glucosa al 30% | Sigma-Aldrich | G7528-250 | |
| Suero de caballo | Invitrogen | 26050-088 | |
| DMEM (4,5 g / L Glc., Con L-Glu, Na Pyr, NaHCO3) | Sigma-Aldrich | D6429-500 | |
| Penicilina / estreptomicina 100 veces | Sigma-Aldrich | P4333-20 | |
| Ácido L-ascórbico | Sigma-Aldrich | A4403 | preparar acciones de 200 mm y almacenar a -20 ° C |
| UltraPure agarosa LMP | Invitrogen | 15517-022 | |
| Millicel insertos | Millipore | PICMORG50 | |
| μ-plato de 35 mm, de baja | Ibidi | 80136 | |
| Vibratome | Microm | HM 650V | |
| Hoja de afeitar | Plano GmbH | 121-6 | |
| Histoacryl pegamento | BRAU9381104 | Braun Aesculap | |
| Dia cuchara perforada de diámetro 15 mm | Herramientas de Bellas Ciencia | 10370 -18 | |
| Pinzas de 5 Dumoxel | Herramientas de Bellas Ciencia | 11252-30 |
Los anticuerpos utilizados para immunostainings:
| Nombre del anticuerpo | Empresa | Número de catálogo | Comentarios (opcional) |
| De conejo anti-tirosina hidroxilasa | Millipore | AB152 | Dilución 1:500 |
| Mouse anti-tirosina hidroxilasa | Millipore | MAB318 | Dilución 1:500 |
| Ratón anti-BrdU | BD Pharmingen | 555627 | Dilución de 1:200 |
| De conejo anti-exfoliados caspasa 3 | Señalización Celular Tecnología | 9661 | Dilución de 1:200 |
| Burro anti-IgG de conejo-Alexa 488 | Invitrogen | A21206 | Dilución 1:500 |
| Burro anti-IgG de ratón-Cy3 | Jackson ImmunoResearch | 715-165-150 | Dilución de 1:200 |
Referencias
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados