Method Article
Mikrofabrikation von implantierbaren Optiken, die in ein mikrostrukturiertes Bildgebungsfenster integriert sind, für fortschrittliche In-vivo-Bildgebung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Herstellung eines implantierbaren integrierten Bildgebungsfensters mittels 3D-Laserdruck. Das Fenster besteht aus einem System von Mikrolinsen, die mit Mikrogerüsten gekoppelt sind. Das Verfahren beinhaltet die Zwei-Photonen-Polymerisation (2PP) des biokompatiblen Photolacks SZ2080 in einer kontinuierlichen Sequenz, um die Fertigungseffizienz und die Abstimmung zwischen den verschiedenen Komponenten zu optimieren.
Zusammenfassung
Im Zusammenhang mit Biomaterialien und Wirkstofftests in Tiermodellen stellt diese Studie ein schlankes Protokoll zur Herstellung eines neuartigen implantierbaren integrierten Bildgebungsfensters vor. Das Mikrogerät besteht aus einem ausgeklügelten System von Mikrolinsen, die mit Mikrogerüsten gekoppelt sind, die speziell für die In-vivo-Quantifizierung der Immunantwort mit Hilfe fortschrittlicher nichtlinearer Anregungsmikroskopie entwickelt wurden. Das Protokoll basiert auf der Zwei-Photonen-Polymerisation (2PP) des biokompatiblen Fotolacks SZ2080, die die Herstellung von Mikrogerüsten und Mikrolinsen in kontinuierlicher Abfolge ermöglicht, um die Fertigungseffizienz und -präzision zu verbessern. Um die Geschwindigkeit, Genauigkeit und strukturelle Integrität weiter zu verbessern, wurde ein hybrider Optikherstellungsansatz implementiert, bei dem das 2PP der Mikrolinsen-Außenhülle gefolgt von einer UV-Massenvernetzung des inneren Kerns verwendet wird. Diese innovative Technik optimiert die optischen Eigenschaften der Mikrolinsen und rationalisiert gleichzeitig den Produktionsprozess. Das resultierende Mikrobauelement weist eine hohe Reproduzierbarkeit und mechanische Stabilität auf, was es zu einer effektiven Methode für das Prototyping von optischen Systemen im Mikromaßstab für eine Reihe von biomedizinischen Anwendungen macht.
Einleitung
Die Intravitalmikroskopie ermöglicht die Untersuchung biologischer Prozesse in lebenden Tieren durch Echtzeit-Visualisierung. In Kombination mit fluoreszierenden nichtlinearen Bildgebungsansätzen kann sogar eine Auflösung auf der subzellulären Skalaerreicht werden 1. Infolgedessen ist es zu einem wichtigen Werkzeug in vielen Bereichen geworden, wie z. B. bei immunologischen Tests oder Krebsstudien, bei denen die Beobachtung der Zellen in ihrer realen physiologischen Umgebung wichtig ist.
Gängige Ansätze für intravitale Inspektionen, wie z. B. dorsale Hautfaltenkammern oder Schädel- und abdominale Bildgebungsfenster, sind hochinvasiv und stellen Schwierigkeiten für Langzeitinspektionen desselben Punktes dar. Daher sind neue in vivo Bildgebungsansätze, die das Leid der Tiere reduzieren und eine einfache Neupositionierung der optischen Sicht ermöglichen, dringend wünschenswert2.
In diesem Rahmen ist es möglich, ein neuartiges miniaturisiertes Bildgebungsfenster auf Basis eines Glassubstrats voranzutreiben, das eine Bildgebungsseite mit optischen Mikrolinsen und eine Gewebereferenzseite mit dreidimensionalen (3D) Mikrogerüsten enthält. Dieses miniaturisierte Bildgebungsfenster kann "subkute" in das Tier implantiert werden und fungiert als "internes" Mikroskopobjektiv. Das Funktionsprinzip des Geräts besteht darin, die Mikrolinsen in Verbindung mit einem externen Mikroskopobjektiv mit niedriger numerischer Apertur (NA) zu verwenden, um in vivo eine nichtlineare Abbildung der biologischen Prozesse durchzuführen, die in den Gerüsten stattfinden. Die Mikrolinsen kompensieren sphärische Aberrationen aufgrund der Bildgebung durch ein inhomogenes Medium wie Gewebe 3,4, während das Mikrogerüst die Geweberegeneration antreibt und als optische Leuchtfeuer 5,6,7 fungiert und somit die Langzeitinspektion desselben Punktes ermöglicht.
Die Grundkomponenten des Geräts, d. h. Mikrogerüste und Mikrolinsen, wurden bereits separat demonstriert, aber ihre Integration in ein und dasselbe Gerät stellt aufgrund ihres 3D-Charakters, ihrer Mikrometergröße und der Notwendigkeit, eine perfekte optische Ausrichtung zwischen ihnen zu haben, mehrere Herausforderungen dar. Die Mikrogerüste, bestehend aus rechteckigen quaderförmigen Gittern, mit repräsentativen Gesamtabmessungen ~ 500 μm x 500 μm x 100 μm und mit Porengrößen ~ 50 μm x 50 μm x 20 μm, können die Zellrekrutierung und neue Vaskularisation steuern und so die Gewebeintegration fördern. Darüber hinaus fungieren die Mikrogerüste aufgrund ihrer Autofluoreszenz als in situ Fluoreszenzbake und ermöglichen so eine schnelle Repositionierung und Ausrichtung unter dem Mikroskop und sogar eine Korrektur von sphärischen Aberrationen während der nichtlinearen Bildgebung, um hochauflösende longitudinale in-vivo-Beobachtungen zu ermöglichen5. Die Mikrolinsen mit hoher numerischer Apertur mit sphärischen oder quasi-parabolischen Profilen und Brennweiten von einigen hundert Mikrometern haben ihre Fähigkeiten für die lineare und nichtlineare Abbildung biologischer Proben unter Beweis gestellt, wenn sie mit einem konfokalen oder Zwei-Photonen-Mikroskop kombiniert werden 3,4.
Die Mikrolinsen und die Mikrogerüste werden durch 3D-Laserbeschriftung, auch Zwei-Photonen-Polymerisation (2PP) genannt, hergestellt. Bei 2PP wird ein infraroter Femtosekunden-Laserstrahl in einem UV-härtenden Fotolack stark fokussiert, und aufgrund der Multiphotonenabsorption am Fokusfleck wird ein begrenztes Voxel aus polymerisiertem Material mit einer Größe von unter einem Mikrometer (~100 nm) erzeugt. Durch Bewegen des Laserfokus in Bezug auf die Fotolackprobe können dreidimensionale Strukturen aus polymerisiertem Material erhalten werden, nachdem das nicht polymerisierte Material8 weggewaschen wurde. Das Verfahren hat eine intrinsisch hohe Auflösung und einen 3D-Charakter, der die Erfassung von 3D-Mikrostrukturen, wie Gerüsten und Linsen, mit guter Stabilität und hoher Oberflächenqualität ermöglicht 9,10,11. Es gibt verschiedene Techniken für die Herstellung von porösen Mikrogerüsten wie 3D-Druck, Nanoimprinting oder Elektrospinnen 12,13,14,15. Alle diese Techniken leiden unter einem Hauptnachteil; Sie sind nicht in der Lage, Auflösungen im Submikrometerbereich zu erreichen, wodurch Strukturen mit Porengrößen (~100 μm) entstehen, die größer als die Zellgröße sind, und ahmen die extrazelluläre Matrix nicht nach, die für eine gute Geweberegeneration unerlässlich ist. Die Herstellung von Mikrolinsen kann durch Verfahren angegangen werden, die auf der Replikation der Linse aus einer Form oder Maske basieren, wie Spritzgießen, Heißprägen oder UV-Formen, oder durch direkte Verfahren wie thermisches Reflow, Mikroplastikprägen oder Mikrotröpfchen-Jetting16,17. Alle von ihnen weisen Einschränkungen in der Oberflächenmorphologie auf, die erzielt werden können, und sind schwer in einen Herstellungsprozess zu integrieren, in dem auch die Mikrogerüste hergestellt werden müssen. Auf der anderen Seite hat 2PP seine Vielseitigkeit bei der Herstellung komplexer optischer Komponenten18,19 unter Beweis gestellt, wie z. B. sphärische oder parabolische Linsen, diffraktive Linsen oder sogar Kombinationen verschiedener Linsen in ein und derselben optischen Komponente 20,21,22,23,24. In diesem Rahmen scheint 2PP die beste Technik für die Herstellung eines Ganzen zu sein, das sowohl Linsen als auch Mikrogerüste enthält.
Obwohl 2PP eine einzigartige Wahl für die Realisierung dieser 3D-Strukturen mit Mikrometerauflösung ist, weist es zwei Haupteinschränkungen auf, d.h. es ist ein zeitaufwändiger Ansatz für relativ große Volumenstrukturen, und es stellt eine begrenzte Fertigungstiefe (entlang der optischen Achse) aufgrund des kurzen Arbeitsabstands von Mikroskopobjektiven dar, die für eine enge Fokussierung verwendet werden.
In diesem Artikel wird ein einzigartiges Protokoll für die Herstellung der Mikrogerüste und der Mikrolinsen auf den gegenüberliegenden Seiten eines Glassubstrats in einem Bestrahlungsprozess in einem Längsschritt vorgeschlagen, der eine gute Ausrichtung beider Elemente garantiert und die Grenzen der Fertigungstiefe überwindet. Das Protokoll ist auch für die Herstellungszeit optimiert. Einerseits spart die einstufige Bestrahlung Ausrichtungszeit, und die Verwendung eines hybriden Ansatzes, der 2PP der Linsenschale und UV-Härtung der inneren Fotolacke kombiniert, reduziert die Bestrahlungszeit für die großvolumigen Linsen25. Die Fähigkeit von 2PP, 3D-Freiformstrukturen herzustellen, ermöglicht die Verwendung dieses Protokolls für jedes Mikrolinsen- und Mikrogerüstdesign und stärkt damit die aktuelle Methode.
Protokoll
Die Einzelheiten zu den Reagenzien und der Ausrüstung, die in dieser Studie verwendet wurden, sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Probe
- Erstes Tropfengießen (Abbildung 1A)
- Reinigen Sie ein kreisförmiges Glasdeckglas mit einem Durchmesser von 12 mm (170 μm Dicke) auf beiden Seiten mit Aceton.
- Trocknen Sie beide Oberflächen mit Stickstoffgas bei Raumtemperatur.
- Tragen Sie mit einer Volumenpipette eine kontrollierte Menge von 46 μl flüssigem Fotolack auf eine Seite des Glasdeckglases auf.
HINWEIS: Bei dem in diesem Protokoll verwendeten lichtempfindlichen Material handelt es sich um einen biokompatiblen, hybriden organischen/anorganischen Fotolack mit der Bezeichnung SZ2080, der für biomedizinische Anwendungen bekannt und validiert ist26. Achten Sie darauf, dass ein äußerer Ring auf dem Glassubstrat frei bleibt. Da dieser glasige Raum frei von Fotolack ist, gewährleistet er die korrekte Aufbewahrung der Probe im Träger, um die Vorbereitung besser zu unterstützen. - Lassen Sie die Probe 48 Stunden lang unter der chemischen Haube, damit der erste Tropfen Fotolack durch Verdampfen des Lösungsmittels trocknen und den Sol-Gel-Zustand erreichen kann.
- Zweiter Fallguss (Abbildung 1A)
- Wenn der erste Tropfen Fotolack den Sol-Gel-Zustand erreicht hat (Schritt 1.1.4.), drehen Sie die Probe auf den Kopf und legen Sie die saubere Oberfläche frei.
- Legen Sie die Probe auf einen Stützhalter und heben Sie die erste tropfengegossene Oberfläche vom Boden ab.
- Ein zweiter Tropfen mit 46 μl flüssigem Fotolack wird auf die saubere Glasoberfläche aufgetragen, wobei der äußere Ringraum wie in Schritt 1.1.3 verlassen wird.
- Lassen Sie die Probe mindestens 48 Stunden lang unter der Chemikalienhaube und lassen Sie das Lösungsmittel verdampfen.
HINWEIS: Nach 4-6 Tagen ist die doppelt tropfengegossene Probe bereit für die Verwendung für 2PP (Abbildung 1B). Achten Sie von nun an darauf, die Probe aufgrund des lichtempfindlichen Materials keinem Umgebungslicht auszusetzen. Die Lichteinwirkung verschlechtert den Fotolack.
2. Zwei-Photonen-Polymerisation (2PP) der Mikrostrukturen
- Ausrichtung einrichten (Abbildung 2)
- Schalten Sie die Femtosekunden-Nahinfrarot-Laserquelle (1030 nm Wellenlänge, 1 MHz, mit minimaler Pulsdauer = 230 fs) ein.
HINWEIS: Stellen Sie Laserparameter wie die Pulsbreite und die Wiederholrate ein. - Richten Sie den Strahlengang des Laserstrahls durch eine Reihe von Optiken und Spiegeln aus, die auf kinematischen Spiegelhalterungen montiert sind, bis er das Mikroskopobjektiv erreicht. Drehen Sie die Spiegel iterativ, um den Strahl innerhalb der Lochblenden für die Nahinfrarotausrichtung (NIR) zu zentrieren.
HINWEIS: Der Arbeitsabstand des Mikroskopobjektivs sollte länger sein als die Gesamthöhe des herzustellenden Endprodukts (Linsenhöhe + Deckglasdicke + Höhe des Mikrogerüsts). NIR-Nadellöcher sind so konzipiert, dass sie die Ausrichtung von IR-Strahlen vereinfachen. Dies gewährleistet eine präzise Strahlausrichtung entlang des Strahlengangs, der Komponenten wie eine Halbwellenplatte, einen Strahlaufweiter und einen dichroitischen Spiegel durchläuft. Um die Laserleistung automatisch zu steuern, durchläuft der Strahl einen horizontalen Polarisator und eine Halbwellenplatte, und der zweite ist auf einem motorisierten Rotator montiert. Bei Bedarf kann der Balken durch einen Strahlaufweiter geführt werden, um den Strahldurchmesser zu vergrößern und den objektiven hinteren Eingang zu erfüllen. - Richten Sie den Laserstrahl senkrecht auf den Probenhalter, indem Sie ihn mit Hilfe der Rückreflexionszentrierung ausrichten.
- Montieren Sie das Mikroskopobjektiv mit großem Arbeitsabstand auf der speziellen Halterung am Ende des Strahlengangs in der Nähe der Probe (Abbildung 2).
HINWEIS: Eine CCD-Kamera ist über dem dichroitischen Spiegel angebracht, der auf die objektive optische Achse ausgerichtet ist, um den Fertigungsprozess zu überwachen. Es ermöglicht einem, den Laserfokuspunkt und die polymerisierten Strukturen zu sehen.
- Schalten Sie die Femtosekunden-Nahinfrarot-Laserquelle (1030 nm Wellenlänge, 1 MHz, mit minimaler Pulsdauer = 230 fs) ein.
- Montage von Mustern
- Befestigen Sie (mit Klebeband) das doppelt herabfallende Glasdeckglas auf dem Probenhalter, der an den Translationstischen angebracht ist. Montieren Sie die Probe mit dem zweiten abgegebenen Tropfen nach unten.
HINWEIS: Der Probenhalter hat ein zentrales Loch, in dem die Probe an der Bodenstufe5 aufgehängt werden kann. Der Halter ist mit einem kardanischen mechanischen System verbunden, das für die Probenbewegung mit einem X-, Y-Translationstisch verschraubt ist. - Zentrieren Sie die Probe manuell mit dem montierten Mikroskopobjektiv.
- Befestigen Sie (mit Klebeband) das doppelt herabfallende Glasdeckglas auf dem Probenhalter, der an den Translationstischen angebracht ist. Montieren Sie die Probe mit dem zweiten abgegebenen Tropfen nach unten.
- Zentrierung der Probe
- Stellen Sie die Laserleistung auf den minimalen Wert ein, der ausreicht, um die Strahlreflexion in der CCD-Kamerasoftware zu sehen (ca. 5 mW).
HINWEIS: Messen Sie die Laserleistung an der hinteren Pupille des Objektivs (die Transmission des in diesem Protokoll verwendeten Objektivs beträgt 70 % bei einer Wellenlänge von 1030 nm). - Schalten Sie die Bedienerschnittstellensoftware für den Motion-Controller und die CCD-Kamera ein.
- Fokussieren Sie den Laserstrahl auf die Oberseite des ersten Fotolacktropfens.
- Verfolgen Sie das gekrümmte Profil des Tropfens und suchen Sie die Probenkanten entlang der X- und Y-Richtung. Legen Sie den Mittelpunkt des Tropfens per Software als Referenz für den absoluten Nullpunkt fest.
HINWEIS: Das Klebeband, das zur Fixierung der Probe verwendet wird, spielt eine Rolle bei der Erkennung von Kanten, indem es den Brechungsindex und damit die Strahlreflexion verändert.
- Stellen Sie die Laserleistung auf den minimalen Wert ein, der ausreicht, um die Strahlreflexion in der CCD-Kamerasoftware zu sehen (ca. 5 mW).
- Kompensation der Probenneigung
- Fokussieren Sie den Laserstrahl in der Mitte der Probe auf die Grenzfläche zwischen der Oberseite des Glasdeckglases und der Basis des ersten Tropfen Fotolack. Legen Sie sie als Nullreferenz auf der Z-Achse fest.
- Unter Berücksichtigung des Durchmessers der Probe bewegen Sie sich in die Kantenposition (für das 12 mm Deckglas sind es ~ - 4 mm) in negativer Richtung der X-Achse. Fokussieren Sie in dieser Position die Grenzfläche (zwischen dem Glas und dem oberen Tropfen des Fotolacks) und stellen Sie sie als absolute Nullpunktreferenz entlang der vertikalen Richtung Z ein.
- Bewegen Sie sich in die Kantenposition in positiver Richtung der X-Achse (für das 12 mm Deckglas ist es ~ + 4 mm). Hier finden Sie die Oberfläche, die das Objektiv in vertikaler Richtung Z bewegt.
- Kippen Sie die Probe, um die Abweichung in Z-Richtung zwischen der negativen und der positiven Position entlang der X-Achse zu korrigieren. Verwenden Sie eine einstellbare kinematische Halterung zum Kippen des Probenhalters (wie bei einem Kardanring).
- Wiederholen Sie die Schritte 2.4.2-2.4.4 iterativ, bis die Probe auf der X-Achse vollständig ausbalanciert ist.
- Führen Sie das gleiche Verfahren aus, das in den Schritten 2.4.2 bis 2.4.5 in Y-Richtung beschrieben wurde.
- Sobald die Probe sowohl auf der X- als auch auf der Y-Planarachse perfekt ausbalanciert ist, kehren Sie in die zentrale Position zurück und fokussieren Sie die Grenzfläche zwischen dem Glas und dem Fotolack an diesem Punkt.
- Setzen Sie den neuen Z-Wert des Fokus als Referenz in der Z-Achse (Z = 0).
HINWEIS: Das Verfahren in Schritt 2.4 zielt darauf ab, die perfekte Rechtwinkligkeit zwischen dem Laserstrahl und der Deckglasoberfläche zu gewährleisten, um eine perfekte Verankerung der später herzustellenden 2PP-Strukturen zu gewährleisten. Ab 2.4 müssen alle Eingriffe in Übereinstimmung mit dem Brechungsindex durchgeführt werden. Fügen Sie daher bei Bedarf das Medium des Ziels für den Indexabgleich hinzu.
- Mikrogerüste 2PP auf dem unteren Fotolacktropfen
- Schalten Sie ein rotes LED-Beleuchtungssystem ein, um den Polymerisationsprozess in Echtzeit zu überwachen.
HINWEIS: Unter dem komplexen Probenhalter-Gimbal befindet sich eine Rotlichtdiodenbeleuchtung (Abbildung 2). Diese Beleuchtung ermöglicht es, das polymerisierte Volumen während des 2PP-Prozesses zu sehen. Der Fotolack ist empfindlich für kürzere Wellenlängen (sichtbares Licht); Daher wird das rote LED-Licht die Probe nicht stören. - Bewegen Sie bei ausgeschaltetem Laser das Objektiv in Z-Richtung unter dem Glasdeckglas, um die zweite Grenzfläche zwischen der Unterseite des Glases und der Basis des unteren Lacktropfens zu finden.
HINWEIS: Die zweite Schnittstelle befindet sich bei einem Z-Wert, der ungefähr der Deckglasdicke (170 μm) entspricht. - Erhöhen Sie die Laserleistung auf bis zu 100 mW, um eine Zwei-Photonen-Polymerisation im unteren Tropfen zu ermöglichen.
- Stimmen Sie die Fokusposition (steigendes Z) ab, um die zweite Grenzfläche zu finden, indem Sie eine einfache Referenzstruktur polymerisieren.
HINWEIS: Ein Beispiel für eine Referenzstruktur ist eine polymerisierte Leitung mit einer Länge von 50 μm. - Legen Sie die erste Fokusposition, an der die Polymerisation der Referenzstruktur stattfindet, als Nullreferenz entlang der vertikalen Richtung (Z-Achse) fest.
HINWEIS: Die Referenz in Schritt 2.5.5 unterstreicht die Basisebene für das 2PP der Mikrogerüste. - Stellen Sie die Polymerisationsleistungen (~ 100-200 mW) ein und führen Sie den Maschinencode als CNC-Programm (Computer Numerical Control) für die richtige Bewegung der Translationsstufen aus, um die gewünschte 3D-Struktur herzustellen (Abbildung 3A).
HINWEIS: Das CNC-Programm besteht aus einem Satz von räumlichen Koordinaten (x, y, z), die bestimmen, in welche Richtung sich die Translationsplattformen bewegen, um das endgültige 3D-Objekt zu erzeugen. Diese Polymerisationsleistungen werden durch die Höhe des oberen Tropfens und die spezifischen experimentellen Bedingungen (Fotolack, Laser und Bewegungssystem) beeinflusst.
- Schalten Sie ein rotes LED-Beleuchtungssystem ein, um den Polymerisationsprozess in Echtzeit zu überwachen.
- Mikrolinsen 2PP auf dem oberen Fotolacktropfen
- Wenn Sie sich entlang der Z-Achse bewegen, kehren Sie zur ersten Grenzfläche zwischen der oberen Glasoberfläche und dem oberen Tropfen Fotolack zurück (Schritt 2.4.8). Behalten Sie das gleiche planare Referenzsystem (X-, Y-Koordinate) bei, um eine perfekte Ausrichtung der Mikrolinsen 2PP mit den bereits hergestellten Mikrostrukturen zu gewährleisten.
- Finden Sie die Grenzfläche, indem Sie eine einfache Referenzstruktur polymerisieren.
HINWEIS: Verwenden Sie den gleichen Vorgang, der in Schritt 2.5.4 beschrieben wurde, jedoch nur in der Richtung der vertikalen Bewegung. - Legen Sie die erste Polymerisationslinie als Nullreferenz entlang der vertikalen Richtung (Z-Achse) fest.
HINWEIS: Die Referenz in Schritt 2.6.3 unterstreicht die Grundfläche für das 2PP der Mikrolinsen. - Stellen Sie die Fertigungsparameter für die 2PP der Kontur der gewünschten Mikrolinse ein (Abbildung 3B). Der Laserstrahl beschreibt eine kreisförmige Bahn, die im Radius abnimmt, um die äußere Oberfläche einer einzelnen Mikrolinse kontinuierlich zu polymerisieren. Legen Sie die Schraffur- und Slicing-Parameter entlang der X- bzw. Z-Richtung fest.
HINWEIS: Bei der Konstruktion der Objektive sollte die vom Benutzer gewünschte effektive Brennweite berücksichtigt werden. Als Faustregel gilt, dass es ein Wert sein sollte, der länger ist als die Deckglasdicke, und es sollte ermöglichen, den gesamten Atlas abzubilden. Eine vorläufige rechnerische Simulation des endgültigen optischen Systems wird empfohlen. - Stellen Sie die Polymerisationsleistung (~ 15-20 mW) ein und führen Sie das Programm aus, das die Bewegung der Translationsstufen leitet.
HINWEIS: Diese Polymerisationsleistung wird durch die Höhe des oberen Tropfens, die spezifischen Versuchsbedingungen und das Design der gewünschten Mikrolinse beeinflusst (Abbildung 3B). Abbildung 4 zeigt ein repräsentatives Beispiel für eine parabolische Mikrolinse mit der parametrischen Funktion, die das Mikrolinsenprofil und seine geometrischen Hauptmerkmale beschreibt.
3. Entwicklung von Mustern
- Entnehmen Sie die Probe aus dem Versuchsaufbau.
- Deaktivieren Sie bei ausgeschaltetem Laser die X-, Y- und Z-Translationsachse und entfernen Sie den Halter.
- Ziehen Sie das Klebeband ab und lösen Sie die Probe vom Halter.
HINWEIS: Achten Sie vor der Probenentwicklung darauf, dass die Probe aufgrund des lichtempfindlichen Materials keinem Umgebungslicht ausgesetzt wird. Die Lichteinwirkung würde die gesamte Menge an Fotolack vernetzen.
- Entwicklung von Stichproben (Abbildung 5A)
- Legen Sie die Probe in eine geeignete Stütze, um sie vom Boden abzuheben, und halten Sie sie in einer horizontalen Position.
HINWEIS: Bei diesem Probenhalter handelt es sich um ein kundenspezifisches SLA-gedrucktes Probenrack, das so konzipiert ist, dass beide 2PP-Prototypoberflächen der Entwicklungslösung5 ausgesetzt sind. - Bereiten Sie ein 50-ml-Becherglas vor und setzen Sie die Halterung mit der Probe hinein.
HINWEIS: Achten Sie darauf, dass die 2PP-Mikrolinsen auf der Oberseite bleiben, um strukturelle Verformungen während der Entwicklung aufgrund ihres nicht polymerisierten Innenkerns zu vermeiden. - Füllen Sie das Becherglas mit ~20 mL Entwicklungslösung, wobei die Probe vollständig bedeckt ist. Die Lösung besteht aus 50% (v/v) 2-Pentanon und 50% (v/v) Isopropylalkohollösung.
- Lassen Sie die Probe 45 Minuten lang in der Entwicklungslösung.
- Legen Sie die Probe in eine geeignete Stütze, um sie vom Boden abzuheben, und halten Sie sie in einer horizontalen Position.
- Waschen von Proben
- Heben Sie die Unterstützung von der Entwicklungslösung auf.
- Nehmen Sie die Probe durch manuelle Handhabung oder mit einer Pinzette und waschen Sie sie vorsichtig mit ein paar Tropfen Isopropylalkohol.
- Trocknen Sie beide bearbeiteten Oberflächen des Glasdeckglases mit einem sanften Stickstoffstrom (bei Raumtemperatur).
HINWEIS: Alle in den Schritten 3.2 bis 3.3 beschriebenen Verfahren werden unter einem chemischen Abzug durchgeführt.
4. Probe der UV-Bestrahlung
- Exposition der Mikrolinsen gegenüber UV-Strahlung (Wellenlänge 385 nm) (Abbildung 5B)
- Legen Sie das Glasdeckglas auf einen Probenhalter, der an der Grundplatte aufgehängt ist. Legen Sie die Probe mit den Mikrolinsen nach unten.
HINWEIS: Der Probenhalter verfügt über ein zentrales Loch, um die vom Bodentisch suspendierte Probe zu platzieren, wobei die Integrität der Mikrostruktur auf der Unterseite erhalten bleibt. - Bereiten Sie eine UV-Lampe mit einer Wellenlänge von 385 nm vor.
- Positionieren Sie die Probe unter der UV-Quelle senkrecht ausgerichtet zur Oberfläche des Glasdeckglases.
- Die Probe wird 120 s lang einer UV-Strahlung mit einer Geschwindigkeit von 300 mW ausgesetzt.
HINWEIS: Die UV-Strahlung erfolgt durch das Mikrogerüst und das Glassubstrat. Auf diese Weise wird der noch nicht polymerisierte Kern der Linsen UV-vernetzt, wodurch eine direkte und zusätzliche Exposition gegenüber der zuvor polymerisierten Oberfläche vermieden wird. - Die UV-Quelle bei -45° und +45° in Bezug auf die Normalposition der Probenebene betiteln, Schritt 4.1.4 wiederholen.
HINWEIS: Diese dreistufige UV-Belichtung in verschiedenen Winkeln ermöglicht die vollständige Vernetzung des gesamten nicht polymerisierten Resists innerhalb des Mikrolinsenvolumens, wodurch Stabilität erreicht wird. Dies ist besonders wichtig für breite Mikrolinsen. - Nehmen Sie die Probe aus dem Halter und bewahren Sie sie auf.
- Legen Sie das Glasdeckglas auf einen Probenhalter, der an der Grundplatte aufgehängt ist. Legen Sie die Probe mit den Mikrolinsen nach unten.
5. Morphologische Charakterisierung
- Aufnahmen mit der Rasterelektronenmikroskopie (REM) (Abbildung 6)
- Bereiten Sie die REM-Station vor. Befestigen Sie ein Stück Kohleband an der REM-Halterung, um die Probe zu haften.
- Legen Sie die Glasprobe in einem Winkel von 45° zur Ausrichtung der REM-Kamera auf die Halterung. Achten Sie darauf, die Probe an einer leeren Stelle auf dem Deckglas anzubringen, um die Integrität der Struktur zu erhalten (Abbildung 6B).
- Wiederholen Sie die Aufnahme wie in Schritt 5.1.2 für beide Oberflächen des Glasdeckglases, um 3D-REM-Bilder der Mikrogerüste und der Mikrolinsen zu sammeln (Abbildung 6A,C).
- Lösen Sie die Probe vorsichtig vom Kohleband und bewahren Sie sie in einer abgedeckten Box auf.
Ergebnisse
Es wurde ein Protokoll für die Herstellung eines doppelseitig implantierbaren mikrostrukturierten Geräts bereitgestellt, das ein optisches System und eine Referenz für die Gewebeanalyse enthält. Das Verfahren nutzt die Zwei-Photonen-Laserpolymerisation, um 3D-Mikrostrukturen und Mikrooptiken auf der gegenüberliegenden Seite desselben Substrats herzustellen. Die Verwendung eines Objektivs mit großem Arbeitsabstand ermöglicht die Herstellung beider Strukturen, ohne das Substrat umzudrehen, wodurch der Schritt der Neuausrichtung eingespart und eine perfekte Ausrichtung zwischen beiden Komponenten gewährleistet wird. Dieses Gerät ermöglicht eine fortschrittliche Bildgebung in situ , indem es dank Mikrooptiken und einem mikrofabrizierten Referenzrahmen die Korrektur optischer Aberrationen und wiederholte Beobachtungen desselben Bereichs ermöglicht. 1 zeigt das Verfahren zur Vorbereitung beider Oberflächen des Trägersubstrats für die anschließende Fertigung. Eine Skizze des Versuchsaufbaus, der zur Mikrofabrikation beider Oberflächen der Probe verwendet wurde, ist in Abbildung 2 dargestellt. Das Bild zeigt auch den komplexen Objektiv-Probenhalter, wobei sich der erste auf die Probe konzentriert, die von einem Rot-LED-Beleuchtungssystem beleuchtet wird, was eine Echtzeitüberwachung der Fertigung mit maschinellem Sehen ermöglicht. Abbildung 3 zeigt qualitativ die Flexibilität des Protokolls, die die Mikrofabrikation verschiedener Designs von Mikrogerüsten und Mikrolinsen ermöglicht. Abbildung 4 zeigt die SAG-Funktion, die zum Entwerfen von Mikrolinsen mit einem asphärischen parabolischen Profil verwendet wird, und eine Skizze eines repräsentativen Designs, das mit seinen Hauptmerkmalen korreliert. In Abbildung 5 sind die Schritte zur Probenentwicklung und UV-Belichtung dargestellt, die erforderlich sind, um das gesamte Volumen der Mikrolinsen vollständig zu vernetzen. Abbildung 6 schließlich zeigt Beispiele für Ergebnisse der Mikrofabrikation. Das vorgestellte Verfahren ermöglicht die Polymerisation von 3D-Mikrostrukturen beider Oberflächen desselben Geräts, wodurch eine hervorragende Auflösung und Stabilität gewährleistet wird. Schließlich ist Abbildung 7 eine Illustration, die den allgemeinen Arbeitsablauf des Protokolls darstellt und mit Abbildung 8 endet, die ein Beispiel für eine endgültige Anwendung des vorgeschlagenen Geräts zeigt, d. h. die In-vitro-Bildgebung von Zellen, die innerhalb des Mikrogerüsts gezüchtet wurden.

Abbildung 1: Protokoll für die Probenvorbereitung. Dieses Bild zeigt eine Skizze des zweistufigen Prozesses für das Tropfengießen von Fotolacken auf einem tragenden kreisförmigen Glasdeckglas (A). Auf der rechten Seite ist ein Bild der Probe mit dem getrockneten Fotolack zu sehen, der auf beiden Seiten abgeschieden ist (B). Die Probe wird durch den Probenhalter gestützt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Aufbau der Herstellung von Zwei-Photonen-Laserpolymerisation (2PP). Auf der rechten Seite ist ein repräsentatives Diagramm des Fertigungsaufbaus dargestellt. Die Hauptkomponenten des Aufbaus sind eine Femtosekunden-Laserquelle mit einer Wellenlänge von 1030 nm, einer minimalen Pulsbreite von 230 fs und einer Wiederholrate von 1 MHz, ein Tisch zur Leistungssteuerung, ein Strahlaufweiter, ein dichroitischer Spiegel und ein Mikroskopobjektiv mit hoher numerischer Apertur (100x, NA 1.1). Eine CCD-Kamera ist über dem dichroitischen Spiegel angebracht, der auf die objektive optische Achse ausgerichtet ist, um den Fertigungsprozess zu überwachen. Auf der linken Seite ist eine Vergrößerung zu sehen, wobei der Zoom des letzten Teils des optischen Aufbaus ein Foto des komplexen Objektiv-/Probenhalter-/LED-Beleuchtungssystems für die industrielle Bildverarbeitung zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Mehrere Designs von 3D-Mikrostrukturen und Mikrolinsen. Die Abbildung zeigt verschiedene Beispiele für (A) Mikrogerüste und (B) Mikrolinsen, die mit dem vorgeschlagenen Verfahren hergestellt werden können. Die hohe Flexibilität des Protokolls ermöglicht die Herstellung von Mikrostrukturen mit einer Vielzahl von geometrischen Merkmalen, Auflösungen, Abmessungen und Volumen, was seine Vielseitigkeit unter Beweis stellt. Die Graustufen in Panel (B) zielen darauf ab, die Abnahme der Laserleistung und der Schreibgeschwindigkeit hervorzuheben, um die Oberfläche zu glätten und die Oberflächenrauheit zu minimieren. Genaue Parameter für die Herstellung werden entsprechend dem spezifischen Design der Mikrolinse eingestellt. Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Beispiel für eine gefertigte Mikrolinse. Das Panel zeigt ein repräsentatives Beispiel für ein asphärisches parabolisches Profil, das die parametrische Beschreibung der gekrümmten Oberfläche der Linse als Durchhangfunktion z(r) (A) hervorhebt. Dabei ist Htot die Dicke der Linse, r die radiale Koordinate und fn die Brennweite einer parabolischen refraktiven Linse, die sich von ihrer effektiven Brennweite unterscheidet. Die Dioptrienstärke wird durch den Brechungsindex der Linse bestimmt und wie er sich von denen des umgebenden Mediums unterscheidet. Auf der rechten Seite zeigt die Konstruktionsskizze die beiden Hauptebenen, die am Eckpunkt V1 und einige μm über der Oberfläche 2 liegen (Π1 und Π2, gestrichelte Linien) (B). Die Skizze zeigt eine einzelne asphärische parabolische Mikrolinse mit einem Durchmesser von 600 μm, die auf einem N-BK7-Glassubstrat (mit einer Dicke von 170 μm) hergestellt wurde. (C) unterstreicht die geometrischen Parameter für die asphärische Parabollinse, die in SZ2080 Fotolack mikrofabriziert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Protokolle für die Probenentwicklung und UV-Exposition. Das Bild zeigt das in der Entwicklungslösung getränkte fabrizierte Muster als Skizze (A). Die Probe wird durch den Halter in die Lösung gehoben, was die korrekte Entwicklung beider Seiten der Probe ermöglicht und die doppelseitige mikrostrukturierte Vorrichtung erhält. Auf der rechten Seite ist ein Bild der Setup-Konfiguration für die UV-Bestrahlung der Probe zu sehen (B). Das Bild zeigt die UV-Lampe, die senkrecht zur Oberfläche der Probe positioniert ist. Wie im Datenblatt der UV-Lampe angegeben, stimmt der Stromabstand zwischen der Lampe und der Probe mit dem Betriebsabstand der Lampe überein. Die Probe, die der UV-Strahlung ausgesetzt ist und vom Probenhalter gehandhabt wird, ist im vergrößerten Bild rechts hervorgehoben. Maßstab: 12 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Rasterelektronenmikroskopische (REM) Aufnahmen repräsentativer Herstellungsergebnisse. Das Panel hebt eine doppelseitig hergestellte Vorrichtung durch eine Seitenansicht (B) und zwei repräsentative Ergebnisse von hergestellten Mikrolinsen (A) und Mikrogerüsten (C) durch REM-Bilder hervor. Die beiden Konstrukte, die auf unterschiedlichen Flächen desselben Glassubstrats liegen, sind im zentralen Bild (B) deutlich zu erkennen. Die Mikrolinsen sind auf der Unterseite des Glases dargestellt, während sich die Mikrogerüste auf der oberen befinden. Das REM-Bild einer gefertigten Mikrolinse mit sphärischem Design ist rechts als Beispiel für das stabile und glatte Ergebnis der Herstellung (A) zu sehen. Auf der linken Seite zeigt das Bild das repräsentative Ergebnis eines porösen 2PP-Mikrogerüsts mit beliebiger Geometrie (C). Maßstabsleisten: (A,C) - 50 μm; (B) - 1 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
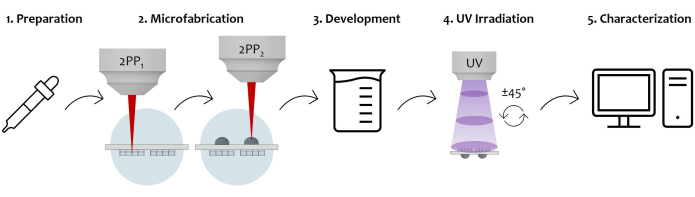
Abbildung 7: Schematische Darstellung des Protokoll-Workflows und der Geräteanwendung: Die Abbildung zeigt den gesamten Fertigungsprozess Schritt für Schritt. Es beginnt mit der Vorbereitung der Probe durch den sequentiellen Fotolack-Tropfenguss auf beiden Oberflächen des Glassubstrats (1). Sobald der Fotolack einen Sol-Gel-Zustand erreicht hat, ist die Probe bereit, durch Zwei-Photonen-Laserpolymerisation hergestellt zu werden (2). Daher werden beide Fotolacktropfen nacheinander bestrahlt, wobei zuerst die Mikrostrukturen und dann die Mikrolinsen mikrostrukturiert werden. Anschließend durchläuft das doppelseitig mikrofabrizierte Substrat ein Entwicklungsverfahren, um den gesamten nicht polymerisierten Resist, der die Konstrukte umgibt, zu entfernen (3). Dazu wird die Probe in einer alkoholischen Lösung eingeweicht und anschließend schonend getrocknet. Folgt der UV-Bestrahlung der Probe, indem es das glasartige Substrat durchdringt, um den nicht polymerisierten inneren Kern der Mikrolinsen vollständig zu vernetzen (4). Schließlich wird eine Qualitätskontrolle der mikrofabrizierten Probe durch Aufnahmen mit der Rasterelektronenmikroskopie (REM) durchgeführt, um die Mikrostrukturen morphologisch zu charakterisieren (5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Mögliche Anwendung des mikrostrukturierten Bildgebungsfensters. Auf der linken Seite zeigt eine repräsentative Skizze das optische System, das aus dem Gerät besteht, das mit einem externen Mikroskopobjektiv in einem Standard-Scansystem (A) gekoppelt ist. Dabei handelt es sich um die sogenannte virtuelle Konfiguration, die in diesem Fall für die Abbildung des Wachstums lebender Zellen im Inneren des Mikrogerüsts verwendet wird. Fluoreszenz-Fibroblasten (Red Fluorescence Protein (RFP) markiert) wurden auf die Glasoberfläche des Geräts ausgesät, die die 3D-Mikrostrukturen trägt. Konfokale Fluoreszenzbilder von Zellen wurden in der Brennebene des Glasdeckglases (B, grüner Hashtag), also mit dem einzigen Einsatz des externen Objektivs, und durch eine einzige Mikrolinse in seiner Brennebene (A, violetter Hashtag) aufgenommen. Die Zellkerne sind in Blau (Hoechst-Färbung) und das Zytoskelett in Rot (RFP) sichtbar. Maßstabsleisten: (B) - 100 μm; (C) - 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Um eine genaue Abbildung des gewünschten Bereichs 3,6 in dem mikrostrukturierten Fenster zu gewährleisten, ist eine genaue Ausrichtung der beiden Strukturen (Mikrogerüst und Mikrolinsen) zwingend erforderlich. Dies stellt die größte Herausforderung des vorgeschlagenen Protokolls dar, da die hohe Auflösung von 2PP eng mit einer Begrenzung der Fertigungstiefe 3,6 zusammenhängt. Das Wenden der Probe während der Herstellung, um beide Oberflächen nacheinander dem Laserstrahl auszusetzen, kann eine Option sein, erschwert jedoch die Neuausrichtung und ist zeitaufwändig5. Dies würde auch zu Schwierigkeiten bei der Suche nach demselben Referenzsystem führen und somit die gute Ausrichtung zwischen mikrooptischen Komponenten und Mikrogerüsten beeinträchtigen. Durch die kontinuierliche Durchführung des gesamten Prozesses ohne Demontage der Probe wird ein konsistentes Referenzsystem aufrechterhalten, wodurch eine genaue Ausrichtung der Strukturen erleichtert und garantiert wird. Zu diesem Zweck verwenden wir ein Objektiv mit großem Arbeitsabstand (2,5 mm), das dank seiner hohen numerischen Apertur eine gute Auflösung beibehält (Schritt 1.1). Dieser Ansatz verkürzt auch die Herstellungszeit erheblich, da er die Ausrichtung der Probe nach dem Wenden spart3. Darüber hinaus stellt die Handhabung der Proben aufgrund ihrer geringen Größe und Zerbrechlichkeit eine weitere Herausforderung dar, was die Manipulation und präzise Ausrichtung noch wichtiger macht.
Bei 2PP-Prozessen ist eine umfassende Untersuchung des Herstellungsprozesses unerlässlich, um Schlüsselparameter wie die optimale Laserwellenlänge, die Pulsbreite sowie die Laserleistungen und Tischbewegungen 9,10,11 zu ermitteln. Daher wurde eine umfassende Charakterisierung des 2PP-Prozesses unter Berücksichtigung verschiedener Konfigurationen des Versuchsaufbaus durchgeführt, um zunächst hochstabile, hochauflösende 3D-Strukturen mit Details im zellularen Maßstab für biologische Anwendungen zu gewährleisten 27,28,29,30. Darüber hinaus war die Minimierung der Oberflächenrauheit der implantierbaren Mikrolinsen entscheidend, um qualitativ hochwertige Mikrooptiken mit den gewünschten optischen Eigenschaften zu erhalten, wodurch die immunologische Reaktion auf das Implantat reduziert wurde 19,22,31. Daher besteht die Herausforderung des Prozesses darin, Parameter wie Leistung und Pulsbreite auf der Grundlage experimenteller Faktoren wie dem Brechungsindex und dem Volumen des lichtempfindlichen Materials, den Umgebungsbedingungen (z. B. Feuchtigkeit und Temperatur) und der Lasereffizienz einzustellen. Eine umfangreiche Charakterisierung war auch für die UV-Belichtungszeit und -intensität erforderlich, um das gesamte Volumen der Mikrolinsen vollständig zu vernetzen und ihre Stabilität zu gewährleisten. Diese Einstellungen müssen auf die UV-Quelle, den Arbeitsabstand und das spezifische Volumen des zu polymerisierenden Elements abgestimmt werden.
Eine wesentliche Einschränkung des 2PP-Verfahrens ist der geringe Durchsatz aufgrund der extrem hohen Auflösung, die es bietet. Angesichts dessen sind polymerisierte Merkmale sehr klein, von Hunderten von Nanometern bis zu einigen Mikrometern 9,26. Daher verlängern sich die Herstellungszeiten bei der Herstellung von Strukturen im Maßstab von Hunderten von Mikrometern, die nach 2PP-Standards relativ groß sind, erheblich, insbesondere bei sperrigen Strukturen. Infolgedessen kann die Erstellung integrierter Geräte mit mehreren Strukturen mit solch großen Abmessungen mehrere Stunden dauern. In diesem Rahmen konnte das für die Herstellung von Mikrolinsen vorgeschlagene hybride UV-2PP-Protokoll die Herstellungszeit einer einzelnen Mikrolinse im Vergleich zu den 2PP ihres gesamten Volumens um 98 % reduzieren. Dies ermöglichte eine höhere Präzision beim 2PP-Scannen der Außenhülle der Mikrolinse, wodurch die Oberflächenrauheit reduziert wurde, während die Mikrolinsenschale dick genug war, um die Stabilität der Linse zu gewährleisten, und das alles innerhalb einer tolerierbaren Herstellungszeit. Um den Prozess weiter zu beschleunigen, wird in Zukunft ein Parallelisierungsansatz vorgeschlagen, der das gleichzeitige Schreiben mehrerer Strukturen32 ermöglicht. Bei dieser Strategie wird der Laserstrahl in mehrere Strahlen aufgeteilt, um mehrere Brennpunkte zu schaffen, was eine parallele Fertigung ermöglicht und dadurch die Gesamtproduktionszeit erheblich verkürzt.
Im Gegensatz zu den gängigsten weichen lithographischen Techniken besteht einer der Hauptvorteile des 2PP darin, dass es sich um einen maskenlosen additiven Fertigungsansatz handelt, der die Herstellung beliebiger Strukturen innerhalb eines Volumens aus lichtempfindlichem Materialermöglicht 11. Diese Fähigkeit ermöglicht die Herstellung komplexer dreidimensionaler und poröser Strukturen mit hohem Anpassungspotenzial. Darüber hinaus ermöglicht das 2PP, basierend auf dem Prinzip der nichtlinearen Absorption, eine Auflösung unterhalb der Beugungsgrenze zu erreichen, was mit Standard-3D-Drucktechniken oder Fused Deposition Modeling (FDM) als Beispiel nicht erreichbar ist33. Dies ist besonders wertvoll für die Erstellung poröser 3D-Gerüste mit Merkmalen im Mobilfunkmaßstab, um das Zellwachstum, die Rekrutierung und die Gewebeintegration zu unterstützen.
Die Herstellung von mikrostrukturierten implantierbaren Geräten mit integrierter Optik nach dem hier vorgeschlagenen Verfahren hat das Potenzial, Anwendungen in der Mechanobiologie, in vitro und im Tissue Engineering erheblich zu beeinflussen (Abbildung 7 und Abbildung 8). Das vorgestellte Protokoll ermöglicht die Herstellung eines hochwertigen technischen Geräts mit Mikrostrukturen, die die Gewebeintegration unterstützen und gleichzeitig als Referenzpunkte für die Bildgebung in vivo dienen. Darüber hinaus verbesserten diese richtig konstruierten Mikrolinsen die fortschrittliche nichtlineare Bildgebung, indem sie sphärische Aberrationen korrigierten, die durch das das Implantat umgebende Gewebe verursacht wurden4. Die Vielseitigkeit des Prozesses ermöglicht es uns, das Design des Geräts anzupassen, z. B. Gerüste und Referenzstrukturen mit einer für bestimmte Anwendungen optimierten Geometrie zu erstellen, was sowohl bei 3D-Rekonstruktionen als auch bei der Korrektur von Bildfehlern in der Nachbearbeitung hilft. Schließlich verbessert die Anpassung des Mikrolinsendesigns auf der Grundlage von Gewebebrechungsindizes die anwendungsspezifische Bildgebung und schafft effektiv eine optische In-situ-Linse innerhalb des Geräts.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Diese Forschung wurde von der Europäischen Union im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 (GA-Nr. 964481-IN2SIGHT) gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
Referenzen
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926 (2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103 (2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107 (2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527 (2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20 (2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810 (2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204 (2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179 (2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621 (2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646 (2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577 (2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794 (2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten