Method Article
Bildgebung von Ca2+ -Signalen in kleinen Lungenvenen bei physiologischem intraluminalem Druck
In diesem Artikel
Zusammenfassung
In diesem Protokoll stellen wir eine neuartige Technik zur Aufzeichnung und Analyse von Ca2+ -Signalen in intrapulmonalen Venen (kleine Lungenvenen oder PVs) bei physiologischem intraluminalem Druck vor. Die Technik umfasst die Isolierung kleiner PVs, deren Inkubation mit einem Ca2+ -Indikator, ihre Kanülierung und Druckbeaufschlagung, die konfokale Bildgebung von Ca2+ -Signalen und die Datenanalyse.
Zusammenfassung
Lungenvenen (PVs) transportieren sauerstoffreiches Blut von der Lunge zurück zum linken Herzen und erfüllen somit eine wichtige Funktion bei der Zufuhr von sauerstoffreichem Blut zu lebenswichtigen Organen. Die meisten Studien zu Lungengefäßen haben sich jedoch auf Lungenarterien und Kapillaren unter normalen und Krankheitsbedingungen konzentriert. Ca2+ -Signale sind wichtige Regulatoren der Gefäßfunktion. Trotz der kritischen physiologischen Rolle von PVs wurden Ca2+ -Signale in kleinen intrapulmonalen PVs unter physiologischen Bedingungen nicht aufgezeichnet. Hier beschreiben wir eine Technik zur Aufzeichnung der Ca2+ -Signalaktivität in Maus-PVs, die isoliert, kanüliert und bei 5 mmHg unter Druck gesetzt sind. Durch die Integration eines Ca2+ -Indikators können wirCa2+ -Signale in der Myozytenschicht kleiner PVs mit Hilfe der konfokalen Hochgeschwindigkeitsbildgebung der Spinning-Disk unter physiologischen Bedingungen untersuchen. Unsere repräsentativen Daten deuten darauf hin, dass dieCa2+ -Signale in kleinen PV-Myozyten durch Öffnungen von Ryanodinrezeptor-Ionenkanälen vermittelt werden. Diese Methode wird für Forscher auf dem Gebiet der Lungengefäßphysiologie und -erkrankungen von großem Interesse sein.
Einleitung
Das Lungengefäßsystem spielt eine wichtige Rolle beim Austausch von Gasen, der Zufuhr von Sauerstoff und der Entfernung von Kohlendioxid aus dem Blut 1,2. Lungenarterien (PAs) erhalten sauerstoffarmes Blut aus dem rechten Herzen. Der Gasaustausch findet auf der Ebene der Kapillaren (Alveolarkapillaren) statt, und sauerstoffreiches Blut wird über die Lungenvenen (PVs) an das linke Herz abgegeben. Im Gegensatz zu anderen Venen, die sauerstoffarmes Blut transportieren, erfüllen PVs eine wichtige Funktion, sauerstoffreiches Blut zum linken Herzen und damit zu lebenswichtigen Organen im Körper zu transportieren. Die Signalmechanismen, die die PV-Funktion unter normalen und Krankheitsbedingungen regulieren, sind jedoch nur unzureichend verstanden.
Studien zu Lungengefäßen haben sich hauptsächlich auf PAs und Lungenkapillaren konzentriert. Neuere Studien zeigen, dass Ca2+-Signale in endothelialen und glatten Muskelzellschichten entscheidend für die Regulierung der Funktion von PAssind 3,4,5. Darüber hinaus sind abnormale Ca2+-Signalmechanismen für die beeinträchtigte Funktion von PAs und Lungenkapillaren bei Krankheitszuständenverantwortlich 6,7,8,9,10. Studien zu intrapulmonalen Venen (small PVs) sind jedoch nach wie vor rar. Ektopische Aktivität in großen PVs, die an das linke Herz angrenzen (kardiale PVs), wurde als Quelle für Vorhofflimmern beim Menschen vorgeschlagen11,12, und spontane Pulsation13 und Ca2+-Signale 12,14,15 wurden auch in großen PVs gezeigt. Kleine PVs liefern sauerstoffreiches Blut an große PVs. DieCa2+-Signalmechanismen in kleinen PVs wurden jedoch nicht unter physiologischem intraluminalem Druck untersucht.
In diesem Manuskript stellen wir eine neue Methode zur Isolierung, Kanülierung und Druckbeaufschlagung kleiner PVs und zur Abbildung von Ca2+-Signalen in PV-Myozyten mit Hilfe der konfokalen Hochgeschwindigkeits-Spinning-Disk-Mikroskopie vor. Das übergeordnete Ziel dieser Methode ist es, spontane und induzierte Ca2+-Signale in kleinen PV-Myozyten unter physiologischem intraluminalem Druck aufzuzeichnen. Der intraluminale Druck spielt eine entscheidende Rolle bei der Regulierung von Ca2+-Signalen in Myozyten16. Typischerweise werden PVs physiologischen intraluminalen Drücken im Bereich von 4 bis 10 mm Hg17,18 ausgesetzt. Änderungen des intraluminalen Drucks während des Herzzyklus können die Ca2+-Signale in PV-Myozyten beeinflussen. Daher ist es wichtig, eine Technik einzusetzen, die es uns ermöglicht, diese Signale unter physiologischen Bedingungen zu untersuchen und zu untersuchen, wie sich unterschiedliche intraluminale Drücke auf sie auswirken. Darüber hinaus konzentrierten sich die meisten früheren Forschungen zu PVs auf größere kardiale PVs. Die derzeitige Technik konzentriert sich auf kleine PVs, die sich tief in der Lunge befinden, was für das Verständnis der Regulation der Lungenfunktion sowohl bei Gesundheit als auch bei Krankheit relevanter sein könnte.
Protokoll
Alle Tierprotokolle wurden vom Animal Care and Use Committee der University of Virginia genehmigt (Protokolle 4100 und 4120). C57BL6/J Mäuse im Alter von 10-12 Wochen werden mit Pentobarbital (90 mg/kg; intraperitoneal) euthanasiert, gefolgt von einer zervikalen Dislokation zur Entnahme von Lungengewebe 3,4,19,20.
1. Isolierung kleiner PVs
- Reinigen Sie die Sezierwerkzeuge und das Geschirr mit 100 % Ethanol und waschen Sie sie anschließend mit entionisiertem Wasser.
- Verwenden Sie eine Schere, um die Brusthöhle zu öffnen. Verwenden Sie eine Pinzette, um das Herz und die Lunge vorsichtig und mit minimaler Berührung der Lunge aus der Brusthöhle zu entfernen.
- Legen Sie das Gewebe auf eine mit Sylgard beschichtete Platte, die kalte (4-10 °C) HEPES-gepufferte physiologische Salzlösung (HEPES-PSS, in mM, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 Hexahydrat, 2 CaCl2 Dihydrat und 7 Dextrose, pH-Wert eingestellt auf 7,4 unter Verwendung von 1 M NaOH)3,4,19. Verwenden Sie Präpariernadeln, um das Herz und die Lunge so zu fixieren, dass die großen PVs und PAs deutlich sichtbar sind und der linke Lungenlappen leicht gedehnt ist, wie in Abbildung 1 gezeigt.
- Unter Verwendung großer Lungenvenen (PVs) als Referenzpunkte entfernen Sie vorsichtig mit einer feinen Schere das Gewebe, das die kleinen intrapulmonalen Venen (kleine PVs mit einem Durchmesser von ca. 50-100 μm, dargestellt durch das gestrichelte Rechteck in Abbildung 1) umgibt. Achten Sie darauf, den direkten Kontakt mit den kleinen PVs zu vermeiden. Isolieren Sie die kleinen PVs vorsichtig vom umgebenden Gewebe.
- Isolieren Sie ca. 1-2 mm lange Segmente von kleinen PVs. Platzieren Sie kleine PVs in 4-10 °C HEPES-PSS.
2. Laden kleiner PVs mit einem Ca2+ Indikator
HINWEIS: Kleine PVs sollten vorsichtig behandelt werden, wobei darauf zu achten ist, dass die Pinzette nur die Spitzen der PVs berührt. Diese Methode ist eine Modifikation der zuvor beschriebenen Technik 3,7,20,21.
- Bereiten Sie eine Stammkonzentration von 2,5 mM Fluo-4 AM mit DMSO 3,4 vor. Bereiten Sie unter Verwendung der oben genannten Stammlösung 10 μM Fluo-4 AM und 0,04 % Pluronsäure mit HEPES-PSS vor.
- Kleine PVs werden in ein 1,5-ml-Röhrchen mit der Ladelösung (10 μM Fluo-4 AM und 0,04 % Pluronsäure in HEPES-PSS) gegeben3,4. Decken Sie das Röhrchen mit Alufolie ab und stellen Sie es zur Inkubation bei 37 °C für 1 h in ein Wasserbad.
- Nach der Inkubation die Ladelösung vorsichtig durch 4-10 °C HEPES-PSS ersetzen und 30 min als Waschschritt auf Eis halten.
3. Kanülierung von kleinen PV
HINWEIS: Diese Methode ist eine Modifikation der zuvor beschriebenen Technik 3,20,21.
- Bereiten Sie die Druckmyographiekammer mit zwei Glaskanülen vor, eine auf jeder Seite. Füllen Sie die Kanülen mit PSS (119 mM NaCl, 4,7 mM KCl, 1,2 mM KH2PO4, 1,2 mM MgCl2 160 Hexahydrat, 2,5 mM CaCl2 Dihydrat 3,4,21,22, 7 mM Dextrose und 24 mM NaHCO 3, gehalten auf pH 7,4 durch Blasen der Lösung mit 21 % O 2 und 5 % CO 2) mit einer 10 mL Spritze.
- Nehmen Sie ein kleines PV aus der Waschlösung und legen Sie es in die Druckmyographiekammer. Kanülieren Sie mit einer Pinzette mit feiner Spitze vorsichtig ein Ende des kleinen PV auf eine der Kanülen. Binden Sie dann mit einem Mikrofilament aus Nylonfaden einen Knoten um das kanülierte Ende des kleinen PV und die Spitze der Kanüle, um ihn zu sichern.
- Schieben Sie das PSS vorsichtig durch die Kanüle, um das Blut im PV zu entfernen. Binden Sie das andere Ende mit einem Nylonfaden mit einer Glaskanüle mit Mikrofilamenten ab, wie in Abbildung 1 gezeigt.
4. Druckbeaufschlagung und Ca2+ -Bildgebung von kleinen PV-Anlagen
HINWEIS: Diese Methode ist eine Modifikation der zuvor beschriebenen Technik 3,21.
- Verwenden Sie einen Servodruckregler, der an einem PSS-haltigen Schlauch befestigt ist, und beaufschlagen Sie den kleinen PV von einem Ende aus mit 5 mm Hg. Verwenden Sie eine Schlauchpumpe, die sowohl an einen Einlass als auch an einen Auslass angeschlossen ist, um den PSS zu übersichern. Die Temperatur des Superfusats wird auf 37 °C gehalten.
- Nach der Äquilibrierungsphase können Sie Ca2+ -Bilder für 1000 Bilder (Bildrate: 30 Bilder pro Sekunde) mit dem 40-fachen Wassertauchobjektiv (NA 0,8) und einem konfokalen Bildgebungssystem mit rotierender Scheibe aufnehmen. Stimulieren Sie Fluo-4 mit einem 488-nm-Festkörperlaser und erfassen Sie emittierte Fluoreszenz mit einem 525/36-nm-Bandpassfilter.
- Den Ryanodinrezeptor (RyR)-Antagonisten Ryanodin (5 μM)21,23 auf das Superfusat auftragen. Warten Sie 5 Minuten. Nehmen Sie dieCa-2+-Bilder wie oben beschrieben erneut auf und erfassen Sie weitere 1000 Bilder mit einer Geschwindigkeit von 30 Bildern/s.
5. Ca2+ Bildanalyse
HINWEIS: Diese Methode ist eine Modifikation der zuvor beschriebenen Technik 21,22,24. Veränderungen in der Aktivität von Ca2+-Signalen in PV-Myozyten können wichtige Einblicke in die Hemmung oder Verstärkung der Erregungs-Kontraktions-Kopplung in PVs liefern.
- Verwenden Sie eine speziell entwickelte Software (entwickelt von Dr. Adrian Bonev, https://github.com/vesselman/SparkAn), um Ca2+ -Bilder zu analysieren.
- Glätten Sie Bilder mit 5 x 5 Boxcar-Filtern und 5 x 5 Medianfiltern. Verwenden Sie einen Rahmen, der einen flachen PV-Bereich mit mehreren Zellen für die automatische Ereigniserkennung umreißt.
- Klicken Sie auf Ansicht und automatische Ereigniserkennung. Verwenden Sie die folgenden Einstellungen: Ereignisschwellenwert bei einer Amplitude von 1,3 F/F0, Toleranz von 20 %, Scanbox von 7 x 7 Pixeln und laufender Durchschnitt von 7 Bildern. Generieren Sie automatisch alle 10 Bilder durchschnittliche Bilder, beginnend mit dem ersten Bild.
- Klicken Sie auf Suche starten (das Augensymbol). Suchen Sie die Ereignistabelle, die als Markierungsdatei gespeichert ist, im Menü Datei. Um Ereignisse pro μm² zu berechnen, dividieren Sie die Anzahl der erkannten Ca2+ -Signale durch die Fläche des ausgewählten Frames.
Ergebnisse
Abbildung 2A zeigt ein Sichtfeld von einem kleinen PV bei 5 mm Hg intraluminalem Druck. Die +-Symbole zeigen die automatisch erkanntenCa-2+-Signale innerhalb eines ausgewählten Frames (Video 1) an, die durch den grünen Rand gekennzeichnet sind. Von jedem PV wurde ein Sichtfeld aufgezeichnet, und von jeder Maus wurde ein PV verwendet. Ein kleiner PV wurde als n=1 betrachtet. Die Anzahl der Ca2+-Signale pro μm2 pro Minute wurde vor und 5 min nach der Zugabe des RyR-Inhibitors Ryanodin (5 μM)23 in gepaarten Experimenten verglichen. Ein gepaarter t-Test wurde für statistische Vergleiche verwendet, um signifikante Unterschiede zu erkennen. Die Anzahl der spontan auftretenden Ca2+-Signale betrug unter den oben beschriebenen Bedingungen 0,73 ± 0,2 Ereignisse pro Minute proμm 2 (Abbildung 2B,C). Die Behandlung mit Ryanodin hemmte dieCa2+-Signale in kleinen PVs fast vollständig (Abbildung 2C, Video 2), was sich in einer drastischen Verringerung der Ereignisse pro Minute pro μm2 zeigt. Diese Daten zeigen, dass die spontane Aktivität von Ca2+-Signalen in der Myozytenschicht von unter Druck stehenden kleinen PVs Öffnungen von RyRs darstellt. Diese Ergebnisse liefern Hinweise darauf, dass die Aktivität von Ca2+-Signalen in kleinen PVs unter physiologischem intraluminalem Druck untersucht werden kann. Diese Methode wird zukünftige Studien über die Auswirkungen von intraluminalem Druck und neurohumoralen Mediatoren auf die Ca2+-Signalübertragung in kleinen PV-Myozyten erleichtern und möglicherweise wertvolle Einblicke in die Regulation der PV-Funktion bieten. Während sich die aktuelle Studie auf die Anzahl der RyRCa 2+-Signale konzentriert, ist es auch möglich, die kinetischen Eigenschaften dieser Signale zu analysieren, einschließlich Dauer, Amplitude, räumliche Ausbreitung und Anstiegszeit. Das Verständnis, wie physiologische und pathologische Reize die kinetischen Eigenschaften von RyRCa 2+-Signalen beeinflussen, kann wichtige Informationen über die Regulation der PV-Funktion sowohl im gesunden als auch im kranken Zustand liefern.
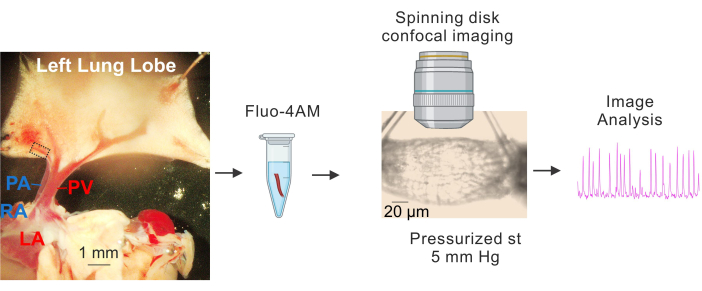
Abbildung 1: Vorbereitung und Ca2+ Bildgebung von PVs. Sequenzielle Bilder, die die Identifizierung und Isolierung kleiner PVs, die Inkubation von fluo4-AM, die Kanülierung und Druckbeaufschlagung (5 mm Hg), die konfokale Hochgeschwindigkeitsbildgebung der Spinning-Disk und die Bildanalyse zeigen. Das gestrichelte Rechteck in der Abbildung links stellt den PV dar, der für die Studie verwendet wurde. Abkürzungen: PA = Lungenarterie; RA = rechter Vorhof; PV = Lungenvene; LA = linkes Atrium. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
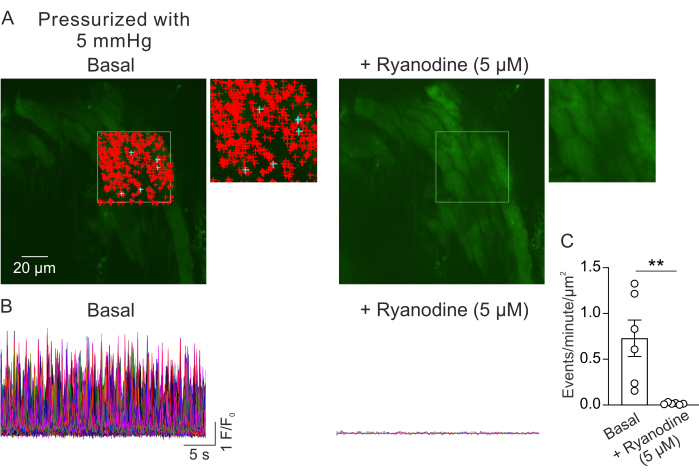
Abbildung 2: Analyse der Ca2+ -Bildgebung. (A) Bilder eines Sichtfeldes aus einem unter Druck stehenden (5 mm Hg), mit Fluo-4 beladenen, kleinen PV in Abwesenheit (links) oder Anwesenheit von Ryanodin (5 μM; RyR-Inhibitor, rechts). Das grüne Rechteck kennzeichnet den Bereich, der für die automatische Erkennung von Ca2+ -Signalen ausgewählt wurde. Die +-Zeichen stellen automatisch erkannte Ereignisse innerhalb des Frames dar. Rote Schilder kennzeichnen Signale mit einer Fläche von weniger als 3000 μm2, während blaue Schilder Signale anzeigen, die eine Fläche von mehr als 3000 μm2 einnehmen. Jedes +-Zeichen gibt ein Ca2+ -Ereignis oder -Signal an. (B) F/F0-Spuren von detektierten Ereignissen aus dem ausgewählten Bereich (siehe A), die die Aktivität vonCa2+ -Signalen in der Myozytenschicht von unter Druck stehenden kleinen PVs unter basalen Bedingungen (links) und in Gegenwart von Ryanodin (rechts) zeigen. (C) Quantifizierung von Ereignissen pro Minute pro μm2 von Ca2+ -Signalen in kleinen PVs vor und nach der Zugabe von Ryanodin (1 PV pro Maus; n=6 Mäuse; **p < 0,01 vs. Basal; gepaarter t-Test). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Ca2+ -Signale in einem kleinen PV-Gerät, das vor der Behandlung mit Ryanodin bei 5 mm Hg unter Druck gesetzt wurde. Das Sichtfeld stellt den ausgewählten Frame dar, der in Abbildung 2 in grüner Farbe dargestellt ist. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Ca2+ -Signale in einem kleinen PV, das nach der Behandlung mit Ryanodin (5 μM) bei 5 mm Hg unter Druck gesetzt wurde. Das Sichtfeld stellt den ausgewählten Frame dar, der in Abbildung 2 in grüner Farbe dargestellt ist. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Ca2+ -Signale in glatten Muskelzellen spielen eine entscheidende Rolle bei der Regulierung der Gefäßfunktion25. PVs sind ein wichtiges, aber relativ wenig untersuchtes Gefäßbett, das für die Zufuhr von sauerstoffreichem Blut zum linken Herzen verantwortlich ist26. DieCa2+- Signalmechanismen in kleinen PVs und ihr Einfluss auf die physiologische Funktion sind jedoch unbekannt. Das Ziel dieses Manuskripts ist es, eine neue Methode zur Isolierung, Kanülierung und Druckbeaufschlagung kleiner PVs zu beschreiben, um Ca2+ -Signale in der Myozytenschicht aufzuzeichnen und dieseCa2+ -Signale zu analysieren. Die Fähigkeit, Ca2+ -Signale in kleinen PVs zu visualisieren, könnte dazu beitragen, unser Verständnis dafür zu verbessern, wie diese Signale unter normalen und kranken Bedingungen funktionieren. Während die Untersuchung von Ca2+ -Signalen in PVs in der intakten Lunge physiologisch relevantere Daten liefern würde, sind kleine PVs in der intakten Lunge nicht deutlich sichtbar, was zu technischen Herausforderungen bei der Beladung vonCa2+ -Farbstoffen und der konfokalen Bildgebung führen kann. Die Isolierung und Druckbeaufschlagung kleiner PVs bietet eine alternative Möglichkeit, Ca2+ -Signale unter physiologischen intraluminalen Drücken, Temperaturen und ionischen Lösungen zu beobachten.
Die in diesem Manuskript beschriebene Ca2+-Bildgebung von PVs basiert auf unserem etablierten Verfahren zur Ca2+-Bildgebung in systemischen Arterien 21,22,27. Die Daten deuten darauf hin, dass die Mehrheit der Ca2+-Signale in kleinen PV-Myozyten auf Öffnungen von RyR-Ionenkanälen zurückzuführen ist. Daher wird das in diesem Manuskript skizzierte Protokoll zukünftige Studien zur RyR-Regulation und ihren Auswirkungen auf die PV-Funktion unter normalen Bedingungen und bei Krankheiten ermöglichen. Die RyR2-Aktivität ist essentiell für Kontraktionen in kardialen Myozyten28, während sie in arteriellen glatten Muskelzellen mit Entspannung in Verbindung gebracht wurde29. Der genaue Effekt der RyR-Aktivität auf die kleine PV-Kontraktion ist noch nicht bekannt. Die Druckmyographie ist eine häufig verwendete Technik zur Überwachung von Veränderungen in der Kontraktion kleiner Blutgefäße. Daher ist es wahrscheinlich, dass die PV-Druckvorbereitung auch zur Überwachung kleiner PV-Kontraktionen verwendet werden kann.
Ryanodin zeigt konzentrationsabhängige Effekte auf die RyR-Aktivität, indem es sie bei submikromolaren Konzentrationen erhöht und bei mikromolaren Konzentrationen verringert23. Ryanodin kann auch eine indirekte hemmende Wirkung auf andere Ca2+ -Signale in kleinen PVs haben, eine Möglichkeit, die noch nicht getestet wurde. Bei der verwendeten Konzentration beobachteten wir keinen kompensatorischen Anstieg der Ca2+ -Signale in PVs. Die Regulation von Ca2+- Signalen in isolierten und unter Druck stehenden PVs kann sich von der in PVs innerhalb einer intakten Lunge unterscheiden, eine Möglichkeit, die noch erforscht werden muss. Die Aufzeichnung von Ca2+- Signalen in kleinen PVs in der intakten Lunge einer anästhesierten Maus stellt jedoch erhebliche Herausforderungen dar, die sich aus der Lage der Lunge in der Brusthöhle und der Schwierigkeit ergeben, einen Ca2+- Indikator selektiv in PVs in einer anästhesierten Maus zu laden.
Es ist bekannt, dass die Scherspannung des Blutflusses die Funktion der Blutgefäße verändert. Obwohl die derzeitige Methode es ermöglicht, den Einfluss des intraluminalen Drucks auf Ca2+ -Signale in kleinen PVs zu isolieren, ist das Fehlen von Strömungs- oder Scherspannung eine potenzielle Einschränkung. Fließ- oder Schubspannungen können jedoch problemlos aufgenommen und in Kombination mit der Ca2+ -Bildgebung unter Verwendung der zuvor beschriebenen Setupsdurchgeführt werden 21. Es ist möglich, dass die Strömungs-/Scherspannung die Aktivität von Ca2+ -Signalen in kleinen PVs verändert, was ein interessantes Thema für zukünftige Untersuchungen wäre.
Wir haben Fluo-4-AM als Ca2+ -Indikator verwendet, um Ca2+ -Signale in kleinen PVs aufzuzeichnen. Je nach experimentellem Bedarf sollte es möglich sein, andere Ca2+ -Indikatoren zu verwenden, die bei 488 nm (Calbryte 520 AM)7 oder 560 nm (Calbryte 590 AM)30 angeregt werden können. Die Verwendung eines konfokalen Bildgebungssystems mit Spinning-Disk ermöglicht die Bildgebung von Ca2+ -Signalen, insbesondere in PV-Myozyten. Obwohl in der aktuellen Studie nicht untersucht, wird die Fokussierung auf die Endothelzellschicht die Aufzeichnung von endothelialen Ca2+ -Signalen in kleinen PVs ermöglichen. PAs und PVs sind funktionell unterschiedlich und unterschiedlichen Mikroumgebungen ausgesetzt. Daher kann ein Vergleich von Myozyten- und endothelialenCa2+ -Signalen zwischen kleinen PAs und kleinen PVs entscheidende Einblicke in ihre funktionellen Unterschiede liefern.
Es ist plausibel, dass Ca2+-Signale in kleinen PVs den Fluss von sauerstoffreichem Blut durch PVs regulieren. Der Druck im linken Vorhof ändert sich während jedes Herzzyklus von 4 mmHg auf 12 mmHg17,18. Da PVs den linken Vorhof mit Blut versorgen, ist es wahrscheinlich, dass sich auch der Druck in den PVs während des Herzzyklus ändert. Frühere Studien haben gezeigt, dass RyRs durch intraluminalen Druck in kleinen Arterien aktiviert werden können16. Daher könnte die Messung der Wirkung des intraluminalen Drucks auf PVCa 2+-Signale neue Einblicke in die Abgabe von sauerstoffreichem Blut aus PVs an das linke Herz liefern. Nervenstimulation und humorale Mediatoren im Blutkreislauf können ebenfalls Ca2+-Signale der glatten Muskulatur aktivieren. Die aktuelle Methode wird zukünftige Studien über den Einfluss von neurohumoralen Mediatoren auf die PVCa 2+ Signale und die PV-Funktion erleichtern.
Es gibt einige kritische Schritte innerhalb des Protokolls, die beachtet werden sollten. Eine sorgfältige Dissektion der Lungenvenen (PVs) ist äußerst wichtig. Es ist wichtig, den Bildgebungsbereich der PVs nicht mit Präparierwerkzeugen zu berühren, da sich dies negativ auf ihre Gesundheit auswirken kann. Es sollten nur die Enden der PVs berührt werden. Die Verkürzung der Präparierzeit kann die Erfolgsquote erhöhen. Eine unzureichende Farbstoffbeladung kann zu einem geringeren Signal-Rausch-Verhältnis führen und die Wahrscheinlichkeit von Fehlalarmen bei der automatischen Ereigniserkennung erhöhen. Das Befolgen des hier beschriebenen Protokolls sollte eine angemessene Farbstoffbeladung in PV-Myozyten sicherstellen.
Zusammenfassend haben wir eine Methode zur Aufzeichnung von Ca2+ -Signalen in kleinen PVs vorgestellt, die es ermöglicht, dieCa2+- Signalmechanismen in diesem wichtigen, aber oft übersehenen Gefäßbett zu untersuchen. Wichtig ist, dass die Fähigkeit, Ca2+ -Signale in kleinen PVs unter normalen Bedingungen aufzuzeichnen, ein wertvolles Verständnis der pathologischen Mechanismen für Erkrankungen der Lunge liefern könnte, einschließlich pulmonaler Hypertonie, Lungenverletzungen und Herzinsuffizienz-induziertem Lungenödem.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Forschung wurde durch Auszeichnungen der NHLBI (HL167208, HL157407 und HL146914) über SKS und NIDDK (DK138271) bis hin zum YLC finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Referenzen
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten