Method Article
Echtzeit-Detektion der dynamischen Affinität zwischen Biomolekülen mit Hilfe der Oberflächenplasmonenresonanz (SPR)-Technologie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die vorliegende Studie zielt darauf ab, das Prinzip und die Methodik der Oberflächenplasmonenresonanz (SPR)-Technologie aufzuklären, die vielseitige Anwendungen in mehreren Bereichen findet. Dieser Artikel beschreibt die SPR-Technologie, ihre einfache Bedienung und ihre bemerkenswerte Wirksamkeit, mit dem Ziel, ein breiteres Bewusstsein und eine breitere Akzeptanz dieser Technologie bei den Lesern zu fördern.
Zusammenfassung
Die Oberflächenplasmonenresonanz (SPR)-Technologie ist eine empfindliche, präzise Methode zum Nachweis von Viren, pathogenen molekularen Proteinen und Rezeptoren, zur Bestimmung von Blutgruppen und zum Nachweis von Lebensmittelverfälschungen, neben anderen biomolekularen Nachweisen. Diese Technologie ermöglicht die schnelle Identifizierung potenzieller Bindungen zwischen Biomolekülen und ermöglicht ein schnelles und benutzerfreundliches, nicht-invasives Screening verschiedener Indikatoren, ohne dass eine Markierung erforderlich ist. Darüber hinaus erleichtert die SPR-Technologie die Echtzeit-Detektion für das Hochdurchsatz-Wirkstoffscreening. In diesem Programm werden das Anwendungsgebiet und die Grundprinzipien der SPR-Technologie kurz vorgestellt. Der Betriebsprozess wird detailliert beschrieben, beginnend mit der Instrumentenkalibrierung und dem grundlegenden Systembetrieb, gefolgt von der Ligandenerfassung und der Mehrzyklusanalyse des Analyten. Die Echtzeitkurve und experimentelle Ergebnisse der Bindung von Quercetin und Calycosin an das KCNJ2-Protein wurden ausgearbeitet. Insgesamt bietet die SPR-Technologie eine hochspezifische, einfache, empfindliche und schnelle Methode für das Wirkstoffscreening, den Echtzeitnachweis der damit verbundenen Pharmakokinetik, den Virusnachweis sowie die Identifizierung von Umwelt- und Lebensmittelsicherheit.
Einleitung
Die Oberflächenplasmonenresonanz (SPR)-Technologie ist eine optische Detektionstechnik, die eine Markierung des Analyten überflüssig macht. Es ermöglicht die Echtzeit- und dynamische Überwachung der quantitativen Bindungsaffinität, Kinetik und Thermodynamik. Diese hohe Durchsatzkapazität ist hochempfindlich und reproduzierbar und ermöglicht die Messung verschiedener Öffnungsraten, Ausweichraten und Affinitäten. Darüber hinaus erhöht die geringe erforderliche Probenmenge den Nutzen dieses Verfahrensweiter 1,2. Die biomolekulare Detektionsmethode3 mit schneller Reaktion, die die Affinitätsbindung zwischen Biomolekülen überwacht, hat sich zu einem prominenten Forschungsgebiet entwickelt.
Die SPR-Technologie hat verschiedene Anwendungen im Bereich der Arzneimittelforschung und -entwicklung4. Eine seiner Anwendungen besteht darin, die strukturellen Grundlagen spezifischer Wirkstoffziele zu entdecken. Es kann auch eingesetzt werden, um die Wirkstoffe chinesischer Kräuter zu identifizieren, die signifikante pharmakologische Aktivitäten besitzen, und ihre Mechanismen für das Wirkstoffscreening und die Verifizierung zu untersuchen. Gassner et al. haben eine lineare Dosis-Wirkungs-Kurve für bispezifische Antikörper durch SPR-Bestimmung erstellt, die eine Konzentrationsanalyse und Qualitätskontrolle ermöglicht5. Darüber hinaus kann SPR für die Durchführung klinischer Immunogenitätstests in der Pharmakopöe und in der Impfstoffentwicklung verwendet werden6.
Ein Bereich, in dem es eingesetzt werden kann, ist der Nachweis von Pestizidrückständen, Tierarzneimittelrückständen, illegalen Zusatzstoffen, pathogenen Bakterien und Schwermetallen 7,8,9,10 in landwirtschaftlichen Produkten und Lebensmittelsicherheitstests. Durch den Einsatz der SPR-Technologie können die Genauigkeit und Effizienz dieser Tests verbessert werden.
Ein weiterer Bereich, in dem die SPR-Technologie eingesetzt werden kann, ist der schnelle Nachweis von Toxinen und Antibiotika. Diese Technologie ermöglicht die Bindung von viralen Antikörpern, niedermolekularen Verbindungen und Aptameren an den SPR-Biosensorchip. Der SPR-Biosensor-Chip erkennt dann unterschiedliche Konzentrationen viraler RNA als Analyt11. Diese Methode wurde erfolgreich beim schnellen Nachweis von Viren wie H5N1, dem H7N9-Vogelgrippevirus und dem neuartigen Coronavirus 12,13,14 eingesetzt. Zusätzlich zu diesen Anwendungen ist die SPR-Technologie auch in der Proteomik, beim Wirkstoffscreening, beim Echtzeitnachweis der damit verbundenen Pharmakokinetik und bei der Untersuchung von Viren und pathogenen Proteinen und Rezeptoren nützlich 15,16,17,18. Es eignet sich besonders für wissenschaftliche Forschung und Lehrexperimente an Universitäten und Forschungsinstituten und ist ein wertvolles Werkzeug in verschiedenen Wissenschafts- und Forschungsumgebungen.
Das Prinzip der SPR ist die kollektive Schwingungsbewegung freier Elektronen an der Grenzfläche zwischen einer Metallschicht und einem Dielektrikum, die durch einfallende Lichtwellenhervorgerufen wird 19. Es ist im Wesentlichen die Resonanz zwischen der evaneszenten Welle und der Plasmawelle auf der Metalloberfläche20. Beim Übergang von einem photodichten Medium zu einem photophoben Medium tritt unter bestimmten Bedingungen eine Totalreflexion auf. Aus der Perspektive der Wellenoptik erzeugt das einfallende Licht, wenn es die Grenzfläche erreicht, nicht sofort reflektiertes Licht. Stattdessen durchdringt es das optisch phobische Medium zunächst in einer Tiefe von etwa einer Wellenlänge. Anschließend fließt es etwa eine halbe Wellenlänge entlang der Grenzfläche, bevor es wieder in das optisch dichte Medium zurückkehrt. Diese Welle, die das optisch phobische Medium durchdringt, wird als Ausweichwelle bezeichnet, solange die Gesamtenergie des Lichts konstant bleibt. Da Metall freies Elektronengas enthält, kann es als Plasma angesehen werden. Das einfallende Licht regt die Längsschwingung des Elektronengases an, was zur Erzeugung einer Ladungsdichtewelle entlang der Metall-Dielektrikum-Grenzfläche führt, die als Oberflächenplasmawelle bezeichnet wird. Diese Resonanz breitet sich in beiden Medien in Form einer exponentiellen Dämpfung aus. Dadurch wird die Energie des reflektierten Lichts deutlich reduziert. Der entsprechende Einfallswinkel, bei dem das reflektierte Licht vollständig verschwindet, wird als Resonanzwinkel21 bezeichnet. SPR ist sehr empfindlich gegenüber dem Brechungsindex des Mediums, das an der Metallfilmoberfläche20 haftet. Der SPR-Winkel variiert mit dem Brechungsindex der Metallfilmoberfläche, wobei die Brechungsindexänderung hauptsächlich proportional zur Molekülmasse der Metallfilmoberfläche22 ist. Jede Änderung der Eigenschaften des Oberflächenmediums oder des Ausmaßes der Adhäsion führt zu unterschiedlichen Resonanzwinkeln. So kann die molekulare Wechselwirkung analysiert werden, indem die Änderungen des Resonanzwinkels untersucht werden.
Diese zerstörungsfreie, markierungsfreie optische SPR-Analyse, die auf den oben genannten Prinzipien basiert, eignet sich für die Forschung in verschiedenen Bereichen. Daher haben wir die Winkelverschiebung der SPR-Kurve und experimentelle Ergebnisse durch Mehrzyklusanalyse am Beispiel der Kombination von Quercetin und Calycosin mit dem rekombinanten KCNJ2-Protein demonstriert.
Protokoll
HINWEIS: Die vollständige experimentelle Erfassungskurve zeigt, dass der experimentelle Prozess in acht verschiedene Stufen eingeteilt werden kann.
1. Proben- und Puffervorbereitung
- Bereiten Sie die Sensorchips vor dem Experiment vor.
- Die Chips mit der Piranha-Lösung (30% H2O2: H2SO4=1:3; v/v) 2 min behandeln. Reinigen Sie den Chip anschließend gründlich mit einer großen Menge entionisiertem Wasser und weichen Sie ihn dann in wasserfreiem Ethanol ein, damit er auf natürliche Weise trocknen kann.
- Als nächstes weichen Sie den Chip über Nacht in einer Lösung von 11-Mercapto-l-Undecanol (MUOH) mit einer Konzentration von 50 M ein. Legen Sie den Chip anschließend in eine Epichlorhydrin-Lösung und lassen Sie ihn 4 h lang bei 25 °C reagieren.
- Entfernen Sie den Chip aus der Lösung und waschen Sie ihn gründlich mit destilliertem Wasser und wasserfreiem Ethanol. Zum Schluss geben Sie die Dextran-Basislösung auf die Goldfilmoberfläche des Chips und lassen sie 20 h lang bei 25 °C reagieren. Reinigen Sie den Chip mit entionisiertem Wasser und tauchen Sie ihn dann in eine Bromessigsäurelösung, um die Modifikation der Dextranhydroxylcarboxymethylierung zu erreichen. Verwenden Sie Quercetin und Calycosin mit einer Reinheit von ≥98,5 % bzw. ≥99 %).
- Bereiten Sie alle Puffer vor, die Laufpuffer, Aktivator, Immobilisierungspuffer (10 mM Natriumacetat) und Regenerationslösung 10 mM Glycin-HCl, pH 1,5 enthalten. Der Aktivator enthält 115 mg N-Hydroxysuccinimid (NHS), 750 mg 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimidhydrochlorid (EDC) und 10,5 ml 1 M Ethanolaminhydrochlorid-NaOH bei einem pH-Wert von 8,5. Lösen Sie EDC und NHS auf, indem Sie 10 ml gefiltertes deionisiertes Wasser in jedes Fläschchen geben (siehe Materialtabelle).
HINWEIS: Lagern Sie EDC- und NHS-Aliquots bei -18 °C oder darunter, verwenden Sie die Aliquote innerhalb von 2 Monaten. Alle Lösungen sollten vor der Verwendung entgast werden.
2. Kalibrierung des Geräts
- Zeichnen Sie eine Standardkurve der Alkoholkonzentration und des Spitzenwerts der Injektion von Alkohol in verschiedenen Konzentrationen (2 %, 1 %, 0,5 %, 0,2 % und 0,1 % Volumenverhältnis) auf blankes Gold und vergleichen Sie den maximalen Spitzenwert von Alkohol.
HINWEIS: Bei der Injektion mit einer Durchflussrate von 50 μL/min erhielt die Software zur Datenanalyse eine Standardkurve. - Berechnen Sie gemäß dem technischen Handbuch den Korrekturfaktor des Instruments, dargestellt durch K, mit der Formel:
K=Δθ/Δ[(A-B)/(A+B)]
In dieser Formel stellen A und B die Signalwerte der jeweiligen Detektoren dar. Der theoretische Steigungswert, wie im Handbuch angegeben, beträgt 0,06. Daher kann der Korrekturfaktor K als K=0,06/R berechnet werden (wobei R die Steigung der linearen Regressionsgleichung ist, die aus der Standardkurve erhalten wird). - Multiplizieren Sie den gemessenen Δ[(A-B)/(A+B)]-Wert mit dem Korrekturfaktor, um den tatsächlichen Δθ-Wert zu erhalten.
3. Grundlegende Systembedienung
- Um das System zu starten, schalten Sie den Netzschalter ein und warten Sie, bis die Erkennungseinheit die voreingestellte Temperatur (normalerweise 25 °C) erreicht hat.
- Öffnen Sie die Steuerungssoftware, indem Sie > OpenSPRTM Control Software auf Start > Programm klicken, und das Softwareprogramm stellt nach dem Ausführen automatisch eine Verbindung zum Hostsystem her.
- Befolgen Sie die Standardarbeitsanweisung des SPR-Instruments, um den COOH-Chip (Glucan-basierter Chip) zu installieren. Geben Sie zunächst einen Tropfen Zedernöl auf die Rückseite des SPR-Biochips. Befestigen Sie dann den COOH-Chip an der Prismenoberfläche des Sensors und stellen Sie sicher, dass sich keine Luftblasen zwischen dem Chip und dem Prisma befinden. Installieren Sie abschließend das Durchflussbecken und ziehen Sie es an den Lichtpunkt fest.
HINWEIS: Positionieren Sie das Durchflussbecken in den dafür vorgesehenen Schlitz und befestigen Sie es sicher mit den Befestigungsschrauben. Die Kanalabmessungen betragen 10 mm x 1 mm x 1 mm. - Platzierung der Chips
- Um die Späneluke zu öffnen, wählen Sie die Option Späne einfügen aus dem Menü Extras. Wenn sich bereits ein Chip im Chipschacht befindet, klicken Sie im Menü Extras auf die Option Chip auswerfen.
- Wählen Sie den entsprechenden Chiptyp aus dem Dropdown-Menü Chiptyp aus, wenn Sie einen neuen Chip verwenden, und geben Sie die Chip-ID mit den experimentellen Informationen zum Chip ein. Die Chip-Chargennummer kann ausgefüllt werden (optional). Wenn es sich um einen gebrauchten Chip handelt, wählen Sie Chip wiederverwenden und suchen Sie die entsprechenden Chipinformationen im Dropdown-Menü der Chip-ID.
- Halten Sie den Chip mit der Wortseite nach oben, schieben Sie den Chip vorsichtig in Richtung des Pfeils auf dem Chip in den Kartensteckplatz und schließen Sie schließlich die Klappe des Chipfachs.
- Klicken Sie auf die Schaltfläche Dock Chip . Das System wechselt automatisch in den Standby-Zustand, nachdem der Chip platziert wurde.
- Um das gesamte interne Durchflusssystem mit einer hohen Durchflussrate zu spülen, wählen Sie > Befehl "Prime" > "Start" aus. Der gesamte Vorgang dauert 6-7 Minuten. Klicken Sie auf Schließen , um das System automatisch in den Standby-Zustand zu versetzen.
- Halten Sie die schwarze Taste auf der rechten Seite des Röhrenhalters gedrückt und öffnen Sie die Metallabdeckung auf der linken Seite. Nachdem Sie das entsprechende Reagenzglas platziert haben, schließen Sie vorsichtig den Metalldeckel. Wenn Sie ein Klickgeräusch hören, wird die Metallabdeckung verriegelt.
- Schieben Sie den Reagenzglashalter vorsichtig entlang des Kartensteckplatzes in das Probenfach und hören Sie ein Klickgeräusch, das anzeigt, dass sich der Reagenzglashalter in der richtigen Position befindet und verriegelt ist.
- Klicken Sie im Dialogfeld Rackfach auswerfen auf OK, um das Rack automatisch in das Probenfach einzuführen und die Klappe zu schließen.
HINWEIS: Es gibt eine zeitliche Begrenzung, wenn die Musterkabinentür geöffnet wird. Die Tür schließt nach 60 s Öffnung automatisch. In den letzten 15 s erscheint der Countdown im Dialogfeld in roter Schrift und blinkt. Warten Sie, bis sich die Tür geschlossen hat, bevor Sie sie wieder öffnen, um zu vermeiden, dass Sie sich die Hand einklemmen. - Normalisierung von Antwortsignalen
- Wählen Sie Tool > Weitere Tools aus, wählen Sie im Verzeichnis Wartungstools die Option Normalisieren aus, und klicken Sie auf Start > Weiter.
- Geben Sie 120 μl 70%ige BIAnormalisierungslösung in ein 7-mm-Reagenzglas. Stellen Sie das Reagenzglas in die im Programm angegebene Position (R2F6). Nachdem Sie sich vergewissert haben, dass der Deckel des Röhrchenhalters richtig geschlossen ist, setzen Sie den Röhrchenhalter in das Probenfach ein, schließen Sie die Kabinentür und klicken Sie auf Start, um das Programm auszuführen.
4. Liganden-Erfassung
- pH-Messung
- Bevor Sie Liganden auf dem Chip fixieren, prüfen Sie einen geeigneten Ligandenpuffer auf den pH-Wert, um Liganden in der Nähe der Oberfläche des Chips durch elektrostatische Adsorption anzureichern und so einen besseren Kopplungseffekt zu erzielen. Die allgemeine Ligandenkonzentration beträgt 10-100 μg/ml, und für das erste Experiment versuchen Sie, 20 μg/ml zu verwenden.
- Screening des Liganden von 10 mM Natriumacetat mit pH-Werten von 5,5, 5,0, 4,5 und 4. Um die Prozessparameter einzustellen, wählen Sie Run-Wizard, Surface Preparation-Immobilization pH Scouting, und klicken Sie auf Neu.
- Wählen Sie den Chipkanal aus, der aus den Kanälen 1, 2, 3 oder 4 ausgewählt werden kann. Der Puffer verfügt über vier voreingestellte Bedingungen: 10 mM Natriumacetat, pH 5,5, 5,0, 4,5 und 4. Geben Sie als Nächstes den Ligandennamen, die Kontaktzeit (180 s) und die Flussrate (5 μL/min) ein.
- Nachdem die Oberfläche mit 50 mM NaOH regeneriert wurde, stellen Sie die Oberflächentemperatur des Chips und die Temperatur der Probenkammer ein. Wählen Sie dann links das Proben- und Reagenzienrack1 aus und platzieren Sie die Lösung entsprechend der entsprechenden Position im Probenrack. Speichern Sie die experimentelle Methode, und starten Sie das Experiment, indem Sie auf Weiter klicken.
- Immobilisierung von Liganden
- Wählen Sie Run-Wizard, Surface Preparation-Immobilization, und klicken Sie auf Neu. Legen Sie die Mobilisierungsfunktion auf vier Kanäle fest: FC1, FC2, FC3 und FC4. Im Allgemeinen wird Kanal 1 als Referenz beim Koppeln der Kanäle 1 und 2 verwendet, und Kanal 3 ist die Referenz bei der Mobilisierung aller vier Kanäle.
- Verwenden Sie die Referenzkanäle für den blanken Kontrast oder die aktivierungsgeschlossene ligandenfreie Fixierung, indem Sie die Kanäle 1 und 2 verwenden, um die Liganden auf Kanal 2 zu koppeln.
HINWEIS: Es stehen zwei Kopplungsmodi zur Verfügung: Ziel auf immobilisiertes Niveau und Angabe der Kontaktzeit. Geben Sie im Modus "Ziel für immobilisiertes Niveau" das Ziel-Kopplungsniveau ein, und die Software erreicht automatisch das entsprechende Niveau. Der Kontaktzeitmodus erfordert die Eingabe von Einspritzzeit und Durchflussrate und wird in der Regel auf der Grundlage von Vorversuchen verwendet.
5. Mehrzyklen-Analyt-Methode
- Führen Sie Prime aus und füllen Sie die Spritze und die Kammer mit einem festen Puffer. Wählen Sie Ausführen-Manueller Lauf aus, wählen Sie Kanäle 1-2 in Reihe auf dem Flusspfad aus, und klicken Sie auf Start.
- Beginnen Sie mit der maximalen Durchflussrate (150 μl/min) und erkennen Sie den Puffer, bei dem es sich um HEPES (pH 7,4) handelt. Wenn eine stabile Basislinie erreicht ist, spülen Sie den Probenring mit Puffer und leeren Sie den Probenring.
HINWEIS: Wenn die Basislinie (eine Gleichgewichtslinie, die sich auf der Messkurve bildet, wenn der Puffer ausgeführt wird) nicht innerhalb von 10 Minuten erreicht wird, versuchen Sie, 10 mM Natriumhydroxid für 30 s zu injizieren. - Aktivieren Sie den Chip mit EDC/NHS-Lösung (1:1, je 50 μl).
- 200 μl Ligand, verdünnt mit dem aktivierten Puffer, 4 Minuten lang auf die Probe auftragen. Sobald die Bindung stabilisiert ist, waschen Sie den Probenring mit Puffer.
- Probe von 200 μl Blockierungslösung, spülen Sie den Probenring mit Puffer aus und entleeren Sie ihn mit Luft. Beobachten Sie die Grundlinie 5 Minuten lang, um die Stabilität zu gewährleisten.
- Verdünnen Sie die Analyten mit Pufferlösung und nehmen Sie dann 3,9 μM, 7,8 μM, 15,625 μM und 31,25 μM Quercetin und 15,625 μM, 31,25 μM, 62,5 μM, 125 μM und 250 μM Calycosin als Proben mit 20 μl/min.
- Die Bindungszeit von Protein (10 μg/ml-50 μg/ml) und Ligand beträgt 240 s, mit einer natürlichen Dissoziationszeit von 360 s. Erhöhen Sie die Flussrate auf 150 μl/min und injizieren Sie einen geeigneten Regenerationspuffer, um den Analyten zu entfernen.
6. Regeneration
- Verwenden Sie zur Regeneration 10 mM Glycin-HCl, hohe Salz- oder Säure-Base-Lösungen mit unterschiedlichen pH-Werten (z. B. 2,5, 4,5, 5,0, 5,5 usw.).
- Um die Regenerationsbedingungen zu überprüfen, verwenden Sie run-wizard-assay development-regeneration scouting, und klicken Sie auf Neu. Wählen Sie 1-2 Kanäle in Reihe auf dem Strömungsweg aus, wählen Sie den Chip aus und klicken Sie auf Weiter.
- Um den Chip aufzuwärmen, klicken Sie auf Start, was mehr als 3x erfolgen sollte. Geben Sie den Namen des Analyten ein und stellen Sie die Flussrate der regenerierten Lösung auf 150 μL/min ein.
7. Datenanalyse
- Analysieren Sie die experimentellen Ergebnisse mit einer SPR-Datenanalysesoftware unter Verwendung des Eins-zu-Eins-Analysemodells.
HINWEIS: Der gesamte Prozess wird im laufenden Puffer durchgeführt. Die anderen Puffer, die im SPR-Assay-Prozess verwendet werden, sind die gleichen wie der Injektionspuffer.
8. Wartung des Systems
- Entfernen Sie nach Abschluss des Experiments den Detektionschip und ersetzen Sie ihn durch den Wartungschip. Ersetzen Sie den laufenden Puffer durch ausreichend frisches Reinwasser und spülen Sie das System mit Prime. Nach der Grundierung wechselt das System automatisch in den Standby-Modus, um die Flüssigflasche zu reinigen und das Nadelwasser zu wechseln.
Ergebnisse
Um zu bestimmen, ob das Protein auf der Chipoberfläche fixiert ist, wird die Ordinate (Antwortsignal) der SPR-Sensorkarte (Abbildung 1) verwendet, während die Winkelverschiebung der SPR-Kurve erhalten wird. Abbildung 2 und Abbildung 3 zeigen die SPR-Kurve der Wechselwirkung zwischen Quercetin und Calycosin mit dem rekombinanten KCNJ2-Protein auf der immobilisierten Oberfläche des rekombinanten KCNJ2-Proteins nach Kontrollreduktion bei Konzentrationen im Bereich von 3,9 μM bis 250 μM. Um Ungenauigkeiten durch Stofftransporteffekte zu minimieren, wurden die rekombinanten KCNJ2-Proteinmoleküle nicht nur auf niedrige Konzentrationen fixiert, sondern während des kinetischen Tests auch einer höheren Flussrate von 20 μL/min ausgesetzt. Folglich wurden die sensorischen Dosis-Wirkungs-Karten von Quercetin und Calycosin erhalten. Tabelle 1 und Tabelle 2 zeigen die Berechnungsergebnisse der kinetischen Geschwindigkeitskonstanten (Assoziationsratenkonstante, Ka; Dissoziationsratenkonstante, Kd) und der Dissoziationsgleichgewichtskonstante (KD). Beim Vergleich beider wurde beobachtet, dass die Ka-Konstante für Calycosin höher war als die für Quercetin, was darauf hindeutet, dass weniger Zeit benötigt wurde, um den Komplex zu bilden. Umgekehrt war die Kd-Konstante für Quercetin niedriger als die von Calycosin, was zeigt, dass Quercetin mehr Zeit benötigte, um das Protein abzubauen, wenn eine größere Menge des rekombinanten KCNJ2-Proteins an der Oberfläche fixiert war. Der niedrige KD-Gehalt bestätigte die hohe molekulare Affinität zwischen dem Analyten und dem rekombinanten KCNJ2-Protein, die wahrscheinlich eng mit dem Kanal zusammenhängt, in dem dieses Protein gefunden wird.

Abbildung 1: SPR-Sensorbild eines rekombinanten KCNJ2-Proteins, das auf einer COOH-Sensorhalterung mit Glucangruppenmodifikation immobilisiert ist. Aktivierung: Aktivierung des EDC/NHS 1:1-Gemischs (Injektionszeit: 1 min, Durchflussrate: 20 μL/min). Fixierung: 0,06 mg/ml rekombinante KCNJ2-Proteinfixierung (Injektionszeit: 5 min, Flussrate: 20 μl/min). Inaktivierung: Verbleibender aktiver NHS-Ester mit Ethanolamin inaktiviert (Durchflussrate: 20 μL/min). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
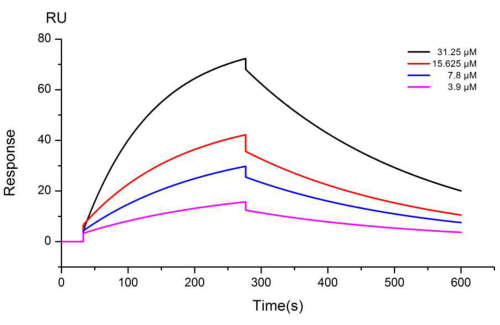
Abbildung 2: Sensorische Karte der Interaktion zwischen Quercetin und immobilisiertem rekombinantem KCNJ2-Protein. Getestet wurden vier Konzentrationen: 3,9 μM, 7,8 μM, 15,625 μM und 31,25 μM. Die Affinitätskonstante zwischen Quercetin und dem rekombinanten KCNJ2-Protein betrug 20,5 μM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Sensorische Karte der Interaktion zwischen Calycosin und immobilisiertem rekombinantem KCNJ2-Protein. Fünf Konzentrationen wurden getestet: 15,625 μM, 31,25 μM, 62,5 μM, 125 μM und 250 μM.Die Affinitätskonstante zwischen Calycosin und dem rekombinanten KCNJ2-Protein betrug 204 μM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Parameter | Paraphrase | Ergebnis |
| ka (1/(M*s)) | Konstante der Assoziationsrate | 1,84 x 102 cm |
| kd (1/s) | Konstante der Dissoziationsrate | 3,78 x 10-3 cm |
| KD (M) | Dissoziationsgleichgewichtskonstante Affinitätskonstante | 2,05 x 10-5 cm |
Tabelle 1: Kinetische Messungen der Quercetin-Wechselwirkung mit dem rekombinanten KCNJ2-Protein.
| Parameter | Paraphrase | Ergebnis |
| ka (1/(M*s)) | Konstante der Assoziationsrate | 1,21 x 102 cm |
| kd (1/s) | Konstante der Dissoziationsrate | 2,46 x 10-2 cm |
| KD (M) | Dissoziationsgleichgewichtskonstante Affinitätskonstante | 2,04 x 10-4 cm |
Tabelle 2: Kinetische Messungen der Calycosin-Wechselwirkung mit dem rekombinanten KCNJ2-Protein.
Diskussion
Der SPR-Analysezyklus ist in vier Stufen unterteilt. Die erste Phase, die Baseline, beinhaltet die Injektion des Puffers. Darauf folgt die zweite Phase, die Ligandenerfassung. Der Sensorchip COOH wird mit EDC/NHS (1:1) bei einer Durchflussrate von 20 μL/min aktiviert. Anschließend wird der Chip mit 1 M Ethanolaminhydrochlorid-NaOH bei einer Durchflussrate von 20 μL/min deaktiviert. Weiter geht es mit der dritten Stufe, der Mehrzyklus-Analytmethode. Der Analyt wird mit einer Flussrate von 20 μL/min für eine Assoziationsphase von 240 s in den Kanal injiziert, gefolgt von einer Dissoziationsperiode von 360 s. Sowohl der Assoziations- als auch der Dissoziationsprozess werden im laufenden Puffer durchgeführt. Die Zyklen des Analyten wiederholen sich entsprechend den Analytkonzentrationen in aufsteigender Reihenfolge. Nach jedem Zyklus der Interaktionsanalyse muss die Oberfläche des Sensorchips mit 10 mM Glycin-HCl als Injektionspuffer bei einer Flussrate von 150 μl/min vollständig regeneriert werden, um den Analyten zu entfernen. Dann wird der nächste Konzentrationszyklus des Analyten wiederholt, indem Analytinjektions- und Regenerationsschritte durchgeführt werden. Im vierten Schritt wird der Chip schließlich regeneriert, indem 10 mM Glycin-HCl mit einer Flussrate von 150 μL/min in den laufenden Puffer injiziert werden. Dieser Zyklus ermöglicht ein schnelles und nicht-invasives Screening verschiedener Indikatoren und ermöglicht so ein Wirkstoffscreening mit hohem Durchsatz23.
Darüber hinaus kann es Antikörperreaktionen im Frühstadium erkennen und mögliche Ergebnisse vorhersagen24. Im Vergleich zu anderen Technologien verfügt SPR über einfache Bedienungsschritte, die keine komplexen Verfahren wie Elektrophorese und Membrantransfer erfordern. Es bietet mehrere Vorteile, darunter einen kurzen Detektionszyklus von 15 min25, eine Echtzeiterkennung ohne die Notwendigkeit einer Beschriftungvon 26,27, die Minimierung menschlicher Fehler und eine hohe Wiederholgenauigkeit. Darüber hinaus ermöglicht seine Fähigkeit, Multidaten wie dynamische Parameter wie Ka, Kd und KD zu erfassen, eine genaue Bestimmung molekularer Wechselwirkungen, insbesondere in komplexen Systemen mit dichten Molekülen28,29.
Es gibt jedoch Einschränkungen zu beachten. Erstens sind SPR-Chips relativ teuer, da sie in der Regel aus einem Goldfilm bestehen, der mit anderen Metallelementen gemischt ist, mit strengen Anforderungen an die Dicke des Goldfilms. Zweitens kann die kinetische Detektion durch die Massentransferrate beeinflusst werden. Drittens kann es auf dem SPR-Sensorchip zu einer gewissen unspezifischen Adsorption kommen. Schließlich steht SPR vor Herausforderungen beim genauen Nachweis von Substanzen mit kleinem Molekulargewicht30. Um dieses Problem zu lösen, können Methoden wie Massenmarkierung und indirekte Konkurrenz die Empfindlichkeit der Detektion kleiner Moleküle erhöhen und bieten breite Anwendungen und vielversprechende Aussichten.
SPR findet umfangreiche Anwendungen in der Umweltforschung, der Lebensmittelsicherheit31 sowie in der Früherkennung und Behandlung von Herzerkrankungen, Demenz und Krebs. Darüber hinaus haben die Forscher begonnen, SPR mit verschiedenen Technologien wie Elektrochemie32, Fluoreszenzspektroskopie33 und elektrochemischer Rastermikroskopie zu kombinieren, um die analytischen Nachweismöglichkeiten zu erweitern.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch das Sichuan Provincial Major R&D Project (2022YFS043), das Key Research and Development Program von Ningxia (2023BEG02012) und das Xinglin Scholar Research Promotion Project der Chengdu University of TCM (XKTD2022013) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride (EDC) | Nan Jing Reagent,Nanjing,China | C08296594 | |
| Anhydrous ethanol | Merck Chemical Technologies Ltd., Shanghai, China | 459836 | |
| BIAnormalizing solution | Merck Chemical Technologies Ltd., Shanghai, China | 49781 | |
| Blocking solution | Bosheng Biotechnology Co.,Ltd., Shanghai, China | 110050 | |
| Bromoacetic acid | Merck Chemical Technologies Ltd., Shanghai, China | 17000 | |
| Calycosin | Push Bio-technology Co., Ltd., Chengdu, China | PU0124-0025 | |
| Dextran | Canspec Scientific Instruments Co., Ltd.,Shanghai, China | PM10036 | |
| Epichlorohydrin | Merck Chemical Technologies Ltd., Shanghai, China | 492515 | |
| Ethanolamine hydrochloride | Yuanye Biotech Co., Ltd., Shanghai, China | S44235 | |
| Glycine-HCl | Merck Chemical Technologies Ltd., Shanghai, China | G2879 | |
| H2O2 | Merck Chemical Technologies Ltd., Shanghai, China | 3587191 | |
| H2SO4 | Nantong high-tech Industrial Development Zone,China | 2020001150C | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCNJ2 (Human) Recombinant Protein | Abnova,West Meijie Technology Co., Ltd., Beijing, China | H00003759-Q01 | |
| MUOH | Jizhi Biochemical Technology Co., Ltd., Shanghai, China | M40590 | |
| NaOH | Merck Chemical Technologies Ltd., Shanghai, China | SX0603 | |
| N-Hydroxysuccinimide(NHS) | Yuanye Biotech Co., Ltd., Shanghai, China | S13005 | |
| OpenSPRTM | Nicoya | ||
| Quercetin | Push Bio-technology Co., Ltd., Chengdu, China | PU0041-0025 | |
| Sensor Chip COOH | Nicoya | ||
| Sodium Acetate | Merck Chemical Technologies Ltd., Shanghai, China | 229873 |
Referenzen
- Jebelli, A., Oroojalian, F., Fathi, F., Mokhtarzadeh, A., Guardia, M. Recent advances in surface plasmon resonance biosensors for microRNAs detection. Biosens Bioelectron. 169, 112599(2020).
- Sun, B., Xu, J., Liu, S., Li, Q. X. Characterization of small molecule-protein interactions using SPR method. Methods Mol Biol. 2690, 149-159 (2023).
- Mousavi, S. M., et al. Biomedical applications of an ultra-sensitive surface plasmon resonance biosensor based on smart MXene quantum dots (SMQDs). Biosensors (Basel). 12 (9), 743(2022).
- Olaru, A., Bala, C., Jaffrezic-Renault, N., Aboul-Enein, H. Y. Surface plasmon resonance (SPR) biosensors in pharmaceutical analysis. Crit Rev Anal Chem. 45 (2), 97-105 (2015).
- Meschendoerfer, W., Gassner, C., Lipsmeier, F., Regula, J. T., Moelleken, J. SPR-based assays enable the full functional analysis of bispecific molecules. J Pharm Biomed Anal. 132, 141-147 (2017).
- Djaileb, A., et al. Cross-validation of ELISA and a portable surface plasmon resonance instrument for IgG antibody serology with SARS-CoV-2 positive individuals. Analyst. 146 (15), 4905-4917 (2021).
- Miyake, S., et al. Simultaneous detection of six different types of pesticides by an immunosensor based on surface plasmon resonance. Anal Sci. 36 (3), 335-340 (2020).
- Ravindran, N., et al. Recent advances in surface plasmon resonance (SPR) biosensors for food analysis: a review. Crit Rev Food Sci Nutr. 63 (8), 1055-1077 (2023).
- Bhandari, D., Chen, F. C., Bridgman, R. C. Magnetic nanoparticles enhanced surface plasmon resonance biosensor for rapid detection of Salmonella typhimurium in Romaine lettuce. Sensors (Basel). 22 (2), 475(2022).
- Amirjani, A., Kamani, P., Hosseini, H. R. M., Sadrnezhaad, S. K. SPR-based assay kit for rapid determination of Pb2. Anal Chim Acta. 1220, 340030(2022).
- Shrivastav, A. M., Cvelbar, U., Abdulhalim, I. A comprehensive review on plasmonic-based biosensors used in viral diagnostics. Commun Biol. 4 (1), 70(2021).
- Nguyen, V. T., et al. Highly sensitive sandwich-type SPR based detection of whole H5Nx viruses using a pair of aptamers. Biosens Bioelectron. 86, 293-300 (2016).
- Chang, Y. F., et al. Simple strategy for rapid and sensitive detection of avian influenza A H7N9 virus based on intensity-modulated SPR biosensor and new generated antibody. Anal Chem. 90 (3), 1861-1869 (2018).
- Das, C. M., Guo, Y., Kang, L., Ho, H. P., Yong, K. T. Investigation of plasmonic detection of human respiratory virus. Adv Theory Simul. 3 (7), 2000074(2020).
- Lakayan, D., Haselberg, R., Niessen, W. M., Somsen, G. W., Kool, J. On-line coupling of surface plasmon resonance optical sensing to size-exclusion chromatography for affinity assessment of antibody samples. J Chromatogr. A. 1452, 81-88 (2016).
- Loo, J. F., et al. An aptamer bio-barcode (ABC) assay using SPR, RNase H, and probes with RNA and gold-nanorods for anti-cancer drug screening. Analyst. 142 (19), 3579-3587 (2017).
- Fabini, E., Danielson, U. H. Monitoring drug-serum protein interactions for early ADME prediction through surface plasmon resonance technology. J Pharm Biomed Anal. 144, 188-194 (2017).
- Khalenkov, A. M., Norton, M. G., Scoot, D. E. Method for screening influenza neutralizing antibodies in crude human plasma and its derivatives using SPR. Heliyon. 9 (5), 15651(2023).
- Locatelli-Hoops, S., Yeliseev, A. A., Gawrisch, K., Gorshkova, I. Surface plasmon resonance applied to G protein-coupled receptors. Biomed Spectrosc Imaging. 2 (3), 155-181 (2013).
- Singh, S., et al. 2D nanomaterial-based surface plasmon resonance sensors for biosensing applications. Micromachines (Basel). 11 (8), 779(2020).
- Pourmadadi, M., et al. Properties and applications of graphene and its derivatives in biosensors for cancer detection: A comprehensive review. Biosensors. 12 (5), 269(2022).
- Singh, T. I., Singh, P., Karki, B. Early detection of chikungunya virus utilizing the surface plasmon resonance comprising a silver-silicon-PtSe 2 multilayer structure. Plasmonics. 18 (3), 1173-1180 (2023).
- Das, S., Devireddy, R., Gartia, M. R. Surface plasmon resonance (SPR) sensor for cancer biomarker detection. Biosensors (Basel. 13 (3), 396(2023).
- Liu, R., Ye, X., Cui, T. Recent progress of biomarker detection sensors. Research (Wash D C). 2020, 7949037(2020).
- Bolognesi, M., et al. A fully integrated miniaturized optical biosensor for fast and multiplexing plasmonic detection of high- and low-molecular-weight analytes. Adv Mater. 35 (26), 2208719(2023).
- Inoue, S., Fukada, K., Hayashi, K., Seyama, M. Data processing of SPR curve data to maximize the extraction of changes in electrochemical SPR measurements. Biosensors (Basel). 12 (8), 615(2022).
- Topor, C. V., Puiu, M., Bala, C. Strategies for surface design in surface plasmon resonance (SPR) sensing. Biosensors (Basel). 13 (4), 465(2023).
- Bonnet, H., et al. Negative SPR signals during low molecular weight analyte recognition). Anal Chem. 93 (8), 4134-4140 (2021).
- He, P., et al. Cholesterol chip for the study of cholesterol-protein interactions using SPR. Biosensors (Basel). 12 (10), 788(2022).
- Kausaite-Minkstimiene, A., et al. An ultra-sensitive SPR immunosensor for quantitative determination of human cartilage oligomeric matrix protein biomarker. Biosens Bioelectron. 234, 115370(2023).
- Pandey, P. S., et al. SPR based biosensing chip for COVID-19 diagnosis-A review. IEEE Sens J. 22 (14), 13800-13810 (2022).
- Mei, Y., et al. Single-layer graphene-coated gold chip for electrochemical surface plasmon resonance study. Anal Bioanal Chem. 411, 4577-4585 (2019).
- Zhou, L., Arugula, M. A., Chin, B. A., Simonian, A. L. Simultaneous surface plasmon resonance/fluorescence spectroelectrochemical in situ monitoring of dynamic changes on functional interfaces: A study of the electrochemical proximity assay model system. ACS Appl Mater Interfaces. 10 (48), 41763-41772 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten